Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Modellierung des Größenspektrums für Makrowirbellose und Fische in Stream-Ökosystemen
In diesem Artikel
Zusammenfassung
Dies ist ein Protokoll zur Modellierung des Größenspektrums (Skalierungsverhältnis zwischen individueller Masse und Populationsdichte) für kombinierte Fische und wirbellose Daten aus wadenbaren Bächen und Flüssen. Zu den Methoden gehören: Feldtechniken zur Sammlung quantitativer Fische und wirbelloser Proben; Labormethoden zur Standardisierung der Felddaten; und statistische Datenanalyse.
Zusammenfassung
Das Größenspektrum ist eine inverse, allometrische Skalierungsbeziehung zwischen der durchschnittlichen Körpermasse (M) und der Dichte (D) von Individuen innerhalb einer ökologischen Gemeinschaft oder eines Nahrungsnetzes. Wichtig ist, dass das Größenspektrum davon ausgeht, dass die individuelle Größe und nicht die Verhaltens- oder Lebensgeschichtemerkmale der Art die primäre Determinante des Überflusses innerhalb eines Ökosystems ist. Im Gegensatz zu herkömmlichen allometrischen Beziehungen, die sich auf Daten auf Artenebene konzentrieren (z. B. Körpergröße der mittleren Arten im Vergleich zur Populationsdichte), sind Größenspektrenanalysen "ataxic" – einzelne Proben werden nur anhand ihrer Größe identifiziert, ohne Rücksicht auf taxonomische Identität. Größenspektrenmodelle sind effiziente Darstellungen traditioneller, komplexer Lebensmittelnetze und können sowohl in beschreibenden als auch in prädiktiven Kontexten verwendet werden (z. B. Vorhersage von Reaktionen großer Verbraucher auf Veränderungen der Basalressourcen). Empirische Studien aus verschiedenen aquatischen Ökosystemen haben auch moderate bis hohe Ähnlichkeiten in Größenspektrenhängen berichtet, was darauf hindeutet, dass gemeinsame Prozesse die Häufigkeit kleiner und großer Organismen in sehr unterschiedlichen Umgebungen regulieren können. Dies ist ein Protokoll zum Modellieren des Größenspektrums auf Community-Ebene in wadenbaren Streams. Das Protokoll besteht aus drei Hauptschritten. Sammeln Sie zunächst quantitative benthische Fische und wirbellose Proben, die zur Schätzung der lokalen Dichte verwendet werden können. Zweitens, standardisieren Sie die Fisch- und Wirbellosendaten, indem Sie alle Individuen in ataxic-Einheiten umwandeln (d. h. Personen, die nach Größe identifiziert werden, unabhängig von der taxonomischen Identität), und Personen in Protokoll-2-Größen-Behältern summieren. Drittens, verwenden Sie die lineare Regression, um die Beziehung zwischen ataxic M und D Schätzungen zu modellieren. Detaillierte Anweisungen finden Sie hierin, um jeden dieser Schritte abzuschließen, einschließlich benutzerdefinierter Software, um die D-Schätzung und die Größenspektrenmodellierung zu erleichtern.
Einleitung
Körpergrößenskalierungsbeziehungen, wie z. B. der positive Zusammenhang zwischen Körpermasse und Stoffwechselrate, sind auf der Ebene des einzelnen Organismus bekannt und werden nun auf höheren Ebenen der Organisation1,2,3 untersucht. . Diese allometrischen Beziehungen sind meist machtrechtliche Funktionen der Form Y = aMb, wobei Y die Variable des Interesses ist (z. B. Stoffwechsel, Überfluss oder Größe des Home-Bereichs), M ist die Körpermasse eines einzelnen oder durchschnittlichen individuell ist b ein Skalierungskoeffizient und a eine Konstante. Aus Gründen der statistischen Bequemlichkeit werden Y- und M-Daten oft vor der Analyse protokolltransformiert und dann mit linearen Gleichungen des Formularprotokolls modelliert (Y) = log (a) + b log (M), wobei b und log ( a) werden die lineare Modellneigung bzw. abfangen.
Das Größenspektrum ist eine Art von allometrischer Beziehung, die dichte (D, die Anzahl der Individuen pro Flächeneinheit) oder Biomasse (B, die summierte Masse von Individuen pro Flächeneinheit) als Funktion von M vorhersagt (siehe Abschnitt 4 für zusätzliche Informationen über die Verwendung von "normalisierten" D- oder B-Schätzungen.) Wie andere Skalierungsbeziehungen zwischen M und D oder zwischen M und Bspielt das Größenspektrum eine zentrale Rolle in der Grundlagen- und angewandten Ökologie. Auf Bevölkerungsebene interpretieren Biologen negative D 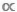 M-Beziehungen oft als Nachweis eines dichteabhängigen Überlebens oder als Modelle der Tragfähigkeit des Ökosystems (d. h. die "Selbstverdünnungsregel")4, 5. Auf Gemeinschaftsebene können
M-Beziehungen oft als Nachweis eines dichteabhängigen Überlebens oder als Modelle der Tragfähigkeit des Ökosystems (d. h. die "Selbstverdünnungsregel")4, 5. Auf Gemeinschaftsebene können 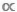 B-M-Beziehungen verwendet werden, um systembasierte Auswirkungen anthropogener Störungen zu untersuchen, wie z. B. die größenselektive Fischerei6,7. Die allometrische Skalierung von D und B mit M ist auch von zentraler Bedeutung für die jüngsten Bemühungen, Population, Gemeinschaft und Ökosystemökologie zu vereinen2,8,9.
B-M-Beziehungen verwendet werden, um systembasierte Auswirkungen anthropogener Störungen zu untersuchen, wie z. B. die größenselektive Fischerei6,7. Die allometrische Skalierung von D und B mit M ist auch von zentraler Bedeutung für die jüngsten Bemühungen, Population, Gemeinschaft und Ökosystemökologie zu vereinen2,8,9.
Ein besonders wichtiges Merkmal des Größenspektrums ist die Tatsache, dass es völlig ataxic9,10ist. Dieser Punkt ist beim Vergleich von Streudiagrammen von D 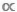 M- oder B-M-Daten
M- oder B-M-Daten 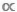 leicht zu übersehen, aber die Unterscheidung zwischen Taxi- und Ataxic-Modellen ist entscheidend. In Taxic-Modellen wird ein einzelner M-Wert verwendet, um die durchschnittliche Körpermasse jedes Einzelnen einer bestimmten Art oder Taxa11darzustellen. In ataxic Modellen werden alle Personen innerhalb eines Datensatzes in eine Reihe von Körpergrößenintervallen oder M-Abschnitte partitioniert, unabhängig von ihrer taxonomischen Identität12. Letzteres, ataxic Ansatz ist vorteilhaft in aquatischen Ökosystemen, wo viele Taxa zeigen unbestimmtes Wachstum und erleben eine oder mehrere ontogenetische Veränderungen im Fütterungsverhalten; in diesen Fällen wird ein einzelner M-Durchschnitt auf Artenebene die Tatsache verschleiern, dass eine Art verschiedene funktionelle Rollen im Laufe ihrer Lebensgeschichte ausfüllen kann9,13,14.
leicht zu übersehen, aber die Unterscheidung zwischen Taxi- und Ataxic-Modellen ist entscheidend. In Taxic-Modellen wird ein einzelner M-Wert verwendet, um die durchschnittliche Körpermasse jedes Einzelnen einer bestimmten Art oder Taxa11darzustellen. In ataxic Modellen werden alle Personen innerhalb eines Datensatzes in eine Reihe von Körpergrößenintervallen oder M-Abschnitte partitioniert, unabhängig von ihrer taxonomischen Identität12. Letzteres, ataxic Ansatz ist vorteilhaft in aquatischen Ökosystemen, wo viele Taxa zeigen unbestimmtes Wachstum und erleben eine oder mehrere ontogenetische Veränderungen im Fütterungsverhalten; in diesen Fällen wird ein einzelner M-Durchschnitt auf Artenebene die Tatsache verschleiern, dass eine Art verschiedene funktionelle Rollen im Laufe ihrer Lebensgeschichte ausfüllen kann9,13,14.
Hier stellen wir ein komplettes Protokoll zur Quantifizierung des Größenspektrums in wadenbaren Bächen und Flüssen vor. Das Protokoll beginnt mit Feldprobenmethoden zur Erfassung der notwendigen Fisch- und benthischen Makroinvertebratendaten. Fische werden im Rahmen einer "Drei-Pass-Erschöpfung" gesammelt. Die Häufigkeit wird dann anhand der Erschöpfungsdaten mit der Zippin-Methode15geschätzt. Bei der Erschöpfungsprobe werden einzelne Fische innerhalb einer geschlossenen Studienreichweite (d. h. Einzelpersonen können die beiliegende Reichweite weder betreten noch verlassen) durch drei aufeinanderfolgende Proben aus der Reichweite entfernt. So wird die Zahl der verbleibenden Fische nach und nach aufgebraucht. Aus diesem Erschöpfungstrend kann die Gesamtmenge innerhalb der Studienreichweite geschätzt und dann in D (in Fischen pro m2)umgerechnet werden, indem die bekannte Oberfläche der Studienreichweite verwendet wird. Benthische Makroinvertebraten werden mit Standard-Probenehmern mit festen Flächen gesammelt, dann im Labor identifiziert und gemessen.
Als nächstes werden die kombinierten Fisch- und Makroinvertebrate-Daten auf die Großen aufgeteilt. Traditionell wurde die Oktave- oder Log-2-Skala (d. h. Verdoppelungsintervalle) verwendet, um Größenbin-Grenzen16festzulegen. Sobald eine Liste der Größenbehälter erstellt wurde, ist die Aufteilung einzelner benthischer Makroinvertebraten auf ihre jeweiligen Größenbehälter einfach, da Wirbellose direkt als Anzahl von Individuen pro Flächeneinheit aufgezählt werden. Die Schätzung der Fischbestände in den Behältern der Größe ist jedoch abstrakter, da diese Schätzungen aus den Erschöpfungsdaten abgeleitet werden. Es werden daher detaillierte Anweisungen zur Schätzung des Fischreichtums innerhalb von Größenbehältern, unabhängig von der taxonomischen Identität, aus Erschöpften probendaten gegeben.
Schließlich wird die lineare Regression verwendet, um das Größenspektrum zu modellieren. Dieses Protokoll ist vollständig kompatibel mit der ursprünglichen, allgemeinen Methode von Kerr und Dickie16 und identisch mit den Methoden von McGarvey und Kirk, 201817 in einer Studie von Fischen und wirbellosen Größe Spektren in West Virginia Bäche verwendet. Durch die Verwendung dieses Protokolls können die Forscher sicherstellen, dass ihre Ergebnisse direkt mit anderen Studien vergleichbar sind, die auf Kerr und Dickie16aufbauen, wodurch ein breites und robustes Verständnis der Beziehungen zur Körpergrößenskalierung in Süßwasser beschleunigt wird. Ökosysteme und die Mechanismen, die sie antreiben.
Protokoll
Alle hier beschriebenen Methoden wurden vom Institutional Animal Care and Use Committee (IACUC) der Virginia Commonwealth University genehmigt.
1. Sammlung und Verarbeitung von Fischproben
- Isolieren von Fischen innerhalb der Studie Reichweite, um eine geschlossene Fisch-Assemblage zu schaffen
- Identifizieren Sie die vor- und nachgelagerten Enden der Studie (Die Richtung ist relativ zu einem Vermesser, der "vorgelagert" und gegen den Wasserstrom gerichtet ist) und markieren Sie dann die Enden mit abnehmbarem Flagging-Band.
ANMERKUNG: Die Gesamtlänge der Studienreichweite ist willkürlich, sollte aber lang genug sein, um eine repräsentative Auswahl der verschiedenen Lebensraumtypen (z. B. Riffles, Runs, Pools, Undercut-Banken) innerhalb des gesamten Stroms umfassen zu können. In den meisten Fällen ist eine Reichweite von 100 bis 200 m studienangemessen. - Messen Sie die Breite des benetzten Stromkanals bei 5–10 Transekte, die gleichmäßig entlang der Länge der Studienreichweite verteilt sind. Schätzen Sie die Gesamtfläche der Studie als durchschnittliche benetzte Kanalbreite multipliziert mit der Gesamtlänge der Reichweite.
- Sichere Blocknetze (d. h. knotenlose Waden mit Schwimmern auf der obersten Linie und Gewichtungen auf der Unterseite) über den Stromkanal an den vor- und nachgelagerten Enden der Studienreichweite. Verwenden Sie mittlere bis grobe Netznetze (6,3 –9,5 mm oder 1/4–3/8 Zoll Netz), um die Ansammlung von Schmutz und Verstopfung zu minimieren. Verwenden Sie keine großen (>12,7 mm) Netznetze, da kleine Fische durchgehen.
ANMERKUNG: Bereiten Sie vor der Probenahme ein Rigging-Kit vor, das Folgendes enthält: (i) 8 lange (ca. 15 m lange) Polypropylen-Seilstücke (9,5 mm oder 3/8 Zoll Durchmesser); und (ii) 8 Nocken-Action-Krawattengurte. Verwenden Sie keine Ratschen-Aktionsgurte, da diese beim Loslassen ihrer Ladung schnappen und schwere Verletzungen verursachen können.- Suchen Sie am vorgelagerten Ende der Studie einen Baum, eine Wurzel, ein großes Gestein oder ein anderes festes Objekt, das verwendet werden kann, um ein Netz auf jeder Seite des Stroms zu verankern. Die Verfügbarkeit geeigneter Ankerpunkte auf jeder Seite des Stroms wirkt sich wahrscheinlich auf die Position der vorgelagerten Grenze aus.
- Wählen Sie ein Stück Polypropylen-Seil und erstellen Sie eine Schleife an jedem Ende mit einem Bogenknoten. Verwenden Sie nur einen Bogenknoten, da andere Knoten dauerhaft versiegelt werden können, wenn sie Feuchtigkeit und hoher Spannung ausgesetzt sind. Anweisungen zum Binden eines Bogenknotens finden Sie in Abbildung 1.
- Wickeln Sie das Seil um den Baum/Wurzel/Fels und füttern Sie die Schleife an einem Ende durch die Schleife am anderen Ende, um einen Ankerpunkt zu erstellen (Abbildung 2). Verkürzen oder verlängern Sie den Seilanker, indem Sie Wraps um den Baum/die Wurzel/den Felsen hinzufügen oder entfernen.
- Wiederholen Sie die Schritte 1.1.3.1– 1.1.3.3, um einen zweiten Ankerpunkt auf der gegenüberliegenden Seite des Streams festzulegen.
- Erstellen Sie eine Schleife in den Linien an jeder der vier Ecken des Blocknetzes mit einem Bogenknoten. Verwenden Sie nur einen Bogenknoten (Abbildung 1).
- Verbinden Sie beide Seiten der oberen Linie des Blocknetzes (die Linie mit Schwimmern) mit den Ankerpunkten mit Nocken-Action-Krawattengurten. Legen Sie die Haken an beiden Enden des Bindegurts in die Schlaufen an den Ecken des Blocknetzes und an den Ankerpunkten ein (Abbildung 2). Ziehen Sie den freien Tether des Krawattengurts durch die Nockenschnalle, um jeden Kontaktpunkt festzuziehen.
ANMERKUNG: Um die Spannung an den Ankern zu lösen (zum Einstellen des Blocknetzaufbaus oder zum Entfernen des Blocknetzes, wenn die Probenahme abgeschlossen ist), drücken Sie die Nockentaste an jedem der Abklemmgurte. - Sichern Sie die Unterseite des Blocknetzes (die Linie mit Gewichten), indem Sie sie mit Zelteinsätzen an die Bachbank heften.
- Stellen Sie eine Dichtung mit dem Boden des Stroms mit großen Felsen, um das Blocknetz nach unten zu heften. Legen Sie Steine auf der Seite des Netzes nach oben. Stellen Sie sicher, dass die Oberseite des Netzes über dem Wasserstand bleibt (Abbildung 2). Passen Sie die Höhe(n) des/der Ankerpunkte nach Bedarf an.
- Legen Sie ein zweites Blocknetz fest, indem Sie die Schritte 1.1.3.1– 1.1.3.8 am nachgelagerten Ende der Studienreichweite wiederholen.
- Identifizieren Sie die vor- und nachgelagerten Enden der Studie (Die Richtung ist relativ zu einem Vermesser, der "vorgelagert" und gegen den Wasserstrom gerichtet ist) und markieren Sie dann die Enden mit abnehmbarem Flagging-Band.
- Führen Sie den ersten von 3 Fischprobenentnahmepässen innerhalb der beiliegenden Studienreichweite durch. Dieses Protokoll geht davon aus, dass ein Rucksack-Elektrofischer verfügbar ist und alle Vermessungspersonal für den Einsatz entsprechend geschult sind. Andere Methoden können möglicherweise verwendet werden, sind aber möglicherweise nicht so effektiv bei der Sammlung repräsentativer Fischproben.
HINWEIS: In kleinen Bächen sind 4-5 Personen eine ideale Besatzungsgröße: eine für den Betrieb des Elektrofischers, zwei zum Netz betäubte Fische und ein oder zwei, um Halteeimer und Shuttle-Gefangene zu transportieren. Auch Rucksack Elektrofischen kann erhebliche Verletzungen verursachen, sowohl Fische und Menschen zu strömen18. Es ist daher wichtig, Vorsicht walten zu lassen und eine angemessene Ausbildung zu erhalten.- Ab dem nachgeschalteten Ende der geschlossenen Studie erreichen, schalten Sie den Rucksack Elektrofischer ein und bewegen Sie sich in die vorgelagerte Richtung. Fortschritte langsam, bewegen sich Seite an Seite während der gesamten Studie erreichen, um sicherzustellen, dass alle instream Habitats beprobt werden. Der erste Erschöpfungspass ist abgeschlossen, wenn das vorgelagerte Netz erreicht ist.
- Lassen Sie unterstützende Besatzungsmitglieder dem Anführer folgen (der den Elektrofischer betreibt), betäubtfische Fische mit Tauchnetzen sammeln, während sie gesichtet werden, und sie in temporäre Eimer übertragen, dann in belüftete Haltewannen. Verwenden Sie kleine batteriebetriebene "Köder-Eimer"-Pumpen mit Belüftungssteinen, um sicherzustellen, dass gefangene Fische gesund bleiben.
- Achten Sie besonders auf sehr kleine, jung-jährige Fische, da sie schwer zu erkennen und zu fangen sind. Wenn der Fang der kleinsten Fische sehr ineffizient ist, können die Ergebnisse verzerrt sein. In diesem Fall kann es erforderlich sein, die kleinsten Log2-Größenklassen aus den Fischdaten zu entfernen, bevor die Dichte in den Abschnittsbehältern der Größe 2 geschätzt wird (siehe Schritt 3.2.2).
HINWEIS: Der Erfolg beim Netting von betäubten Fischen wird mit einer Reihe von biologischen und ökologischen Bedingungen variieren. Zum Beispiel wird trübes Wasser, in dem die Sicht gering ist, die Fähigkeit einschränken, Fische effektiv zu lokalisieren und zu fangen; Wenn die Trübung zu hoch ist, sollte die Probenahme neu geplant oder eine alternative Probenahmestelle ausgewählt werden.
- Achten Sie besonders auf sehr kleine, jung-jährige Fische, da sie schwer zu erkennen und zu fangen sind. Wenn der Fang der kleinsten Fische sehr ineffizient ist, können die Ergebnisse verzerrt sein. In diesem Fall kann es erforderlich sein, die kleinsten Log2-Größenklassen aus den Fischdaten zu entfernen, bevor die Dichte in den Abschnittsbehältern der Größe 2 geschätzt wird (siehe Schritt 3.2.2).
- Verarbeitung von Fischen, die im ersten Erschöpfungspass gesammelt wurden
- Bestimmen Sie, ob eine Anästhesie benötigt wird. Lebende Fische sind oft schwer zu handhaben, und sedieren kann notwendig sein, um Stress und Verletzungen von Fischproben zu minimieren. Wenn Anästhesie verwendet wird, sind zwei Optionen weit verbreitet (Stand April 2019) verfügbar: Tricain-S (Tricain Methansulfonat, MS-222) und Kohlendioxid (Backpulver).
HINWEIS: Tricaine-S beinhaltet eine 21-tägige Haltedauer, bevor exponierte Fische sicher verzehrt werden können19,20, aber es ist derzeit (Stand April 2019) das einzige Fisch-Beruhigungsmittel, das von der US-amerikanischen Food and Drug Administration zugelassen wurde. - Befolgen Sie bei der Verwendung von Beruhigungsmitteln sorgfältig alle Anweisungen des Anästhetikums. In allen Fällen die Anästhesieverbindung in einem belüfteten Wasserbad mischen. Untertauchen gesammeltfische im Bad, bis sedieren beobachtet wird. Nach der Sedatiertheit die Fische so schnell wie möglich verarbeiten, da eine längere Exposition gegenüber Beruhigungsmitteln zum Tod führen kann.
- Verwenden Sie kleine Tauchnetze, um gesampelte Fische einzeln oder in kleinen Chargen einzeln oder in kleinen Chargen zur Identifizierung aus dem Haltebecken (mit oder ohne Sedierung) zu holen. Legen Sie die Proben in weiße Kunststoff- oder Emailschalen und verwenden Sie Zangen und Lupen zur Untersuchung. Verwenden Sie lokale oder regionale Identifikationsschlüssel (z. B. "Die Fische von Ohio")21, um bei der Identifizierung zu helfen.
- Messen Sie die Gesamtlänge (von der Schnarbe bis zum Ende der Caudalflosse) für jede Probe und wiegen Sie dann auf einem Feldgleichgewicht. Wenn Sie eine elektronische Waage verwenden, wählen Sie eine mit 0,1 oder 0,01 g Genauigkeit aus. Halten Sie eine transparente Kunststoffbox zur Hand, um sie bei Bedarf als Wind- und Regenblase zu verwenden (sie muss groß genug sein, um das Gleichgewicht und die zu wiegenden Proben zu decken).
- Zeichnen Sie alle Informationen (Artenidentität, Gesamtlänge und Gewicht) auf wasserdichten Datenblättern auf. Ein druckbares Beispiel für ein Fischdatenblatt finden Sie in der Zusatzdatei 1.
- Nach der Verarbeitung die Fische in einen separaten belüfteten Halte-/Erholungsbehälter zurückgeben. Wenn alle Fische verarbeitet sind, lassen Sie sie flussabwärts des nachgeschalteten Blocknetzes frei.
HINWEIS: Wenn Sie sie versehentlich in Ihre beiliegende Studienreichweite freigeben, werden Sie Ihre Probe ruinieren! Wenn Anästhesie verwendet wurde, warten Sie, bis alle Fische erholt haben und wieder Gleichgewicht gefunden haben.
- Bestimmen Sie, ob eine Anästhesie benötigt wird. Lebende Fische sind oft schwer zu handhaben, und sedieren kann notwendig sein, um Stress und Verletzungen von Fischproben zu minimieren. Wenn Anästhesie verwendet wird, sind zwei Optionen weit verbreitet (Stand April 2019) verfügbar: Tricain-S (Tricain Methansulfonat, MS-222) und Kohlendioxid (Backpulver).
- Durchführen des zweiten und dritten Erschöpfungsdurchläufes
ANMERKUNG: Wenn in den ersten drei Durchgängen kein starker Erschöpfungstrend induziert wird (d. h. wenn die Anzahl der beprobten Fische durch den dritten Durchgang nicht merklich zurückgegangen ist), können zusätzliche Pässe erforderlich sein, um die Fischmenge genau abzuschätzen22. Zeitlich erlaubt, ist es oft eine gute Idee, proaktiv vier oder fünf aufeinanderfolgende Erschöpfungspässe durchzuführen.- Stellen Sie sicher, dass die vor- und nachgelagerten Blocknetze noch sicher sind. Wenn in beiden Blocknetzen erhebliche Trümmer gesammelt wurden, entfernen Sie sie per Handkommissionierung.
- Sammeln Sie die verbleibenden Erschöpfungspass-Beispiele, indem Sie die Schritte 1.2–1.3 wiederholen. Stellen Sie sicher, dass der Stichprobenaufwand zwischen allen drei Durchgängen konsistent bleibt. Verwenden Sie das gleiche Bewegungstempo (Timing des Prozesses wird empfohlen) und dieselben Besatzungsmitglieder, um die Stichprobenreichweite erneut zu vermessen.
- Wenn Sie fertig sind, zerlegen Sie die Blocknetze und entfernen Sie alle Ankermaterialien.
2. Sammlung und Verarbeitung von benthischen Makroinvertebratenproben
- Wählen Sie benthische Makroinvertebrate-Probenstandorte innerhalb der Grenzen der Fischprobenahme reichweiten, die repräsentativ für die wichtigsten Arten von physischen Lebensräumen (z. B. Riffeln oder Läufe) sind, die in der Studienreichweite beobachtet werden.
- Sammeln Sie mit einem Probenehmer mit fester Fläche die erste benthische Makroinvertebrate-Probe. In flachen Bächen mit umfangreichem Kies-zu-Kies-Material sind der Surber-Sampler und der Hess-Sampler die am häufigsten verwendeten Geräte, aber jeder Festflächen-Sampler kann verwendet werden. Bei der Probenahme anderer Arten von Lebensräumen, in denen diese Geräte nicht funktionieren, konsultieren Sie Merritt et al. 23 und Hauer und Resh24.
- Die Probenahmevorrichtung fest gegen den Bachboden platzieren, wobei das Probenentnahmenetz nachgeschaltet ist; große Pflastersteine nach Bedarf bewegen, um eine feste Dichtung mit dem Substrat zu etablieren.
- Verwenden Sie eine Draht- oder Kunststoffbürste, um das Substrat innerhalb des Probenahmebereichs für einen Zeitraum von 2 min kräftig zu schrubben, so dass ausgelassene benthische Makroinvertebraten in das Probennetz driften können.
- Den Probeninhalt aus dem Netz in ein Kunststoffglas geben und zur Konservierung mit 70% Isopropylalkohol abdecken. Beschriften Sie das Glas und bewahren Sie es an einem sicheren Ort auf, um es in das Labor zu übertragen.
- Sammeln und bewahren Sie weitere benthische Makroinvertebrate-Proben, wiederholen Sie Schritt 2.2.
HINWEIS: Die Anzahl der Makroinvertebraten-Proben, die gesammelt werden sollten, ist variabel und etwas willkürlich. Idealerweise sollten 5-10 Replikationsproben gesammelt und einzeln aufbewahrt werden. Mindestens 3 Replizienproben sollten gesammelt werden. - Geben Sie alle gesammelten Proben zur Verarbeitung in die Übungseinheit zurück.
HINWEIS: Isopropylalkohol ist eine brennbare Flüssigkeit, und wenn konservierte Proben über den Boden oder das Luftfahrtunternehmen versendet werden, muss zunächst alle einschlägigen Gefahrgut-/Gefahrgutschulungen, Verpackungen und Versandanforderungen erfüllt werden. - Sortieren und identifizieren Sie im Labor erhaltene benthische Makroinvertebratenproben.
- Trennen Sie die Proben von feinem Sediment, indem Sie den Probeninhalt sorgfältig in ein Feinmaschsieb (z. B. 125 oder 250 m) gießen und spülen.
- Spülinhalt auf eine weiße Kunststoff- oder Emailschale übertragen, mit einem kleinen Wasservolumen abdecken und Makrowirbellose manuell aus den restlichen Rückständen mit feinen Punktzangen pflücken. Die extrahierten Makrowirbellosen in einen kleinen Behälter mit 70% Isopropylalkohol legen.
ANMERKUNG: Wenn eine große Menge grober Pflanzen- oder Mineralrückstände mit dem Probeninhalt vermischt wird, was es schwierig macht, Makrowirbellose in der Schale zu sehen, kann es erforderlich sein, den verbleibenden Probeninhalt zu verarbeiten, indem das Material zuerst untergeteilt und mit mehrere kleinere Mengen. - Identifizieren Sie Proben mit hilfe eines sezierenden Stereomikroskops mit einem in einem der Okularen installierten Oularmeter auf die niedrigste praktische taxonomische Ebene. In den meisten Fällen handelt es sich um Familien- oder Gattungsebene.
HINWEIS: Die Verarbeitung und Identifizierung des gesamten Inhalts einer einzelnen wirbellosen Probe erfordert oft 2 –5 h oder länger. Budget genug Zeit und stellen Sie sicher, dass eine geeignete Bibliothek von taxonomischen Schlüsseln25,26,27,28 zur Verfügung steht, um bei der Identifizierung zu helfen. - Verwenden Sie das Okularmikrometer im Mikroskop-Okular, um die gesamte Körperlänge jeder Probe zu messen. Wenn eine Messung der Körperlänge nicht möglich ist (z. B. beschädigte oder fehlende Unterleibe), kann die Messung der Kopfkapselbreite ausreichen.
- Schätzung der individuellen Trockenmasse (M) für jede Probe unter Verwendung der Körperlängen- oder Kopfkapselbreitenmessungen und der steuerspezifischen Körperlänge vs. M oder Kopfbreite vs. M Regressionsgleichungen aus veröffentlichten Quellen29, 30. Zum Beispiel die empirische Körperlänge (mm) vs. M (mg) Gleichung, die in Benke et al. berichtet wird. 29 für die Alderfly Sialis sp. (Megaloptera, Sialidae) ist M = 0,0031 x Gesamtlänge2.801. Daher beträgt die geschätzte M für eine Sialis sp. Probe mit einer Gesamtlänge von 15 mm 6.104 mg.
ANMERKUNG: Wenn eine veröffentlichte Länge-M-Gleichung für ein bestimmtes Taxon nicht verfügbar ist, ersetzen Sie eine geeignete Gleichung auf einer höheren Ebene der taxonomischen Auflösung (z. B. ersetzen Sie die entsprechende Gleichung auf Familienebene, wenn die Gleichung auf Gattungsebene nicht verfügbar) oder von einem eng verwandten Taxon mit einer ähnlichen Körperform.
3. Abschätzung von Fischen und benthischen Makroinvertebratendichten in Baumbehälternin 2 Größe
Eine Animation, die zeigt, wie die Daten von Fischen und wirbellosen Tieren für die Größenspektrenanalyse formatiert werden, finden Sie unter http://bit.ly/SizeSpectraDensities.
- Erstellen Sie eine Reihe von Holz-2-großen Behältern, die alle wirbellosen und Fischproben umfassen, von der kleinsten benthischen Makroinvertebrate bis zum größten Fisch. Stellen Sie sicher, dass alle Größenschätzungen in Einheiten von mg Trockenmasse sind.
HINWEIS: Aus Gründen der Konsistenz empfehlen wir die von McGarvey und Kirk17verwendeten Größenbehälter. Diese Größenbehälter reichen von 0,0001 bis 214.748.3648 mg. Eine Kalkulationstabelle mit den unteren und oberen Grenzwerten für jeden dieser 31 Protokoll-2-Abschnitte ist in der Zusatzdatei 2angegeben. - Schätzen Sie die Fischmenge in jedem der entsprechenden Größenbehälter.
- Konvertieren Sie zunächst alle einzelnen Fischgewichte von der g-Nassmasse (auf den Felddatenblättern aufgezeichnet) in mg Trockenmasse. Der nass-trockene Massenumwandlungsfaktor von Wasser31 (1 g Nassmasse = 0,2 g Trockenmasse) kann nach der Umwandlung von g in mg verwendet werden.
- Zusammengenommen ist die Gesamtzahl der einzelnen Fische, die in den jeweiligen Größenbehältern (unabhängig von der Artenidentität) während der ersten, zweiten und dritten Erschöpfungsproben gefangen wurden. Ein Beispiel ist in der Ergänzenden Datei 2dargestellt.
ANMERKUNG: Eine voreingenommene Unterprobe von sehr kleinen Fischen ist bei der Probenahme von Dampffischen üblich und wird sich zeigen, wenn Individuen in Denkübeln der Größe2 zusammengefasst werden; Die Häufigkeit der kleinsten Fische wird auffallend geringer sein als in größeren Behältern (z. B. 5 vs. 100 Individuen in angrenzenden Behältern). Entfernen Sie Abschnitte der Größe von log 2, die vor der Größenspektrenanalyse deutlich verzerrt sind (siehe Schritt 4). - Verwenden Sie die Zippin Maximum Likelihood Gleichung15,32, um die gesamte Fischmenge (n) innerhalb der kleinsten Fischgröße Bin zu schätzen.
- Beginnen Sie mit der Berechnung einer Zwischen-X-Statistik als

wobei ich den i. Probenahmepass beziffere (i = 1, 2, 3 usw.), k die Gesamtzahl der Durchgänge (k = 3, es sei denn, zusätzliche Pässe wurden vermessen) und Ci die Gesamtzahl der Anzahl der Fische, die während des Ith Passes gefangen wurden. - Berechnen Sie die Maximale Wahrscheinlichkeitsschätzung von n, indem Sie iterativ abnehmende n-Werte in Gleichung 2 ersetzen, bis

wobei T die Gesamtzahl der Personen ist, die während k-Pässen erfasst wurden, und alle verbleibenden Variablen wie oben in Gleichung 1 definiert sind. - Wenn in der ersten, zweiten oder dritten Erschöpfungsprobe Nullzählungen beobachtet werden, schätzen Sie n als Summe der Personen, die unter den drei Erschöpfungsproben erfasst wurden. Ein bearbeitetes Beispiel der Gleichungen 1 und 2 ist in der Ergänzenden Datei 2dargestellt.
HINWEIS: Mehrere Softwareanwendungen können verwendet werden, um Zippin-Überflussschätzungen aus Erschöpfungsproben zu berechnen, wie z. B. die Funktion "Entfernung" im R-Paket "FSA" (Fisheries Stock Assessment)33. Es ist jedoch lehrreicher, die Gleichungen 1 und 2 in einer Kalkulationstabelle manuell zu lösen. Detaillierte Anweisungen finden Sie in Lockwood und Schneider34 und Supplementary File 2.
- Beginnen Sie mit der Berechnung einer Zwischen-X-Statistik als
- Wiederholen Sie Schritt 3.2.3 für jeden der verbleibenden Fischgrößenbehälter.
- Konvertieren Sie die n Schätzung für jede Größe Behälter mit Fisch in eine pro 1 m2D Schätzung, indem Sie n durch die Gesamtflächenschätzung der untersuchten Reichweite von Schritt 1.1.2 oben dividiert. Wenn z. B. die Zippin n-Schätzung 70 Fische beträgt und die Oberfläche der untersuchten Reichweite 1.200 m2 beträgt, dann D = 0,058 Fische/m2.
- Schätzen Sie die Häufigkeit der benthischen Makroinvertebraten innerhalb der Abschnittsabschnitte in log 2, indem Sie die Ergebnisse jeder Feldprobe bündeln (d. h. die Ergebnisse der Replizierungsproben zu einer einzigen Liste einzelner Proben kombinieren), und summieren Sie dann die Gesamtzahl der Personen innerhalb jeder Größe bin.
ANMERKUNG: Wenn die in Schritt 2.5.5 verwendeten Längen-Massen-Gleichungen individuelle Gewichtsschätzungen in Einheiten von mg Trockenmasse ergeben, ist für benthische Makroinvertebraten keine zusätzliche Einheitenumwandlung erforderlich. - Schätzen Sie benthische Makroinvertebrate D innerhalb jeder Größe bin als
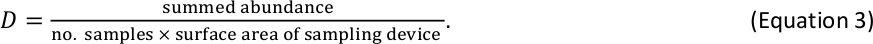
Wenn z. B. 6 benthische Makroinvertebratenproben mit einem Standard-Hess-Gerät (Oberfläche = 0,086 m2) und insgesamt 110 Personen innerhalb eines bestimmten Größenbehälters gezählt wurden, beträgt die D-Schätzung für diese Größe 213 Individuen/m 2 . - Kombinieren Sie D-Ergebnisse für Fische und benthische Makrowirbeltiere in einer einzigen Tabelle mit D-Schätzungen pro Protokoll2-Größe- bin. Wenn Fische und Makrowirbellose in der gleichen Größe im Mülleimer vorkommen (ein seltenes Ereignis, das bei den größten wirbellosen Tieren und kleinsten Fischen auftreten kann), summen Sie ihre jeweiligen D-Schätzungen, um eine Gesamt-D-Schätzung für diese Größe behälter zu erhalten.
- Löschen Sie alle "leeren" Protokoll-2-Größenabschnitte (d. h. Größenabschnitte mit D-Werten von Null), da leere Abschnitte die linearen Regressionsmodelle verzerrt, die zur Schätzung der Größenspektrenparameter35, 36verwendet werden.
4. Modellierung des benthischen Makroinvertebraten und Fischgrößenspektrums
- Schätzen Sie die durchschnittliche Trockenmassefür jeden Abschnitt der Log-2-Größe () anhand eines der folgenden Werte: (i) den Mindestwert (untere Grenze) für jeden Größenbehälter; ii) den Höchstwert (obere Grenze); iii) das arithmetische Mittel (des Minimums und des Maximums); oder (iv) den geometrischen Mittelwert (des Minimums und des Maximums)35.
ANMERKUNG: In den unten gezeigten Beispielen wurde das Zeichen als arithmetisches Mittel jedes Abschnitts mit der Größe 2 des Protokolls geschätzt (siehe Zusatzdatei 2). - 'Normalisieren' die D-Schätzung für jeden Log 2-Größenbehälter, indem man sie durch ihre jeweilige Breite dividiert (d. h. Differenz zwischen der oberen und unteren Grenze)16, 35. Dadurch wird verhindert, dass die ungleichmäßigen Protokoll-2-Größenintervalle in den linearen Regressionsmodellen, die zur Schätzung der Größenspektrenparameter35,37 ,38verwendet werden, Verzerrungen erzeugen.
- Log10 transformiert alle Daten , um die kurvenlineare D
 M-Beziehung in eine lineare Beziehung zu konvertieren. Verwenden Sie dann die normale Regression der kleinsten Quadrate mit den Daten des Protokolls10()und10(), um das Größenspektrum als
M-Beziehung in eine lineare Beziehung zu konvertieren. Verwenden Sie dann die normale Regression der kleinsten Quadrate mit den Daten des Protokolls10()und10(), um das Größenspektrum als 
wobei log10(a) das Abfangen und b die Steigung des linearen Größenspektrummodells ist.
Ergebnisse
Beispielergebnisse, einschließlich ursprünglicher Felddaten, werden für Slaunch Fork, West Virginia, einen kleinen Bach im südlichen West Virginia, präsentiert. Die Ergebnisse des Spektrenmodells für zusätzliche Größen werden auch für zwei weitere Bäche in derselben Region präsentiert: Camp Creek und Cabin Creek, West Virginia. Dies sind die drei Studienstandorte, die in McGarvey und Kirk17enthalten sind, aber die hier vorgestellten Daten stammen aus neuen Proben, die im Mai 2015 gesam...
Diskussion
Dieses ataxic große Spektrenprotokoll kann verwendet werden, um die Größenstruktur innerhalb von Gemeinschaften von Bachfischen und Wirbellosen zu quantifizieren und zu modellieren. Frühere Größenspektrenstudien in Strömungsökosystemen reichten von der grundlegenden beschreibenden Forschung39,40 bis hin zu Vergleichen entlang eines Längsflussprofils41 und zwischen verschiedenen biogeographischen Regionen42....
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Die Finanzierung dieser Arbeit wurde von der National Science Foundation (Stipendium DEB-1553111) und der Eppley Foundation for Scientific Research bereitgestellt. Dieses Manuskript ist VCU Rice Rivers Center Beitrag #89.
Materialien
| Name | Company | Catalog Number | Comments |
| Chest waders | Multiple options | n/a | Personal protective equipment for use during electrofishing. Do NOT use 'breatheable' waders as electrical current will pass through them. |
| Rubber lineman's gloves | Multiple options | n/a | Personal protective equipment for use during electrofishing. |
| Dip nets with fiberglass poles | Multiple options | n/a | Used to capture stunned fishes during electrofishing. |
| Backpack electrofishing unit | Smith-Root; Halltech; Midwest Lake Management; Aqua Shock Solutions | www.smith-root.com; www.halltechaquatic.com; https://midwestlake.com; https://aquashocksolutions.com/ | Backpack electrofishers are currently manufactured and distributed by four independent companies in North America. Prices and warranty/technical support are the most important factors in choosing a vendor. |
| Block nets/seines (×2) | Duluth Nets | https://duluthfishnets.com/ | Necessary length will depend on stream width. 3/8 inch mesh is recommended. |
| Cam-action utility straps with 1 inch nylon webbing (×4) | Multiple options | n/a | Used to secure/anchor block nets. Available at auto supply, hardware, and department stores. |
| Large tent stakes (×4) | Multiple options | n/a | Used to secure/anchor block nets. Available at camping and department stores. |
| 5 gallon plastic buckets (×5) | Multiple options | n/a | Used to hold and transport fish during electrofishing. Available at hardware and paint supply stores. |
| 10-20 gallon totes (×3) | Multiple options | n/a | Used as livewells, sedation tanks, and recovery bins for captured fishes. Available at hardware and department stores. |
| Battery powered 'bait bucket' aeration pumps | Cabelas | IK-019008 | Used to aerate fish holding bins during field processing. |
| Fish anesthesia (Tricaine-S) | Syndel | www.syndel.com | Used to sedate fishes for field processing. Tricaine-S is regulated by the U.S. Food and Drug Administration. |
| Folding camp table and chairs | Cabelas | IK-518976; IK-552777 | Used to process fish samples. |
| Pop-up canopy | Multiple options | n/a | Used as necessary for sun and rain protection. |
| Fish measuring board | Wildco | 3-118-E40 | Used to measure fish lengths. |
| Battery powered field scale with weighing dish | Multiple options | n/a | Used to weigh fishes. Must weigh be accurate to 0.1 or 0.01 grams. |
| Clear plastic wind/rain baffle | Multiple options | n/a | Used to shield scale in rainy or windy conditions. Must be large enough to cover the scale and a weighing dish. |
| White plastic or enamel examination trays | Multiple options | n/a | Trays are essential for examining fishes in the field. |
| Stainless steel forceps | Multiple options | n/a | Forceps are helpful when examining small fishes and in transfering invertebrates to specimen jars. |
| Hand magnifiers | Multiple options | n/a | Magnification is often helpful when identifying fish specimens in the field. |
| Fish identification keys | n/a | n/a | Laminated keys that are custom prepared for specific locations are most effective. |
| Datasheets printed on waterproof paper | Rite in the Rain | n/a | Waterproof paper is essential when working with aquatic specimens. |
| Retractable fiberglass field tapes | Lufkin | n/a | Used to measure stream channel dimensions. |
| Surber sampler or Hess sampler | Wildco | 3-12-D56; 3-16-C52 | Either of these fixed-area benthic samplers will work well in shallow streams with gravel or pebble substrate. |
| 70% ethanol or isopropyl alcohol | Multiple options | n/a | Used as invertebrate preservative. |
| Widemouth invertebrate specimen jars (20-32 oz.) | U.S. Plastic Corp. | 67712 | Any widemouth plastic jars will work but these particular jars are durable and inexpensive. |
Referenzen
- Peters, R. H. . The ecological implications of body size. , (1983).
- Brown, J. H., Gillooly, J. F., Allen, A. P., Savage, V. M., West, G. B. Toward a metabolic theory of ecology. Ecology. 85 (7), 1771-1789 (2004).
- Marquet, P. A., et al. Scaling and power-laws in ecological systems. Journal of Experimental Biology. 208 (9), 1749-1769 (2005).
- Bohlin, T., Dellefors, C., Faremo, U., Johlander, A. The energetic equivalence hypothesis and the relation between population-density and body-size in stream-living salmonids. The American Naturalist. 143 (3), 478-493 (1994).
- Dunham, J. B., Vinyard, G. L. Relationships between body mass, population density, and the self-thinning rule in stream-living salmonids. Canadian Journal of Fisheries and Aquatic Sciences. 54 (5), 1025-1030 (1997).
- Jennings, S., Blanchard, J. L. Fish abundance with no fishing: predictions based on macroecological theory. Journal of Animal Ecology. 73 (4), 632-642 (2004).
- Petchey, O. L., Belgrano, A. Body-size distributions and size-spectra: universal indicators of ecological status?. Biology Letters. 6 (4), 434-437 (2010).
- Woodward, G., et al. Body size in ecological networks. Trends in Ecology and Evolution. 20 (7), 402-409 (2005).
- Trebilco, R., Baum, J. K., Salomon, A. K., Dulvy, N. K. Ecosystem ecology: size-based constraints on the pyramids of life. Trends in Ecology and Evolution. 28 (7), 423-431 (2013).
- White, E. P., Ernest, S. K. M., Kerkhoff, A. J., Enquist, B. J. Relationships between body size and abundance in ecology. Trends in Ecology and Evolution. 22 (6), 323-330 (2007).
- Schmid, P. E., Tokeshi, M., Schmid-Araya, J. M. Relation between population density and body size in stream communities. Science. 289 (5484), 1557-1560 (2000).
- Morin, A., Nadon, D. Size distribution of epilithic lotic invertebrates and implications for community metabolism. Journal of the North American Benthological Society. 10 (3), 300-308 (1991).
- Mittelbach, G. G., Persson, L. The ontogeny of piscivory and its ecological consequences. Canadian Journal of Fisheries and Aquatic Sciences. 55 (6), 1454-1465 (1998).
- Woodward, G., Hildrew, A. G. Body-size determinants of niche overlap and intraguild predation within a complex food web. Journal of Animal Ecology. 71 (6), 1063-1074 (2002).
- Zippin, C. The removal method of population estimation. Journal of Wildlife Management. 22 (1), 82-90 (1958).
- Kerr, S. R., Dickie, L. M. . The biomass spectrum: a predator-prey theory of aquatic production. , (2001).
- McGarvey, D. J., Kirk, A. J. Seasonal comparison of community-level size-spectra in southern coalfield streams of West Virginia (USA). Hydrobiologia. 809 (1), 65-77 (2018).
- Reynolds, J. B., Kolz, A. L., Zale, A. V., Parrish, D. L., Sutton, T. M. Electrofishing. Fisheries techniques. 8, 305-361 (2012).
- Bowker, J., Trushenski, J. Fish drug questions answered by the FDA. Fisheries. 38 (12), 549-552 (2013).
- Topic Popovic, N., et al. Tricaine methane-sulfonate (MS-222) application in fish anaesthesia. Journal of Applied Ichthyology. 28 (4), 553-564 (2012).
- Trautman, M. B. . The fishes of Ohio. , (1981).
- Riley, S. C., Fausch, K. D. Underestimation of trout population size by maximum-likelihood removal estimates in small streams. North American Journal of Fisheries Management. 12 (4), 768-776 (1992).
- Merritt, R. W., Cummins, K. W., Resh, V. H., Batzer, D. P., Merritt, R. W., Cummins, K. W., Berg, M. B. Sampling aquatic insects: collection devices, statistical considerations, and rearing procedures. An introduction to the aquatic insects of North America. , 15-37 (2008).
- Hauer, F. R., Resh, V. H., Hauer, F. R., Lamberti, G. A. Macroinvertebrates. Methods in stream ecology. 1, 297-319 (2017).
- Thorp, J. H., Covich, A. P. . Ecology and classification of North American freshwater invertebrates. , (2010).
- Merritt, R. W., Cummins, K. W., Berg, M. B. . An introduction to the aquatic insects of North America. , (2008).
- Stewart, K. W., Stark, B. P. . Nymphs of North American stonefly genera (Plecoptera). , (2002).
- Wiggins, G. B. . Larvae of the North American caddisfly genera (Trichoptera). , (1998).
- Benke, A. C., Huryn, A. D., Smock, L. A., Wallace, J. B. Length-mass relationships for freshwater macroinvertebrates in North America with particular reference to the Southeastern United States. Journal of the North American Benthological Society. 18 (3), 308-343 (1999).
- Smock, L. A. Relationships between body size and biomass of aquatic insects. Freshwater Biology. 10 (4), 375-383 (1980).
- Waters, T. F. Secondary production in inland waters. Adv. Ecol. Res. 10, 91-164 (1977).
- Carle, F. L., Strub, M. R. New method for estimating population-size from removal data. Biometrics. 34 (4), 621-630 (1978).
- Ogle, D. H., Wheeler, P., Dinno, A. FSA: fisheries stock analysis. R package version 0.8.22.9000. , (2018).
- Lockwood, R. N., Schneider, J. C., Schneider, J. C. Stream fish population estimates by mark-and-recapture and depletion methods. Manual of fisheries survey methods II: with periodic updates. 7, (2000).
- Blanco, J. M., Echevarría, F., García, C. M. Dealing with size-spectra: some conceptual and mathematical problems. Scientia Marina. 58 (1-2), 17-29 (1994).
- White, E. P., Enquist, B. J., Green, J. L. On estimating the exponent of power-law frequency distributions. Ecology. 89 (4), 905-912 (2008).
- Vidondo, B., Prairie, Y. T., Blanco, J. M., Duarte, C. M. Some aspects of the analysis of size spectra in aquatic ecology. Limnology and Oceanography. 42 (1), 184-192 (1997).
- Sprules, W. G., Barth, L. E. Surfing the biomass size spectrum: some remarks on history, theory, and application. Canadian Journal of Fisheries and Aquatic Sciences. 73 (4), 477-495 (2016).
- Poff, N. L., et al. Size structure of the metazoan community in a Piedmont stream. Oecologia. 95 (2), 202-209 (1993).
- Ramsay, P. M., et al. A rapid method for estimating biomass size spectra of benthic metazoan communities. Canadian Journal of Fisheries and Aquatic Sciences. 54 (8), 1716-1724 (1997).
- Solimini, A. G., Benvenuti, A., D’Olimpio, R., Cicco, M. D., Carchini, G. Size structure of benthic invertebrate assemblages in a Mediterranean river. Journal of the North American Benthological Society. 20 (3), 421-431 (2001).
- Huryn, A. D., Benke, A. C., Hildrew, A., Raffaelli, D., Edmonds-Brown, R. Relationship between biomass turnover and body size for stream communities. Body size: the structure and function of aquatic ecosystems. 4, 55-76 (2007).
- Gaedke, U. The size distribution of plankton biomass in a large lake and its seasonal variability. Limnology and Oceanography. 37 (6), 1202-1220 (1992).
- Stead, T. K., Schmid-Araya, J. M., Schmid, P. E., Hildrew, A. G. The distribution of body size in a stream community: one system, many patterns. Journal of Animal Ecology. 74 (3), 475-487 (2005).
- Brose, U., et al. Consumer-resource body-size relationships in natural food webs. Ecology. 87 (10), 2411-2417 (2006).
- Mehner, T., et al. Empirical correspondence between trophic transfer efficiency in freshwater food webs and the slope of their size spectra. Ecology. 99 (6), 1463-1472 (2018).
- Daan, N., Gislason, H. G., Pope, J. C., Rice, J. Changes in the North Sea fish community: evidence of indirect effects of fishing?. ICES Journal of Marine Science. 62 (2), 177-188 (2005).
- Murry, B. A., Farrell, J. M. Resistance of the size structure of the fish community to ecological perturbations in a large river ecosystem. Freshwater Biology. 59 (1), 155-167 (2014).
- Broadway, K. J., Pyron, M., Gammon, J. R., Murry, B. A. Shift in a large river fish assemblage: body-size and trophic structure dynamics. PLoS ONE. 10 (4), e0124954 (2015).
- Vila-Martínez, N., Caiola, N., Ibáñez, C., Benejam, L., Brucet, S. Normalized abundance spectra of fish community reflect hydro-peaking on a Mediterranean large river. Ecological Indicators. 97, 280-289 (2019).
- Brucet, S., et al. Size-based interactions across trophic levels in food webs of shallow Mediterranean lakes. Freshwater Biology. 62 (11), 1819-1830 (2017).
- Ersoy, Z., et al. Size-based interactions and trophic transfer efficiency are modified by fish predation and cyanobacteria blooms in Lake Mývatn, Iceland. Freshwater Biology. 62 (11), 1942-1952 (2017).
- Arranz, I., Hsieh, C. H., Mehner, T., Brucet, S. Systematic deviations from linear size spectra of lake fish communities are correlated with predator–prey interactions and lake-use intensity. Oikos. 128 (1), 33-44 (2019).
- Jennings, S., et al. Long-term trends in the trophic structure of the North Sea fish community: evidence from stable-isotope analysis, size-spectra and community metrics. Marine Biology. 141 (6), 1085-1097 (2002).
- Guiet, J., Poggiale, J. C., Maury, O. Modelling the community size-spectrum: recent developments and new directions. Ecological Modelling. 337, 4-14 (2016).
- Robinson, J. P. W., et al. Fishing degrades size structure of coral reef fish communities. Global Change Biology. 23 (3), 1009-1022 (2017).
- Reuman, D. C., Mulder, C., Raffaelli, D., Cohen, J. E. Three allometric relations of population density to body mass: theoretical integration and empirical tests in 149 food webs. Ecology Letters. 11 (11), 1216-1228 (2008).
- Huryn, A. D., Wallace, J. B., Anderson, N. H., Merritt, R. W., Cummins, K. W., Berg, M. B. Habitat, life history, secondary production, and behavioral adaptations of aquatic insects. An introduction to the aquatic insects of. 5, 55-103 (2008).
- Werner, E. E., Gilliam, J. F. The ontogenetic niche and species interactions in size-structured populations. Annual Review of Ecology and Systematics. 15 (1), 393-425 (1984).
- Edwards, A. M., Robinson, J. P. W., Plank, M. J., Baum, J. K., Blanchard, J. L. Testing and recommending methods for fitting size spectra to data. Methods in Ecology and Evolution. 8 (1), 57-67 (2017).
- Roell, M., Orth, D. Production of three crayfish populations in the New River of West Virginia, USA. Hydrobiologia. 228 (3), 185-194 (1992).
- Hawkins, C. P., Murphy, M. L., Anderson, N. H., Wilzbach, M. A. Density of fish and salamanders in relation to riparian canopy and physical habitat in streams of the northwestern United States. Canadian Journal of Fisheries and Aquatic Sciences. 40 (8), 1173-1185 (1983).
- Rabeni, C. F., Collier, K. J., Parkyn, S. M., Hicks, B. J. Evaluating techniques for sampling stream crayfish (Paranephrops planifrons). New Zealand Journal of Marine and Freshwater Research. 31 (5), 693-700 (1997).
- DiStefano, R. J., Gale, C. M., Wagner, B. A., Zweifel, R. D. A sampling method to assess lotic crayfish communities. Journal of Crustacean Biology. 23 (3), 678-690 (2003).
- Price, J. E., Welch, S. M. Semi-quantitative methods for crayfish sampling: sex, size, and habitat bias. Journal of Crustacean Biology. 29 (2), 208-216 (2009).
- Sheldon, R. W., Sutcliffe, W. H., Paranjape, A. M. Structure of pelagic food chain and relationship between plankton and fish production. Journal of the Fisheries Research Board of Canada. 34 (12), 2344-2353 (1977).
- Andersen, K., et al. Asymptotic size determines species abundance in the marine size spectrum. The American Naturalist. 168 (1), 54-61 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten