このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
河川生態系におけるマクロ無脊椎動物と魚類のサイズスペクトルのモデリング
要約
これは、魚と無脊椎動物のデータを組み合わせた大きさスペクトル(個々の質量と人口密度のスケーリング関係)をモデル化するプロトコルです。方法は次のとおりです: 定量的な魚や無脊椎動物のサンプルを収集するフィールドテクニック;フィールド データを標準化するラボ メソッド。と統計データ分析。
要約
サイズスペクトルは、平均体重(M)と生態学的コミュニティまたは食物網内の個人の密度(D)との間の逆の同種スケーリング関係である。重要なのは、サイズスペクトルは、種の行動や生命の歴史特性ではなく、個々のサイズが生態系内の豊かさの主要な決定要因であると仮定します。したがって、種レベルのデータに焦点を当てた従来の同種関係(例えば、平均種の体の大きさと人口密度)とは異なり、サイズスペクトル分析は「アタキシック」であり、個々の標本は、そのサイズによってのみ識別される。分類のアイデンティティ。サイズスペクトルモデルは、従来の複雑な食品ウェブの効率的な表現であり、説明的な文脈や予測コンテキスト(例えば、基底資源の変化に対する大規模な消費者の反応を予測する)で使用することができます。多様な水生生態系からの実証研究はまた、サイズスペクトル斜面の類似性が中程度から高いレベルであると報告されており、一般的なプロセスが非常に異なる設定で小さな生物と大きな生物の豊富さを調節する可能性があることを示唆している。これは、ワダブルストリームでコミュニティレベルのサイズスペクトルをモデル化するためのプロトコルです。プロトコルは、3 つの主要な手順で構成されます。まず、局所密度を推定するために使用できる定量的なベンチック魚と無脊椎動物のサンプルを収集します。第二に、すべての個人をアタキシック単位(すなわち、分類のアイデンティティに関係なく、サイズで識別される個人)に変換し、ログ2サイズのビン内の個人を合計することによって、魚と無脊椎動物のデータを標準化します。第 3 に、線形回帰を使用して、非課税MとDの推定値の関係をモデル化します。D推定とサイズスペクトルモデリングを容易にするカスタムソフトウェアを含む、これらの各ステップを完了するための詳細な手順を本明細書に記載されています。
概要
体重と代謝率の間の正の関連など、体の大きさのスケーリング関係は、個々の生物レベルでよく知られており、現在、組織1、2、3のより高いレベルで研究されています。.これらの同種関係は、最も多くの場合、Y =aM bという形式のパワーロー関数であり、Yは目的の変数(例えば、代謝、豊富さ、またはホームレンジサイズ)であり、Mは単一または平均の体重である。 個別、b はスケーリング係数、a は定数です。 統計的な便宜上、Y およびMデータは、多くの場合、分析の前にログ変換され、フォーム ログ (Y) = log (a) + b log (M)の線形方程式でモデル化され、ここでbおよび log (a)は、それぞれ線形モデルの勾配と切片になります。
サイズスペクトルは、密度(D、単位面積当たりの個体数)またはバイオマス(B、単位面積当たりの個人の合計質量)をMの関数として予測する同種関係の一種である(追加についてはセクション4を参照)。「正規化された」DまたはBの推定値の使用に関する情報)MとDの間、またはMとBの間の他のスケーリング関係と同様に、サイズスペクトルは、基本的なエコロジーと応用エコロジーにおいて中心的な役割を果たします。集団レベルでは、生物学者はしばしば、密度依存的生存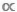 の証拠として、または生態系運搬能力のモデルとして否定的なD M関係を解釈する(すなわち、「自己間伐規則」)4、 5.コミュニティレベルでは、B
の証拠として、または生態系運搬能力のモデルとして否定的なD M関係を解釈する(すなわち、「自己間伐規則」)4、 5.コミュニティレベルでは、B 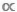 M関係は、サイズ選択的釣り6、7などの人為的摂動のシステムレベルの効果を研究するために使用することができる。MとDとBの同種スケーリングは、人口、コミュニティ、生態系生態系を結びつける最近の取り組みの中心でもあります 2,8,9.
M関係は、サイズ選択的釣り6、7などの人為的摂動のシステムレベルの効果を研究するために使用することができる。MとDとBの同種スケーリングは、人口、コミュニティ、生態系生態系を結びつける最近の取り組みの中心でもあります 2,8,9.
サイズスペクトルの特に重要な特徴の1つは、それが完全に非課税9、10であるという事実です。この点は、D 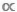 MまたはB
MまたはB 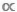 Mデータの散布図を比較する場合は見逃しやすいですが、税モデルとアタックスモデルの区別は重要です。課税モデルでは、1 つのM値が、特定の種またはタキサ11の各個体の平均体重を表すために使用されます。非課税モデルでは、データセット内のすべての個人は、分類 ID12に関係なく、一連のボディ サイズ間隔またはMビンに分割されます。後者のアタキシックアプローチは、多くのタキサが不確定な成長を示し、摂食行動の1つ以上の遺伝的変化を経験する水生生態系において有利である。これらの例では、単一の種レベルのM平均は、種がその生涯の歴史9、13、14を通じて異なる機能的役割を果たすことができるという事実をあいまいにします。
Mデータの散布図を比較する場合は見逃しやすいですが、税モデルとアタックスモデルの区別は重要です。課税モデルでは、1 つのM値が、特定の種またはタキサ11の各個体の平均体重を表すために使用されます。非課税モデルでは、データセット内のすべての個人は、分類 ID12に関係なく、一連のボディ サイズ間隔またはMビンに分割されます。後者のアタキシックアプローチは、多くのタキサが不確定な成長を示し、摂食行動の1つ以上の遺伝的変化を経験する水生生態系において有利である。これらの例では、単一の種レベルのM平均は、種がその生涯の歴史9、13、14を通じて異なる機能的役割を果たすことができるという事実をあいまいにします。
ここでは、ワダブル川と河川内のサイズスペクトルを定量化するための完全なプロトコルを提示する。プロトコルは、必要な魚とベンチックマクロ無脊椎動物のデータを収集するためのフィールドサンプリング方法から始まります。魚は「3パス枯渇」サンプリングプロセスを通じて収集されます。その後、Zippin法15を用いて枯渇データから豊富さが推定される。枯渇サンプリングでは、閉じたスタディ範囲内の個々の魚(すなわち、個人は囲まれたリーチに入ることも出て行くこともできない)は、3つの連続したサンプルを通してリーチから除去されます。したがって、残りの魚の数は徐々に減少します。この枯渇傾向から、研究範囲内の総総総量を推定し、その後、研究範囲の既知の表面積を使用して、D(m2当たりの魚)に変換することができる。ベンチックマクロ無脊椎動物は、標準的な固定領域サンプラーで収集され、その後、実験室で同定され、測定されます。
次に、魚とマクロ無脊椎動物のデータを組み合わせてサイズビンに分割します。従来、オクターブまたはログ2スケール(すなわち、倍増間隔)は、サイズビン境界16を設定するために使用されてきた。サイズビンのリストが確立されると、無脊椎動物は単位面積あたりの個人数として直接列挙されるため、それぞれのサイズビン間の個々のベンチックマクロ無脊椎動物のパーティション分割は簡単です。しかし、これらの推定値は枯渇データから推測されるため、サイズビン内の魚の豊富さを推定する方が抽象的です。したがって、詳細な手順は、劣化サンプルデータから、分類のアイデンティティに関係なく、サイズビン内の魚の豊富さを推定するために提供されます。
最後に、線形回帰を使用してサイズスペクトルをモデル化します。このプロトコルは、カーとディッキー16の元の一般的な方法と完全に互換性があり、マクガーヴィーとカークによって使用される方法と同じです, 201817ウェストバージニア州の流れで魚と無脊椎動物のサイズスペクトルの研究で.このプロトコルを使用することにより、研究者は、その結果がKerrとDickie16に基づいて構築された他の研究と直接比較可能であることを保証することができ、それによって淡水の体サイズスケーリング関係の広範かつ堅牢な理解を加速することができます生態系とそれらを駆動するメカニズム。
プロトコル
ここに記載されているすべての方法は、バージニアコモンウェルス大学の機関動物ケアおよび使用委員会(IACUC)によって承認されています。
1. 魚類サンプルの収集・処理
- 研究範囲内で魚を隔離し、閉じた魚の集合体を作成する
- 上流と下流(方向は「上流」に面し、水流に対して相対的である)を識別し、調査範囲の端部に取り外し可能なフラグテープで端部をマークします。
注:スタディリーチの全長は任意ですが、ストリーム全体に存在する異なる生息地タイプ(例えば、リッフル、ラン、プール、アンダーカットバンクなど)の代表的な選択を包含するのに十分な長さである必要があります。ほとんどの場合、100 ~ 200 m のスタディ範囲で十分です。 - スタディの範囲の長さに沿って均等に分布する 5 ~ 10 トランスペクトで、濡れ流れチャネルの幅を測定します。平均湿ったチャネル幅にリーチの全長を掛けたように、スタディの総表面積を推定します。
- セキュアブロックネット(すなわち、上流線に浮かび上がったノットレスのセーヌと、下線の重み)が、スタディの上流と下流の端にあるストリームチャネルを横切って到達します。ミディアムを使用してメッシュネット(6.3~9.5mmまたは1/4~3/8インチメッシュ)を粗くし、破片や目詰まりの蓄積を最小限に抑えます。小さな魚が通過するように大きな(>12.7 mm)メッシュネットを使用しないでください。
注:サンプリングの前に、(i)8長い(≥15 mの長さ)ポリプロピレンロープ(9.5ミリメートルまたは3/8インチの直径)を含むリギングキットを準備します。と(ii)8カムアクションタイダウンストラップ。ラチェットアクションストラップは、荷が解放されたときにスナップし、重傷を引き起こす可能性がありますので、使用しないでください。- スタディの上流の端で、ストリームの両側にネットを固定するために使用できる木、ルート、大きな岩、またはその他のソリッド オブジェクトを見つけます。ストリームの両側に適切なアンカー ポイントが使用できるかどうかは、アップストリーム境界の位置に影響を与える可能性があります。
- ポリプロピレンロープの一部を選択し、ボウライン結び目を使用して、各端にループを作成します。他の結び目は、水分と高張力にさらされると永久に密閉される可能性があるため、ボウラインノットのみを使用してください。ボウラインノットの結び目の手順については、図 1を参照してください。
- 木/根/岩の周りにロープを巻き、一方の端で一方の端にループを供給し、もう一方の端のループを通してアンカーポイントを作成します(図2)。木/根/岩の周りのラップを追加または削除して、ロープアンカーを短くまたは長くします。
- 手順 1.1.3.1 ~ 1.1.3.3 を繰り返し、ストリームの反対側に 2 番目のアンカー ポイントを確立します。
- ボウラインノットを使用して、ブロックネットの4つのコーナーのそれぞれにラインにループを作成します。ボウラインノットのみを使用します (図1)。
- カムアクションタイダウンストラップを使用して、ブロックネットの上線(フロート付きライン)の両側をアンカーポイントに接続します。タイダウン ストラップの両端にあるフックを、ブロック ネットの角とアンカー ポイントのコーナーのループに挿入します (図2)。タイダウンストラップのフリーテザーをカムバックルを通して引き出し、各接点を締めます。
注:アンカーの張力を解放するには(ブロックネットのセットアップを調整したり、サンプリングが完了したときにブロックネットを取り外す場合)、各タイダウンストラップのカムボタンを押します。 - テントステークでストリームバンクにそれらを固定することにより、ブロックネット(重みのあるライン)の一番下の行を固定します。
- 大きな岩を使って、ブロックネットを固定するために、ストリームの底部にシールを確立します。上流に面した網の側面に岩を置きます。ネットの上部が水位を上回っていることを確認してください (図2)。必要に応じて、アンカー ポイントの高さを調整します。
- スタディの下流の端でステップ 1.1.3.1 — 1.1.3.8 を繰り返して、2 番目のブロック ネットを設定します。
- 上流と下流(方向は「上流」に面し、水流に対して相対的である)を識別し、調査範囲の端部に取り外し可能なフラグテープで端部をマークします。
- 囲まれたスタディの範囲内で、3匹の魚のサンプリング枯渇パスの最初のパスを実行します。このプロトコルは、バックパックのエレクトロフィッシャーが利用可能であり、すべての測量乗組員がそれを使用するように適切に訓練されていることを前提としています。他の方法は、潜在的に使用することができますが、代表的な魚のサンプルを収集するのに効果的ではないかもしれません.
注:小さな小川では、4~5人が理想的な乗組員サイズです:1つは電気フィッシャーを操作し、2つは見事な魚を網に入れ、1つまたは2つはバケツとシャトル捕獲された魚を運ぶために1つまたは2つです。また、バックパックのエレクトロフィッシングは、魚と人間の両方をストリーミングする重大な傷害を引き起こす可能性があります 18.したがって、注意を払い、適切なトレーニングを受ける必要があります。- 囲まれたスタディリーチの下流の端から始まり、バックパックのエレクトロフィッシャーをオンにして上流方向に移動します。ゆっくりと進歩し、すべてのインストリーム生息地がサンプリングされるように、研究範囲全体を通して左右に移動します。アップストリーム ネットに到達すると、最初の枯渇パスが完了します。
- 支援する乗組員はリーダー(エレクトロフィッシャーを操作している)に従い、見つかったようにディップネットで見事な魚を集め、一時的なバケツに移し、その後、通気槽に入れましょう。捕獲された魚が健康でいることを確認するために通気石と小さなバッテリー駆動の「ベイトバケツ」ポンプを使用してください。
- 彼らは見つけ、捕獲することは困難であるので、非常に小さな、若い年の魚に特に注意してください。最も小さい魚の捕獲が非常に非効率的である場合、結果は偏っている可能性があります。この場合、ログ2サイズビン内の密度を推定する前に、魚データから最小のログ2サイズクラスを削除する必要がある場合があります (手順 3.2.2 を参照)。
注:見事な魚を網に入れ上げの成功は、生物学的および環境的条件の数によって異なります。例えば、視界が低い濁った水は、効果的に魚を見つけて捕獲する能力を制約します。濁度が高すぎる場合は、サンプリングを再スケジュールするか、代替サンプリング サイトを選択する必要があります。
- 彼らは見つけ、捕獲することは困難であるので、非常に小さな、若い年の魚に特に注意してください。最も小さい魚の捕獲が非常に非効率的である場合、結果は偏っている可能性があります。この場合、ログ2サイズビン内の密度を推定する前に、魚データから最小のログ2サイズクラスを削除する必要がある場合があります (手順 3.2.2 を参照)。
- 最初の枯渇パスで採取した魚の処理
- 麻酔が必要かどうかを判断します。生きた魚は取り扱いにくいことが多く、魚類のストレスや傷害を最小限に抑えるためには、けががが必要な場合があります。麻酔を使用する場合、トリカインS(トリカインメタンスルホン酸トリカイン、MS-222)と二酸化炭素(ベーキングソーダ)の2つのオプションが広く利用可能です(2019年4月現在)。
注:トリカイン-Sは、露出した魚が安全に消費することができる前に21日間の保持期間を伴いますが、現在(2019年4月現在)米国食品医薬品局によって承認された唯一の魚の鎮静剤です。 - 鎮静剤を使用する場合は、麻酔製品に付属するすべての指示に注意深く従ってください。いずれの場合も、通気水浴で麻酔化合物を混ぜます。沈降が観察されるまで、お風呂に集めた魚を水没させる。鎮静剤への長期暴露が死を引き起こす可能性があるため、魚をできるだけ早く処理します。
- 小さなディップネットを使用して、保持タンク(沈んだ有無にかかわらず)からサンプリングされた魚を個別に、または小さなバッチで取り出して識別します。試料を白いプラスチックまたはエナメルトレイに入れ、鉗子と虫眼鏡を使用して検査を行います。識別を支援するために、ローカルまたは地域の識別キー(例えば、「オハイオの魚」)21を使用してください。
- 各標本の全長(スナウトの先端からカウダルフィンの端まで)を測定し、フィールドバランスで重量を量ります。電子バランスを使用する場合は、0.1 または 0.01 g の精度で 1 つを選択します。必要に応じて、風と雨のバッフルとして使用するために手元に透明なプラスチック製のボックスを保持します(それはバランスと重量を量っている標本をカバーするのに十分な大きさでなければなりません)。
- 防水データシートにすべての情報(種のアイデンティティ、全長、重量)を記録します。魚のデータ シートの印刷可能な例は、補足ファイル 1で提供されます。
- 処理したら、魚を別の通気保持/回収ビンに戻します。すべての魚が処理された場合は、下流ブロックネットの下流にそれらを解放します。
注:あなたが誤ってあなたの囲まれた研究の範囲にそれらを解放した場合、あなたはあなたのサンプルを台無しにします!麻酔を使用した場合は、すべての魚が回復し、平衡を取り戻すまで放出するのを待ちます。
- 麻酔が必要かどうかを判断します。生きた魚は取り扱いにくいことが多く、魚類のストレスや傷害を最小限に抑えるためには、けががが必要な場合があります。麻酔を使用する場合、トリカインS(トリカインメタンスルホン酸トリカイン、MS-222)と二酸化炭素(ベーキングソーダ)の2つのオプションが広く利用可能です(2019年4月現在)。
- 2 番目と 3 番目の枯渇パスの実行
注:最初の3つのパスで強い枯渇傾向が誘発されない場合(すなわち、サンプリングされた魚の数が3回目のパスによって顕著に減少していない場合)、魚の豊富さを正確に推定するために追加のパスが必要な場合があります22。時間が許す限り、多くの場合、積極的に4つまたは5つの連続した枯渇パスを行うことが良い考えです。- アップストリーム ブロック ネットとダウンストリーム ブロック ネットがまだ安全であることを確認します。いずれかのブロックネットに重要な破片が収集されている場合は、手摘みで取り外します。
- 残りの枯渇パスサンプルを 1.2 ~ 1.3 の手順を繰り返して収集します。サンプリング作業が 3 つのパスすべてで一貫性を保つことを確認します。同じ運動ペース(プロセスが推奨されるタイミング)と同じ乗組員を使用して、サンプリング範囲を再調査します。
- 完了したら、ブロックネットを分解し、すべてのアンカー材料を削除します。
2. ベンチックマクロ無脊椎動物サンプルの収集と処理
- 研究範囲で観察される主要なタイプの物理的生息地(例えば、リッフルまたはラン)を代表する魚のサンプリングリーチの境界内のベンチックマクロ無脊椎動物サンプルサイトを選択します。
- 固定領域サンプラーを使用して、最初のベンチックマクロ無脊椎動物サンプルを収集します。広範な砂利から小石のサイズの材料を持つ浅い流れでは、サーバーサンプラーとヘスサンプラーは最も一般的に使用されるデバイスですが、任意の固定領域サンプラーを使用することができます。これらのデバイスが動作しない他のタイプの生息地をサンプリングする場合は、Merritt et al.を参照してください。23とハウアーとレッシュ24.
- サンプリング デバイスをストリーム底面にしっかりと配置し、サンプル コレクション ネット指向のダウンストリームを使用します。基板でしっかりとしたシールを確立するために必要に応じて大きな石畳を動かします。
- ワイヤーブラシまたはプラスチックブラシを使用して、サンプリングエリア内の基板を2分間精力的にスクラブし、脱落したベンチックマクロ無脊椎動物がサンプルネットにドリフトできるようにします。
- サンプル内容物をネットからプラスチック瓶に移し、保存のために70%のイソプロピルアルコールで覆います。瓶にラベルを付け、ラボに転送するための安全な場所に保管してください。
- 追加のベンシックマクロ無脊椎動物サンプルを収集し、保存し、ステップ2.2を繰り返します。
注: 収集する必要があるマクロ無脊椎動物サンプルの数は可変であり、やや任意です。理想的には、5 ~ 10 の反復サンプルを収集し、個別に保存する必要があります。少なくとも、3 つの反復サンプルを収集する必要があります。 - 収集したすべてのサンプルをラボに返却して処理します。
注:イソプロピルアルコールは可燃性の液体であり、保存されたサンプルが地上または航空会社を介して出荷される場合は、最初に完了し、すべての関連する危険物/危険物のトレーニング、梱包、および出荷要件を満たす必要があります。 - ラボでは、保存されたベンチックマクロ無脊椎動物サンプルを並べ替えて識別します。
- 微細な堆積物から微細な堆積物から検体を分離し、サンプル内容物を細かいメッシュふるい(例えば、125または250 μm)に注意深く注ぎ、すすいでください。
- すすみの入った内容物を白いプラスチックまたはエナメルトレイに移し、少量の水で覆い、残りの残留物から細かい点鉗子でマクロ無脊椎動物を手動で取り出します。抽出したマクロ無脊椎動物を70%イソプロピルアルコールの小さな容器に入れる。
注:大量の粗い植物やミネラル残渣をサンプル内容物と混合すると、トレイ内の無脊椎動物が見えにくくなり、まず材料を細分化して残りのサンプル内容物を処理する必要がある場合があります。いくつかのより少ない量。 - 眼のマイクロメートルを眼のマイクロメートで解剖するステレオ顕微鏡を使用して、最も実用的な分類レベルの標本を特定する。ほとんどの場合、これはファミリ レベルまたは属レベルです。
注: 単一の無脊椎動物サンプルの完全な内容を処理および識別するには、多くの場合、2 ~ 5 h 以上が必要です。十分な時間を予算し、分類キー25、26、27、28の適切なライブラリが識別を支援するために利用可能であることを確認してください。 - 顕微鏡の眼のマイクロメートルを使用して、各標本の完全な体長を測定します。体長測定が不可能な場合(例えば、腹部の損傷や欠損など)、頭部カプセル幅の測定で十分な場合があります。
- 出版物29からの体長または頭部カプセル幅測定と分類特異的な体長対Mまたは頭部幅対M回帰方程式を用いた各標本の個々の乾燥質量(M)を推定する。 30.例えば、Benkeらで報告された経験体長(mm)とM(mg)方程式。 アルダーフライ・シアリスspの場合は29。(メガロプテラ、シリダイ)はM = 0.0031×全長2.801です。従って、全長15mmのシアリスsp.標本の推定Mは6.104mgである。
注: パブリッシュされた長さとM方程式が特定の分類で使用できない場合は、分類分解能の高いレベルで適切な方程式を置き換えます (たとえば、属レベル方程式が適切なファミリ レベル方程式を置き換える場合)使用不可)、または同様のボディ形状を持つ密接に関連する分類から。
3. ログ2サイズのビン内の魚とベンチックマクロ無脊椎動物の密度の推定
サイズスペクトル解析で使用するために魚と無脊椎動物のデータをフォーマットする方法を示すアニメーションは、http://bit.ly/SizeSpectraDensitiesで利用可能です。
- 最小のベンチックマクロ無脊椎動物から最大の魚に至るまで、すべての無脊椎動物と魚の標本を包含する一連のログ2サイズのビンを確立します。すべてのサイズの推定値が mg の乾燥質量の単位であることを確認します。.
注: 一貫性を保つために、McGarvey と Kirk17で使用されるサイズビンをお勧めします。これらのサイズのビンは 0.0001 から 214,748.3648 mg の範囲.これらの 31 ログ2サイズのビンの下限と上限を持つスプレッドシートは、補足ファイル 2で提供されます。 - 対応する各サイズのビン内の魚の豊富さを推定します。
- まず、すべての個々の魚の重みをg湿質量(フィールドデータシートに記録)からmg乾燥質量に変換します。ウォーターズ31(1g湿式質量=0.2g乾燥質量)の湿式質量変換係数は、gからmgに変換した後に使用することができる。
- 1 番目、2 番目、および 3 番目の枯渇サンプルの間に、それぞれのサイズビン (種の同一性に関係なく) 内で捕獲された個々の魚の合計数を合計します。補足ファイル 2に例を示します。
注:非常に小さな魚の偏ったアンダーサンプリングは、蒸気魚のサンプリングで一般的であり、個人がログ2サイズのビン内で合計されるときに明らかになります。最小の魚の総計量は、より大きなビン(例えば、隣接するサイズのビンの5対100個体)よりも顕著に低くなります。サイズスペクトル解析の前に明確に偏っているログ2サイズのビンを削除します(手順 4 を参照)。 - ジッピン最大尤度方程式15,32を使用して、最小の魚のサイズビン内の魚の総量 (n) を推定します。
- 中間X統計量を次のように計算する最初に

i番目のサンプリング パス (i = 1、 2、3 など) を示す場合、k はパスの合計数を表します (k = 3、追加のパスが調査されていない限り)、C iは合計です。ithパス中に捕獲された魚の数。 - 方程式 2 の減少n値を繰り2 回置換して n の最大尤度推定値を計算します。

ここで、Tはkパス中にキャプチャされた個人の合計数であり、残りの変数はすべて式 1 で前述の値とおりです。 - 最初、2番目、または3番目の枯渇サンプルでゼロカウントが観察された場合、3つの枯渇サンプルの中で捕捉された個体の合計としてnを推定します。数式 1 と 2 の作業例を補足ファイル 2に示します。
注:いくつかのソフトウェアアプリケーションは、Rパッケージ'FSA'(水産ストック評価)33の「除去」機能など、枯渇サンプルからのジッピングの豊富な推定値を計算するために使用することができます。ただし、スプレッドシートで方程式 1 と 2 を手動で解く方が有益です。詳細な手順は、ロックウッドとシュナイダー34と補足ファイル2で提供されています.
- 中間X統計量を次のように計算する最初に
- 残りの魚のサイズのビンごとに手順 3.2.3 を繰り返します。
- 上記のステップ1.1.2から調査されたリーチの総表面積推定値でnを割って、魚を含む各サイズビンのn推定値を1m2D推定値に変換します。 たとえば、Zippin nの推定値が 70 匹で、調査対象範囲の表面積が 1,200 m2の場合、D = 0.058 魚/m2です。
- 各フィールドサンプルの結果をプールすることにより、ログ2サイズのビン内のベンチックマクロ無脊椎動物の豊富さを推定し(すなわち、複製サンプルの結果を個々の標本の単一のリストに結合し、その合計数を合計する)各サイズのビン内の個人。
注: ステップ 2.5.5 で使用される長質量方程式が mg ドライ質量の単位で個々の重量の推定値を生成する場合、ベンチックマクロ無脊椎動物に追加の単位変換は必要ありません。 - 各サイズビン内のベンチックマクロ無脊椎動物Dを推定
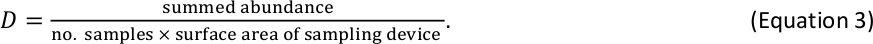
例えば、6つのベンチックマクロ無脊椎動物サンプルを標準的なHessデバイス(表面積= 0.086 m2)で収集し、合計110個が所定のサイズビン内でカウントされた場合、そのサイズビンのD推定値は213個/m2です。 . - 魚のD結果とベンシックマクロ無脊椎動物を、ログ2サイズのビンあたりのD推定値の単一のテーブルに結合します。 魚とマクロ無脊椎動物が同じサイズのビン(最大無脊椎動物と最小の魚のために発生する可能性があるまれな事象)で発生した場合、それぞれのD推定値を合計して、そのサイズビンの合計D推定値を得ます。
- 空のビンはサイズスペクトルパラメータ35、36の推定に使用される線形回帰モデルに偏りが生じるように、任意の「空の」ログ2サイズのビン(すなわち、D値がゼロのサイズビン)を削除します。
4. ベンチックマクロ無脊椎動物と魚の大きさスペクトルのモデリング
- 各ログ2サイズビンの平均乾燥質量を、(i) 各サイズ ビンの最小値 (下限) のいずれかを使用して推定します。(ii) 最大値 (上限)(iii) 算術平均 (最小値と最大値);または(iv)幾何平均(最小値と最大値)35.
注: 以下に示す例では、各ログ2サイズのビンの算術平均として推定されました (補足ファイル 2を参照)。 - 各ログ2サイズのビンのD推定値をそれぞれの幅(すなわち、上側と下の境界の差)で割ることによって「正規化」する16,35.これにより、サイズスペクトルパラメータ35、37、38のサイズスペクトル パラメータの推定に使用される線形回帰モデルに不均一な log2サイズ間隔が作成されないようにします。
- Log10は、すべてのデータと、曲線形D
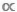 M関係を線形リレーションシップに変換します。次に、ログ 10()および log10(=)データを使用して、サイズスペクトルを次のようにモデル化する通常の最小二乗回帰を使用します。
M関係を線形リレーションシップに変換します。次に、ログ 10()および log10(=)データを使用して、サイズスペクトルを次のようにモデル化する通常の最小二乗回帰を使用します。 
ここで、log10(a) は切片であり、b は線形サイズスペクトルモデルの傾きです。
結果
元のフィールド データを含む例示の結果は、ウェストバージニア州南部の小さな流れであるウェストバージニア州の Slaunch Fork に対して提示されます。追加のサイズスペクトルモデルの結果は、同じ地域の他の2つのストリームについても提示されます:キャンプクリークとキャビンクリーク、ウェストバージニア州。これらは、McGarveyとカーク17に含まれる3つの研究サイトで...
ディスカッション
この非課税サイズスペクトルプロトコルは、河川魚と無脊椎動物のコミュニティ内のサイズ構造を定量化およびモデル化するために使用できます。河川生態系における以前のサイズスペクトル研究は、基本的な記述的研究39、40から縦方向の河川プロファイル41に沿った比較、および異なる生物地理的領域42の間で...
開示事項
著者は何も開示していない。
謝辞
この研究のための資金は、国立科学財団(助成金DEB-1553111)と科学研究のためのエプリー財団によって提供されました。この原稿はVCUライスリバーズセンターの寄付#89です。
資料
| Name | Company | Catalog Number | Comments |
| Chest waders | Multiple options | n/a | Personal protective equipment for use during electrofishing. Do NOT use 'breatheable' waders as electrical current will pass through them. |
| Rubber lineman's gloves | Multiple options | n/a | Personal protective equipment for use during electrofishing. |
| Dip nets with fiberglass poles | Multiple options | n/a | Used to capture stunned fishes during electrofishing. |
| Backpack electrofishing unit | Smith-Root; Halltech; Midwest Lake Management; Aqua Shock Solutions | www.smith-root.com; www.halltechaquatic.com; https://midwestlake.com; https://aquashocksolutions.com/ | Backpack electrofishers are currently manufactured and distributed by four independent companies in North America. Prices and warranty/technical support are the most important factors in choosing a vendor. |
| Block nets/seines (×2) | Duluth Nets | https://duluthfishnets.com/ | Necessary length will depend on stream width. 3/8 inch mesh is recommended. |
| Cam-action utility straps with 1 inch nylon webbing (×4) | Multiple options | n/a | Used to secure/anchor block nets. Available at auto supply, hardware, and department stores. |
| Large tent stakes (×4) | Multiple options | n/a | Used to secure/anchor block nets. Available at camping and department stores. |
| 5 gallon plastic buckets (×5) | Multiple options | n/a | Used to hold and transport fish during electrofishing. Available at hardware and paint supply stores. |
| 10-20 gallon totes (×3) | Multiple options | n/a | Used as livewells, sedation tanks, and recovery bins for captured fishes. Available at hardware and department stores. |
| Battery powered 'bait bucket' aeration pumps | Cabelas | IK-019008 | Used to aerate fish holding bins during field processing. |
| Fish anesthesia (Tricaine-S) | Syndel | www.syndel.com | Used to sedate fishes for field processing. Tricaine-S is regulated by the U.S. Food and Drug Administration. |
| Folding camp table and chairs | Cabelas | IK-518976; IK-552777 | Used to process fish samples. |
| Pop-up canopy | Multiple options | n/a | Used as necessary for sun and rain protection. |
| Fish measuring board | Wildco | 3-118-E40 | Used to measure fish lengths. |
| Battery powered field scale with weighing dish | Multiple options | n/a | Used to weigh fishes. Must weigh be accurate to 0.1 or 0.01 grams. |
| Clear plastic wind/rain baffle | Multiple options | n/a | Used to shield scale in rainy or windy conditions. Must be large enough to cover the scale and a weighing dish. |
| White plastic or enamel examination trays | Multiple options | n/a | Trays are essential for examining fishes in the field. |
| Stainless steel forceps | Multiple options | n/a | Forceps are helpful when examining small fishes and in transfering invertebrates to specimen jars. |
| Hand magnifiers | Multiple options | n/a | Magnification is often helpful when identifying fish specimens in the field. |
| Fish identification keys | n/a | n/a | Laminated keys that are custom prepared for specific locations are most effective. |
| Datasheets printed on waterproof paper | Rite in the Rain | n/a | Waterproof paper is essential when working with aquatic specimens. |
| Retractable fiberglass field tapes | Lufkin | n/a | Used to measure stream channel dimensions. |
| Surber sampler or Hess sampler | Wildco | 3-12-D56; 3-16-C52 | Either of these fixed-area benthic samplers will work well in shallow streams with gravel or pebble substrate. |
| 70% ethanol or isopropyl alcohol | Multiple options | n/a | Used as invertebrate preservative. |
| Widemouth invertebrate specimen jars (20-32 oz.) | U.S. Plastic Corp. | 67712 | Any widemouth plastic jars will work but these particular jars are durable and inexpensive. |
参考文献
- Peters, R. H. . The ecological implications of body size. , (1983).
- Brown, J. H., Gillooly, J. F., Allen, A. P., Savage, V. M., West, G. B. Toward a metabolic theory of ecology. Ecology. 85 (7), 1771-1789 (2004).
- Marquet, P. A., et al. Scaling and power-laws in ecological systems. Journal of Experimental Biology. 208 (9), 1749-1769 (2005).
- Bohlin, T., Dellefors, C., Faremo, U., Johlander, A. The energetic equivalence hypothesis and the relation between population-density and body-size in stream-living salmonids. The American Naturalist. 143 (3), 478-493 (1994).
- Dunham, J. B., Vinyard, G. L. Relationships between body mass, population density, and the self-thinning rule in stream-living salmonids. Canadian Journal of Fisheries and Aquatic Sciences. 54 (5), 1025-1030 (1997).
- Jennings, S., Blanchard, J. L. Fish abundance with no fishing: predictions based on macroecological theory. Journal of Animal Ecology. 73 (4), 632-642 (2004).
- Petchey, O. L., Belgrano, A. Body-size distributions and size-spectra: universal indicators of ecological status?. Biology Letters. 6 (4), 434-437 (2010).
- Woodward, G., et al. Body size in ecological networks. Trends in Ecology and Evolution. 20 (7), 402-409 (2005).
- Trebilco, R., Baum, J. K., Salomon, A. K., Dulvy, N. K. Ecosystem ecology: size-based constraints on the pyramids of life. Trends in Ecology and Evolution. 28 (7), 423-431 (2013).
- White, E. P., Ernest, S. K. M., Kerkhoff, A. J., Enquist, B. J. Relationships between body size and abundance in ecology. Trends in Ecology and Evolution. 22 (6), 323-330 (2007).
- Schmid, P. E., Tokeshi, M., Schmid-Araya, J. M. Relation between population density and body size in stream communities. Science. 289 (5484), 1557-1560 (2000).
- Morin, A., Nadon, D. Size distribution of epilithic lotic invertebrates and implications for community metabolism. Journal of the North American Benthological Society. 10 (3), 300-308 (1991).
- Mittelbach, G. G., Persson, L. The ontogeny of piscivory and its ecological consequences. Canadian Journal of Fisheries and Aquatic Sciences. 55 (6), 1454-1465 (1998).
- Woodward, G., Hildrew, A. G. Body-size determinants of niche overlap and intraguild predation within a complex food web. Journal of Animal Ecology. 71 (6), 1063-1074 (2002).
- Zippin, C. The removal method of population estimation. Journal of Wildlife Management. 22 (1), 82-90 (1958).
- Kerr, S. R., Dickie, L. M. . The biomass spectrum: a predator-prey theory of aquatic production. , (2001).
- McGarvey, D. J., Kirk, A. J. Seasonal comparison of community-level size-spectra in southern coalfield streams of West Virginia (USA). Hydrobiologia. 809 (1), 65-77 (2018).
- Reynolds, J. B., Kolz, A. L., Zale, A. V., Parrish, D. L., Sutton, T. M. Electrofishing. Fisheries techniques. 8, 305-361 (2012).
- Bowker, J., Trushenski, J. Fish drug questions answered by the FDA. Fisheries. 38 (12), 549-552 (2013).
- Topic Popovic, N., et al. Tricaine methane-sulfonate (MS-222) application in fish anaesthesia. Journal of Applied Ichthyology. 28 (4), 553-564 (2012).
- Trautman, M. B. . The fishes of Ohio. , (1981).
- Riley, S. C., Fausch, K. D. Underestimation of trout population size by maximum-likelihood removal estimates in small streams. North American Journal of Fisheries Management. 12 (4), 768-776 (1992).
- Merritt, R. W., Cummins, K. W., Resh, V. H., Batzer, D. P., Merritt, R. W., Cummins, K. W., Berg, M. B. Sampling aquatic insects: collection devices, statistical considerations, and rearing procedures. An introduction to the aquatic insects of North America. , 15-37 (2008).
- Hauer, F. R., Resh, V. H., Hauer, F. R., Lamberti, G. A. Macroinvertebrates. Methods in stream ecology. 1, 297-319 (2017).
- Thorp, J. H., Covich, A. P. . Ecology and classification of North American freshwater invertebrates. , (2010).
- Merritt, R. W., Cummins, K. W., Berg, M. B. . An introduction to the aquatic insects of North America. , (2008).
- Stewart, K. W., Stark, B. P. . Nymphs of North American stonefly genera (Plecoptera). , (2002).
- Wiggins, G. B. . Larvae of the North American caddisfly genera (Trichoptera). , (1998).
- Benke, A. C., Huryn, A. D., Smock, L. A., Wallace, J. B. Length-mass relationships for freshwater macroinvertebrates in North America with particular reference to the Southeastern United States. Journal of the North American Benthological Society. 18 (3), 308-343 (1999).
- Smock, L. A. Relationships between body size and biomass of aquatic insects. Freshwater Biology. 10 (4), 375-383 (1980).
- Waters, T. F. Secondary production in inland waters. Adv. Ecol. Res. 10, 91-164 (1977).
- Carle, F. L., Strub, M. R. New method for estimating population-size from removal data. Biometrics. 34 (4), 621-630 (1978).
- Ogle, D. H., Wheeler, P., Dinno, A. FSA: fisheries stock analysis. R package version 0.8.22.9000. , (2018).
- Lockwood, R. N., Schneider, J. C., Schneider, J. C. Stream fish population estimates by mark-and-recapture and depletion methods. Manual of fisheries survey methods II: with periodic updates. 7, (2000).
- Blanco, J. M., Echevarría, F., García, C. M. Dealing with size-spectra: some conceptual and mathematical problems. Scientia Marina. 58 (1-2), 17-29 (1994).
- White, E. P., Enquist, B. J., Green, J. L. On estimating the exponent of power-law frequency distributions. Ecology. 89 (4), 905-912 (2008).
- Vidondo, B., Prairie, Y. T., Blanco, J. M., Duarte, C. M. Some aspects of the analysis of size spectra in aquatic ecology. Limnology and Oceanography. 42 (1), 184-192 (1997).
- Sprules, W. G., Barth, L. E. Surfing the biomass size spectrum: some remarks on history, theory, and application. Canadian Journal of Fisheries and Aquatic Sciences. 73 (4), 477-495 (2016).
- Poff, N. L., et al. Size structure of the metazoan community in a Piedmont stream. Oecologia. 95 (2), 202-209 (1993).
- Ramsay, P. M., et al. A rapid method for estimating biomass size spectra of benthic metazoan communities. Canadian Journal of Fisheries and Aquatic Sciences. 54 (8), 1716-1724 (1997).
- Solimini, A. G., Benvenuti, A., D’Olimpio, R., Cicco, M. D., Carchini, G. Size structure of benthic invertebrate assemblages in a Mediterranean river. Journal of the North American Benthological Society. 20 (3), 421-431 (2001).
- Huryn, A. D., Benke, A. C., Hildrew, A., Raffaelli, D., Edmonds-Brown, R. Relationship between biomass turnover and body size for stream communities. Body size: the structure and function of aquatic ecosystems. 4, 55-76 (2007).
- Gaedke, U. The size distribution of plankton biomass in a large lake and its seasonal variability. Limnology and Oceanography. 37 (6), 1202-1220 (1992).
- Stead, T. K., Schmid-Araya, J. M., Schmid, P. E., Hildrew, A. G. The distribution of body size in a stream community: one system, many patterns. Journal of Animal Ecology. 74 (3), 475-487 (2005).
- Brose, U., et al. Consumer-resource body-size relationships in natural food webs. Ecology. 87 (10), 2411-2417 (2006).
- Mehner, T., et al. Empirical correspondence between trophic transfer efficiency in freshwater food webs and the slope of their size spectra. Ecology. 99 (6), 1463-1472 (2018).
- Daan, N., Gislason, H. G., Pope, J. C., Rice, J. Changes in the North Sea fish community: evidence of indirect effects of fishing?. ICES Journal of Marine Science. 62 (2), 177-188 (2005).
- Murry, B. A., Farrell, J. M. Resistance of the size structure of the fish community to ecological perturbations in a large river ecosystem. Freshwater Biology. 59 (1), 155-167 (2014).
- Broadway, K. J., Pyron, M., Gammon, J. R., Murry, B. A. Shift in a large river fish assemblage: body-size and trophic structure dynamics. PLoS ONE. 10 (4), e0124954 (2015).
- Vila-Martínez, N., Caiola, N., Ibáñez, C., Benejam, L., Brucet, S. Normalized abundance spectra of fish community reflect hydro-peaking on a Mediterranean large river. Ecological Indicators. 97, 280-289 (2019).
- Brucet, S., et al. Size-based interactions across trophic levels in food webs of shallow Mediterranean lakes. Freshwater Biology. 62 (11), 1819-1830 (2017).
- Ersoy, Z., et al. Size-based interactions and trophic transfer efficiency are modified by fish predation and cyanobacteria blooms in Lake Mývatn, Iceland. Freshwater Biology. 62 (11), 1942-1952 (2017).
- Arranz, I., Hsieh, C. H., Mehner, T., Brucet, S. Systematic deviations from linear size spectra of lake fish communities are correlated with predator–prey interactions and lake-use intensity. Oikos. 128 (1), 33-44 (2019).
- Jennings, S., et al. Long-term trends in the trophic structure of the North Sea fish community: evidence from stable-isotope analysis, size-spectra and community metrics. Marine Biology. 141 (6), 1085-1097 (2002).
- Guiet, J., Poggiale, J. C., Maury, O. Modelling the community size-spectrum: recent developments and new directions. Ecological Modelling. 337, 4-14 (2016).
- Robinson, J. P. W., et al. Fishing degrades size structure of coral reef fish communities. Global Change Biology. 23 (3), 1009-1022 (2017).
- Reuman, D. C., Mulder, C., Raffaelli, D., Cohen, J. E. Three allometric relations of population density to body mass: theoretical integration and empirical tests in 149 food webs. Ecology Letters. 11 (11), 1216-1228 (2008).
- Huryn, A. D., Wallace, J. B., Anderson, N. H., Merritt, R. W., Cummins, K. W., Berg, M. B. Habitat, life history, secondary production, and behavioral adaptations of aquatic insects. An introduction to the aquatic insects of. 5, 55-103 (2008).
- Werner, E. E., Gilliam, J. F. The ontogenetic niche and species interactions in size-structured populations. Annual Review of Ecology and Systematics. 15 (1), 393-425 (1984).
- Edwards, A. M., Robinson, J. P. W., Plank, M. J., Baum, J. K., Blanchard, J. L. Testing and recommending methods for fitting size spectra to data. Methods in Ecology and Evolution. 8 (1), 57-67 (2017).
- Roell, M., Orth, D. Production of three crayfish populations in the New River of West Virginia, USA. Hydrobiologia. 228 (3), 185-194 (1992).
- Hawkins, C. P., Murphy, M. L., Anderson, N. H., Wilzbach, M. A. Density of fish and salamanders in relation to riparian canopy and physical habitat in streams of the northwestern United States. Canadian Journal of Fisheries and Aquatic Sciences. 40 (8), 1173-1185 (1983).
- Rabeni, C. F., Collier, K. J., Parkyn, S. M., Hicks, B. J. Evaluating techniques for sampling stream crayfish (Paranephrops planifrons). New Zealand Journal of Marine and Freshwater Research. 31 (5), 693-700 (1997).
- DiStefano, R. J., Gale, C. M., Wagner, B. A., Zweifel, R. D. A sampling method to assess lotic crayfish communities. Journal of Crustacean Biology. 23 (3), 678-690 (2003).
- Price, J. E., Welch, S. M. Semi-quantitative methods for crayfish sampling: sex, size, and habitat bias. Journal of Crustacean Biology. 29 (2), 208-216 (2009).
- Sheldon, R. W., Sutcliffe, W. H., Paranjape, A. M. Structure of pelagic food chain and relationship between plankton and fish production. Journal of the Fisheries Research Board of Canada. 34 (12), 2344-2353 (1977).
- Andersen, K., et al. Asymptotic size determines species abundance in the marine size spectrum. The American Naturalist. 168 (1), 54-61 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved