Method Article
سريع للغاية ومحددة وضع العلامات الأيضية من الحمض النووي الريبي في فيفو مع 4-ثيوراسيل (Ers4tU)
In This Article
Summary
استخدام uracil ثيولاتيل لحساسة وعلى وجه التحديد تنقية الحمض النووي الريبي المنقولة حديثا من الخميرة Saccharomyces سيريفيسياي.
Abstract
التماثلية النيوكليوتيدات، 4-الثيوراسيل (4tU)، يتم تناولها بسهولة من قبل الخلايا ودمجها في الحمض النووي الريبي كما يتم تدوينها في الجسم الحي، مما يسمح العزلة من الحمض النووي الريبي المنتجة خلال فترة وجيزة من وضع العلامات. ويتم ذلك عن طريق إرفاق moiety البيوتين إلى مجموعة ثيو المدرجة وتنقية التقارب، وذلك باستخدام الخرز المغلفة streptavidin. تحقيق عائد جيد من الحمض النووي الريبي النقي، توليفها حديثا التي هي خالية من الحمض النووي الريبي الموجودة من قبل يجعل أقصر أوقات وضع العلامات ممكن ويسمح زيادة الدقة الزمنية في الدراسات الحركية. هذا هو بروتوكول لتنقية محددة جدا، وارتفاع العائد من RNA توليفها حديثا. يصف البروتوكول المعروض هنا كيف يتم استخراج الحمض النووي الريبي من الخميرة Saccharomyces سيريفيسياي. ومع ذلك، يجب أن يكون بروتوكول تنقية الحمض النووي الريبي الثيولاتي من إجمالي الحمض النووي الريبي فعالاً باستخدام الحمض النووي الريبي من أي كائن حي بمجرد استخراجه من الخلايا. الحمض النووي الريبي النقي هو مناسبة للتحليل من قبل العديد من التقنيات المستخدمة على نطاق واسع، مثل النسخ العكسي-qPCR، RNA-seq وSLAM-seq. خصوصية وحساسية ومرونة هذه التقنية تسمح رؤى لا مثيل لها في استقلاب الحمض النووي الريبي.
Introduction
الحمض النووي الريبي له طبيعة ديناميكية; قريبا بعد هو أنتجت كثير [رنا] سريعا عالجت ويحطّم. حاليا، معظم الدراسات من التمثيل الغذائي الحمض النووي الريبي تحليل الحمض النووي الريبي الخلوية الإجمالية، والتي تتم معالجتها في الغالب بشكل كامل وعلى مستوى الدولة ثابت. ويعتمد هذا المستوى على التوازن بين معدلات النسخ والنضج والتدهور بعد النسخ. يتطلب تحليل العمليات التي تؤدي إلى توازن الدولة الثابت تقنيات متخصصة لالتقاط أنواع الحمض النووي الريبي قصيرة العمر.
إن وضع العلامات الأيضية للرنا مع نظائرها النيوكليوتيدات مثل 4-ثيوراسيل (4tU) أو 4-ثيويريدين (4sU) (انظر Duffy et al.1 للحصول على مراجعة ممتازة)، يوفر القدرة على عزل RNAs الوليدة التي تحمل علامات ثيو ووسيطات تجهيزها. ومع ذلك، تتضمن البروتوكولات المنشورة أوقات وضع العلامات من عدة دقائق2،3، وهو بطيء بالنسبة لمعدل إنتاج العديد من النصوص. يستغرق الأمر في ترتيب دقيقة واحدة لتدوين جين الخميرة المتوسط، لذلك وضع العلامات الخميرة RNA لأقل من دقيقة واحدة يمكن اعتبارقصيرة للغاية. بروتوكول 4 ثيراسيل سريعة للغاية ومحددة (ers4tU) يزيد من نسبة الإشارة إلى الضوضاء عن طريق تعظيم التأسيس 4tU والتقليل من استرداد RNA غير المسمى، الموجودة من قبل مما يجعل أوقات وضع العلامات قصيرة جدا ممكن4.
يجب استيراد قاعدة ثيو المعدلة في الخلايا بسرعة وبكميات كافية لتسمية بكفاءة RNA توليفها حديثا (nsRNA). ولتعزيز ذلك، تزرع الخلايا في وسط خال ٍ من الأوراسيل، كما أن التعبير عن التميّز المناسب يساعد على زيادة التناول بـ 4tU أو 4sU (انظر الجدول 1 للاطلاع على قائمة ببلازميدات تحمل جينات بيرميس مناسبة والشكل التكميلي1). الذوبان 4tU في هيدروكسيد الصوديوم يتجنب الحاجة إلى المذيبات العضوية السامة المطلوبة من قبل نظائرها النيوكليوتيدات الأخرى. لسوء الحظ، لوحظ أن الثقافات المتنامية لفترات طويلة مع النيوكليوسيدات المعدلة ثيوفي تركيزات أكبر من 50 درجة مئوية لتعطيل ريبوسوسوم5 . ومع ذلك، فإن التركيز (10 درجة مئوية) المستخدمة هنا، وأوقات وضع العلامات القصيرة للغاية، تقلل من الآثار الضارة5 (الشكل1أ)،في حين لا تزال تسفر عن الحمض النووي الريبي الكافي للتحليل.
ويمكن الجمع بين هذه التقنية مع استنفاد سريع ومحدد بوساطة أوكسين من البروتين المستهدف6،7 ( الشكل2) ، ويشار إليه باسم بروتوكول "β-est AID 4U" ، الذي ينظم فيه بيتا استراديول التعبير عن أوكسين يتم الجمع بين نظام degron اللاتبر (AID) مع وضع العلامات 4tU. مع نهج بيتا-إست AID 4U، يمكن استنفاد البروتين المستهدف والتأثير علىاستقلاب الحمض النووي الريبي رصدها عن كثب (الشكل 2). والتوقيت حاسم؛ من المستحسن عرض الفيديو المصاحب وإيلاء اهتمام وثيق للشكل 2 وشكله المتحرك (انظر الشكل التكميلي2).
يجب إيقاف معالجة وتدهور الحمض النووي الريبي بسرعة فائقة من أجل دقة دقة الوقت. ويتحقق ذلك باستخدام الميثانول في درجة حرارة منخفضة، والذي يصلح محتويات الخلية بسرعة كبيرةويحط من غشاء الخلية مع الحفاظ على محتوى الحمض النووي 8. يجب أن يكون استخراج الحمض النووي الريبي فعالة وليس تلف الحمض النووي الريبي. اللثي الميكانيكي فعال في غياب وكلاء تشاوتروبيك (غالبا ما تحتوي هذه على مجموعات ثيو، لذلك ينبغي تجنبها). ويفضل هطول الأمطار كلوريد الليثيوم من الحمض النووي الريبي، كما يتم تسريع tRNAs أقل كفاءة. يتم نسخ tRNAs بسرعة وثيولاتيد بشكل طبيعي9،لذلك إزالة tRNAs يقلل من المنافسة على الكاشف biotinylation. إذا كانت RNAs الصغيرة والمنظمة للغاية ذات أهمية، يوصى بأساليب هطول الأمطار الحمض النووي الريبي المستندة إلى الكحول.
لاستعادة الحمض النووي الريبي الثيولاتي، يتم إرفاق البيوتين بشكل مشترك عن طريق مجموعات ثيو المدمجة في الحمض النووي الريبي مع 4tU. ويوصى باستخدام البيوتين المعدل، الذي يعلق عن طريق رابطة ثنائي كبريتيد قابلة للتصلب (على سبيل المثال، HPDP-البيوتين (N-6-(Biotinamido)hexyl]-3€ -(2€pyridyldithio)propionamide، أو MTS-البيوتين (ميثان ثيوسولفونات)) بما أنّ هو يسمح إطلاق من ال [رنا] بإضافة من يقلّل عاملة. الحمض النووي الريبي biotinylated هو تقارب تنقية على streptavidin إلى جانب الخرز المغناطيسي. هذا البروتوكول مشابه للجهات الأخرى المذكورة سابقاً10 ولكن تم تحسين بشكل مكثف لتقليل الخلفية.
وهناك نوعان من تجارب وضع العلامات على الثيول يمكن القيام بها، وهما وضع العلامات المستمر والمستمر. ولكل منها مزاياها الخاصة. في وضع العلامات المستمرة يتم إضافة 4tU إلى الثقافة والعينات التي تؤخذ على فترات منتظمة. يوضح هذا النوع من التجارب كيفية معالجة الحمض النووي الريبي وكيفية تغير المستويات مع مرور الوقت. ومن الأمثلة على ذلك مقارنة المتحولين بتجارب من النوع البري وتجربة مطاردة النبض. والتجارب المبينة في الشكل 3ب(ج) من هذا النوع. ل [سمّينغ] مستمرّة يحثّ تغير داخل النظامة وال [رنا] يراقب. وبمجرد أن يتم إدخال التغيير يجب تقسيم الثقافة إلى عدة ثقافات فرعية، وفي أوقات محددة، يتم وضع علامة على كل منها لفترة قصيرة. ومن الأمثلة على ذلك برنامج المساعدة 4U الذي يظهر في الشكل 27. هذا النوع من التجارب مفيد بشكل خاص لرصد تأثير التغيير الأيضي على معالجة الحمض النووي الريبي (انظر الشكل 3d).
وترد في الشكل 4 والشكل 5تمثيل بياني لتجربة وضع العلامات على الثيو، كما يتوفر جدول بيانات يبسط إلى حد كبير أداء البروتوكول (انظر قالب التجربة 4tU.xlsx). بالإضافة إلى هذا يحتوي "المعلومات التكميلية" على دليل استكشاف الأخطاء وإصلاحها واسعة النطاق. وللاطلاع على بروتوكول المعونة 4U الذي يدمج وضع العلامات على وحدة التخزين 4 tU مع بروتوكول استنفاد الأوكسين، انظر الشكل 2 والشكل التكميلي2. انظر Barrass et al.7 للاطلاع على البروتوكول المفصل لاستنفاد المعونة.
Protocol
1- النمو ووضع العلامات على الثيو
ملاحظة: الوقت لإكمال هذا المقطع من البروتوكول متغير للغاية استناداً إلى معدل نمو الخلية. السماح بساعة واحدة لإعداد الحلول والمعدات قبل وضع العلامات على الثيو و30 دقيقة بعد وضع العلامات لمعالجة العينات.
- تأكد من سلالة S. cerevisiae يحتوي علىترميز بلازميد permease (الجدول 1) لتعزيز استيراد 4tU في الخلية.
ملاحظة: بدون مستورد، من غير المرجح أن يكون وضع العلامات لمدة أقل من دقيقتين ناجحاًفي 11 (انظر الشكل التكميلي1). 4tU التأسيس هو أكثر كفاءة إذا كان النمو في المتوسط دون uracil، لذلك يجب أن يكون الضغط URA3+؛ العديد من البلازميدات في الجدول 1 تحمل URA3 كعلامة. إذا كان هذا البروتوكول أن يقترن مع استنفاد بيتا-است AID7، مطلوب تعديلات سلالة إضافية. - إعداد YMM uracil خالية من المتوسطة عن طريق إضافة 6.9 غرام من قاعدة النيتروجين الخميرة دون الأحماض الأمينية،20 غرام من الجلوكوز، و 1.92 غرام من SCSM واحد التسرب -ura (جدول المواد) إلى 1 لتر من الماء. الأوتوكلاف أو مرشح تعقيم متوسط النمو قبل الاستخدام.
ملاحظة: يفضل تعقيم الفلتر كمجمعات ببتيد/سكر تنتجها الأوتوكلاف تترس بالخلايا في الميثانول المستخدم في جمع العينات. - تنمو الخميرة في YMM uracil خالية من المتوسطة إلى كثافة بصرية في 600 نانومتر (OD600)من 0.6−0.8. ضمان الثقافة في مرحلة تسجيل النمو وكان لمدة سنتين على الأقل مضاعفة. ويوصى عادة بالنمو عند درجة حرارة 30 درجة مئوية، ولكن يمكن استخدام درجات حرارة أخرى، على سبيل المثال، للسلالات الحساسة لدرجة الحرارة.
ملاحظة: اعتماداً على سلالة، وظروف النمو وعائد الحمض النووي الريبي، سوف تكون هناك حاجة إلى حجم عينة 30 مل تقريباً. وسيتم افتراض هذا المبلغ في جميع أنحاء البروتوكول. 30 مل من الثقافة هو الأكثر التي سوف تناسب في أنبوب الطرد المركزي 50 مل مع 20 مل من الميثانول، لذلك هو حجم مناسب لبدء التحسين. النظر في استخدام حجم العينة أكثر لنقاط الوقت المبكر لزيادة استرداد الحمض النووي الريبي، وقد استخدمت ما يصل إلى 2000 مل لخلايا أبطأ نموا في أوقات وضع العلامات قصيرة حقا (<1 دقيقة). - البرد حوالي 50 مل من H2O على الجليد. لكل عينة، إضافة 200 درجة مئوية من الخرز الزركونيا إلى أنبوب المسمار كاب 2 مل والبرد على الجليد. أيضا وضع 20 مل من الميثانول (الحذر)، في أنابيب الطرد المركزي 50 مل، ووضعها على الجليد الجاف (الحذر). يجب أن يكون الميثانول 1/3 إلى 2/3 حجم العينة.
تحذير: الميثانول سام عن طريق الاستنشاق والاتصال والاستهلاك. الاستغناء عن كميات كبيرة في غطاء محرك السيارة الدخان، وارتداء اثنين من أزواج من القفازات، كما الميثانول يمكن أن تخترق قفازات مختبر النتريل. الميثانول قابل للاشتعال للغاية، والابتعاد عن جميع مصادر الاشتعال.
ملاحظة: كما الجليد الجاف يمكن أن يسبب حروق باردة على الاتصال وتنتج غاز asphixiant، واستخدام القفازات عند المناولة والاستخدام في مساحة جيدة التهوية.
ملاحظة: إضافة الخرز في هذه المرحلة هو أسهل من بعد أن تم إضافة العينة كما أنبوب جاف وعندما الغزل أسفل بيليه الخلية يتم نسج الخرز أيضا واضحة من موضوع أنبوب توفير بعض الوقت. بالإضافة إلى ذلك، وهذا يسمح للحبات لتبرد قبل إضافة العينة. - إذا كان ارتفاع S. pombe هو أن تضاف إلى الثقافة (وليس في وقت لاحق)، إذابة aliquot من خلايا بومبي S. ثيوالت على الجليد ودوامة تماما، على الأقل 30 ثانية، ثم إضافة إلى الثقافة. إذا أعدت وفقا للتعليمات أدناه، واحد S. pombe aliquot يكفي ل400 مل من الثقافة (ما يكفي لاثني عشر 30 مل عينات بالإضافة إلى القليل للسماح للأخطاء في التعامل). إذا تم استخدام ثقافة أكثر أو أقل، ضبط حجم S. pombe إضافة إلى الثقافة.
- تنمو 1 لتر من ثقافة S. pombe إلى OD600 إلى 0.8 تماما كما هو موضح في بروتوكول S. cerevisiae.
- ثيو التسمية كما الخطوة 1.7، ولكن لمدة 10 دقيقة.
- إصلاح كل من الثقافة باستخدام 400 مل من الميثانول على الجليد الجاف، أساسا كما هو موضح في الخطوة 1.9.
- بيليه الخلايا عن طريق الطرد المركزي في 3000 × ز لمدة 3 دقائق.
- تجاهل supernatant وإعادة تعليق بيليه الخلية في 3.3 مل من H2O.
- ينقسم إلى aliquots من 80 ميكرولتر لكل منهما. تخزين في -80 درجة مئوية.
- استخدام كل من aliquot واحد لثقافة 400 مل أو 10 ميكرولتر لكل عينة 30 مل.
ملاحظة: تقليل حجم الارتفاع إلى 1/10 إذا كان تنفيذ RNAseq. لا تقم بإعادة استخدام aliquots; تجاهل أي ارتفاع غير المستخدمة. هذا الارتفاع مفيد لتطبيع ومقارنة النتائج عبر نقاط الوقت والتجارب.
- وبالنسبة لوضع العلامات غير المستمرة، فإن الحث على الاضطراب الأيضي المطلوب (مثل ظروف النمو، أو الحث الجيني أو الاستنفاد مثل بيتا-إيست AID7 (الشكل 2 والشكل التكميلي2)، ثم تقسيم الثقافة. تأكد من أن جميع القوارير ووسائل الإعلام في درجة الحرارة المطلوبة، وإذا كان ذلك ممكنا، وerate المتوسطة قبل إضافة الثقافة.
- إضافة 4tU إلى الثقافة إلى تركيز 10 درجة مئويةومزيج بقوة (1 /10،000 من حجم الثقافة من 100 م م 4tU حل في 1 M هيدروكسيد الصوديوم). ثيول التسمية لمدة 15 s إلى 5 دقيقة.
ملاحظة: ثلاثين ثانية نقطة بداية جيدة. ثيو وضع العلامات لأقل من 20 s يعطي نتائج أكثر متغير ة بسبب صعوبات التلاعب بالثقافة تحت ضغط الوقت. ومع ذلك، وضع العلامات لأكثر من دقيقة واحدة يقلل من الدقة الزمنية للتقنية. - إذا كان لا بد من إجراء تجربة مطاردة؛ السماح بوسم ثيو لمدة 20-30 ق ثم مطاردة عن طريق إضافة 1/200 حجم الثقافة من 1 M uridine (وليس ثيولاتيد)، إلى تركيز نهائي من 5 mM.
ملاحظة: Uridine هو أفضل لuracil لمطاردة، كما uridine هو أكثر قابلة للذوبان في الماء مما يسمح لكمية أصغر أن تضاف إلى الثقافة، وبالتالي هناك اضطراب أقل لنمو الخلايا. - أخذ عينات من الثقافة على فترات منتظمة (على الأقل 15 ق)، إلى نهاية الدورة الزمنية. ومن الصعب إجراء فترات أخذ العينات أقصر من ذلك بشكل موثوق. إضافة العينة إلى الميثانول على الجليد الجاف أعدت في الخطوة 1.4. للراحة، إضافة 30 مل من الثقافة إلى أنبوب 50 مل تحتوي على 20 مل من الميثانول.
ملاحظة: يذوب ثاني أكسيد الكربون في الميثانول عند البرد. هذا يأتي من الحل على إضافة العينة والرغاوي بقوة على خلط، مما أدى إلى فقدان العينة. لتجنب ذلك، قم بتبريد الميثانول إلى <-70 درجة مئوية في أنبوب مغلق بإحكام حتى قريب من الوقت المطلوب، ثم نقل إلى الجليد الجاف. - ختم الأنبوب ومزيج جيدا عن طريق الهز. ضع العينات على الثلج تحقق من أن أيا من العينات قد جمدت؛ إذا كان الأمر كذلك ، دافئة بلطف في اليد ، وعكس باستمرار. ويتم ذلك على أفضل وجه في اليد كما يمكن تقييم درجة حرارة العينة، فإنه ينبغي أن يشعر دائما الباردة. ضعها على الجليد. وهذه ليست نقطة توقف مؤقت؛ بل هي نقطة توقف مؤقت. مرة واحدة كل عينة هو السائل المضي قدما إلى الخطوة التالية.
- تدور في 3000 × ز لمدة 2 دقيقة (في 4 درجة مئوية إذا كان ذلك ممكنا) لبيليه الخلايا. صب قبالة السائل وإعادة تعليق بيليه في ما لا يقل عن 1 مل من الماء المثلج عن طريق الأنابيب بلطف صعودا وهبوطا.
ملاحظة: الميثانول المتبقية في عينة بيليه يساعد على إعادة تعليق. - نقل إلى 2 مل أنابيب غطاء المسمار كما أعدت في الخطوة 1.4. تدور لفترة وجيزة (على سبيل المثال، 10 ق الوقت الإجمالي) في > 13،000 × ز لإعادة بيليه الخلايا، ووضع مرة أخرى على الجليد وإزالة السائل.
ملاحظة: يمكن تخزين بيليه الخلية في -70 إلى -80 درجة مئوية لعدة أشهر.
2. إعداد الجيش الملكي النيبالي الكلي
ملاحظة: وقت الإكمال هو 90 دقيقة.
- استخدم الحلول المعالجة بثنائي إيثيل البيروكربونات (DEPC) لحماية الحمض النووي الريبي من التدهور. Aliquot الحلول باستخدام نصائح ماصة فلتر وارتداء القفازات في جميع الأوقات.
- إلى حل إضافة 1/1000 حجم DEPC ومزيج من هز قوي.
- يترك في درجة حرارة الغرفة (RT) لمدة 24 ساعة، ثم الأوتوكلاف.
- لا يمكن معالجة الحلول مع مجموعات الأمين (مثل tris). Aliquot مسحوق وتخزينها خصيصا لعمل الحمض النووي الريبي. استخدام DEPC المعالجة سابقا H2O لجعل الحل.
ملاحظة: كما ثيو المجموعة على الحمض النووي الريبي هو photoactivatable، تقليل التعرض للأشعة فوق البنفسجية من هذه النقطة على. يجب أن يكون التخزين في الظلام ويتم الحضانة على أفضل وجه في آلة PCR مع غطاء.
- إذا كان ارتفاع S. pombe هو أن تضاف إلى بيليه الخلية بدلا من الثقافة (لا تفعل على حد سواء)، إضافته الآن. إذابة aliquot من خلايا s. pombe ثيولاتيد على الجليد ودوامة تماما، على الأقل 30 ث، قبل إضافة إلى بيليه.
ملاحظة: إذا أُعدت وفقاً للخطوات 1-5-1-1-5-7، يلزم توفير 10 ميكرولتر من S. pombe aliquot لبيليه واحد مشتق من 30 مل من الثقافة. - قبل وضع الغطاء، تدور لفترة وجيزة جدا لمدة 1-2 s لضمان عدم وجود حبات زركونيا محاصرين بين الغطاء والأنبوب، والتي يمكن أن تسبب عينة والفينول للتسرب من الأنبوب.
- إعادة تعليق الخلايا في 400 درجة مئوية من خلات EDTA (AE) العازلة (50 مل خلات الصوديوم درجة الحموضة 5.3، 10 MM EDTA درجة الحموضة 8.0)، عن طريق دوامة بقوة. إضافة 40 درجة مئوية من 10٪ (ث / الخامس) كبريتات دودسيل الصوديوم (SDS). لا دوامة، كما SDS سوف رغوة.
- إذا كان بروتوكول بيتا-إست AID 4U لاستخدامها، واتخاذ 40 درجة مئوية من تعليق الخلية لتحليل البروتين7. إضافة 40 درجة مئوية من AE لجعل وحدة التخزين احتياطية تصل إلى 400 درجة مئوية.
- إضافة 800 درجة مئوية من الفينول (الحذر) في درجة الحموضة المنخفضة ودوامة لمدة 10 ثانية.
تحذير: الفينول سام وتآكل عن طريق الاستنشاق والاتصال. دائما تنفيذ الإجراءات التي تنطوي على الفينول في غطاء محرك السيارة الدخان وارتداء اثنين من أزواج من القفازات. - Lyse الخلايا في المجانسة (على سبيل المثال، جدولالمواد) لمدة ثلاثة رشقات نارية 2 دقيقة في أدنى إعداد الطاقة. ترك العينات على الجليد لمدة 2 دقيقة بين نبضات التجانس.
ملاحظة: تحسين الظروف في حالة استخدام المجانسة الأخرى. وسيؤدي عدم كفاية الهز إلى ضعف الغلة، في حين أن الهز المفرط يؤدي إلى ارتفاع واضح في الغلة، كما هو محدد من خلال الامتصاص عند 260 نانومتر (A260)،ولكن قد تتدهور الحمض النووي الريبي. ويفضل المجانسة، ولكن الساخنة الفينول RNA تنقية12 يمكن استخدامها. - ضع العينة على الثلج الجاف لمدة 5 دقائق، حتى تترسخ، وهذا يقلل من الحمض النووي الجينومي ترحيلها إلى الحمض النووي الريبي. لا تجمد لفترة طويلة جدا كما أن العينة لن تذوب. تدور 5 دقائق في ميكروفوج في > 13،000 × ز في RT؛ لا تغري للقيام بذلك في 4 درجة مئوية، كما أن مزيج عينة / الفينول سوف تبقى صلبة في جميع أنحاء تدور إذا أجريت في درجة حرارة منخفضة.
ملاحظة: إذا كانت العينة لا تزال مجمدة في نهاية الدوران، إعادة تدور لمدة 5 دقائق أخرى حتى إذابة العينة تماما. - استخراج الفينول / الكلوروفورم ثم استخراج الكلوروفورم مع حجم متساو (حوالي 600 درجة مئوية) من الفينول: الكلوروفورم 5: 1 ثم الكلوروفورم (تحذير). نقل المرحلة العليا إلى أنبوب آخر يحتوي على الفينول: الكلوروفورم 5:1 أو الكلوروفورم. دوامة، ثم تدور لمدة 5 دقائق في ميكروفوج في RT. ثم نقل المرحلة العليا إلى أنبوب جديد 1.5 مل.
تحذير: الكلوروفورم سام عن طريق الاستنشاق والاتصال. دائما تنفيذ الإجراءات التي تنطوي على الكلوروفورم في غطاء محرك السيارة الدخان وارتداء زوجين من القفازات. - إضافة حجم ثالث إلى نصف (حوالي 300 درجة مئوية) من 10 مل، ومزيج لتعجيل الحمض النووي الريبي. يجب أن تذهب العينة غائمة على الفور ولكن ترك لمدة 10 دقيقة على الأقل على الجليد أو في 4 درجة مئوية (لا تخزن أدناه -20 درجة مئوية كما أنها سوف تجمد)، أو حتى flocculates عجل.
- تدور لمدة 5 دقائق في > 13،000 × ز في ميكروفوج. إزالة السائل، لفترة وجيزة إعادة تدور وإزالة dregs. اغسل بيليه بـ 300-500 لتر من الإيثانول بنسبة 70%، والدوران لفترة وجيزة وإزالة الإيثانول المتبقي.
ملاحظة: خلال هذه الإذاهي ة إبقاء بيليه على نفس الجانب من الأنبوب كما تدور الأولى، وبهذه الطريقة بيليه لن تتحرك وكسر؛ إن هو يكسر بعض من ال [رنا] استطاع كنت خسرت بحادث.
ملاحظة: لا تجف بيليه; طالما تمت إزالة معظم السائل فإنه لن تتداخل مع الخطوات اللاحقة. ويمكن أيضا تخزين الحمض النووي الريبي في هذه المرحلة عند -20 درجة مئوية لبضعة أشهر أو -70 إلى -80 درجة مئوية للتخزين على المدى الطويل. - إعادة حل بيليه RNA في 90 درجة مئوية من TE درجة الحموضة 7.0 (10 M تريس حمض الهيدروكلوريك درجة الحموضة 7.0، 1 MM EDTA درجة الحموضة 8.0) عن طريق التدفئة في 65 درجة مئوية مع الهز كما بيليه RNA يمكن أن يكون من الصعب إعادة حل. يجب أن يكون هذا لمدة لا تزيد عن 5 دقائق كما يحط من الحمض النووي الريبي في درجات حرارة أعلى. تحقق من ذوبان الحمض النووي الريبي الكامل ومن ثم نقل إلى أنبوب 0.2 مل. ماصة العينة صعودا وهبوطا؛ يجب أن يكون هناك أي "كتل"، والسائل يجب أن ترتفع وتسقط بسلاسة في الطرف. هذا الحل لزج لذلك يجب أن تكون الحركة الأنابيب النهائية بطيئة.
ملاحظة: يمكن تخزين الحمض النووي الريبي عند -20 درجة مئوية في الظلام في هذه المرحلة; وهذا يمكن أن يكون مفيدا أيضا للذوبان RNA.
3. Biotinylation
ملاحظة: وقت الإكمال هو 60 دقيقة. يتم إجراء الخطوات التالية بشكل مريح في شريط من الأنابيب مع قبعات متكاملة كما لديهم ميل أقل لفتح على دوامة من شرائط مع قبعات منفصلة.
- Biotinylate عن طريق إضافة10 ميكرول (1 /10 حجم النهائي) من 5 mM HPDP-البيوتين الحل (MTS-البيوتين يمكن استخدامها بنفس الطريقة تماما كما HPDP-البيوتين)، إلى الحمض النووي الريبي ومزيج تماما. سخن الحمض النووي الريبي لمدة لا تزيد عن بضع ثوان عند 65 درجة مئوية قبل إضافة البيوتين. الحضانة في 65 درجة مئوية لمدة 15 دقيقة إلى حد أقصى من 30 دقيقة في الظلام.
ملاحظة: مطلوب هذا التدفئة كما يعجل بعض دفعات HPDP في RT في عينة RNA. كتلة PCR مع غطاء ساخن مثالية لهذا. - إعداد حجم الراتنج الصغيرة، حجمعمود استبعاد (جدول المواد) لاستبعاد البيوتين غير المدمجة. إزالة العلامة السفلية للعمود وتخفيف الغطاء، ووضعها في أنبوب الطرد المركزي 2 مل. تدور في 1500 × ز لمدة 1 دقيقة لطرد المخزن المؤقت إضافة 0.3 مل من TE بلطف إلى الجزء العلوي من العمود وتدور مرة أخرى. كرر الغسيل وتدور مرتين أكثر لما مجموعه 3 يغسل. وأخيرا نقل العمود غسلها إلى أنبوب 1.5 مل جديدة.
- بمجرد اكتمال الحضانة العينة (الخطوة 3.1) إضافة العينة إلى أعلى العمود. تدور في 1500 × ز لمدة 2 دقيقة. عينة الحمض النووي الريبي biotinylated الآن في الجزء السفلي من الأنبوب.
ملاحظة: تدور دقيقة واحدة غير كافية لelute العينة بأكملها. - إضافة حجم ثالث إلى نصف (حوالي 40 درجة مئوية) من 10 مل، مزيج لإعادة عجل الحمض النووي الريبي كخطوة 2.10. يجب أن تذهب العينة غائمة على الفور ولكن تترك لمدة 5 دقائق على الأقل على الجليد أو في 4 درجة مئوية أو حتى flocculates عجل. لا تخزن تحت -20 درجة مئوية كما أنها سوف تجمد. الطرد المركزي العينة لمدة 5 دقائق في > 13،000 × ز في ميكروفوج.
- غسل مع الإيثانول 80٪، ≤ 1 ح الدورية. اتبع الإجراء في الخطوة 2.11 لإزالة أكبر قدر ممكن من السائل.
ملاحظة: بما أن HPDP-biotin قابل للذوبان في الإيثانول بنسبة 80%، فإن هذه خطوة تنقية إضافية. - كرر غسول الإيثانول بنسبة 80% لإزالة أكبر قدر ممكن من البيوتين غير المدمج.
ملاحظة: يمكن أيضا تخزين الحمض النووي الريبي في هذه المرحلة عند -20 درجة مئوية في الظلام.
4. تنقية الحمض النووي الريبي توليفها حديثا
ملاحظة: وقت الإكمال هو 2 ساعة.
- إعادة حل الحمض النووي الريبي في 200 درجة مئوية من DEPC المعالجة H2O (65 درجة مئوية الحضانة يمكن استخدامها، على غرار الإجراء في الخطوة 2.12).
- قياس تركيز الحمض النووي الريبي في A260 باستخدام مقياس الطيف الضوئي؛ قد يكون من الضروري تخفيف العينة 1/10 للحصول عليه ضمن النطاق الخطي للمقياس الطيفي. دوامة هذا التخفيف لمدة 10 s على الأقل لضمان حل الحمض النووي اللزج بالتساوي.
ملاحظة: يمكن تقييم كفاءة biotinylation بواسطة نقطة وصمة عار13 إذا لزم الأمر. - إضافة كميات متساوية من الحمض النووي الريبي إلى أنبوب جديد وجعل ما يصل إلى 200 درجة مئوية في DEPC المعالجة H2O. استخدام كل من العينة مع أدنى تركيز الحمض النووي الريبي واستخدام حجم مناسب من العينات الأخرى لديك كمية مماثلة من الحمض النووي الريبي لكل.
ملاحظة: يحتوي قالب تجربة 4tU جدول البيانات نموذج للمساعدة في هذا الحساب. - عندما تكون العينة في RT، إضافة 25 ميكرولتر من 10 × NaTM العازلة (0.1 M تريس حمض الهيدروكلوريكدرجة الحموضة 7.0، 2 M NaCl، 250 مل ملغ كل 2)، 25 ميكرولتر من 1 M NaPi درجة الحموضة 6.8 (0.5 M NaH2PO4 0.5 M Na2HPO4) ، و 2.5 ميكرولتر من 10٪ SDS. يُمزج المزيج جيداً ويُدْعُف بلطف (<30 s؛ حوالي 100 × ز).
ملاحظة: لتجنب هطول الأمطار من SDS والأملاح، يجب الاحتفاظ العينات في RT طوال الإجراءات التالية حتى الخطوة 4.13. - جعل المخزن المؤقت حبة تحتوي على 1X NaTM المخزن المؤقت، 0.1 M NaPi، و 0.1٪ SDS، 2 مل لكل عينة. إضافة المبلغ المطلوب من H2O أولاً وSDS الأخير. هذا ينبغي أن تكون طازجة في كل مرة كأشكال عجل بعد 24 ح.
ملاحظة: لتجنب تشكيل الترسيب يجب الاحتفاظ المخزن المؤقت حبة في RT خلال الإجراءات التالية. لا DEPC علاج أو الأوتوكلاف. - إضافة 50 درجة مئوية من الخرز streptavidin إلى انخفاض الاحتفاظ 1.5 مل أنبوب. وضع الأنبوب على الرف المغناطيسي، والانتظار للحبات لتسوية ومن ثم إزالة السائل
- غسل الخرز streptavidin.
- إضافة 200 درجة مئوية من العازلة حبة ودوامة حتى يتم إعادة تعليق بيليه حبة تماما. عادة 3-5 s هو كل ما هو مطلوب. لإذاهية قبل إضافة عينة RNA يكفي لتحويل الأنابيب جولة حتى الخرز السفر عبر الأنبوب إلى الجانب الآخر. ثم تحويل الأنابيب مرة أخرى إلى الجانب الأصلي حتى الخرز السفر عبر الأنبوب مرة أخرى.
- تدور الأنبوب بسرعة منخفضة (حوالي 100 × ز) بحد أقصى 5 ق لتدور أسفل السائل، ولكن ليس الخرز.
- مكان في الرف المغناطيسي للسماح للحبات ليتم التقاطها من قبل المغناطيس.
- إزالة السائل عن طريق الطموح لعدد قليل من العينات. صب قبالة السائل إذا كان العديد من العينات.
ملاحظة: مع عدد كبير من العينات، إزالة جميع السوائل فقط عن طريق الطموح يمكن أن تكون إشكالية، كما قد يتم تجفيف الخرز في العينة الأولى قبل الانتهاء من العينة الأخيرة، وهذا يزيد الخلفية. يمكن التعجيل الغسيل عن طريق صب قبالة السائل من جميع العينات في وقت واحد في حين على المغناطيس. وينبغي أن تترك لفترة أطول قليلا على المغناطيس قبل صب وكمية صغيرة من السوائل التي لا تزال يجب أن يستنشق بعيدا ولكن، عموما، وهذا يعني وقتا أقل على المغناطيس ودون سائل. وبهذه الطريقة، فمن الممكن أن تفعل 24 أو أكثر من عمليات الاستخراج بسرعة.
- كتلة مع 200 ميكرولتر حبة العازلة، 10 ميكرولتر 20 ملغ / مل الجليكوجين، و 2.5 ميكرولتر 5 ملغ / مل tRNA، 20 دقيقة نهاية الدورية على نهاية بسرعة معتدلة في RT. التناوب هو للحفاظ على الخرز في التعليق. بمجرد اكتمال الحظر إزالة السائل كالخطوات 4.7.2−4.7.4 وغسل مرة أخرى، كما الخطوات الواردة في القسم 4.7.
- إعادة تعليق الخرز في العينة. حضانة في RT مع التناوب لمدة 30 دقيقة.
- أثناء الحضانة، إعداد أنبوب 1.5 مل جديدة لكل عينة. إضافة 1/10 حجم (ما يقرب من 10 درجة مئوية) من 3 M خلات الصوديوم درجة الحموضة 5.3 و 20 ميكروغرام من الجليكوجين، وتدور في حوالي 100 × ز لمدة 3 ق. مخزن في رف حتى الحاجة.
- قم بإزالة RNA غير المنضم من الخرز، كخطوات 4.7.2−4.7.4. يمكن المثابرة الحمض النووي الريبي غير المنضم في أنبوب جديد، ولكن الأملاح وSDS تجعل من الصعب جدا لتنقية. ثم غسل الخرز، كما القسم 4.7 مع دوامة، لمدة لا تقل عن 3 إلى 5 مرات كحد أقصى.
- بعد غسل النهائي تأخذ عناية خاصة لاستنشاق كل السائل. العودة إلى كل أنبوب واستنشاق dregs من المخزن المؤقت مرة أخرى.
- لelute الحمض النووي الريبي، إضافة 50 درجة مئوية من إعداد ها-ميكروكتوثانولبيتا الطازجة (βME) إلى الخرز (1 /20 تخفيف محلول الأسهم الموردة تجاريا). دوامة وتدور لفترة وجيزة، كما الخطوات 4.7.1 و 4.7.2. ضع الطين في الرف المغناطيسي وماصة الحمض النووي الريبي الذي يحتوي على حل في أنبوب الطرد المركزي 1.5 مل أعدت في الخطوة 4.10.
- Elute مرة أخرى كخطوة 4.13 لاسترداد الحمض النووي الريبي المتبقية من الخرز وإضافة عينة مُحتَلة إلى الأنبوب الذي يحتوي على أول إلوتيون من هذه الخرزات.
- إزالة الخرز المتبقية من RNA eluted عن طريق وضع العينة مرة أخرى في الرف المغناطيسي ونقل السائل إلى جديدة، وانخفاض ملزمة 0.5 مل أنبوب الطرد المركزي.
- خلط العينة ومن ثم عجل nsRNA عن طريق إضافة وحدات تخزين 2.5x (280 درجة مئوية) من الإيثانول ومزيج مرة أخرى. يترك لمدة ساعة واحدة إلى ليلة وضحاها عند -20 درجة مئوية. تدور في جهاز طرد مركزي قبل المبردة (4 درجة مئوية) لمدة 20 دقيقة في السرعة القصوى (على الأقل 13،000 × ز).
- يغسل جيدا مع 200 درجة مئوية من الإيثانول 70٪ في -20 درجة مئوية. كما βME المتبقية سوف تمنع التطبيقات المصب، تدور في كل خطوة لإزالة أكبر قدر ممكن من dregs؛ في النهاية يجب أن العينة لا رائحة βME.
- إعادة الذوبان في 10-20 درجة مئوية من DEPC المعالجة 1X TE مع ما يعادل 0.005 ميكرولتر RNase المانع.
ملاحظة: ينبغي إجراء جميع المراحل اللاحقة على الجليد. - قياس تركيز الحمض النووي الريبي والنقاء.
- قياسA 260 وA 225 في مقياس الطيف ية حجم عينة منخفضة.
ملاحظة: الحد الأقصى للامتصاص بالقرب من = 225 نانومتر هو من ملوث لا يمكن تجنبه من الخرز. في غياب الحمض النووي الريبي تنخفض الإشارة من الملوثات إلى 35٪ في = 260 نانومتر. ولذلك، فإن الكمية الفعلية من الحمض النووي الريبي تقريبية بالصيغة: (A260-(A225*0.35))*40 ng/μL. - بدلا من ذلك، تحليل العينة على نظام الكهربائي السائل الصغير مثل محلل حيوي.
ملاحظة: هذا التحليل هو أفضل من استخدام مقياس الطيف حيث يمكن تقييم سلامة الحمض النووي الريبي، والملوثات لا تتداخل مع الكم ومطلوب عينة أقل.
- قياسA 260 وA 225 في مقياس الطيف ية حجم عينة منخفضة.
- تحليل nsRNA.
ملاحظة: على سبيل المثال، يمكن قياس RNAs محددة بواسطة تقنيات qPCR النسخ العكسي القياسية. الحمض النووي الريبي أعدت بهذه الطريقة متوافق مع إعداد مكتبة لRNA-seq. إزالة rRNA ليست ضرورية لوضع العلامات مرات أقل من 5 دقائق.
النتائج
يتم عرض الغلة النموذجية لnsRNA المستردة باستخدام هذا البروتوكول ers4tU في الشكل 1b، وقد تم إنتاج هذا من قبل محلل حيوي ويظهر أثر العائد من RNA مقابل حجم (النيوكليوتيدات [nt]). لاحظ، في كل من تتبع المحلل الحيوي والرسم البياني الوارد، أن الانتعاش RNA من نقطة زمنية 0 هو جزء صغير جدا من تلك التي تعافى من نقاط زمنية أطول - ما يقرب من 0.3 ميكروغرام من الحمض النووي الريبي تعافى من حوالي 109 خلايا مقارنة مع أكثر من ضعف ذلك بكثير بعد 30 ثانية فقط من وضع العلامات (0.8 ميكروغرام من nsRNA) من نفس العدد من الخلايا. الانتعاش الحمض النووي الريبي في 15 ق هو أكثر متغير كما الاختلافات الصغيرة في أداء أخذ العينات لها تأثير أكبر نسبيا على استرداد الحمض النووي الريبي. في تتبع المحلل الحيوي، يمكن النظر إلى سلائف rRNA على أنها ذروة بالقرب من 1000 nt ومضاعفة من القمم في 1700-1800 nt. وتزداد وفرة هذه الوسطاء مع استمرار الثيوليشن.
واستُخدمت الوسمات الثيوية لتحديد كمية الربطبين نص ACT1 (الشكل 3). تم إجراء الثيوليشن وأخذ العينات على فترات 15 ق من بداية وضع العلامات ثيو وتجهيز ACT1 RNA رصدها (الشكل3أ،ب). كما يمكن أن نرى، يتم إنشاء ما قبل mRNA (عن طريق النسخ)، واللاريات (من قبل الخطوة الأولى من الربط من ما قبل mRNA)، حتى بعد 15 ق فقط من وضع العلامات. بعد حوالي 45 ق إلى 1 دقيقة، وكميات من اللاريات وما قبل mRNA تصل إلى التوازن مع أكبر قدر من هذه الأنواع RNA التي يتم إنشاؤها عن طريق النسخ كما تتم معالجتها بعيدا عن طريق الربط.
لإنتاج البيانات المبينة في الشكل 3c تم نبض سلالة مع 4tU لمدة 25 ثانية ثم مطاردة مع uridine. الجيل من ما قبل mRNA واللاريات تصل إلى حد أقصى في 1 دقيقة. هذا يقارن جيّدا مع رقم [3ب]; الحد الأقصى الذي يتم تحقيقه بعد 45 ق للوصول إلى التوازن بالإضافة إلى 25 ق من وضع العلامات. وبعد الذروة، تنخفض المستويات مع مطاردة الـ RNAs التي تحمل اسم ثيو من خلال عملية الربط.
الشكل 3D يظهر استنفاد عامل ربط البروتين وتأثيره على التمثيل الغذائي الحمض النووي الريبي، وذلك باستخدام بيتا-است AID 4U النظام6،7. هنا، يتم تخفيض Prp16p من مستويات فسيولوجية قريبة إلى 5٪ من هذا المستوى بعد 25 دقيقة من الاستنفاد. Prp16p هو عامل الربط الأساسية للخطوة الثانية من الربط15. تتم إزالة اللايات خلال الخطوة الثانية من الربط (الشكل3a)،ولكن هنا أنها تزيد فوق مستوى ما قبل mRNA كما Prp16 يصبح الحد. في أوقات الاستنفاد في وقت لاحق، تصبح عوامل أخرى محدودة بسبب الآثار الثانوية، بحيث تنخفض مستويات اللاريات، وترتفع مستويات ما قبل الميرنا. ينخفض مستوى الـ mRNA المعصّق.
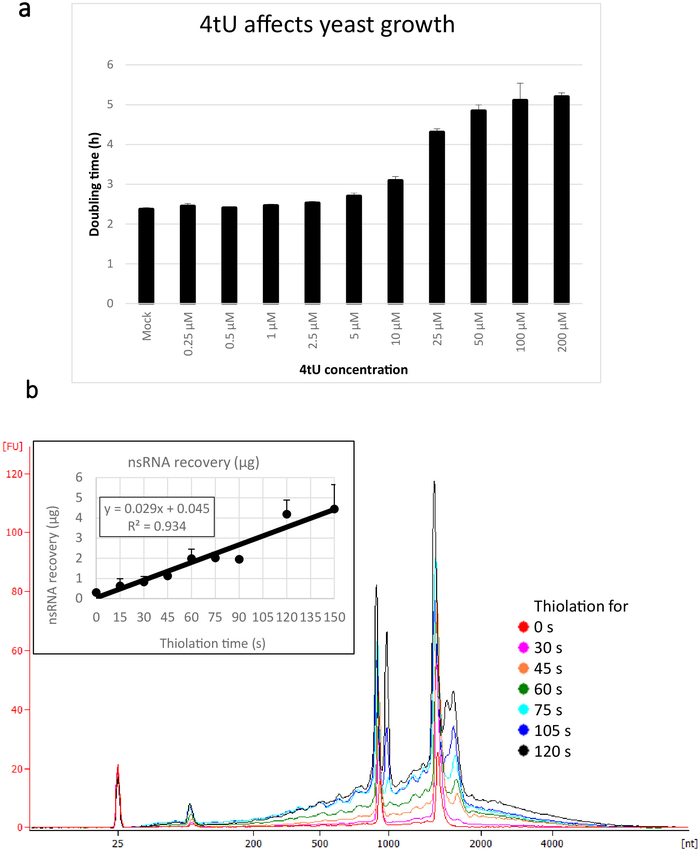
الشكل 1: النمو في انتعاش 4tU وRNA. (أ) 4-الثيوراسيل يؤثر على النمو. زيادة تركيز 4tU في YMM التسرب من النمو المتوسط دون uracil يزيد من الوقت مضاعفة من S. سيريفيسياي (BY4741) تحمل p4FuiΔpest بلازمبيست. تم رصد نمو أربع ثقافات تكرار في 30 درجة مئوية في Tecan لانهائية برو 200. وكانت جميع الثقافات في مرحلة السجل طوال الوقت، مع OD600 بين 0.1 و 0.6. موك هي ثقافة التحكم مع كمية مماثلة من NaOH وأضاف، والتي لا تغير في حد ذاتها معدل النمو. ويبين هذا الرسم البياني أن وضع العلامات على الثيو هو حل وسط بين وضع العلامات السريعة والأضرار التي تلحق بالخلية. أشرطة الخطأ هي خطأ قياسي من 4 النسخ المتماثل. (ب) يزيد العائد nsRNA خطيا من حوالي 15 ق من وضع العلامات. يظهر الرقم الرئيسي آثار المحلل الحيوي من تنقية، nsRNA من 0 (لا ثيولاتيد) إلى 2 دقيقة بعد إضافة 4tU في فترات 15 ق. لاحظ أنه لا يتم عرض العينة 15 s، كما أنه كان لا يمكن تمييزها عن العينة غير الموسومة. القمتين الكبيرتين تتوافقان مع RNAs ريبوسومال (rRNAs). السلائف rRNA ووسيطة مرئية كعدة قمم في وزن جزيئي أكبر من rRNAs ناضجة. ويزداد مع مرور الوقت استرداد هذه السلائف والمواد الوسيطة. وتظهر نتائج تجربة تمثيلية واحدة. يظهر الرسم البياني الوارد انتعاش nsRNA مع زيادة الحضانة مع 4tU. يزيد العائد من nsRNA مع زيادة وقت النمو مع 4tU. الانتعاش خطي بشكل ملحوظ (R2 = 0.934) طوال المقياس الزمني لهذه التجربة ويظهر زيادة طفيفة على الخلفية حتى في 15 s وضع العلامات مع 4tU حتى وإن كان لا يمكن تمييزها عن العينة غير الموسومة بالعين من المحلل الحيوي تتبع. تظهر أشرطة الخطأ خطأ قياسي لثلاثة عمليات نسخ متماثل بيولوجية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
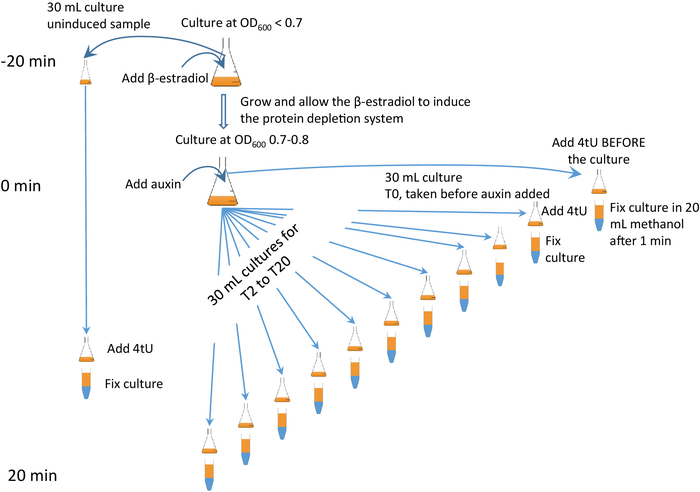
الشكل 2: بروتوكول رسومي 4U β-est AID 4U. ملخص رسومي لبروتوكول بروتوكول بيتا-إست AID 4U. β-استراديول (β-est) يعزز التعبير عن نظام المزيل للأوزون الأوكسين (AID) الذي بدوره يستنفد البروتين المستهدف الموسومة AID* ، راجع باراس وآخرون7 للحصول على بروتوكول مفصل. في هذه الحالة، يتم بدء التعبير عن نظام degron 25 دقيقة قبل بدء تدهور البروتين والثيويليون في كل نقطة زمنية لمدة دقيقة واحدة. يظهر إصدار متحرك في الشكل التكميلي 2. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
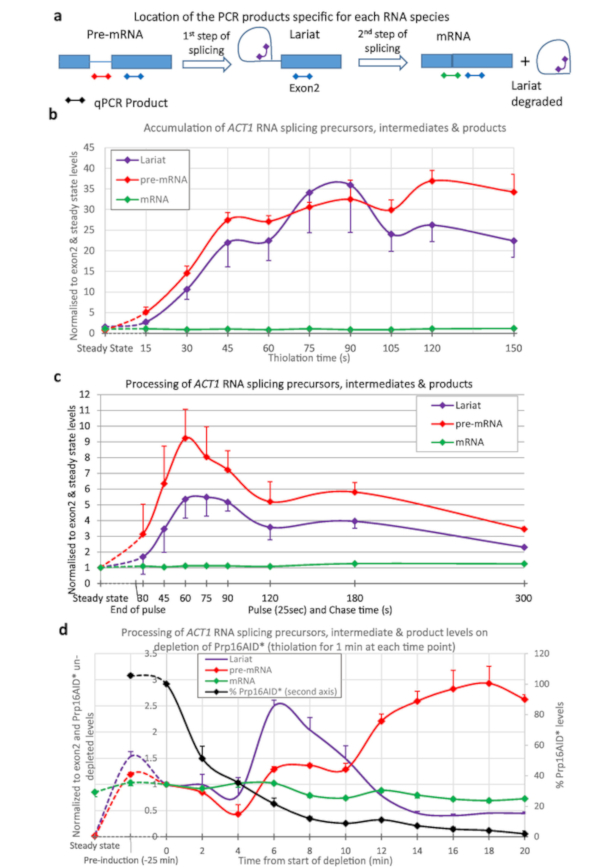
الشكل 3: السلائف والمواد الوسيطة من ربط الحمض النووي الريبي ACT1. تم رصد الربط بين نسخ ACT1 قبل mRNA عن طريق النسخ العكسي الكمي PCR16. وتظهر مستويات سلائف ACT1 (ما قبل الميرنا)، واللاريات-exon2 الوسيطة (لاريات) والمنتجات اللصق (mRNA) طبيعية مقابل مستوى ACT1 Exon2 ومستويات الحالة الثابتة لهذه RNAs. (أ) موقع منتجات qPCR على نسخة ACT1. مخطط لمواقع منتجات qPCR المستخدمة في اختبار مستويات السلائف والمواد الوسيطة والمنتجات من رد فعل الربط من نسخ ACT1 16. يتم تمثيل Exons بواسطة صناديق، intron كخط ومنتجات qPCR كخطوط مع الماس في أي من الطرفين، واللون يطابق تلك المستخدمة في الرسوم البيانية. وPCR ما قبل mRNA محددة لمرحلة ما قبل mRNA وليس أي وسيطة من الربط كما يعبر هذا المنتج نقطة الفرع الذي تعطل بعد الخطوة الأولى من الربط. سوف اللاريات PCR الكشف عن الناتج من الخطوة الأولى من الربط واللاريات المقتطعة المنتجة بعد الثانية. وPCR mRNA محددة للمنتج من الربط، mRNA. ولا تظهر في الرسوم البيانية النتائج المستمدة من الـ PCR الطارد للبراز (الموجودة في جميع السلائف والمواد الوسيطة والمنتجات، باستثناء اللاريات المقتطع) لأن ذلك استُخدم لتطبيع البيانات، وبالتالي فهو يساوي دائماً 1. (ب) وضع العلامات الثيولام المستمرة. يزيد مقدار ما قبل mRNA مع مرور الوقت كما يتم دمج 4tU عن طريق النسخ، وبعد تأخير قصير، الربط يحولها إلى منتجات وسيطة ولصق اللاريات exon2. مستويات هذه الأنواع ما قبل mRNA واللاريات يمكن الكشف عنها فوق الخلفية بعد أقل من 15 ق من النمو مع 4tU وتصل إلى الحد الأقصى بعد ما يقرب من 45 ق من الوسم المستمر مع 4tU، وعند هذه النقطة يتم موازنة إنتاجها عن طريق التحويل إلى لصق [مرنا] [و/ور] تدهور. يتم تطبيع القيم إلى حالتها الثابتة (أقصى نقطة من الرسم البياني)، وexon 2 مستويات لإظهار مظهرها ومعالجتها بالمقارنة مع نسخ exon 2. بما أنّ [رنا] ربط من [أكت1] كثيرا [ك-كّرأيشنل]4,17 يلصق [مرنا] سريعا يصبح النوع وافرة أكثر, مستواه مماثلة إلى أنّ من [إإكسون] 2. خطأ قياسي من ثلاثة نسخ بيولوجية، كل مُسّسق في ثلاث مرات. (ج) نبض / مطاردة. نبض الثيوليشن من 25 ثانية تليها مطاردة مع أوريدين. بالمقارنة مع مستويات الحالة الثابتة لهذه RNAs (نقطة اليسار الأكثر)، فهي في البداية وفيرة جدا ً في تجمع توليفها حديثاً. وتنخفض المستويات تدريجياً عند معالجتها في الحمض النووي الريبي (أو التدهور)، وتقترب من مستويات مشابهة جداً لمستويات الحالة الثابتة بمقدار 5 دقائق. (د) nsRNA واستنفاد البروتين. الربط بين نسخ ACT1 قبل mRNA رصدها من قبل النسخ العكسيالكمي PCR كما هو الحال في لوحة (أ) عند استنفاد البروتين Prp16 باستخدام نظام degron أوكسين كما هو موضح في الشكل 2. كما يتم عرض مستويات البروتين Prp16 في الرسم البياني المرسوم ضد المحور ص الثاني كنسبة مئوية من المستويات قبل استنفاد أوكسين. Prp16 هو عنصر حيوي من spliceosome، وخاصة بالنسبة للخطوة الثانيةمن الربط هو مبين في لوحة ( أ) ، وبعد ذلك يتم تدهور اللاريات. عندما تصبح هذه الخطوة الحد من اللاريات تتراكم في البداية. في وقت لاحق نقاط الربط فشل تماما، لم يعد يتم إنتاج اللاريات وارتفاع مستويات ما قبل mRNA. أشرطة الخطأ هي خطأ قياسي من ثلاثة نسخ متماثل البيولوجية، كل مُسَّسق في ثلاثة أضعاف. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
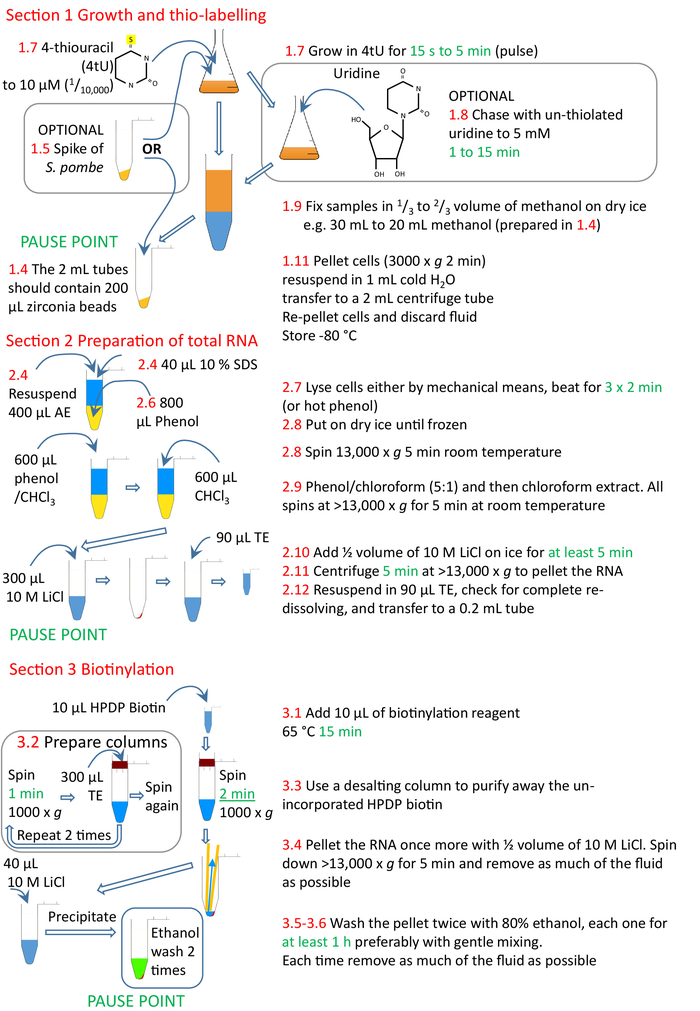
الشكل 4: ملخص بياني للفروع من البروتوكول من 1 إلى 3. الخلايا هي ثيولاتيد مع 4tU ويسمح لها بالنمو لدمج النيوكليوتيد المعدلة في الحمض النووي الريبي. يمكن إضافة ارتفاع S. pombe ثيواليد للسماح بالتطبيع عبر نقاط الوقت والتجارب. يمكن مطاردة نبض 4tU باستخدام أوريدين غير ثيولاتيد. يمكن أن يتم وضع العلامات إما بشكل مستمر من إضافة 4tU أو من تغيير لظروف النمو، وتقسيم الثقافة و4tU إضافة إلى الثقافات في أوقات متزايدة من تغيير حالة النمو، ولكن كل وضع العلامات فقط لفترة وجيزة. يتم جمع الخلايا، والحمض النووي الريبي أعدت من الخلايا، ويفضل استخدام المجانسة والأساليب القائمة على الفينول. الحمض النووي الريبي هو biotinylated ومن ثم الحمض النووي الريبي biotinylated تنقية من البيوتين غير المدمجة باستخدام عمود استبعاد حجم. وnsRNA هو الآن على استعداد لتنقية مع الخرز streptavidin (القسم 4، الشكل5). تتوافق الأرقام باللون الأحمر مع أرقام الخطوات في البروتوكول. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
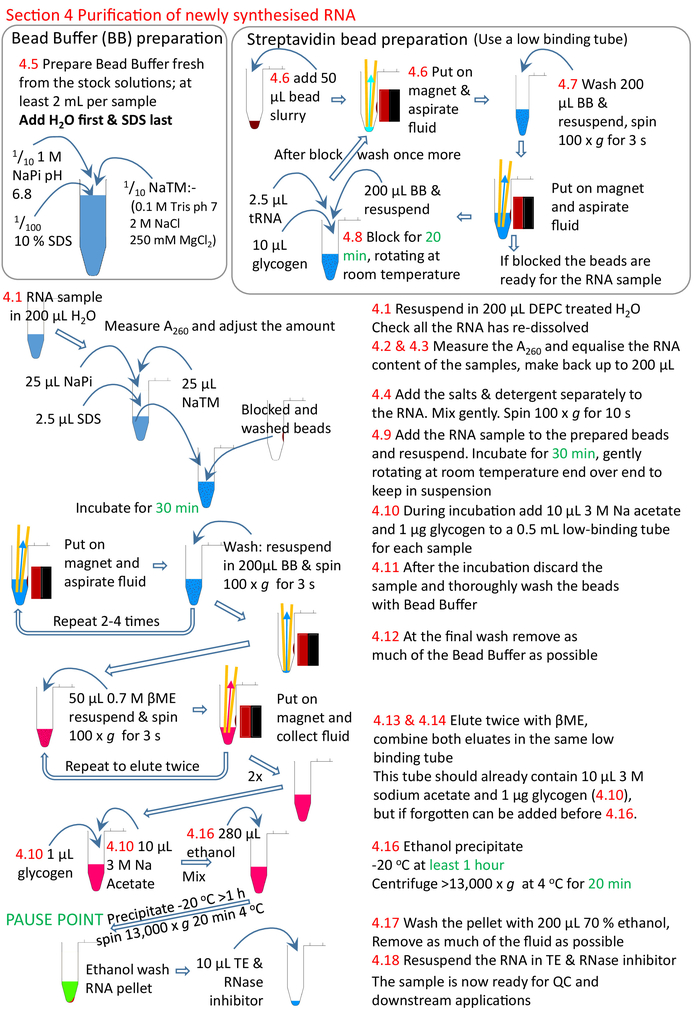
الشكل 5: ملخص بياني للفرع 4 من البروتوكول. متابعة من الأقسام 1إلى 3 (الشكل 4)، يتم حظر حبات streptavidin وعينة RNA biotinylated تضاف إلى الخرز أعدت. يربط الحمض النووي الريبي biotinylated إلى الخرز streptavidin والحمض النووي الريبي un-biotinylated إزالتها وغسلها. يتم التحلل الحمض النووي الريبي biotinylated من الخرز باستخدام βME وعجلت جاهزة لمزيد من البحوث. تتوافق الأرقام باللون الأحمر مع أرقام الخطوات في البروتوكول. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي 1: تحسين استرداد nsRNA من خلايا الخميرة مع وبدون نسخ إضافية من المستورد في 1 و 3 دقائق من وضع العلاماتثيو. لاحظ أن Fui1 هو المروج الخميرة الخاصة أعرب عنها من بلازميد 2 ميكرومتر. النسخة الجينية من هذا الجين موجودة في كل من هذه السلالات. الرجاء النقر هنا لتحميل هذا الملف.
الشكل التكميلي 2: نسخة متحركة من بروتوكول الرسوم ية 4U β-est AID 4U. الرجاء النقر هنا لتحميل هذا الملف.
الملف التكميلي 1: 4tU_experiment_template.xltx. الرجاء النقر هنا لتحميل هذا الملف.
| اسم بلازميد | المستورد / permease | علامه | التعليق | |
| محمد الدوسري | س. سيريفيسياي فوي1 | URA3 | فوي1 يستورد Uracil وUridine، مما يجعلها مثالية لتجارب النبض / مطاردة. | |
| محمد الدوسري | س. سيريفيسياي فوي1 | LEU2 | ||
| p4Fui-ΔPEST | س. سيريفيسياي فوي1 | URA3 | تم تعطيل عزر PEST من Fui1، وبالتالي فإن permease لا تتحلل عندما يكون هناك ما يكفي من uracil داخل الخلايا لاحتياجات الخلية. يعمل بشكل جيد في تجارب وضع العلامات ويحسن أداء النبض/المطاردة. | |
| محمد الدوسري | س. سيريفيسياي فور4 | URA3 | أوراسيل بيرميس | |
| محمد الدوسري | H. Sapiens ENT1 | LEU2 | ميلر وآخرون11. يحتوي أيضًا على جين كيناز من HSV الثيميدين. | |
| (ناقل نووي متساوي) | ||||
| جميع البلازميدات هي 2 ميكرومتر على أساس. وتستند جميع p4 بلازميدات وpAT على pRS16 سلسلة من بلازميدات. يتم التعبير عن FUI1 وFUR4 من المروجين المحلية الخاصة بهم. | ||||
الجدول 1: البلازميدات المستخدمة في هذا البروتوكول.
Discussion
تقدم هذه المقالة بروتوكولًا لوضع العلامات بسرعة فائقة ومحددة من وحدة التخزين الأونوع، من أجل استعادة الحمض النووي الريبي الوليد، الذي تم تصنيعه حديثًا من S. cerevisiae بعد أقل من 15 ق من وضع العلامات، مع تلوث منخفض جدًا بواسطة RNA غير المسمى.
يجب على المستخدم دائما الحرص على الحفاظ على سلامة الحمض النووي الريبي باستخدام درجات الحرارة الباردة والكواشف المعالجة DEPC. Streptavidin حبة تنقية موثوق بها عموما. ومع ذلك، من الصعب التعامل مع المخزن المؤقت حبة; يجب أن يتم ذلك حديثا، مع مكوناته المضافة في الترتيب الصحيح، وليس المبردة أو autoclaved. وتشمل أوجه القصور الشائعة الحمض النووي الريبي يجري حلها بشكل غير كامل بعد خطوات هطول الأمطار، وذلك إما كونها لا biotinylated أو فقدت خلاف ذلك خلال خطوات المعالجة. هناك تعليمات استكشاف الأخطاء وإصلاحها واسعة النطاق في المواد التكميلية.
هناك بعض القيود التي يجب أن تكون على بينة من في ers4tU. واحد سبق ذكره هو أن 4tU يبطئ نمو الخميرة (الشكل1a). وبصرف النظر عن RNAs ثيولاتيد الذاتية9، يمكن تنقية فقط RNAs التي تم تدوينها خلال فترة وضع العلامات عن طريق هذه الطريقة. البوليمرات التي توقفت على الجينات طوال وقت الثيوليشن لن تنتج النصوص الثيولاتية التي يمكن تنقيتها، على الرغم من أن النصوص التي تحمل جزئيا بسبب دخول البوليمرات أو ترك حالة توقف أثناء الثيوليشن يمكن استردادها. السلالات التي تنسخ بشكل سيء، إما بسبب ظروف الطفرة أو النمو، تنتج nsRNA قليلاً، على الرغم من أن التقنيات المستخدمة هنا سوف تحسن مع ذلك انتعاش nsRNA بالمقارنة مع أساليب أخرى. قد تكون أوقات أطول وزيادة أحجام الثقافة ضرورية في هذه السلالات والظروف. لاحظ أن uracil هو مصدر جيد للنيتروجين وبالتالي ينبغي أن يحاكم هذا الأسلوب قبل استخدامها للدراسات التي تنطوي على تجويع النيتروجين.
ويفيد بروتوكول ers4tU بشكل خاص في تحليل التقييمات RNS قصيرة الأجل، وكثير منها متدهور بسرعة بحيث لا يمكن تحديدها دون شل آلية التدهور. ومن الأمثلة على ذلك النصوص غير المستقرة الغامضة (CUTs)4، والنصوص القصيرة التي تنتجها الإنهاء المبكر أو المروج التوقف القريب18 والنسخ المضادة للتحسس "المنبع" من المروج (PROMPTs)19. الوسطاء المنتجة أثناء معالجة أنواع الحمض النووي الريبي مستقرة هي أيضا عابرة ولكن يمكن إثراؤها باستخدام النسخ ers4tU4. وبالتالي فإن بروتوكول ers4tU استثنائي في السماح بتحليل أنواع الحمض النووي الريبي العابرة للغاية والتقاطها في ظل ظروف فسيولوجية قريبة، وهو ميزة كبيرة على الطرق الأخرى. وقد استخدمت هذه التقنية لدراسة النسخ وحركة معالجة الحمض النووي الريبي المصب في متحولات بوليميراز RNA أن elongate أسرع أو أبطأ من العادي20.
الثيوليشن هو أيضا متوافق مع RNA-seq وSLAM-seq21،مما يسمح لجميع RNA المنتجة في غضون فترة زمنية قصيرة جدا أن تتميز بتفاصيل رائعة.
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
ساندت هذا عمل كان ب [ولّكم] تمويل إلى [جب] [104648]. ويدعم العمل في مركز ويلكوم لبيولوجيا الخلايا من قبل ويلكوم التمويل الأساسي [092076]. يعترف المؤلفون بأعضاء المختبر لمساعدتهم: بيلا مودلين، إيمانويلا ساني، سوزانا دي لوكاس- أرياس وشيني جورج. كما يود المؤلفون أن يشكروا باتريك كرامر على البلازميد YEpEBI31111.
Materials
| Name | Company | Catalog Number | Comments |
| β-mercaptoethanol (βME) | Sigma-Aldrich | M3148 | CAUTION toxic. Stock solutions are aproximatly 14 M, make at 1/20 dilution for use |
| Chloroform | Sigma-Aldrich | 25668 | CAUTION toxic |
| Diethyl pyrocarbonate (DEPC) | Sigma-Aldrich | D5758 | add 1/1000 volume to a solution, leave at room temperature for 24 h, then autoclave |
| DMF (N,N-dimethylformamide) | Sigma-Aldrich | 227056 | CAUTION toxic |
| EDTA | Sigma-Aldrich | 3609 | Make 0.5 M and pH to 8.0 with sodium hydroxide |
| Ethanol | Sigma-Aldrich | 29221 | |
| EZ-link HPDP Biotin | Thermo scientific | 21341 | Store protected from light. Disolve all the vial contents in 22.7 mL DMF (to make a 4 mM stock solution). Store away from water, in the dark & at -20 °C. Check the solution before using, as some batches of HPDP precipitate in storage; heat at 42 °C to resuspend. |
| Glucose | Fisher Scientific | G/0500/60 | |
| Glycogen [20 mg/mL] | Sigma-Aldrich | 10901393001 | Store at -20 °C |
| Immobilised TCEP Disulfide Reducing Gel | Thermo Scientific | 77712 | Optional |
| LiCl | Sigma-Aldrich | 793620 | 10 M solution. CAUTION: this gets very hot as is dissolves and can even boil at greater than 100 oC, add the LiCl crystals to the water slowly. |
| Magnesium chloride (MgCl2) | Sigma-Aldrich | 63033 | 1 M solution. CAUTION: this gets very hot as is dissolves and can even boil at greater than 100 oC, add the MgCl2 crystals to the water slowly. |
| Methanol | Fisher Scientific | M/4000/PC17 | CAUTION Toxic and flammable |
| NaH2PO4 | Sigma-Aldrich | S3139 | Make 1 M solutions of each and mix in equal amount to obtain a solution of the appropriate pH |
| Na2HPO4 | Sigma-Aldrich | S3264 | |
| NaCl | Sigma-Aldrich | S9888-M | 5 M solution |
| Phenol, low pH. | Sigma-Aldrich | P4682 | Store in the dark at 4 °C. CAUTION toxic |
| Phenol Chloroform 5:1 (125:24:1) low pH. | Sigma-Aldrich | P1944 | Store in the dark at 4 °C. CAUTION toxic |
| Pierce Spin Columns | Thermo Scientific | 69702 | Optional |
| SCSM single drop-out –ura | Formedium | DSCS101 | |
| Sodium Acetate | Sigma-Aldrich | 32318-M | Make a 3 M solution and pH to 5.3 with acetic acid |
| Sodium hydroxide | Sigma-Aldrich | 795429 | CAUTION corrosive |
| SDS (Sodium dodecyl sulfate) | Sigma-Aldrich | 436143 | CAUTION irritant, do not inhale |
| Streptavidin Magnetic beads | NEB | 1420S | Store at 4°C |
| SUPERase-In, RNase inhibitor | Life technologies | AM2696 | Store at -20°C |
| Thiolated Schizosaccharomyces pombe for spike | See section 1.7 of the protocol | ||
| 4-thiouracil (4tU) | ACROS ORGANICS | 359930010 | Store in the dark. Make 100 mM Stock in 1M NaOH, store solutions at -20°C. |
| Tris base | Sigma-Aldrich | 93362 | 1 M solutions at various pH |
| tRNA | Sigma-Aldrich | 10109541001 | 5mg/ml, store at -20°C |
| Uridine | Sigma-Aldrich | U3750 | Make 1 M solution in H2O. Split into 2 mL aliquots and store at -20 C. |
| Yeast nitrogen base without amino acids with amonium sulphate | Formedium | CYN0410 | |
| Zeba Columns 0.5ml | Thermo Scientific | 89882 | Store at 4 °C |
| Zirconia beads | Thistle Scientific | 110791052 | |
| Equipment and Consumables | |||
| Beadbeater | Biospec | 112011EUR | Other homogenisers can be used; the correct conditions for each homogeniser and strain must be established. |
| Bioanalyser (Agilent) or similar to assess RNA quality. If this is not important a spectrophotometer is useful to quantify the RNA. | |||
| Centrifuge: capable of spinning cultures at 4 °C and at least 3000 g. Pre-chill if possible. | |||
| Centrifuge: capable of spinning up to 2 mL tubes at variable speeds upto 13,000 g and down to 1000 g | |||
| Magnetic rack for separating the beads from the sample. The one used in the paper is 3D printed, available from Thingiverse (thing:3562952). Comercially available racks exist | |||
| PCR machine with a heated lid that will allow incubation in the dark. | |||
| Rotating wheel to rotate 1.5 mL tubes end over end | |||
| Shaking heating block (such as Eppendorf Thermomixer) is recomended | |||
| Tubes, centrifuge, Low retention, RNase free 0.5mL | Eppendorf | H179467N | |
| Tubes, centrifuge, Low retention, RNase free 1.5mL | Ambion | AM12350 | |
| Tubes, centrifuge, 50 mL | Sarstedt | 62.547.004 | Other centrifuge tubes are not gas proof allowing CO2 to disolve in the methanol, this comes out of solution vigorously on adding warm culture, leading to sample loss |
| Tubes, centrifuge, 15 mL | Sarstedt | 62.554.001 | |
| Tubes, 2 mL, screw cap | Greiner | 723361 | |
| Tubes 0.2 mL strip of 8 with integral lids | Brand | 781332 |
References
- Duffy, E. E., Schofield, J. A., Simon, M. D. Gaining insight into transcriptome-wide RNA population dynamics through the chemistry of 4-thiouridine. Wiley Interdisciplinary Reviews: RNA. 10 (1), e1513(2018).
- Windhager, L., et al. Ultrashort and progressive 4sU-tagging reveals key characteristics of RNA processing at nucleotide resolution. Genome Research. 22, 2031-2042 (2012).
- Baptista, T., Devys, D. Saccharomyces cerevisiae Metabolic Labeling with 4-thiouracil and the Quantification of Newly Synthesized mRNA As a Proxy for RNA Polymerase II Activity. Journal of Visualized Experiments. (140), e57982(2018).
- Barrass, J. D., et al. Transcriptome-wide RNA processing kinetics revealed using extremely short 4tU labeling. Genome Biology. 16, 282(2015).
- Burger, K., et al. 4-thiouridine inhibits rRNA synthesis and causes a nucleolar stress response. RNA Biology. 10, 1623-1630 (2013).
- Mendoza-Ochoa, G. I., et al. A fast and tuneable auxin-inducible degron for depletion of target proteins in budding yeast. Yeast (Chichester England). 36 (1), 75-81 (2018).
- Barrass, J. D., Mendoza-Ochoa, G. I., Maudlin, I. E., Sani, E., Beggs, J. D. Tuning degradation to achieve specific and efficient protein depletion. Journal of Visualized Experiments. , (2019).
- Hobro, A. J., Smith, N. I. An evaluation of fixation methods: Spatial and compositional cellular changes observed by Raman imaging. Vibrational Spectroscopy. 91, 31-45 (2017).
- Gustilo, E. M., Vendeix, F. A. P., Agris, P. F. tRNA's Modifications Bring Order to Gene Expression. Current Opinion in Microbiology. 11, 134-140 (2008).
- Dolken, L., et al. High-resolution gene expression profiling for simultaneous kinetic parameter analysis of RNA synthesis and decay. RNA. 14, 1959-1972 (2008).
- Miller, C., et al. Dynamic transcriptome analysis measures rates of mRNA synthesis and decay in yeast. Molecular Systems Biology. 7, 458(2011).
- Schmitt, M. E., Brown, T. A., Trumpower, B. L. A rapid and simple method for preparation of RNA from Saccharomyces cerevisiae. Nucleic Acids Research. 18, 3091-3092 (1990).
- Rädle, B., et al. Metabolic Labeling of Newly Transcribed RNA for High Resolution Gene Expression Profiling of RNA Synthesis, Processing and Decay in Cell Culture. Journal of Visualized Experiments. (78), e50195(2013).
- Herzog, V. A., et al. Thiol-linked alkylation of RNA to assess expression dynamics. Nature Methods. 14, 1198-1204 (2017).
- Ohrt, T., et al. Molecular dissection of step 2 catalysis of yeast pre-mRNA splicing investigated in a purified system. RNA. 19, 902-915 (2013).
- Alexander, R. D., et al. RiboSys, a high-resolution, quantitative approach to measure the in vivo kinetics of pre-mRNA splicing and 3′-end processing in Saccharomyces cerevisiae. RNA. 16, 2570-2580 (2010).
- Wallace, E. W. J., Beggs, J. D. Extremely fast and incredibly close: cotranscriptional splicing in budding yeast. RNA. 23, 601-610 (2017).
- Adelman, K., Lis, J. T. Promoter-proximal pausing of RNA polymerase II: emerging roles in metazoans. Nature Reviews Genetics. 13, 720-731 (2012).
- Preker, P., et al. RNA Exosome Depletion Reveals Transcription Upstream of Active Human Promoters. Science. 322, 1851-1854 (2008).
- Aslanzadeh, V., Huang, Y., Sanguinetti, G., Beggs, J. D. Transcription rate strongly affects splicing fidelity and cotranscriptionality in budding yeast. Genome Research. 28, 203-213 (2018).
- Schofield, J. A., Duffy, E. E., Kiefer, L., Sullivan, M. C., Simon, M. D. TimeLapse-seq: adding a temporal dimension to RNA sequencing through nucleoside recoding. Nature Methods. 15, 221-225 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved