Method Article
4-티우라실(Ers4tU)을 가진 생체내 RNA의 매우 신속하고 특정한 대사 라벨링
요약
효모 사카로미세세스 세레비시아에서새로 전사된 RNA를 민감하게 그리고 구체적으로 정화하기 위해 티오레이드 우라실을 사용한다.
초록
뉴클레오티드 유사체, 4-티우라실 (4tU)은 세포에 의해 쉽게 채택되고생체 내에서 전사될 때 RNA에 통합되어 짧은 기간 동안 생산된 RNA를 분리할 수 있습니다. 이는 스트렙타비딘 코팅 비드를 사용하여 통합된 티오기와 친화도 정화에 비오틴 모이어티를 부착함으로써 수행된다. 기존 RNA가 없는 순수하고 새로 합성된 RNA의 좋은 수율을 달성하면 라벨링 시간이 단축되고 운동 연구에서 시간적 분해능이 증가합니다. 이것은 새로 합성된 RNA의 매우 특이하고 높은 수율 정제를 위한 프로토콜이다. 여기에 제시된 프로토콜은 효모 사카로마이세스 세레비시아에서 RNA가 어떻게 추출되는지 설명합니다. 그러나, 총 RNA로부터 티오레이트 RNA의 정제를 위한 프로토콜은 일단 세포로부터 추출되면 임의의 유기체로부터 RNA를 사용하여 효과적이어야 한다. 정제된 RNA는 역전사-qPCR, RNA-seq 및 SLAM-seq와 같은 많은 널리 사용되는 기술에 의한 분석에 적합하다. 이 기술의 특이성, 감도 및 유연성은 RNA 대사에 대한 비교할 수없는 통찰력을 허용합니다.
서문
RNA는 역동적인 성질을 가지고 있다; 생산 직후 많은 RNA가 빠르게 처리되고 저하됩니다. 현재, RNA 물질 대사의 대부분의 연구는 총 세포 RNA를 분석, 이는 주로 완전히 처리 및 정상 상태 수준에서. 이 수준은 전사, 전사 후 성숙 및 저하 속도 사이의 균형에 따라 달라집니다. 안정된 상태 평형으로 이끌어 내는 프로세스의 분석은 아주 단명한 RNA 종을 붙잡기 위하여 전문화한 기술이 필요합니다.
4-티우라실 (4tU) 또는 4-티오리딘 (4sU)과 같은 뉴클레오티드 유사체를 가진 RNA의 대사 라벨링 (우수한 검토를 위해 더피 등1 참조), 티오 라벨 된 초기 RNAs 및 처리 중간체를 분리하는 기능을 제공합니다. 그러나, 게시된 프로토콜은 많은 전사체의 생산 속도에 비해 느린 몇 분2,3의라벨링 시간을 포함한다. 평균 효모 유전자를 전사하는 데 1 분의 순서로 걸리므로 효모 RNA를 1 분 미만으로 표시하는 것은 매우 짧은 것으로 간주 될 수 있습니다. 매우 신속하고 특정한 4티우라실 프로토콜(ers4tU)은 4tU 통합을 최대화하고 라벨이 부착되지 않은 기존 RNA의 회수를 최소화하여 신호대 잡음 비를 최대화하여 라벨링 시간을 매우 짧게 만드는 4.
티오-변형염기는 새로 합성된 RNA(nsRNA)에 효율적으로 라벨을 붙일 수 있도록 세포 내로 신속하고 충분한 양을 수입해야 한다. 이를 촉진하기 위해, 세포는 우라실 프리 배지에서 성장하고, 적절한 파마이즈의 발현은 4tU 또는 4sU 섭취량을 증진시키는 데 도움이 된다(적절한 파마이즈 유전자 및 보충체 도1을 운반하는 플라스미드의 리스트에 대한 표 1 참조). 4tU의 수산화 나트륨 용해도는 다른 뉴클레오티드 유사체가 요구하는 독성 유기 용매의 필요성을 방지합니다. 불행히도, 50 μM 이상의 농도에서 티오 변형 뉴클레오시드를 가진 장기간 성장하는 배양은 리보솜5를방해하는 것으로 관찰되었다. 그러나, 여기서 사용되는 농도(10 μM)는 매우 짧은 라벨링 시간, 해로운 효과를 최소화5(도1a),여전히 분석을 위한 충분한 RNA를 산출하면서.
이 기술은 표적 단백질6,7의 신속하고 특이적인 보조 매개 고갈과 결합될 수 있으며, "β-est AID 4U" 프로토콜로 지칭되며, 이 프로토콜은 β-estradiol 조절식이 있는 보조제의 유도성 다채기(AID) 시스템은 4tU 라벨링과 결합됩니다. β-est AID 4U 접근법을 사용하면 표적 단백질이 고갈될 수 있고 RNA대사에 미치는 영향이 면밀히 모니터링될 수 있다(그림 2). 타이밍은 매우 중요합니다. 함께 제공되는 비디오를 보고 그림 2와 애니메이션 된 양식에 주의를 기울이는 것이 좋습니다 (추가 그림 2참조).
정확한 시간 해결을 위해 RNA의 처리 및 분해를 매우 신속하게 중단해야 합니다. 이는 저온에서 메탄올을 사용하여 달성되며, 이는 세포 내용물들을 매우 빠르게 고정시키고 핵산함량을유지하면서 세포막을 저하시킵니다 8. RNA 추출은 효율적이어야 하며 RNA를 손상시키지 않아야 합니다. 기계적 인해는 chaotropic 에이전트의 부재에서 효과적입니다 (종종 이들은 티오 그룹을 포함하므로 피해야한다). RNA의 염화리튬 침전은 tRNA가 덜 효율적으로 침전되기 때문에 바람직하다. tRNA는 급속하게 전사되고 자연적으로thiolated 9, 그래서 제거 tRNAs는 생물 항성 시약에 대한 경쟁을 감소시킵니다. 작고 고도로 구조화 된 RNA가 관심이있는 경우 알코올 기반 RNA 침전 방법이 권장됩니다.
티오레이트 RNA를 회수하기 위해, 비오틴은 4tU를 가진 RNA내로 통합된 티오기를 통해 공유적으로 부착된다. 클레블 이황화물 결합을 통해 부착되는 변형 된 비오틴 (예를 들어, HPDP-biotin (N-[6-(Biotinamido)h엑실]-3 ́-(2́-p yridyldithio)propionamide, 또는 MTS-비오틴(메탄 티오불폰)을 사용하는 것이 좋습니다. 환원제를 첨가하여 RNA의 방출을 허용한다. 생체별화된 RNA는 자기 구슬에 결합된 스트렙타비딘상에서 화합성을 정제한다. 이 프로토콜은 이전에나열된 다른 프로토콜과 유사하지만 배경을 줄이기 위해 집중적으로 최적화되었습니다.
수행 될 수있는 티올 라벨링 실험의 두 가지 유형이 있습니다, 연속 및 불연속 라벨링. 각각은 자신의 장점이 있습니다. 연속 라벨링에서 4tU는 일정한 간격으로 채취한 배양 및 샘플에 첨가된다. 실험의 이 모형은 RNA가 처리되는 방법 및 수준이 시간이 지남에 따라 어떻게 변화하는지 보여줍니다. 예로는 야생형 실험및 펄스체이스 실험과 돌연변이의 비교가 있다. 도 3b,c에 도시된 실험은 이러한 유형이다. 불연속 라벨링의 경우 변경이 시스템 내로 유도되고 RNA가 모니터링됩니다. 변경이 유도되면 배양은 여러 하위 문화로 분할되어야하며 특정 시간에 각 문화는 짧은 기간 동안 티오 라벨로 표시됩니다. 일예는 도 27에도시된 β-est AID 4U이다. 이러한 유형의 실험은 RNA 처리에 대한 대사 변화의 효과를 모니터링하는 데 특히 유용합니다(도 3d참조).
티오 라벨링 실험의 그래픽 표현은 그림 4 및 그림5에 표시되며 프로토콜의 성능을 크게 단순화하는 스프레드시트를 사용할 수 있습니다(4tU 실험 template.xlsx참조). 이뿐만 아니라 추가 정보에는 광범위한 문제 해결 가이드가 포함되어 있습니다. 4tU 라벨링을 auxin 고갈 프로토콜과 통합하는 β-est AID 4U 프로토콜의 경우 그림 2 및 보충 그림2를 참조하십시오. 자세한 AID 고갈 프로토콜은 Barrass 외 7을 참조하십시오.
프로토콜
1. 성장과 티오 라벨링
참고: 프로토콜의 이 절을 완료하는 시간은 세포 성장 속도에 따라 매우 가변적입니다. 티오 라벨링 전에 1시간 동안 솔루션과 장비를 준비하고 시료를 가공하기 위해 30분 후 라벨링할 수 있습니다.
- S. 세레비시아균이 세포 내로의 4tU 수입을 증폭시키기위해 퍼마이즈(표 1)를 코딩하는 플라스미드를 함유하고 있는지 확인한다.
참고: 수입업자가 없으면 2분 미만의 라벨링이 성공할 가능성은 11(추가 그림 1참조). 4tU 통합은 성장이 우라실없이 매체에있는 경우 더 효율적이다, 그래서 변형은 URA3+이어야한다; 표 1의 여러 플라스미드는 URA3를 마커로 운반합니다. 이 프로토콜이 β-est AID 고갈7과결합될 경우, 추가적인 변형 변형이 요구된다. - 아미노산이 없는 효모 질소 염기 6.9 g, 포도당 20g, SCSM 싱글 드롭아웃 우라 1.92 g를물 1L에 첨가하여 YMM 우라실 프리 배지를 준비합니다. 사용 전에 성장 매체를 소독하거나 필터를 오토클레이브 또는 필터로 살균하십시오.
참고: 필터 살균은 샘플 수집에 사용되는 메탄올의 세포와 오토클레이브에 의해 생성된 펩타이드/당 복합체로서 선호됩니다. - YMM 우라실 프리 배지에서 효모를 0.6-0.8의 600 nm (OD600)에서광학 밀도로 성장시다. 문화가 로그 위상 성장에 있고 적어도 두 배로 증가했는지 확인합니다. 일반적으로 30°C에서의 성장은 권장되지만, 온도에 민감한 균주에 는 다른 온도가 사용될 수 있습니다.
참고: 변형, 성장 조건 및 RNA 수율에 따라 약 30 mL 샘플 부피가 필요합니다. 이 금액은 프로토콜 전체에서 가정됩니다. 30 mL의 배양량은 20 mL의 메탄올을 가진 50 mL 원심분리튜브에 가장 적합하므로 최적화를 시작하는 편리한 부피이다. RNA 회복을 증가시키기 위해 초기 시간 지점에 더 많은 샘플 볼륨을 사용하는 것이 좋습니다, 최대 2000 mL는 정말 짧은 라벨 링 시간 (&1 분)에서 느린 성장 세포에 사용되었습니다. - 얼음에 H2O의 약 50 mL를 식힙니다. 각 샘플에 대해 지르코니아 비즈 200 μL을 2 mL 스크류 캡 튜브에 넣고 얼음에 식힙니다. 또한 메탄올 20 mL (주의)를 50 mL 원심 분리튜브에 넣고 드라이 아이스 (주의)에 놓습니다. 메탄올은 샘플의 부피의 1/3/ 3/ 2/3이어야 한다.
주의: 메탄올은 흡입, 접촉 및 소비에 의해 독성이 있습니다. 메탄올이 니트릴 실험실 장갑을 관통할 수 있기 때문에 연기 후드에 대량으로 분배하고 두 쌍의 장갑을 착용하십시오. 메탄올은 인화성이 매우 높으며 모든 발화원으로부터 멀리하십시오.
참고: 드라이 아이스는 접촉시 차가운 화상을 입힐 수 있고 asphixiant 가스를 생성할 수 있으므로, 잘 통풍이 잘 되는 공간에서 취급하고 사용할 때 장갑을 사용하십시오.
참고 : 이 시점에서 구슬을 추가하는 것은 튜브가 건조하고 셀 펠릿아래로 회전 할 때 샘플이 첨가 된 후보다 쉽습니다. 또한, 이것은 샘플이 추가되기 전에 구슬을 냉각 할 수 있습니다. - S. pombe 스파이크가 배양에 추가될 경우 (나중에가 아닌), 얼음과 소용돌이에 티오레이트 S. pombe 세포의 aliquot를 철저히 해동, 적어도 30 s, 다음 문화에 추가. 아래 의 지침에 따라 준비된 경우, 하나의 S. pombe aliquot는 400 mL의 배양에 충분합니다 (12 개의 30 mL 샘플에 충분하고 처리 오류를 허용하기에 약간의). 더 많거나 적은 배양이 사용되는 경우, 배양에 추가된 S. pombe의 부피를 조정한다.
- S. pombe 배양물의 1L를 Od600 to 0.8로 정확히 S. 세레비시아에대한 프로토콜에 기재된 바와 같이 성장시다.
- 티오 라벨은 1.7 단계로, 10 분 동안.
- 1.9단계에서 설명한 바와 같이 드라이 아이스에 400 mL의 메탄올을 사용하여 모든 배양을 수정합니다.
- 3000 x g에서 3000 x g에서 원심분리에 의해 세포를 3 분 동안 펠렛.
- 상온자를 버리고 H2 O의 3.3 mL에서세포 펠릿을 다시 중단합니다.
- 각각 80 μL의 알리쿼트로 나눕습니다. -80 °C에서 보관하십시오.
- 400 mL 배양에 대해 하나의 알리쿼트 또는 30 mL 샘플당 10 μL을 모두 사용하십시오.
참고: RNAseq를 수행하는 경우 스파이크 볼륨을 1/10으로 줄입니다. aliquots를 재사용하지 마십시오. 사용하지 않은 스파이크를 폐기합니다. 이 스파이크는 시간 점 및 실험에서 결과를 정규화하고 비교하는 데 유용합니다.
- 불연속 라벨링을 위해, 필요한 대사 교란(예를 들어, 성장 조건, β-est AID 7(도 2 및 보충도2)과 같은 고갈(예를 들어, 성장 조건, 유전자 유도 또는 고갈)을 유도한 다음 배양을 분할한다. 모든 플라스크와 매체가 필요한 온도에 있는지 확인하고, 가능하다면 배양을 추가하기 전에 배지를 통기하십시오.
- 배양물에 4tU를 10 μmMM의 농도로넣고 격렬하게 혼합한다(100 mM4tU의 배양부량의 1/10,000 을 1 MNaOH에 용해). 15 s에서 5 분 동안 티올 라벨.
참고: 30초는 좋은 출발점입니다. 20초 미만의 티오 라벨링은 시간 압력하에서 배양을 조작하는 데 어려움으로 인해 더 많은 가변적인 결과를 제공합니다. 그러나 1분 이상 라벨링하면 기술의 시간적 분해능이 줄어듭니다. - 추격 실험이 수행될 경우; 20-30s에 대한 티오 라벨링을 허용한 다음 5mMM의 최종 농도에 1/200 배양 부피 1 M uridine (티오레이트되지 않음)을 추가하여 추적합니다.
참고: 우리딘은 더 적은 부피가 배양에 첨가될 수 있도록 더 많은 수용성이기 때문에 세포의 성장에 방해가 덜되기 때문에, 추격을 위한 우라실에 바람직하다. - 정규 간격(적어도 15s)으로 배양 샘플을 시간 코스가 끝날 때까지 가져가십시오. 이보다 짧은 샘플링 간격은 안정적으로 수행하기 가 어렵습니다. 1.4단계에서 제조된 드라이 아이스에 메탄올에 샘플을 첨가한다. 편의를 위해 20 mL의 메탄올을 함유한 50 mL 튜브에 30 mL의 배양을 추가하십시오.
참고 : 이산화탄소는 감기 때 메탄올에 용해됩니다. 이것은 샘플 손실의 결과로 - 혼합시 적극적으로 샘플 및 거품의 추가에 용액에서 나온다. 이를 방지하기 위해 메탄올을 필요한 시간에 가까워질 때까지 단단히 밀봉된 튜브에서 <-70°C로 식힌 다음 드라이 아이스로 옮긴다. - 튜브를 밀봉하고 흔들어 완전히 섞어줍니다. 샘플을 얼음 위에 놓습니다. 어떤 샘플도 고정되지 않은지 확인합니다. 그렇다면, 부드럽게 손에 따뜻하게, 지속적으로 반전. 이것은 시료의 온도를 평가 할 수 있으므로 손에서 가장 잘 수행되며 항상 차가운 느낌을 가져야합니다. 얼음 위에 놓습니다. 일시 중지 지점이 아닙니다. 모든 샘플이 유체가 되면 다음 단계로 진행됩니다.
- 3000 x g에서 2 분 동안 (가능한 경우 4 °C에서) 세포를 펠렛합니다. 액체를 붓고 적어도 1 mL의 얼음 차가운 물에 펠릿을 부드럽게 위아래로 파이프팅하여 다시 놓습니다.
참고: 샘플 펠릿의 잔류 메탄올은 재서스펜션을 돕습니다. - 1.4단계에서 준비된 대로 2mL 스크류 캡 튜브로 옮김. >13,000 x g에서 짧게 돌리면 세포를 다시 펠렛하고 얼음 위에 다시 놓고 액체를 제거하십시오.
참고: 세포 펠릿은 몇 달 동안 -70 ~ -80°C에서 보관할 수 있다.
2. 총 RNA의 준비
참고: 완료 시간은 90분입니다.
- 디에틸 파이로카보네이트(DEPC) 처리 된 솔루션을 사용하여 RNA를 분해하지 않도록 보호하십시오. Aliquot 필터 파이펫 팁을 사용하여 솔루션을 알리쿼트하고 항상 장갑을 착용하십시오.
- 용액에 DEPC 의 1/1000 볼륨을 추가하고 격렬한 흔들림으로 혼합합니다.
- 실온(RT)에서 24시간 동안 그대로 둔 다음 오토클레이브를 합니다.
- 아민 그룹(예: tris)이 있는 솔루션은 DEPC를 처리할 수 없습니다. Aliquot 분말 및 RNA 작업에 대 한 특별히 저장. 용액을 만들기위해 이전에 DEPC 처리 H2 O를 사용합니다.
참고: RNA의 티오-그룹은 광활성이 가능하므로 이 시점부터 자외선에 대한 노출을 최소화하십시오. 저장은 어두운 에 있어야하고 인큐베이션은 가장 뚜껑PCR 기계에서 이루어집니다.
- S. pombe 스파이크가 배양보다는 세포 펠릿에 추가될 경우(둘 다 하지 않음), 지금 추가합니다. 펠릿에 추가하기 전에 얼음과 소용돌이에 티오레이드 S. pombe 세포의 aliquot를 철저하게, 적어도 30 초 해.
참고: 1.5.1-1.5.7 단계에 따라 제조된 경우, 10 μL의 S. pombe aliquot는 배양 30 mL로부터 유래된 하나의 펠릿에 필요합니다. - 캡을 착용하기 전에 1-2s를 매우 짧게 회전하여 캡과 튜브 사이에 지르코니아 구슬이 갇혀 있지 않도록하여 샘플과 페놀이 튜브에서 누출될 수 있습니다.
- 아세테이트 EDTA(AE) 완충액(50 mM 아세테이트 pH 5.3, 10 mM EDTA pH 8.0)의 400 μL에서 세포를 격렬하게 소용돌이치면서 다시 중단한다. 40 μL의 10% (v) 나트륨 도데실 황산염 (SDS)을 추가하십시오. SDS가 거품을 내므로 소용돌이를 일으키지 마십시오.
- β-est AID 4U 프로토콜을 사용할 경우, 단백질 분석을 위해 세포 현탁액의 40 μL을 취한다7. AE 40 μL을 추가하여 볼륨을 최대 400 μL까지 백업합니다.
- 낮은 pH와 10초 동안 와류에서 800 μL의 페놀(주의)을 넣으세요.
주의: 페놀은 흡입과 접촉에 의해 독성및 부식성입니다. 항상 연기 후드에 페놀과 관련된 절차를 수행하고 장갑 두 쌍을 착용. - 가장 낮은 전력 설정에서 3개의 2분 버스트에 대해 균질화(예: 재료표)로 세포를 라이즈합니다. 균질화의 펄스 사이에 2 분 동안 얼음에 샘플을 둡니다.
참고: 다른 균질제를 사용하는 경우 조건을 최적화합니다. 불충분한 흔들림은 수율이 떨어지는 결과를 초래하는 반면, 과도한 흔들림은 260 nm (A260)에서흡광도에 의해 결정된 바와 같이 명백한 더 높은 수율을 초래하지만 RNA는 저하될 수 있습니다. 균질화제가 바람직하지만, 뜨거운 페놀 RNA정제(12)가 사용될 수 있다. - 용해된 샘플을 건조 얼음 위에 5분 동안 놓고, 고형화될 때까지, 이것은 게놈 DNA가 RNA로 이월되는 것을 감소시킵니다. 샘플이 해동되지 않는 한 너무 오래 동결하지 마십시오. RT에서 >13,000 x g에서 마이크로 퍼지에서 5 분 회전; 샘플 / 페놀 혼합은 낮은 온도에서 수행되는 경우 스핀 전반에 걸쳐 고체로 유지되기 때문에 4 °C에서이 작업을 수행하도록 유혹하지 마십시오.
참고: 시료가 스핀 이끝날 때 에도 동결된 경우, 샘플이 완전히 해동될 때까지 다시 5분 간 다시 회전합니다. - 페놀/클로로포름 추출물은 페놀의 동일한 부피(약 600 μL)로 클로로포름 추출물을 함유한 후 클로로포름 5:1을 함유하고 있습니다(주의). 페놀을 함유한 다른 튜브로 상부 를 옮기다:클로로포름 5:1 또는 클로로포름. 소용돌이, 다음 RT에서 마이크로 fuge에서 5 분 동안 회전. 그런 다음 상단 위상을 새로운 1.5 mL 튜브로 옮김을 전송합니다.
주의: 클로로포름은 흡입과 접촉에 의해 독성이 있습니다. 항상 연기 후드에 클로로폼과 관련된 절차를 수행하고 장갑 두 쌍을 착용하십시오. - 10 M LiCl의 세 번째 에서 절반 부피 (약 300 μL)를 추가하고 RNA를 침전시키기 위해 혼합합니다. 시료는 즉시 흐리게 하지만 얼음이나 4 °C (동결될 때 -20 °C 이하로 보관하지 마십시오) 또는 침전물 flocculates때까지 적어도 10 분 동안 방치해야합니다.
- 마이크로 퍼지에서 >13,000 x g에서 5분 동안 회전합니다. 액체를 제거하고 잠시 다시 회전하고 찌꺼기를 제거하십시오. 70% 에탄올의 300-500 μL로 펠릿을 세척하고, 잠시 회전하고 남은 에탄올을 제거합니다.
참고 : 이러한 세차하는 동안 첫 번째 스핀과 튜브의 동일한 측면에 펠릿을 유지, 이 방법은 펠렛이 이동하고 중단되지 않습니다; RNA의 일부를 끊으면 실수로 손실 될 수 있습니다.
참고 : 펠릿을 건조시키지 마십시오. 대부분의 유체가 제거된 경우 후속 단계를 방해하지 않습니다. RNA는 또한 몇 달 동안 -20°C 또는 -70~-80°C에서 장기 보관을 위해 이 단계에서 저장될 수 있다. - RNA 펠릿을 90 μL의 TE pH 7.0(10 mM Tris HCl pH 7.0, 1 mM EDTA pH 8.0)에서 재용해하여 RNA 펠렛으로서 흔들어 65°C에서 가열하여 다시 용해하기 어려울 수 있다. RNA가 더 높은 온도에서 저하되기 때문에 이것은 더 이상 5 분 이상이어야합니다. 전체 RNA 용해도를 확인한 다음 0.2 mL 튜브로 옮김을 확인합니다. 피펫 샘플을 상하; "덩어리"가 없어야하며 유체가 끝에서 원활하게 상승하고 떨어져야합니다. 이 솔루션은 점성이 있으므로 최종 파이펫팅 동작이 느려야 합니다.
참고: RNA는 이 단계에서 어둠 속에서 -20°C에서 저장될 수 있다; 이것은 또한 RNA 용해도에 유익할 수 있습니다.
3. 생물항제
참고: 완료 시간은 60분입니다. 다음 단계는 별도의 캡이있는 스트립보다 소용돌이에 열리는 경향이 적기 때문에 일체형 캡이있는 튜브 스트립에서 편리하게 수행됩니다.
- 5 mM HPDP-비오틴 용액(MTS-비오틴)의 10 μL(1/10 최종 부피)을 첨가하여 RNA에 완전히 혼합하여 HPDP-비오틴과 정확히 동일한 방식으로 사용할 수 있습니다. 비오틴을 첨가하기 전에 65 °C에서 몇 초 동안 RNA를 예열하십시오. 65°C에서 15분 동안 최대 30분 동안 배양한다.
참고: 일부 HPDP 배치는 RNA 샘플의 RT에서 침전되기 때문에 이 가열이 필요합니다. 가열 된 뚜껑이있는 PCR 블록이 이상적입니다. - 통합되지 않은 비오틴을 제외하기위해 작은 수지 부피, 크기 배제 컬럼(표)을 준비한다. 기둥의 하단 태그를 제거하고 뚜껑을 풀고 2mL 원심 분리튜브에 놓습니다. 버퍼를 플러시하기 위해 1 분 동안 1500 x g에서 회전하여 TE의 0.3 mL을 부드럽게 추가하고 다시 돌루십시오. 세척을 반복하고 총 3 번 씻을 때 두 번 더 돌이내라. 마지막으로 세척된 컬럼을 신선한 1.5 mL 튜브로 옮김을 옮김을 옮김.
- 샘플 배양(단계 3.1)이 완료되면 샘플을 컬럼의 맨 위에 추가합니다. 1500 x g에서 2 분 동안 돌루기. 생체 티니어 RNA 견본은 관의 바닥에 지금 입니다.
참고: 1분 회전으로 전체 샘플을 채우면 충분하지 않습니다. - 10 M LiCl의 세 번째 에서 절반 부피 (약 40 μL)를 추가하고 RNA를 2.10 단계로 다시 침전시키기 위해 혼합하십시오. 시료는 즉시 흐리게 해야 하지만 얼음이나 4°C또는 침전물 응집물 때까지 적어도 5분 동안 방치해야 합니다. 동결되기 때문에 -20 °C 이하로 보관하지 마십시오. 샘플을 마이크로퓨지에서 >13,000 x g에서 5분 동안 원심분리합니다.
- 80% 에탄올, ≤1 시간 회전으로 씻으소서. 2.11단계의 절차를 따라 가능한 한 많은 유체를 제거하십시오.
참고: HPDP-비오틴은 80% 에탄올에 매우 용해되므로 추가적인 정제 단계입니다. - 80% 에탄올 세척을 반복하여 가능한 한 많이 통합되지 않은 비오틴을 제거합니다.
참고: RNA는 또한 어둠 속에서 -20 °C에서 이 단계에서 저장될 수 있습니다.
4. 새로 합성된 RNA의 정제
참고 : 완료 시간은 2 시간입니다.
- DEPC 처리된 H2O의200 μL에서 RNA를 재용해(65°C 배양할 수 있으며, 단계 2.12의 절차와 유사하게 사용될 수 있다).
- 분광광도계를 사용하여 A260에서 RNA 농도를 측정합니다. 시료는 분광광도계의 선형 범위 내에서 샘플을 얻으려면 1/10을 희석해야 할 수 있습니다. 소용돌이는 점성 RNA가 고르게 용해되는 것을 보장하기 위해 적어도 10 s에 대한 이러한 희석.
참고: 생물항제의 효율은 필요한 경우 도트 블롯13에 의해 평가될 수 있습니다. - 신선한 튜브에 동일한 양의 RNA를 추가하고 DEPC 처리 된 H2O. 모든 샘플을 가장 낮은 RNA 농도로 사용하고 각각에 대해 비슷한 양의 RNA를 갖기 위해 다른 샘플의 적절한 부피를 사용합니다.
참고: 스프레드시트 4tU 실험 template.xlsx에는 이 계산을 돕는 양식이 있습니다. - 샘플이 RT에있을 때, 10 x NaTM 버퍼의 25 μL을 추가 (0.1 M Tris HCl pH7.0, 2M NaCl, 250 mM MgCl 2), 25 μL 의 1 M NaPi pH 6.8 (0.5 M NaH2PO4 0.5 M Na2 HPO4) 및 10 % SDS의 2.5 μL. 완전히 섞어서 부드럽게 돌립니다(&30s; 약 100 x g).
참고: SDS와 염의 침전을 피하려면 4.13단계까지 다음 절차 전반에 걸쳐 샘플을 RT에 보관해야 합니다. - 1x NaTM 버퍼, 0.1 M NaPi 및 0.1% SDS, 샘플당 2mL를 포함하는 비드 버퍼를 만듭니다. H2O의 필요한 양을 먼저 추가하고 SDS를 마지막으로 추가합니다. 이것은 24 시간 후에 침전물 양식으로 매번 신선하게 만들어야 합니다.
참고: 침전물의 형성을 피하려면 다음 절차 전반에 걸쳐 비드 버퍼를 RT에 보관해야 합니다. DEPC 치료 또는 오토클레이브를 하지 마십시오. - 낮은 유지력 1.5 mL 튜브에 스트렙타비딘 비드 50 μL을 추가합니다. 튜브를 마그네틱 랙에 놓고 구슬이 가라앉을 때까지 기다린 다음 유체를 제거할 때까지 기다립니다.
- 스트렙타비딘 구슬을 씻으자.
- 비드 펠릿이 완전히 다시 중단될 때까지 200 μL의 비드 버퍼와 와류를 추가합니다. 일반적으로 3-5 s가 필요한 전부입니다. RNA 견본이 추가되기 전에 세차하는 것은 구슬이 관을 가로질러 다른 쪽으로 이동하도록 관을 둥글게 돌리기에 충분합니다. 그런 다음 튜브를 원래 쪽으로 돌려 구슬이 다시 튜브를 가로 질러 이동하도록합니다.
- 튜브를 저속(약 100 x g)으로 회전하여 최대 5초동안 유체를 스핀다운하지만 구슬은 회전시키지 않습니다.
- 자석에 의해 구슬을 포착할 수 있도록 마그네틱 랙에 놓습니다.
- 적은 수의 샘플에 대한 포부로 유체를 제거; 많은 샘플경우 액체를 부어.
참고 : 많은 수의 샘플을 사용하면 첫 번째 샘플의 구슬이 마지막 샘플이 완료되기 전에 건조 될 수 있기 때문에 흡인에 의해 순수하게 모든 유체를 제거하는 것이 문제가 될 수 있습니다. 자석에 있는 동안 모든 샘플에서 유체를 한 번에 부어 세척을 신속하게 할 수 있습니다. 그들은 붓기 전에 자석에 조금 더 오래 남아 있어야하며 남아있는 소량의 유체는 흡인되어야하지만, 전반적으로 자석에 적은 시간을 의미하고 유체가없는 것을 의미합니다. 이러한 방식으로, 24개 이상의 추출을 신속하게 수행할 수 있다.
- 200 μL 비드 버퍼, 10 μL 20 mg/mL 글리코겐, 2.5 μL 5 mg/mL tRNA, RT에서 적당한 속도로 20분 회전 끝의 블록. 회전은 비드를 현탁액에 유지하는 것이다. 차단이 완료되면 단계 4.7.2-4.7.4로 유체를 제거하고 섹션 4.7의 단계로 다시 세척한다.
- 샘플에서 비드를 다시 일시 중단합니다. RT에서 30분 동안 회전하여 배양합니다.
- 배양 동안, 각 샘플에 대해 신선한 1.5 mL 튜브를 준비한다. 3M 아세테이트 pH 5.3 및 글리코겐 20 μg의 1/10 부피(약 10 μL)를 추가하고, 필요시까지 랙에 보관할 때 약 100 x g으로 돌이세요.
- 단계 4.7.2-4.7.4로 비드에서 언바운드 RNA를 제거합니다. 언바운드 RNA는 신선한 튜브에서 인내할 수 있지만 소금과 SDS는 정화하기가 매우 어렵습니다. 그런 다음 구슬을 소용돌이로 섹션 4.7로 최소 3 ~ 최대 5 회 동안 씻으하십시오.
- 최종 세척 후 모든 액체를 흡인하는 특별한주의를 기울여야합니다. 각 튜브로 돌아가 서 다시 한 번 버퍼의 찌꺼기를 흡인합니다.
- RNA를 용성시키기 위해, 새로 제조된 0.7 M β-메르카포에탄올(βME)의 50 μL을 비드(시판원료 용액의 1/20 희석)에 첨가한다. 소용돌이와 단계 4.7.1 및 4.7.2로, 짧게 회전합니다. 슬러리를 마그네틱 랙에 넣고 4.10단계에서 제조된 1.5 mL 원심분리기 튜브에 함유된 RNA를 피펫으로 넣는다.
- 4.13단계로 다시 한 번 용루하여 구슬로부터 잔류 RNA를 회수하고 이들 비드로부터 제1 용출을 함유하는 튜브에 용출 샘플을 첨가한다.
- 용출된 RNA에서 잔류 구슬을 제거하고 샘플을 마그네틱 랙에 다시 넣고 유체를 신선하고 낮은 결합 0.5 mL 원심분리기로 옮김을 전달합니다.
- 샘플을 혼합한 다음 에탄올의 2.5배 부피(280 μL)를 추가하여 nsRNA를 침전시키고 한 번 더 섞습니다. -20 °C에서 하룻밤 동안 1 시간 동안 둡니다. 미리 냉각된 원심분리기(4°C)에서 최대 속도(최소 13,000 x g)에서 20분 동안 회전시킵니다.
- -20°C에서 70% 에탄올의 200 μL로 철저히 씻으십시오. 잔류 βME는 다운스트림 응용을 억제하기 때문에 모든 단계에서 스핀하여 가능한 한 많은 찌꺼기를 제거합니다. 끝에서 샘플은 βME 냄새가 나지 않아야합니다.
- 0.005 μL RNase 억제제와 함께 DEPC 처리 1x TE의 10-20 μL에서 다시 용해.
참고: 이후의 모든 스테이지는 얼음에서 수행해야 합니다. - RNA 농도와 순도를 측정합니다.
- 낮은 시료 부피 분광광도계에서 A260 및 A225를 측정합니다.
참고: λ 에 가까운 흡광도 최대 = 225 nm는 구슬에서 피할 수 없는 오염 물질에서 나온 것입니다. RNA가 없을 때 오염물질의 신호는 λ = 260 nm에서 35%로 감소합니다. 따라서 실제 RNA 양은 수식에 의해 근사화됩니다: (A260-(A 225*0.35))*40 ng/μL. - 양자택일로, 바이오 분석기와 같은 마이크로 유체 전기 영동 시스템에 견본을 분석하십시오.
참고: 이 분석은 RNA 무결성을 평가할 수 있고, 오염물질이 정량화를 방해하지 않으며, 더 적은 샘플이 요구되기 때문에 분광광도계를 사용하는 것이 바람직하다.
- 낮은 시료 부피 분광광도계에서 A260 및 A225를 측정합니다.
- nsRNA를 분석합니다.
참고: 예를 들어, 특정 RNA는 표준 역전사 qPCR 기술에 의해 정량화될 수 있다. 이러한 방식으로 제조된 RNA는 RNA-seq. rRNA의 제거가 5분 미만의 라벨링 시간에 필요하지 않다.
결과
이러한 ers4tU 프로토콜을 사용하여 회수된 nsRNA에 대한 전형적인 수율은 도 1b에표시되며, 이것은 바이오분석자에 의해 생성되었으며, 트레이스는 RNA 대 크기(뉴클레오티드[nt])의 수율을 나타낸다. 참고, 바이오 분석기 추적 및 삽입 그래프 모두에서, 시간 포인트 0에서 RNA 복구는 더 긴 시간 포인트에서 복구 의 매우 작은 부분 - 약 0.3 RNA의 약 0.3 μg는 약에서 복구 109 세포보다 두 배 이상 동일한 수의 세포로부터 단지 30s의 라벨링(0.8 μg의 nsRNA)을 채진하였다. 15 s에서의 RNA 회복은 샘플링을 수행하는 작은 차이가 RNA 회복에 비례적으로 더 큰 영향을 미치기 때문에 더 가변적이다. 바이오 분석기 추적에서 rRNA 전구체는 1000 nt 근처의 피크와 1700-1800 nt에서 피크의 두 배로 볼 수 있습니다. 이러한 중간체의 풍부는 티올레이션이 계속됨에 따라 증가합니다.
티오 라벨링은 ACT1 전사체의 접합을 정량화하는데 사용되었다(도 3). 티올레이션을 수행하고 모니터링된 ACT1 RNA의 처리 및 티오 라벨링의 시작으로부터 15 s 간격으로 채취한 샘플(도3a,b). 알 수 있듯이, pre-mRNA는 (전사에 의해) 생성되고, lariats (pre-mRNA로부터 접합의 첫 번째 단계에 의해), 심지어 단지 15 초의 라벨링 후에도 생성된다. 약 45 s 내지 1 분 후에, lariats 및 pre-mRNA의 양은 접합에 의해 멀리 처리되는 것과 같이 전사에 의해 생성되는 이 RNA 종의 많은 것과 평형에 도달합니다.
도 3c에 나타낸 데이터를 생성하기 위해 스트레인을 25s에 대해 4tU로 펄스한 다음 우리딘으로 쫓아냈다. 전 mRNA 및 lariats의 생성은 1 분에서 최대에 도달합니다. 이는 그림 3b와잘 비교됩니다. 평형에 도달하기 위해 45 s 후에 달성되는 최대 값과 라벨링의 25 s. 피크 후, 티오 라벨 RNA는 접합 과정을 통해 쫓아로 수준이 감소.
도 3d는 β-est AID 4U 시스템6,7을사용하여 단백질 접합 인자의 고갈 및 RNA 대사에 미치는 영향을 나타낸다. 여기에서, Prp16p는 고갈의 25 분 후에 이 수준의 5%에 가까운 생리적인 수준에서 감소됩니다. Prp16p는 접합15의두 번째 단계에 필수적인 접합 요소입니다. Lariats 접합의 두 번째 단계 동안 제거 (그림3a),하지만 여기 Prp16 제한 되 면 그들은 사전 mRNA의 수준 이상으로 증가. 나중에 고갈 시간에, 그밖 요인은 이차 효력 때문에 제한되고, 그래서 lariat의 수준이 감소하고, pre-mRNA 수준 상승. 접합 된 mRNA의 수준은 감소합니다.
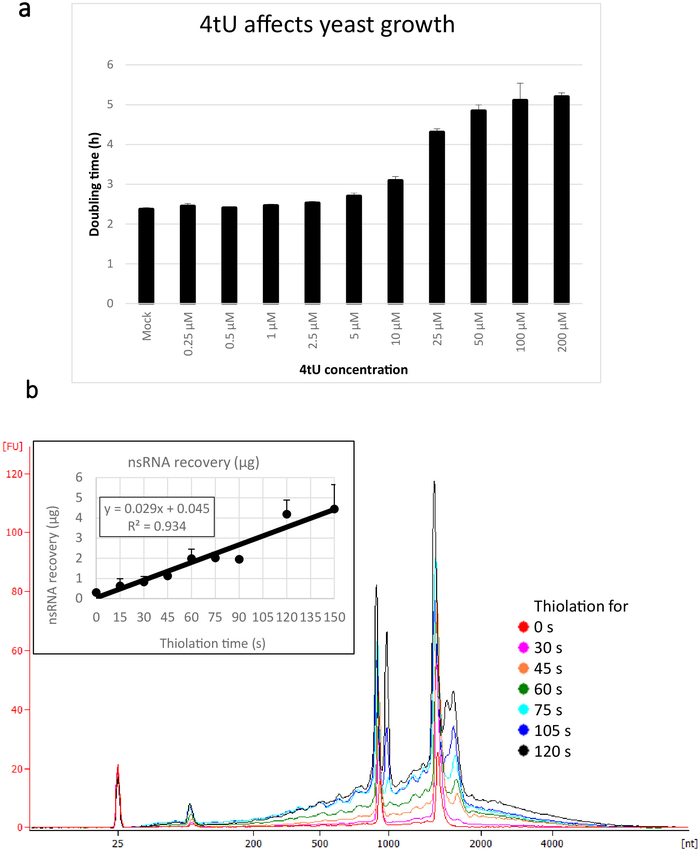
그림 1: 4tU 및 RNA 회복의 성장. (a) 4-티우라실이 성장에 영향을 미칩니다. 우라실 없이 YMM 드롭아웃 성장 배지에서 4tU의 농도를 증가시키면 p4FuiΔPEST 플라스미드를 운반하는 S. 세레비시아(BY4741)의 배가 증가한다. 테칸 인피니트 프로 200에서 30°C에서 4개의 복제 배양물의 성장을 모니터링하였다. 모든 문화는 전체로그 단계에 있었으며 OD600은 0.1에서 0.6 사이였습니다. 모의 객체는 NaOH가 추가된 동등한 양을 가진 제어 문화권이며, 그 자체로 성장률을 변경하지는 않습니다. 이 그래프는 티오 라벨링이 빠른 라벨링과 세포 손상 사이의 타협임을 보여줍니다. 오류 막대는 4개의 복제본의 표준 오류입니다. (b) nsRNA 수율은 약 15초의 라벨링으로부터 선형으로 증가한다. 주요 도면은 15 s 간격으로 4tU를 첨가한 후 0(티오레이트되지 않음)에서 2분까지 정제된 nsRNA의 생체분석기 흔적을 나타낸다. 15s 샘플은 레이블이 지정되지 않은 샘플과 구별할 수 있으므로 표시되지 않습니다. 두 개의 큰 피크는 리보소말 RNA(rRNA)에 해당합니다. rRNA 전구체 및 중간체는 성숙한 rRNAs 보다는 더 중대한 분자량에 몇몇 봉우리로 보입니다. 이러한 전구체 및 중간체의 회복은 시간이 지남에 따라 증가합니다. 하나의 대표적인 실험의 결과가 도시되어 있다. 인세트 그래프는 4tU를 가진 증가인 배양과 nsRNA의 회복을 나타낸다. nsRNA의 수율은 4tU로 성장의 증가 시간으로 증가합니다. 이 실험의 기간 동안 복구는 현저하게 선형(R2 = 0.934)이며 바이오분석기에서 눈으로 표기되지 않은 시료와 구별할 수 없더라도 4tU로 라벨링된 15s에서도 배경에 비해 약간 증가하는 것을 보여줍니다. 추적. 오류 막대는 세 가지 생물학적 복제에 대한 표준 오류를 표시합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
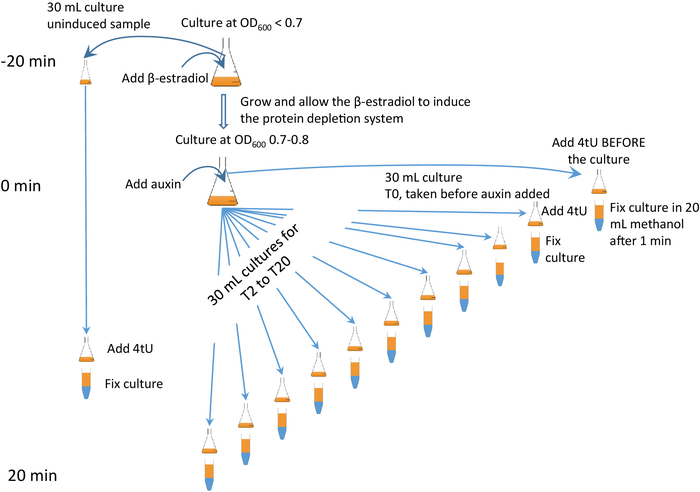
도 2: β-est AID 4U β-est AID 4U 그래픽 프로토콜. β-est AID 4U 프로토콜의 프로토콜에 대한 그래픽 요약. β-estradiol(β-est)은 보조*태그가 지정된 표적 단백질을 고갈시키는 보조인 유도성 투성(AID) 시스템의 발현을 촉진하며, 자세한 프로토콜은 Barrass et al. 7을 참조하십시오. 이 경우, 탈지 계 발현은 단백질 분해가 시작되기 25분 전에 시작되고 각 시점에서 티올레이션은 1분 동안 이다. 애니메이션 된 버전은 추가 그림2에 나타납니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
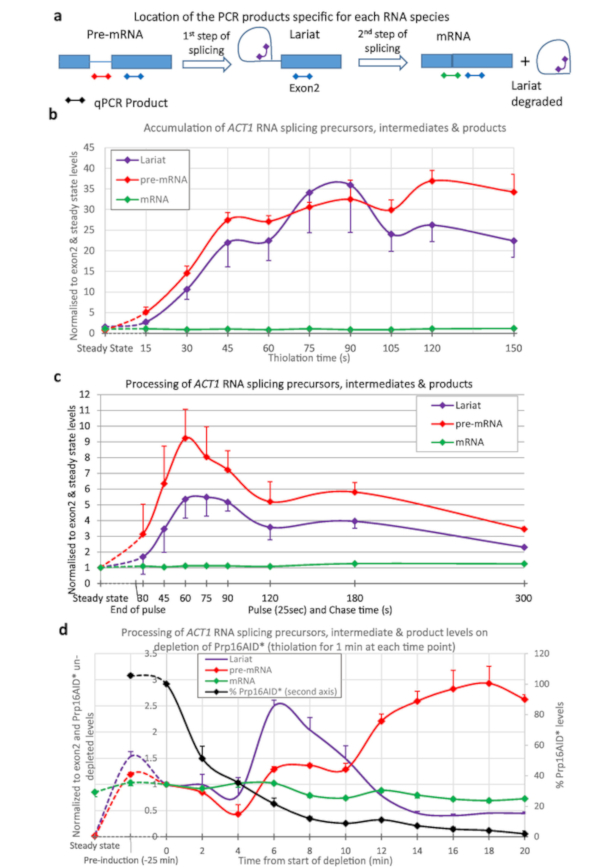
그림 3: ACT1 RNA 접합의 전구체 및 중간체. ACT1 프리-mRNA 전사체의 접합은 정량적 역전사 PCR16에의해 모니터링되었다. ACT1 전구체(pre-mRNA), 중간 lariat-exon2(Lariat) 및 접합 생성물(mRNA)의 수준은 ACT1 Exon2 수준 및 이러한 RNA의 정상 상태 수준에 대해 정규화된 것으로 나타났다. (a) ACT1 성적증명서에 qPCR 제품의 위치. ACT1 전사체 16의 접합 반응의 전구체, 중간체 및 제품의 수준을 분석하는 데 사용되는 qPCR 제품의위치의 회로도. 엑손은 상자, 인트론을 라인으로, qPCR 제품은 양쪽 끝에 다이아몬드가 있는 선으로 표시되며, 색상은 그래프에 사용된 것과 일치합니다. pre-mRNA PCR은 이 제품이 접합의 첫 번째 단계 후에 중단되는 분기점을 가로지르기 때문에 접합의 중간체가 아닌 사전 mRNA에 특이적입니다. Lariat PCR은 접합의 첫 번째 단계의 생성물 및 두 번째 후 생산된 절제된 라리야를 검출합니다. mRNA PCR은 접합, mRNA의 생성물특정이다. 엑시온 PCR의 결과(절제된 라리를 제외한 모든 전구체, 중간체 및 제품에 존재함)는 데이터를 정규화하는 데 사용되었기 때문에 그래프에 나타나지 않으므로 항상 1과 동일합니다. (b) 연속 티오라벨링. 4tU가 전사에 의해 통합됨에 따라 사전 mRNA의 양은 시간이 지남에 따라 증가하고, 짧은 지연 후, 접합은 이를 lariat-exon2 중간 및 접합 된 제품으로 변환합니다. 이 pre-mRNA 와 lariat 종의 수준은 4tU를 가진 성장의 작은 15 s 후에 배경 위에 검출되고 4tU를 가진 연속적인 라벨링의 대략 45 s 후에 최대에 도달하고, 이 시점에서 그들의 생산은 접합된 변환에 의해 균형을 입니다 mRNA 및/또는 저하. 값은 정상 상태(그래프의 왼쪽 부분)로 정규화되고, exon 2 레벨은 엑온 2의 전사와 비교하여 모양과 처리를 표시합니다. ACT1의 RNA 접합은 크게 공동 전사4,17 접합 mRNA가 급속하게 가장 풍부한 종으로, 그 수준은 엑소온 2의 그것과 유사하다. 3개의 생물학적 복제물의 표준 오차, 각각삼중으로 분석. (c) 펄스 / 체이스. 25초의 티올레이션 펄스와 우리딘의 추격. 이러한 RNA(가장 왼쪽 지점)의 정상 상태 수준에 비해 처음에는 새로 합성된 풀에서 매우 풍부합니다. 그들은 mRNA로 처리 될 때 수준은 점차적으로 감소 (또는 저하), 에 의해 정상 상태 수준과 매우 유사한 수준에 접근 5 분. 세 생물학적 복제의 표준 오류, 각각 삼중 분석. (d) nsRNA 및 단백질 고갈. 도2에 기재된 바와 같이 프론 데그론 시스템을 이용하여 Prp16 단백질이 고갈된 후 패널(a)에서와 같이 정량적 역전사 PCR에 의해 모니터링된 ACT1 프리-mRNA 전사체의 스플릭. Prp16 단백질 수준은 또한 보조고갈 전에 레벨의 백분율로 제2 Y축에 대하여 플롯된 그래프에 표시됩니다. Prp16은 스플리세오좀의 중요한 구성 요소이며, 특히 패널(a)에 도시된접합의 제2 단계에 특히 중요하며, 그 후 라리에이트가 분해된다. 이 단계가 제한되면 lariats는 처음에 축적. 나중에 점합이 완전히 실패하면 lariats가 더 이상 생산되지 않고 mRNA 이전 수준이 상승합니다. 오차 바는 3개의 생물학적 복제물의 표준 오차이며, 각각 삼중으로 분석된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
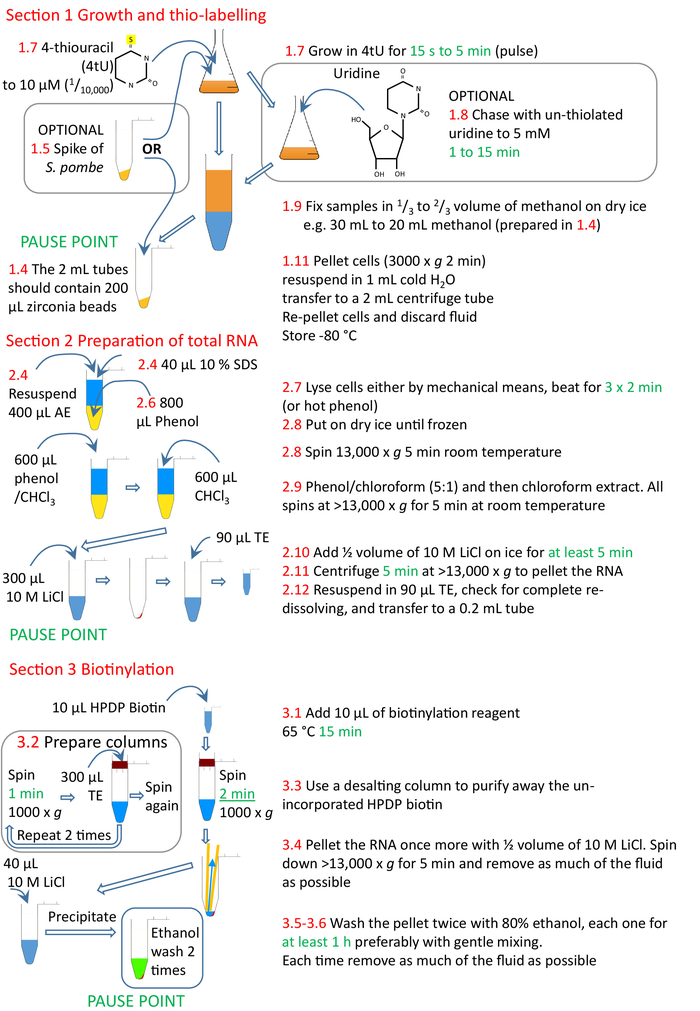
그림 4: 프로토콜 섹션 1에서 3까지의 그래픽 요약. 세포는 4tU로 티오레이되고 RNA내로 변형된 뉴클레오티드를 통합하도록 성장하도록 허용된다. 시간 포인트와 실험에 걸쳐 정규화를 허용하기 위해 thiolated S. pombe 스파이크를 추가할 수 있습니다. 4tU의 펄스는 비티오레이식 소변을 사용하여 추격할 수 있다. 라벨링은 4tU 첨가또는 성장 조건에 대한 변화로부터 연속으로 수행될 수 있으며, 배양 스플릿 및 4tU는 성장 조건 변화로부터 증가하는 시간에 배양에 첨가되지만, 각각의 라벨링은 단지 짧은 시간 동안에만 수행될 수 있다. 상기 세포는 세포로부터 제조된 RNA, 바람직하게는 균질화 및 페놀 계 방법을 사용하여 제조된다. RNA는 크기 배제 컬럼을 사용하여 통합되지 않은 비오틴으로부터 정제된 생체티니틸화된 RNA를 생체화한 후 정제한다. nsRNA는 이제 스트렙타비딘 비드로 정제할 준비가 되었습니다(섹션 4, 그림5). 빨간색 숫자는 프로토콜의 단계 번호와 일치합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
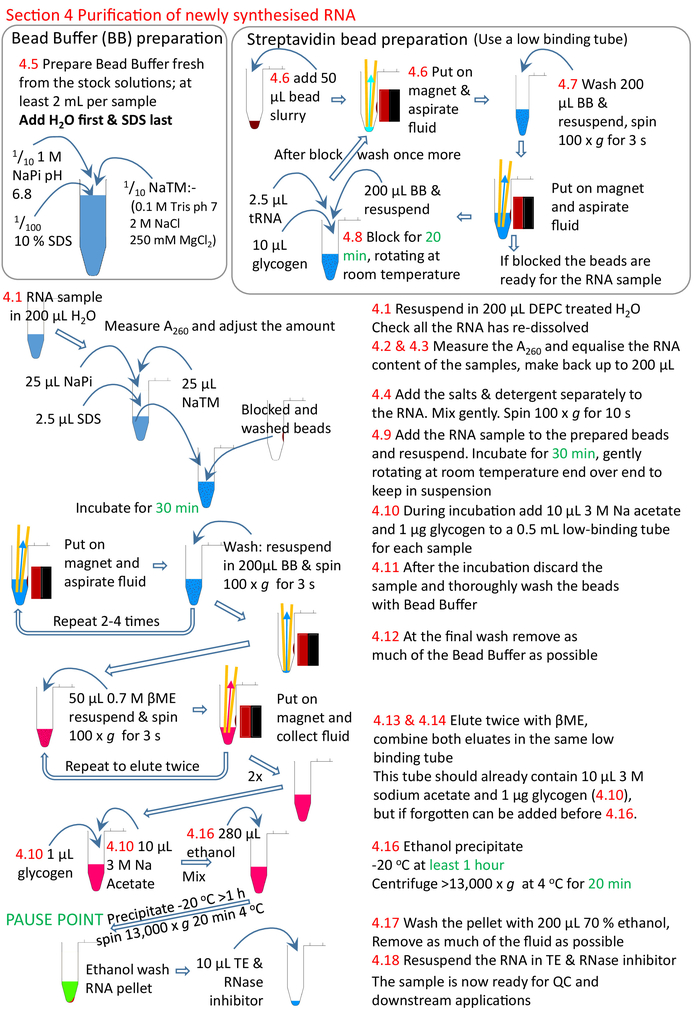
그림 5: 프로토콜 섹션 4의 그래픽 요약. 섹션 1에서 3(그림4)에 따라, 스트렙타비딘 비드가 차단되고 생체 화된 RNA 샘플을 준비된 구슬에 첨가한다. 생체용 RNA는 스트렙타비딘 구슬과 비생체화된 RNA를 제거하고 세척합니다. 생체티니화된 RNA는 βME를 사용하여 구슬로부터 용출되고 추가 연구를 위해 준비되었다. 빨간색 숫자는 프로토콜의 단계 번호와 일치합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 1: 티오 라벨링의 1 및 3 분에서 수입의 추가 사본이 있는 유무에 관계없이 효모 세포에서 nsRNA 회복의개선. Fui1은 2 μm 플라스미드에서 발현된 효모자체 프로모터입니다. 이 유전자의 게놈 사본은 이 긴장의 둘 다에서 나타나. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보조 도 2: β-est AID 4U β-est AID 4U 그래픽 프로토콜의 애니메이션 버전. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 1: 4tU_experiment_template.xltx. 이 파일을 다운로드하려면 여기를 클릭하십시오.
| 플라스미드 이름 | 수입/파마이즈 | 마커 | 코멘트 | |
| p4Fui | S. 세레비시아에 후이1 | 우라3 | Fui1은 우라실과 우리딘을 수입하여 펄스/체이스 실험에 이상적입니다. | |
| pAT2 | S. 세레비시아에 후이1 | 류22 | ||
| p4Fui-ΔPEST | S. 세레비시아에 후이1 | 우라3 | Fui1의 PEST 모티프는 비활성화되었습니다, 그래서 세포의 요구에 충분한 세포 내 우라실이있을 때 permease가 저하되지 않습니다. 라벨링 실험에서 잘 작동하며 펄스/체이스 성능을 향상시킵니다. | |
| p4Fur | S. 세레비시아에 Fur4 | 우라3 | 우라실 파마이즈 | |
| 예페비311 | H. 사피엔스 ENT1 | 류22 | 밀러 외.11. 또한 HSV 티미딘 키나아제 유전자를 함유하고 있습니다. | |
| (평형 뉴클레오시드 수송기) | ||||
| 모든 플라스미드는 2 μm 기초입니다. 모든 p4 플라스미드 및 pAT는 pRS16 시리즈 플라스미드를 기반으로 합니다. FUI1 및 FUR4는 내인성 프로모터로부터 표현됩니다. | ||||
표 1: 이 프로토콜과 함께 사용되는 플라스미드.
토론
이 문서는 매우 신속하고 특정 4tU 라벨링에 대한 프로토콜을 제시, 초기의 회복을위한, 라벨링의 작은 후 S. cerevisiae에서 새로 합성 된 RNA 15 s, 라벨이 없는 RNA에 의해 매우 낮은 오염.
사용자는 항상 차가운 온도와 DEPC 처리 된 시약을 사용하여 RNA의 무결성을 유지하기 위해주의를 기울여야합니다. 스트렙타비딘 비드 정제는 일반적으로 신뢰할 수 있다; 그러나 비드 버퍼는 처리하기가 어렵습니다. 그것은 그것의 구성 요소가 올바른 순서로 추가, 신선하게 만들어야하며, 냉장 또는 오토 클레이브하지. 일반적인 실패는 침전 단계 후에 불완전하게 용해되는 RNA를 포함하고, 그래서 처리 단계 도중 biotinylated 또는 그렇지 않으면 분실되지 않는. 보충 자료에는 광범위한 문제 해결 도움말이 있습니다.
ers4tU에서 알아야 할 몇 가지 제한 사항이 있습니다. 이미 언급 한 것은 4tU효모의 성장이느려졌다는 것입니다(도 1a). 내인성 RNA 9를 제외하고,라벨링 기간 동안 전사 된 RNA 만이이 방법으로 정제 될 수 있습니다. 티올화 시간 내내 유전자에 일시 중지된 폴리머라제는 정제될 수 있는 티오화된 전사체를 생성하지 않지만, 티올화 동안 일시 중지된 상태로 들어가거나 떠나는 중합체로 인해 부분적으로 표지된 전사체는 회수될 수 있다. 돌연변이 또는 성장 조건 때문에 제대로 전사하는 균주는 다른 방법에 비해 nsRNA의 회복을 향상시킬 수 있지만 여기에 사용되는 기술은 거의 nsRNA를 생성하지 않습니다. 이러한 균주 및 조건에서 더 긴 시간 및 증가 된 배양 볼륨이 필요할 수 있습니다. 우라실은 질소의 좋은 소스이며, 그래서이 방법은 질소 기아와 관련된 연구에 사용되기 전에 시험되어야한다.
ers4tU 프로토콜은 수명이 짧은 RNA의 분석에 특히 유용하며, 그 중 상당수는 급격히 저하되어 분해 기계를 손상시키지 않고는 식별할 수 없습니다. 예로는 비밀불안정성 전사체(CUTs)4, 프로모터(PROMPTs) 19로부터의 조기 종단 또는 프로모터 근위정 일시중지 및안티센스 전사 "업스트림"에 의해 생성된 짧은 전사체를 포함한다. 안정한 RNA 종의 처리 도중 생성된 중간체는 또한 일시적이지만 ers4tU전사 4를 사용하여 풍부하게 될 수 있다. ers4tU 프로토콜은 그러므로 다른 방법에 비해 큰 이점인 가까운 생리적 조건 하에서 분석되고 포획되는 높게 과도한 RNA 종을 허용하는 예외적입니다. 이 기술은 정상20보다더 빨리 또는 느리게 길게 하는 RNA 폴리머라제 돌연변이체에서 전사 및 하류 RNA 처리 역학을 연구하는 데 사용되어 왔다.
Thiolation은 또한 RNA-seq 및 SLAM-seq21과호환되므로 매우 짧은 시간 내에 생성된 모든 RNA가 정교한 디테일을 특징으로 합니다.
공개
저자는 공개 할 것이 없다.
감사의 말
이 작품은 JB [104648]에 웰컴 자금 에 의해 지원되었다. 세포 생물학을 위한 웰컴 센터에서 일은 Wellcome 코어 자금 조달 [092076]에 의해 지원됩니다. 저자들은 벨라 모들린, 에마누엘라 사니, 수잔나 드 루카스-아리아스, 샤이니 조지 등 연구실 구성원들의 도움을 인정한다. 저자는 또한 플라스미드 YEpEBI31111에대한 패트릭 크레이머에게 감사하고 싶습니다 .
자료
| Name | Company | Catalog Number | Comments |
| β-mercaptoethanol (βME) | Sigma-Aldrich | M3148 | CAUTION toxic. Stock solutions are aproximatly 14 M, make at 1/20 dilution for use |
| Chloroform | Sigma-Aldrich | 25668 | CAUTION toxic |
| Diethyl pyrocarbonate (DEPC) | Sigma-Aldrich | D5758 | add 1/1000 volume to a solution, leave at room temperature for 24 h, then autoclave |
| DMF (N,N-dimethylformamide) | Sigma-Aldrich | 227056 | CAUTION toxic |
| EDTA | Sigma-Aldrich | 3609 | Make 0.5 M and pH to 8.0 with sodium hydroxide |
| Ethanol | Sigma-Aldrich | 29221 | |
| EZ-link HPDP Biotin | Thermo scientific | 21341 | Store protected from light. Disolve all the vial contents in 22.7 mL DMF (to make a 4 mM stock solution). Store away from water, in the dark & at -20 °C. Check the solution before using, as some batches of HPDP precipitate in storage; heat at 42 °C to resuspend. |
| Glucose | Fisher Scientific | G/0500/60 | |
| Glycogen [20 mg/mL] | Sigma-Aldrich | 10901393001 | Store at -20 °C |
| Immobilised TCEP Disulfide Reducing Gel | Thermo Scientific | 77712 | Optional |
| LiCl | Sigma-Aldrich | 793620 | 10 M solution. CAUTION: this gets very hot as is dissolves and can even boil at greater than 100 oC, add the LiCl crystals to the water slowly. |
| Magnesium chloride (MgCl2) | Sigma-Aldrich | 63033 | 1 M solution. CAUTION: this gets very hot as is dissolves and can even boil at greater than 100 oC, add the MgCl2 crystals to the water slowly. |
| Methanol | Fisher Scientific | M/4000/PC17 | CAUTION Toxic and flammable |
| NaH2PO4 | Sigma-Aldrich | S3139 | Make 1 M solutions of each and mix in equal amount to obtain a solution of the appropriate pH |
| Na2HPO4 | Sigma-Aldrich | S3264 | |
| NaCl | Sigma-Aldrich | S9888-M | 5 M solution |
| Phenol, low pH. | Sigma-Aldrich | P4682 | Store in the dark at 4 °C. CAUTION toxic |
| Phenol Chloroform 5:1 (125:24:1) low pH. | Sigma-Aldrich | P1944 | Store in the dark at 4 °C. CAUTION toxic |
| Pierce Spin Columns | Thermo Scientific | 69702 | Optional |
| SCSM single drop-out –ura | Formedium | DSCS101 | |
| Sodium Acetate | Sigma-Aldrich | 32318-M | Make a 3 M solution and pH to 5.3 with acetic acid |
| Sodium hydroxide | Sigma-Aldrich | 795429 | CAUTION corrosive |
| SDS (Sodium dodecyl sulfate) | Sigma-Aldrich | 436143 | CAUTION irritant, do not inhale |
| Streptavidin Magnetic beads | NEB | 1420S | Store at 4°C |
| SUPERase-In, RNase inhibitor | Life technologies | AM2696 | Store at -20°C |
| Thiolated Schizosaccharomyces pombe for spike | See section 1.7 of the protocol | ||
| 4-thiouracil (4tU) | ACROS ORGANICS | 359930010 | Store in the dark. Make 100 mM Stock in 1M NaOH, store solutions at -20°C. |
| Tris base | Sigma-Aldrich | 93362 | 1 M solutions at various pH |
| tRNA | Sigma-Aldrich | 10109541001 | 5mg/ml, store at -20°C |
| Uridine | Sigma-Aldrich | U3750 | Make 1 M solution in H2O. Split into 2 mL aliquots and store at -20 C. |
| Yeast nitrogen base without amino acids with amonium sulphate | Formedium | CYN0410 | |
| Zeba Columns 0.5ml | Thermo Scientific | 89882 | Store at 4 °C |
| Zirconia beads | Thistle Scientific | 110791052 | |
| Equipment and Consumables | |||
| Beadbeater | Biospec | 112011EUR | Other homogenisers can be used; the correct conditions for each homogeniser and strain must be established. |
| Bioanalyser (Agilent) or similar to assess RNA quality. If this is not important a spectrophotometer is useful to quantify the RNA. | |||
| Centrifuge: capable of spinning cultures at 4 °C and at least 3000 g. Pre-chill if possible. | |||
| Centrifuge: capable of spinning up to 2 mL tubes at variable speeds upto 13,000 g and down to 1000 g | |||
| Magnetic rack for separating the beads from the sample. The one used in the paper is 3D printed, available from Thingiverse (thing:3562952). Comercially available racks exist | |||
| PCR machine with a heated lid that will allow incubation in the dark. | |||
| Rotating wheel to rotate 1.5 mL tubes end over end | |||
| Shaking heating block (such as Eppendorf Thermomixer) is recomended | |||
| Tubes, centrifuge, Low retention, RNase free 0.5mL | Eppendorf | H179467N | |
| Tubes, centrifuge, Low retention, RNase free 1.5mL | Ambion | AM12350 | |
| Tubes, centrifuge, 50 mL | Sarstedt | 62.547.004 | Other centrifuge tubes are not gas proof allowing CO2 to disolve in the methanol, this comes out of solution vigorously on adding warm culture, leading to sample loss |
| Tubes, centrifuge, 15 mL | Sarstedt | 62.554.001 | |
| Tubes, 2 mL, screw cap | Greiner | 723361 | |
| Tubes 0.2 mL strip of 8 with integral lids | Brand | 781332 |
참고문헌
- Duffy, E. E., Schofield, J. A., Simon, M. D. Gaining insight into transcriptome-wide RNA population dynamics through the chemistry of 4-thiouridine. Wiley Interdisciplinary Reviews: RNA. 10 (1), e1513(2018).
- Windhager, L., et al. Ultrashort and progressive 4sU-tagging reveals key characteristics of RNA processing at nucleotide resolution. Genome Research. 22, 2031-2042 (2012).
- Baptista, T., Devys, D. Saccharomyces cerevisiae Metabolic Labeling with 4-thiouracil and the Quantification of Newly Synthesized mRNA As a Proxy for RNA Polymerase II Activity. Journal of Visualized Experiments. (140), e57982(2018).
- Barrass, J. D., et al. Transcriptome-wide RNA processing kinetics revealed using extremely short 4tU labeling. Genome Biology. 16, 282(2015).
- Burger, K., et al. 4-thiouridine inhibits rRNA synthesis and causes a nucleolar stress response. RNA Biology. 10, 1623-1630 (2013).
- Mendoza-Ochoa, G. I., et al. A fast and tuneable auxin-inducible degron for depletion of target proteins in budding yeast. Yeast (Chichester England). 36 (1), 75-81 (2018).
- Barrass, J. D., Mendoza-Ochoa, G. I., Maudlin, I. E., Sani, E., Beggs, J. D. Tuning degradation to achieve specific and efficient protein depletion. Journal of Visualized Experiments. , (2019).
- Hobro, A. J., Smith, N. I. An evaluation of fixation methods: Spatial and compositional cellular changes observed by Raman imaging. Vibrational Spectroscopy. 91, 31-45 (2017).
- Gustilo, E. M., Vendeix, F. A. P., Agris, P. F. tRNA's Modifications Bring Order to Gene Expression. Current Opinion in Microbiology. 11, 134-140 (2008).
- Dolken, L., et al. High-resolution gene expression profiling for simultaneous kinetic parameter analysis of RNA synthesis and decay. RNA. 14, 1959-1972 (2008).
- Miller, C., et al. Dynamic transcriptome analysis measures rates of mRNA synthesis and decay in yeast. Molecular Systems Biology. 7, 458(2011).
- Schmitt, M. E., Brown, T. A., Trumpower, B. L. A rapid and simple method for preparation of RNA from Saccharomyces cerevisiae. Nucleic Acids Research. 18, 3091-3092 (1990).
- Rädle, B., et al. Metabolic Labeling of Newly Transcribed RNA for High Resolution Gene Expression Profiling of RNA Synthesis, Processing and Decay in Cell Culture. Journal of Visualized Experiments. (78), e50195(2013).
- Herzog, V. A., et al. Thiol-linked alkylation of RNA to assess expression dynamics. Nature Methods. 14, 1198-1204 (2017).
- Ohrt, T., et al. Molecular dissection of step 2 catalysis of yeast pre-mRNA splicing investigated in a purified system. RNA. 19, 902-915 (2013).
- Alexander, R. D., et al. RiboSys, a high-resolution, quantitative approach to measure the in vivo kinetics of pre-mRNA splicing and 3′-end processing in Saccharomyces cerevisiae. RNA. 16, 2570-2580 (2010).
- Wallace, E. W. J., Beggs, J. D. Extremely fast and incredibly close: cotranscriptional splicing in budding yeast. RNA. 23, 601-610 (2017).
- Adelman, K., Lis, J. T. Promoter-proximal pausing of RNA polymerase II: emerging roles in metazoans. Nature Reviews Genetics. 13, 720-731 (2012).
- Preker, P., et al. RNA Exosome Depletion Reveals Transcription Upstream of Active Human Promoters. Science. 322, 1851-1854 (2008).
- Aslanzadeh, V., Huang, Y., Sanguinetti, G., Beggs, J. D. Transcription rate strongly affects splicing fidelity and cotranscriptionality in budding yeast. Genome Research. 28, 203-213 (2018).
- Schofield, J. A., Duffy, E. E., Kiefer, L., Sullivan, M. C., Simon, M. D. TimeLapse-seq: adding a temporal dimension to RNA sequencing through nucleoside recoding. Nature Methods. 15, 221-225 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유