Method Article
واحد جزيء Förster الرنين أساليب نقل الطاقة للتحقيق في الوقت الحقيقي من قرار تقاطع هوليداي من قبل GEN1
* These authors contributed equally
In This Article
Summary
يعرض هنا بروتوكول لتنفيذ جزيء واحد Förster نقل الطاقة الرنين لدراسة قرار HJ. يتم استخدام الإثارة بالتناوب بلونين لتحديد ثوابت التفكك. ثم يتم تطبيق smFRET الفاصل الزمني لون واحد في الاختبارات الانقسام في الوقت الحقيقي للحصول على توزيع الوقت يسكن قبل قرار HJ.
Abstract
تقيس الطرق السائبة سلوك المجموعة من الجزيئات، حيث يتم متوسط معدلات التفاعل الفردية للخطوات الأساسية في جميع أنحاء السكان. يوفر نقل الطاقة بالرنين (smFRET) أحادي الجزيء تسجيلًا للتغيرات المطابقة التي تحدثها الجزيئات الفردية في الوقت الحقيقي. ولذلك، smFRET قوية في قياس التغيرات الهيكلية في الإنزيم أو الركيزة أثناء الربط والحفز. يقدم هذا العمل بروتوكولًا لتصوير جزيء واحد للتفاعل بين تقاطع هوليداي رباعي الاتجاه (HJ) وفجوة إندونوكليس الأول (GEN1)، وهو إنزيم إعادة تركيب متجانس دوري. كما تقدم هي لون واحد واثنين من لون بالتناوب الإثارة (أليكس) smFRET البروتوكولات التجريبية لمتابعة قرار HJ من قبل GEN1 في الوقت الحقيقي. يتم تحديد حركية التمهّل GEN1 في HJ، الذي اقترح أن يلعب دوراً رئيسياً في حل HJ وظلت بعيدة المنال حتى الآن. التقنيات الموصوفة هنا يمكن تطبيقها على نطاق واسع للحصول على رؤى ميكانيكية قيمة للعديد من أنظمة الحمض النووي الإنزيم.
Introduction
توفر أساليب جزيء واحد على أساس الكشف عن الفلورة نسب إشارة إلى ضوضاء عالية1. FRET هو تقنية مطيافية يمكن قياس المسافات في نطاق 1-10 نانومتر، مما يجعل هذه التقنية كمسطرة جزيئية لقياس المسافات في نطاق نانومتر2،3. وطيف امتصاص المقبل له تداخل طيفي جزئي مع طيف انبعاثات المانح في نهاية الطول الموجي أقصر. يتم التوسط في فريت من خلال نقل الطاقة أقل من الإشعاع بين المانح وزوج مقبول، في حين أن كفاءة نقل الطاقة تعتمد على المسافة والتوجه من مقبول4.
وقد تم تنفيذ العديد من النهج لتقليل الخلفية وتحسين كفاءة الكشف عن إشارة الفلورة5و6. نهج واحد هو الفحص المجهري البؤري، حيث ثقب يقيد بقعة الإثارة إلى حجم أقل من الحد الانعراج7. وثمة نهج آخر هو الفلورة التأمل الداخلي الكلي (TIRF)، وهو تقنية إضاءة واسعة المجال حيث يتم توجيه الضوء خارج المحور فوق زاوية حرجة8. ثم ينعكس الضوء داخليا تماما في واجهة بين الزجاج والحل المائي، وتوليد موجة المبشرة التي تضيء فقط الفلوروفورتعلق على سطح الزجاج ويمنع الخلفية من الفلوروفور في بقية الحل.
في الفحص المجهري البؤري، يمكن أن تكون الجزيئات إما نشر بحرية أو تعطيل السطح. يمكن أن يكون القرار الزمني الذي تم تحقيقه ضمن ميكروثانية إلى عدة مللي ثانية9. يتم إجراء الكشف البؤري لجزيء واحد بواسطة صمام ثنائي الانهيارات الثلجية أحادي الفوتون (SPAD) والمسح الضوئي نقطة بنقطة من المنطقة ذات الاهتمام10. في TIRF، يتم تسجيل سلسلة زمنية من بضع مئات من الجزيئات المعطلة على السطح بواسطة جهاز كشف ثنائي الأبعاد حساس للموقف مقترن بـ (CCD). وتزيد اتفاقية مكافحة التصحر من إشارة الفلورة إما عن طريق تكثيف شاشة الفوسفور ولوحة القناة الدقيقة أو عن طريق الضرب على رقاقة الإلكترونات الضوئية (EMCCD). القرار الزمني يعتمد على سرعة القراءة وكفاءة الكم من اتفاقية مكافحة التصحر وعادة على ترتيب بضع عشرات من مللي ثانية6.
HJ هو وسيط مركزي في إصلاح الحمض النووي وإعادة تركيب11،12،13،14. HJ اثنين من خيوط عبور مستمرة واثنين من التي تربط بين خيوط مستمرة دون تقاطع بعضها البعض. HJ موجود في الحل كما X-مكدسة المعاقات، والتي تخضع للايزومرات المستمر من قبل خيوط مستمرة تصبح عبور وخيوط عبور تصبح مستمرة في15conformer أخرى. تفضيل أيزومر من HJ يعتمد على التسلسل الأساسي والبيئة الأيونية وقد درست على نطاق واسع من قبل اريت16،17،18،19.
GEN120 هو بروتين أحادي في الحل21 ويتطلب التميّز لشق HJ، مما يسمح بالفصل السليم للخيوط المعاد دمجها22،23. تفضيل التجصيّق للـ HJ يؤثر على نتيجة إعادة التركيب الوراثي من خلال تحديد اتجاه القرار من قبل HJ resolveases24. فهم كيفية ربط GEN1 HJ، وتنسيق الشقين، ويضمن حلها الكامل كانت جميعها تحت دراسة مكثفة21،22،23،25،26 ،27،28،29،30.
في هذه الدراسة، يتم استخدام إنشاء TIRF على أساس موضوعي كما هو موضح سابقا31. يتم تطبيق الإثارة بالتناوب بلونين (ALEX) لتحديد التغيرات المطابقة عند تفاعل GEN1 مع الفلوروفور المسمى HJ. ALEX تنتج 2D الرسوم البيانية على أساس اثنين من المعلمات قياس النسب ة كفاءة E، وهو المانح ة يقبل تعتمد على بعد، والمعلمة stoichiometry S، الذي يقيس stoichiometry المانحة والمقبولة32. اليكس تمكن من فرز الأنواع الفلورية على أساس stoichiometries من الفلوروفورس بما في ذلك المانحين فقط، ومقبول فقط، ومجموعة فرعية مختلطة. ALEX يمكن توسيع نطاق استخدام FRET إلى مجموعة كاملة ويمكن الكشف عن الاختلافات في سطوع الفلوروفور وoligomerization وكذلك رصد التفاعلات جزيء ligand33.
وقد وجد أن GEN1 ينجح باستمرار في حل HJ خلال عمر مجمع GEN1-HJ. وتستمد التغيرات المطابقة المعتمدة على الوقت من آثار الزمن للجزيئات الفردية، في حين أن الرسوم البيانية تمثل توزيع السكان الأساسيين. باستخدام الفاصل الزمني لون واحد FRET، يتم عرض سريع على معدلات وبطء معدلات قبالة لDIMER GEN1، مما يزيد من تقارب ديمر GEN1 تجميعها في المنتج شق الأول.
Protocol
1 - إعداد الأغطية ذات الوظائف السطحية
-
تنظيف
- ضع خمسأغطية تغطية (24 مم × 60 مم) في الإيثانول داخل جرة كوبلين. سونيكات في الإيثانول ثم في 1 M هيدروكسيد البوتاسيوم لمدة 30 دقيقة لمدة 3X. يغسل في الأسيتون 3X ثم decant.
-
[سلّينأيشن]
- إعداد حل من 2.8٪ 3-أمينوبروبيلتريثوكسيسيلين (APTES) في الأسيتون. ختم زجاجة APTES مع فيلم البارافين وتخزينها في 4 درجة مئوية.
ملاحظة: استخدام نظارات السلامة والعمل تحت غطاء محرك الدخان. يجب أن تكون حاوية محلول السيلان جافة تماما ً وتشطف بالأسيتون مباشرة قبل وبعد صب محلول السيلان في الجرة. - صب 70 مل من محلول APTES 2.8٪ في جرة كوبلين التي تحتوي على الأغطية. هز الجرة لمدة 4 دقائق في شاكر المدارية.
- اسمحوا جرة الوقوف على مقاعد البدلاء لمدة 5 دقائق، سونيكات لمدة 1 دقيقة، وأخيرا الحفاظ على جرة على مقاعد البدلاء لمدة 10 دقائق أخرى لsilane للرد مع مجموعات هيدروكسيل على سطح الزجاج.
- إرواء رد الفعل بإضافة 1 لتر من الماء منزوع الأيونات عن طريق صب الماء مباشرة في جرة لتبادل المذيبات السريع. شطف الشرائح 3X في الماء عن طريق هز جانبية من جرة على سطح مستو.
- خذ الأغطية من الجرة ووضعها على صينية رقائق الألومنيوم. تُخبز الأغطية في فرن على حرارة 110 درجة مئوية لمدة 30 دقيقة لتجفيف الأغطية وعلاج السيلين. اترك الدرج على مقاعد البدلاء للأغطية لتبرد إلى درجة حرارة الغرفة.
- إعداد حل من 2.8٪ 3-أمينوبروبيلتريثوكسيسيلين (APTES) في الأسيتون. ختم زجاجة APTES مع فيلم البارافين وتخزينها في 4 درجة مئوية.
-
PEGylation
- قم بتسخين PEG biotinylated وPEG، المخزنة عند -20 درجة مئوية لدرجة حرارة الغرفة (RT) لمنع تكثيف الرطوبة عند فتح الحاوية.
- ضع خمسأغطية مع السطح السيلاي الذي يواجه الصندوق. ضع اثنين من زلات الزجاج غطاء (22 مم × 22 مم) كما الفواصل على طول حواف الأغطية silanized.
- مرة واحدة الاحماء، وجعل حلول PEG وPEG biotinylated بنسبة ~ 1:100 في 1 مل من الطازجة، 0.1 M محلول بيكربونات الصوديوم عن طريق إضافة 1.5 ملغ من PEG biotinylated و 150 ملغ من PEG في أنبوب 1.5 مل.
- دوامة أنبوب لإذابة PEG وتدور إلى أسفل لإزالة فقاعات الهواء.
ملاحظة: المضي قدما من هذه الخطوة، تكون سريعة، لأن PEG تحلل في الحل في غضون مقياس زمني من دقيقة. - بسرعة تطبيق 100 € L من الحل PEG لكل غطاء. خذ غطاء آخر مخبوز وضع سطحه العلوي السيلاي على السطح من الوجه إلى أسفل على رأس غطاء مع حل PEG، وبالتالي تشكيل شطيرة الزجاج الحل الزجاجي الذي 22 مم × 22 مم الأغطية غير silanized تسمح للغطاءين وظيفية اثنين ل أن تكون منفصلة بسهولة.
- احتضان الأغطية بين عشية وضحاها (16 ح) في الظلام وفي RT. بمجرد اكتمال الحضانة، تأخذ الأغطية بعيدا، ثم شطف 10X باستخدام الماء منزوع الأيونات عن طريق الغسيل من الجانب مع زجاجة بخ.
- تجفيف الأغطية تحت تدفق النيتروجين الجاف. تخزين الأغطية الجافة تحت فراغ.
ملاحظة: يمكن استخدام الشرائح لمدة شهر واحد دون تدهور الجودة.
2. إعداد خلية التدفق
-
خلية تدفق أحادية القناة
- حفر اثنين من الثقوب مع قطر 1.22 ملم في الجزء الأوسط من شريحة الكوارتز (50 مم × 20 مم) مع مراكز تقع 37 ملم وعلى حدة و 6.5 ملم من حافة الشريحة(الشكل 1A).
- قطع قناة 41 مم × 2.25 مم إلى قطعة 50 مم × 20 مم من ورقة مزدوجة اللصق باستخدام قاطع إلكتروني.
- قشر قبالة الجانب البلاستيك من الغطاء الواقي ومحاذاة حواف قطعة مع حواف الشريحة الكوارتز. إزالة فقاعات الهواء المحاصرين عن طريق الضغط بلطف مع زوج من ملاقط البولي تترافلوروإيثيلين.
- قشر قبالة الجانب ورقة من قطعة لاصقة. جبل قطعة على سطح وظيفية من غطاء.
- قطع أنابيب البولي ايثيلين (1.22 ملم) في طول 11 سم للمدخل و 25 سم للمنفذ. إدراج أنبوب في الثقوب حفر سابقا كمدخل ومخرج لخلية التدفق.
- استخدام الغراء الايبوكسي 5 دقائق لختم حول حواف واجهة الكوارتز coverslip وحول الأنابيب للمدخل ومخرج.
- استخدام خلية التدفق على الفور بمجرد أن يجف أو تخزين تحت فراغ جاف للاستخدام في وقت لاحق.
- حل أفيدين في PBS إلى تركيز 0.03 ملغ / مل. تصفية من خلال 0.2 ميكرومتر فلتر حقنة.
- تدفق avidin في خلية التدفق باستخدام حقنة 1 مل. استخدام حقنة أخرى مليئة العازلة لغسل avidin الزائدة. يجب الحرص على عدم إدخال فقاعات الهواء أثناء تبادل المحاقن.
-
خلية تدفق متعددة القنوات
- حفر ستة ثقوب بقطر 1.22 ملم على كل من الجانبين الطويلين من شريحة الكوارتز (76 مم × 25 مم)(الشكل 1B). جعل الثقوب 4.5 ملم من حافة الشريحة و9.3 ملم بعيدا. تأكد من المسافة بين مراكز كل زوج حفرة هو 15 ملم.
- قطع ست قنوات (20 مم × 2.25 مم) إلى قطعة 76 مم × 25 مم من شريط مزدوج اللصق باستخدام القاطع الإلكتروني.
- قشر قبالة الجانب البلاستيك من الغطاء الواقي ومحاذاة حواف قطعة لاصقة مع حواف الشريحة الكوارتز. إزالة أي فقاعات الهواء المحاصرين عن طريق الضغط لطيف باستخدام زوج من ملاقط البولي تترافلوروإيثيلين.
- قشر قبالة الجانب ورقة من قطعة لاصقة وجبل على سطح وظيفية من غطاء.
ملاحظة: في بعض الأحيان تقشير قبالة الجانب ورقة وإرفاق الشريحة الكوارتز يعمل بشكل جيد في خلية تدفق متعددة القنوات. - قطع أنابيب مدخل (11 سم) وأنابيب منفذ (25 سم) للقنوات الست. إعداد خلية التدفق كما هو موضح في الخطوات 2.1.6-2.1.9.
- قم بتوصيل منفذ القناة الأولى بالمضخة. ضع مدخل في أنبوب 0.5 مل مع OSS.
ملاحظة: يتم اختيار طول أنبوب مدخل لتحقيق أقصى قدر من الأحداث في تجارب الانقسام التي أجريت تحت تدفق مستمر عن طريق مزامنة الوقت من دخول الإنزيم في خلية التدفق والبدء في التصوير وبالتالي تقليل التبييض الضوئي المبكر لل الفلوروفورس. - الانتقال إلى قناة جديدة عن طريق قطع منفذ القناة المستخدمة. إغلاق منفذ مع المكونات المصنوعة من إبرة حقنة مختومة مع الغراء في الجزء البلاستيك. أغلق مدخل القناة المستخدمة.
3- إعداد نظام مسح الأكسجين (OSS)
- حل 0.2 غرام من (±)-6-هيدروكسي-2,5,7,8-tetramethylchromane-2-carboxylic حمض (ثلاثي الدولة quencher الذي يقلل من وامض من الفلوروفوريس) في 800 ميكرولتر من الميثانول.
- إضافة 6 مل من منزوع الأيونات H2O وإضافة 1 N NaOH قطرة حتى يذوب. تصفية من خلال مرشح حقنة، وجعل في aliquots 1 مل، وتخزينها في -80 درجة مئوية. تركيز المخزون هو ~ 100 درجة مئوية.
- إعداد حل جديد من حمض 3،4-dihroxybenzoic (PCA) عن طريق حل 61 ملغ من مسحوق PCA في 4 مل من ddH2O. تركيز المخزون هو ~ 100 nM.
- إضافة 58 درجة مئوية من 10 N NaOH قطرة، والتأكد من دوامة بعد كل قطرة حتى يتم حل PCA تماما (درجة الحموضة = 9).
- حل 5.3 ملغ من protocatechuate 3,4-dioxygenase (3,4-PCD) في 7 مل من المخزن المؤقت PCD (الجدول 1). 3,4-PCD يزيل الأكسجين من المخازن المؤقتة ملزمة / الانقسام عن طريق تحفيز أكسدة حمض بروتوكاتشويك34.
- تقسيم حل PCD إلى 1 مل aliquots. وتركيز المخزون هو حوالي 1 في المائة.
- إعداد مخزن مؤقت ربط جديد(جدول 1). استبدال 2 M CaCl2 مع 2 MM MgCl2 لتجارب الانقسام smFRET.
- إعداد 1 مل من المخزن المؤقت للتصوير(الجدول 1). الحفاظ على العازلة التصوير على الجليد حتى يتم إدخالها في خلية التدفق للحفاظ على نشاط نظام مسح الأكسجين.
4. إعداد HJs المسمى الفلورسنت
- إعادة تشكيل القلة الليفيلية(الجدول 2)في المخزن المؤقت Tris-EDTA(الجدول 1)بتركيز 100 ميكرومتر.
- إعداد تقاطع الاصطناعية عن طريق خلط أجزاء متساوي ة ~ 3 ميكرولتر من كل من القلة X0 المدرجة في الجدول 1.
- الصلب عن طريق التدفئة في 95 درجة مئوية لمدة 5 دقائق تليها التبريد البطيء إلى RT بمعدل 1 درجة مئوية / دقيقة.
- تحميل الخليط على 8 سم × 8 سم من 10٪ تريس-بورات-EDTA بولياكريلاميد هلام. تطبيق 100 V وتشغيل هلام ل ~ 2 ساعة. وينظر بوضوح العصابات عن طريق العين، ولونها الأرجواني.
- قم باستئصال شريط الركيزة الصلبة بشفرة نظيفة. نقل قطعة هلام في أنبوب الأوتوكلاف 1.5 مل.
- سحق قطعة هلام داخل الأنبوب مع الغطاس نظيفة ثم إضافة 100 درجة مئوية من 200 العازلة(الجدول 1).
- استخراج HJ عن طريق هز الأنبوب في 20 درجة مئوية في 1500 دورة في الدقيقة في خلاط حراري ل ~ 2 ساعة أو حضانة بين عشية وضحاها في 4 درجة مئوية.
- أداء هطول الأمطار الإيثانول على الحل الذي يحتوي على الركيزة35.
- إعادة تعليق الركيزة في 20 μL من المخزن المؤقت TE100(الجدول 1). التركيز النهائي هو 1-3 ميكرومتر Aliquot 2 ميكرولتر في كل أنبوب وتخزينها في -20 درجة مئوية.
5. التعبير عن البروتين وتنقية GEN1
- بناء بلازميد للتعبير عن اقتطاع GEN1 الإنسان1،2،3،4،5 مع مسدس الهيستيدين العلامة في C-تيرمينوس20 بواسطة PCR من ناقلات الدخول.
ملاحظة: وضع علامات N-المحطة الطرفية يؤدي إلى تعطيل GEN1. يجعل ذيل C غير منظم تنقية GEN1 كاملة الطول أصعب بكثير. أيضاً، تم الإبلاغ عن GEN1 طول كامل لإظهار نشاط أقل من اقتطاع الإصدار23. - تحويل ناقلات التعبير إلى E. القولونية BL21-CodonPlus(DE3)-RIPL سلالة.
- تلقيح الخلايا المحولة إلى اثنين من 6 لتر قوارير كل تحتوي على 2 L L من وسائل الإعلام المرق لوريا في 37 درجة مئوية مع هز في 180 دورة في الدقيقة حتى يتم التوصل إلى OD600 من 0.8.
- تهدئة الثقافة إلى 16 درجة مئوية والحث على التعبير GEN1 مع 0.1 m isopropyl-β-d-ثيوغالاكتوبيرانوسيد (IPTG) لمدة 48 ساعة.
- حصاد الخلايا عن طريق الغزل لهم أسفل في 4 درجة مئوية في 1000 × ز في جهاز طرد مركزي. كل لتر من الثقافة تسفر 5–6 غرام من بيليه.
- تخلص من supernatant وresuspend الخلايا الكريات في المخزن المؤقت lysis (الجدول 1)باستخدام 4 مل / غرام من الخلايا.
- قم بإجراء lysis الخلية باستخدام جهاز تعطيل الخلية عند 30 كيلو بتغرام ثم تدور لأسفل عند 10,000 × ز لمدة 1 ساعة عند 4 درجة مئوية. جمع supernatant وتصفيتها على الجليد باستخدام مرشحات 0.45 ميكرومتر.
- قم بتنقية البروتين باستخدام FPLC عن طريق تمرير الفيلترات من خلال عمود Ni-NTA سعة 5 مل بمعدل تدفق يبلغ 2.5 مل/دقيقة باستخدام المخزن المؤقت A(الجدول 1).
- اغسل مع 15 مجلد عمود (السيرة الذاتية). Elute مع التدرج الخطي من المخزن المؤقت A و 500 mMMImidazole أكثر من 20 السيرة الذاتية في 5 mL كسور. GEN1 elutes من العمود في حوالي 100 mMMImidazole.
- ماصة 10 ميكرولتر aliquots من الكسور التي تم جمعها، إضافة حجم متساو من 2X SDS صبغ التحميل إلى كل aliquot. تشويه العينات عن طريق التدفئة في 90 درجة مئوية لمدة 5 دقائق، بارد، وتدور أسفل العينات.
- تحميل العينات على 10٪ بيس تريس هلام. تشغيل هلام لمدة 30-45 دقيقة في 200 V. وصمة عار باستخدام كوماسي الأزرق الرائعة، ثم destain. جمع الكسور التي تحتوي على GEN1 تنقية.
- تقليل تركيز الملح من الكسور مجتمعة إلى 100 mM عن طريق التخفيف باستخدام العازلة C(الجدول 1).
- تمرير البروتين الملح المنخفض من خلال عمود الهيبارين 5 مل بمعدل تدفق 3 مل / دقيقة باستخدام المخزن المؤقت B(الجدول 1).
- اغسل مع 10 السيرة الذاتية Elute باستخدام التدرج من 20 السيرة الذاتية مع المخزن المؤقت B و 1 M NaCl. جمع 5 الكسور مل التي GEN1 elutes حول 360 مل NaCl.
- تحقق من الكسور المنوّقة لكسور GEN1 المنقّاة كما هو موضح في الخطوة 5.8. الجمع بين هذه الكسور وتخفيف إلى 100 مل حمض الانخلال باستخدام المخزن المؤقت C.
- قم بتحميل بروتين الملح السفلي على عمود تبادل الموجبة بمعدل تدفق 1 مل/دقيقة باستخدام المخزن المؤقت B.
- Elute بواسطة تدرج من 40 السيرة الذاتية باستخدام المخزن المؤقت B و 1 M NaCl. جمع 1.7 مل الكسور التي GEN1 elutes حوالي 300 مل NaCl.
- تحقق من نقاء GEN1 في الكسور المنوّقة كما هو موضح في الخطوة 5.8.
- الجمع بين أنقى الكسور وdialyze في 4 درجة مئوية مقابل المخزن المؤقت للتخزين(الجدول 1). إجراء تبادل واحد على الأقل من المخزن المؤقت أثناء غسيل الكلى.
- قياس تركيز البروتين ~ 0.5–1 ملغ / مل. Aliquot البروتين dialyzed في 10-15 حجم ميكرولتر في أنابيب صغيرة، فلاش تجميد في النيتروجين السائل، وتخزينها في -80 درجة مئوية.
6. تجارب وحدة مكافحة التفريق أحادية الجزيء
ملاحظة: يتم تنفيذ تجارب smFRET على إعداد TIRF يستند إلى هدف مخصص(الشكل 1C)الموضحسابقاً 31.
- تجارب FRET أحادية اللون
- تطبيق قطرة واحدة من زيت الغمر على هدف TIRF 100x. تعيين EMCCD لتحقيق مكاسب مناسبة لتحسين الإشارة إلى الخلفية ومنع التشبع.
ملاحظة: لا تنظر مباشرة إلى شعاع الليزر وارتداء نظارات واقية عند محاذاة الليزر. - ضع خلية التدفق بعناية على حامل العينة. رفع الهدف تدريجيا باستخدام التكيف الخشنة حتى يلامس النفط غطاء.
- تشغيل الليزر الأخضر (532 نانومتر). التبديل إلى وضع ضبط غرامة من الهدف. توجيه الانبعاثات إلى منفذ الكاميرا لمراقبة الصورة على الشاشة.
- ضبط ارتفاع الهدف حتى يتم جلب السطح وظيفيا من غطاء في التركيز ويمكن ملاحظتها على الشاشة.
ملاحظة: اكتساب الصورة من قبل EMCCD يؤدي إلى إثارة الليزر عن طريق مرشح قابل للضبط acousto البصرية (AOTF) لمنع تبييض الصور عينة عندما لا يتم الحصول على الصور. - تحقق من أن الخلفية من سطح وظيفية من الأغطية لا تتجاوز بقع قليلة قبل أن تتدفق في HJ المسمى الفلورسنت.
- تمييع الركيزة الأسهم حوالي 1000 مرة في المخزن المؤقت TE100(الجدول 1)إلى تركيز نهائي من 1-5 nM. ماصة 0.2-0.5 ميكرولتر من الركيزة المخففة إلى 120 ميكرولتر من المخزن المؤقت للتصوير مع OSS في أنبوب 0.5 مل.
- قم بتوصيل منفذ خلية التدفق بمضخة الحقنة. أدخل أنبوب مدخل خلية التدفق في أنبوب 1.5 مل وتشغيل مضخة الحقنة بمعدل تدفق 30-50 درجة مئوية /دقيقة لسحب الحل من الأنبوب.
- تحقق في كثير من الأحيان السطح للحصول على تغطية جيدة (100-300 من الركيزة الموزعة بشكل متجانس، ومتباعدة جيدا) عن طريق التصوير لفترة وجيزة مع الليزر الأخضر.
- إذا كانت التغطية السطحية لا تزال غير كافية إما الانتظار لبضع دقائق لHJ المسمى بشكل فلورسنت من الحل لتسوية على السطح أو تكرار الخطوة المتدفقة.
- تدفق آخر 120 درجة مئوية من المخزن المؤقت للتصوير(الجدول 1)في 30-50 درجة مئوية / دقيقة لغسل غير منضم الفلورسنت المسمى HJ. ثم اسمحوا خلية تدفق الجلوس لمدة 5 دقائق للسماح لOSS لاستنفاد الأكسجين المذاب. يجب أن يكون التبييض الضوئي للفلوروفورس الحد الأدنى في بداية التصوير.
- تعيين وقت التعرض (~ 60 مللي ثانية)، سيتم تعيين وقت الدورة تلقائياً بواسطة برنامج يستند إلى سرعة نقل البيانات (~ 104 مللي ثانية)، وتحديد العدد المطلوب من الدورات أو الإطارات (~ 400). يتم تقسيم الانبعاثات من الجهة المانحة (Cy3) ومقبول (اليكسا فلور 647) إلى قناتين ملونتين بواسطة جهاز تقسيم الصورة.
- ابحث عن منطقة مناسبة على السطح، وتركيز الصورة عن طريق ضبط ارتفاع الهدف والسجل وحفظ الفيلم بتنسيق TIFF 16 بت.
- الانتقال إلى منطقة جديدة.
ملاحظة: تحرك دائمًا في اتجاه واحد فقط (أي من منفذ إلى مدخل) لتجنب تصوير نفس المنطقة مرتين. - إعداد 1، 2، 5، 10، 25، 50، 75، و 100 NM GEN1 في 120 ميكرولتر من المخزن المؤقت للتصوير واحد في كل مرة. تدفق الحل بمعدل تدفق من 30-50 درجة مئوية / دقيقة.
ملاحظة: إذا تم إجراء القياس المطلوب تحت حالة ثابتة كما هو الحال في ربط HJ بواسطة GEN1 أو ايزومرات HJ الحرة، ثم انتظر 3-5 دقائق بعد توقف التدفق لتسجيل الفيلم. احصل على ثلاثة إلى أربعة أفلام من مناطق جديدة لكل تركيز من التركيزات من الـ GEN1. - إذا تم إجراء القياس تحت تدفق مستمر كما هو الحال في انشقاق HJ بواسطة GEN1 ثم بدء تسجيل 5-10 ق قبل دخول GEN1 في خلية التدفق. كرر القياس بالانتقال إلى قناة جديدة في خلية التدفق المكونة من ست قنوات.
- في النهاية، استخدم شريحة حبة فلورسنت ثابتة لتعيين جزيئات المتبرع والمقبول لبعضها البعض في جهاز تقسيم الصورة.
- إضافة 0.2 ميكرولتر من حبات الفلورسنت قطرها 1 ميكرومتر إلى 500 درجة مئوية من 1 M Tris (درجة الحموضة = 8.0) للسماح للحبات بالتمسك بالسطح.
- قطع مربع (18 مم × 18 مم) داخل قطعة 22 مم × 22 مم من ختم لاصق على الوجهين. قشر قبالة وعصا قطعة إلى منتصف شريحة الكوارتز 76 مم × 25 ملم.
- ضع 50 ميكرولتر من محلول الخرز المخفف واترك لمدة 5-10 دقائق لتستقر. يُرفق غطاء مقاس 22 مم × 22 مم أعلى القطعة المربعة. الجافة محلول الخرز الزائد مع الأنسجة، ثم ختم الغرفة عن طريق الغراء الايبوكسي.
- الحصول على 100 لقطة من الخرز الشريحة في وقت التعرض 60 مللي ثانية.
تحذير: خفض قوة الليزر والحصول على EMCCD إلى الحد الأدنى لتجنب تشبع الكاشف. - تثبيت حزمة البرامج (على سبيل المثال، TwoTones) وفتح الأفلام فيها كما هو مبين في دليل المستخدم36. حدد مواضع الخرز الفردية في قنوات المتبرعين والمقبولين. إنشاء مصفوفة تحويل كما هو موضح في الدليل.
ملاحظة: يستخدم هذا البرنامج مصفوفة التحويل لمطابقة مواضع الجسيمات في قنوات المانح ة ومقبول ة وتصحيح أي محاذاة طفيفة في جهاز تقسيم الصورة. - انتقل إلى ملف، اضغط على تحميل فيلم، ثم حدد ملف الفيلم واضغط على فتح. في قائمة الملفات، اضغط على تحميل TFORM وحدد مصفوفة التحويل التي تم إنشاؤها من شريحة الخرز. اضبط العتبة للقنوات المانحة ومقبولة حتى لا يتم تضمين أي إيجابيات خاطئة.
- في قائمة تصفية القناة، اختر خيار D&&A لتحديد الجسيمات التي تحمل علامة مع كل من المانح والمقبول. تحقق من أقرب حقل حد الجار لاستبعاد الجزيئات التي هي قريبة جدا من بعضها البعض. تحقق من الهليلتية القصوى لاستبعاد الجزيئات غريب الأطوار جدا والتحقق من حدود العرض لاستبعاد جزيئات واسعة جدا أو ضيقة جدا.
- نوع plotHistCW كما هو موضح في دليل Twotones لبناء الرسوم البيانية.
ملاحظة: يتم حساب كفاءة FRET "الظاهرة" بواسطة البرنامج عن طريق قسمة انبعاث المقبل على إجمالي الانبعاثات من الجهة المانحة ومقبولها. يستخدم Twotones 100 فاصلات لسلة توزيع حالات الجزيئات مقابل كفاءة FRET. - نوع plotTimetraceCW كما هو موضح في دليل Twotones لتوليد آثار الوقت لكل جزيء.
ملاحظة: يمكن تحليل آثار الوقت بشكل أكبر بواسطة vbFRET37 لتحديد حالات FRET مختلفة وأوقات التمركز الخاصة بهم ومعدلات الانتقال بين حالات مختلفة.
- تطبيق قطرة واحدة من زيت الغمر على هدف TIRF 100x. تعيين EMCCD لتحقيق مكاسب مناسبة لتحسين الإشارة إلى الخلفية ومنع التشبع.
- تجارب الإثارة بالتناوب (ALEX) بالتناوب
- تسجيل فيلم يتكون من إطارات متتالية من الانبعاثات المانحة ومقبول عن طريق الإثارة المباشرة مع الليزر الأخضر والأحمر، على التوالي، كل ~ 80 مللي ثانية في المدة.
- فتح أفلام أليكس المكتسبة في Twotones. تعيين عتبة الكشف المناسبة بحوالي 300 للقنوات الثلاث: انبعاث المانحين بسبب إثارة المانحين (DexDem)؛ الانبعاثات المقبولة بسبب الإثارة المانحة (DexAem)؛ وانبعاث مقبول بسبب الإثارة المباشرة (AexAem).
- تطبيق فلتر قناة DexDem&&DexAem&&AexAem لتحديد للجسيمات التي لديها كل من المانح والمقبول. ربط الجسيمات ~ 200-300 في القنوات الثلاث.
- استخدام رمز PLOTHisALEX MATLAB لتوليد الرسوم البيانية أليكس. تناسب قمم مختلفة في الرسوم البيانية لوظائف gaussian وتحديد النسبة المئوية لكل السكان المنطقة تحت منحنى باستخدام برنامج المنشأ38.
ملاحظة: القمم في فحص ملزم تتوافق مع مجمع GEN1-HJ ملزمة، بينما في HJ الحرة، تمثل القمم أيزومرات متداخلة. - استخدم رمز plotTimetraceALEX MATLAB لإنشاء تتبع زمني لكل جزيء يظهر انبعاث المتبرعين عن طريق الإثارة المباشرة، وانبعاثات المقبول بسبب فريت والإثارة المباشرة.
ملاحظة: تتبع اتّزان أليكس بشكل مستقل لإظهار انبعاثات كل من المانح والمقبول، ولكن باستبانة زمنية أقل من FRET أحادية اللون. على غرار FRET لون واحد، يمكن تحليل آثار الوقت أليكس كذلك من قبل vbFRET لتحديد مختلف الدول الحنق وأوقات يسكن كل منها. - تحديد ثابت التفكك عن طريق تركيب النسب المئوية للسكان المنضمين مقابل تركيز GEN1 إلى دالة القطع الزائد.
- الفاصل الزمني لون واحد FRET
- تعيين وقت التعرض من الليزر الأخضر إلى 60 مللي ثانية ودورة الوقت إلى 624 مللي ثانية أو أقل، اعتمادا على سرعة الديناميات الملاحظة.
- تعيين معدل التدفق إلى 110 درجة مئوية / دقيقة في قناة واحدة من خلية تدفق ست قنوات. بدء التسجيل لفترة وجيزة قبل مدخل GEN1 داخل خلية التدفق.
ملاحظة: يؤدي التدفق المستمر إلى تبييض الصور السريع للفلوروفوري، وبالتالي فإن مزامنة بداية التصوير وإدخال البروتين تزيد من عدد الأحداث التي تم التقاطها. تعتمد قراءة مضخة الحقنة المثلى على حجم الأموات والأنابيب الدقيقة المستخدمة لتجميع خلية التدفق. في حالتنا هو ~ 25 ميكرولتر. - الحصول على فيلم من حوالي 125 لقطة لإجمالي وقت الاقتناء من 78 s. في نهاية التسجيل، فضح العينة إلى الليزر الأحمر لمدة 50 إطارا لكل منها مع 25 مللي ثانية وقت التعرض للتحقيق في مقبول.
ملاحظة: هذا الأسلوب يطيل إطار المراقبة في تجربة الانقسام من خلال تقليل عدد دورات الإثارة. المعلمات الحركية كما كعلى وك قبالة من dimerization مشتقة عن طريق تركيب التوزيع لنموذج ثنائي الأسي30،38.
7. التحليل الكهربائي التحول التنقل (EMSA)
- في حجم إجمالي 50 درجة مئوية، واحتضان التركيز المطلوب من GEN1 مع 50 PM Cy5 المسمى HJ في RT لمدة 30 دقيقة في المخزن المؤقت ملزمEMSA(الجدول 1).
- تحميل العينات على 8 سم × 8 سم من 6٪ تريس-بورات-EDTA هلام. تشغيل هلام باستخدام 100 V لمدة 1 ساعة + 20 دقيقة في 1X TBE العازلة في RT.
- تحديد النسبة المئوية للركائز المقيدة بتركيز GEN1 من مساهمتها النسبية في كثافة الفلورة الإجمالية للمسار المعني.
ملاحظة: يتم تحديد GEN1 مونومر-HJ (الفرقة I) من خلال الاتفاق من حجمها مع ربط بيكوميلار من مونومر GEN1 إلى HJ شق21،30. يتم تعيين GEN1-dimer-HJ إلى الفرقة الثانية بسبب الربط التدريجي من مونومر GEN1 إلى HJ21،23. - حساب الثوابت ملزمة واضحة Kد-مونومر-التطبيق-EMSA و Kد-dimer-app-EMSA باستخدام المعادلة:

حيث: ماكس هو التركيز الذي الأنواع المعنية وصلت إلى الحد الأقصى ملزمة (مونومر أو ديمر)؛ n هو معامل التل; كاف د-التطبيق-EMSA هو ثابت ملزم واضح من الأنواع المعنية، مما يدل على تركيز GEN1 الذي نصف الحد الأقصى من مونومر أو dimer موجود.
النتائج
انحياز المُكّن وايزومرات من HJ
وقد تم التحقيق على نطاق واسع من قبل ايزومرات HJ من قبل افريه من خلال وضع العلامات على اثنين من الأسلحة المجاورة من تقاطع17،18،39. يتم وضع المانح (Cy3) ومقبول (اليكسا فلور 647) في الأسلحة المجاورة اثنين، R (حبلا 2) وX (حبلا 3)، على التوالي(الشكل 2A). وقد تم تعيين أيزومرات مكدسة-X من خلال اثنين من خيوط هادمستمر [أي Iso(1,3) أو Iso(2,4)]. يظهر الرسم البياني ALEX FRET من العلامة المجاورة X0 قمتين تتوافقان مع تداخل Iso (1,3) (E ~0.75) وIso (2,4) (E ~0.40)(الشكل 2B).
يتم استخدام FRET لون واحد للحصول على آثار الوقت لتسجيل التغيرات المطابقة السريعة في HJ الحرة مع دقة زمنية عالية ~ 10 مللي ثانية عن طريق الحد من المنطقة المستخدمة من الكاميرا EMCCD2. يظهر تتبع زمني لـ FRET أحادي اللون لتقاطع X0 التحولات بين أيزومرات FRET العالية والمنخفضة(الشكل 2B). وتتفق معدلات أيزوميرك كIso(1,3)-Iso(2,4) وkIso(2,4)-Iso(1,3) التي تم الحصول عليها من المخططات الالهية لوقت الإقامة من Iso(1,3) وIso(2,4)(الشكل 2,4)مع تلك التي تم الإبلاغعنها سابقاً 17.
SMFRET يوضح تشويه نشط للHJ من قبل GEN1
HJ يخضع لإعادة ترتيب الهيكلية على ملزمة لGEN122. وبالتالي، فإن التباعد بين الجهة المانحة ومقبولها مماثل في كل من Iso(1,3) وIso(2,4)(الشكل 3A). تم تنفيذ الاختبارات الملزمة smFRET في وجود Ca2+ لمنع انشقاق HJ. تم الحصول على الرسوم البيانية للتسمية المجاورة X0 تقاطع في تركيزات GEN1 مختلفة من قبل ALEX(الشكل 3B). الرسم البياني يصلح لاثنين من وظائف غاوسي: واحدة المقابلة للحرة عالية ايزو فري فري (1,3)، والآخر المقابلة للسكان GEN1-HJ ملزمة بعد طرح مساهمة Iso(2,4) من ذروة افري منخفضة.
في تركيز GEN1 المشبعة، فإن الرسم البياني للفريت من X0 لديه فقط ذروة منخفضة واحدة من FRET المقابلة لGEN1 ملزمة إما أيزومر من HJ كما هو متوقع من قبل نموذج22. يتم تحديد ثابت تفكك مونومر الظاهر(Kd-monomer-app)من الملاءمة القطعية للنسب المئوية للسكان المرتبطين بـ GEN1 كدالة لتركيز GEN1(الشكل 3C). العلامة المجاورة nk-X0 يمثل نسخة من شق الغناء HJ الذي يحاكي المنتج بعد أول رد فعل شق. بسبب تخفيف سلالة التراص من قبل شق محاكاة، nk-X0 هو هيكل غير ايزوميرة40 كما هو واضح من ذروة الركيزة واحدة في E ~ 0.40، على عكس X0 (الشكل 3D مقابل الشكل 3B). هيكل مجمع GEN1-nk-X0 يشبه هيكل مجمع GEN1-X0، كما يتضح من التشابه في كفاءة FRET (E ~ 0.25 لNK-X0 و 0.32 لX0)(الشكل 3D مقابل. الشكل 3 باء). يتم إظهار الربط القوي من مونومر GEN1 إلى nk-X0 من خلال قيمة Kd-monomer-app أقل من قيمة X0 (الشكل 3E مقابل الشكل 3C). هذا الربط الضيق قد يكون بمثابة آلية حماية ضد القرار غير الكامل للHJ في حالة غير محتملة من تفكك جي إن 1 dimer أو واحدة من monomers لها.
ربط خطوة بخطوة من مونومر GEN1 إلى HJ
ربط مونومر GEN1 إلى HJ تليها تشكيل ديمر هو سمة فريدة من نوعها لeukaryotic HJ resolvease GEN1 مقارنة مع resolveases prokaryotic، والتي توجد في شكل dimeric في الحل21،23،41. EMSA من GEN1 في 50 pM X0 يظهر اقتران stepwise من GEN1 في مجمعات ترتيب أعلى، كما هو مبين من قبل الأرقام الرومانية في اللوحة العليا(الشكل 4A). ثابت التفكك من مونومر GEN1 التي تحددها EMSA(Kد-مونومر-EMSA)يتزامن مع ثابت التفكك من smFRET ملزمة فحص Kد-مونومر التطبيق (الشكل 4A والشكل 3C ، على التوالي). يتم استخدام القياس الكمي للنطاق الثاني لحساب ثابت تفكك التوازن من GEN1 dimer(Kd-dimer-EMSA). EMSA من GEN1 في 50 pM nk-X0 يوضح ربط مونومر بارزة كما هو مبين من قبل منخفضة جدا Kد-مونومر-التطبيق-EMSA الذي هو 30 أضعاف أقل من ذلك من X0، في حين أن Kد-dimer-EMSA هو مماثلة لتلك التي من X0 (الشكل 4B).
مزيد من الأدلة على أن جين 1 مونومر يربط ويشوه HJ هو مراقبة عدد كبير من آثار الجسيمات غير المفكة مع حالة منخفضة مستقرة فريت(الشكل 4C)في وجود ملغ2 + في تركيزات GEN1 منخفضة. وانخفض عدد هذه الآثار عند زيادة تركيز الجين 1. والدافع وراء قرار HJ من قبل ملزمة ضيقة من مونومر GEN1، الذي يدعم تشكيل خافت. ويلاحظ ربط مونومر في آثار الوقت من nk-Xغير متمشيا 0 في ملغ2 +، والذي يمتد حتى تركيز نانومولار قليلة(الشكل 4D). وGEN1 مونومر يربط بإحكام لحماية nk-X0، في نهاية المطاف ضمان القرار الكامل من خلال تشكيل ديمر.
SMFRET قرار التقوله من HJ
يتم استخدام مصطلح "انشقاق" في smFRET الاختبارات بالتبادل مع "قرار" HJ، لأنه في هذا الاستعراض يتم الكشف عن إصدار المنتج الذي يلي الحدث الانقسام الثاني. يتم تسجيل الأحداث عن طريق الإثارة ذات اللون الواحد الفاصل الزمني لتقليل ابيضاض الصور للمقبول الحساس للصور خلال وقت الاكتساب البالغ حوالي 1.3 دقيقة.
يوضح المخطط في الشكل 5A شقوق الخيوط 1 و 3 من X0 Iso(1,3) بعد الربط والتشويه بواسطة GEN1 من X0 تعلق على الزجاج وظيفية. كل من المانح والمقبول الخوض في حل مما يؤدي إلى فقدان إشاراتهم بعد قرار HJ. يتم فصل الشقوق الأولى والثانية في nk-X0، مما يمثل نموذجًا أوليًا للـ HJ الذي تم حله جزئيًا. عند ربط GEN1، NK-X0 يعتمد بنية مماثلة لX0. ويمضي القرار بشق واحد في حبلا 1، كما هو موضح في الشكل 5B.
المغادرة المتزامنة للجهة المانحة ومقبول بعد حالة ضعيفة مستقرة من FRET في آثار حل X0 حدث دون ظهور فريت المتوسطة (E = ~ 0.40) يشير إلى أن القرار الكامل يحدث في غضون عمر GEN1-HJ مجمع(الشكل 5C). لذلك، تشير هذه النتائج إلى أن دقة HJ تحدث داخل عمر المعقدة GEN1-HJ. قرار nk-X0 يمضي أيضا بعد إعادة ترتيب الهيكلية ويختتم برحيل دوبلكس تحمل اثنين من الفلوروفور(الشكل 5D)مماثلة لX0.
حركية DIMERIZATION GEN1 على حرف المونومر GEN1 ملزمة HJ
[تيم-بوونت] يقيس [سّفرت] [ت][ب]-انشقاق أيّ في الدّرجة الأولى يتضمّن الوقت يتطلّب ل [ديمر] تشكيل والقرار من ال [هج] بعد التشويه ب [جن1] [مونومر]. وتطبيقاً لهذه التقنية، تقدم أدلة مباشرة لدعم الادعاء بأن تشكيل اخافت مطلوب لحل كل من X0 وnk-X0،لأن توزيع الـ"تي"قبل الانقسام يعتمد على التركيز في GEN1.
يتم تعريف المعدل الظاهر لقرار HJ(كالتطبيق)على أنه معكوس لمتوسط الانقسامقبل الانقسام في تركيز GEN1 المعني. يُستخدم مصطلح "الظاهر" لوصف معدل قرار HJ، حيث لا يمكن استبعاد إمكانية أن يظل GEN1 مرتبطًا بالمنتج بعد قرار HJ.
تعكس وظائف كثافة الاحتمال (PDF) لتوزيعات X0 (الشكل 6A)وقت تشكيل الديمر، وهو أطول عند تركيزات GEN1 منخفضة، ثم أقصر في تركيزات GEN1 الأعلى. يتم تحديد معدلات الاقتران والتفكك لdimer، كعلى ديمر وكقبالة ديمر،على التوالي، من نموذج ثنائي الأسي30. أيضا، ملفات PDF من nk-X0 (الشكل 6B)تظهر توزيع مماثل إلى X0 مما يشير إلى الحاجة إلى تشكيل dimer.
تم تركيب مؤامرةالتطبيق كمقابل تركيز GEN1 إلى وظيفة القطع الزائد. الثوابت معدل الحفز واضح(كماكس التطبيق)من X0 و nk-X0 هي 0.107 ± 0.011 ق-1 و 0.231 ± 0.036 ق-1، على التوالي(الشكل 6C). المؤامرات منالتطبيق كلX0 و NK-X0 تقاطعات تتقاطع في تركيز GEN1 ~ 5.6 nM بسبب أسرع كماكس التطبيق وأبطأ كعلى dimer من nicked مقارنة مع تقاطع سليمة.
وباختصار، فإن kسريع نسبياعلى dimer وبطيئة كقبالة ديمر يؤدي إلى تقدم رد الفعل إلى الأمام نحو قرار HJ بمجرد تشكيل dimer. الربط القوي من مونومر GEN1 إلى تقاطع nk-X0 يشكل آلية آمنة من الفشل ضد أي انشقاق الثاني إحباط غير المحتمل أو يساعد على التقاط أي HJs غير محلولة بشكل غير كامل تركتها مسارات القرار الأولية في الخلية.
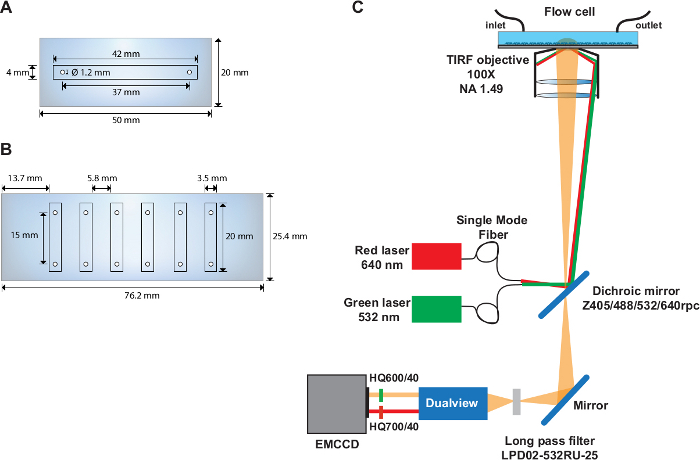
الشكل 1: خلايا تدفق أحادية ومتعددة القنوات وتخطيط الإعداد البصري.
(أ)مخطط خلية التدفق أحادية القناة. (B)مخطط خلية التدفق المكونة من ست قنوات. (C)تخطيط الإعداد البصري الذي يصور مصادر الإثارة، هدف TIRF، مرآة ثنائية الانعكاسية المثبتة داخل مكعب الفلتر، وفلاتر الانبعاثات المستخدمة في جهاز تقسيم الصورة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: التحيز المُعَرِّف والأيزومرات في HJ التي لاحظتها اِريت.
(أ)ايزومرات مطابقة X-مكدسة X للتسمية المجاورة التي تحمل اسم "الخيوط المستمرة". يتم ترقيم خيوط، في حين يتم الإشارة إلى الأسلحة بالرسائل. يتم عرض مواقع الشق بالأسهم. ويشار إلى مواقف الجهة المانحة (الخضراء) والمقبولة (الحمراء) والتغيير في فريت عند ايزومرات. (B)اللوحة اليمنى: فريت تتبع الوقت (أسود) ومثالية تتبع فريت (أحمر) من X0 في 50 مليون متر حجم2+. اللوحة اليسرى: الرسم البياني للالحنق من X0 في 50 مل ملغ2+. وترد أدناه كثافة الفلورة للجهة المانحة (الخضراء) ومقبول (أحمر). (ج)تم تركيب الرسوم البيانية الزمنية للتسمية المجاورة X0 Iso(1,3) وIso(2,4) على وظائف أحادية الأس ية لتحديد معدلات أيزومرات. وتشير الشكوك إلى الفاصل الزمني للثقة بنسبة 95%. تم تعديل هذا الرقم من المؤلفات المنشورة سابقا30.
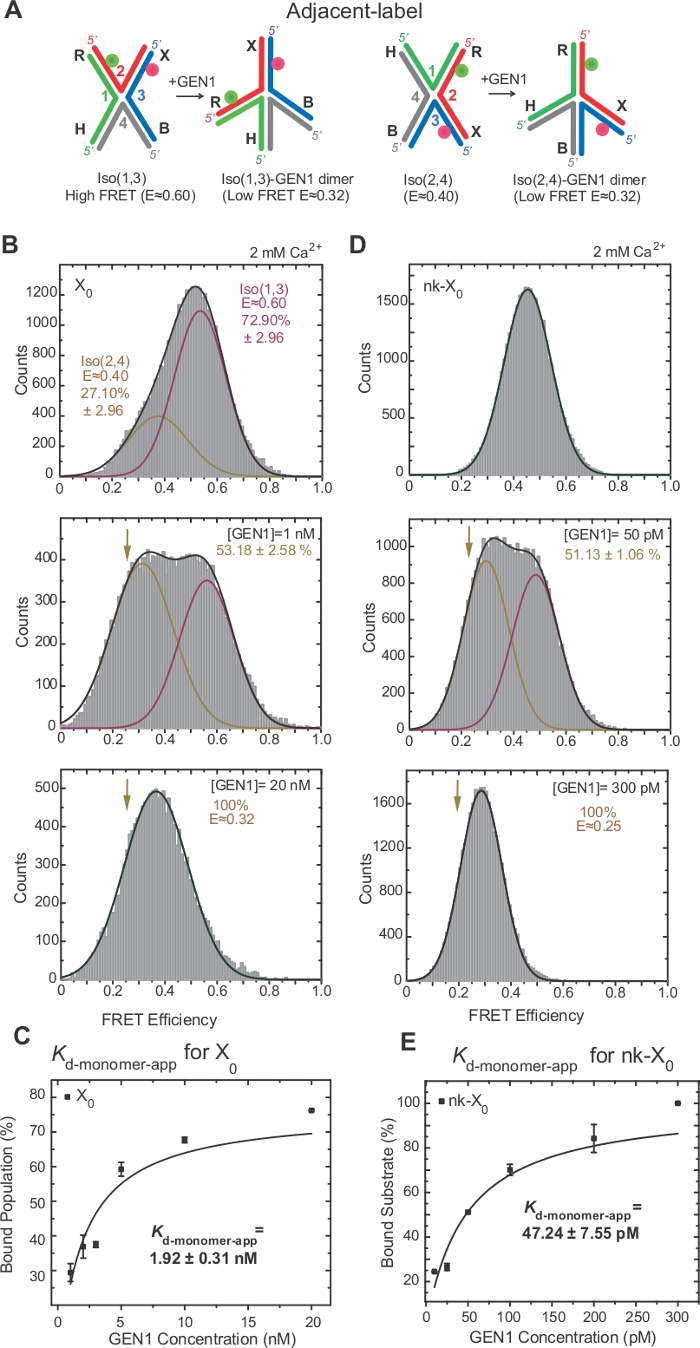
الشكل 3: التشويه النشط للHJ بواسطة GEN1.
(أ)التعديل الهيكلي للتسمية المجاورة HJ على أساس النموذج المقترح22. (B)ALEX FRET الرسم البياني للتسمية المجاورة X0 لديه ذروة عالية كبيرة للفريت (E = ~ 0.6) المقابلة لIso (1,3) وانخفاض ذروة فريت (E = ~ 0.4) لIso (2,4). ويناسب الرسم البياني بأكمله وظيفتين من وظائف غاوسية: إحداهما تقابل الـ FRET (1,3) العالية الحرة، والأخرى تقابل السكان المقيدين ناقص المساهمة الأولية للإيسو (2,4) في مجموع السكان. (C)يتم تحديد ثابت تفكك مونومر الظاهر(Kd-monomer-app)من نوبة مفرطة من النسب المئوية للسكان المرتبطة بـ GEN1 كدالة لتركيز GEN1. (D)رسوم بيانية للتسمية المجاورة nk-X0 بتركيزات مختلفة من GEN1. يماثل المنطقة تحت ال [فريت] منخفضة ([إ] =~0.25) [غوسّين] إلى النسبة مئويّة من ال ال السّكان يحدّ. (E)يتم تحديد Kd-monomer-التطبيق من nk-X0 من تناسب القطع الزائد من السكان المرتبطة GEN1. تمثل أشرطة الخطأ الانحرافات المعيارية من تجربتين أو أكثر. تم تعديل هذا الرقم من المؤلفات المنشورة سابقا30. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: الربط التدريجي لـ GEN1 بـ HJ.
(أ)تحليل التحول التنقل الكهربائي (EMSA) من GEN1 في 50 pM X0. اللوحة العلوية: تشير الأرقام الرومانية إلى عدد مونومرات GEN1 في المجمع. اللوحة السفلى: ربط مونومر GEN1 إلى X0. تم الحصول على ثوابت التفكك الظاهر من نوبة السينية للأنواع المعنية وتمثل متوسط تجربتين. (B)EMSA من GEN1 في 50 pM nk-X0 يوضح ربط مونومر بارزة كما هو مبين من قبل منخفض جدا Kد-مونومر-التطبيق-EMSA. (C)FRET تتبع الوقت من ملزمة ولكن غير متمشيا المجاورة التسمية X0 في ملغ2 +. تم تنفيذ الإثارة المانحة لمدة 1.3 دقيقة~ ، تليها الإثارة المباشرة للقبول (المنطقة الوردية المظللة). (D)FRET تتبع الوقت من ملزمة ولكن غير مفك المجاورة التسمية nk-X0 في ملغ2 +. تم تعديل هذا الرقم من المؤلفات المنشورة سابقا30. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: SMFRET تحليل القرار من HJ.
(أ)مخطط التسمية المجاورة X0 Iso(1,3) بعد التشويه بواسطة GEN1. يتم إرفاق الركيزة إلى السطح وظيفية عن طريق الربط البيوتين / أفيدين. يؤدي تفكك GEN1 بعد الشقين إلى فقدان كل من المتبرع والمقبول الذي يذهب إلى الحل. (B)التخطيطي ة من القرار من المجاورة التسمية nk-X0 عن طريق شق حبلا 1. (C)تتبع الوقت (أسود) في 2 MM ملغ2 + من انشقاق Iso (1,3). يشكل ظهور ربط GEN1 حالة حالة ضعيفة مستقرة حتى يتم فقدان إشارة FRET فجأة بسبب الانقسام. وفي المقابل، فإن الزيادة في عدد المتبرعين وانخفاض كثافة الفلورة المقبولة عند ربط GEN1 يعقبها الاختفاء المتزامن للفلورة من كلا الأصباغ عند الانقسام. (D)وبالمثل، يظهر تتبع الوقت من nk-X0 حالة ضعيفة مستقرة للخروج من الاتحاد عند ربط GEN1 والتي يتم إبرامها من خلال فقدان مفاجئ لإشارة FRET. تم تعديل هذا الرقم من المؤلفات المنشورة سابقا30. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: حركية DIMERIZATION GEN1 على حرف المونومر منضم إلى GEN1 HJ.
(أ)توضح رسم دالة كثافة الاحتمال (PDF) لتوزيع X0 قبل الانقسام اعتمادها على تركيز GEN1. تم الحصول على أوقات يسكن من حالة فريت منخفضة (تقبل الانقسام)في تركيز GEN1 ذات الصلة من اثنين أو أكثر من التجارب وتستخدم للحصول على متوسط معدلات (كالتطبيق). يتم تحديد معدلاتالتطبيق كالمدرجة من معكوس متوسطقبل الانقسام في تركيز GEN1 ذات الصلة. يتم حساب الجمعية(كعلى dimer)والتفكك(كقبالة ديمر)معدلات لتشكيل ديمر من نموذج ثنائي الأسي38. تمثل الأخطاء SEM منالتطبيق ك. (ب) مؤامرة PDF من توزيعات قبلالانقسام من nk-X0 ومعدلاتالتطبيق كالمعنية. (C) مؤامرة منالتطبيق كمقابل تركيز GEN1 المجهزة لوظيفة القطع الزائد لتحديد معدل الحفاز الظاهر(كماكس التطبيق). مؤامرة منالتطبيق كلX0 و nk-X0 يوضحأسرع التطبيق كالأولية من X0 التي يتم تجاوزها بعد ذلك من قبل nk-X0 أعلاه [GEN1] ~ 5.6 nM. تم تعديل هذا الرقم من المؤلفات المنشورة سابقا30. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| المخزن المؤقت | التركيب | ||
| المخزن المؤقت للربط | 40 m Tris-HCl pH 7.5, 40 m M NaCl, 2 m CaCl2,1 mDTT, 0.1% BSA و 5% (v/v) الجلسرين | ||
| المخزن المؤقت A | 20 m Tris-HCl درجة الحموضة 8.0، 1 MDTT و 300 مل NaCl | ||
| المخزن المؤقت B | 20 m Tris-HCl درجة الحموضة 8.0، 1 MDTT و 100 مل NaCl | ||
| المخزن المؤقت C | 20 m Tris-HCl درجة الحموضة 8.0 و 1 mM DTT | ||
| المخزن المؤقت للانشقاق | 40 m Tris-HCl pH 7.5, 40 mM NaCl, 2 m MMgCl2,1 mM DTT, 0.1% BSA and 5% (v/v) الجلسرين | ||
| المخزن المؤقت لربط EMSA | 40 m Tris-HCl pH 7.5, 40 mM NaCl, 1 mDTT, 2 m CaCl2,0.1 mg/ml BSA, 5% (v/v) الجلسرين و 5 نانوغرام/ميكرول بولي-دي-دي سي | ||
| المخزن المؤقت للتصوير (الربط) | 40 ميكرولتر (±)-6-هيدروكسي-2،5،7،8-تيتراميثيلكرومان-2-كاربوكسيليك حمض (4 μM)، 60 ميكرولتر PCA (6 nM)، 60 ميكرولتر PCD (60 nM) و 840 ميكرولتر من العازلة ملزمة | ||
| المخزن المؤقت للتصوير (انشقاق) | 40 ميكرولتر (±)-6-هيدروكسي-2،5،7،8-تيتراميثيلكرومان-2-كاربوكسيليك حمض (4 μM)، 60 ميكرولتر PCA (6 nM)، 60 ميكرولتر PCD (60 nM) و 840 ميكرولتر من المخزن المؤقت للانشقاق | ||
| اللليس العازلة | 20 m Tris-HCl pH 8.0, 10 mm β-mercaptoethanol, 300 mM NaCl و 2 mM PMSF | ||
| المخزن المؤقت لتخزين الـ PCD | 100 m Tris-HCl درجة الحموضة 7.5، 1 mM EDTA، 50 مل KCl و 50٪ الجلسرين | ||
| المخزن المؤقت للتخزين | 20 m Tris-HCl pH 8.0, 1 mM DTT, 0.1 mM EDTA, 100 mNaCl و 10% الجلسرين | ||
| المخزن المؤقت TBE | 89 m Tris-HCl, 89 m حمض البوريك و 2 mM EDTA | ||
| المخزن المؤقت TE100 | 10 m Tris.HCl pH 8.0 و 100 mM NaCl | ||
| مخزن تريز-إدتا المؤقت | 50 m Tris-HCl درجة الحموضة 8.0 و 1 mM EDTA درجة الحموضة 8.0 | ||
الجدول 1: قائمة المخازن المؤقتة وتركيباتها المستخدمة في هذه الدراسة.
| اليغو | تسلسل | ||
| X0-st1 | ACGCTGCCGAAtCTACCAGTGCCTTGCTAGGACATCTTT | ||
| X0-st2 | GGGTGAACCTGGTGTG/iCy3/AAAGGTCCATGTGTGTAATCGTGTGTGTGTGTGTGT | ||
| X0-st3 | ACGGCATAAAGCTTGACGA/iAF647-dT/TACACAGATGGTGTGTAGAGGATGGACTATCG | ||
| X0-st4 | 5'البيوتينCGATAGTCGGCCTCACTCCATGTGTAGCAAGGCACTGGGTAATATGT | ||
| X0- أدج | X0-st1, X0-st2, X0-st3 & X0-st4 | ||
| X0In_st2 | GGGTGAACCGGTGTAAGAAGATATCCATCTGTGTAATCGTGTGTGTGTGT | ||
| X0In_st4 | 5'البيوتينCGATAGTCGGCCTCACTCCATGTGTAGCAAGGA/iCy3/TGGTAGAATTCGGCGT | ||
| Nk-X0 | X0-st1, X0-st2, X0-nk3a, X0-nk3b & X0-st4 | ||
| X0- nk3a | ACGGCATAAAGCTTGACGA/iAF647-dT/TACACAGATC | ||
| X0- nk3b | ATGGAGCTGTAGAGGATGACTATCG | ||
الجدول 2: ركائز SMFRET وEMSA HJ. قائمة oligonucleotides المستخدمة لإعداد HJs المسمى الفلورسنت لsmFRET وEMSA. تم الحصول على القلة تجاريا. وكانت القلة التي تحمل علامة الفلورسنت نقية HPLC، وعند الإمكان، تم تنقية القلة من ≥ 60 bp.
Discussion
في هذه الدراسة، تم تنفيذ تقنيات smFRET مختلفة لتحديد حركية قرار HJ من قبل GEN130. وقد استخدمت نهج smFRET مماثلة لمتابعة متطلبات مطابقة الحمض النووي رفرف مزدوج والانقسام من قبل النسخ المتماثل الحمض النووي وإصلاح رفرف endonuclease 142،43،44. هنا، تتم مناقشة الخطوات الهامة في هذا البروتوكول. يجب أن يكون رد فعل السيلان خالية من أي أثر للرطوبة. يجب تطبيق حل البيغيليشن بسرعة على الزجاج السيلاني بمجرد حل PEG لتجنب التحلل المائي. في خلية التدفق متعددة القنوات، يجب إزالة أي هواء محاصر في ورقة لاصقة لتجنب التسرب بين القنوات المجاورة. وينبغي أن يكون الحل PCA أعدت حديثا لأنه يتأكسد مع مرور الوقت. إضافة 10 N NaOH ينبغي أن يكون قطرة، مع دوامة في ما بين. يجب أن تكون خلفية الفلورة في غطاء الحد الأدنى قبل أن تتدفق HJ المسمى الفلورسنت. يجب إجراء التصوير في خلية التدفق في اتجاه واحد لتجنب تصوير المناطق المبيضة. في تجارب ALEX، يجب تقليل قوة الليزر الأحمر لتجنب التبييض السريع للمقبول. في تجارب الفاصل الزمني، يجب أن يكون وقت الدورة أقصر من أسرع حدث.
smFRET هو تقنية حساسة التي يمكن أن توفر رؤى قيمة في الوقت الحقيقي في التفاعلات الجزيئية الحيوية. ومع ذلك، فإن هذه الطريقة لديها العديد من التحديات التقنية، من بينها تحقيق تغيير قابل للقياس في فريت أثناء التفاعل البيوكيميائي. هذا ضروري للحصول على ميزات منفصلة بشكل جيد في الرسوم البيانية والدول المميزة في آثار الزمن. في كثير من الحالات، يتطلب smFRET تصميم دقيق للركائز، واختيار أزواج الفلوروفور ومواقفهم، وتضخيم التغييرات في حالة نقص في الحمض النووي في الركيزة بسبب التغييرات الهيكلية قليلا في الركيزة45. نهج آخر لأداء FRET هو استخدام البروتينات المسماة46. ويقتصر نافذة المراقبة في فريت من قبل استقرار مقبول مثل Cy5 أو اليكسا فلور 647 الذي يميل إلى التبييض بسرعة أكبر من المانح (Cy3 في هذه الحالة). لذلك، يتطلب الاتحاد البحث المستمر عن الفلوروفوريس مستقرة لتمديد مدة التجربة والجهود المبذولة لتطوير أنظمة مسح الأكسجين لإطالة إشارة الفلورة وتعظيم نسبة الإشارة إلى الضوضاء47،48 .
من بين النصائح لاستكشاف الأخطاء وإصلاحها في smFRET هو موازنة العديد من المعلمات المشاركة في التصوير مثل قوة الليزر، ووقت التعرض، ووقت الدورة، وعدد من الدورات لتحقيق أقصى قدر من الانبعاثات الفلورية، وإطالة مدة التجربة، وتحقيق الفواصل الزمنية المناسبة لأخذ العينات لديناميات الإنزيم. تعد أوقات المراقبة والآثار الأدنى من تبييض الصور ضرورية للحصول على توزيعات وقت الجلوس عالية الدقة التي تمثل ديناميات الإنزيم. ALEX يولد أفضل الرسوم البيانية منذ هذا الأسلوب يخضع لمساهمات أقل من الجسيمات الضوئية بالمقارنة مع FRET لون واحد. ومع ذلك، الدقة الزمنية في ALEX أقل من ذلك في FRET لون واحد.
وأخيراً، فإن تركيز smFRET على الكشف عن التغيرات المطابقة/الهيكلية في الجزيئات الفردية في الجسور في الوقت الحقيقي الفجوة بين التقنيات الهيكلية عالية الدقة (أي التصوير البلوري بالأشعة السينية، والرنين المغناطيسي النووي، والمجهر الإلكتروني)، الذي يوفر التفاصيل الهيكلية الدقة الذرية في ظل ظروف ثابتة والأساليب السائبة التي تسفر عن متوسط الفرقة من خاصية قابلة للقياس. في العديد من الجوانب، وقد ثبت smFRET أن تكون تقنية قوية لدراسة النظم البيولوجية في الوقت الحقيقي.
Disclosures
ولا يعلن صاحبا البلاغ عن أي مصالح مالية متنافسة.
Acknowledgements
وقد تم دعم هذا العمل من قبل جامعة الملك عبد الله للعلوم والتكنولوجيا من خلال التمويل الأساسي وجائزة البحوث التنافسية (CRG3) إلى S.M. H.
Materials
| Name | Company | Catalog Number | Comments |
| (±)-6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid (Trolox) | Sigma-Aldrich | 238813 | |
| 0.1 M sodium bicarbonate buffer | Fisher | 144-55-8 | |
| 10 % Novex Tris-Borate-EDTA gel | Thermo Fisher Scientific | EC6275BOX | |
| 100 X TIRF objective | Olympus | NAPO 1.49 | |
| 3,4-dihroxybenzoic acid (PCA) | Sigma-Aldrich | P5630 | |
| 3-aminopropyltriethoxysilane (APTES) | Sigma-Aldrich | 741442 | |
| 6% Novex Tris-Borate-EDTA gel | Thermo Fisher Scientific | EC6265BOX | |
| Adhesive sheet | Grace bio-labs | SA-S-1L | |
| Benchtop refrigerated centrifuge | Eppendorf | Z605212 | |
| Biotin-PEG | Laysan Bio | Biotin-PEG-SVA 5000 | |
| Bovine Serum Albumin (BSA) | New England Biolabs | B9001S | |
| Calcium Chloride Dihydrate | Sigma-Aldrich | 31307 | |
| cation exchange column | GE healthcare | MonoS (4.6/100) | |
| Cell distruptor | Constant Cell Disruption System | TS5/40/CE/GA | |
| Coomassie Brilliant Blue | MP Biomedicals | 808274 | |
| Cy3 emission filter | Chroma | HQ600/40M-25 | |
| Cy5/Alexa Fluor 647 emission filter | Chroma | HQ700/40M-25 | |
| Dichroic for DV2 filter cube | Photometrics | 630dcxr-18x26 | |
| Dithiothreitol (DTT) | Thermo Scientific | R0861 | |
| Drill | Dremel | 200-1/21 | |
| Electronic cutter | Copam | CP-2500 | |
| EMCCD camera | Hamamatsu | C9100-13 | |
| Epoxy glue | Devcon | 14250 | |
| FPLC Aktapurifier UPC 10 | GE Healthcare | 28406268 | |
| GelQuant.NET software | biochemlabsolutions.com | Version 1.8.2 | |
| GEN1 entry vector | Harvard plasmid repository | HSCD00399935 | |
| Glycerol | Sigma Life Science | G5516 | |
| green laser (emission 532 nm) | Coherent | Compass 315M-100 | |
| Heparin column | GE healthcare | HiTrap Heparin column | |
| HEPES | BDH | BDH4162 | |
| Image splitter | Photometrics | Dualview (DV2) | |
| Imidazole | Sigma-Aldrich | I2399 | |
| Inverted microscope | Olympus | IX81 | |
| Isopropyl-ß-D-thiogalactoside (IPTG) | Goldbio. | 12481C100 | |
| Laser scanner | GE healthcare | Typhoon Trio | |
| LB Broth | Fisher Scientific | BP1426-500 | |
| Long pass 532nm filter | Semrock | LPD02-532RU-25 | |
| Magnesium Chloride | Sigma Life Science | M8266 | |
| mPEG | Laysan Bio | mPEG-SVA 5000 | |
| Neutravidin | Pierce | 31000 | |
| Ni-NTA column | GE healthcare | HisTrap FF | |
| NuPAGE 10% Bis-Tris gels | Novex Life technologies | NP0301BOX | |
| NuPAGE 10% Bis-Tris Protein Gels | Thermo Fisher Scientific | NP0302PK2 | |
| Origin software | OriginLab Corporation | Version 8.5 | |
| Phenylmethylsulfonyl fluoride (PMSF) | Alexis Biochemicals | 270-184-G025 | |
| Phosphate-buffered saline | GIBCO | 14190 | |
| Polyethylene Tubing (I.D. 0.76 mm O.D. 1.22mm) | Fisher (Becton Dickinson) | 427416 | |
| Protocatechuate 3,4-dioxygenase (3,4-PCD) | Sigma-Aldrich | P8279-25UN | |
| Quad-band dichroic | Chroma Inc | Z405/488/532/640rpc | |
| red laser (emission 640 nm) | Coherent | Cube 640 100C | |
| Sodium Chloride | Fisher Chemical | S271 | |
| Sorvall RC-6 plus centrifuge | Thermo Fisher Scientific | 46910 | |
| Spectrophotometer | Thermo Fisher Scientific | Nanodrop 2000 | |
| Syringe pump | Harvard Apparatus | 70-3007 | |
| Teflon tweezers | Rubis | K35A | |
| Tris Base | Promega | H5135 | |
| Ultracentrifuge | Beckman Coulter | Optima L-90K | |
| Ultrafiltration membrane | Millipore | UFC90300 |
References
- Moerner, W. E., Fromm, D. P. Methods of single-molecule fluorescence spectroscopy and microscopy. Review of Scientific Instruments. 74 (8), 3597-3619 (2003).
- Ha, T. Single-molecule fluorescence resonance energy transfer. Methods. 25 (1), 78-86 (2001).
- Weiss, S. Fluorescence spectroscopy of single biomolecules. Science. 283 (5408), 1676-1683 (1999).
- Stryer, L. Fluorescence energy transfer as a spectroscopic ruler. Annual Review of Biochemistry. 47, 819-846 (1978).
- Roy, R., Hohng, S., Ha, T. A practical guide to single-molecule FRET. Nature Methods. 5 (6), 507-516 (2008).
- Walter, N. G., Huang, C. Y., Manzo, A. J., Sobhy, M. A. Do-it-yourself guide: how to use the modern single-molecule toolkit. Nature Methods. 5 (6), 475-489 (2008).
- Conchello, J. A., Lichtman, J. W. Optical sectioning microscopy. Nature Methods. 2 (12), 920-931 (2005).
- Axelrod, D. Total internal reflection fluorescence microscopy in cell biology. Methods in Enzymology. 361, 1-33 (2003).
- Kim, H. D., et al. Mg2+-dependent conformational change of RNA studied by fluorescence correlation and FRET on immobilized single molecules. Proceedings of the National Academy of Sciences of the United States of America. 99 (7), 4284-4289 (2002).
- Lee, T. H., et al. Measuring the folding transition time of single RNA molecules. Biophysical Journal. 92 (9), 3275-3283 (2007).
- Holliday, R. Mechanism for Gene Conversion in Fungi. Genetical Research. 5 (2), 282-304 (1964).
- West, S. C., et al. The Formation and Resolution of Holliday Junctions during the Recombinational Repair of DNA Damages. Journal of Cellular Biochemistry. , 269-269 (1995).
- Cox, M. M., et al. The importance of repairing stalled replication forks. Nature. 404 (6773), 37-41 (2000).
- West, S. C. Molecular views of recombination proteins and their control. Nature Reviews: Molecular Cell Biology. 4 (6), 435-445 (2003).
- Duckett, D. R., et al. The structure of the Holliday junction, and its resolution. Cell. 55 (1), 79-89 (1988).
- Clegg, R. M., et al. Fluorescence resonance energy transfer analysis of the structure of the four-way DNA junction. Biochemistry. 31 (20), 4846-4856 (1992).
- McKinney, S. A., Declais, A. C., Lilley, D. M., Ha, T. Structural dynamics of individual Holliday junctions. Nature Structural Biology. 10 (2), 93-97 (2003).
- Joo, C., McKinney, S. A., Lilley, D. M., Ha, T. Exploring rare conformational species and ionic effects in DNA Holliday junctions using single-molecule spectroscopy. Journal of Molecular Biology. 341 (3), 739-751 (2004).
- Hyeon, C., Lee, J., Yoon, J., Hohng, S., Thirumalai, D. Hidden complexity in the isomerization dynamics of Holliday junctions. Nature Chemistry. 4 (11), 907-914 (2012).
- Ip, S. C., et al. Identification of Holliday junction resolvases from humans and yeast. Nature. 456 (7220), 357-361 (2008).
- Rass, U., et al. Mechanism of Holliday junction resolution by the human GEN1 protein. Genes & Development. 24 (14), 1559-1569 (2010).
- Liu, Y., et al. Crystal Structure of a Eukaryotic GEN1 Resolving Enzyme Bound to DNA. Cell Reports. 13 (11), 2565-2575 (2015).
- Chan, Y. W., West, S. GEN1 promotes Holliday junction resolution by a coordinated nick and counter-nick mechanism. Nucleic Acids Research. 43 (22), 10882-10892 (2015).
- van Gool, A. J., Hajibagheri, N. M., Stasiak, A., West, S. C. Assembly of the Escherichia coli RuvABC resolvasome directs the orientation of holliday junction resolution. Genes & Development. 13 (14), 1861-1870 (1999).
- Lee, S. H., et al. Human Holliday junction resolvase GEN1 uses a chromodomain for efficient DNA recognition and cleavage. eLife. 4, (2015).
- Chan, Y. W., West, S. C. Spatial control of the GEN1 Holliday junction resolvase ensures genome stability. Nature Communications. 5, 4844(2014).
- Liu, Y., Freeman, A. D., Declais, A. C., Lilley, D. M. J. A monovalent ion in the DNA binding interface of the eukaryotic junction-resolving enzyme GEN1. Nucleic Acids Research. 46 (20), 11089-11098 (2018).
- Zhou, R., et al. Junction resolving enzymes use multivalency to keep the Holliday junction dynamic. Nature Chemical Biology. 15 (3), 269-275 (2019).
- Bellendir, S. P., et al. Substrate preference of Gen endonucleases highlights the importance of branched structures as DNA damage repair intermediates. Nucleic Acids Research. 45 (9), 5333-5348 (2017).
- Sobhy, M. A., et al. Resolution of the Holliday junction recombination intermediate by human GEN1 at the single-molecule level. Nucleic Acids Research. 47 (4), 1935-1949 (2019).
- Sobhy, M. A., et al. Versatile single-molecule multi-color excitation and detection fluorescence set-up for studying biomolecular dynamics. Review of Scientific Instruments. 82 (11), 113702(2011).
- Kapanidis, A. N., et al. Fluorescence-aided molecule sorting: analysis of structure and interactions by alternating-laser excitation of single molecules. Proceedings of the National Academy of Sciences of the United States of America. 101 (24), 8936-8941 (2004).
- Lee, N. K., et al. Accurate FRET measurements within single diffusing biomolecules using alternating-laser excitation. Biophysical Journal. 88 (4), 2939-2953 (2005).
- Rashid, F., et al. Initial state of DNA-Dye complex sets the stage for protein induced fluorescence modulation. Nature Communications. 10 (1), 2104(2019).
- Sambrook, J., Russell, D. W. Standard ethanol precipitation of DNA in microcentrifuge tubes. Cold Spring Harbor Protocols. 2006 (1), (2006).
- Holden, S. J., et al. Defining the limits of single-molecule FRET resolution in TIRF microscopy. Biophysical Journal. 99 (9), 3102-3111 (2010).
- Bronson, J. E., Fei, J., Hofman, J. M., Gonzalez, R. L. Jr, Wiggins, C. H. Learning rates and states from biophysical time series: a Bayesian approach to model selection and single-molecule FRET data. Biophysical Journal. 97 (12), 3196-3205 (2009).
- Kou, S. C., Cherayil, B. J., Min, W., English, B. P., Xie, X. S. Single-molecule Michaelis-Menten equations. Journal of Physical Chemistry B. 109 (41), 19068-19081 (2005).
- Clegg, R. M., Murchie, A. I., Lilley, D. M. The solution structure of the four-way DNA junction at low-salt conditions: a fluorescence resonance energy transfer analysis. Biophysical Journal. 66 (1), 99-109 (1994).
- Pohler, J. R., Duckett, D. R., Lilley, D. M. Structure of four-way DNA junctions containing a nick in one strand. Journal of Molecular Biology. 238 (1), 62-74 (1994).
- Fogg, J. M., Lilley, D. M. Ensuring productive resolution by the junction-resolving enzyme RuvC: large enhancement of the second-strand cleavage rate. Biochemistry. 39 (51), 16125-16134 (2000).
- Sobhy, M. A., Joudeh, L. I., Huang, X., Takahashi, M., Hamdan, S. M. Sequential and multistep substrate interrogation provides the scaffold for specificity in human flap endonuclease 1. Cell Reports. 3 (6), 1785-1794 (2013).
- Rashid, F., et al. Single-molecule FRET unveils induced-fit mechanism for substrate selectivity in flap endonuclease 1. eLife. 6, e21884(2017).
- Zaher, M. S., et al. Missed cleavage opportunities by FEN1 lead to Okazaki fragment maturation via the long-flap pathway. Nucleic Acids Research. 46 (6), 2956-2974 (2018).
- Didenko, V. V. DNA probes using fluorescence resonance energy transfer (FRET): designs and applications. BioTechniques. 31 (5), 1106-1116 (2001).
- Toseland, C. P. Fluorescent labeling and modification of proteins. Journal of Chemical Biology. 6 (3), 85-95 (2013).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An oxygen scavenging system for improvement of dye stability in single-molecule fluorescence experiments. Biophysical Journal. 94 (5), 1826-1835 (2008).
- Swoboda, M., et al. Enzymatic oxygen scavenging for photostability without pH drop in single-molecule experiments. ACS Nano. 6 (7), 6364-6369 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved