Method Article
HOLLIday Kavşak Çözünürlüğünün GEN1 Tarafından Gerçek Zamanlı İncelenmesi için Tek Moleküllü Förster Rezonans Enerji Transfer Yöntemleri
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada sunulan HJ çözünürlüğü çalışma için tek moleküllü Förster rezonans enerji transferi gerçekleştirmek için bir protokoldür. Dissosilasyon sabitlerini belirlemek için iki renkli alternatif uyarma kullanılır. Tek renkli zaman atlamalı smFRET daha sonra HJ çözünürlüğünden önce çalışma süresi dağılımını elde etmek için gerçek zamanlı dekolte tahlillerinde uygulanır.
Özet
Toplu yöntemler, altta yatan adımların bireysel tepki oranlarının popülasyon genelinde ortalama olduğu moleküllerin topluluk davranışını ölçer. Tek moleküllü Förster rezonans enerji transferi (smFRET) tek tek moleküller tarafından gerçek zamanlı olarak meydana gelen konformasyonel değişikliklerin kaydını sağlar. Bu nedenle, smFRET bağlama ve kataliz sırasında enzim veya substrat yapısal değişiklikleri ölçmede güçlüdür. Bu çalışma, sitozolik homolog rekombinasyon enzimi olan dört yönlü Holliday kavşağı (HJ) ve gap enonukleaz I (GEN1) etkileşiminin tek moleküllü görüntülemesi için bir protokol sunmaktadır. Ayrıca sunulan tek renkli ve iki renkli alternatif uyarma (ALEX) smFRET deneysel protokolleri gerçek zamanlı OLARAK GEN1 tarafından HJ çözünürlüğünü takip etmek. GEN1 dimerization kinetiği HJ, HJ çözümünde önemli bir rol oynadığı öne sürülmüştür ve şimdiye kadar zor kalmıştır belirlenir. Burada açıklanan teknikler, birçok enzim-DNA sisteminin değerli mekanistik görüşlerini elde etmek için yaygın olarak uygulanabilir.
Giriş
Floresan algılamaya dayalı tek moleküllü yöntemler yüksek sinyal-gürültü oranları sağlar1. FRET, 1-10 nm aralığındaki mesafeleri ölçebilen spektroskopik bir tekniktir ve bu tekniği nanometre aralığındaki mesafeleri ölçmek için moleküler bir cetvel olarak işleyen2,3. Kabul edenin emilim spektrumu, daha kısa dalga boyu ucunda donörün emisyon spektrumu ile kısmi bir spektral çakışma vardır. FRET bir donör ve kabul çifti arasında radyasyonsuz enerji transferi aracılık, enerji transferi verimliliği ise mesafe ve kabul eden4yönünü bağlıdır.
Arka planı en aza indirmek ve floresan sinyalinin algılama verimliliğini artırmak için çeşitli yaklaşımlar uygulanmıştır5,6. Bir yaklaşım konfokal mikroskopi, hangi bir iğne deliği kırınım sınırı7altında bir boyuta uyarma nokta kısıtlar. Diğer bir yaklaşım ise, ışığın kritik biraçının üzerinde eksen dışına yönlendirildiği geniş alan aydınlatma tekniği olan toplam iç yansıma floresansıdır (TIRF). Işık daha sonra tamamen iç cam ve sulu çözelti arasındaki arayüze yansıtılır, sadece cam yüzeyine bağlı floroforlar aydınlatır ve geri kalanı floroforlardan arka plan önler bir evanescent dalga üreten çözüm.
Konfokal mikroskopide moleküller serbestçe difüzyon veya yüzey immobilize edilebilir. Ulaşılan zamansal çözünürlük birkaç milisaniye9mikrosaniye içinde olabilir. Tek bir molekül için konfokal algılama tek foton çığ diyot (SPAD) ve ilgi bölgesinin nokta-by-nokta tarama10tarafından gerçekleştirilir. TIRF'de, yüzeyde hareketsiz hale getirilen birkaç yüz molekülden oluşan bir zaman serisi, pozisyona duyarlı iki boyutlu bir yük dedektörü (CCD) ile kaydedilir. CCD, floresan sinyalini ya yoğun fosfor ekranı ve mikrokanal plakası ya da fotoelektronların çip üzerinde çoğalması (EMCCD) ile güçlendirir. Zamansal çözünürlük, CCD'nin okuma hızına ve kuantum verimliliğine bağlıdır ve genellikle birkaç onmilisaniyelik6.
HJ DNA onarım ı ve rekombinasyon11,12,13,14merkezi bir ara. HJ'nin birbirine kesişmeden sürekli iplikçikler arasında birbirine bağlanan iki sürekli ve iki geçiş ipliği vardır. HJ x-yığılmış konforplar olarak çözüm var, sürekli iplikçikler geçiş olma ve geçiş iplikçikleri diğer conformer15sürekli hale tarafından sürekli izomerizasyon geçmesi . HJ izomer tercihi çekirdek sırası ve iyonik ortama bağlıdır ve yoğun FRET16,17,18,19tarafından incelenmiştir.
GEN120 çözeltisi21 monomerik bir proteindir ve hj cleave dimerization gerektirir, böylece yeniden birleştirilmiş iplikçiklerin uygun ayrılmasına izin22,23. HJ istifleme conformer tercihi HJ resolvases24tarafından çözünürlüğün yönünü ayarlayarak genetik rekombinasyon sonucunu etkiler. GEN1'in HJ'yi nasıl bağdaştirdığını, iki kesiyi nasıl koordine ettiği ve tam çözüme kavuşturulur şekilde anlaşılması yoğun bir çalışma altında dır21,22,23,25,26 ,27,28,29,30.
Bu çalışmada, daha önce31olarak açıklandığı gibi objektif tabanlı TIRF kurulumu kullanılır. Gen1'in HJ etiketli florofor ile etkileşimi üzerine konformasyonel değişiklikleri belirlemek için iki renkli alternatif uyarma (ALEX) uygulanır. ALEX iki oranmetrik parametreleri FRET verimliliği E, donör-kabul eden mesafe bağımlı ve stokiyometri parametre S, donör-kabul eden stokiyometri32ölçer dayalı 2D histogramlar üretir. ALEX, floresan türlerin sadece donör, sadece kabul eden ve karışık alt popülasyonlar da dahil olmak üzere floroforların stokiyometries dayalı sıralama sağlar. ALEX, FRET kullanımını tüm menzile kadar genişletebilir ve florofon parlaklığı ve oliomerizasyon farklılıklarını tespit edebilir ve makromolekül-ligand etkileşimlerini izleyebilir33.
GEN1'in HJ'yi gen1-HJ kompleksinin ömrü boyunca çözmede sürekli olarak başarılı olduğu saptandı. Zamana bağlı konformasyonel değişimler tek tek moleküllerin zaman izlerinden türetilirken, histogramlar altta yatan popülasyonların dağılımını temsil eder. Zaman atlamalı tek renkli FRET kullanılarak, GEN1 dimer için hızlı hızlar ve yavaş off-rates gösterilmiştir, bu da ilk kesi ürününde monte edilmiş GEN1 dimer'in afiyetini artırır.
Protokol
1. Yüzey işlevselleştirilmiş kapakların hazırlanması
-
Temizleme
- Coplin kavanozun içine etanol içine beş kapak (24 mm x 60 mm) yerleştirin. 3x için 30 dakika için 1 M potasyum hidroksit sonra etanol sonicate. Aseton 3x sonra decant yıkayın.
-
Silanizasyon
- Aseton %2.8 3-aminopropyltrietoksisilane (APTES) çözeltisi hazırlayın. APTES şişesini parafin filmle kapatın ve 4 °C'de saklayın.
NOT: Güvenlik gözlüğü kullanın ve duman başlığı altında çalışın. Silane çözeltisinin kabı tamamen kuruolmalı ve silane çözeltisi kavanoza dökülmesinden hemen önce ve sonra aseton ile durulanmalıdır. - %2,8'lik APTES çözeltisinin 70 mL'ini kapaklı kapakları içeren Coplin kavanozuna dökün. Bir orbital shaker 4 dakika için kavanoz sallayın.
- Kavanoz 5 dakika için bankta standı, 1 dakika için sonicate, ve son olarak cam yüzeyinde hidroksil grupları ile reaksiyona silane için başka bir 10 dakika için bankta kavanoz tutun.
- Hızlı çözücü değişimi için doğrudan kavanoza su dökerek 1 L deiyonize su ilavesi ile reaksiyonu söndürün. Düz bir yüzeyüzerinde kavanozun yansal sallayarak slaytlar 3x suda durulayın.
- Kapakları kavanozdan çıkarın ve alüminyum folyo tepsiye yerleştirin. Kapakları 110 °C'de 30 dk pişirip kapakları kurutun ve silane'yi iyileştirin. Kapak kapaklarının oda sıcaklığına kadar soğuması için tepsiyi tezgahta bekletin.
- Aseton %2.8 3-aminopropyltrietoksisilane (APTES) çözeltisi hazırlayın. APTES şişesini parafin filmle kapatın ve 4 °C'de saklayın.
-
PEGiletion
- -20 °C'de oda sıcaklığında (RT) depolanan biyotinylated PEG ve PEG'i ısıtın ve kabı açtıktan sonra nem yoğuşmasını önleyin.
- Bir kutunun üzerine bakan silanized yüzeyi ile beş kapakları yerleştirin. İki kapaklı cam fişini (22 mm x 22 mm) silanize kapakların kenarlarıboyunca boşluk olarak yerleştirin.
- Isındıktan sonra, 1 mL taze, 0,1 M sodyum bikarbonat çözeltisi 1,5 mg biyotinylated PEG ve 150 mg PEG 1,5 mL tüpe ~ 1:100 oranında biyotinylated PEG ve PEG çözeltileri yapın.
- Peg çözmek ve hava kabarcıkları kaldırmak için aşağı spin için tüp Girdap.
NOT: Bu adımdan itibaren hızlı olun, çünkü PEG çözeltide min bir zaman ölçeği içinde hidrolize eder. - PEG çözeltisinin 100 μL'sini her coverslip'e hızlıca uygulayın. Başka bir pişmiş kapak slip alın ve peg çözeltisi ile kapağın üstüne üst silanized yüzeyi yüz aşağı yerleştirin, böylece 22 mm x 22 mm silanized coverlips iki fonksiyonel coverlips izin bir cam çözeltisi cam sandviç oluşturan kolayca ayrılabilir.
- Kapakları bir gecede (16 saat) karanlıkta ve RT'de kuluçkaya yatırın. Kuluçka tamamlandıktan sonra, kapakları ayırın, sonra bir fışkırtma şişesi ile yandan yıkayarak deiyonize su kullanarak 10x durulayın.
- Kapakları kuru nitrojen akışı altında kurutun. Kuru kapakları vakum altında saklayın.
NOT: Slaytlar kalite bozulması olmadan 1 ay boyunca kullanılabilir.
2. Akış hücresinin hazırlanması
-
Tek kanallı akış hücresi
- Bir kuvars kaydıranın orta kısmında 1,22 mm çapında iki delik (50 mm x 20 mm) bulunan merkezler 37 mm arayla ve 6,5 mm kaydıraktan(Şekil 1A)alın.
- 41 mm x 2,25 mm'lik bir kanalı, elektronik bir kesici kullanarak 50 mm x 20 mm'lik çift yapışkanlı bir sac parçasına kesin.
- Koruyucu kapağın plastik tarafını soyun ve parçanın kenarlarını kuvars kaydırağının kenarlarıyla hizalayın. Bir çift politetetrafloroetilen cımbızla hafifçe bastırarak kapana kısılmış hava kabarcıklarını çıkarın.
- Yapışkan parçanın kağıt tarafını soyun. Parçayı kapak kaymasının işlevselleştirilmiş yüzeyine monte edin.
- Polietilen boruyu (I.D. 1.22 mm) giriş için 11 cm, çıkış için 25 cm'lik bir uzunluğa kesin. Tüpü, akış hücresi için giriş ve çıkış olarak önceden delinmiş deliklere yerleştirin.
- Kuvars kapaklı arayüzün kenarlarına ve giriş ve çıkış için tüplerin etrafına sızdırmak için 5 dk epoksi tutkal kullanın.
- Daha sonra kullanmak için kuruyan veya kuru vakum altında depolayın hemen akış hücresi kullanın.
- PBS'deki avidini 0.03 mg/mL konsantrasyonuna kadar eritin. 0,2 μm şırınga filtresiüzerinden süzün.
- 1 mL şırınga kullanarak akış hücresine avidin akışı. Aşırı avidin yıkamak için tampon dolu başka bir şırınga kullanın. Şırıngaları değiştirirken hava kabarcıklarını tanıtmamaya dikkat edin.
-
Çoklu kanal akış hücresi
- Bir kuvars kaydıranın uzun kenarlarının her birine 1,22 mm çapında altı delik (76 mm x 25 mm)(Şekil 1B)delin. Delikleri kaydıraktan 4,5 mm ve 9,3 mm arayla yapın. Her delik çiftinin merkezleri arasındaki mesafenin 15 mm olduğundan emin olun.
- Elektronik kesiciyi kullanarak 76 mm x 25 mm'lik çift yapışkanlı bant içine altı kanal (20 mm x 2,25 mm) kesin.
- Koruyucu kapağın plastik tarafını soyun ve yapışkan parçanın kenarlarını kuvars kaydırağının kenarlarıyla hizalayın. Bir çift politetetrafloroetilen cımbız kullanarak hafifçe bastırarak kapana kısılmış hava kabarcıklarını çıkarın.
- Yapışkan parçanın kağıt tarafını soyun ve kapak kaymasının işlevselleştirilmiş yüzeyine monte edin.
NOT: Bazen kağıt tarafını soymak ve kuvars kaydıraja takmak çok kanallı akış hücresinde iyi çalışır. - Altı kanal için giriş tüplerini (11 cm) ve çıkış tüplerini (25 cm) kesin. Akış hücresini 2.1.6-2.1.9 adımlarında açıklandığı gibi hazırlayın.
- İlk kanalın çıkışını pompaya bağlayın. Girişi OSS ile 0,5 mL tüpe yerleştirin.
NOT: Giriş tüpünün uzunluğu, enzim girişinin akış hücresine eşitlenme süresi nin senkronize edilmesi ve görüntülemenin başlaması yla sürekli akış altında yapılan dekolte deneylerinde meydana gelen olayların sayısını en üst düzeye çıkarmak için seçilir. florofororlar. - Kullanılan kanalın çıkışını keserek yeni bir kanala geçin. Plastik parçada tutkal ile mühürlenmiş bir şırınga iğneyapılmış bir fiş ile çıkış kapatın. Kullanılan kanalın girişini kapatın.
3. Oksijen atma sisteminin (OSS) hazırlanması
- 0.2 g (±)-6-hidroksi-2,5,7,8-tetramethylchromane-2-karboksilik asit (floroforların yanıp sönmesini en aza indiren üçlü hal quencher) 800 μL metanol.
- 6 mL deiyonize H2O ekleyin ve eriyene kadar 1 N NaOH damla ekleyin. Şırınga filtresiile filtre uygulayın, 1 mL aliquot yapın ve -80 °C'de saklayın. Stok konsantrasyonu ~100 μM'dir.
- DDH2O 4 mL PCA tozu 61 mg eriterek 3,4-dihroxybenzoic asit (PCA) taze bir çözüm hazırlayın. Stok konsantrasyonu ~100 nM'dir.
- PCA tamamen eriyene kadar her damladan sonra girdap için emin olun, 10 N NaOH dropwise 58 μL ekleyin (pH = 9).
- 5.3 mg protocatechuate 3,4-dioksijenaz (3,4-PCD) 7 mL PCD depolama tamponu (Tablo 1) çözünür. 3,4-PCD protocatechuic asit oksidasyon katalize ederek bağlayıcı / dekolte tamponlar oksijen kaldırır34.
- PCD çözümlerini 1 mL aliquots'a bölün. Stok konsantrasyonu ~1 μM'dir. Sıvı nitrojendeki aliquotları tutturun ve uzun süreli depolama için -80 °C'de veya kısa süreli depolama için -20 °C'de saklayın.
- Taze bağlayıcı arabellek hazırlayın (Tablo 1). SmFRET dekolte deneyleri için 2 mM MgCl2 ile 2 mM CaCl2 yerine.
- Görüntüleme arabelleği 1 mL hazırlayın (Tablo 1). Oksijen atma sisteminin aktivitesini korumak için akış hücresine girene kadar görüntüleme tamponu buz üzerinde tutun.
4. Floresan etiketli HJs hazırlanması
- Tris-EDTA tamponundaki lyophilized oligos(Tablo 2)100 μM konsantrasyonuna yeniden yapılandırılır.
- Tablo 1'delistelenen X0 oligolarının her birinin ~3 μL'lik equimolar porsiyonlarını karıştırarak sentetik bağlantıyı hazırlayın.
- Anneal 95 °C'de 5 dakika ısıtılarak 1 °C/dk'lık bir hızda RT'ye yavaş soğumanın ardından 1 °C/dk. İstenilen soğutma hızına ulaşmak için bir ısı bloğu veya PCR termocycler kullanın.
- Karışımı %10 Tris-borat-EDTA poliakrilamid jelin8 cm x 8 cm üzerine yükleyin. 100 V uygulayın ve jeli ~2 saat çalıştırın. Bantlar açıkça gözle görülür ve renkleri mordur.
- Temiz bir bıçakla anneleştirilmiş substrat bandını çıkar. Jel parçasını otoklavlı 1,5 mL tüpe aktarın.
- Jel parçasını temiz bir pistonla tüpün içine ezin ve 100 μL TE100 tamponu ekleyin(Tablo 1).
- HJ'yi 20 °C'de 1.500 rpm'de ~2 saat veya gece boyunca 4 °C'de kuluçkaya yatırarak ayıklayın.
- Substrat35içeren çözelti üzerinde etanol çökeltme gerçekleştirin.
- SUBSTRATi TE100 tamponunun 20 μL'inde yeniden askıya alın (Tablo 1). Son konsantrasyon 1-3 μM. Aliquot 2 μL her tüp ve -20 °C'de depolanır.
5. GEN1 protein ekspresyonu ve saflaştırılması
- Giriş vektörü PCR tarafından C-terminus20 heksa histidine-etiketi ile kesilmiş insan GEN11,2,3,4,5 ifadesi için plazmid inşa.
NOT: N-terminal etiketleme gen1 inaktivasyonu neden olur. Yapılandırılmamış C-tail, tam uzunluktaki GEN1'in arınmasını önemli ölçüde daha zor hale getirir. Ayrıca, tam uzunlukta GEN1 kesilmiş sürüm23daha az etkinlik sergilemek bildirilmiştir. - İfade vektörü E. coli BL21-CodonPlus (DE3)-RIPL süzme dönüştürün.
- Dönüştürülmüş hücreleri, her biri 37 °C'de 2 L Luria suyu madeni bulunan iki adet 6 L şişeye dönüştürün ve 0,8'in OD600'üne ulaşınceye kadar 180 rpm'de titreşin.
- Kültürü 16 °C'ye kadar soğutun ve 0,1 mM izopropil-β-d-tiyogalactopyranoside (IPTG) ile GEN1 ekspresyonunu 48 saat süreyle indükleyin.
- Hücreleri 4 °C'de 1000 x g'da bir santrifüjde döndürerek hasat edin. Kültürün her litre verimleri 5-6 g pelet.
- 4 mL/g hücreleri kullanarak supernatant atın ve lysis tampon(Tablo 1)içinde peletlenmiş hücreleri yeniden askıya.
- 30 kPsi'de bir hücre bozucu kullanarak hücre lisisi yapın ve 4 °C'de 1 saat boyunca 10.000 x g'de aşağı doğru döndürün. Supernatant toplayın ve 0.45 μm filtreler kullanarak buz üzerinde filtre.
- Filtrat'ı 5 mL Ni-NTA kolondan 2,5 ml/dk akış hızında geçirerek FPLC kullanarak protein saflaştırmasını gerçekleştirin (Tablo 1).
- 15 sütun hacmi (CV) ile yıkayın. 5 mL kesirlerde 20 CV üzerinde Tampon A ve 500 mM Imidazol lineer degradeile elute. GEN1 yaklaşık 100 mM Imidazol sütunundan eutes.
- Toplanan kesirlerden pipet 10 μL aliquots, her aliquot için 2x SDS yükleme boya eşit hacim ekleyin. Numuneleri 90 °C'de 5 dk, serin ve aşağı doğru çevirerek dennature.
- Örnekleri %10 Bis-Tris jeline yükleyin. Coomassie Brilliant Blue kullanarak 200 V. Stain 30-45 dakika için jel çalıştırın, sonra destain. Saflaştırılmış GEN1 içeren kesirleri toplayın.
- Tampon C kullanarak seyrelterek kombine kesirlerin tuz konsantrasyonu 100 mM'ye düşürün(Tablo 1).
- Düşük tuz proteinini Tampon B(Tablo 1)kullanarak 3 mL/dk akış hızında 5 mL heparin kolonundan geçirin .
- 10 CV ile yıkayın. Elute Tampon B ve 1 M NaCl ile 20 CV'lik bir degrade kullanarak. GEN1'in 360 mM NaCl civarında olduğu 5 mL fraksiyonu toplayın.
- Adım 5.8'de açıklandığı gibi saflaştırılmış GEN1 fraksiyonları için eluted kesirleri kontrol edin. Bu kesirleri birleştirin ve Buffer C kullanarak 100 mM NaCl seyreltin.
- Alt tuz proteinini Tampon B kullanarak 1 mL/dk akış hızında bir katyon değişim sütununa yükleyin.
- Tampon B ve 1 M NaCl kullanarak 40 CV bir degrade ile elute. GEN1'in 300 mM NaCl civarında eute saldığı 1,7 mL kesirleri toplayın.
- Adım 5.8'de açıklandığı gibi eluted fraksiyonları GEN1 saflığı için kontrol edin.
- En saf kesirleri birleştirin ve 4 °C'de diyalizi depolama tamponuna karşı(Tablo 1). Diyaliz sırasında tampon en az bir değişim gerçekleştirin.
- Protein konsantrasyonu ~0.5–1 mg/mL ölçün. Aliquot diyaliz proteini küçük tüplerde 10-15°L hacimlerde, sıvı nitrojende parlama-dondurma ve -80 °C'de saklayın.
6. Tek moleküllü FRET deneyleri
NOT: smFRET deneyleri, daha önce31olarak tanımlanan özel olarak oluşturulmuş nesnel tabanlı TIRF kurulumu(Şekil 1C)üzerinde gerçekleştirilir.
- Tek renkli FRET deneyleri
- 100x TIRF hedefi üzerine daldırma yağı bir damla uygulayın. Sinyali arka plana optimize etmek ve doygunluğu önlemek için EMCCD'yi uygun kazanç için ayarlayın.
NOT: Lazer ışınına doğrudan bakmayın ve lazeri hizalarken koruyucu gözlük takmayın. - Akış hücresini numune tutucunun üzerine dikkatlice yerleştirin. Yağ kapak kaymasına dokunana kadar kaba ayarı kullanarak hedefi kademeli olarak yükseltin.
- Yeşil lazeri açın (532 nm). Hedefin ince ayar moduna geçin. Monitördeki görüntüyü gözlemlemek için samisyonu kamera portuna yönlendirin.
- Kapak kaymasının işlevselleştirilmiş yüzeyi odak lanana ve monitörde gözlemlenene kadar hedefin yüksekliğini ayarlayın.
NOT: EMCCD tarafından görüntü edinimi, görüntüler elde edilmezken örnek fotobeyaztasyonun önlenmesi için acousto-optik takoz filtresi (AOTF) aracılığıyla lazer uyarılmasını tetikler. - Kapakkapaklarının işlevselleştirilmiş yüzeyinden arka planın floresan etiketli HJ'de akmadan önce birkaç noktayı aşmadığını kontrol edin.
- TE100 tamponundaki(Tablo 1)stok substratını 1-5 nM'lik son konsantrasyona kadar yaklaşık 1000 kez seyreltin. Pipet 0.2-0.5 μL seyreltilmiş substrat içine 120 μL OSS ile görüntüleme tampon 0.5 mL tüp içine.
- Akış hücresinin çıkışını şırınga pompasına bağlayın. Akış hücresinin giriş tüpünü 1,5 mL tüpe yerleştirin ve çözeltiyi tüpten çekmek için şırınga pompasını 30-50 μL/dk akış hızında çalıştırın.
- Sık sık iyi kapsama için yüzey kontrol (100-300 homojen olarak dağıtılan, iyi aralıklı substrat) yeşil lazer ile kısa bir süre görüntüleme.
- Yüzey kapsama alanı hala yeterli değilse, çözeltiden floresan olarak etiketlenmiş HJ için birkaç dakika bekleyin ve yüzeye yerleşin veya akan adımı tekrarlayın.
- 30-50 μL/dk'da 120 μL görüntüleme tamponu(Tablo 1)akışı ile bağlanmamış floresan hj etiketli yıkama. Daha sonra akış hücresi 5 dakika oturup OSS çözünmüş oksijen tüketmek için izin sağlar. Floroforların fotobeyazlama görüntüleme başında minimal olmalıdır.
- Pozlama süresini (~60 ms) ayarlayın, döngü süresi veri aktarım hızına (~104 ms) bağlı olarak yazılım tarafından otomatik olarak ayarlanır ve istenen döngü veya çerçeve sayısını (~400) belirtin. Donör (Cy3) ve acceptor (Alexa Fluor 647) emisyon bir görüntü ayırıcı cihaz tarafından iki renk kanallarına ayrılır.
- Yüzeyde uygun bir alan bulun, hedefin yüksekliğini ayarlayarak görüntüyü odakla ve kaydedin ve filmi 16 bit TIFF formatında kaydedin.
- Yeni bir alana geçin.
NOT: Aynı alanı iki kez görüntülemekten kaçınmak için her zaman tek bir yönde hareket edin (örneğin, çıkıştan girişe). - 1, 2, 5, 10, 25, 50, 75 ve 100 nM GEN1'i 120 μL görüntüleme tamponuna birer birer hazırlayın. Çözeltiyi 30-50 μL/dk akış hızında akış.
NOT: Gerekli ölçüm, HJ'nin GEN1 tarafından bağlanması nda veya serbest HJ'nin izomerizasyonunda olduğu gibi sabit bir durumda yapılırsa, filmi kaydetmek için akış durduktan sonra 3-5 dakika bekleyin. Her GEN1 konsantrasyonu için yeni alanlardan üç ila dört film edinin. - Gen1 tarafından HJ'nin bölünmesinde olduğu gibi sürekli akış altında ölçüm yapılırsa, GEN1'in akış hücresine girişinden önce 5-10 s'yi kaydetmeye başlayın. Altı kanallı akış hücresindeyeni bir kanala taşınarak ölçümü yineleyin.
- Sonunda, görüntü bölme cihazında donör ve kabul eden parçacıkları birbirine haritalamak için sabit floresan boncuk kaydırağı kullanın.
- Boncukların yüzeye yapışmasını sağlamak için 500 μL 1 M Tris (pH = 8,0) içine 1 μL floresan boncuk0,2 μL ekleyin.
- Çift taraflı yapışkan contanın 22 mm x 22 mm'lik parçasının içinde bir kare (18 mm x 18 mm) kesin. 76 mm x 25 mm kuvars kaydırağının ortasına parçayı soyup yapıştırın.
- Seyreltilmiş boncuk çözeltisinin 50 μL'sini yerleştirin ve yerleşmek için 5-10 dk bekletin. Kare parçanın üzerine 22 mm x 22 mm kapak kaydırın. Kuru fazla boncuk çözeltisi doku ile, sonra epoksi tutkal ile oda mühür.
- 60 ms pozlama süresinde 100 kare boncuk slayt edinin.
DİkKAT: Dedektörün doygunlaşmasını önlemek için lazer gücünü ve EMCCD kazancını minimuma indirin. - Yazılım paketini yükleyin (örn. TwoTones) ve36kullanım kılavuzunda belirtildiği gibi filmleri açın. Bağışçı ve kabul eden kanallardaki tek tek boncukların konumlarını seçin. Kılavuzda açıklandığı gibi bir dönüştürme matrisi oluşturun.
NOT: Bu yazılım, donör ve kabul eden kanallardaki parçacıkların konumlarını eşleştirmek ve görüntü bölme aygıtındaki herhangi bir hafif yanlış hizalamayı düzeltmek için dönüşüm matrisini kullanır. - DosyayaGit , Film Yükle tuşuna basın, ardından film dosyasını seçin ve Açtuşuna basın. Dosya menüsünde, Yükle TFORM tuşuna basın ve boncuk slaytından oluşturulan dönüşüm matrisini seçin. Yanlış pozitif ler dahil edilene kadar donör ve kabul eden kanalların eşiğini ayarlayın.
- Kanal filtresi menüsünde, hem bağışçı hem de kabul eden le etiketlenmiş parçacıklar için D&&A seçeneğini seçin. Birbirine çok yakın olan molekülleri dışlamak için En Yakın komşu sınır alanını kontrol edin. Çok eksantrik molekülleri dışlamak için Max eliptikliğini kontrol edin ve çok geniş veya çok dar molekülleri dışlamak için Genişlik sınırlarını kontrol edin.
- Histogramları oluşturmak için Twotones kılavuzunda belirtildiği gibi çizimHistCW yazın.
NOT: "Görünür" FRET verimliliği, kabul edenin emisyonunu donör ve kabul edenin toplam emisyonlarına bölerek program tarafından hesaplanır. Twotones FRET verimliliğine karşı moleküllerin durumlarının dağılımını bin lemek için 100 aralık kullanır. - Her molekül için zaman izlerini oluşturmak için Twotones kılavuzunda belirtildiği gibi plotTimetraceCW yazın.
NOT: Zaman izleri vbFRET37 tarafından farklı FRET durumlarını, ilgili çalışma sürelerini ve farklı durumlar arasındaki geçiş oranlarını belirlemek için daha fazla analiz edilebilir.
- 100x TIRF hedefi üzerine daldırma yağı bir damla uygulayın. Sinyali arka plana optimize etmek ve doygunluğu önlemek için EMCCD'yi uygun kazanç için ayarlayın.
- İki renkli alternatif uyarma FRET (ALEX) deneyleri
- Her ~80 ms süresi nde, sırasıyla, yeşil ve kırmızı lazerler ile doğrudan uyarma ile donör ve kabul edici emisyonların ardışık kareoluşan bir film kaydedin.
- Twotones'da satın alınan ALEX filmlerini açın. Üç kanal için uygun algılama eşiğini ~300 olarak ayarlayın: donör uyarma (DexDem) nedeniyle donör emisyon; donör uyarma (DeksAem) nedeniyle kabul veya emisyon; ve doğrudan uyarma (AexAem) nedeniyle kabul veya emisyon.
- Kanal filtresi DexDem&&DexAem&&AexAem'i uygulayArak hem bağışçı hem de kabul eden partikülleri seçin. Üç kanalda ~ 200-300 parçacıklar bağ.
- ALEX histogramları oluşturmak için plotHistALEX MATLAB kodunu kullanın. Histogramlarda farklı zirveleri gaussian işlevlerine sığdırın ve Origin yazılımı38'ikullanarak eğrinin altındaki alanın her popülasyonun yüzdesini belirleyin.
NOT: Bağlayıcı çıktısa tepe noktası bağlı GEN1-HJ kompleksine karşılık gelirken, serbest HJ'de zirveler değiş tokuş izomerlerini temsil eder. - Doğrudan uyarma ile donör emisyongösteren her molekül için bir zaman izi oluşturmak için plotTimetraceALEX MATLAB kodunu kullanın, ve FRET ve doğrudan uyarma nedeniyle kabul edici emisyonlar.
NOT: ALEX zaman-izleme bağımsız hem donör ve kabul eden emisyonlarını göstermek için, ancak tek renkli FRET daha düşük zamansal çözünürlükte. Tek renkli FRET'e benzer şekilde, ALEX zaman izleri vbFRET tarafından farklı FRET durumlarını ve bunların ilgili çalışma sürelerini belirlemek için daha fazla analiz edilebilir. - Bağlı popülasyonun yüzdelerini gen1 konsantrasyonuna karşı hiperbolik bir fonksiyona sığdırarak dissosyon sabitini belirleyin.
- Zaman atlamalı tek renkli FRET
- Gözlenen dinamiklerin hızına bağlı olarak yeşil lazerin maruz kalma süresini 60 ms'e, çevrim süresini ise 624 ms veya daha düşük bir alana ayarlayın.
- Altı kanallı akış hücresinin bir kanalında akış hızını 110 μL/dk olarak ayarlayın. Akış hücresi içinde GEN1 girişinden önce kısa bir süre kayıt başlatın.
NOT: Sürekli akış floroforların hızlı fotobeyazlasyonuna yol açar, bu nedenle görüntüleme ve protein girişinin başlamasının senkronize edilmesi yakalanan olayların sayısını en üst düzeye çıkarır. Optimal şırınga pompası okuma ölü hacmi ve akış hücresi monte etmek için kullanılan tam tüp bağlıdır; bizim durumumuzda ~ 25 μL olduğunu. - 78 s toplam satın alma süresi için ~ 125 kare bir film edinin. Kaydın sonunda, numuneyi her biri 25 ms pozlama süresine sahip 50 kare boyunca kırmızı lazere maruz bırakarak kabul edeni incen.
NOT: Bu yöntem, uyarma döngülerinin sayısını azaltarak dekolte deneyindeki gözlem penceresini uzatır. Dimerizasyon dan kve kolarak kinetik parametreler, dağılımın iki üstel modele sığdırılmasıyla türetilmiştir30,38.
7. Elektroforetik hareketlilik değişim tahlilleri (EMSA)
- 50 μL toplam hacimde, EMSA bağlayıcı tamponda 30 dk için RT'de 50 pM Cy5 etiketli HJ ile istenilen GEN1 konsantrasyonuna inkübüldürülür (Tablo 1).
- Örnekleri 8 cm x 8 cm %6 Tris-borat-EDTA jelüzerine yükleyin. JEL'de 1 x TBE tamponunda 1 saat + 20 dk için 100 V kullanarak çalıştırın.
- Gen1 konsantrasyonundaki bağlı substrat yüzdesini, ilgili şeridin toplam floresan yoğunluğuna göreli katkısından belirleyin.
NOT: GEN1 monomer-HJ (bant I) nickli HJ21,30GEN1 monomer picomolar bağlayıcı ile boyutu anlaşması ile tanımlanır. GEN1-dimer-HJ HJ21,23GEN1 monomer adım adım bağlanması nedeniyle bant II atanır. - Kd-monomer-app-EMSA ve Kd-dimer-app-EMSA denklemini kullanarak görünür bağlama sabitlerinihesaplayın:

Nerede: Max, ilgili türlerin maksimum bağlayıcınoktasına (monomer veya dimer) ulaştığı konsantrasyondur; n Hill katsayısıdır; K d-app-EMSA, gen1 konsantrasyonunun yarım maksimum monomer veya dimer'in bulunduğu konsantrasyonu gösteren, ilgili türün belirgin bağlayıcı sabitidir.
Sonuçlar
Conformer önyargı ve HJ izomerizasyonu
HJ izomerizasyonuyoğun kavşak17,18,39iki bitişik kolların etiketleme yoluyla FRET tarafından araştırılmıştır. Donör (Cy3) ve alıcı (Alexa Fluor 647) sırasıyla iki komşu kol, R (iplik 2) ve X (iplik 3) konumlandırılmış(Şekil 2A). Yığılmış-X izomerleri iki sürekli iplikçikleri (yani, Iso(1,3) veya Iso(2,4)] tarafından atandı. Bitişik etiketli X0'ın ALEX FRET histogramı, daha bol olan Iso(1,3) (E ~0,75) ve daha az bol Iso(2,4) (E ~0,40)(Şekil 2B)ile değiş tokuşa karşılık gelen iki tepe noktası gösterir.
Tek renkli FRET, EMCCD2 kameranın kullanılan alanını azaltarak serbest HJ'deki hızlı konformasyonel değişiklikleri yüksek zamansal çözünürlük ~10 ms ile kaydetmek için zaman izlerini elde etmek için kullanılır. X0 bağlantısının temsili tek renkli FRET zaman izi, yüksek ve düşük FRET izomerleri arasındaki geçişleri gösterir(Şekil 2B). Izomerizasyon oranları kIso(1,3)-Iso(2,4) ve kIso(2,4)-Iso(1,3) iso(1,3) ve Iso(2,4)(Şekil 2C)histogramlarından elde edilen iso(17) ile uyumludur.
SMFRET, HJ'nin GEN1 tarafından etkin bir şekilde bozulmasını göstermektedir
HJ, GEN122'yebağlandıktan sonra yapısal yeniden düzenlemeden geçer. Bu nedenle, donör ve kabul eden arasındaki boşluk hem Iso(1,3) hem de Iso(2,4)(Şekil 3A)ile benzerdir. SmFRET bağlayıcı tahliller HJ bölünmesini önlemek için Ca2 + varlığında yapılmıştır. Farklı GEN1 konsantrasyonlarında bitişik etiketli X0 kavşağının FRET histogramları ALEX(Şekil 3B)tarafından elde edilmiştir. Histogram iki Gaussişlevi'ne uygundur: biri serbest yüksek FRET Iso'ya (1,3) karşılık gelen, diğeri ise düşük FRET zirvesinden Iso'nun (2,4) katkısını çıkararak bağlı GEN1-HJ popülasyonuna karşılık gelen.
GEN1 konsantrasyonunu doyontma anda, X0 FRET histogram ı model 22 tarafından tahmin edildiği gibi HJ ya izomer bağlı GEN1 karşılık gelen sadece tek bir düşük FRET tepe vardır22. Belirgin monomer dissosilasyon sabiti(Kd-monomer-app)GEN1 konsantrasyonunun bir fonksiyonu olarak GEN1'e bağlı popülasyon yüzdelerinin hiperbolik uyumundan belirlenir (Şekil 3C). Bitişik etiketli nk-X0, ilk kesi reaksiyonundan sonra ürünü taklit eden tek liştirilmiş hj sürümünü temsil eder. Simüle edilen çentik tarafından istifleme zorlanma kabartma nedeniyle, nk-X0 x0 aksine, E ~ 0.40 tek substrat zirvesinden belirgin olmayan bir izomerize yapısı40 (Şekil 3D vs Şekil 3B). GEN1-nk-X0 kompleksinin yapısı, FRET verimliliklerinde (NK-X0 için E ~0,25 ve X0için 0,32) benzerliğinde belirtildiği gibi GEN1-X0 kompleksinin yapısına benzer (Şekil 3D vs. Şekil 3B). GEN1 monomerinin nk-X0'a güçlü bağlanması X0'dan 40 kat daha düşük Kd-monomer-app değeri ile gösterilmiştir(Şekil 3E vs. Şekil 3C). Bu sıkı bağlama, GEN1 dimer'in veya monomerlerinden birinin parçalanması durumunda HJ'nin eksik çözümüne karşı bir koruma mekanizması görevi görebilir.
GEN1 monomerinin HJ'ye adım adım bağlanması
Gen1 monomerinin HJ'ye bağlanması ve ardından dimer oluşumu, çözelti21,23,41çözeltisinde dimerik formda bulunan prokaryotik resolvases ile karşılaştırıldığında ökaryotik HJ resolvase GEN1 için benzersiz bir özelliktir. 50 pM X0'daki GEN1'in EMSA'sı, üst paneldeki Roma rakamlarıyla belirtildiği gibi GEN1'in adım sallayarak üst sıra komplekslerine doğru olan adımsal ilişkisini göstermektedir (Şekil 4A). EMSA(Kd-monomer-EMSA)tarafından belirlenen GEN1 monomerinin dissosiyam sabiti, smFRET bağlayıcı tsömeyme sabitkkd-monomer-uygulamasından (Şekil 4A ve Şekil 3C) , sırasıyla). II bandının nicelliği GEN1 dimer(Kd-dimer-EMSA)denge dissosilasyon sabitini hesaplamak için kullanılır. 50 pM nk-X0'da GEN1'in EMSA'sı, X 0'dan 30 kat daha düşük olan çok düşük Kd-monomer-app-EMSA ile belirtildiği gibi belirgin monomer bağlanmasınıgösterirken, Kd-dimer-EMSA X0 ile karşılaştırılabilir (Şekil 4B).
GEN1 monomer'in HJ'yi bağlayıp bozduğunun bir diğer kanıtı da, düşük GEN1 konsantrasyonlarında Mg2+ varlığında kararlı düşük FRET durumuna(Şekil 4C)sahip amca aved partiküllerinin önemli sayıda izlerinin gözlemidir. Bu izlerin sayısı GEN1 konsantrasyonunun artmasıyla azalmıştır. HJ'nin çözünürlüğü, dimer oluşumunu destekleyen GEN1 monomer'in sıkı bağlanmasıyla yapılır. Monomer bağlama mg2 +amca aved nk-X0 zaman izlerinde gözlenir , hangi kadar uzanır birkaç nanomolar konsantrasyonu(Şekil 4D). GEN1 monomer, nk-X0'ı korumak için sıkıca bağlanır ve sonunda dimer oluşumu ile tam çözünürlük sağlar.
HJ SMFRET çözünürlük tspür
SmFRET tahlillerinde "dekolte" terimi HJ'nin "çözünürlüğü" ile birbirinin yerine kullanılır, çünkü bu tahlilde sadece ikinci bölünme olayını takip eden ürün sürümü algılanır. Olaylar ~ 1,3 dakika edinme süresi içinde foto-duyarlı kabul fotobeyaztma en aza indirmek için hızlandırılmış tek renkli uyarma tarafından kaydedilir.
Şekil 5A'daki şema, x0 Iso'nun (1,3) 1 ve 3 iplikçiklerinin, İşlevselleştirilmiş cama bağlı bir X0'ın GEN1'i ile bağlanması ve bozulmasından sonraki kesilerini göstermektedir. Hem bağışçı hem de kabul eden, HJ kararından sonra sinyallerinin kaybolması ile sonuçlanan çözüme geçer. Birinci ve ikinci kesiler nk-X0'da ayrılmış, bu da kısmen çözülmüş HJ'nin prototipini örneklemektedir. GEN1'in bağlanması üzerine nk-X0, X0'abenzer bir yapı yı benimser. Çözünürlük, Şekil 5B'degösterildiği gibi iplik 1'deki tek bir kesi ile ilerler.
Çözülmüş X0'ın izlerinde stabil bir düşük FRET durumundan sonra donörün ve kabul edenin aynı anda ayrılması, bir ara FRET (E = ~0,40) ortaya çıkmadan meydana gelen tam çözünürlüğün GEN1-HJ ömrü içinde oluştuğunu gösterir karmaşık (Şekil 5C). Bu nedenle, bu sonuçlar HJ çözünürlüğünün GEN1-HJ karmaşık ömrü içinde oluştuğunu göstermektedir. NK-X0'ın çözünürlüğü de yapısal yeniden düzenlemeden sonra ilerler ve X0'abenzer iki florofor(Şekil 5D)taşıyan dubleksin ayrılmasıyla sonuçlandırır.
GEN1 monomer bağlı HJ'de GEN1 dimerizasyonunun kinetik
Zaman atlamalı smFRET, GEN1 monomer tarafından bozulmadan sonra HJ'nin dimer oluşumu ve çözümü için gereken süreyi içeren öncedekolteyi ölçer. Bu tekniğin uygulanması, dimer oluşumunun hem X0 hem de nk-X0'ınçözümü için gerekli olduğu iddiasını desteklemek için doğrudan kanıt sağlanmaktadır , çünkü öncedekolte dağılımı GEN1 konsantrasyonuna bağlıdır.
HJ çözünürlüğünün(kapp)belirgin oranı, ilgili GEN1 konsantrasyonundaki önceki bölünme denönceki ortalamanın tersi olarak tanımlanır. GEN1'in HJ kararı ndan sonra ürüne bağlı kalma olasılığı hariç tutulamadığından, "görünür" terimi HJ çözünürlüğünün oranını tanımlamak için kullanılır.
X0 (Şekil 6A)arasındakidekolte öncesi dağılımların olasılık yoğunluğu fonksiyonları (PDF), düşük GEN1 konsantrasyonlarında daha uzun, daha yüksek GEN1 konsantrasyonlarında daha kısa olan dimer oluşumu süresini yansıtır. Dimer, kon-dimer ve koff-dimeriçin ilişkilendirme ve ayrışma oranları, sırasıyla, bir iki üstel model30belirlenir. Ayrıca, nk-X0 (Şekil 6B)PDF'leri dimer oluşumu gereksinimini gösteren X0'a benzer bir dağılım gösterir.
Kuygulamasının GEN1 konsantrasyonuna karşı çizimi hiperbolik bir fonksiyona uygundu. X0 ve nk-X0'ın görünür kataliz hızı sabitleri(kMax-app)sırasıyla 0,107 ± 0,011 s-1 ve 0,231 ± 0,036 s-1'dir (Şekil 6C). X0 ve nk-X0 kavşakları için kuygulamasının çizimleri GEN1 konsantrasyonu ~5.6 nM'de kesişiyor çünkü daha hızlı kMax-app ve daha yavaş k on-dimer ile karşılaştırıldığında bozulmamış kavşak.
Özetle, göreceli olarak hızlı kon-dimer ve yavaş koff-dimer, dimer oluşturulduktan sonra HJ çözünürlüğüne doğru ileri reaksiyonun ilerlemesine yol açar. GEN1 monomerinn nk-X0 kavşağına güçlü bağlanması, olası olmayan ikinci dekoltelere karşı bir arıza-emniyet mekanizması oluşturur veya hücredeki birincil çözünürlük yollarının geride bıraktığı tamamen çözülmemiş HJ'leri toplamaya yardımcı olur.
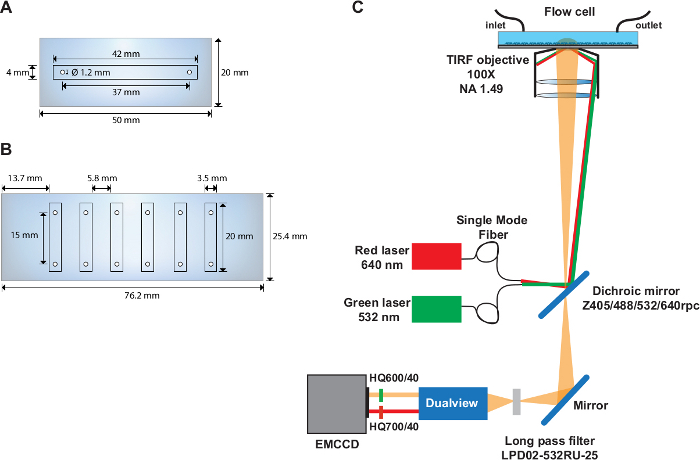
Şekil 1: Tek ve çok kanallı akış hücreleri ve optik kurulumun düzeni.
(A) Tek kanallı akış hücresi şeması. (B) Altı kanallı akış hücresişeması. (C) Uyarma kaynaklarını gösteren optik kurulumun düzeni, TIRF hedefi, filtre küpünün içine monte edilmiş dikroik ayna ve görüntü ayırıcı cihazda kullanılan emisyon filtreleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: FRET tarafından gözlenen HJ'nin konformer önyargısı ve izomerizasyonu.
(A) Bitişik etiketli X-yığılmış HJ konarmatörlerin izomerizasyonu iki sürekli iplikçikten sonra adlandırılmıştır. Kollar harflerle gösterilirken iplikler numaralanır. Kesi siteleri oklarla gösterilir. Donörün (yeşil) ve kabul edenin (kırmızı) pozisyonları ve izomerizasyon üzerine FRET'deki değişim belirtilir. (B) Sağ panel: FRET zaman izi (siyah) ve idealize FRET iz (kırmızı) X0 50 mM Mg2+. Sol panel: 50 mM Mg2+x0 FRET histogramı. Donörün (yeşil) ve kabul edenin (kırmızı) floresan yoğunlukları aşağıda gösterilmiştir. (C) Komşu etiketli X0 Iso(1,3) ve Iso(2,4)'ın çalışma süresi histogramları, izomerizasyon oranlarını belirlemek için tek üstel fonksiyonlara takıldı. Belirsizlikler uyum% 95 güven aralığı gösterir. Bu rakam daha önce yayınlanmış literatür30değiştirilmiştir.
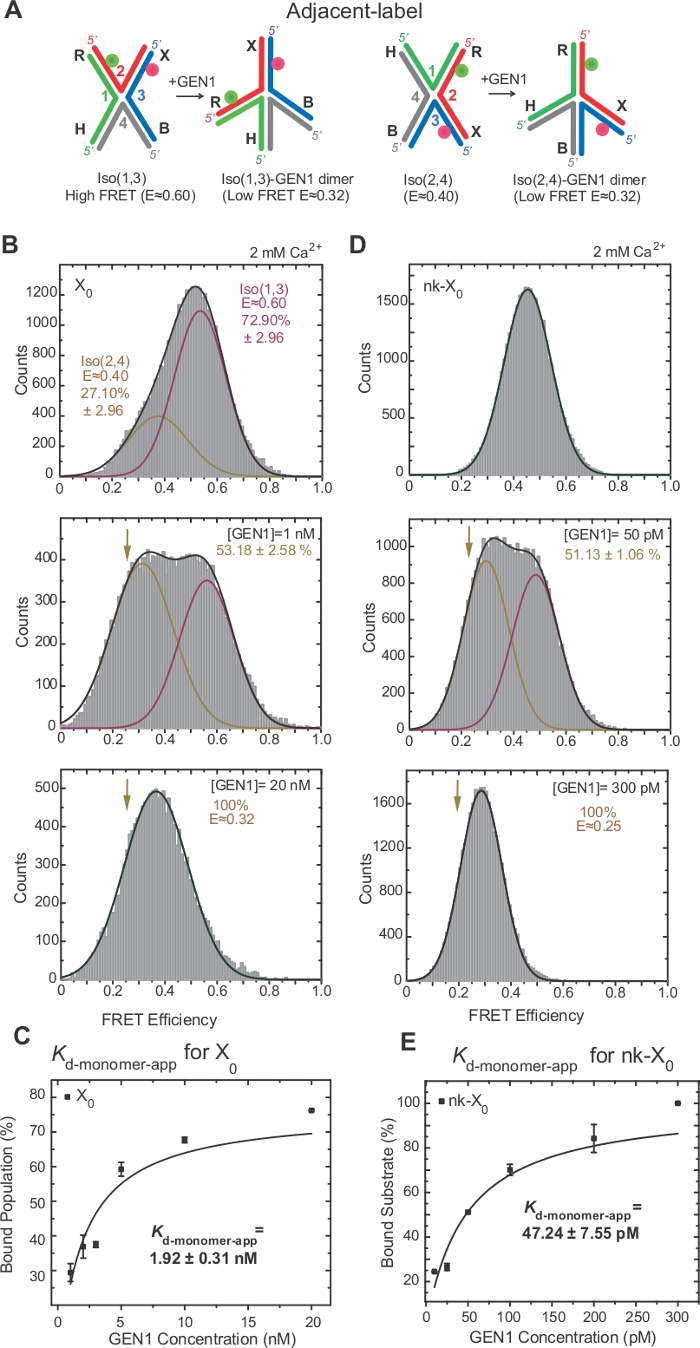
Şekil 3: HJ'nin GEN1 tarafından etkin bozulması.
(A) Önerilen model22'yegöre bitişik etiket HJ'nin yapısal modifikasyonu . (B) Bitişik etiket X0'ın ALEX FRET histogramı, Iso(1,3) ve daha düşük FRET zirvesine (E = ~0,4) karşılık gelen büyük bir yüksek FRET tepe noktasına (E = ~0,6) sahiptir(2,4). Tüm histogram iki Gauss işlevine uygundur: biri serbest yüksek FRET Iso'ya (1,3) karşılık gelen, diğeri ise bağlı popülasyona karşılık gelen Iso'nun (2,4) toplam popülasyona ilk katkısı hariç. (C) Belirgin monomer dissosiyasyon sabiti(Kd-monomer-app)GEN1 konsantrasyonunun bir fonksiyonu olarak GEN1'e bağlı popülasyonların yüzdelerinin hiperbolik uyumundan belirlenir. (D) Farklı GEN1 konsantrasyonlarında bitişik etiketli nk-X0'ın FRET histogramları. Düşük FRET (E = ~0,25) Gaussian altındaki alan bağlı nüfusun yüzdesine karşılık gelir. (E) NK-X0'ın Kd-monomer-uygulaması GEN1'e bağlı popülasyonun hiperbolik uyumundan belirlenir. Hata çubukları, iki veya daha fazla denemeden gelen standart sapmaları temsil eder. Bu rakam daha önce yayınlanmış literatür30değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: GEN1'in HJ'ye adım adım bağlanması.
(A) Gen1 elektroforetik hareketlilik değişim istibi (EMSA) 50 pM X0. Üst panel: Roma rakamları kompleksteki GEN1 monomerlerinin sayısını gösterir. Alt panel: GEN1 monomerinin X0'abağlanması. Belirgin dissosilasyon sabitleri ilgili türün sigmoidal uyum elde edildi ve iki deneyin ortalamasını temsil eder. (B) GEN1'in 50 pM nk-X0'daki EMSA'sı, çok düşük Kd-monomer-app-EMSAile belirtildiği gibi belirgin monomer bağlanmasını göstermektedir. (C) FRET zaman izi bağlı ama mg2+komşu etiket X0. ~1,3 dk için donör uyarma yapıldı, ardından doğrudan kabul veya uyarma (gölgeli pembe bölge) yapıldı. (D) FRET zaman izi bağlı ama mg2+da yan etiketli nk-X0. Bu rakam daha önce yayınlanmış literatür30değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: HJ SMFRET çözünürlük titreci.
(A) GEN1 tarafından bozulmadan sonra bitişik etiket X0 Iso(1,3) şeması. Substrat biotin/avidin bağlantısı ile fonksiyonel yüzeye bağlanır. Gen1'in iki kesiden sonra ayrışması, çözüme giden hem donörhem de kabul verenin kaybına yol açıyor. (B) Bitişik etiketli nk-X0 çözünürlüğünün şematik iplikçik 1. (C) Iso dekoltesinin 2 mM Mg2+ 'da zaman izi (siyah). GEN1 bağlamanın başlangıcı, FRET sinyali dekolte nedeniyle aniden kaybolana kadar sabit bir düşük FRET durumu oluşturur. Buna karşılık, donördeki artış ve GEN1 bağlanması üzerine kabul veya floresan yoğunluklarının azalması, floresan'ın dekolte üzerine her iki boyadan aynı anda kaybolması ile takip edilir. (D) Benzer şekilde, nk-X0'ın zaman izi, GEN1 bağlanması üzerine stabil bir düşük FRET durumunu gösterir ve bu durum FRET sinyalinin ani kaybı yla sonuçlandırılır. Bu rakam daha önce yayınlanmış literatür30değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 6: GEN1 monomer bağlı HJ'de GEN1 dimerizasyonunun kinetik.
(A) X0'ın bölünmeden önceki dağılımlarının olasılık yoğunluğu fonksiyonu (PDF) çizimi GEN1 konsantrasyonuna olan bağımlılığını göstermektedir. İlgili GEN1 konsantrasyonundaki düşük FRET durumunun (τbefore-dekolte)dolan süreleri iki veya daha fazla deneyden elde edilmiştir ve ortalama oranları elde etmek için kullanılır(kuygulaması). Listelenen kuygulama oranları, ilgili GEN1 konsantrasyonundaki ortalama nın tersi olarak belirlenir. Dimer formasyonu için ilişkilendirme (kon-dimer) ve ayrışma(koff-dimer)oranları iki üstel model38'denhesaplanır. Hatalar kuygulamasınınSEM'ini temsil ediyor. (B) NK-X0'ın ve ilgili kuygulama oranlarının öncekidekolte dağılımlarının PDF çizimi. (C) Kuygulamasının çizimi ve GEN1 konsantrasyonu hiperbolik bir fonksiyona takılı dır görünür katalitik hızı belirlemek için(kMax-app). X0 ve nk-X0 için kuygulamasının konusu, X0'ın daha hızlı başlangıç kuygulamasını göstermektedir ve bu uygulama nk-X0 ile [GEN1] ~5.6 nM'nin üzerinde aşılır. Bu rakam daha önce yayınlanmış literatür30değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Arabellek | Kompostiyon | ||
| Bağlama arabelleği | 40 mM Tris-HCl pH 7.5, 40 mM NaCl, 2 mM CaCl2, 1 mM DTT, %0.1 BSA ve %5 (v/v) gliserol | ||
| Arabellek A | 20 mM Tris-HCl pH 8.0, 1 mM DTT ve 300 mM NaCl | ||
| Arabellek B | 20 mM Tris-HCl pH 8.0, 1 mM DTT ve 100 mM NaCl | ||
| Arabellek C | 20 mM Tris-HCl pH 8.0 ve 1 mM DTT | ||
| Dekolte tamponu | 40 mM Tris-HCl pH 7.5, 40 mM NaCl, 2 mM MgCl2, 1 mM DTT, %0.1 BSA ve %5 (v/v) gliserol | ||
| EMSA bağlama arabelleği | 40 mM Tris-HCl pH 7.5, 40 mM NaCl, 1 mM DTT, 2 mM CaCl2, 0.1 mg/ml BSA, %5 (v/v) gliserol ve 5 ng/μl Poli-dI-dC | ||
| Görüntüleme arabelleği (bağlama) | 40 μL (±)-6-Hidroksi-2,5,7,8-tetramethylchromane-2-karboksilik asit (4 μM), 60 μL PCA (6 nM), 60 μL PCD (60 nM) ve 840 μL Bağlayıcı tampon | ||
| Görüntüleme tamponu (dekolte) | 40 μL (±)-6-Hidroksi-2,5,7,8-tetramethylchromane-2-karboksilik asit (4 μM), 60 μL PCA (6 nM), 60 μL PCD (60 nM) ve 840 l L Cleavage tamponu | ||
| Lysis arabelleği | 20 mM Tris-HCl pH 8.0, 10 mM β-mercaptoetanol, 300 mM NaCl ve 2 mM PMSF | ||
| PCD depolama arabelleği | 100 mM Tris-HCl pH 7.5, 1 mM EDTA, 50 mM KCl ve %50 gliserol | ||
| depolama arabelleği | 20 mM Tris-HCl pH 8.0, 1 mM DTT, 0.1 m EDTA, 100 mM NaCl ve %10 gliserol | ||
| TBE arabelleği | 89 mM Tris-HCl, 89 mM Borik asit ve 2 mM EDTA | ||
| TE100 tampon | 10 mM Tris.HCl pH 8.0 ve 100 mM NaCl | ||
| Tris-EDTA arabelleği | 50 mM Tris-HCl pH 8.0 ve 1 mM EDTA pH 8.0 | ||
Tablo 1: Bu çalışmada kullanılan arabelleklerin listesi ve bunların bileşimleri.
| Özcan | Sıra | ||
| X0-st1 | ACGCTGCCGAATTCTACCAGTGCCTTTGCTAGGACATCTTTTGCCCACCTGCAGGTTCACCC | ||
| X0-st2 | GGGTGAACCTGCAGGTGGG/iCy3/AAAGATGTCCATCTGTGTGTAATCGTCAAGCTTTATGCCGT | ||
| X0-st3 | ACGGCATAAAAGCTTGACGA/iAF647-dT/TACAACAGATCATGGAGCTGTCTAGAGGATCCGACTATCG | ||
| X0-st4 | 5'BiotinCGATAGTCGGATCCTCTCTAGACAGCTCCATGTAGCAAGGCACTGGTAGAATTCGGCAGCGTGT | ||
| X0-Adj | X0-st1, X0-st2, X0-st3 & X0-st4 | ||
| X0In_st2 | GGGTGAACCTGCAGGTGGGCAAAGATGTCCATCTGTTGTAATCGTCAAGCTTTATGCCGT | ||
| X0In_st4 | 5'BiotinCGATAGTCGGATCCTCTCTAGACAGCTCCATGTAGCAAGGCA/iCy3/TGGTAGAATTCGGCAGCGT | ||
| Nk-X0 | X0-st1, X0-st2, X0-nk3a, X0-nk3b & X0-st4 | ||
| X0-nk3a | ACGGCATAAAGCTTGACGA/iAF647-dT/TACAACAGATC | ||
| X0-nk3b | ATGGAGCTGTCTAGAGGATCCGACTATCG | ||
Tablo 2: SMFRET ve EMSA HJ yüzeyleri. SmFRET ve EMSA için floresan etiketli HJ'lerin hazırlanmasında kullanılan oligonükleotidlerin listesi. Oligolar ticari olarak elde edildi. Floresan etiketli oligolar HPLC saflaştırılmış ve mümkün olduğunda ≥60 bp'lik oligolar PAGE-saflaştırılmıştır.
Tartışmalar
Bu çalışmada, GEN130ile HJ çözünürlüğünün kinetiklerini belirlemek için farklı smFRET teknikleri uygulanmıştır. Benzer smFRET yaklaşımları DNA replikasyonu ve onarım flep enonukleaz 142,43,44tarafından çift flep DNA konformasyonal gereksinimi ve bölünmesi takip etmek için kullanılmıştır. Burada, bu protokoldeki kritik adımlar tartışılmıştır. Silanizasyon reaksiyonu herhangi bir nem izinden uzak olmalıdır. Pegilasyon çözeltisi, hidrolizi önlemek için PEG çözüldükten sonra silanize cama hızla uygulanmalıdır. Çok kanallı akış hücresinde, komşu kanallar arasında sızıntıyı önlemek için yapışkan levhada sıkışmış herhangi bir hava kaldırılmalıdır. PCA çözeltisi zamanla oksitlendiği için yeni hazırlanmalıdır. 10 N NaOH ilavesi damla şeklinde olmalı, arada girdap ile. Kapak taki floresan arka plan floresan hj etiketli akan önce minimal olmalıdır. Akış hücresindegörüntüleme ağartılmış alanları görüntüleme önlemek için tek yönde yapılmalıdır. ALEX deneylerinde, kabul edenin hızlı beyazlatma önlemek için kırmızı lazer gücü azaltılmalıdır. Hızlandırılmış deneylerde, döngü süresi en hızlı olaydan daha kısa olmalıdır.
smFRET biyomoleküler reaksiyonlarda değerli gerçek zamanlı öngörüler sağlayabilen hassas bir tekniktir. Ancak, bu yöntem, biyokimyasal reaksiyon sırasında FRET ölçülebilir bir değişiklik elde eden çeşitli teknik zorluklar vardır. Bu histogramlar ve zaman izleri ayırt edilebilir durumlarda iyi ayrılmış özellikleri elde etmek için gereklidir. Birçok durumda, smFRET substratların dikkatli bir şekilde tasarlanması, florofor çiftleri ve konumlarının seçilmesi ve45substratTaki küçük yapısal değişiklikler nedeniyle DNA alt katmanındaki FRET değişikliklerinin yükseltilmesi gerekmektedir. FRET gerçekleştirmek için başka bir yaklaşım etiketli proteinlerkullanmaktır 46. FRET'deki gözlem penceresi, donörden daha hızlı ağartMa eğiliminde olan Cy5 veya Alexa Fluor 647 gibi kabul edenin stabilitesi ile sınırlıdır (Bu durumda Cy3). Bu nedenle FRET, deney süresini uzatmak için kararlı florofororların sürekli aranmasını ve floresan sinyalini uzatmak ve sinyal-gürültü oranını en üst düzeye çıkarmak için oksijen atma sistemleri geliştirme çabalarını gerektirir47,48 .
smFRET'teki sorun giderme ipuçları arasında, floresan emisyonunen en üst düzeye çıkarmak, deney süresini uzatmak ve enzim dinamiği için uygun örnekleme aralıkları. Enzim dinamiklerini temsil eden yüksek doğruluk süresi dağılımları elde etmek için daha uzun gözlem süreleri ve fotobeyazrlamanın en az etkileri gereklidir. Alex, bu yöntem tek renkli FRET'e göre fotobeyaznilmiş partiküllerden daha düşük katkılara maruz kaldığı için daha iyi histogramlar üretir. Ancak, ALEX zamansal çözünürlük tek renkli FRET daha düşüktür.
Son olarak, SMFRET'in gerçek zamanlı olarak moleküllerdeki konformasyonel/yapısal değişimleri tespit etme vurgusu, yüksek çözünürlüklü yapısal teknikler (yani X-ışını kristalografisi, nükleer manyetik rezonans, elektron mikroskobu) arasındaki boşluğu köprüler, statik koşullar ve ölçülebilir bir özelliğin topluluk ortalamasını veren toplu yöntemler altında atomik çözünürlük yapısal ayrıntıları sağlar. Birçok açıdan, smFRET gerçek zamanlı olarak biyolojik sistemleri incelemek için güçlü bir teknik olduğunu kanıtlamıştır.
Açıklamalar
Yazarlar hiçbir rakip mali çıkarları beyan.
Teşekkürler
Bu çalışma Kral Abdullah Bilim ve Teknoloji Üniversitesi tarafından temel finansman ve S. M. H'ye Rekabetçi Araştırma Ödülü (CRG3) ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| (±)-6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid (Trolox) | Sigma-Aldrich | 238813 | |
| 0.1 M sodium bicarbonate buffer | Fisher | 144-55-8 | |
| 10 % Novex Tris-Borate-EDTA gel | Thermo Fisher Scientific | EC6275BOX | |
| 100 X TIRF objective | Olympus | NAPO 1.49 | |
| 3,4-dihroxybenzoic acid (PCA) | Sigma-Aldrich | P5630 | |
| 3-aminopropyltriethoxysilane (APTES) | Sigma-Aldrich | 741442 | |
| 6% Novex Tris-Borate-EDTA gel | Thermo Fisher Scientific | EC6265BOX | |
| Adhesive sheet | Grace bio-labs | SA-S-1L | |
| Benchtop refrigerated centrifuge | Eppendorf | Z605212 | |
| Biotin-PEG | Laysan Bio | Biotin-PEG-SVA 5000 | |
| Bovine Serum Albumin (BSA) | New England Biolabs | B9001S | |
| Calcium Chloride Dihydrate | Sigma-Aldrich | 31307 | |
| cation exchange column | GE healthcare | MonoS (4.6/100) | |
| Cell distruptor | Constant Cell Disruption System | TS5/40/CE/GA | |
| Coomassie Brilliant Blue | MP Biomedicals | 808274 | |
| Cy3 emission filter | Chroma | HQ600/40M-25 | |
| Cy5/Alexa Fluor 647 emission filter | Chroma | HQ700/40M-25 | |
| Dichroic for DV2 filter cube | Photometrics | 630dcxr-18x26 | |
| Dithiothreitol (DTT) | Thermo Scientific | R0861 | |
| Drill | Dremel | 200-1/21 | |
| Electronic cutter | Copam | CP-2500 | |
| EMCCD camera | Hamamatsu | C9100-13 | |
| Epoxy glue | Devcon | 14250 | |
| FPLC Aktapurifier UPC 10 | GE Healthcare | 28406268 | |
| GelQuant.NET software | biochemlabsolutions.com | Version 1.8.2 | |
| GEN1 entry vector | Harvard plasmid repository | HSCD00399935 | |
| Glycerol | Sigma Life Science | G5516 | |
| green laser (emission 532 nm) | Coherent | Compass 315M-100 | |
| Heparin column | GE healthcare | HiTrap Heparin column | |
| HEPES | BDH | BDH4162 | |
| Image splitter | Photometrics | Dualview (DV2) | |
| Imidazole | Sigma-Aldrich | I2399 | |
| Inverted microscope | Olympus | IX81 | |
| Isopropyl-ß-D-thiogalactoside (IPTG) | Goldbio. | 12481C100 | |
| Laser scanner | GE healthcare | Typhoon Trio | |
| LB Broth | Fisher Scientific | BP1426-500 | |
| Long pass 532nm filter | Semrock | LPD02-532RU-25 | |
| Magnesium Chloride | Sigma Life Science | M8266 | |
| mPEG | Laysan Bio | mPEG-SVA 5000 | |
| Neutravidin | Pierce | 31000 | |
| Ni-NTA column | GE healthcare | HisTrap FF | |
| NuPAGE 10% Bis-Tris gels | Novex Life technologies | NP0301BOX | |
| NuPAGE 10% Bis-Tris Protein Gels | Thermo Fisher Scientific | NP0302PK2 | |
| Origin software | OriginLab Corporation | Version 8.5 | |
| Phenylmethylsulfonyl fluoride (PMSF) | Alexis Biochemicals | 270-184-G025 | |
| Phosphate-buffered saline | GIBCO | 14190 | |
| Polyethylene Tubing (I.D. 0.76 mm O.D. 1.22mm) | Fisher (Becton Dickinson) | 427416 | |
| Protocatechuate 3,4-dioxygenase (3,4-PCD) | Sigma-Aldrich | P8279-25UN | |
| Quad-band dichroic | Chroma Inc | Z405/488/532/640rpc | |
| red laser (emission 640 nm) | Coherent | Cube 640 100C | |
| Sodium Chloride | Fisher Chemical | S271 | |
| Sorvall RC-6 plus centrifuge | Thermo Fisher Scientific | 46910 | |
| Spectrophotometer | Thermo Fisher Scientific | Nanodrop 2000 | |
| Syringe pump | Harvard Apparatus | 70-3007 | |
| Teflon tweezers | Rubis | K35A | |
| Tris Base | Promega | H5135 | |
| Ultracentrifuge | Beckman Coulter | Optima L-90K | |
| Ultrafiltration membrane | Millipore | UFC90300 |
Referanslar
- Moerner, W. E., Fromm, D. P. Methods of single-molecule fluorescence spectroscopy and microscopy. Review of Scientific Instruments. 74 (8), 3597-3619 (2003).
- Ha, T. Single-molecule fluorescence resonance energy transfer. Methods. 25 (1), 78-86 (2001).
- Weiss, S. Fluorescence spectroscopy of single biomolecules. Science. 283 (5408), 1676-1683 (1999).
- Stryer, L. Fluorescence energy transfer as a spectroscopic ruler. Annual Review of Biochemistry. 47, 819-846 (1978).
- Roy, R., Hohng, S., Ha, T. A practical guide to single-molecule FRET. Nature Methods. 5 (6), 507-516 (2008).
- Walter, N. G., Huang, C. Y., Manzo, A. J., Sobhy, M. A. Do-it-yourself guide: how to use the modern single-molecule toolkit. Nature Methods. 5 (6), 475-489 (2008).
- Conchello, J. A., Lichtman, J. W. Optical sectioning microscopy. Nature Methods. 2 (12), 920-931 (2005).
- Axelrod, D. Total internal reflection fluorescence microscopy in cell biology. Methods in Enzymology. 361, 1-33 (2003).
- Kim, H. D., et al. Mg2+-dependent conformational change of RNA studied by fluorescence correlation and FRET on immobilized single molecules. Proceedings of the National Academy of Sciences of the United States of America. 99 (7), 4284-4289 (2002).
- Lee, T. H., et al. Measuring the folding transition time of single RNA molecules. Biophysical Journal. 92 (9), 3275-3283 (2007).
- Holliday, R. Mechanism for Gene Conversion in Fungi. Genetical Research. 5 (2), 282-304 (1964).
- West, S. C., et al. The Formation and Resolution of Holliday Junctions during the Recombinational Repair of DNA Damages. Journal of Cellular Biochemistry. , 269-269 (1995).
- Cox, M. M., et al. The importance of repairing stalled replication forks. Nature. 404 (6773), 37-41 (2000).
- West, S. C. Molecular views of recombination proteins and their control. Nature Reviews: Molecular Cell Biology. 4 (6), 435-445 (2003).
- Duckett, D. R., et al. The structure of the Holliday junction, and its resolution. Cell. 55 (1), 79-89 (1988).
- Clegg, R. M., et al. Fluorescence resonance energy transfer analysis of the structure of the four-way DNA junction. Biochemistry. 31 (20), 4846-4856 (1992).
- McKinney, S. A., Declais, A. C., Lilley, D. M., Ha, T. Structural dynamics of individual Holliday junctions. Nature Structural Biology. 10 (2), 93-97 (2003).
- Joo, C., McKinney, S. A., Lilley, D. M., Ha, T. Exploring rare conformational species and ionic effects in DNA Holliday junctions using single-molecule spectroscopy. Journal of Molecular Biology. 341 (3), 739-751 (2004).
- Hyeon, C., Lee, J., Yoon, J., Hohng, S., Thirumalai, D. Hidden complexity in the isomerization dynamics of Holliday junctions. Nature Chemistry. 4 (11), 907-914 (2012).
- Ip, S. C., et al. Identification of Holliday junction resolvases from humans and yeast. Nature. 456 (7220), 357-361 (2008).
- Rass, U., et al. Mechanism of Holliday junction resolution by the human GEN1 protein. Genes & Development. 24 (14), 1559-1569 (2010).
- Liu, Y., et al. Crystal Structure of a Eukaryotic GEN1 Resolving Enzyme Bound to DNA. Cell Reports. 13 (11), 2565-2575 (2015).
- Chan, Y. W., West, S. GEN1 promotes Holliday junction resolution by a coordinated nick and counter-nick mechanism. Nucleic Acids Research. 43 (22), 10882-10892 (2015).
- van Gool, A. J., Hajibagheri, N. M., Stasiak, A., West, S. C. Assembly of the Escherichia coli RuvABC resolvasome directs the orientation of holliday junction resolution. Genes & Development. 13 (14), 1861-1870 (1999).
- Lee, S. H., et al. Human Holliday junction resolvase GEN1 uses a chromodomain for efficient DNA recognition and cleavage. eLife. 4, (2015).
- Chan, Y. W., West, S. C. Spatial control of the GEN1 Holliday junction resolvase ensures genome stability. Nature Communications. 5, 4844(2014).
- Liu, Y., Freeman, A. D., Declais, A. C., Lilley, D. M. J. A monovalent ion in the DNA binding interface of the eukaryotic junction-resolving enzyme GEN1. Nucleic Acids Research. 46 (20), 11089-11098 (2018).
- Zhou, R., et al. Junction resolving enzymes use multivalency to keep the Holliday junction dynamic. Nature Chemical Biology. 15 (3), 269-275 (2019).
- Bellendir, S. P., et al. Substrate preference of Gen endonucleases highlights the importance of branched structures as DNA damage repair intermediates. Nucleic Acids Research. 45 (9), 5333-5348 (2017).
- Sobhy, M. A., et al. Resolution of the Holliday junction recombination intermediate by human GEN1 at the single-molecule level. Nucleic Acids Research. 47 (4), 1935-1949 (2019).
- Sobhy, M. A., et al. Versatile single-molecule multi-color excitation and detection fluorescence set-up for studying biomolecular dynamics. Review of Scientific Instruments. 82 (11), 113702(2011).
- Kapanidis, A. N., et al. Fluorescence-aided molecule sorting: analysis of structure and interactions by alternating-laser excitation of single molecules. Proceedings of the National Academy of Sciences of the United States of America. 101 (24), 8936-8941 (2004).
- Lee, N. K., et al. Accurate FRET measurements within single diffusing biomolecules using alternating-laser excitation. Biophysical Journal. 88 (4), 2939-2953 (2005).
- Rashid, F., et al. Initial state of DNA-Dye complex sets the stage for protein induced fluorescence modulation. Nature Communications. 10 (1), 2104(2019).
- Sambrook, J., Russell, D. W. Standard ethanol precipitation of DNA in microcentrifuge tubes. Cold Spring Harbor Protocols. 2006 (1), (2006).
- Holden, S. J., et al. Defining the limits of single-molecule FRET resolution in TIRF microscopy. Biophysical Journal. 99 (9), 3102-3111 (2010).
- Bronson, J. E., Fei, J., Hofman, J. M., Gonzalez, R. L. Jr, Wiggins, C. H. Learning rates and states from biophysical time series: a Bayesian approach to model selection and single-molecule FRET data. Biophysical Journal. 97 (12), 3196-3205 (2009).
- Kou, S. C., Cherayil, B. J., Min, W., English, B. P., Xie, X. S. Single-molecule Michaelis-Menten equations. Journal of Physical Chemistry B. 109 (41), 19068-19081 (2005).
- Clegg, R. M., Murchie, A. I., Lilley, D. M. The solution structure of the four-way DNA junction at low-salt conditions: a fluorescence resonance energy transfer analysis. Biophysical Journal. 66 (1), 99-109 (1994).
- Pohler, J. R., Duckett, D. R., Lilley, D. M. Structure of four-way DNA junctions containing a nick in one strand. Journal of Molecular Biology. 238 (1), 62-74 (1994).
- Fogg, J. M., Lilley, D. M. Ensuring productive resolution by the junction-resolving enzyme RuvC: large enhancement of the second-strand cleavage rate. Biochemistry. 39 (51), 16125-16134 (2000).
- Sobhy, M. A., Joudeh, L. I., Huang, X., Takahashi, M., Hamdan, S. M. Sequential and multistep substrate interrogation provides the scaffold for specificity in human flap endonuclease 1. Cell Reports. 3 (6), 1785-1794 (2013).
- Rashid, F., et al. Single-molecule FRET unveils induced-fit mechanism for substrate selectivity in flap endonuclease 1. eLife. 6, e21884(2017).
- Zaher, M. S., et al. Missed cleavage opportunities by FEN1 lead to Okazaki fragment maturation via the long-flap pathway. Nucleic Acids Research. 46 (6), 2956-2974 (2018).
- Didenko, V. V. DNA probes using fluorescence resonance energy transfer (FRET): designs and applications. BioTechniques. 31 (5), 1106-1116 (2001).
- Toseland, C. P. Fluorescent labeling and modification of proteins. Journal of Chemical Biology. 6 (3), 85-95 (2013).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An oxygen scavenging system for improvement of dye stability in single-molecule fluorescence experiments. Biophysical Journal. 94 (5), 1826-1835 (2008).
- Swoboda, M., et al. Enzymatic oxygen scavenging for photostability without pH drop in single-molecule experiments. ACS Nano. 6 (7), 6364-6369 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır