Method Article
Méthodes de transfert d'énergie par résonance à molécule unique pour l'étude en temps réel de la résolution de jonction Holliday par GEN1
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Présenté ici est un protocole pour effectuer un transfert d'énergie de résonance de résonance de F'rster à l'étude de la résolution de HJ. L'excitation alternée bicolore est utilisée pour déterminer les constantes de dissociation. Un seul temps de temps smFRET est ensuite appliqué dans les essais de clivage en temps réel pour obtenir la distribution de temps d'arrêt avant la résolution HJ.
Résumé
Les méthodes en vrac mesurent le comportement d'ensemble des molécules, dans lequel les taux de réaction individuels des étapes sous-jacentes sont moyens dans toute la population. Le transfert d'énergie de résonance de la seule molécule (smFRET) fournit un enregistrement des changements conformationnels qui se produisent par des molécules individuelles en temps réel. Par conséquent, smFRET est puissant dans la mesure des changements structurels dans l'enzyme ou le substrat pendant la liaison et la catalyse. Ce travail présente un protocole pour l'imagerie monomolécule de l'interaction d'une jonction holliday à quatre voies (HJ) et de l'endonuclease I d'écart (GEN1), une enzyme de recombinaison homologolique cytosolique. Sont également présentés des protocoles expérimentaux d'excitation alternée unicolore et bicolore (ALEX) smFRET pour suivre la résolution du HJ par GEN1 en temps réel. La cinétique de la dimerisation GEN1 est déterminée au HJ, qui a été suggéré de jouer un rôle clé dans la résolution du HJ et est resté insaisissable jusqu'à présent. Les techniques décrites ici peuvent être largement appliquées pour obtenir des idées mécanistes précieuses de nombreux systèmes d'ADN-enzyme.
Introduction
Les méthodes monomolécules basées sur la détection de la fluorescence fournissent des rapports signal-bruit élevés1. FRET est une technique spectroscopique qui peut mesurer des distances dans la gamme de 1 à 10 nm, rendant cette technique comme une règle moléculaire pour mesurer les distances dans la gamme nanométrique2,3. Le spectre d'absorption de l'accepteur a un chevauchement spectral partiel avec le spectre d'émission du donneur à l'extrémité de longueur d'onde plus courte. FRET est médiatisé par le transfert d'énergie sans rayonnement entre un donneur et une paire d'accepteurs, alors que l'efficacité du transfert d'énergie dépend de la distance et de l'orientation de l'accepteur4.
Plusieurs approches ont été mises en œuvre pour minimiser l'arrière-plan et améliorer l'efficacité de détection du signal de fluorescence5,6. Une approche est la microscopie confocale, dans laquelle un sténopé limite la tache d'excitation à une taille inférieure à la limite de diffraction7. Une autre approche est la fluorescence interne totale de réflexion (TIRF), qui est une technique d'éclairage de large champ dans laquelle la lumière est dirigée hors-axe au-dessus d'un angle critique8. La lumière est alors totalement réfléchie à l'interface entre le verre et la solution aqueuse, générant une onde évanescente qui n'éclaire que les fluorophores attachés à la surface de verre et empêche l'arrière-plan des fluorophores dans le reste de la solution.
Dans la microscopie confocale, les molécules peuvent être soit librement diffuses, soit immobiliser sémunisation en surface. La résolution temporelle atteinte peut être en quelques microsecondes à plusieurs millisecondes9. La détection confocale d'une seule molécule est effectuée par diode avalanche monophoton (SPAD) et balayage point par point de la région d'intérêt10. Dans TIRF, une série chronologique de quelques centaines de molécules immobilisées à la surface est enregistrée par un détecteur couplé de charge bidimensionnel sensible à la position (CCD). Le CCD amplifie le signal de fluorescence soit par un écran de phosphore intensifié et une plaque microcanal, soit par une multiplication des photoélectrons (EMCCD). La résolution temporelle dépend de la vitesse de lecture et de l'efficacité quantique du CCD et généralement de l'ordre de quelques dizaines de millisecondes6.
HJ est un intermédiaire central dans la réparation et la recombinaison d'ADN11,12,13,14. HJ a deux brins continus et deux brins de croisement qui se connectent entre les brins continus sans se croiser. HJ existe en solution comme les conformateurs X-empilés, qui subissent l'iogérisation continue par les brins continus devenant la traversée et les brins de croisement devenant continus dans l'autre conformateur15. Isomer préférence du HJ dépend de la séquence de base et de l'environnement ionique et a été largement étudié par FRET16,17,18,19.
GEN120 est une protéine monomérique dans la solution21 et nécessite une dimerisation pour couper le HJ, permettant ainsi une séparation appropriée des brins recombinés22,23. La préférence d'empilement de conformiste du HJ influence le résultat de la recombinaison génétique en fixant l'orientation de la résolution par les résolutionsHJ 24. Comprendre comment GEN1 lie le HJ, coordonne les deux incisions, et s'assure que sa pleine résolution ont tous fait l'objet d'une étude intensive21,22,23,25,26 ,27,28,29,30.
Dans cette étude, une mise en place tirf basée sur l'objectif est utilisée comme décrit précédemment31. L'excitation alternée de deux couleurs (ALEX) est appliquée pour déterminer les changements conformationnels sur l'interaction de GEN1 avec le fluorophore étiqueté HJ. ALEX produit des histogrammes 2D basés sur deux paramètres ratiométriques FRET efficacité E, qui est dépendant de la distance donneur-accepteur, et le paramètre stoichiométrie S, qui mesure la stoichiométrie donneur-accepteur32. ALEX permet le tri des espèces fluorescentes en fonction des stoichiométries des fluorophores, y compris les sous-populations mixtes, les donneurs seulement, les accepteurs et les sous-populations mixtes. ALEX peut étendre l'utilisation de FRET à la gamme complète et peut détecter des différences dans la luminosité et l'oligomerisation de fluorophore aussi bien que surveiller des interactions macromolécule-ligand33.
Il est constaté que GEN1 réussit constamment à résoudre le HJ dans la durée de vie du complexe GEN1-HJ. Les changements conformationnels dépendants du temps sont dérivés des traces temporelles des molécules individuelles, tandis que les histogrammes représentent la distribution des populations sous-jacentes. L'utilisation du FRET monocolore en time-lapse, des taux d'arrêt rapides et des débits lents pour le dimère GEN1 sont démontrés, ce qui augmente l'affinité du dimère GEN1 assemblé au premier produit d'incision.
Protocole
1. Préparation des couvertures fonctionnalisées de surface
-
nettoyage
- Placer cinq couvercles (24 mm x 60 mm) dans de l'éthanol à l'intérieur d'un bocal Coplin. Sonicate en éthanol puis en hydroxyde de potassium de 1 M pendant 30 min pour 3x. Laver à l'acétone 3x puis décant.
-
Silanisation
- Préparer une solution de 2,8% 3-aminopropyltriethoxysilane (APTES) en acétone. Sceller la bouteille APTES avec un film de paraffine et conserver à 4 oC.
REMARQUE : Utilisez des lunettes de sécurité et travaillez sous une hotte de fumée. Le récipient de la solution de silane doit être complètement sec et rincé par l'acétone immédiatement avant et après avoir versé la solution de silane dans le bocal. - Verser 70 ml de la solution APTES de 2,8 % dans le bocal Coplin contenant les couvertures. Agiter le pot pendant 4 min dans un shaker orbital.
- Laissez le pot reposer sur le banc pendant 5 min, sonicate pendant 1 min, et enfin garder le pot sur le banc pendant un autre 10 min pour la silane de réagir avec les groupes d'hydroxyle sur la surface de verre.
- Désinceliser la réaction par l'ajout de 1 L d'eau déionisée en versant de l'eau directement dans le bocal pour un échange rapide de solvants. Rincer les glissières 3x dans l'eau en secouant latéralement le pot sur une surface plane.
- Sortez les couvercles du bocal et placez-les sur un plateau en aluminium. Cuire les couvercles dans un four à 110 oC pendant 30 min pour sécher les feuilles de couverture et guérir la sélane. Laissez le plateau sur le banc pour que les couvercles refroidissent à température ambiante.
- Préparer une solution de 2,8% 3-aminopropyltriethoxysilane (APTES) en acétone. Sceller la bouteille APTES avec un film de paraffine et conserver à 4 oC.
-
PEGylation (EN)
- Réchauffer le PEG et le PEG biotinylated, stockés à -20 oC à température ambiante (RT) pour empêcher la condensation de l'humidité lors de l'ouverture du récipient.
- Placez cinq couvercles avec la surface silanisée face vers le haut sur une boîte. Placez deux feuillets de verre de couverture (22 mm x 22 mm) pendant les espacetries le long des bords des couvertures silanisées.
- Une fois réchauffés, fabriquer des solutions PEG et PEG biotinylated à un rapport de 1:100 dans 1 ml de solution de bicarbonate de sodium frais de 0,1 M en ajoutant 1,5 mg de PEG biotinylated et 150 mg de PEG dans un tube de 1,5 mL.
- Vortex le tube pour dissoudre PEG et spin vers le bas pour enlever les bulles d'air.
REMARQUE: Aller de l'avant à partir de cette étape, être rapide, parce que PEG hydrolyse en solution dans un délai de min. - Appliquez rapidement 100 l de la solution PEG à chaque bordereau de couverture. Prenez un autre bordereau cuit au four et placez sa surface silanisée supérieure face cachée sur le dessus de la couverture avec la solution PEG, formant ainsi un sandwich en verre-solution-verre dans lequel les couvertures non silanisées de 22 mm x 22 mm permettent aux deux couvertures fonctionnalisées de être séparés facilement.
- Incuber les couvertures pendant la nuit (16 h) dans l'obscurité et à RT. Une fois l'incubation terminée, démonter les résilles, rincez 10x à l'aide d'eau déionisée en lavant sur le côté avec une bouteille d'asperge.
- Séchez les feuilles de couverture sous un flux d'azote sec. Conserver les feuilles sèches sous vide.
REMARQUE: Les diapositives peuvent être utilisées pendant 1 mois sans dégradation de la qualité.
2. Préparation de la cellule d'écoulement
-
Cellule à flux unique
- Percer deux trous de 1,22 mm de diamètre dans la partie médiane d'une glissière à quartz (50 mm x 20 mm) avec les centres situés à 37 mm l'un de l'autre et à 6,5 mm du bord de la glissière (figure 1A).
- Découpez un canal de 41 mm x 2,25 mm en un morceau de 50 mm x 20 mm d'une feuille à double adhésif à l'aide d'un cutter électronique.
- Épluchez le côté plastique du couvercle protecteur et alignez les bords de la pièce avec les bords de la glissière à quartz. Enlever les bulles d'air emprisonnées en appuyant doucement avec une paire de pinces à épiler en polytétrafluoroéthylène.
- Éplucher le côté papier de la pièce adhésive. Montez la pièce sur la surface fonctionnalisée de la glissière.
- Couper le tube de polyéthylène (I.D. 1.22 mm) dans une longueur de 11 cm pour l'entrée et de 25 cm pour la prise. Insérez le tube dans les trous précédemment forés comme entrée et sortie pour la cellule d'écoulement.
- Utilisez de la colle époxy de 5 min pour sceller les bords de l'interface quartz-coverslip et autour des tubes pour l'entrée et la sortie.
- Utilisez la cellule d'écoulement immédiatement une fois qu'elle sèche ou entreposez sous vide sec pour une utilisation ultérieure.
- Dissoudre l'avidine dans PBS à une concentration de 0,03 mg/mL. Filtrer à travers un filtre à seringues de 0,2 m.
- Flux avidin dans la cellule d'écoulement à l'aide d'une seringue de 1 ml. Utilisez une autre seringue remplie de tampon pour éliminer l'excès d'avidin. Veillez à ne pas introduire de bulles d'air lors de l'échange des seringues.
-
Cellule d'écoulement à canaux multiples
- Percer six trous d'un diamètre de 1,22 mm sur chacun des longs côtés d'une glissière à quartz (76 mm x 25 mm) (Figure 1B). Faire les trous à 4,5 mm du bord de la glissière et à 9,3 mm l'un de l'autre. Assurez-vous que la distance entre les centres de chaque paire de trous est de 15 mm.
- Découper six canaux (20 mm x 2,25 mm) en un morceau de ruban adhésif double adhésif de 76 mm x 25 mm à l'aide du cutter électronique.
- Épluchez le côté plastique du couvercle protecteur et alignez les bords de la pièce adhésive avec les bords de la glissière à quartz. Enlever les bulles d'air emprisonnées en appuyant doucement à l'aide d'une paire de pinces à épiler en polytétrafluoroéthylène.
- Épluchez le côté papier de la pièce adhésive et montez sur la surface fonctionnalisée de la glissière.
REMARQUE : Parfois, le décollement du côté du papier et l'attachement à la glissière de quartz fonctionne bien dans la cellule d'écoulement multicanal. - Couper les tubes d'invette (11 cm) et les tubes de sortie (25 cm) pour les six canaux. Préparer la cellule d'écoulement telle que décrite dans les étapes 2.1.6-2.1.9.
- Connectez la sortie du premier canal à la pompe. Placer l'entrée dans un tube de 0,5 ml avec OSS.
REMARQUE : La longueur du tube d'entrée est choisie pour maximiser le nombre d'événements dans les expériences de clivage effectuées sous le flux continu en synchronisant le temps d'entrée d'enzyme dans la cellule d'écoulement et le début de l'imagerie diminuant ainsi le photoblanchiment prématuré de la fluorophores. - Déplacez-vous vers un nouveau canal en déconnectant la prise du canal utilisé. Fermer la prise avec un bouchon fait à partir d'une aiguille de seringue scellée avec de la colle dans la partie en plastique. Fermer l'en-face du canal utilisé.
3. Préparation du système de récupération d'oxygène (OSS)
- Dissoudre 0,2 g d'acide (quencher d'état triplet) qui minimise le clignotement des fluorophores dans 800 l'eau de méthanol.
- Ajouter 6 ml de H2O déionisé et ajouter 1 N NaOH dans le sens de la goutte jusqu'à ce qu'il se dissolve. Filtrer à travers un filtre à seringues, faire 1 ml d'aliquots et conserver à -80 oC. La concentration du stock est de 100 m.
- Préparer une solution fraîche de 3,4-dihroxybenzoic acide (PCA) en dissolvant 61 mg de poudre de PCA dans 4 mL de ddH2O. La concentration du stock est de 100 nM.
- Ajouter 58 'L de 10 NaOH dropwise, en veillant à vortex après chaque goutte jusqu'à ce que PCA soit entièrement dissous (pH 9).
- Dissoudre 5,3 mg de protocatechuate 3,4-dioxygenase (3,4-PCD) dans 7 mL de tampon de stockage PCD (tableau 1). 3,4-PCD enlève l'oxygène des tampons de liaison/clivage en catalysant l'oxydation de l'acide protocatechuic34.
- Diviser la solution PCD en 1 mL d'aliquots. La concentration du stock est de 1 M. Snap-freeze les aliquots dans l'azote liquide et le stockage à -80 oC pour le stockage à long terme ou à -20 oC pour le stockage à court terme.
- Préparer un tampon de liaison frais (tableau 1). Remplacer 2 mM CaCl2 par 2 mM MgCl2 pour les expériences de clivage smFRET.
- Préparer 1 ml du tampon d'imagerie (tableau 1). Gardez le tampon d'imagerie sur la glace jusqu'à ce qu'il soit introduit dans la cellule d'écoulement pour maintenir l'activité du système de récupération d'oxygène.
4. Préparation de HJs étiquetés fluorescents
- Reconstituer les oligos lyophilisés (tableau 2) dans le tampon Tris-EDTA (tableau 1) à une concentration de 100 M.
- Préparer la jonction synthétique en mélangeant des portions d'équimolar de 3 l de chacun el où les oligos X0 figurent dans le tableau 1.
- Anneal en chauffant à 95 oC pendant 5 min, suivi d'un refroidissement lent à RT à un taux de 1 oC/min. Utilisez soit un bloc thermique, soit un thermocycler PCR pour atteindre le taux de refroidissement désiré.
- Chargez le mélange sur 8 cm x 8 cm de 10% tris-borate-EDTA gel polyacrylamide. Appliquer 100 V et faire fonctionner le gel pendant 2 h. Les bandes sont clairement vus à l'œil nu, et leur couleur est violette.
- Accise la bande du substrat annealed avec une lame propre. Transférer la pièce de gel dans un tube autoclaved de 1,5 ml.
- Écraser la pièce de gel à l'intérieur du tube avec un piston propre, puis ajouter 100 l de tampon TE100 (tableau 1).
- Extraire le HJ en secouant le tube à 20 oC à 1 500 tr/min dans un thermomixeur pour 2 h ou incuber pendant la nuit à 4 oC.
- Effectuer des précipitations d'éthanol sur la solution contenant le substrat35.
- Resuspendre le substrat en 20 l de tampon TE100 (tableau 1). La concentration finale est de 1à3 M. Aliquot 2 L dans chaque tube et entreposez à -20 oC.
5. Expression et purification protéinées de GEN1
- Construire le plasmide pour l'expression de l'homme tronqué GEN11,2,3,4,5 avec hexa histidine-tag au C-terminus20 par PCR du vecteur d'entrée.
REMARQUE : Le marquage N-terminal entraînerait l'inactivation de GEN1. La queue C non structurée rend la purification de la pleine longueur GEN1 beaucoup plus difficile. En outre, la pleine longueur GEN1 a été signalé à montrer moins d'activité que la version tronquée23. - Transformez le vecteur d'expression en e. coli BL21-CodonPlus (DE3)-RIPL.
- Inoculer les cellules transformées en deux flacons de 6 L contenant chacun 2 L de l'amas de bouillon de Luria à 37 oC en secouant à 180 tr/min jusqu'à ce qu'un OD600 de 0,8 soit atteint.
- Refroidissez la culture à 16 oC et induisez l'expression GEN1 avec 0,1 mM d'isopropyl-d-thiogalactopyranoside (IPTG) pendant 48 h.
- Récoltez les cellules en les faisant tourner vers le bas à 4 oC à 1 000 x g dans une centrifugeuse. Chaque litre de culture donne 5à6 g de granule.
- Jeter le supernatant et resuspendre les cellules granulées dans le tampon de lyse (tableau 1) en utilisant 4 ml/g de cellules.
- Effectuer la lyse cellulaire à l'aide d'un perturbateur cellulaire à 30 kPsi, puis tourner vers le bas à 10.000 x g pendant 1 h à 4 oC. Recueillir le supernatant et le filtrer sur la glace à l'aide de filtres de 0,45 m.
- Effectuer la purification des protéines à l'aide de FPLC en passant le filtrate à travers une colonne Ni-NTA de 5 ml à un débit de 2,5 ml/min à l'aide du tampon A (tableau 1).
- Laver avec 15 volumes de colonnes (CV). Elute avec un gradient linéaire de tampon A et 500 mM Imidazole plus de 20 CV en fractions de 5 ml. GEN1 élute de la colonne à environ 100 mM Imidazole.
- Pipette 10 Aliquots L des fractions collectées, ajouter un volume égal de 2x SDS colorant de chargement à chaque aliquot. Dénaturer les échantillons en chauffant à 90 oC pendant 5 min, refroidir et faire tourner les échantillons.
- Chargez les échantillons sur 10% de gel Bis-Tris. Exécuter le gel pendant 30à45 min à 200 V. Stain à l'aide de Coomassie Brilliant Blue, puis destain. Recueillir les fractions qui contiennent GEN1 purifié.
- Réduire la concentration en sel des fractions combinées à 100 mm par dilution à l'aide d'un tampon C(tableau 1).
- Passer la protéine faible en sel à travers une colonne d'héparine de 5 ml à un débit de 3 ml/min à l'aide du tampon B (tableau 1).
- Laver avec 10 CV. Elute à l'aide d'un gradient de 20 CV avec Buffer B et 1 M NaCl. Recueillir 5 mL fractions dans lesquelles GEN1 élude autour de 360 mM NaCl.
- Vérifiez les fractions élucées pour les fractions GEN1 purifiées telles que décrites à l'étape 5.8. Combinez ces fractions et diluez-les à 100 mM NaCl à l'aide du tampon C.
- Chargez la protéine de sel inférieure sur une colonne d'échange de cation à 1 ml/min de débit à l'aide du tampon B.
- Elute par un gradient de 40 CV en utilisant Buffer B et 1 M NaCl. Recueillir 1,7 ml fractions dans lesquelles GEN1 élude environ 300 mM NaCl.
- Vérifiez la pureté de GEN1 dans les fractions élucées telles que décrites à l'étape 5.8.
- Combiner les fractions les plus pures et dialyser à 4 oC contre le tampon de stockage (tableau 1). Effectuer au moins un échange de la mémoire tampon pendant la dialyse.
- Mesurer la concentration enprotéines de 0,5 mg/ml. Aliquot la protéine dialysée en 10à15 volumes de L dans de petits tubes, le flash-gel dans l'azote liquide, et stocker à -80 oC.
6. Expériences FRET à molécule unique
REMARQUE : Les expériences smFRET sont effectuées sur une configuration TIRF basée sur des objectifs sur mesure sur mesure (figure 1C) décrite précédemment31.
- Expériences FRET monocolores
- Appliquer une goutte d'huile d'immersion sur l'objectif 100x TIRF. Définir l'EMCCD à gain approprié pour optimiser le signal à l'arrière-plan et prévenir la saturation.
REMARQUE : Ne regardez pas directement dans le faisceau laser et portez des lunettes de protection lors de l'alignement du laser. - Placez soigneusement la cellule d'écoulement sur le support de l'échantillon. Augmenter graduellement l'objectif en utilisant un ajustement grossier jusqu'à ce que l'huile touche la couverture.
- Allumez le laser vert (532 nm). Passez au mode de réglage fin de l'objectif. Dirigez l'émission vers le port de la caméra pour observer l'image sur le moniteur.
- Ajuster la hauteur de l'objectif jusqu'à ce que la surface fonctionnalisée de la glissière de couverture soit mise au point et puisse être observée sur le moniteur.
REMARQUE : L'acquisition d'images par EMCCD déclenche l'excitation laser via le filtre acousto-optique tunable (AOTF) pour empêcher l'échantillon de photoblanchiment lorsque les images ne sont pas acquises. - Vérifiez que l'arrière-plan de la surface fonctionnalisée des couvertures ne dépasse pas quelques taches avant de couler dans le HJ étiqueté fluorescent.
- Diluer le substrat de stock environ 1000 fois dans le tampon TE100 (tableau 1) à une concentration finale de 1 à 5 nM. Pipette 0,2 à 0,5 L du substrat dilué en 120 oL du tampon d'imagerie avec OSS dans un tube de 0,5 ml.
- Connectez la sortie de la cellule d'écoulement à la pompe à seringues. Insérez le tube d'entrée de la cellule d'écoulement dans un tube de 1,5 ml et actionnez la pompe à seringues à un débit de 30 à 50 l/min pour retirer la solution du tube.
- Vérifiez fréquemment la surface pour une bonne couverture (100 à 300 de substrat homogènement distribué et bien espacé) en imagerie brièvement avec le laser vert.
- Si la couverture de surface n'est toujours pas suffisante, attendez quelques minutes pour que le HJ étiqueté fluorescent de la solution se dépose sur la surface ou répète l'étape qui coule.
- Flux supplémentaire de 120 l de tampon d'imagerie (tableau 1) à 30'50 'L/min pour laver hJ fluorescente non liée. Ensuite, laissez la cellule d'écoulement reposer pendant 5 min pour permettre à l'OSS d'épuiser l'oxygène dissous. Le photoblanchiment des fluorophores devrait être minime au début de l'imagerie.
- Définir le temps d'exposition (60 ms), le temps de cycle sera automatiquement réglé par logiciel en fonction de la vitesse de transfert de données (104 ms), et spécifier le nombre souhaité de cycles ou d'images (400). L'émission du donneur (Cy3) et de l'accepteur (Alexa Fluor 647) est divisée en deux canaux de couleur par un dispositif de fractionnement d'image.
- Trouver une zone appropriée sur la surface, concentrer l'image en ajustant la hauteur de l'objectif et enregistrer et enregistrer le film en format 16 bits TIFF.
- Déplacez-vous dans une nouvelle zone.
REMARQUE : Déplacez-vous toujours dans une seule direction (c.-à-d. de la prise à l'inlet) pour éviter l'imagerie de la même zone deux fois. - Préparer 1, 2, 5, 10, 25, 50, 75 et 100 nM GEN1 dans 120 'L de tampon d'imagerie un à la fois. Flux de la solution à un débit de 30-50 L/min.
REMARQUE: Si la mesure requise est effectuée à l'état stable comme dans la liaison de HJ par GEN1 ou l'iogérisation du HJ gratuit, puis attendre 3 à 5 min après le flux s'arrête pour enregistrer le film. Acquérir trois à quatre films de nouvelles zones pour chaque concentration GEN1. - Si la mesure est effectuée en continu comme dans le clivage de HJ par GEN1, puis commencer à enregistrer 5-10 s avant l'entrée de GEN1 dans la cellule d'écoulement. Répétez la mesure en se déplaçant vers un nouveau canal dans la cellule d'écoulement à six canaux.
- À la fin, utilisez une diapositive fixe de perle fluorescente pour cartographier les particules du donneur et de l'accepteur les unes aux autres dans le dispositif de fractionnement d'image.
- Ajouter 0,2 L de perles fluorescentes de 1 m de diamètre dans 500 l de 1 M Tris (pH à 8,0) pour permettre aux perles de coller à la surface.
- Couper un carré (18 mm x 18 mm) à l'intérieur d'un morceau de 22 mm x 22 mm d'un joint adhésif à double face. Épluchez et collez le morceau au milieu d'une glissière de quartz de 76 mm x 25 mm.
- Placer 50 l de la solution de perles diluées et laisser reposer de 5 à 10 min. Fixez un bordereau de 22 mm x 22 mm sur le dessus de la pièce carrée. Sécher l'excès de perles solution avec du tissu, puis sceller la chambre par de la colle époxy.
- Acquérir 100 cadres de la glissière de perles à un temps d'exposition de 60 ms.
CAUTION: Abaissez la puissance laser et le gain EMCCD au minimum pour éviter la saturation du détecteur. - Installez le logiciel (p. ex. TwoTones) et ouvrez les films qui s'y contaient comme indiqué dans le manuel d'utilisation36. Sélectionnez les positions des perles individuelles dans les canaux du donneur et de l'accepteur. Générer une matrice de transformation telle que décrite dans le manuel.
REMARQUE : Ce logiciel utilise la matrice de transformation pour correspondre aux positions des particules dans les canaux du donneur et de l'accepteur et corriger tout léger désalignement dans le dispositif de fractionnement d'image. - Aller à Fichier, appuyez sur Load Movie, puis sélectionnez le fichier du film et appuyez sur Open. Dans le menu de fichiers, appuyez sur Charge TFORM et sélectionnez la matrice de transformation générée à partir de la diapositive de perles. Ajustez le seuil pour les canaux donneur et accepteur jusqu'à ce qu'aucun faux positif ne soit inclus.
- Dans le menu du filtre Channel, choisissez l'option D et A pour sélectionner les particules étiquetées à la fois avec le donneur et l'accepteur. Vérifiez le champ de limite de voisin le plus proche pour exclure les molécules qui sont très proches les unes des autres. Vérifier l'ellipticité Max pour exclure les molécules très excentriques et vérifier les limites de largeur pour exclure les molécules très larges ou très étroites.
- Type plotHistCW tel qu'instruit dans le manuel Twotones pour construire des histogrammes.
REMARQUE : L'efficacité « apparente » du FRET est calculée par le programme en divisant l'émission de l'accepteur par les émissions totales du donateur et de l'accepteur. Twotones utilise 100 intervalles pour bin la distribution des états des molécules contre l'efficacité FRET. - Type de parcelleTimetraceCW comme indiqué dans le manuel Twotones pour générer les traces temporelles pour chaque molécule.
REMARQUE : Les traces temporelles peuvent être analysées plus en détail par vbFRET37 afin d'identifier les différents états FRET, leurs temps d'attente respectifs et les taux de transition entre les différents états.
- Appliquer une goutte d'huile d'immersion sur l'objectif 100x TIRF. Définir l'EMCCD à gain approprié pour optimiser le signal à l'arrière-plan et prévenir la saturation.
- Expériences d'excitation alternée bicolore FRET (ALEX)
- Enregistrez un film composé de cadres consécutifs d'émissions de donneurs et d'accepteurs par excitations directes avec les lasers verts et rouges, respectivement, d'une durée de 80 ms chacun.
- Ouvrez les films ALEX acquis dans Twotones. Fixer le seuil de détection approprié à 300 euros pour les trois canaux : émission des donateurs due à l'excitation des donateurs (DexDem); l'émission d'accepteurs due à l'excitation des donateurs (DexAem); et l'émission d'accepteur due à l'excitation directe (AexAem).
- Appliquer le filtre Channel DexDem et DexAem et AexAem pour sélectionner pour les particules qui ont à la fois donateur et accepteur. Lier les particules 200 à 300 euros dans les trois canaux.
- Utilisez le code PlotHistALEX MATLAB pour générer des histogrammes ALEX. Alignez différents pics dans les histogrammes aux fonctions gaussiennes et déterminez le pourcentage de chaque population la zone sous la courbe en utilisant le logiciel Origin38.
REMARQUE : Les pics de l'analyse de liaison correspondent au complexe GEN1-HJ lié, tandis que dans le HJ libre, les pics représentent les isosomers interchangeants. - Utilisez le code MATLAB de la parcelleTimetraceALEX pour générer une trace temporelle pour chaque molécule montrant l'émission des donneurs par excitation directe, et les émissions d'accepteurs dues au FRET et à l'excitation directe.
REMARQUE : ALEX trace de temps indépendamment pour montrer les émissions du donateur et de l'accepteur, mais à une résolution temporelle inférieure à celle du FRET d'une seule couleur. Semblable à fret unicolore, les traces temporelles ALEX peuvent être analysées plus en détail par vbFRET pour identifier les différents états FRET et leurs temps d'attente respectifs. - Déterminer la constante de dissociation en adaptant les pourcentages de la population liée par rapport à la concentration GEN1 à une fonction hyperbolique.
- Temps lapse fret monocolore
- Définir le temps d'exposition du laser vert à 60 ms et le temps de cycle à 624 ms ou moins, selon la vitesse de la dynamique observée.
- Définir le débit à 110 l/min dans un canal de la cellule d'écoulement à six canaux. Commencez l'enregistrement brièvement avant l'entrée de GEN1 à l'intérieur de la cellule d'écoulement.
REMARQUE : Le flux continu conduit à un photoblanchiment rapide des fluorophores, donc synchroniser le début de l'imagerie et l'entrée de protéines maximise le nombre d'événements capturés. La lecture optimale de la pompe à seringues dépend du volume mort et du tube exact utilisé pour assembler la cellule d'écoulement; dans notre cas, il est de 25 euros L. - Acquérir un film de 125 images pour un temps d'acquisition total de 78 s. À la fin de l'enregistrement, exposez l'échantillon au laser rouge pendant 50 images chacune avec un temps d'exposition de 25 ms pour sonder l'accepteur.
REMARQUE : Cette méthode prolonge la fenêtre d'observation dans l'expérience de clivage en diminuant le nombre de cycles d'excitation. Les paramètres cinétiques comme kon et koff de la dimerisation sont dérivés en adaptant la distribution à un modèle bi-exponentiel30,38.
7. Essais de changement de mobilité électrophorétique (EMSA)
- Dans un volume total de 50 L, incuber la concentration désirée de GEN1 avec 50 pM Cy5 étiqueté HJ à RT pendant 30 min dans le tampon de liaison EMSA (tableau 1).
- Chargez les échantillons sur 8 cm x 8 cm de gel Tris-borate-EDTA de 6 %. Exécuter le gel en utilisant 100 V pour 1 h - 20 min en tampon 1x TBE à RT.
- Déterminer le pourcentage de substrat lié à une concentration GEN1 à partir de sa contribution relative à l'intensité totale de fluorescence de la voie respective.
REMARQUE: GEN1 monomer-HJ (bande I) est identifié par l'accord de sa taille avec la liaison picomolar de GEN1 monomer à la hJ21entaillé,30. GEN1-dimer-HJ est affecté à la bande II en raison de la liaison progressive de GEN1 monomer à la HJ21,23. - Calculez les constantes de liaison apparentes Kd-monomer-app-EMSA et Kd-dimer-app-EMSA en utilisant l'équation :

Où : Max est la concentration à laquelle l'espèce respective a atteint sa liaison maximale (monomère ou dimère); n est le coefficient de Hill; K (en) d-app-EMSA est la constante de liaison apparente de l'espèce respective, dénotant la concentration de GEN1 à laquelle la moitié-maximum de monomère ou de dimère est présente.
Résultats
Préjugé et isomérisation du HJ
L'isogérisation de HJ a fait l'objet d'une enquête approfondie par fret par l'étiquetage de deux bras adjacents de la jonction17,18,39. Le donneur (Cy3) et l'accepteur (Alexa Fluor 647) sont positionnés aux deux bras voisins, R (brin 2) et X (brin 3), respectivement (figure 2A). Les isomères empilés-X ont été assignés par leurs deux brins continus [c.-à-d., Iso(1,3) ou Iso(2,4)]. L'histogramme ALEX FRET de l'étiquette adjacente X0 montre deux pics qui correspondent à l'échange de l'Iso (1,3) (E 0,75) plus abondant et moins abondant Iso(2,4) (E 0,40) (Figure 2B).
Fret monocolore est utilisé pour acquérir des traces de temps pour enregistrer les changements conformationnels rapides dans le HJ libre avec une résolution temporelle élevée de 10 ms via la réduction de la zone utilisée de la caméra EMCCD2. Une trace de temps FRET de couleur unique représentative de la jonction X0 montre les transitions entre les isomères FRET élevés et bas (Figure 2B). Les taux d'isorisation kIso(1,3)-Iso(2,4) et kIso(2,4)-Iso(1,3) obtenus à partir des histogrammes de temps de séjour d'Iso(1,3) et d'Iso(2,4) (figure 2C) sont compatibles avec ceux rapportés précédemment17.
SMFRET démontre une distorsion active du HJ par GEN1
HJ subit un réarrangement structurel lors de la liaison avec GEN122. Ainsi, l'espacement entre le donneur et l'accepteur est similaire à l'Iso (1,3) et à l'Iso(2,4) (figure 3A). Les essais de liaison smFRET ont été effectués en présence de Ca2 pour empêcher le clivage du HJ. LES histogrammes FRET de la jonction X0 de l'étiquette adjacente à différentes concentrations gen1 ont été acquis par ALEX (Figure 3B). L'histogramme est adapté à deux fonctions gaussiennes : l'une correspondant à la haute FRET Iso (1,3), et l'autre correspondant à la population liée gen1-HJ après avoir soustrait la contribution de l'Iso (2,4) du pic fret faible.
À la concentration saturante de GEN1, l'histogramme fret de X0 n'a qu'un seul pic fret faible correspondant à GEN1 lié à l'un ou l'autre isomère du HJ comme prévu par le modèle22. La dissociation apparente du monomère constante (Kd-monomer-app) est déterminée à partir de l'ajustement hyperbolique des pourcentages de population gen1-lié en fonction de la concentration GEN1 (Figure 3C). L'étiquette adjacente nk-X0 représente une version entaillée unique HJ qui imite le produit après la première réaction d'incision. En raison du soulagement de la souche d'empilement par le pseudo simulé, nk-X0 est une structure non-isomerizing40 comme évident à partir du pic de substrat unique à E 0,40, contrairement à X0 (Figure 3D vs Figure 3B). La structure du complexe GEN1-nk-X0 est similaire à celle du complexe GEN1-X0, comme l'indique la similitude de l'efficacité fret (E 0,25 pour nk-X0 et 0,32 pour X0) (Figure 3D vs. Figure 3B). La forte liaison du monomère GEN1 au nk-X0 est démontrée par la valeur de l'application Kd-monomer 40 fois plus faible que celle de X0 (Figure 3E vs Figure 3C). Cette liaison serrée peut servir de mécanisme de protection contre la résolution incomplète du HJ dans le cas peu probable de la dissociation du dimère GEN1 ou de l'un de ses monomères.
Liaison stepwise de monomère GEN1 au HJ
La liaison du monomère GEN1 au HJ suivie de la formation de dimer est une caractéristique unique pour le hJ eucaryotique resolvase GEN1 par rapport aux résolutions procaryotes, qui existent sous forme dimérique dans la solution21,23,41. EMSA de GEN1 à 50 pM X0 montre l'association progressive de GEN1 dans les complexes d'ordre supérieur, comme indiqué par les chiffres romains dans le panneau supérieur (Figure 4A). La constante de dissociation du monomère GEN1 déterminée par EMSA (Kd-monomer-EMSA) coïncide avec la constante de dissociation de l'assay de liaison smFRET Kd-monomer-app ( Figure4A et Figure 3C , respectivement). La quantification de la bande II est utilisée pour calculer la constante de dissociation de l'équilibre de GEN1 dimer (Kd-dimer-EMSA). EMSA de GEN1 à 50 pM nk-X0 démontre la liaison monomère proéminente comme indiqué par le très faible Kd-monomer-app-EMSA qui est 30 fois plus bas que celui de X0, tandis que son Kd-dimer-EMSA est comparable à celle de X0 (Figure 4B).
Une autre preuve que gen1 monomère lie et déforme le HJ est l'observation d'un nombre important de traces de particules non clivées à faible état FRET stable (Figure 4C) en présence de Mg2 à de faibles concentrations GEN1. Le nombre de ces traces a diminué en augmentant la concentration de GEN1. La résolution du HJ est entraînée par la liaison serrée du monomère GEN1, qui soutient la formation du dimère. La liaison monomère est observée dans les traces temporelles du nk-X0 non clivé dans Mg2,qui s'étend jusqu'à peu de concentration nanomolaire (Figure 4D). Le monomère GEN1 se lie étroitement pour sauvegarder nk-X0, assurant éventuellement la pleine résolution par la formation de dimère.
SMFRET résolution d'astoisûr du HJ
Le terme « clivage » dans les essais smFRET est utilisé de façon interchangeable avec « résolution » du HJ, puisque dans cet analyse, seule la version du produit qui suit le deuxième événement de clivage est détectée. Les événements sont enregistrés par excitation en une seule couleur en time-lapse afin de minimiser le photoblanchiment de l'accepteur photosensible pendant le temps d'acquisition de 1,3 min.
Le schéma de la figure 5A illustre les incisions des brins 1 et 3 de X0 Iso(1,3) après la liaison et la distorsion par GEN1 d'un X0 attaché au verre fonctionnalisé. Le donateur et l'accepteur entrent en solution entraînant la perte de leurs signaux après la résolution HJ. Les premières et deuxièmes incisions sont découplées dans le nk-X0, qui illustre un prototype pour le HJ partiellement résolu. Sur la liaison de GEN1, nk-X0 adopte une structure similaire à X0. La résolution procède par une seule incision dans le brin 1, comme l'illustre la figure 5B.
Le départ simultané du donneur et de l'accepteur après un état FRET faible stable dans des traces de X0 résolu s'est produit sans l'émergence d'un FRET intermédiaire (E - 0,40) indique que la résolution complète se produit dans la durée de vie du GEN1-HJ complexe (figure 5C). Par conséquent, ces résultats suggèrent que la résolution HJ se produit dans la durée de vie complexe GEN1-HJ. La résolution du nk-X0 se poursuit également après un réarrangement structurel et se termine par le départ du duplex transportant deux fluorophores (Figure 5D) similaire à X0.
Cinétique de la dimérisation GEN1 sur GEN1 monomer lié HJ
Mesures smFRET time-lapse -avant le clivage qui comprend principalement le temps nécessaire pour la formation du dimère et la résolution du HJ après la distorsion par GEN1 monomer. En appliquant cette technique, des éléments de preuve directs sont fournis à l'appui de l'allégation selon laquelle la formation du dimère est nécessaire pour la résolution de X0 et de nk-X0, puisque la distribution de la concentration gen1dépend de la concentration.
Le taux apparent de la résolution HJ (kapp) est défini comme l'inverse de la moyenne de'avant-clivage à la concentration GEN1 respective. Le terme « apparent » est utilisé pour décrire le taux de la résolution HJ, puisque la possibilité que GEN1 reste lié au produit après la résolution HJ ne peut pas être exclue.
Les fonctions de densité de probabilité (PDF) des distributionsavant clivage de X0 (Figure 6A) reflètent le temps de formation du dimère, qui est plus long à de faibles concentrations de GEN1, puis plus court à des concentrations GEN1 plus élevées. Les taux d'association et de dissociation pour le dimer, kon-dimer et koff-dimer, respectivement, sont déterminés à partir d'un modèle bi-exponentiel30. En outre, les pDF de nk-X0 (Figure 6B) montrent une distribution similaire à X0 indiquant l'exigence de formation de dimère.
L'intrigue del'application kcontre la concentration GEN1 a été adaptée à une fonction hyperbolique. Les constantes apparentes du taux de catalyse (kMax-app) de X0 et nk-X0 sont de 0,107 à 0,011 s-1 et 0,231 à 0,036 s-1, respectivement (Figure 6C). Les parcelles de kapp pour X0 et nk-X0 jonctions se croisent à la concentration GEN1 5,6 nM en raison de la plus rapide kMax-app et plus lent kon-dimer de la nicked par rapport à la jonction intacte.
En résumé, le krelativement rapideon-dimer et le klenthors-dimer conduisent à la progression de la réaction vers l'avant vers la résolution HJ une fois que le dimer est formé. La forte liaison du monomère GEN1 à la jonction nk-X0 constitue un mécanisme de sécurité contre tout clivage improbable avorté seconde ou aide à ramasser tous les HJs incomplètement non résolus laissés par les voies de résolution primaire dans la cellule.
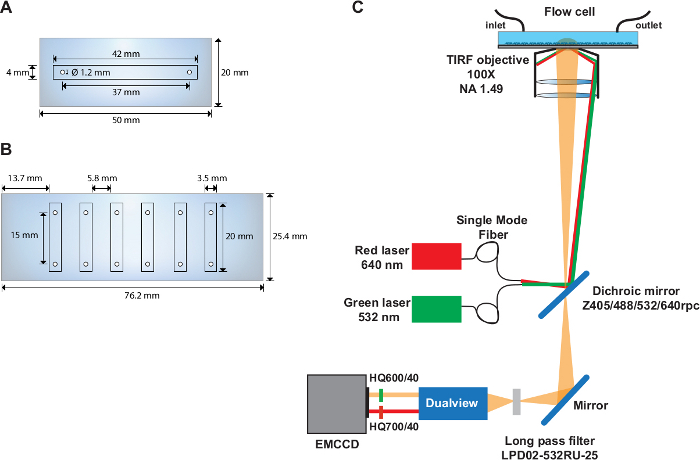
Figure 1 : Cellules d'écoulement à canal unique et multiple et mise en page de la configuration optique.
(A) Schéma de la cellule d'écoulement à un seul canal. (B) Schéma tique de la cellule d'écoulement à six canaux. (C) Mise en page de la configuration optique représentant les sources d'excitation, l'objectif TIRF, le miroir dichroïque installé à l'intérieur du cube de filtre et les filtres d'émission utilisés dans le dispositif de fractionnement d'images. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2 : Biais de contorsion et iomérisation du HJ observés par FRET.
(A) Isomerization des conformateurs HJ empilés de l'étiquette X adjacents nommés d'après les deux brins continus. Les brins sont numérotés, tandis que les bras sont indiqués par des lettres. Les sites d'incision sont représentés par des flèches. Les positions du donateur (vert) et de l'accepteur (rouge) et le changement dans le FRET lors de l'isomérisation sont indiqués. (B) Panneau droit : trace de temps FRET (noir) et trace fret idéalisée (rouge) de X0 à 50 mM Mg2. Panneau gauche : histogramme FRET de X0 à 50 mM Mg2. Les intensités de fluorescence du donneur (vert) et de l'accepteur (rouge) sont indiquées ci-dessous. (C) Les histogrammes de temps d'atsatation de l'étiquette adjacente X0 Iso(1,3) et d'Iso(2,4) ont été adaptés à des fonctions monoexponentiels pour déterminer les taux d'isorisation. Les incertitudes indiquent l'intervalle de confiance de 95% de l'ajustement. Ce chiffre a été modifié à partir de la littérature publiée précédemment30.
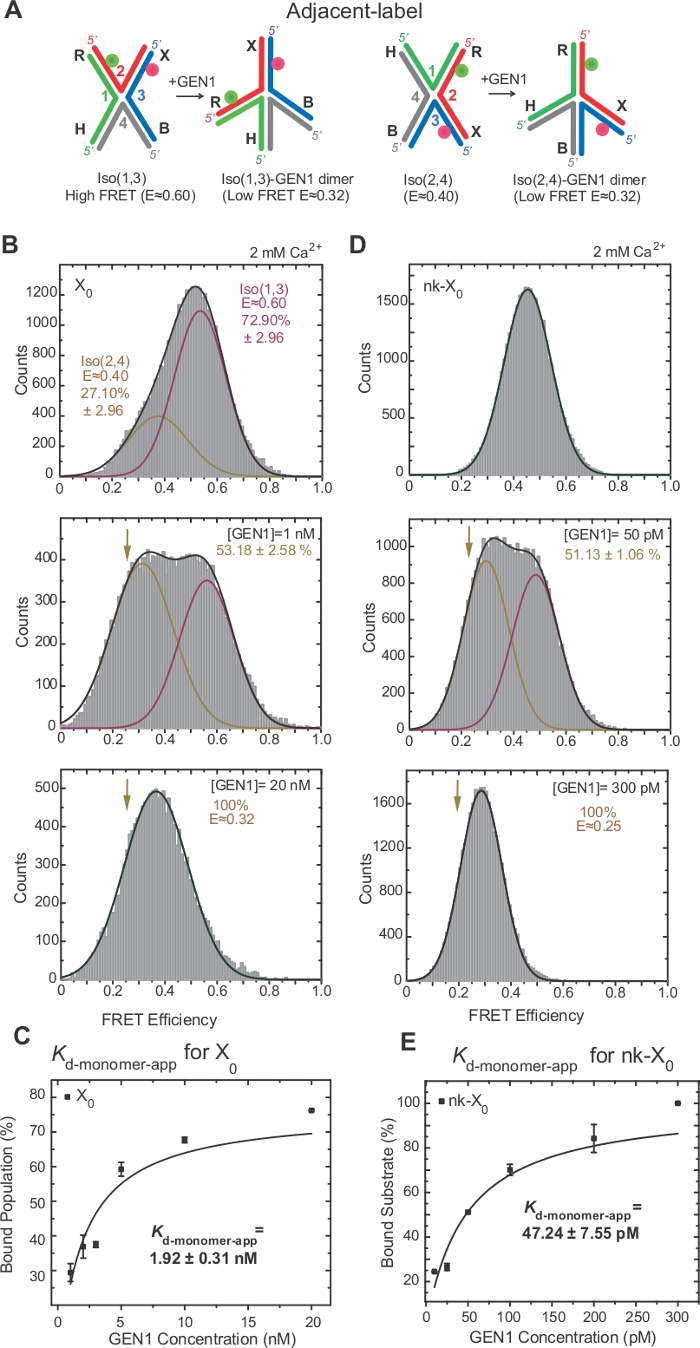
Figure 3 : Distorsion active du HJ par GEN1.
(A) Modification structurelle de l'étiquette adjacente HJ basée sur le modèle proposé22. (B) L'histogramme ALEX FRET de l'étiquette adjacente X0 a un pic FRET élevé majeur (E - 0,6) correspondant à Iso (1,3) et un pic FRET inférieur (E - 0,4) pour Iso (2,4). L'histogramme entier est adapté à deux fonctions gaussiennes : l'une correspondant à la haute FRET Iso (1,3), et l'autre correspondant à la population liée moins la contribution initiale d'Iso (2,4) à la population totale. (C) La constante apparente de dissociation monomère (Kd-monomer-app) est déterminée à partir d'un ajustement hyperbolique des pourcentages de populations GEN1-liées en fonction de la concentration GEN1. (D) Histogrammes FRET de l'étiquette adjacente nk-X0 à différentes concentrations GEN1. La zone sous le fret faible (E - 0,25) Gaussian correspond au pourcentage de la population liée. (E) Le Kd-monomer-app de nk-X0 est déterminé à partir de l'ajustement hyperbolique de la population GEN1-lié. Les barres d'erreur représentent les écarts types de deux expériences ou plus. Ce chiffre a été modifié à partir de la littérature publiée précédemment30. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 4 : Liaison progressive de GEN1 au HJ.
(A) Epophoretic mobility shift assay (EMSA) de GEN1 à 50 pM X0. Panneau supérieur : les chiffres romains indiquent le nombre de monomères GEN1 dans le complexe. Panneau inférieur : liaison du monomère GEN1 à X0. Les constantes apparentes de dissociation ont été obtenues à partir d'un ajustement sigmoïdal de l'espèce respective et représentent la moyenne de deux expériences. (B) EMSA de GEN1 à 50 pM nk-X0 démontre la liaison monomère proéminente comme indiqué par le très faible Kd-monomer-app-EMSA. (C) FRET trace temporelle de l'étiquette adjacente x0 en Mg2 . L'excitation des donneurs pendant 1,3 min a été réalisée, suivie de l'excitation de l'accepteur direct (région rose ombragée). (D) FRET trace temporelle de l'étiquette adjacente liée mais non clivée nk-X0 en Mg2. Ce chiffre a été modifié à partir de la littérature publiée précédemment30. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 5 : L'exemple de résolution SMFRET du HJ.
(A) Schéma de l'étiquette adjacente X0 Iso(1,3) après distorsion par GEN1. Le substrat est fixé à la surface fonctionnalisée par liaison biotine/avidine. La dissociation de GEN1 après les deux incisions a comme conséquence la perte du donneur et de l'accepteur qui entrent dans la solution. (B) Schéma de la résolution de l'étiquette adjacente nk-X0 en clivage brin 1. (C) Trace temporelle (noir) à 2 mMg Mg2 du clivage d'Iso(1,3). Le début de la liaison GEN1 forme un état FRET bas stable jusqu'à ce que le signal FRET soit brusquement perdu en raison du clivage. En conséquence, l'augmentation du donneur et la diminution des intensités de fluorescence acceptorsurale sur la liaison GEN1 sont suivies par la disparition simultanée de la fluorescence des deux colorants sur le clivage. (D) De même, la trace temporelle du nk-X0 montre un état FRET bas stable sur la liaison GEN1 qui est conclue par la perte brutale du signal FRET. Ce chiffre a été modifié à partir de la littérature publiée précédemment30. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 6 : Cinétique de la dimérisation GEN1 sur GEN1 monomer lié HJ.
(A) La parcelle de la fonction de densité de probabilité (PDF) de la distributionavant clivage de X0 illustre sa dépendance à la concentration GEN1. Les temps d'attente de l'état faible de FRET(avant-clivage)à la concentration respective de GEN1 ont été obtenus à partir de deux expériences ou plus et utilisés pour obtenir des taux moyens (kapp). Les tauxd'application kénumérés sont déterminés à partir de l'inverse de la moyenne avantclivage à la concentration GEN1 respective. L'association (kon-dimer) et les taux de dissociation (koff-dimer) pour la formation de dimer sont calculés à partir d'un modèle bi-exponentiel38. Les erreurs représentent SEM del'application k. (B) L'intrigue PDF des distributionsavant clivage de nk-X0 et les tarifs respectifs del'application k. (C) Terrain del'application kpar rapport à la concentration GEN1 adaptée à une fonction hyperbolique pour déterminer le taux catalytique apparent (kMax-app). L'intrigue del'application kpour X0 et nk-X0 illustrel'application kinitiale plus rapide de X0 qui est ensuite dépassé par nk-X0 au-dessus [GEN1] 5,6 nM. Ce chiffre a été modifié à partir de la littérature publiée précédemment30. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
| tampon | Compostion | ||
| Tampon de liaison | 40 mM Tris-HCl pH 7,5, 40 mM NaCl, 2 mM CaCl2, 1 mM DTT, 0,1 % BSA et 5 % (v/v) glycérol | ||
| Tampon A | 20 mM Tris-HCl pH 8.0, 1 mM DTT et 300 mM NaCl | ||
| Tampon B | 20 mM Tris-HCl pH 8.0, 1 mM DTT et 100 mM NaCl | ||
| Tampon C | 20 mM Tris-HCl pH 8.0 et 1 mM DTT | ||
| Tampon de clivage | 40 mM Tris-HCl pH 7,5, 40 mM NaCl, 2 mM MgCl2, 1 mM DTT, 0,1 % BSA et 5 % (v/v) glycérol | ||
| Tampon de liaison EMSA | 40 mM Tris-HCl pH 7,5, 40 mM NaCl, 1 mM DTT, 2 mM CaCl2, 0,1 mg/ml BSA, 5 % (v/v) glycérol et 5 ng/l Poly-dI-dC | ||
| Tampon d'imagerie (liaison) | 40 L ()-6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid (4 M), 60 'L PCA (6 nM), 60 'L PCD (60 nM) et 840 'L of Binding buffer | ||
| Tampon d'imagerie (clivage) | 40 L ()-6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid (4 M), 60 'L PCA (6 nM), 60 'L PCD (60 nM) et 840 'L of Cleavage buffer | ||
| Tampon De Lysis | 20 mM Tris-HCl pH 8,0, 10 mM de mercaptoéthanol, 300 mM NaCl et 2 mM De PMSF | ||
| Tampon de stockage PCD | 100 mM Tris-HCl pH 7,5, 1 mM EDTA, 50 mM KCl et 50% glycérol | ||
| tampon de stockage | 20 mM Tris-HCl pH 8,0, 1 mM DTT, 0,1 mM EDTA, 100 mM NaCl et 10% glycérol | ||
| Tampon TBE | 89 mM Tris-HCl, 89 mM d'acide borique et 2 mM EDTA | ||
| Tampon TE100 | 10 mM Tris.HCl pH 8.0 et 100 mM NaCl | ||
| Tampon Tris-EDTA | 50 mM Tris-HCl pH 8,0 et 1 mM EDTA pH 8,0 | ||
Tableau 1 : La liste des tampons et leurs compositions utilisées dans cette étude.
| Oligo | ordre | ||
| X0-st1 | ACGCTGCCGAATTCAccaGTGCCTTGCTAGCACATCTTTGCCCacCTGCAGGTTCACCC | ||
| X0-st2 | GGGTGAACCTGCAGGTGGG/iCy3/AAAGATGTCCATTGTTGTAATCGTCAAGCTTTATGCCGTCGT | ||
| X0-st3 | ACGGCATAAAGCTGACGA/iAF647-dT/TACAACAGATCATGGAGCTGTCTAGAGGATCCGACTATCG | ||
| X0-st4 | 5'BiotinCGATAGTGGATCCTCTAGACAGCTCCATGTAGCAAGGCACTGGTAGAATTCGGCAGCGT | ||
| X0-Adj | X0-st1, X0-st2, X0-st3 et X0-st4 | ||
| X0In-st2 | GGGTGAACCTGCAGGTGGGCAAAGATGTCCATCTGTTGTAATCGTCAAGCTTTATGCCGT | ||
| X0In-st4 | 5'BiotinCGATAGTGGATCCTCTAGACAGCTCCATGTAGCAAGGCA/iCy3/TGGTAGAATTCGGCAGCGT | ||
| Nk-X0 | X0-st1, X0-st2, X0-nk3a, X0-nk3b et X0-st4 | ||
| X0-nk3a | ACGGCATAAAGCTGACGA/iAF647-dT/TACAACAGATC | ||
| X0-nk3b | ATGGAGCTGTCTAGAGGATCCGACTATCG | ||
Tableau 2 : substrats SMFRET et EMSA HJ. La liste des oligonucléotides utilisés pour la préparation des HJ fluorescents étiquetés pour smFRET et EMSA. Les oligos ont été obtenus commercialement. Les oligos étiquetés fluorescents étaient purifiés par HPLC et, dans la mesure du possible, les oligos de 60 pb étaient purifiés page.
Discussion
Dans cette étude, différentes techniques smFRET ont été mises en œuvre pour déterminer la cinétique de la résolution HJ par GEN130. Des approches smFRET similaires ont été utilisées pour suivre l'exigence conformationnelle de l'ADN à double volet et le clivage par la réplication de l'ADN et la réparation des volets endonuclease 142,43,44. Ici, les étapes critiques de ce protocole sont discutées. La réaction de silanisation doit être exempte de toute trace d'humidité. La solution de pegylation doit être appliquée rapidement sur le verre silanisé une fois que LE PEG est dissous pour éviter l'hydrolyse. Dans la cellule d'écoulement multicanal, tout air emprisonné dans la feuille adhésive doit être enlevé pour éviter les fuites entre les canaux voisins. La solution PCA doit être fraîchement préparée car elle s'oxyde au fil du temps. L'ajout de 10 N NaOH doit être dropwise, avec vortexing entre les deux. L'arrière-plan de fluorescence dans le coverslip devrait être minimal avant de couler le HJ fluorescent. L'imagerie dans la cellule d'écoulement doit être effectuée dans une direction pour éviter l'imagerie des zones blanchies. Dans les expériences ALEX, la puissance du laser rouge devrait être réduite pour éviter le blanchiment rapide de l'accepteur. Dans les expériences en time-lapse, le temps de cycle doit être plus court que l'événement le plus rapide.
smFRET est une technique sensible qui peut fournir des informations précieuses en temps réel dans les réactions biomoléculaires. Cependant, cette méthode a plusieurs défis techniques, parmi lesquels est d'atteindre un changement mesurable dans FRET au cours de la réaction biochimique. Ceci est nécessaire pour obtenir des caractéristiques bien séparées dans les histogrammes et les états distinguables dans les traces temporelles. Dans de nombreux cas, smFRET nécessite une conception soigneuse des substrats, la sélection des paires de fluorophore et leurs positions, et l'amplification des changements fret dans le substrat d'ADN en raison des petits changements structurels dans le substrat45. Une autre approche pour effectuer FRET est d'utiliser des protéines étiquetées46. La fenêtre d'observation dans FRET est limitée par la stabilité de l'accepteur comme Cy5 ou Alexa Fluor 647 qui tend à blanchir plus rapidement que le donneur (Cy3 dans ce cas). Par conséquent, FRET nécessite une recherche continue de fluorophores stables pour prolonger la durée de l'expérience et les efforts visant à développer des systèmes de récupération d'oxygène pour prolonger le signal de fluorescence et maximiser le rapport signal-bruit47,48 .
Parmi les conseils pour le dépannage dans smFRET est d'équilibrer les plusieurs paramètres impliqués dans l'imagerie tels que la puissance laser, temps d'exposition, temps de cycle, et le nombre de cycles pour maximiser l'émission de fluorescence, prolonger la durée de l'expérience, et atteindre intervalles d'échantillonnage appropriés pour la dynamique enzymatique. Des temps d'observation plus longs et des effets minimes du photoblanchiment sont essentiels pour obtenir des distributions de temps de séjour de haute fidélité qui représentent la dynamique enzymatique. ALEX génère de meilleurs histogrammes puisque cette méthode est soumise à des contributions plus faibles à partir de particules photoblanchies par rapport à fret monocolore. Cependant, la résolution temporelle dans ALEX est inférieure à celle de fret unicolore.
Enfin, l'accent mis par smFRET sur la détection des changements conformationnels/structurels dans les molécules individuelles en temps réel comble l'écart entre les techniques structurelles à haute résolution (c.-à-d. la cristallographie aux rayons X, la résonance magnétique nucléaire, la microscopie électronique), qui fournit des détails structurels de résolution atomique dans des conditions statiques et des méthodes en vrac qui donnent la moyenne d'ensemble d'une propriété mesurable. À bien des égards, smFRET s'est avéré être une technique puissante pour étudier les systèmes biologiques en temps réel.
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt financier concurrent.
Remerciements
Ce travail a été soutenu par l'Université des sciences et de la technologie king Abdullah par le biais d'un financement de base et d'un prix de recherche concurrentiel (CRG3) à S. M. H.
matériels
| Name | Company | Catalog Number | Comments |
| (±)-6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid (Trolox) | Sigma-Aldrich | 238813 | |
| 0.1 M sodium bicarbonate buffer | Fisher | 144-55-8 | |
| 10 % Novex Tris-Borate-EDTA gel | Thermo Fisher Scientific | EC6275BOX | |
| 100 X TIRF objective | Olympus | NAPO 1.49 | |
| 3,4-dihroxybenzoic acid (PCA) | Sigma-Aldrich | P5630 | |
| 3-aminopropyltriethoxysilane (APTES) | Sigma-Aldrich | 741442 | |
| 6% Novex Tris-Borate-EDTA gel | Thermo Fisher Scientific | EC6265BOX | |
| Adhesive sheet | Grace bio-labs | SA-S-1L | |
| Benchtop refrigerated centrifuge | Eppendorf | Z605212 | |
| Biotin-PEG | Laysan Bio | Biotin-PEG-SVA 5000 | |
| Bovine Serum Albumin (BSA) | New England Biolabs | B9001S | |
| Calcium Chloride Dihydrate | Sigma-Aldrich | 31307 | |
| cation exchange column | GE healthcare | MonoS (4.6/100) | |
| Cell distruptor | Constant Cell Disruption System | TS5/40/CE/GA | |
| Coomassie Brilliant Blue | MP Biomedicals | 808274 | |
| Cy3 emission filter | Chroma | HQ600/40M-25 | |
| Cy5/Alexa Fluor 647 emission filter | Chroma | HQ700/40M-25 | |
| Dichroic for DV2 filter cube | Photometrics | 630dcxr-18x26 | |
| Dithiothreitol (DTT) | Thermo Scientific | R0861 | |
| Drill | Dremel | 200-1/21 | |
| Electronic cutter | Copam | CP-2500 | |
| EMCCD camera | Hamamatsu | C9100-13 | |
| Epoxy glue | Devcon | 14250 | |
| FPLC Aktapurifier UPC 10 | GE Healthcare | 28406268 | |
| GelQuant.NET software | biochemlabsolutions.com | Version 1.8.2 | |
| GEN1 entry vector | Harvard plasmid repository | HSCD00399935 | |
| Glycerol | Sigma Life Science | G5516 | |
| green laser (emission 532 nm) | Coherent | Compass 315M-100 | |
| Heparin column | GE healthcare | HiTrap Heparin column | |
| HEPES | BDH | BDH4162 | |
| Image splitter | Photometrics | Dualview (DV2) | |
| Imidazole | Sigma-Aldrich | I2399 | |
| Inverted microscope | Olympus | IX81 | |
| Isopropyl-ß-D-thiogalactoside (IPTG) | Goldbio. | 12481C100 | |
| Laser scanner | GE healthcare | Typhoon Trio | |
| LB Broth | Fisher Scientific | BP1426-500 | |
| Long pass 532nm filter | Semrock | LPD02-532RU-25 | |
| Magnesium Chloride | Sigma Life Science | M8266 | |
| mPEG | Laysan Bio | mPEG-SVA 5000 | |
| Neutravidin | Pierce | 31000 | |
| Ni-NTA column | GE healthcare | HisTrap FF | |
| NuPAGE 10% Bis-Tris gels | Novex Life technologies | NP0301BOX | |
| NuPAGE 10% Bis-Tris Protein Gels | Thermo Fisher Scientific | NP0302PK2 | |
| Origin software | OriginLab Corporation | Version 8.5 | |
| Phenylmethylsulfonyl fluoride (PMSF) | Alexis Biochemicals | 270-184-G025 | |
| Phosphate-buffered saline | GIBCO | 14190 | |
| Polyethylene Tubing (I.D. 0.76 mm O.D. 1.22mm) | Fisher (Becton Dickinson) | 427416 | |
| Protocatechuate 3,4-dioxygenase (3,4-PCD) | Sigma-Aldrich | P8279-25UN | |
| Quad-band dichroic | Chroma Inc | Z405/488/532/640rpc | |
| red laser (emission 640 nm) | Coherent | Cube 640 100C | |
| Sodium Chloride | Fisher Chemical | S271 | |
| Sorvall RC-6 plus centrifuge | Thermo Fisher Scientific | 46910 | |
| Spectrophotometer | Thermo Fisher Scientific | Nanodrop 2000 | |
| Syringe pump | Harvard Apparatus | 70-3007 | |
| Teflon tweezers | Rubis | K35A | |
| Tris Base | Promega | H5135 | |
| Ultracentrifuge | Beckman Coulter | Optima L-90K | |
| Ultrafiltration membrane | Millipore | UFC90300 |
Références
- Moerner, W. E., Fromm, D. P. Methods of single-molecule fluorescence spectroscopy and microscopy. Review of Scientific Instruments. 74 (8), 3597-3619 (2003).
- Ha, T. Single-molecule fluorescence resonance energy transfer. Methods. 25 (1), 78-86 (2001).
- Weiss, S. Fluorescence spectroscopy of single biomolecules. Science. 283 (5408), 1676-1683 (1999).
- Stryer, L. Fluorescence energy transfer as a spectroscopic ruler. Annual Review of Biochemistry. 47, 819-846 (1978).
- Roy, R., Hohng, S., Ha, T. A practical guide to single-molecule FRET. Nature Methods. 5 (6), 507-516 (2008).
- Walter, N. G., Huang, C. Y., Manzo, A. J., Sobhy, M. A. Do-it-yourself guide: how to use the modern single-molecule toolkit. Nature Methods. 5 (6), 475-489 (2008).
- Conchello, J. A., Lichtman, J. W. Optical sectioning microscopy. Nature Methods. 2 (12), 920-931 (2005).
- Axelrod, D. Total internal reflection fluorescence microscopy in cell biology. Methods in Enzymology. 361, 1-33 (2003).
- Kim, H. D., et al. Mg2+-dependent conformational change of RNA studied by fluorescence correlation and FRET on immobilized single molecules. Proceedings of the National Academy of Sciences of the United States of America. 99 (7), 4284-4289 (2002).
- Lee, T. H., et al. Measuring the folding transition time of single RNA molecules. Biophysical Journal. 92 (9), 3275-3283 (2007).
- Holliday, R. Mechanism for Gene Conversion in Fungi. Genetical Research. 5 (2), 282-304 (1964).
- West, S. C., et al. The Formation and Resolution of Holliday Junctions during the Recombinational Repair of DNA Damages. Journal of Cellular Biochemistry. , 269-269 (1995).
- Cox, M. M., et al. The importance of repairing stalled replication forks. Nature. 404 (6773), 37-41 (2000).
- West, S. C. Molecular views of recombination proteins and their control. Nature Reviews: Molecular Cell Biology. 4 (6), 435-445 (2003).
- Duckett, D. R., et al. The structure of the Holliday junction, and its resolution. Cell. 55 (1), 79-89 (1988).
- Clegg, R. M., et al. Fluorescence resonance energy transfer analysis of the structure of the four-way DNA junction. Biochemistry. 31 (20), 4846-4856 (1992).
- McKinney, S. A., Declais, A. C., Lilley, D. M., Ha, T. Structural dynamics of individual Holliday junctions. Nature Structural Biology. 10 (2), 93-97 (2003).
- Joo, C., McKinney, S. A., Lilley, D. M., Ha, T. Exploring rare conformational species and ionic effects in DNA Holliday junctions using single-molecule spectroscopy. Journal of Molecular Biology. 341 (3), 739-751 (2004).
- Hyeon, C., Lee, J., Yoon, J., Hohng, S., Thirumalai, D. Hidden complexity in the isomerization dynamics of Holliday junctions. Nature Chemistry. 4 (11), 907-914 (2012).
- Ip, S. C., et al. Identification of Holliday junction resolvases from humans and yeast. Nature. 456 (7220), 357-361 (2008).
- Rass, U., et al. Mechanism of Holliday junction resolution by the human GEN1 protein. Genes & Development. 24 (14), 1559-1569 (2010).
- Liu, Y., et al. Crystal Structure of a Eukaryotic GEN1 Resolving Enzyme Bound to DNA. Cell Reports. 13 (11), 2565-2575 (2015).
- Chan, Y. W., West, S. GEN1 promotes Holliday junction resolution by a coordinated nick and counter-nick mechanism. Nucleic Acids Research. 43 (22), 10882-10892 (2015).
- van Gool, A. J., Hajibagheri, N. M., Stasiak, A., West, S. C. Assembly of the Escherichia coli RuvABC resolvasome directs the orientation of holliday junction resolution. Genes & Development. 13 (14), 1861-1870 (1999).
- Lee, S. H., et al. Human Holliday junction resolvase GEN1 uses a chromodomain for efficient DNA recognition and cleavage. eLife. 4, (2015).
- Chan, Y. W., West, S. C. Spatial control of the GEN1 Holliday junction resolvase ensures genome stability. Nature Communications. 5, 4844(2014).
- Liu, Y., Freeman, A. D., Declais, A. C., Lilley, D. M. J. A monovalent ion in the DNA binding interface of the eukaryotic junction-resolving enzyme GEN1. Nucleic Acids Research. 46 (20), 11089-11098 (2018).
- Zhou, R., et al. Junction resolving enzymes use multivalency to keep the Holliday junction dynamic. Nature Chemical Biology. 15 (3), 269-275 (2019).
- Bellendir, S. P., et al. Substrate preference of Gen endonucleases highlights the importance of branched structures as DNA damage repair intermediates. Nucleic Acids Research. 45 (9), 5333-5348 (2017).
- Sobhy, M. A., et al. Resolution of the Holliday junction recombination intermediate by human GEN1 at the single-molecule level. Nucleic Acids Research. 47 (4), 1935-1949 (2019).
- Sobhy, M. A., et al. Versatile single-molecule multi-color excitation and detection fluorescence set-up for studying biomolecular dynamics. Review of Scientific Instruments. 82 (11), 113702(2011).
- Kapanidis, A. N., et al. Fluorescence-aided molecule sorting: analysis of structure and interactions by alternating-laser excitation of single molecules. Proceedings of the National Academy of Sciences of the United States of America. 101 (24), 8936-8941 (2004).
- Lee, N. K., et al. Accurate FRET measurements within single diffusing biomolecules using alternating-laser excitation. Biophysical Journal. 88 (4), 2939-2953 (2005).
- Rashid, F., et al. Initial state of DNA-Dye complex sets the stage for protein induced fluorescence modulation. Nature Communications. 10 (1), 2104(2019).
- Sambrook, J., Russell, D. W. Standard ethanol precipitation of DNA in microcentrifuge tubes. Cold Spring Harbor Protocols. 2006 (1), (2006).
- Holden, S. J., et al. Defining the limits of single-molecule FRET resolution in TIRF microscopy. Biophysical Journal. 99 (9), 3102-3111 (2010).
- Bronson, J. E., Fei, J., Hofman, J. M., Gonzalez, R. L. Jr, Wiggins, C. H. Learning rates and states from biophysical time series: a Bayesian approach to model selection and single-molecule FRET data. Biophysical Journal. 97 (12), 3196-3205 (2009).
- Kou, S. C., Cherayil, B. J., Min, W., English, B. P., Xie, X. S. Single-molecule Michaelis-Menten equations. Journal of Physical Chemistry B. 109 (41), 19068-19081 (2005).
- Clegg, R. M., Murchie, A. I., Lilley, D. M. The solution structure of the four-way DNA junction at low-salt conditions: a fluorescence resonance energy transfer analysis. Biophysical Journal. 66 (1), 99-109 (1994).
- Pohler, J. R., Duckett, D. R., Lilley, D. M. Structure of four-way DNA junctions containing a nick in one strand. Journal of Molecular Biology. 238 (1), 62-74 (1994).
- Fogg, J. M., Lilley, D. M. Ensuring productive resolution by the junction-resolving enzyme RuvC: large enhancement of the second-strand cleavage rate. Biochemistry. 39 (51), 16125-16134 (2000).
- Sobhy, M. A., Joudeh, L. I., Huang, X., Takahashi, M., Hamdan, S. M. Sequential and multistep substrate interrogation provides the scaffold for specificity in human flap endonuclease 1. Cell Reports. 3 (6), 1785-1794 (2013).
- Rashid, F., et al. Single-molecule FRET unveils induced-fit mechanism for substrate selectivity in flap endonuclease 1. eLife. 6, e21884(2017).
- Zaher, M. S., et al. Missed cleavage opportunities by FEN1 lead to Okazaki fragment maturation via the long-flap pathway. Nucleic Acids Research. 46 (6), 2956-2974 (2018).
- Didenko, V. V. DNA probes using fluorescence resonance energy transfer (FRET): designs and applications. BioTechniques. 31 (5), 1106-1116 (2001).
- Toseland, C. P. Fluorescent labeling and modification of proteins. Journal of Chemical Biology. 6 (3), 85-95 (2013).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An oxygen scavenging system for improvement of dye stability in single-molecule fluorescence experiments. Biophysical Journal. 94 (5), 1826-1835 (2008).
- Swoboda, M., et al. Enzymatic oxygen scavenging for photostability without pH drop in single-molecule experiments. ACS Nano. 6 (7), 6364-6369 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon