Method Article
GEN1에 의한 홀리데이 정션 분해능의 실시간 조사를 위한 단일 분자 Förster 공명 에너지 전송 방법
요약
여기서 제시된 것은 HJ 분해능을 연구하기 위해 단일 분자 Förster 공명 에너지 전달을 수행하기 위한 프로토콜이다. 2색 교대 여기는 해리 상수를 결정하는 데 사용됩니다. 단색 시간 경과 smFRET는 HJ 분해 전에 거주 시간 분포를 얻기 위해 실시간 절단 분석에 적용된다.
초록
벌크 방법은 분자의 앙상블 거동을 측정하며, 이 때 기본 단계의 개별 반응 률은 인구 전체에 걸쳐 평균화됩니다. 단일 분자 Förster 공명 에너지 전달 (smFRET)은 실시간으로 개별 분자에 의해 일어나는 형태 변화의 기록을 제공합니다. 따라서, smFRET는 결합 및 촉매 동안 효소 또는 기판의 구조적 변화를 측정하는데 강력하다. 이 작품은 세포질 상동 재조합 효소인 4방향 홀리데이 접합부(HJ) 및 갭 엔도누클로스 I(GEN1)의 상호작용의 단일 분자 이미징을 위한 프로토콜을 제시한다. 또한 GEN1에 의한 HJ의 분해를 실시간으로 따르기 위한 단색 및 2색 교류(ALEX) smFRET 실험 프로토콜이 제시된다. GEN1 이량화의 역학은 HJ의 해결에 있는 중요한 역할을 하기 위하여 건의된 HJ에서 결정되고 지금까지 애매하게 남아 있습니다. 여기에 기술된 기술은 많은 효소 DNA 시스템의 귀중한 기계론적 통찰력을 얻기 위하여 넓게 적용될 수 있습니다.
서문
형광 검출에 기초한 단일 분자 방법은 높은 신호 대 잡음 비율1을제공합니다. FRET는 1-10 nm 범위의 거리를 측정할 수 있는 분광 기술로, 이 기술을 나노미터 범위2,3에서거리를 측정하기 위한 분자 눈금자로 렌더링합니다. 수용자의 흡수 스펙트럼은 더 짧은 파장 단부에서 공자의 방출 스펙트럼과 부분적인 스펙트럼 중첩을 가한다. FRET는 공여자와 수락자 쌍 사이의 방사선이 없는 에너지 전달에 의해 매개되는 반면, 에너지 전달의 효율은 수용자4의거리 및 방향에 의존한다.
배경을 최소화하고 형광 신호5,6의검출 효율을 향상시키기 위해 여러 가지 접근법이 구현되었습니다. 한 가지 접근법은 공초점 현미경 검사법으로, 핀홀이 여기 지점을 회절 한계7이하의 크기로 제한합니다. 또 다른 접근법은 총 내부 반사 형광(TIRF)이며, 이는 빛이 임계 각8위의 오프축을 향하는 광시야 조명 기술이다. 빛은 유리와 수성 용액 사이의 인터페이스에 완전히 내부적으로 반사되어 유리 표면에 부착 된 형광단만 을 비추고 나머지 부분에서 형광로호르의 배경을 방지하는 전도파를 생성합니다. 솔루션.
공초점 현미경 검사법에서, 분자는 자유롭게 확산되거나 표면 고정될 수 있습니다. 달성된 시간적 해상도는 마이크로초에서 몇 밀리초9이내일 수 있습니다. 단일 분자에 대한 공초점 검출은 관심 영역의 단일 광자 눈사태 다이오드(SPAD) 및 점별 스캐닝에 의해 수행된다10. TIRF에서 표면에 고정된 수백 개의 분자의 타임시리즈는 위치 민감도 2차원 전하 결합 검출기(CCD)에 의해 기록됩니다. CCD는 강화된 형광체 스크린 및 마이크로채널 플레이트 또는 광전자(EMCCD)의 온칩 증식에 의해 형광 신호를 증폭시됩니다. 시간적 해상도는 CCD의 판독 속도 및 양자 효율에 따라 달라지며 일반적으로 수십 밀리초6의순서로 달라집니다.
HJ는 DNA 수리 및 재결합11,12,13,14의중앙 중간체이다. HJ는 서로 교차하지 않고 연속 가닥 간에 연결되는 두 개의 연속 및 2개의 교차 가닥을 가지고 있습니다. HJ는 X-스택 응체로서 용액에 존재하며, 이는 연속 가닥이 교차되고 교차 가닥이 다른컨포머(15)에서연속되는 것에 의해 연속적인 이소성화를 겪는다. HJ의 이소머 선호도는 코어 서열 및 이온 환경에 의존하며 FRET16,17,18,19에의해 광범위하게 연구되었다.
GEN120은 용액21에서 단모성 단백질이며 HJ를 갈라기 위해 이량화가 필요하므로 재결합 된 가닥22,23의적절한 분리를 허용합니다. HJ의 스태킹 컨포머 선호도는 HJ resolvases24에의한 해상도의 방향을 설정하여 유전 재결합의 결과에 영향을 미칩니다. GEN1이 HJ를 결합하고, 두 절개를 조정하고, 전체 해상도가 모두 집중적 인 연구21,22,23,25,26을 받고 있는지 이해 ,27,28,29,30.
이 연구에서는, 앞서31에설명된 바와 같이 객관적인 기반 TIRF 설정이 사용된다. 2색 교대로 여기(ALEX)를 적용하여 Gen1과 HJ라벨이 부착된 형광포와의 상호작용시 형태 변화를 결정합니다. ALEX는 2개의 비율 메트릭 파라미터 FRET 효율 E, 이는 공여체-수용자 거리 의존성, 및 공여체-수용기 stoichiometry32를측정하는 stoichiometry 파라미터 S를 기반으로 2D 히스토그램을 생성한다. ALEX는 기증자 전용, 수용자 전용 및 혼합 하위 집단을 포함하여 형광단의 stoichiometries에 근거를 둔 형광 종의 분류를 가능하게 합니다. ALEX는 전체 범위로 FRET의 사용을 확장할 수 있으며 형광부 밝기 및 올리고머화의 차이를 감지할 수 있을 뿐만 아니라 거대분자-리간드상호작용(33)을모니터링할 수 있다.
GEN1은 GEN1-HJ 복합체의 수명 내에서 HJ를 해결하는 데 지속적으로 성공한 것으로 나타났습니다. 히스토그램은 근본적인 인구의 분포를 나타내는 동안 시간 의존하는 형태 변화는 개별 분자의 시간 추적에서 파생됩니다. 타임랩스 단색 FRET를 사용하여 GEN1 디머에 대한 빠른 온레이트와 느린 오프레이트가 입증되어 첫 절개 제품에서 조립된 GEN1 디머의 친화도를 증가시킴을 유발합니다.
프로토콜
1. 표면 기능화 커버립의 준비
-
클리닝
- 코플린 항아리 안에 에탄올에 5개의 커버슬립(24mm x 60mm)을 넣습니다. 에탄올에 소닉에 넣고 1 M M 수산화 칼륨을 30 분 동안 3x. 아세톤 3x로 씻은 다음 데틴트에 씻으소서.
-
실라화
- 아세톤에 2.8% 3-아미노프로필리에톡실란(APTES)의 용액을 준비한다. APTES 병을 파라핀 필름으로 밀봉하고 4°C에서 보관하십시오.
참고: 안전 고글을 사용하고 연기 후드 아래에서 작업하십시오. 일란 용액의 용기는 완전히 건조되고 항아리에 시란 용액을 붓기 직전과 후에 아세톤으로 헹구어야합니다. - 2.8% APTES 용액의 70 mL를 커버립을 포함하는 코플린 항아리에 붓습니다. 궤도 셰이커에서 항아리를 4분 간 흔들어 줍니다.
- 항아리가 5 분 동안 벤치에 서서 1 분 동안 초음파 처리한 다음 마지막으로 실란이 유리 표면의 하이드록실 그룹과 반응할 수 있도록 10 분 동안 벤치에 항아리를 유지하십시오.
- 신속한 용매 교환을 위해 항아리에 직접 물을 부어 탈이온수 1 L을 첨가하여 반응을 담금질합니다. 평평한 표면에 항아리의 옆으로 흔들어 물에 슬라이드 를 3 배 헹구십시오.
- 커버슬립을 항아리에서 꺼내 알루미늄 호일 트레이에 놓습니다. 커버슬립을 110°C에서 오븐에 30분간 구워 서 커버슬립을 건조시키고 실란을 경화시립니다. 트레이를 벤치에 두어 커버립을 실온으로 식힙니다.
- 아세톤에 2.8% 3-아미노프로필리에톡실란(APTES)의 용액을 준비한다. APTES 병을 파라핀 필름으로 밀봉하고 4°C에서 보관하십시오.
-
PEGylation
- 용기를 개봉시 수분의 응축을 방지하기 위해 -20 °C에서 실온 (RT)에 저장 된 생체 용 페그와 PEG를 따뜻하게하십시오.
- 상자에서 실란화된 표면이 위를 향하여 5개의 덮개 를 놓습니다. 실란화된 커버 슬립의 가장자리를 따라 스페이서로 두 개의 커버 유리 슬립(22mm x 22mm)을 놓습니다.
- 일단 예열되면, 1mL의 신선한, 0.1 M 나트륨 중탄산염 용액에서 1.5 mg의 생체 티니틸화 된 PEG와 150 mg의 PEG를 1.5 mL 튜브에 추가하여 1mL의 비율로 생체 틸화 된 PEG 및 PEG 용액을 만듭니다.
- 튜브를 소용돌이로 하여 PEG를 용해시키고 아래로 회전하여 기포를 제거합니다.
참고 : PEG가 최소 시간 내에 용액에서 가수 분해되기 때문에이 단계에서 진행하십시오. - 각 커버슬립에 PEG 용액 100 μL을 빠르게 바치도록 하십시오. 또 다른 구운 커버 슬립을 가지고 PEG 용액으로 커버 슬립 위에 상단 실란 표면을 향하도록 배치하여 22mm x 22mm 비 실란화 커버립을 허용하는 유리 용액 유리 샌드위치를 형성합니다. 쉽게 분리할 수 있습니다.
- 커버슬립을 밤새 (16시간) 어둠 속에서 RT에서 배양합니다. 배양이 완료되면, 덮개를 따로 따로 가져 온 다음 분출 병으로 옆에서 씻어 탈이온 수를 사용하여 10 배 헹구십시오.
- 마른 질소의 흐름 아래 커버립을 건조. 마른 커버슬립을 진공 밑에 보관하십시오.
참고: 슬라이드는 품질 저하 없이 1개월 동안 사용할 수 있습니다.
2. 유동 전지의 준비
-
단일 채널 플로우 셀
- 석영 슬라이드의 중간 부분에 직경이 1.22mm인 두 개의 구멍을 드릴(50mm x 20mm)의 중앙은 37mm 간격으로, 슬라이드 가장자리에서 6.5mm 떨어져있습니다(그림 1A).
- 전자 커터를 사용하여 41mm x 2.25mm 채널을 50mm x 20mm 크기의 이중 접착 시트로 잘라냅니다.
- 보호 커버의 플라스틱 면을 벗기고 조각의 가장자리를 석영 슬라이드의 가장자리와 정렬합니다. 폴리테트라플루오로에틸렌 핀셋으로 가볍게 눌러 갇힌 기포를 제거합니다.
- 접착제 조각의 용지 쪽을 벗깁니다. 커버슬립의 기능화된 표면에 조각을 장착합니다.
- 폴리에틸렌 튜브(I.D. 1.22 mm)를 입구의 경우 11cm, 출구의 경우 25cm의 길이로 자른다. 튜브를 유동 셀의 입구 및 출구로 이전에 뚫은 구멍에 삽입합니다.
- 5분 에폭시 접착제를 사용하여 석영 커버슬립 인터페이스의 가장자리와 입구 및 출구의 튜브 주변을 밀봉합니다.
- 나중에 사용하기 위해 건조하거나 건조한 진공 아래에 보관한 후 즉시 플로우 셀을 사용하십시오.
- 0.03 mg/mL의 농도로 PBS에서 아비딘을 용해시. 0.2 μm 주사기 필터를 통해 필터링합니다.
- 아비딘을 1 mL 주사기를 사용하여 유동 셀로 흐르게 한다. 버퍼로 채워진 다른 주사기를 사용하여 여분의 아비딘을 씻어냅니다. 주사기를 교환하는 동안 기포가 들어가지 않도록 주의하십시오.
-
다중 채널 흐름 셀
- 석영 슬라이드의 긴 면(76mm x 25mm)에 직경이 1.22mm인 6개의 구멍을 드릴합니다(그림1B). 슬라이드 가장자리에서 4.5mm, 간격으로 9.3mm 떨어진 구멍을 만듭니다. 각 구멍 쌍의 중심 사이의 거리가 15mm인지 확인합니다.
- 전자 커터를 사용하여 6개 채널(20mm x 2.25mm)을 76mm x 25mm 이중 접착 테이프로 잘라냅니다.
- 보호 커버의 플라스틱 면을 벗기고 점착제 조각의 가장자리를 석영 슬라이드의 가장자리와 정렬합니다. 폴리테트라플루오로에틸렌 핀셋을 사용하여 부드럽게 눌러 갇힌 기포를 제거합니다.
- 접착제 조각의 용지 면을 벗겨 내고 커버슬립의 기능화 된 표면에 장착하십시오.
참고: 경우에 따라 용지 면을 벗기고 석영 슬라이드에 부착하는 것이 다채널 흐름 셀에서 잘 작동합니다. - 6개 채널에 대한 입구 튜브(11cm)와 출구 튜브(25cm)를 절단합니다. 단계 2.1.6-2.1.9에 설명된 대로 유동 셀을 준비합니다.
- 첫 번째 채널의 출구를 펌프에 연결합니다. OSS가 있는 0.5 mL 튜브에 입구를 놓습니다.
참고: 입구 관의 길이는 효소가 유동 세포로 들어가는 시간을 동기화하고 이미징의 시작을 동기화하여 연속 적인 흐름 하에서 수행된 절단 실험에서 이벤트 수를 최대화하여 조기 광표백을 감소시키기 위해 선택됩니다. 형광소. - 사용된 채널의 출구를 분리하여 새 채널로 이동합니다. 플라스틱 부품의 접착제로 밀봉된 주사기 바늘로 만든 플러그로 콘센트를 닫습니다. 사용된 채널의 입구를 닫습니다.
3. 산소 청소 시스템 (OSS)의 준비
- 메탄올 800 μL에서 0.2 g의 (±)-6-하이드록시-2,5,7,8-테트라메틸크로메-2-카르복실산(플루오로포레의 깜박임을 최소화하는 삼중 상태 퀴시버)을 용해시.
- 6 mL의 탈이온화 된 H2O를 추가하고 용해 될 때까지 1 N NaOH 드롭 와이즈를 추가하십시오. 주사기 필터를 통해 필터, 1 mL aliquots로 만들고, -80 °C에서 저장합니다. 재고 농도는 ~100 μM입니다.
- ddH2O의 4 mL에 61 mg의 PCA 분말을 용해시킴으로써 3,4-디옥시벤조산(PCA)의 신선한 용액을 준비합니다. 재고 농도는 ~ 100 nM입니다.
- 58 μL 의 10 N NaOH 드롭 와이즈를 추가하여 PCA가 완전히 용해 될 때까지 각 방울 후에 소용돌이를 확인하십시오 (pH = 9).
- 5.3 mg의 프로토카테카테를 3,4-디옥시게나제(3,4-PCD)를 7 mL의 PCD 저장 완충액에 용해시키소서(표 1). 3,4-PCD는 프로토카테츄산34의산화를 촉매하여 결합/절단 완충제에서 산소를 제거합니다.
- PCD 솔루션을 1mL aliquots로 나눕니다. 재고 농도는 ~1 μM. 액체 질소에 aliquots를 스냅 동결하고 장기 보관을 위해 -80 °C또는 단기 보관을 위해 -20 °C에서 저장합니다.
- 새 바인딩 버퍼를 준비합니다(표1). smFRET 절단 실험을 위해 2 mM MM MCl2를 2 mM MgCl2로 대체하십시오.
- 이미징 버퍼의 1 mL를 준비합니다(표1). 산소 청소 시스템의 활성을 유지하기 위해 유동 세포에 도입 될 때까지 얼음에 이미징 버퍼를 유지합니다.
4. 형광 표지 HJs의 준비
- 트리스-EDTA 완충액에서동구화된 올리고(표2)를100 μM의 농도로 재구성한다.
- 표 1에열거된 각 X0 올리고의 ~3 μL을 등쪽 부분을 혼합하여 합성 접합부를 준비한다.
- 어닐은 95°C에서 5분 간 가열한 다음 1°C/min의 속도로 RT로 천천히 냉각한 후, 열 블록 또는 PCR 열자전거러를 사용하여 원하는 냉각 속도를 달성합니다.
- 10% 트리스-보레이트-EDTA 폴리아크릴아미드 젤의 8cm x 8cm에 혼합물을 적재한다. 100V를 바르고 ~2시간 동안 젤을 실행합니다. 밴드는 눈으로 선명하고 색상은 보라색입니다.
- 깨끗한 블레이드로 어닐링 된 기판의 밴드를 절제하십시오. 젤 조각을 오토클레이브 된 1.5 mL 튜브로 옮김.
- 깨끗한 플런저로 튜브 내부의 젤 조각을 분쇄한 다음 TE100 버퍼 100 μL을 추가합니다(표1).
- HJ를 1,500 rpm에서 20°C에서 1,500 rpm에서 흔들어 서모믹서에서 ~2시간 동안 또는 4°C에서 밤새 배양하여 HJ를 추출한다.
- 기판(35)을함유하는 용액상에 에탄올 침전을 수행한다.
- TE100 버퍼의 20 μL에서 기판을 다시 일시 중단한다(표1). 최종 농도는 각 튜브에서 1–3 μM. Aliquot 2 μL이고 -20°C에서 저장한다.
5. GEN1의 단백질 발현 및 정제
- 엔트리 벡터의 PCR에 의해 C-종점(20)에서 헥사 히티딘 태그와 함께 잘린 인간 GEN1 1,2,3,4,5의 발현을 위한 플라스미드를 구성한다.
참고: N-터미널 태그 지정하면 GEN1이 비활성화됩니다. 구조화되지 않은 C-tail은 전체 길이 GEN1의 정제를 훨씬 더 어렵게 합니다. 또한 전체 길이 GEN1은 잘린 버전23보다적은 활성을 나타내는 것으로 보고되었습니다. - 발현 벡터를 대장균 BL21-코돈플러스(DE3)-RIPL 스트레인으로 변환합니다.
- 형질전환된 세포를 각각 37°C에서 루리아 국물 2L를 함유하는 2개의 6L 플라스크로 접종하고, 0.8의 OD600에 도달할 때까지 180 rpm에서 흔들어.
- 배양을 16°C로 냉각시키고 48시간 동안 0.1 mM 이소프로필-β-β-d-티오갈라코피라노사이드(IPTG)로 GEN1 발현을 유도한다.
- 원심분리기에서 1000 x g에서 4°C에서 세포를 회전시켜 세포를 수확합니다. 배양의 각 리터는 펠릿의 5–6 g을 산출합니다.
- 상판을 버리고 세포의 4 mL /g를 사용하여 용해 완충제(표 1)에서펠릿 세포를 다시 일시 중단하십시오.
- 30 kPsi에서 세포 파괴를 사용하여 세포 용해를 수행한 다음 4 °C에서 1 시간 동안 10,000 x g에서 회전합니다. 상한체를 수집하고 0.45 μm 필터를 사용하여 얼음에 걸으하십시오.
- 완충액 A(표 1)를 사용하여 2.5 ml/min 유량에서 5 mL Ni-NTA 컬럼을 통해 여과액을 통과시킴으로써 FPLC를 사용하여 단백질정제를수행한다.
- 15 개의 열 볼륨 (CV)으로 씻으하십시오. 버퍼 A와 500 mM Imidazole의 선형 그라데이션으로 5 mL 분획에서 20 CV 이상을 용해시다. GEN1은 약 100mM 의 이미다졸에서 기둥에서 단송합니다.
- 수집된 분획으로부터 의 피펫 10 μL aliquots는, 각 aliquot에 2x SDS 로딩 염료의 동일한 부피를 추가한다. 90 °C에서 5분 동안 가열하여 시료를 변성시키고, 냉각시키고, 시료를 스핀다운합니다.
- 샘플을 10% 비스-트리스 젤에 로드합니다. 쿠마시 브릴리언트 블루를 사용하여 200 V. 얼룩에서 30-45분 동안 젤을 실행한 다음 얼룩을 지입니다. 정제된 GEN1을 포함하는 분수를 수집합니다.
- 완충제C(표 1)를이용하여 희석하여 결합된 분획의 염 농도를 100 mM으로 감소시다.
- 완충B(표1)를사용하여 3 mL/min의 유량으로 5 mL 헤파린 컬럼을 통해 저염 단백질을 전달한다.
- 버퍼 B와 1 M NaCl 20 CV의 그라데이션을 사용하여 10 CV. Elute로 세척합니다. GEN1이 약 360 mM NaCl을 용출하는 5 mL 분획을 수집합니다.
- 5.8단계에서 설명한 바와 같이 용출된 분획물정제 GEN1 분획을 확인한다. 그 분획을 결합하고 버퍼 C를 사용하여 100mM NaCl에 희석.
- 버퍼 B를 사용하여 1 mL /min 유량으로 양이온 교환 컬럼에 낮은 소금 단백질을 로드하십시오.
- 버퍼 B 및 1 M NaCl을 사용하여 40 CV의 그라데이션으로 용해. GEN1이 약 300 mM NaCl을 용출하는 1.7 mL 분획을 수집합니다.
- 5.8단계에서 설명한 바와 같이 용출 분획에서 GEN1의 순도를 확인한다.
- 가장 순수한 분획을 결합하고 4°C에서 투석을 저장 완충제에 대고있다(표 1). 투석 중에 버퍼를 하나 이상 교환합니다.
- 단백질 농도를 측정 ~0.5–1 mg/mL. 투석 단백질을 10-15 μL의 작은 튜브에 담고 액체 질소에서 플래시 동결하고 -80 °C에서 보관하십시오.
6. 단 분자 FRET 실험
참고: smFRET 실험은 앞서31에설명된 맞춤형 목표 기반 TIRF설정(그림 1C)에서수행됩니다.
- 단색 FRET 실험
- 100x TIRF 목표에 한 방울의 침지 오일을 적용합니다. EMCCD를 적절한 게인으로 설정하여 신호가 배경에 최적화되고 채도를 방지합니다.
참고: 레이저 빔을 직접 들여다보지 말고 레이저를 정렬할 때 보호 고글을 착용하십시오. - 샘플 홀더에 유량 셀을 조심스럽게 놓습니다. 오일이 커버 슬립에 닿을 때까지 거친 조정을 사용하여 점차적으로 목표를 올립니다.
- 녹색 레이저(532nm)를 켭니다. 목표의 미세 조정 모드로 전환합니다. 카메라 포트에 방출을 지시하여 모니터의 이미지를 관찰합니다.
- 커버슬립의 기능화된 표면이 초점이 맞춰질 때까지 목표의 높이를 조정하고 모니터에서 관찰할 수 있습니다.
참고: EMCCD의 이미지 수집은 acousto optic 튜닝 필터(AOTF)를 통해 레이저 흥분을 유발하여 이미지가 획득되지 않을 때 샘플 광표백을 방지합니다. - 커버의 기능화 된 표면의 배경이 형광으로 표시된 HJ로 흐르기 전에 몇 가지 지점을 초과하지 않는지 확인하십시오.
- TE100 완충액(표1)에서스톡 기판을 1-5 nM의 최종 농도로 약 1000회 희석한다. 희석된 기판의 피펫 0.2-0.5 μL을 0.5 mL 튜브내로 OSS를 가진 이미징 버퍼의 120 μL로 한다.
- 유량 셀의 출구를 주사기 펌프에 연결합니다. 유량 전지의 입구 튜브를 1.5 mL 튜브에 삽입하고 30-50 μL/min의 유량으로 주사기 펌프를 작동하여 튜브에서 용액을 인출합니다.
- 녹색 레이저로 간략하게 이미징하여 표면의 커버리지(균일하게 분산된 잘 간격이 있는 기판 100-300)를 자주 확인합니다.
- 표면 커버리지가 여전히 충분하지 않은 경우 형광으로 표지된 HJ가 용액으로부터 몇 분 동안 기다려 표면에 정착하거나 흐르는 단계를 반복한다.
- 또 다른 120 μL의 이미징버퍼(표 1)를30-50 μL/min에서 흐르고, HJ라고 표기된 언바운드 형광으로 세척한다. 그런 다음 유동 세포가 5 분 동안 앉아서 OSS가 용존 산소를 고갈 할 수 있도록하십시오. 형광단의 광표백은 이미징 시작 시 최소화되어야 합니다.
- 노출 시간(~60ms)을 설정하면, 사이클 시간은 데이터 전송 속도(~104ms)에 따라 소프트웨어에 의해 자동으로 설정되고, 원하는 사이클 또는 프레임 수(~400)를 지정한다. 기증자(Cy3) 및 수락자(Alexa Fluor 647)로부터의 방출은 이미지 스플리터 장치에 의해 2개의 컬러 채널로 분할된다.
- 표면에 적합한 영역을 찾아 목표의 높이를 조정하여 이미지에 초점을 맞추고 기록하고 16 비트 TIFF 형식으로 영화를 저장합니다.
- 새 영역으로 이동합니다.
참고: 동일한 영역을 두 번 이미징하지 않으려면 항상 한 방향으로만 이동하십시오(즉, 콘센트에서 입구까지). - 이미징 버퍼의 120 μL에서 1, 2, 5, 10, 25, 50, 75 및 100 nM GEN1을 한 번에 하나씩 준비합니다. 용액을 30-50 μL/min의 유량으로 유량합니다.
참고: GEN1에 의한 HJ 바인딩 또는 자유 HJ의 이성화와 같이 필요한 측정이 정상 상태에서 수행되는 경우, 흐름이 중지된 후 3-5분 정도 기다려 영화를 녹화합니다. 각 GEN1 농도에 대해 새로운 영역에서 3~4개의 영화를 수집합니다. - GEN1에 의한 HJ의 분열에서와 같이 연속적인 흐름 하에서 측정이 수행되는 경우, GEN1이 유동 셀로 들어가기 전에 5-10초의 기록을 시작합니다. 6채널 유량 셀의 새 채널로 이동하여 측정을 반복합니다.
- 끝에서, 고정 형광 비드 슬라이드를 사용하여 이미지 분할 장치에서 공여자 및 수용자 입자를 서로 매핑합니다.
- 0.2 μL의 1 μm 직경형 형광 비드를 500 μL의 1 M Tris (pH = 8.0)에 추가하여 비드가 표면에 달라붙도록 합니다.
- 양면 접착 씰의 22mm x 22mm 조각 내부에 사각형(18mm x 18mm)을 자른다. 껍질을 벗기고 76mm x 25mm 쿼츠 슬라이드의 중간에 붙입니다.
- 희석된 구슬 용액 50 μL을 놓고 5-10분 동안 그대로 둡니다. 정사각형 조각 위에 22mm x 22mm 커버슬립을 부착합니다. 티슈로 마른 과잉 비드 용액을 마른 다음 에폭시 접착제로 챔버를 밀봉하십시오.
- 60ms 노출 시간에 구슬 슬라이드의 100 프레임을 획득합니다.
주의: 검출기의 포화를 피하기 위해 레이저 전력과 EMCCD 게인을 최소한으로 낮추세요. - 소프트웨어 패키지(예를 들어, TwoTones)를 설치하고 사용자매뉴얼(36)에표시된 대로 그 안에 있는 영화를 엽니다. 기증자 및 수락자 채널에서 개별 비드의 위치를 선택합니다. 설명서에 설명된 대로 변환 행렬을 생성합니다.
참고 :이 소프트웨어는 기증자 및 수락자 채널의 입자의 위치를 일치시키고 이미지 분할 장치의 약간의 정렬 불량에 대한 수정 변환 매트릭스를 사용합니다. - 파일로이동하여 동영상 로드를 누릅니다. 파일 메뉴에서 TFORM 로드를 누르고 비드 슬라이드에서 생성된 변환 행렬을 선택합니다. 거짓 긍정이 포함되지 않을 때까지 기증자 및 수락자 채널의 임계값을 조정합니다.
- 채널 필터 메뉴에서 D&A 옵션을 선택하여 기증자와 수락자 로 레이블이 지정된 파티클을 선택합니다. 가장 가까운 이웃 한계 필드를 확인하여 서로 매우 가까운 분자를 제외합니다. 최대 타원성을 확인하여 매우 편심 분자를 배제하고 너비 제한을 확인하여 매우 광범위하거나 매우 좁은 분자를 제외합니다.
- 히스토그램을 구성하기 위해 투톤 매뉴얼에서 지시한 대로 plotHistCW를 입력합니다.
참고: "명백한" FRET 효율은 수용자의 배출량을 기증자와 수락자로부터의 총 배출량으로 나누어 프로그램에 의해 계산됩니다. 투톤은 100 간격을 사용하여 FRET 효율에 대한 분자 상태의 분포를 bin합니다. - 각 분자에 대한 시간 추적을 생성하기 위해 투톤 매뉴얼에서 지시한 대로 plotTimetraceCW를 입력합니다.
참고: 시간 추적은 vbFRET37에 의해 추가로 분석되어 서로 다른 FRET 상태, 각 거주 시간 및 서로 다른 상태 간의 전환 속도를 식별할 수 있습니다.
- 100x TIRF 목표에 한 방울의 침지 오일을 적용합니다. EMCCD를 적절한 게인으로 설정하여 신호가 배경에 최적화되고 채도를 방지합니다.
- 2색 교대로 여기 FRET (ALEX) 실험
- 녹색 및 적색 레이저와 직접 여기하여 기증자 및 수락자 방출의 연속 프레임으로 구성된 영화를 각각 ~ 80 ms 의 지속 시간으로 기록합니다.
- 투톤에서 인수 된 ALEX 영화를 엽니 다. 3개의 채널에 대해 ~300으로 적합한 검출 임계값을 설정: 기증자 여기로 인한 공여자 방출(DexDem); 기증자 여기로 인한 수용자 방출 (DexAem); 직접적인 여기 (AexAem)로 인한 수락자 방출.
- 채널 필터 덱스뎀 & 덱스엠 & AexAem을 적용하여 기증자와 수락자가 모두 있는 파티클을 선택합니다. 입자를 3개의 채널에서 ~200-300으로 연결합니다.
- 플롯HistALEX MATLAB 코드를 사용하여 ALEX 히스토그램을 생성합니다. 히스토그램의 다른 피크를 가우시안 함수에 맞추고 Origin 소프트웨어38을사용하여 곡선 아래의 영역을 각 모집단의 백분율을 결정합니다.
참고: 결합 분석의 피크는 결합된 GEN1-HJ 복합체에 해당하며, 자유 HJ에서는 피크가 교환이성 이소메를 나타냅니다. - plotTimetraceALEX MATLAB 코드를 사용하여 직접 여기및 FRET 및 직접 여기로 인한 공여체 방출을 나타내는 각 분자에 대한 시간 추적을 생성합니다.
참고: ALEX 시간 추적은 독립적으로 기증자와 수락자 모두의 방출을 보여주지만 단색 FRET보다 낮은 시간 해상도로 표시됩니다. 단일 색상 FRET와 마찬가지로 ALEX 시간 추적은 vbFRET에 의해 추가로 분석되어 다른 FRET 상태와 해당 거주 시간을 식별할 수 있습니다. - 쌍곡선 함수에 GEN1 농도 대 바운드 모집단의 백분율을 피팅하여 해리 상수를 결정합니다.
- 타임랩스 단색 FRET
- 관찰된 역학의 속도에 따라 녹색 레이저의 노출 시간을 60ms로 설정하고 사이클 시간을 624ms 이하로 설정합니다.
- 6채널 유량 셀의 한 채널에서 유량을 110μL/min으로 설정합니다. 흐름 셀 내부의 GEN1 입구 전에 잠시 레코딩을 시작합니다.
참고: 연속적인 흐름은 형광단의 빠른 광표백으로 이어지므로 이미징 및 단백질 입력의 시작을 동기화하여 캡처된 이벤트의 수를 최대화합니다. 최적의 주사기 펌프 판독은 죽은 볼륨과 유량 셀을 조립하는 데 사용되는 정확한 튜브에 따라 달라집니다. 우리의 경우 ~ 25 μL입니다. - 총 78s의 촬영 시간 동안 ~ 125 프레임의 영화를 획득합니다. 기록의 끝에서, 수용기를 조사하기 위해 각각 25 ms 노출 시간으로 50 프레임 동안 적색 레이저에 샘플을 노출시다.
참고: 이 방법은 여기 주기 수를 줄임으로써 분열 실험에서 관찰 창을 연장합니다. 이량화의 k및 k오프와 같은 운동 파라미터는 분포를 이중 지수모델(30,38)에피팅하여 유도된다.
7. 전기 적 이동성 변화 분석 (EMSA)
- 50 μL 총 부피에서, EMSA 결합 완충액에서 30분 동안 RT에서 50 pM Cy5 표지된 HJ로 GEN1의 원하는 농도를 배양한다(표1).
- 샘플을 트리스-붕산도-EDTA 젤의 8cm x 8cm에 적재합니다. RT에서 1x TBE 버퍼에서 100V를 1시간 동안 + 20분 동안 사용하여 젤을 실행합니다.
- 각 레인의 총 형광 강도에 대한 상대적 기여도에서 GEN1 농도에서 바운드 기판의 백분율을 결정합니다.
참고 : GEN1 단량체 -HJ (밴드 I)는 닉 HJ21,30에GEN1 단량체의 피코몰러 바인딩과 크기의 계약에 의해 확인된다. GEN1-디머-HJ는 HJ21,23에GEN1 단량체의 단계적 결합 때문에 밴드 II에 할당된다. - 방정식을 사용하여 명백한 바인딩 상수 Kd-단량체 앱-EMSA 및 Kd-dimer-app-EMSA를 계산합니다.

어디에: 최대는 각 종의 최대 결합 (단량체 또는 이량체)에 도달한 농도입니다. n은 언덕 계수입니다. K (주) d-app-EMSA는 각 종의 명백한 결합 상수이며, 단량체 또는 이량체의 절반 최대가 존재하는 GEN1의 농도를 나타냅습니다.
결과
HJ의 컨포머 바이어스 및 이소성화
HJ의 이소성화는접합부 17,18,39의두 개의 인접한 팔의 라벨링을 통해 FRET에 의해 광범위하게 조사되었다. 기증자(Cy3) 및 수용자(Alexa Fluor 647)는 각각 두 개의 인접한 팔, R(가닥 2) 및 X(가닥 3)에 위치한다(도2A). 적층-X 이소메는 그들의 두 연속 가닥[즉, Iso(1,3) 또는 이소(2,4)]에 의해 할당되었다. 인접한 라벨 X0의 ALEX FRET 히스토그램은 더 풍부한 Iso(1,3)(E~0.75) 및 덜 풍부한 Iso(2,4)의 상호 교환에 해당하는 두 개의 피크를 나타낸다(E~0.40)(그림 2B).
단색 FRET는 EMCCD2 카메라의 사용 영역을 줄임으로써 높은 시간 해상도 ~10 ms로 자유 HJ의 급속한 형태 변화를 기록하기 위한 시간 추적을 획득하는 데 사용됩니다. X0 접합부들의 대표적인 단일 컬러 FRET 시간 추적은 고및 저프레티 이성체 사이의 전환을 나타낸다(도2B). 이소(1,3)-이소(2,4) 및 k이소(2,4)-이소(1,3)의 거주 시간 히스토그램으로부터 수득된 이소(1,4)와 이소(2,4)의 이소(2,4)(도 2C)는이전에보고된 것과 일치한다.
SMFRET는 GEN1에 의해 HJ의 활성 왜곡을 보여줍니다
HJ는 GEN122에바인딩할 때 구조적 재배열을 거칩니다. 따라서, 기증자와 수용자 사이의 간격은 ISO(1,3) 및 Iso(2,4)(도3A)에서모두 유사하다. smFRET 결합 성 어여법은 HJ의 절단을 방지하기 위해Ca2+의 존재에서 수행되었다. 상이한 GEN1 농도에서 인접한 라벨 X0 접합의 FRET 히스토그램은 ALEX(도3B)에의해 획득되었다. 히스토그램은 두 개의 가우시안 함수에 적합합니다: 자유 고FRET 이소(1,3)에 대응하는 함수, 그리고 낮은 FRET 피크로부터 ISO(2,4)의 기여도를 뺀 후 바운드 GEN1-HJ 집단에 대응하는 다른 함수.
포화 GEN1 농도에서, X0의 FRET 히스토그램은 모델22에의해 예측된 바와 같이 HJ의 어느 이소머에 결합된 GEN1에 상응하는 단 하나의 낮은 FRET 피크를 갖는다. 명백한 단량체 해리상수(K-monomer-app)는GEN1 농도의 함수로서 GEN1 바운드 집단의 백분율의 쌍곡선 적합성으로부터 결정된다(도3C). 인접한 라벨 nk-X0은 첫 번째 절개 반응 후 제품을 모방하는 독보적인 버전 HJ를 나타냅니다. 시뮬레이션된 닉에 의한 스태킹 스트레인의 완화로 인해, nk-X0은 X 0(도 3D 대 도 3B)과달리 E~0.40에서 단일 기판 피크로부터 명백한 바와 같이 비이성화 구조(40)이다. GEN1-nk-X0 복합체의 구조는 FRET 효율의 유사성에 의해 나타난 바와 같이 GEN1-X0 복합체의 구조와 유사합니다(nk-X 0의 경우 E ~0.25, X0의경우 0.32)(그림 3D 대. 그림 3B)를참조하십시오. GEN1 단량체와 nk-X0의 강력한 결합은 X0보다 40배 낮은K-모노머 앱 값으로 입증됩니다(그림3E 대 그림 3C). 이러한 단단한 결합은 GEN1 디머 또는 그 단량체 중 하나가 해리되는 드문 경우에 HJ의 불완전한 분해에 대한 보호 메커니즘으로서 작용할 수 있다.
GEN1 단량체를 HJ에 단계적으로 바인딩
Gen1 단량체의 결합과 이량체 형성은 용액21,23,41에서디메릭 형태로 존재하는 원핵핵바제에 비해 진핵 HJ resolvase GEN1에 대한 독특한 특징이다. 50 pM X0에서 GEN1의 EMSA는 상부 패널에서 로마 숫자로 나타낸 바와 같이 GEN1을 더 높은 차수 복합체로 단계적으로 연관시다(도4A). EMSA (K-단량체-EMSA)에의해결정된 GEN1 단량체의 해리 상수는 smFRET 결합 분석 K단량체 앱 (그림 4A 및 그림 3C)에서 해리 상수와 일치합니다. )을 각각 사용합니다. 밴드 II의 정량화는 GEN1디머(K-dimer-EMSA)의평형 해리 상수를 계산하는데 사용된다. 50 pM nk-X0에서 GEN1의 EMSA는 X 0보다 30 배 낮은 매우 낮은K-단량체 앱-EMSA에 의해 표시된 바와 같이 눈에 띄는 단량체 결합을 보여주며, K-dimer-EMSA는 X0과 비슷합니다(그림4B).
GEN1 단량체가 HJ를 결합하고 왜곡한다는 추가 증거는 낮은 GEN1 농도에서 Mg2+의 존재 에서 안정된 낮은 FRET 상태(그림 4C)를가진 삼촌 입자의 상당수의 흔적을 관찰하는 것이다. 이러한 추적의 수는 GEN1 농도 증가 시 감소. HJ의 해상도는 이량체 형성을 지원하는 GEN1 단량체의 단단한 결합에 의해 구동됩니다. 단량체 결합은 Mg2+에서삼촌nk-X0의 시간 추적에서 관찰되며, 이는 나노몰 농도가 거의 없는 때까지 연장된다(도4D). GEN1 모노머는 nk-X0을 보호하기 위해 단단히 결합하여 결국 이량체 형성을 통해 완전한 분해능을 보장합니다.
HJ의 SMFRET 해상도 분석
smFRET 분석에서 용어 "분열"은 HJ의 "분해능"과 상호 교환적으로 사용되며, 이 분석에서 두 번째 분열 사건을 따르는 제품 방출만 검출되기 때문이다. 이벤트는 ~ 1.3 분의 수집 시간에 걸쳐 사진 에 민감한 수용자의 광 표백을 최소화하기 위해 타임 랩스 단일 색상 여기로 기록됩니다.
도 5A의 회로도는 기능화된 유리에부착된 X0의 GEN1에 의한 결합 및 왜곡 후 X 0 ISO(1,3)의 가닥 1 및 3의 절개를 도시한다. 기증자와 수락자 모두 HJ 해상도 후 신호손실을 초래하는 용액으로 이동합니다. 제1 및 제2 절개는 nk-X0으로 분리되어 부분적으로 해결된 HJ의 프로토타입을 예시합니다. GEN1을 바인딩하면 nk-X0은 X0과유사한 구조를 채택합니다. 해상도는 도 5B에도시된 바와 같이 가닥 1에서 단일 절개에 의해 진행됩니다.
중간 FRET의 출현 없이 발생한 해결된 X0의 흔적에서 안정된 낮은 FRET 상태 후에 기증자와 수락자의 동시 이탈은 GEN1-HJ의 수명 내에 완전한 분해가 발생한다는 것을 나타냅니다. 복잡합니다(그림5C). 따라서, 이러한 결과는 Gen1-HJ 복합 수명 내에서 HJ 분해능이 발생한다는 것을 시사한다. nk-X0의 분해능은 또한 구조적 재배열 후 진행되며 X0과유사한 두 개의 형광소(도5D)를운반하는 이중의 이탈에 의해 결론을 내린다.
GEN1 단량체 바운드 HJ에 대한 GEN1 이량화의 역학
Time-lapse smFRET는 GEN1 단량체에 의한 왜곡 후 HJ의 이량체 형성 및 분해에 필요한 시간을 주로 포함하는전분열을 측정합니다. 이 기술을 적용하면,X0 및 nk-X0의분해성 모두에 대해 이량체 형성이 필요하다는 주장을 뒷받침하기 위해 직접적인 증거가 제공되며, 이는전분열 전의 분포가 GEN1 농도 의존적이기 때문이다.
HJ해상도(kapp)의명백한 비율은 각각의 GEN1 농도에서 의전 분열의 평균의 역으로 정의된다. "명백한"이라는 용어는 HJ 해상도가 제품에 바인딩된 상태로 유지될 가능성을 배제할 수 없기 때문에 HJ 해상도의 속도를 설명하는 데 사용됩니다.
X0(그림 6A)의분열 전 분포의 확률 밀도 함수(PDF)는 낮은 GEN1 농도에서 더 긴 이량체 형성 시간을 반영한 다음 GEN1 농도가 높을수록 짧습니다. 이량체에 대한 협회 및 해리속도, k온-디머 및 k오프 디머는각각 이중 지수모델(30)으로부터결정된다. 또한, nk-X0(도 6B)의PDF는 X0과 유사한 분포를 나타내며 이량체 형성에 대한 요구사항을 나타낸다.
GEN1농도 대 k앱의 플롯은 쌍곡선 함수에 장착되었다. X0과 nk-X0의 명백한 촉매 비율 상수(kMax-app)는각각 0.107±0.011 s-1 및 0.231±0.036s-1,(도 6C)이다. X0 및 nk-X0 접합에 대한 k앱의 플롯은 GEN1 농도에서 교차 ~ 5.6 nM 때문에 더 빠른 kMax-app 및 느린 k온디머에 비해 닉의 손상되지 않은 접합부입니다.
요약하면, 상대적으로 빠른 k온-이량체 및 느린 k오프-디머는 이량체가 형성되면 HJ 분해능을 향한 전방 반응의 진행으로 이어진다. GEN1 단량체를 nk-X0 접합부로 강력한 결합은 중단된 두 번째 분열에 대한 페일 세이프 메커니즘을 구성하거나 세포의 1차 분해 경로에 의해 남겨진 불완전하게 해결되지 않은 HJ를 픽업하는 데 도움이 됩니다.
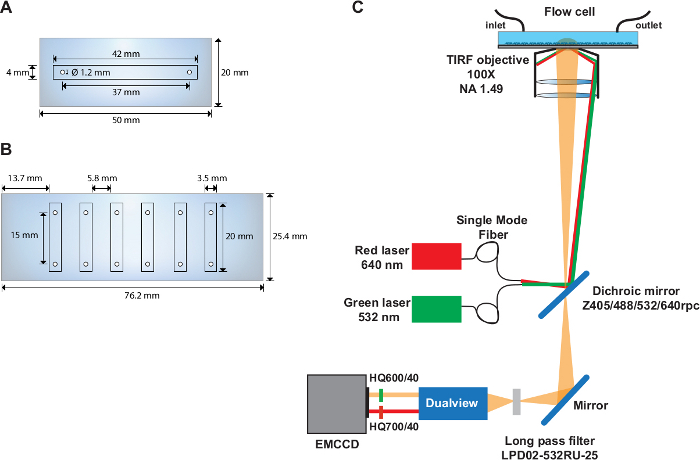
그림 1: 단일 및 다중 채널 플로우 셀 및 광학 설정의 레이아웃.
(A)단일 채널 유동 셀의 회로도. (B)6채널 유동셀의 개략적. (C)광학 설정의 레이아웃은 여기 소스, TIRF 목표, 필터 큐브 내부에 설치된 이색 거울, 이미지 스플리터 장치에 사용되는 방출 필터를 묘사한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 2: FRET에 의해 관찰된 HJ의 컨포머 바이어스 및 이소성화.
(A)인접한 라벨 X-적층 HJ 응체의 이소미화는 두 개의 연속 가닥의 이름을 따서 명명된다. 가닥은 번호가 매겨지고 팔은 문자로 표시됩니다. 절개 부위는 화살표로 표시됩니다. 기증자(녹색)와 수락자(빨간색)의 위치와 이성화 시 의 FRET의 변화가 표시됩니다. (B)오른쪽 패널: 50 mM Mg2+X0의 FRET 시간 추적(검정)과 이상화된 FRET 트레이스(빨간색). 왼쪽 패널: 50 mM Mg2+X0의 FRET 히스토그램 . 공여자(녹색) 및 수용자(빨간색)의 형광 강도는 아래와 같습니다. (C)인접 라벨 X0 Iso(1,3) 및 Iso(2,4)의 거주 시간 히스토그램을 단일 지수 함수에 장착하여 이소미화 속도를 결정하였다. 불확실성은 95% 신뢰 구간을 나타냅니다. 이 수치는 이전에 출판된 문헌30에서수정되었습니다.
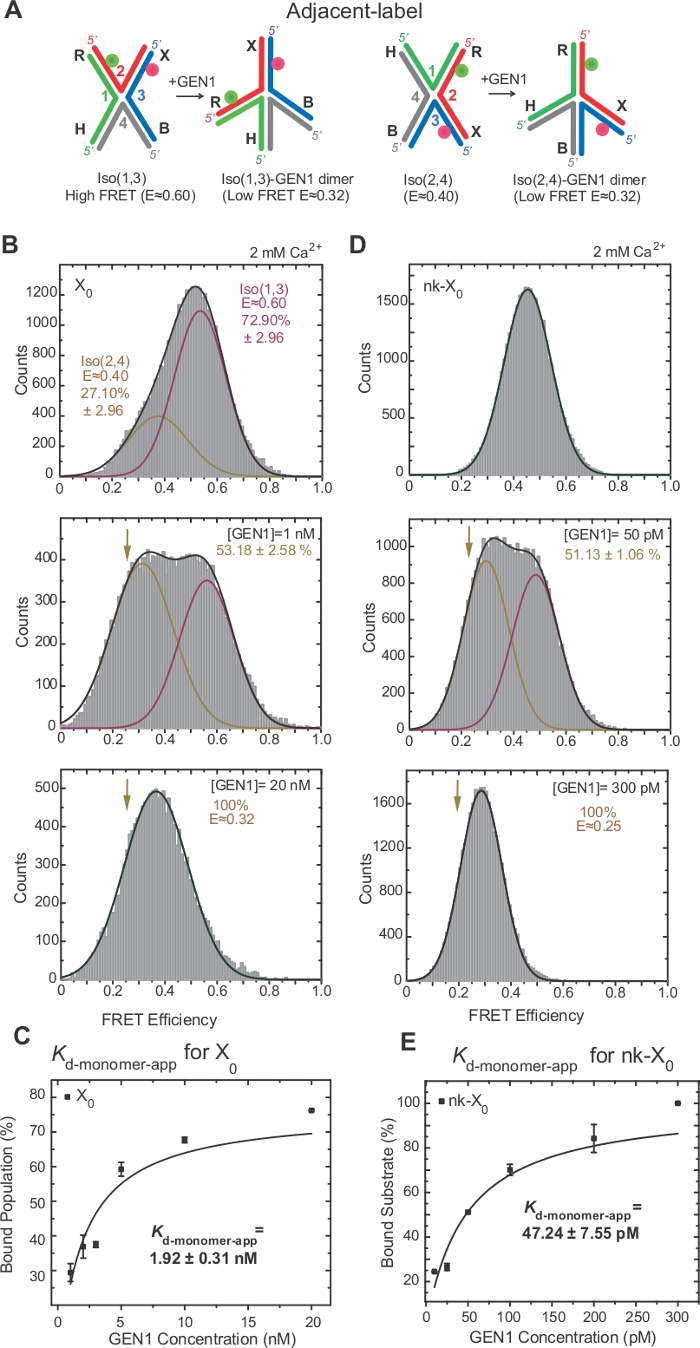
그림 3: GEN1에 의한 HJ의 활성 왜곡.
(a)인접한 라벨HJ의 구조적 변형은 제안된모델(22)에기초한다. (B)인접한 라벨 X0의 ALEX FRET 히스토그램은 Iso(1,3) 및 하부 FRET 피크(E=~0.4)에 대응하는 주요 높은 FRET 피크(E=~0.6)를 갖는다(2,4). 전체 히스토그램은 두 개의 가우시안 함수에 적합합니다: 하나는 자유 높은 FRET Iso(1,3)에 해당하고, 다른 하나는 바운드 인구에 해당하며, 다른 하나는 총 인구에 대한 Iso(2,4)의 초기 기여도를 뺀 값입니다. (C)명백한 단량체 해리 상수(K-monomer-app)는GEN1 농도의 함수로서 GEN1 바운드 집단의 백분율의 쌍곡선 적색에서 결정됩니다. (D)상이한 GEN1 농도에서 인접한 라벨 nk-X0의 FRET 히스토그램. 낮은 FRET 아래의 영역 (E = ~ 0.25) 가우시안 바운드 인구의 백분율에 해당 합니다. (E)nk-X0의 Kd-단량체 앱은 GEN1 바운드 모집단의 쌍곡선 적합성에서 결정됩니다. 오류 막대는 두 개 이상의 실험에서 표준 편차를 나타냅니다. 이 수치는 이전에 출판된 문헌30에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: HJ에 GEN1의 단계별 결합.
(a)50 pM X0에서GEN1의 전기 적 이동성 시프트 분석 (EMSA). 상부 패널: 로마 숫자는 단지내 GEN1 단량체수를 나타냅니다. 하부 패널: GEN1 단량체를 X0에바인딩합니다. 명백한 해리상수는 각각의 종의 시그노이드 적당으로부터 수득되었고, 2개의 실험의 평균을 나타낸다. (B)50 pM nk-X0에서 GEN1의 EMSA는 매우 낮은K-단량체-앱-EMSA에의해 지시된 바와 같이 눈에 띄는 단량체 결합을 보여준다. (C)구속된 시간 추적이지만, Mg2+에서인접한 라벨 X0을 엉키고 있습니다. ~1.3분 동안 기증자 낭송을 수행하였고, 그 다음에 직접 수용자 여기(그늘진 분홍색 영역)가 수행되었다. (D)구속된 시간 추적이지만 Mg2+에서인접한 레이블 nk-X0을 아구치. 이 수치는 이전에 출판된 문헌30에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: HJ의 SMFRET 해상도 분석.
(A)GEN1에 의한 왜곡 후 인접 라벨 X0 Iso(1,3)의 회로도. 기판은 비오틴/아비딘 링키지를 통해 기능화된 표면에 부착됩니다. 두 절개 후 GEN1의 해리는 용액으로 들어가는 기증자와 수용자 모두의 손실을 초래한다. (B)가닥 1을 클리프로 인접 라벨 nk-X0의 분해능을 회로도. (C)이소의 분열의 2mM Mg2+에서 시간 추적 (블랙). GEN1 결합의 개시는 FRET 신호가 분열로 인해 갑자기 손실될 때까지 안정된 낮은 FRET 상태를 형성한다. 이에 따라, GEN1 결합시 공여체의 증가 및 수용체 형광 강도의 감소는 절단 시 두 염료로부터의 형광의 동시 소실이 뒤따른다. (D)유사하게, nk-X0의 시간 추적은 FRET 신호의 갑작스러운 손실에 의해 체결되는 GEN1 결합 시 안정적인 낮은 FRET 상태를 나타낸다. 이 수치는 이전에 출판된 문헌30에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: GEN1 단량체 바운드 HJ에 대한 GEN1 이량화의 역학.
(A)X0의 분열 전 분포의 확률 밀도 함수(PDF) 플롯은 GEN1 농도에 대한 의존도를 보여 줍니다. 각각의 GEN1 농도에서 낮은 FRET 상태(θ전 분열)의대기 시간은 2개 이상의 실험으로부터 수득되었고 평균속도(kapp)를얻기 위해 사용되었다. 나열된 k앱 비율은 각각의 GEN1 농도에서 평균 θ 의전 분열의 역으로 결정됩니다. 이량체 형성에 대한협회(kon-dimer)및 해리(k-off-dimer) 비율은 이중 지수모델(38)으로부터계산된다. 오류는 k앱의SEM을 나타냅니다. (B) nk-X0의 분열 전 분포와 각 k 앱 비율의 PDF 플롯입니다. (c) 명백한 촉매율(kMax-app)을결정하기 위해 쌍곡선 함수에 장착된 GEN1 농도 대 K앱의 플롯. X0과 nk-X0에 대한 k앱의 플롯은 X0의 빠른 초기 k앱을 보여 주며, 이는 [GEN1] ~ 5.6 nM 위의 nk-X0을 능가합니다. 이 수치는 이전에 출판된 문헌30에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 버퍼 | 퇴비 | ||
| 바인딩 버퍼 | 40 mM 트리스-HCl pH 7.5, 40 mM NaCl, 2 mM CaCl2,1 mM DTT, 0.1% BSA 및 5% (v/v) 글리세롤 | ||
| 버퍼 A | 20 mM 트리스-HCl pH 8.0, 1 mM DTT 및 300 mM NaCl | ||
| 버퍼 B | 20 mM 트리스-HCl pH 8.0, 1 mM DTT 및 100 mM NaCl | ||
| 버퍼 C | 20 mM 트리스-HCl pH 8.0 및 1 mM DTT | ||
| 분열 버퍼 | 40 mM 트리스-HCl pH 7.5, 40 mM NaCl, 2 mM MgCl2,1 mM DTT, 0.1% BSA 및 5% (v/v) 글리세롤 | ||
| EMSA 바인딩 버퍼 | 40 mM Tris-HCl pH 7.5, 40 mM NaCl, 1 mM DTT, 2 mM CaCl2, 0.1 mg/ml BSA, 5% (v/v) 글리세롤 및 5 ng/μl 폴리-dI-dC | ||
| 이미징 버퍼(바인딩) | 40 μL (±)-6-하이드록시-2,5,7,8-테트라메틸로메-2 카르복실산(4 μM), 60 μL PCA(6nM), 60 μL PCD(60 nM) 및 840 μL의 결합 버퍼 | ||
| 이미징 버퍼(절단) | 40 μL (±)-6-하이드록시-2,5,7,8-테트라메틸로메-2 카르복실산(4 μM), 60 μL PCA(6nM), 60 μL PCD(60 nM) 및 840 μL 의 절단 버퍼 | ||
| 리시스 버퍼 | 20 mM 트리스-HCl pH 8.0, 10 mM β-메르카프토에탄올, 300 mM NaCl 및 2 mM PMSF | ||
| PCD 스토리지 버퍼 | 100 mM 트리스-HCl pH 7.5, 1 mM EDTA, 50 mM KCl 및 50% 글리세롤 | ||
| 스토리지 버퍼 | 20 mM 트리스-HCl pH 8.0, 1 mM DTT, 0.1 mM EDTA, 100 mM NaCl 및 10% 글리세롤 | ||
| TBE 버퍼 | 89 mM 트리스-HCl, 89 mM 붕산 및 2 mM EDTA | ||
| TE100 버퍼 | 10 mM 트리스.HCl pH 8.0 및 100 mM NaCl | ||
| 트리스-EDTA 버퍼 | 50 mM 트리스-HCl pH 8.0 및 1 mM EDTA pH 8.0 | ||
표 1: 이 연구에 사용된 버퍼 및 해당 컴포지션의 목록입니다.
| Oligo | 시퀀스 | ||
| X0-st1 | ACGCTGCACTCTGCGCTAGTTCTCTTTGCGCCCACCGCAGGTTCACCC | ||
| X0-st2 | GGGTGAACCTGCAGGGGG/iCy3/AAAGATGTCCCTGTTAATTCAAGATTTGCCGT | ||
| X0-st3 | ACGGCATAAGCTTGACGA/iAF647-dT/타카아카카가카트GT타타가가트가타가타카트 | ||
| X0-st4 | 5'BiotinCGATAGTCGGATTCTCTAGACAGCTTTTTTTTTTTTTTTTTTTTTTTTTAATT | ||
| X0-Adj | X0-st1, X0-st2, X0-st3 및 X0-st4 | ||
| X0In_st2 | GGGTGAACCTGCGGCAAAGATGTTTGTTTTTTTCTATTGCCGT | ||
| X0In_st4 | 5'BiotinCGATAGTCGGATTCTCTAGGCTCTAGGCTCTAGGCTTTTAGGCTTTTAGGCTTTTTTTTTTAGCGAGAGG3/TGGTAGATTCGGCGCGC | ||
| Nk-X0 | X0-st1, X0-st2, X0-nk3a, X0-nk3b 및 X0-st4 | ||
| X0-nk3a | ACGGCATAAGCTTGACGA/iAF647-dT/TACAACAGATC | ||
| X0-nk3b | ATGGAGCTGTCTAGAGGATCC가트 | ||
표 2: SMFRET 및 EMSA HJ 기판. smFRET 및 EMSA를 위해 형광표지 된 HJS의 제조에 사용되는 올리고뉴클레오티드의 목록. 올리고는 상업적으로 수득되었다. 형광표지된 올리고는 HPLC 정제되었고, 가능하면 ≥60 bp의 올리고를 PAGE 정제하였다.
토론
본 연구에서는 GEN130에의한 HJ 분해능의 역학을 결정하기 위해 다양한 smFRET 기술이 구현되었다. 유사한 smFRET 접근법은 DNA 복제 및 수리 플랩 엔도너플레제 142,43,44에의한 이중 플랩 DNA 형태 요건 및 절단을 따르기 위해 사용되었다. 여기서는 이 프로토콜의 중요한 단계에 대해 설명합니다. 실란화 반응은 습도의 흔적이 없어야합니다. PEG가 용해되면 가분해를 피하기 위해 실란화 유리에 페질화 용액을 신속하게 적용해야합니다. 다중 채널 유동 셀에서 접착 시트에 갇힌 공기를 제거하여 인접 채널 간의 누설을 방지해야 합니다. PCA 용액은 시간이 지남에 따라 산화되기 때문에 신선하게 준비되어야합니다. 10 N NaOH를 추가하는 것은 그 사이에 소용돌이가 있는 드롭와이즈여야 합니다. 커버 슬립의 형광 배경은 형광으로 표시된 HJ를 흐르기 전에 최소화되어야 합니다. 유동 세포에 있는 화상 진찰은 화상 진찰 표백한 지역을 피하기 위하여 한 방향으로 수행되어야 합니다. ALEX 실험에서, 수용자의 급속한 표백을 피하기 위해 적색 레이저의 힘을 감소시켜야 한다. 시간 경과 실험에서 주기 시간은 가장 빠른 이벤트보다 짧아야 합니다.
smFRET는 생체 분자 반응에 귀중한 실시간 통찰력을 제공 할 수있는 민감한 기술입니다. 그러나, 이 방법은 생화확적인 반응 도중 FRET에 있는 측정 가능한 변경을 달성하는 중 몇몇 기술적인 도전이 있습니다. 이것은 히스토그램과 시간 추적에서 구별 가능한 상태에서 잘 분리 된 기능을 얻는 데 필요합니다. 많은 경우에, smFRET는기판(45)의작은 구조적 변화로 인해 기판의 신중한 설계, 형광부 쌍 및 이들의 위치의 선택, DNA 기판에서의 FRET 변화의 증폭을 필요로 한다. FRET를 수행하기 위한 또 다른 접근법은 표지된 단백질46을사용하는 것입니다. FRET에서의 관찰 창은 기증자(Cy3)보다 더 빠르게 표백하는 경향이 있는 Cy5 또는 Alexa Fluor 647과 같은 수용자의 안정성에 의해 제한된다. 따라서, FRET는 형광 신호를 연장하고 신호 대 잡음 비47,48을 최대화하기 위해 산소 제거 시스템을 개발하기 위한 실험 지속 기간 및 개발 노력을 연장하기 위해 안정적인 형광체에 대한 지속적인 검색을 필요로 한다. .
smFRET에서 문제 해결을 위한 팁 중에는 레이저 파워, 노출 시간, 사이클 시간 및 사이클 수와 같은 이미징과 관련된 여러 매개 변수의 균형을 맞추어 형광 방출을 최대화하고 실험 기간을 연장하며 달성합니다. 효소 역학에 대한 적절한 샘플링 간격을 정합니다. 효소 역학을 나타내는 고충실도 의 거침상 분포를 얻기 위해서는 관찰 시간이 길어지고 광표백으로 인한 최소한의 효과가 필수적입니다. ALEX는 이 방법이 단일 색상 FRET에 비해 광표백 입자의 기여도가 낮기 때문에 더 나은 히스토그램을 생성합니다. 그러나 ALEX의 시간 해상도는 단일 색상 FRET의 해상도보다 낮습니다.
마지막으로, 개별 분자의 형태/구조적 변화를 실시간으로 감지하는 데 중점을 두는 smFRET는 고해상도 구조 기술(즉, X선 결정학, 핵 자기 공명, 전자 현미경 검사법) 사이의 격차를 해소합니다. 측정 가능한 속성의 앙상블 평균을 산출하는 정적 조건 및 벌크 방법하에서 원자 분해능 구조 세부 사항을 제공합니다. 많은 양상에서, smFRET는 실시간으로 생물학 시스템을 공부하기위한 강력한 기술로 입증되었습니다.
공개
저자는 경쟁적인 재정적 이익을 선언하지 않습니다.
감사의 말
이 작품은 핵심 자금 및 경쟁 연구 상을 통해 과학 기술의 왕 압둘라 대학에 의해 지원되었다 (CRG3) S. M. H.
자료
| Name | Company | Catalog Number | Comments |
| (±)-6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid (Trolox) | Sigma-Aldrich | 238813 | |
| 0.1 M sodium bicarbonate buffer | Fisher | 144-55-8 | |
| 10 % Novex Tris-Borate-EDTA gel | Thermo Fisher Scientific | EC6275BOX | |
| 100 X TIRF objective | Olympus | NAPO 1.49 | |
| 3,4-dihroxybenzoic acid (PCA) | Sigma-Aldrich | P5630 | |
| 3-aminopropyltriethoxysilane (APTES) | Sigma-Aldrich | 741442 | |
| 6% Novex Tris-Borate-EDTA gel | Thermo Fisher Scientific | EC6265BOX | |
| Adhesive sheet | Grace bio-labs | SA-S-1L | |
| Benchtop refrigerated centrifuge | Eppendorf | Z605212 | |
| Biotin-PEG | Laysan Bio | Biotin-PEG-SVA 5000 | |
| Bovine Serum Albumin (BSA) | New England Biolabs | B9001S | |
| Calcium Chloride Dihydrate | Sigma-Aldrich | 31307 | |
| cation exchange column | GE healthcare | MonoS (4.6/100) | |
| Cell distruptor | Constant Cell Disruption System | TS5/40/CE/GA | |
| Coomassie Brilliant Blue | MP Biomedicals | 808274 | |
| Cy3 emission filter | Chroma | HQ600/40M-25 | |
| Cy5/Alexa Fluor 647 emission filter | Chroma | HQ700/40M-25 | |
| Dichroic for DV2 filter cube | Photometrics | 630dcxr-18x26 | |
| Dithiothreitol (DTT) | Thermo Scientific | R0861 | |
| Drill | Dremel | 200-1/21 | |
| Electronic cutter | Copam | CP-2500 | |
| EMCCD camera | Hamamatsu | C9100-13 | |
| Epoxy glue | Devcon | 14250 | |
| FPLC Aktapurifier UPC 10 | GE Healthcare | 28406268 | |
| GelQuant.NET software | biochemlabsolutions.com | Version 1.8.2 | |
| GEN1 entry vector | Harvard plasmid repository | HSCD00399935 | |
| Glycerol | Sigma Life Science | G5516 | |
| green laser (emission 532 nm) | Coherent | Compass 315M-100 | |
| Heparin column | GE healthcare | HiTrap Heparin column | |
| HEPES | BDH | BDH4162 | |
| Image splitter | Photometrics | Dualview (DV2) | |
| Imidazole | Sigma-Aldrich | I2399 | |
| Inverted microscope | Olympus | IX81 | |
| Isopropyl-ß-D-thiogalactoside (IPTG) | Goldbio. | 12481C100 | |
| Laser scanner | GE healthcare | Typhoon Trio | |
| LB Broth | Fisher Scientific | BP1426-500 | |
| Long pass 532nm filter | Semrock | LPD02-532RU-25 | |
| Magnesium Chloride | Sigma Life Science | M8266 | |
| mPEG | Laysan Bio | mPEG-SVA 5000 | |
| Neutravidin | Pierce | 31000 | |
| Ni-NTA column | GE healthcare | HisTrap FF | |
| NuPAGE 10% Bis-Tris gels | Novex Life technologies | NP0301BOX | |
| NuPAGE 10% Bis-Tris Protein Gels | Thermo Fisher Scientific | NP0302PK2 | |
| Origin software | OriginLab Corporation | Version 8.5 | |
| Phenylmethylsulfonyl fluoride (PMSF) | Alexis Biochemicals | 270-184-G025 | |
| Phosphate-buffered saline | GIBCO | 14190 | |
| Polyethylene Tubing (I.D. 0.76 mm O.D. 1.22mm) | Fisher (Becton Dickinson) | 427416 | |
| Protocatechuate 3,4-dioxygenase (3,4-PCD) | Sigma-Aldrich | P8279-25UN | |
| Quad-band dichroic | Chroma Inc | Z405/488/532/640rpc | |
| red laser (emission 640 nm) | Coherent | Cube 640 100C | |
| Sodium Chloride | Fisher Chemical | S271 | |
| Sorvall RC-6 plus centrifuge | Thermo Fisher Scientific | 46910 | |
| Spectrophotometer | Thermo Fisher Scientific | Nanodrop 2000 | |
| Syringe pump | Harvard Apparatus | 70-3007 | |
| Teflon tweezers | Rubis | K35A | |
| Tris Base | Promega | H5135 | |
| Ultracentrifuge | Beckman Coulter | Optima L-90K | |
| Ultrafiltration membrane | Millipore | UFC90300 |
참고문헌
- Moerner, W. E., Fromm, D. P. Methods of single-molecule fluorescence spectroscopy and microscopy. Review of Scientific Instruments. 74 (8), 3597-3619 (2003).
- Ha, T. Single-molecule fluorescence resonance energy transfer. Methods. 25 (1), 78-86 (2001).
- Weiss, S. Fluorescence spectroscopy of single biomolecules. Science. 283 (5408), 1676-1683 (1999).
- Stryer, L. Fluorescence energy transfer as a spectroscopic ruler. Annual Review of Biochemistry. 47, 819-846 (1978).
- Roy, R., Hohng, S., Ha, T. A practical guide to single-molecule FRET. Nature Methods. 5 (6), 507-516 (2008).
- Walter, N. G., Huang, C. Y., Manzo, A. J., Sobhy, M. A. Do-it-yourself guide: how to use the modern single-molecule toolkit. Nature Methods. 5 (6), 475-489 (2008).
- Conchello, J. A., Lichtman, J. W. Optical sectioning microscopy. Nature Methods. 2 (12), 920-931 (2005).
- Axelrod, D. Total internal reflection fluorescence microscopy in cell biology. Methods in Enzymology. 361, 1-33 (2003).
- Kim, H. D., et al. Mg2+-dependent conformational change of RNA studied by fluorescence correlation and FRET on immobilized single molecules. Proceedings of the National Academy of Sciences of the United States of America. 99 (7), 4284-4289 (2002).
- Lee, T. H., et al. Measuring the folding transition time of single RNA molecules. Biophysical Journal. 92 (9), 3275-3283 (2007).
- Holliday, R. Mechanism for Gene Conversion in Fungi. Genetical Research. 5 (2), 282-304 (1964).
- West, S. C., et al. The Formation and Resolution of Holliday Junctions during the Recombinational Repair of DNA Damages. Journal of Cellular Biochemistry. , 269-269 (1995).
- Cox, M. M., et al. The importance of repairing stalled replication forks. Nature. 404 (6773), 37-41 (2000).
- West, S. C. Molecular views of recombination proteins and their control. Nature Reviews: Molecular Cell Biology. 4 (6), 435-445 (2003).
- Duckett, D. R., et al. The structure of the Holliday junction, and its resolution. Cell. 55 (1), 79-89 (1988).
- Clegg, R. M., et al. Fluorescence resonance energy transfer analysis of the structure of the four-way DNA junction. Biochemistry. 31 (20), 4846-4856 (1992).
- McKinney, S. A., Declais, A. C., Lilley, D. M., Ha, T. Structural dynamics of individual Holliday junctions. Nature Structural Biology. 10 (2), 93-97 (2003).
- Joo, C., McKinney, S. A., Lilley, D. M., Ha, T. Exploring rare conformational species and ionic effects in DNA Holliday junctions using single-molecule spectroscopy. Journal of Molecular Biology. 341 (3), 739-751 (2004).
- Hyeon, C., Lee, J., Yoon, J., Hohng, S., Thirumalai, D. Hidden complexity in the isomerization dynamics of Holliday junctions. Nature Chemistry. 4 (11), 907-914 (2012).
- Ip, S. C., et al. Identification of Holliday junction resolvases from humans and yeast. Nature. 456 (7220), 357-361 (2008).
- Rass, U., et al. Mechanism of Holliday junction resolution by the human GEN1 protein. Genes & Development. 24 (14), 1559-1569 (2010).
- Liu, Y., et al. Crystal Structure of a Eukaryotic GEN1 Resolving Enzyme Bound to DNA. Cell Reports. 13 (11), 2565-2575 (2015).
- Chan, Y. W., West, S. GEN1 promotes Holliday junction resolution by a coordinated nick and counter-nick mechanism. Nucleic Acids Research. 43 (22), 10882-10892 (2015).
- van Gool, A. J., Hajibagheri, N. M., Stasiak, A., West, S. C. Assembly of the Escherichia coli RuvABC resolvasome directs the orientation of holliday junction resolution. Genes & Development. 13 (14), 1861-1870 (1999).
- Lee, S. H., et al. Human Holliday junction resolvase GEN1 uses a chromodomain for efficient DNA recognition and cleavage. eLife. 4, (2015).
- Chan, Y. W., West, S. C. Spatial control of the GEN1 Holliday junction resolvase ensures genome stability. Nature Communications. 5, 4844(2014).
- Liu, Y., Freeman, A. D., Declais, A. C., Lilley, D. M. J. A monovalent ion in the DNA binding interface of the eukaryotic junction-resolving enzyme GEN1. Nucleic Acids Research. 46 (20), 11089-11098 (2018).
- Zhou, R., et al. Junction resolving enzymes use multivalency to keep the Holliday junction dynamic. Nature Chemical Biology. 15 (3), 269-275 (2019).
- Bellendir, S. P., et al. Substrate preference of Gen endonucleases highlights the importance of branched structures as DNA damage repair intermediates. Nucleic Acids Research. 45 (9), 5333-5348 (2017).
- Sobhy, M. A., et al. Resolution of the Holliday junction recombination intermediate by human GEN1 at the single-molecule level. Nucleic Acids Research. 47 (4), 1935-1949 (2019).
- Sobhy, M. A., et al. Versatile single-molecule multi-color excitation and detection fluorescence set-up for studying biomolecular dynamics. Review of Scientific Instruments. 82 (11), 113702(2011).
- Kapanidis, A. N., et al. Fluorescence-aided molecule sorting: analysis of structure and interactions by alternating-laser excitation of single molecules. Proceedings of the National Academy of Sciences of the United States of America. 101 (24), 8936-8941 (2004).
- Lee, N. K., et al. Accurate FRET measurements within single diffusing biomolecules using alternating-laser excitation. Biophysical Journal. 88 (4), 2939-2953 (2005).
- Rashid, F., et al. Initial state of DNA-Dye complex sets the stage for protein induced fluorescence modulation. Nature Communications. 10 (1), 2104(2019).
- Sambrook, J., Russell, D. W. Standard ethanol precipitation of DNA in microcentrifuge tubes. Cold Spring Harbor Protocols. 2006 (1), (2006).
- Holden, S. J., et al. Defining the limits of single-molecule FRET resolution in TIRF microscopy. Biophysical Journal. 99 (9), 3102-3111 (2010).
- Bronson, J. E., Fei, J., Hofman, J. M., Gonzalez, R. L. Jr, Wiggins, C. H. Learning rates and states from biophysical time series: a Bayesian approach to model selection and single-molecule FRET data. Biophysical Journal. 97 (12), 3196-3205 (2009).
- Kou, S. C., Cherayil, B. J., Min, W., English, B. P., Xie, X. S. Single-molecule Michaelis-Menten equations. Journal of Physical Chemistry B. 109 (41), 19068-19081 (2005).
- Clegg, R. M., Murchie, A. I., Lilley, D. M. The solution structure of the four-way DNA junction at low-salt conditions: a fluorescence resonance energy transfer analysis. Biophysical Journal. 66 (1), 99-109 (1994).
- Pohler, J. R., Duckett, D. R., Lilley, D. M. Structure of four-way DNA junctions containing a nick in one strand. Journal of Molecular Biology. 238 (1), 62-74 (1994).
- Fogg, J. M., Lilley, D. M. Ensuring productive resolution by the junction-resolving enzyme RuvC: large enhancement of the second-strand cleavage rate. Biochemistry. 39 (51), 16125-16134 (2000).
- Sobhy, M. A., Joudeh, L. I., Huang, X., Takahashi, M., Hamdan, S. M. Sequential and multistep substrate interrogation provides the scaffold for specificity in human flap endonuclease 1. Cell Reports. 3 (6), 1785-1794 (2013).
- Rashid, F., et al. Single-molecule FRET unveils induced-fit mechanism for substrate selectivity in flap endonuclease 1. eLife. 6, e21884(2017).
- Zaher, M. S., et al. Missed cleavage opportunities by FEN1 lead to Okazaki fragment maturation via the long-flap pathway. Nucleic Acids Research. 46 (6), 2956-2974 (2018).
- Didenko, V. V. DNA probes using fluorescence resonance energy transfer (FRET): designs and applications. BioTechniques. 31 (5), 1106-1116 (2001).
- Toseland, C. P. Fluorescent labeling and modification of proteins. Journal of Chemical Biology. 6 (3), 85-95 (2013).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An oxygen scavenging system for improvement of dye stability in single-molecule fluorescence experiments. Biophysical Journal. 94 (5), 1826-1835 (2008).
- Swoboda, M., et al. Enzymatic oxygen scavenging for photostability without pH drop in single-molecule experiments. ACS Nano. 6 (7), 6364-6369 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유