Method Article
מולקולה בודדת Förster שיטות העברת אנרגיה בזמן אמת על החלטה של צומת הולידיי-GEN1
* These authors contributed equally
In This Article
Summary
מוצג כאן הוא פרוטוקול לביצוע מולקולה בודדת Förster העברת אנרגיה ללמוד החלטה ג'ונסון. עירור שני הצבעים משמש לקביעת קבועי הדיסוציאציה. הזמן חד צבע לשגות smfret הוא לאחר מכן בזמן אמת מחשוף בחני להשיג את התפלגות זמן לשכון לפני הרזולוציה ג'ונסון.
Abstract
שיטות בצובר למדוד את התנהגות ההרכב של מולקולות, שבו שיעורי תגובה בודדים של השלבים הבסיסיים ממוצעים ברחבי האוכלוסיה. מולקולה בודדת Förster העברת אנרגיה (smFRET) מספק הקלטה של שינויים קונפורמטיים מתרחש על ידי מולקולות בודדות בזמן אמת. לכן, smFRET הוא רב עוצמה במדידת שינויים מבניים באנזים או במצע במהלך הכריכה והזרז. עבודה זו מציגה פרוטוקול עבור הדמיה בודדת מולקולה של האינטראקציה של הולידיי-אין ארבע כיוון (ג'ונסון) והפער endonuclease I (GEN1), ציטוסולומולוגי הומוולוגיים אנזים שילוב מחדש. מוצגים גם הם יחיד צבע ושני צבע עירור מתחלפים (אלכס) smFRET הפרוטוקולים הניסיוניים לעקוב אחר הרזולוציה של ג'ונסון על ידי GEN1 בזמן אמת. הקינטיקה של GEN1 דימרזציה נקבעת על ידי ג'ונסון, אשר הוצע לשחק תפקיד מפתח ברזולוציה של ג'ונסון והוא נשאר חמקמק עד עכשיו. הטכניקות המתוארות כאן יכולות להיות מוחלות באופן נרחב כדי להשיג תובנות מכניסטיות בעלות ערך רב של מערכות האנזים-DNA רבות.
Introduction
שיטות חד-מולקולות המבוססות על זיהוי של קרינה פלואורסצנטית מספקות יחס גבוה של אות לרעש1. לדאוג היא טכניקה ספקטרוסקופית שיכולה למדוד מרחקים בטווח של 1 – 10 ננומטר, עיבוד טכניקה זו כסרגל מולקולרי למדידת מרחקים בטווח ננומטר2,3. לספקטרום הקליטה של הקבלה יש חפיפה ספקטרלית חלקית עם ספקטרום הפליטה של התורם בסוף אורך הגל הקצר יותר. היא מתווכת על ידי העברת אנרגיה פחות הקרינה בין זוג תורם לקבלה, בעוד היעילות של העברת אנרגיה תלויה במרחק וכיוון של הקבלה4.
מספר גישות יושמו כדי למזער את הרקע ולשפר את יעילות הזיהוי של האות הפלואורסצנטית5,6. גישה אחת היא מיקרוסקופיה קונפוקלית, שבה חור מגביל את נקודת העירור לגודל מתחת למגבלת העקיפה7. גישה נוספת היא השתקפות פנימית מוחלטת (TIRF), שהיא טכניקת תאורה רחבת השדות שבה האור מכוון מחוץ לציר מעל זווית קריטית8. האור הוא אז באופן פנימי לחלוטין משתקף בממשק בין הזכוכית והפתרון מימית, יצירת גל אוונזאני רק מאיר את fluorophores מחובר למשטח זכוכית ומונע רקע fluorophores בשאר הפתרון.
במיקרוסקופיה, המולקולות יכולות להיות מפזרת או מתחת לפני השטח באופן חופשי. הרזולוציה הטמפורלית הושגת יכולה להיות בתוך מיקרו-שניות עד מספר אלפיותהתשע 9. הזיהוי הקונמוקד עבור מולקולה בודדת מבוצע על-ידי דיודת מפולת פוטון יחיד (SPAD) וסריקת נקודה אחר נקודה של אזור הריבית10. ב TIRF, סדרת זמן של כמה מאות מולקולות מקיבוע על פני השטח נרשם על ידי מיקום רגיש דו מימדי טעינה מצמידים גלאי (CCD). CCD מגביר את האות הפלואורסצנטית גם על ידי הגברה המסך זרחן ולוחית microchannel או הכפל על שבב של פוטואלקטרונים (EMCCD). הרזולוציה הטמפורלית תלויה במהירות הבדיקה ואת היעילות הקוונטית של CCD ובדרך כלל על סדר של כמה עשרות אלפיות שניה6.
ג'ונסון הוא ביניים מרכזי בתיקון DNA ו שילוב מחדש11,12,13,14. ג'ונסון יש שני מתמשך ושני מעבר גדילי שמתחברים בין הגדילים מתמשך בלי מצטלבים זה את זה. ג'ונסון קיים בפתרון כמו הקונמוגבונים מוערמים X, אשר עוברים איזופיקציה רציפה על ידי הגדילים מתמשך להיות מעבר וקווצות המעבר להיות רציפה בתוך השני15. העדפת איזומר של ג'ונסון תלויה ברצף הליבה ובסביבה היונית, ולמד בהרחבה על-ידי הפרט16,17,18,19.
GEN120 הוא חלבון monomeric בפתרון21 ודורש dimerization לדבוק את ג'ונסון, ובכך לאפשר הפרדה נאותה של הגדילים משולב מחדש22,23. העדפת הערימה של ההשפעות של ג'ונסון משפיעה על תוצאת השילוב הגנטי על-ידי הגדרת כיוון הרזולוציה של האגרטלים הרסולדים24. הבנת האופן שבו GEN1 מאגד את הג, מרכזת את שני החתכים, ומבטיחה שהרזולוציה המלאה הייתה כולה תחת מחקר אינטנסיבי21,22,23,25,26 ,27,28,29,30.
במחקר זה, הגדרת היעד המבוסס TIRF משמש כמתואר בעבר31. 2-צבע עירור מתחלפים (אלכס) מוחל כדי לקבוע את שינויי הקונפורמציה על האינטראקציה של GEN1 עם fluorophore המסומן ג'ונסון. אלכס מייצרת 2d היסטרגגרמות מבוסס על שני פרמטרים מטימטרי היעילות של E, שהיא התורם לקבלה התלוי במרחק, ואת הפרמטר סטויכיומטריה S, אשר מודד את התורם-לקבלה סטויכיומטריה32. אלכס מאפשר מיון של מינים פלואורסצנטי על בסיס הסטואיצ'ימינסים של fluorophores כולל תורם בלבד, קבלה בלבד, מעורבים אוכלוסיות מעורבות. אלכס יכול להאריך את השימוש לדאוג לטווח מלא והוא יכול לזהות הבדלים בהירות fluorophore ו oligomerization, כמו גם לפקח מקרומולקולה-ligand אינטראקציות33.
הוא נמצא כי GEN1 בעקביות מצליח לפתור את ג'ונסון בתוך החיים של הקומפלקס GEN1-ג'ונסון. שינויים תלויי-הזמן התלויים נובעים מסימני הזמן של מולקולות בודדות, ואילו ההיסטגרמות מייצגות את התפלגות האוכלוסיות המשמשות כבסיס. שימוש בזמן פקיעה בצבע יחיד, במהירות על המחירים ולהאט את התעריפים עבור GEN1 דיימר הם הפגינו, אשר להגדיל את הזיקה של GEN1 דיימר התאספו במוצר החתך הראשון.
Protocol
1. הכנת כיסוי משטח לפונקציונליזציה
-
ניקוי
- מקום חמש שמיכות (24 מ"מ x 60 מ"מ) באתנול בתוך צנצנת Coplin. Sonicate באתנול ואז 1 מ ' אשלגן הידרוקסיד עבור 30 דקות עבור 3x. כביסה באצטון 3x ואז decant.
-
סילניזציה
- הכינו פתרון של 2.8% 3-aminopropyltriethoxysilane (APTES) ב אצטון. סגרו את בקבוק ה-APTES עם סרט פרפין והחנות ב -4 ° c.
הערה: השתמש במשקפי בטיחות ועבוד תחת מכסה המנוע. המיכל של הפתרון silane צריך להיות יבש לחלוטין ושטפה על ידי אצטון מיד לפני ואחרי שפיכת פתרון silane לתוך הצנצנת. - יוצקים 70 mL של 2.8% APTES פתרון לתוך הצנצנת Coplin המכיל את הכיסויים. לנער את הצנצנת עבור 4 דקות ב שייקר מסלולית.
- תן את הצנצנת לעמוד על הספסל עבור 5 דקות, sonicate עבור 1 דקות, ולבסוף לשמור את הצנצנת על הספסל לעוד 10 דקות כדי silane להגיב עם קבוצות הידרוקסיל על משטח הזכוכית.
- להרוות את התגובה על ידי תוספת של 1 L של מים מפוהים על ידי שפיכת מים ישירות לצנצנת להחלפת ממס מהירה. שטפו את השקופיות 3 x במים על ידי טלטול לצדדים של הצנצנת על משטח שטוח.
- קח את הכיסויים מצנצנת ומניחים אותם על מגש אלומיניום לסכל. אופים את שמיכות בתנור ב 110 ° c עבור 30 דקות כדי לייבש את הכיסויים ולרפא את silane. השאר את המגש על הספסל עבור הכיסויים כדי לצנן את טמפרטורת החדר.
- הכינו פתרון של 2.8% 3-aminopropyltriethoxysilane (APTES) ב אצטון. סגרו את בקבוק ה-APTES עם סרט פרפין והחנות ב -4 ° c.
-
פינגיציה
- לחמם את הביוטיליס פג ו-פג, מאוחסן ב-20 ° צ' לטמפרטורת החדר (RT) כדי למנוע עיבוי של לחות על פתיחת המיכל.
- מניחים חמש שמיכות עם המשטח הsilanized מול הקופסה. מקום שני שוברי כיסוי זכוכית (22 מ"מ x 22 מ"מ) כמו מרווחים לאורך הקצוות של silanized coverslips.
- לאחר התחמם, הפוך את הפתרונות פג ו-יתד ביולוגי ביחס של ~ 1:100 ב 1 מ ל של טרי, 0.1 M נתרן ביקרבונט פתרון על ידי הוספת 1.5 mg של הביוטילנטיל פג ו150 mg של יתד לתוך שפופרת mL 1.5.
- מערבולת הצינור לפזר פג ו ספין למטה כדי להסיר בועות אוויר.
הערה: הולך קדימה משלב זה, להיות מהיר, כי יתד הידרוליזה בתמיסה בתוך ציר זמן של דקות. - להחיל במהירות 100 μL של הפתרון יתד לכל שמיכות. קח עוד שמיכות אפוי ומקום העליון שלה silanized פני השטח כלפי מטה על גבי coverslip עם הפתרון יתד, ומכאן להרכיב זכוכית-פתרון כריך זכוכית שבה 22 מ"מ x 22 מ"מ מsilanized שמיכות לאפשר את שני שמיכות הפונקציונליזציה כדי ל להפריד בקלות.
- מודב את הכיסויים לילה (16 h) בחושך ב-RT. לאחר הדגירה הושלמה, לקחת את שמיכות לגזרים, ואז לשטוף 10x באמצעות מים מוכי ידי שטיפת מהצד עם בקבוק השפריץ.
- יבש את הכיסויים מתחת. לזרם של חנקן יבש אחסן את הכיסויים היבשים תחת ואקום.
הערה: ניתן להשתמש בשקופיות במשך חודש אחד ללא השפלה איכותית.
2. הכנת תא זרימה
-
תא זרימה של ערוץ יחיד
- מקדחה שני חורים עם קוטר 1.22 מ"מ בחלק האמצעי של שקופית קוורץ (50 מ"מ x 20 מ"מ) עם המרכזים הממוקמים 37 mm נפרד ו 6.5 mm מקצה השקופית (איור 1A).
- גזור 41 mm x 2.25 mm הערוץ לתוך 50 mm x 20 מ"מ פיסת גיליון הדבקה כפולה באמצעות חותך אלקטרוני.
- לקלף את הצד הפלסטי של כיסוי המגן וליישר את קצות החלק עם קצות שקופית הקוורץ. להסיר בועות אוויר לכוד על ידי לחיצה בעדינות עם זוג מלקחיים polyטטרפלואורואתילן.
- מקלפים את הצד הנייר של החלק הדביק. הר את הפיסה על פני השטח הפונקציונל של הכיסויים.
- לחתוך צינורות פוליאתילן (מזהה 1.22 מ"מ) לאורך של 11 ס מ עבור הים ו 25 ס"מ על השקע. הכנס את הצינורית לתוך החורים המופרקים בעבר כשקע ולפורקן עבור תא הזרימה.
- השתמש 5 מינימום דבק אפוקסי כדי לאטום סביב הקצוות של ממשק קוורץ-coverslip ומסביב צינורות עבור כניסת ועודפים.
- השתמש בתא הזרימה מיד לאחר ייבוש או לאחסן תחת ואקום יבש לשימוש מאוחר יותר.
- התמוססות אבידין ב-PBS לריכוז של 0.03 mg/mL. סנן דרך מסנן מזרק 0.2 יקרומטר.
- זרימת הזרימה לתוך תא הזרימה באמצעות מזרק 1 mL. השתמש במזרק אחר מלא במאגר כדי לשטוף את העודפים avidin. להיזהר לא להציג בועות אוויר תוך החלפת מזרקים.
-
תא זרימה מרובה ערוצים
- תרגיל 6 חורים עם קוטר של 1.22 מ"מ על כל אחד מהצדדים הארוכים של שקופית קוורץ (76 מ"מ x 25 מ"מ) (איור 1B). הפוך את החורים 4.5 מ"מ מקצה השקופית ו 9.3 מ"מ בנפרד. ודא שהמרחק בין המרכזים של כל זוג חורים הוא 15 מ"מ.
- גזור שישה ערוצים (20 מ"מ x 2.25 מ"מ) לתוך החלק 76 מ"מ x 25 מ"מ של סרט דביק כפול באמצעות חותך אלקטרוני.
- לקלף את הצד הפלסטי של כיסוי המגן וליישר את הקצוות של פיסת הדבק עם קצות שקופית הקוורץ. להסיר בועות אוויר לכוד על ידי לחיצה עדינה באמצעות זוג מלקחיים פוליטפלואורואתילן.
- לקלף את הצד הנייר של החלק הדביק ולעלות על פני השטח הפונקציונל של העטיפה.
הערה: לפעמים מתקלף את הצד הנייר והצמדה לשקופית הקוורץ עובדת היטב בתא הזרימה הרב-ערוצית. - חותכים את צינורות האוויר (11 ס מ) וצינורות שקע (25 ס מ) עבור ששת הערוצים. הכן את תא הזרימה כמתואר בצעדים 2.1.6 – 2.1.9.
- חבר את השקע של הערוץ הראשון למשאבה. מניחים את הים לתוך שפופרת 0.5 mL עם OSS.
הערה: אורך צינור האוויר נבחר כדי למקסם את מספר האירועים בניסויים המחשוף שבוצעו תחת זרימה רציפה על ידי סנכרון זמן של כניסת אנזימים לתוך תא הזרימה והתחלת הדמיה ובכך הפחתת הלבנת מוקדם של ה . מסכת פלואור - מעבר לערוץ חדש על-ידי ניתוק השקע של הערוץ הנמצא בשימוש. סגור את השקע עם תקע העשוי מחט מזרק חתום עם דבק בחלק פלסטיק. סגור את הפרץ של הערוץ הנמצא בשימוש.
3. הכנת מערכת ניקוי החמצן (OSS)
- התמוססות 0.2 g של (±) -6-הידרוxy-2, 5, 7, 8-טטרמתיל כרומאן-2-חומצה קרבוקסילית (שלישיה המדינה המקרה הממזער מהבהב של fluorophores) ב 800 μL של מתנול.
- הוסף 6 מ ל של H מועברו2O ולהוסיף 1 N הdropwise עד שהוא מתמוסס. סנן באמצעות מסנן מזרק, הפוך ל-1 mL, ואחסן ב-80 ° c. ריכוז המניה הוא ~ 100 μM.
- להכין פתרון טרי של 3, 4-dihקסן חומצה בנזומית (PCA) על ידי המסת 61 מ"ג של אבקת PCA ב 4 מ ל של ddH2O. ריכוז המניה הוא ~ 100 nM.
- הוסף 58 μL של 10 N NaOH הdropwise, וודא מערבולת אחרי כל טיפה עד PCA הוא הומס המלא (pH = 9).
- התמוססות 5.3 מ"ג של protocatechuate 3, 4-דיחמצן (3, 4-PCD) ב 7 מ ל של מאגר אחסון PCD (טבלה 1). 3, 4-PCD מסיר חמצן ממאגרי הכריכה/מחשוף ידי מזרז את החמצון של protocatechuic חומצה34.
- חלק את פתרון ה-PCD לתוך 1 מ"ל. ריכוז המניה הוא ~ 1 μM. הצמד-הקפאת המבחנות בחנקן נוזלי ולאחסן at-80 ° c עבור אחסון לטווח ארוך או ב-20 ° c לאחסון לטווח קצר.
- הכן מאגר כריכה טרי (טבלה 1). תחליף 2 מ"מ CaCl2 עם 2 מ"מ MgCl2 עבור ניסויים במחשוף smfret.
- הכן 1 מ ל של מאגר ההדמיה (טבלה 1). שמור את מאגר ההדמיה על הקרח עד שהוא מוכנס לתא הזרימה כדי לשמור על הפעילות של מערכת ניקוי החמצן.
4. הכנת התווית באמצעות פלואורוסקופים
- מהווים מחדש את הלינופרופרופיגוס (טבלה 2) במאגר טריס-Edta (טבלה 1) לריכוז של 100 μm.
- הכן את הצומת סינתטי על ידי ערבוב חלקים equimolar ~ 3 μL של כל אחד X0 oligos המפורטים בטבלה 1.
- אנעל על ידי חימום ב 95 ° c עבור 5 דקות ואחריו קירור איטי כדי RT בקצב של 1 ° צ'/מינימום. השתמש בבלוק חום או ב-PCR כדי להשיג את קצב הצינון הרצוי.
- לטעון את התערובת על 8 ס"מ x 8 ס"מ של 10% טריס-borate-EDTA למעלה ג'ל פוליאקרילאמיד. החל 100 V והפעל את ג'ל עבור ~ 2 h. הלהקות מראות בבירור בעין, וצבעו סגול.
- בלו את להקת המצע המספח עם להב נקי. להעביר את פיסת ג'ל לתוך שפופרת אוטוקלאוד 1.5 mL.
- למחוץ את פיסת ג'ל בתוך הצינור עם בוכנה נקי ואז להוסיף 100 μL של TE100 מאגר (טבלה 1).
- לחלץ את ג'ונסון על ידי לטלטל את הצינור ב 20 ° צ' ב 1,500 סל ד ב thermomixer עבור ~ 2 h או הדגירה לילה ב 4 ° c.
- לבצע משקעים אתנול על הפתרון המכיל את המצע35.
- השהה מחדש את המצע ב -20 μL של TE100 מאגר (טבלה 1). הריכוז הסופי הוא 1–3 μm. aliquot 2 μl בכל צינור ולאחסן ב-20 ° c.
5. ביטוי חלבון וטיהור של GEN1
- לבנות את הפלביניים עבור הביטוי של האדם הGEN1 נחתך1,2,3,4,5 עם hexa histidine-תג ב C-הטרמינוס20 על ידי PCR של וקטור הכניסה.
הערה: התיוג N-terminal יגרום לחוסר ההפעלה של GEN1. C-tail מובנה הופך את הטיהור של אורך מלא GEN1 קשה באופן משמעותי. כמו כן, האורך המלא GEN1 דווח להפגין פחות פעילות מאשר גירסה מקוצר23. - הפוך את וקטור הביטוי לתוך E. COLI BL21-codonplus (DE3)-מאמץ ripl.
- התחסן את התאים שהפכו לשני 6 מבחנות L כל אחד מכיל 2 לוריא מדיה ציר המרק ב 37 ° c עם טלטול ב 180 סל ד עד הגיעו600 OD של 0.8.
- לצנן את התרבות עד 16 ° c ולגרום GEN1 ביטוי עם 0.1 mM איזופרופיל-β-d-thioגלאוסייד (IPTG) עבור 48 h.
- לקצור את התאים על ידי לסובב אותם ב 4 ° צ' ב 1000 x g בצנטריפוגה. כל ליטר של התרבות תשואות 5–6 g של הגלולה.
- השמט את הסופרנטאנט והשהה מחדש את תאי הפלתד במאגר הליזה (טבלה 1) באמצעות 4 מ"ל/g של תאים.
- בצע את הפירוק התאים באמצעות משתמש תא ב 30 kPsi ואז ספין למטה ב 10,000 x g עבור 1 h ב 4 ° c. לאסוף את סופרנטאנט ולסנן אותו על הקרח באמצעות מסנני 0.45 יקרומטר.
- לבצע טיהור חלבון באמצעות fplc ידי העברת פילטרט דרך העמודה 5 mL-נ. ת. ע ב 2.5 ml/min קצב זרימה באמצעות מאגר a (טבלה 1).
- רוחצים עם 15 אמצעי אחסון של עמודות (CV). אליוט עם מעבר לינארי של מאגר A ו-500 מ"מ סרמדול מעל 20 קורות חיים ב-5 מ"ל שברים. GEN1 מהטור בסביבות 100 מ"מ.
- פיפטה 10 μL מתוך השברים שנאספו, להוסיף נפח שווה של 2x SDS לטעון לצבוע כל aliquot. הספרות מחממת את הדגימות על ידי חימום ב 90 ° c עבור 5 דקות, מגניב, ולסובב את הדגימות.
- לטעון את הדגימות על 10% Bis-Tris ג'ל. הפעל את ג'ל עבור 30–45 דקות ב 200 V. כתם באמצעות coomassie כחול מבריק, ואז מוכתם. לאסוף את השברים המכילים GEN1 מטוהרים.
- הפחת את ריכוז המלח של השברים המשולבים ל 100 מ"מ על ידי דילול באמצעות מאגר C (טבלה 1).
- העבירו את חלבון המלח הנמוך דרך טור הפארין בגודל 5 מ ל בקצב הזרימה של 3 מ ל/דקה באמצעות מאגר B (טבלה 1).
- לשטוף עם 10 קורות חיים. אליוט באמצעות הדרגתי של 20 קורות חיים עם מאגר B ו 1 M הנאל. לאסוף 5 מילימטר שברים שבו GEN1 החומקת סביב 360 mM הנאל.
- בדוק את שברים מטוהרים עבור שברים GEN1 מטוהר כפי שמתואר בשלב 5.8. לשלב את השברים האלה ולדלל ל 100 מ"מ באמצעות מאגר C.
- טען את חלבון המלח התחתון לעמודת חילופי לקטיון בקצב זרימה של 1 mL/min באמצעות מאגר B.
- אליוט על ידי הדרגתי של 40 קורות חיים באמצעות מאגר B ו 1 M הנאל. לאסוף 1.7 שברים מ מ שבו GEN1 הליטים סביב 300 מ"מ הנאל.
- בדוק אם הטוהר של GEN1 בשברים שתוארו כמתואר בשלב 5.8.
- לשלב את השברים הטהורים dialyze ב 4 ° צ' נגד מאגר האחסון (טבלה 1). בצע החלפה אחת לפחות של המאגר במהלך הדיאליזה.
- למדוד את ריכוז החלבון ~ 0.5–1 מ"ג/mL. מחלקים את החלבון דיאליזה בתוך 10–15 כרכים μl בצינורות קטנים, הקפאת flash בחנקן נוזלי, ולאחסן ב-80 ° c.
6. מולקולה בודדת לניסויים בלבד
הערה: הניסויים smFRET מבוצעים על הגדרת מותאם אישית המבוסס TIRF הגדר (איור 1C) תיאר בעבר31.
- מחקרים בעלי צבע יחיד
- להחיל טיפה אחת של שמן טבילה על המטרה 100x TIRF. הגדר את EMCCD לרווח מתאים כדי למטב את האות לרקע ולמנוע רוויה.
הערה: אל תביטו ישירות לתוך קרן הלייזר ולבשו משקפי מגן בעת יישור הלייזר. - הצב את תא הזרימה בזהירות על מחזיק הדגימה. הרימו בהדרגה את המטרה באמצעות הסתגלות גסה עד שהשמן נוגע בסרבל.
- הפעל את לייזר ירוק (532 nm). מעבר למצב התאמה עדין של המטרה. הישר את הפליטה ליציאת המצלמה כדי להתבונן בתמונה שעל הצג.
- התאם את גובה המטרה עד שהמשטח הפונקציונל של הכיסויים מובא בפוקוס וניתן לצפות בה על הצג.
הערה: רכישת התמונה על ידי EMCCD מפעילה את עירור לייזר באמצעות מסנן tunable-אופטיים מדגם acousto (AOTF) כדי למנוע הלבנה לדוגמה כאשר התמונות לא השיגו. - בדוק כי הרקע מהמשטח הפונקציונל של הכיסויים אינו עולה על מקומות מעטים לפני שזורמים ב-"ג'ונסון" המסומן בצבעי פלואורוסקופים.
- לדלל את המצע המניה כ 1000 פעמים ב TE100 מאגר (טבלה 1) לריכוז הסופי של 1 – 5 ננומטר. פיפטה 0.2 – 0.5 μL של המצע מדולל לתוך 120 μL של מאגר הדמיה עם OSS לתוך שפופרת 0.5 mL.
- חבר את השקע של תא הזרימה למשאבת המזרק. הכנס את צינור האוויר של תא הזרימה לתוך שפופרת 1.5 mL ולהפעיל את משאבת המזרק בקצב הזרימה של 30-50 μL/min כדי למשוך את הפתרון מהצינור.
- לעתים קרובות לבדוק את פני השטח עבור כיסוי טוב (100-300 המפוזר באופן מאוד מבוקר, המצע מרווח היטב) על ידי הדמיה בקצרה עם לייזר ירוק.
- אם הכיסוי פני השטח עדיין לא מספיק לחכות כמה דקות עבור התווית של ג'ונסון מתוך הפתרון להתיישב על פני השטח או לחזור על השלב הזורם.
- זרימה נוספת 120 μL של מאגר הדמיה (טבלה 1) בשעה 30 – 50 μl/min כדי לשטוף בלתי מאוגד המסומן באמצעות פלואורוסקופים. אז תן תא הזרימה לשבת 5 דקות כדי לאפשר OSS לרוקן חמצן מומס. Photobleaching לבנת של fluorophores צריך להיות מינימלי בתחילת ההדמיה.
- קבע את זמן החשיפה (~ 60 ms), זמן המחזור יהיה להגדיר באופן אוטומטי על-ידי תוכנה המבוססת על מהירות העברת הנתונים (~ 104 ms), ולציין את המספר הרצוי של מחזורים או מסגרות (~ 400). הפליטה מן התורם (Cy3) וקבלה (אלקסה Fluor 647) מפוצל לשני ערוצי צבע על ידי התקן מפצל תמונה.
- מצא אזור מתאים על פני השטח, למקד את התמונה על ידי התאמת גובה המטרה ולהקליט ולשמור את הסרט בפורמט TIFF 16-bit.
- . מעבר לאזור חדש
הערה: תמיד לנוע בכיוון אחד בלבד (כלומר, מ לשקע למטה) כדי למנוע הדמיה של אותו האזור פעמיים. - להכין 1, 2, 5, 10, 25, 50, 75, ו 100 nM GEN1 ב 120 μL של מאגר הדמיה אחד בכל פעם. זרימה את הפתרון בקצב הזרימה של 30-50 μL/min.
הערה: אם המדידה הנדרשת נעשית במצב יציב כמו באיגוד של ג'ונסון על ידי GEN1 או איזופיקציה של ג'ונסון החופשי, המתן 3 – 5 דקות לאחר הזרמת הזרם כדי להקליט את הסרט. לרכוש שלושה עד ארבעה סרטים מאזורים חדשים עבור כל GEN1 ריכוז. - אם המדידה מבוצעת תחת זרימה רציפה כמו במחשוף של ג'ונסון על ידי GEN1 ואז להתחיל להקליט 5 – 10 לפני הכניסה של GEN1 לתא הזרימה. חזור על המדידה על-ידי העברה לערוץ חדש בתא הזרימה בן ששת הערוצים.
- בסופו של דבר, השתמש בשקופית שקופית פלואורסצנטית קבועה כדי למפות את חלקיקי התורם והקבלה אחד לשני בהתקן פיצול התמונה.
- הוסף 0.2 μl של 1 יקרומטר חרוזים פלורסנט בקוטר 500 μl של 1 M טריס (pH = 8.0) כדי לאפשר את החרוזים כדי להיצמד למשטח.
- חותכים ריבוע (18 מ"מ x 18 ממ ') בתוך פיסת 22 מ"מ x 22 מ"מ בחתיכה של אטם דו צדדי דבק. לקלף ולתקוע את החלק באמצע של שקופית הקוורץ 25 מ"מ בעובי 76 מילימטר.
- מקום 50 μL של הפתרון חרוזים מדולל ולעזוב 5 – 10 דקות כדי ליישב. צרף a 22 מ"מ x 22 מ"מ שמיכות על גבי החלק המרובע. יבש מחרוזת חרוזים הפתרון עם רקמה, ואז לאטום את התא על ידי דבק אפוקסי.
- לרכוש 100 מסגרות של השקופית חרוזים ב 60 ms זמן חשיפה.
התראה: הנמך את כוח הלייזר ואת EMCCD להשיג למינימום כדי למנוע רוויה של הגלאי. - התקן את חבילת התוכנה (למשל, שתי טונים) ולפתוח את הסרטים שם כפי שצוין במדריך למשתמש36. בחר את מיקומי החרוזים הבודדים בערוץ התורם והקבלה. צור מטריצת טרנספורמציה כמתואר במדריך.
הערה: תוכנה זו משתמשת במטריצה המרה כדי להתאים את המיקומים של החלקיקים בערוצי התורם ולקבלה ולתקן את כל חוסר התאמה קלה במכשיר פיצול התמונה. - עבור אל הקובץ, הקש על טען סרט ולאחר מכן בחר את קובץ הסרט ולחץ על פתח. בתפריט קובץ, לחץ על טען TFORM ובחר את מטריצת השינוי שנוצרה משקופית החרוזים. כוונן את הסף עבור ערוצי התורם והקבלה עד שלא ייכללו תוצאות חיוביות שגויות.
- בתפריט מסנן ערוצים , בחר באפשרות D & & A כדי לבחור עבור חלקיקים המסומנים באמצעות התורם והמאשר. בדוק את שדה גבול השכן הקרוב ביותר כדי לא לכלול מולקולות הקרובות מאוד זה לזה. בדוק אליבוליות מקסימלית כדי לא לכלול מולקולות מוזר מאוד לבדוק מגבלות רוחב להוציא מולקולות מאוד רחב או צר מאוד.
- סוג Plothistcw כפי שהורו במדריך שתי טונים לבנות היסטגרמות.
הערה: "לכאורה" יעילות החיסכון מחושבת על ידי התוכנית על ידי חלוקת הפליטה של הקבלה על ידי פליטות סך של התורם וקבלה. שתי טונים משתמש 100 מרווחי ל-bin את התפלגות מצבי המולקולות נגד היעילות. - סוג plotTimetraceCW כפי שהורו במדריך שני גוונים כדי ליצור את הזמן עקבות עבור כל מולקולה.
הערה: זמן-עקבות ניתן לנתח נוסף על ידי vbFRET37 כדי לזהות מצבי מצבים שונים, הזמן שלהם לשכון, ושיעורי המעבר בין מצבים שונים.
- להחיל טיפה אחת של שמן טבילה על המטרה 100x TIRF. הגדר את EMCCD לרווח מתאים כדי למטב את האות לרקע ולמנוע רוויה.
- 2-צבע עירור מתחלף (אלכס) ניסויים
- הקלטת סרט המורכב ממסגרות רצופות של פליטות התורם והקבלה על ידי ההתרגשות ישירה עם לייזרים ירוק ואדום, בהתאמה, כל ~ 80 ms במשך.
- פתחו את הסרטים הנרכשים של אלכס בצמד טונים. הגדר את סף הזיהוי המתאים כ-~ 300 עבור שלושת הערוצים: פליטת תורמים עקב עירור התורמים (DexDem); הפליטה של איקטור עקב עירור התורמים (DexAem); והפליטה של איקטור עקב עירור ישיר (AexAem).
- החל את מסנן הערוצים DexDem & & DexAem & & AexAem כדי לבחור עבור החלקיקים שלהם יש גם תורם וגם קבלה. קשר את החלקיקים ~ 200-300 בשלושת הערוצים.
- השתמש בקוד plotHistALEX MATLAB כדי ליצור היסטוליגרמות של אלכס. התאם פסגות שונות בהיסטגרמות לפונקציות גאוסיאנית וקבע את אחוז האוכלוסיה באזור שמתחת לעקומה באמצעות תוכנת מקור38.
הערה: הפסגות במבנה הכריכה מתאימות לקומפלקס GEN1-ג'ונסון המאוגד, בעוד שבג'ונסון החופשי, מייצגים הפסגות את איזומרים המשתנים. - השתמש בקוד plotTimetraceALEX MATLAB כדי ליצור מעקב הזמן עבור כל מולקולה מראה פליטת התורם על ידי עירור ישיר, ו לקבלה פליטות עקב לדאוג ועירור ישיר.
הערה: אלכס זמן-עקבות באופן עצמאי כדי להראות את פליטת הן של התורם וגם לקבלה, אבל ברזולוציה הרקתית התחתונה מאשר לפרט בצבע יחיד. בדומה לסריג יחיד בצבע, אלכס זמן-רשמים ניתן לנתח עוד יותר על ידי vbFRET כדי לזהות מדינות שונות של הפרט ואת הזמנים שלהם לשכון בהתאמה. - קבע את קבוע הדיסוציאציה על-ידי התאמת אחוזי האוכלוסיה המאוגדת לעומת GEN1 ריכוז לפונקציה היפרבולית.
- הזמן הפקיעה בצבע יחיד סריג
- קבע את זמן החשיפה של לייזר ירוק 60 ms וזמן מחזור ל 624 ms או נמוך יותר, בהתאם למהירות של הדינמיקה נצפתה.
- הגדר את קצב הזרימה ל-110 μL/min בערוץ אחד של תא הזרימה בן ששת הערוצים. התחילו את ההקלטה לזמן קצר לפני הכניסה של GEN1 בתוך תא הזרימה.
הערה: זרימה רציפה מובילה הלבנה מהירה של fluorophores, ולכן סנכרון ההתחלה של הדמיה וכניסת החלבון מגדילה את מספר האירועים שנתפסו. הקריאה האופטימלית של משאבת המזרק תלויה בכרך המת ובצינורות המדויקים המשמשים להרכבת תא הזרימה; במקרה שלנו זה ~ 25 μL. - לרכוש סרט של ~ 125 מסגרות עבור זמן הרכישה הכולל של 78 s. בסוף ההקלטה, לחשוף את המדגם ללייזר אדום עבור 50 מסגרות כל אחד עם 25 ms זמן חשיפה כדי לחקור את הקבלה.
הערה: שיטה זו מאריכה את חלון התצפית בניסוי מחשוף באמצעות הפחתת מספר מחזורי עירור. הפרמטרים הקינטית כ- kו- kמחוץ לדימרזציה נגזרים מהתאמת ההתפלגות לדגם דו-מעריכי30,38.
7. משמרת חשמלית אלקטרופיניטית לתנועה (EMSA)
- ב 50 μL סה כ נפח, מודלת את הריכוז הרצוי של GEN1 עם 50 pM Cy5-התווית ג'ונסון ב RT עבור 30 דקות במאגר כריכת EMSA (טבלה 1).
- לטעון את הדגימות על 8 ס"מ x 8 ס"מ של 6% טריס-בוראט-EDTA ג'ל. הפעל את ג'ל באמצעות 100 V עבור 1 h + 20 דקות במאגר 1x TBE ב-RT.
- קבע את אחוז המצע המאוגד בריכוז GEN1 מהתרומה היחסית שלה לעוצמת הקרינה הפלואורסצנטית הכוללת של הנתיב המתאים.
הערה: GEN1 מונומר-ג'ונסון (הלהקה האני) מזוהה על ידי הסכם הגודל שלה עם הכריכה picomolar של GEN1 מונומר אל הפצע המג'ונסון21,30. GEN1-דימר-ג'ונסון מוקצה ללהקה II בגלל הכריכה החורגת של GEN1 מונומר לג21,23. - חשב את קבועי האיגוד הגלויים kd-monomer-APP-Emsa ו- Kd-dimer-app-emsa באמצעות המשוואה:

היכן: Max הוא הריכוז בו הגיע המין המתאים לכריכת המקסימום (מונומר או דימר); n הוא מקדם הגבעה; ק d-app-emsa הוא קבוע מחייב לכאורה של המינים המתאימים, המציין את הריכוז של GEN1 שבו מקסימום חצי מרבי של מונומר או דיימר קיים.
תוצאות
הטיית הקונלשעבר ואיזופיקציה של ג'ונסון
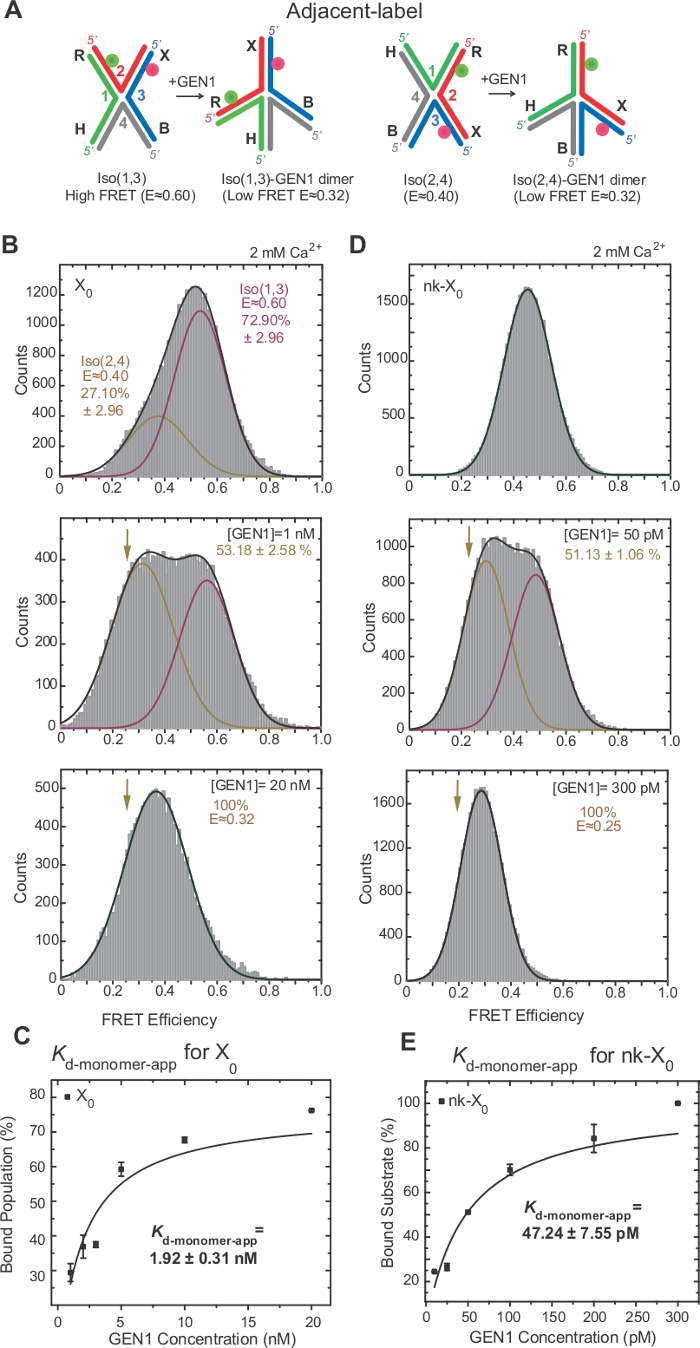
האיזופיקציה של ג'ונסון נחקר בהרחבה על-ידי הוספת תוויות של שתי זרועות סמוכות לצומת17,18,39. התורם (Cy3) והקבלה (אלקסה Fluor 647) ממוקמות בשתי הזרועות השכנות, R (סטרנד 2) ו-X (סטרנד 3), בהתאמה (איור 2 א). מוערמים X איזוers הוקצו על ידי שני קווצות רציפה שלהם [i.e., Iso (1, 3) או Iso (2, 4)]. ההיסטוגרמה של אלכס היסטוגרמה של התווית הסמוכה X0 מראה שתי פסגות המתאימות לשינוי של iso שופע יותר (1, 3) (e ~ 0.75) ושפע פחות iso (2, 4) (e ~ 0.40) (איור 2b).
משתמשים בצבע יחיד משמש לרכישת הזמן עקבות עבור הקלטה את השינויים מהירה מאוד שינויים בג בחינם עם ברזולוציה הטמפורלית הגבוהה ~ 10 ms באמצעות הפחתת האזור שבשימוש של מצלמת EMCCD2. אחד מנציגי השעון היחיד של מייצג X0 של הצומת מציג את המעברים בין מספרי הדקות הגבוהים והנמוכים (איור 2b). שיעורי איזוריזציה kIso (1, 3)-iso (2, 4) ו-kiso (2, 4)-iso (1, 3) התקבל מן היסטגרמות זמן להתעכב של Iso (1, 3) ו-iso (2, 4) (איור 2c) הם עקביים עם אלה שדווחו בעבר17.
SMFRET מדגים עיוות פעיל של ג'ונסון על ידי GEN1
. עם הכריכה ל GEN122 לפיכך, המרווח בין התורם לקבלה דומה בשני הצדדים (1, 3) ו-Iso (2, 4) (איור 3 א). הכריכה של סמפרט בוצעו בנוכחות Ca2 + כדי למנוע את המחשוף של ג'ונסון. היסטגרמות של התווית הסמוכה X0 הצומת ב GEN1 ריכוזי שונים נרכשו על ידי אלכס (איור 3b). ההיסטוגרמה מתאימה לשתי פונקציות גאוסיאנית: אחת המתאימה ל-Iso גדול בחינם (1, 3), והשנייה המתאימה לאוכלוסיית GEN1-ג'ונסון המאוגדת לאחר הפחתת התרומה של Iso (2, 4) מפסגת ה-סריג הנמוך.
ב הGEN1 הריכוזיות ריכוז, ההיסטוגרמה הקשת של X0 יש רק שיא יחיד לפרט נמוך התואם GEN1 מאוגד כדי איזומר של ג'ונסון כפי שניבא על ידי דגם22. קבוע מונומר דיסוציאציה לכאורה (Kd-מונומר-app) נקבע מן ההתאמה ההיפרבולי של האחוזים של האוכלוסייה GEN1 כפונקציה של ריכוז GEN1 (איור 3 ג). התווית הסמוכה-nk-X0 מייצגת גרסה שהיא בלבד שהיא מחקה ג'ונסון המחקה את המוצר לאחר תגובת החתך הראשונה. בשל ההקלה של זן הערימה על ידי ניק מדומה, nk-X0 הוא מבנה לא איזוריזינג40 כפי שניכר מפסגת המצע היחיד ב-E ~ 0.40, בניגוד X0 (איור 3d לעומת איור 3d). המבנה של GEN1-nk-X0 הוא דומה לזה של קומפלקס GEN1-X0 , כפי שמצוין על ידי הדמיון ביעילות (E ~ 0.25 עבור nk-X0 ו 0.32 עבור X0) (איור 3d vs. איור 3 ב). האיגוד החזק של GEN1 מונומר ל nk-X0 מוצג על-ידי הערך 40 הנמוך ביותר Kd-מונומר-app מאשר זה של X0 (איור 3e לעומת איור 3e). הכריכה הצמודה עשויה לשמש כמנגנון הגנה נגד הרזולוציה הלא מלאה של ג'ונסון במקרה הלא סביר של הדיסוציאציה של GEN1 דיימר או אחד המונמרים שלו.
הכריכה החורגת של GEN1 מונומר ל ג'ונסון
האיגוד של GEN1 מונומר לג ואחריו היווצרות דיימר הוא תכונה ייחודית עבור האגרטל החדש של היוקריוטיק הGEN1 לעומת prokaryotic resolvase, אשר קיימים בצורה dimeric בפתרון21,23,41. EMSA של GEN1 ב 50 pM X0 מציג את האגודה החורגת של GEN1 לתוך מכלולי סדר גבוהים יותר, כפי שמצוין בספרות הרומיות בלוח העליון (איור 4a). קבוע הדיסוציאציה של GEN1 מוניומר נקבע על ידי emsa (Kd-מונומר-emsa) עם קבוע הדיסוציאציה מתוך שיטת האיגוד שלsmfret k d-מונומר-app (איור 4a ואיור 3c , בהתאמה). הקוונפיקציה של הלהקה II משמש לחישוב קבוע הדיסוציאציה של שיווי משקל של GEN1 דיימר (Kd-דיימר-emsa). Emsa של GEN1 ב 50 pM nk-X0 מדגים את כריכת המונומר הבולטת כפי שמצוין על ידי Kd-מונומר-app-emsa שהוא 30 מתקפל נמוך מזו של X0, בעוד Kd-dimer-emsa הוא דומה לזו של X0 (איור 4b).
ראיות נוספות כי GEN1 מונומר נקשר ומעוות את ג ' ק הוא התבוננות של מספר משמעותי של עקבות של חלקיקים בלתי מבוקר עם מדינה יציבה נמוכה של המצב (איור 4c) בנוכחות Mg2 + בריכוזים נמוכים GEN1. מספר העקבות הללו ירד על הגדלת הריכוז GEN1. הרזולוציה של ג'ונסון מונע על ידי הכריכה הדוקה של GEN1 monomer, אשר תומך במבנה דיימר. הכריכה של המונומר נצפתה בזמן שרידים של nk-X0 ב-Mg2 +, אשר משתרע עד מספר ריכוז Nanomolar (איור 4d). GEN1 מונומר נקשר בחוזקה כדי להגן על nk-X0, בסופו של דבר להבטיח רזולוציה מלאה באמצעות היווצרות דיימר.
שיטת הרזולוציה של SMFRET של ה-ג'ונסון
המונח "פצילות" ב-smfret בחני משמש לסירוגין עם "החלטה" של ג'ונסון, שכן באותו מקרה רק שחרור המוצר העוקב אחר אירוע המחשוף השני מזוהה. האירועים נרשמים על ידי הקפיצה זמן בצבע יחיד עירור כדי למזער את הלבנת התמונה של הקבלה רגיש לצילום על זמן הרכישה של ~ 1.3 דקות.
התרשים באיור 5A ממחיש את החתכים של קווצות 1 ו -3 של X0 Iso (1, 3) לאחר הכריכה והעיוות על ידי GEN1 של x0 המצורפת לזכוכית הפונקציונליזציה. גם התורם וגם הקבלה נכנסים לפתרון והתוצאה היא אובדן האותות שלהם אחרי הרזולוציה של ג'ונסון. החתכים הראשונים והשניים מופרדים ב-nk-X0, אשר מדגימה אב-טיפוס עבור ה-ג'ונסון שנפתר חלקית. עם כריכת GEN1, nk-X0 מאמצת מבנה דומה ל-X0. הרזולוציה ממשיכה בחתך אחד בסטרנד 1, כפי שמודגם באיור 5B.
העזיבה הזמנית של התורם והקבלה לאחר מדינה דקה יציבה נמוכה בעקבות נפתר X0 אירעה ללא הופעתה של מתווך ביניים (E = ~ 0.40) מציין כי החלטה מלאה מתרחשת בתוך החיים של GEN1-ג'ונסון מורכב (איור 5C). לפיכך, תוצאות אלה מרמזות על כך שהרזולוציה של ג'ונסון מתרחשת במהלך תקופת החיים המורכבת GEN1-ג'ונסון. הרזולוציה של nk-X0 גם ממשיך לאחר הסדר מבניים מסכם על ידי עזיבתו של דופלקס נושאת שני fluorophores (איור 5d) דומה X0.
קינטיקה של GEN1 דימרזציה על GEN1 מוניומר כבול ג'ונסון
מעידה בזמן smfret צעדים τלפני המחשוף אשר כולל בעיקר את הזמן הנדרש עבור היווצרות דיימר והרזולוציה של ג'ונסון אחרי עיוות ידי GEN1 monomer. החלת טכניקה זו, ראיות ישירות מסופק כדי לתמוך בטענה כי היווצרות דיימר נדרש עבור הרזולוציה של שני X0 ו-nk-X0, מאז התפלגות של τלפני המחשוף GEN1 תלוי ריכוז.
הקצב הנראה לעין של הרזולוציה ג'ונסון (kapp) מוגדר כהופכי של הממוצע של τלפני המחשוף על הריכוז GEN1 בהתאמה. המונח "לכאורה" משמש לתיאור שיעור הרזולוציה של ג'ונסון, שכן האפשרות שGEN1 נותרת כבולה אל המוצר לאחר שלא ניתן לכלול את הרזולוציה של ג'ונסון.
פונקציות צפיפות ההסתברות (PDF) של הפצות הτלפני המחשוף של X0 (איור 6a) משקפים את הזמן עבור היווצרות דיימר, אשר ארוך יותר בריכוזים נמוכים GEN1, ולאחר מכן קצר יותר בריכוזים גבוהים GEN1. שיעורי ההתאגדות והדיסוציאציה של הדימר, k-dimer ו- koff-דימר, נקבעים בהתאמה מדגם דו-מעריכי בן30. כמו כן, מסמכי pdf של nk-X0 (איור 6b) הצגת התפלגות דומה ל-X0 המציינת את מערך הדרישה של דיימר.
העלילה של kAPP לעומת GEN1 הריכוז היה מותאם לפונקציה היפרבולית. הקבועים לכאורה לזרז קצב(kMax-App) שלX 0 ו-nk-X0 הם 0.107 ± 0.011 s-1 ו-0.231 ± 0.036 s-1, בהתאמה (איור 6c). המגרשים של kapp עבור X0 ו-nk-X0 צמתים מצטלבים ב GEN1 הריכוז ~ 5.6 ננומטר בגלל kמקסימום-app מהר יותר kב-dimer של הפצע לעומת צומת שלם.
לסיכום, kמהיר יחסיתעל-דיימר ולהאט k-דיימר להוביל את ההתקדמות של תגובת קדימה לקראת החלטה של ג'ונסון פעם הדימר נוצר. הכריכה החזקה של GEN1 מונומר לצומת nk-X0 מהווה מנגנון אל-כשל כנגד כל מחשוף לא סביר השני בוטלה או מסייע לקלוט כל hjs לא מזוהה לחלוטין שנשאר מאחור על ידי מסלולים ברזולוציה העיקרית בתא.
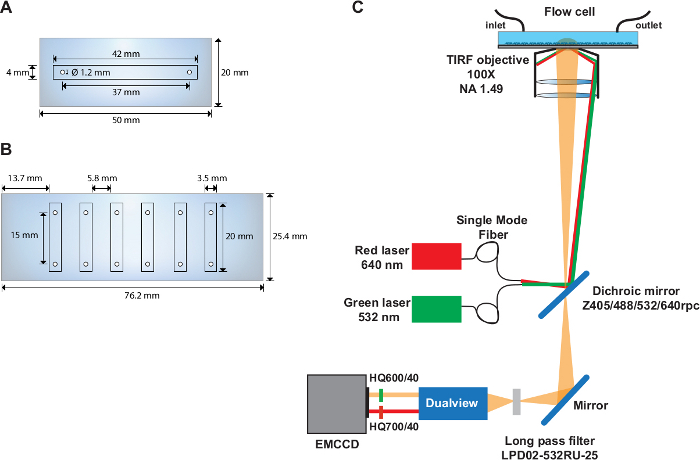
איור 1: תאי זרימה בודדים ומרובי ערוצים ופריסה של הגדרת האופטי.
(א) סכמטי תא הזרימה של הערוץ היחיד. (ב) סכמטי של תא הזרימה בן ששת הערוצים. (ג) הפריסה של הגדרת אופטי המתאר את מקורות עירור, מטרת tirf, דיקרואיק mirror מותקן בתוך קוביית הפילטר, ומסנני פליטה המשמשים את המכשיר מפצל התמונה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: הטיה לשעבר ואיזופיקציה של ה "ג'ונסון" שנצפתה על ידי הפרט.
(א) איזופיקציה של התווית הסמוכה, הקונגבנות מוערמות, שנקראו על שם שני קווצות רציפות. הגדילים ממוספרים, בעוד הזרועות מסומנים באותיות. אתרי החתך מוצגים על ידי חיצים. מעמדם של התורם (ירוק) והקבלה (אדום) והשינוי ב-"באמצעות איזופיקציה" מצוינים. (ב) הלוח הימני: מעקב אחר הזמן (שחור) ו מעקב מאוד אידאלית (אדום) של X0 ב 50 מ ג2 +. פאנל שמאלי: היסטוגרמה סריג של X0 ב 50 מ ג2 +. עוצמות האור של התורם (ירוק) וקבלה (אדום) מוצגים להלן. (ג) להתעכב זמן היסטגרמות של התווית הסמוכה X0 Iso (1, 3) ו-iso (2, 4) היו מותאם לפונקציות יחיד מעריכי כדי לקבוע את שיעורי איזופיקציה. הודאות מציינות את מרווח הביטחון. של 95% מהתאים דמות זו השתנתה מהספרות הקודמת שפורסמה בשנת30.
איור 3: עיוות פעיל של הג על ידי GEN1.
(א) השינוי המבני של adjacentlabel ג'ונסון בהתבסס על המודל המוצע22. (ב) אלכס בהיסטוגרמה היסטוגרמה של התווית הסמוכה X0 יש שיא גדול לדאוג גבוה (E = ~ 0.6) המתאים iso (1, 3) ושיא לדאוג התחתון (e = ~ 0.4) עבור iso (2, 4). ההיסטוגרמה כולה מתאימה לשתי פונקציות גאוסיאנית: אחת המתאימה ל-Iso גדול בחינם (1, 3), והשנייה המתאימה לאוכלוסיה המאוגדת פחות התרומה הראשונית של Iso (2, 4) לאוכלוסיה הכוללת. (ג) קבוע מונומר דיסוציאציה לכאורה (Kd-מונומר-app) נקבע מפני התאמה היפרבולי של האחוזים של אוכלוסיות מאוגדות GEN1 כפונקציה של ריכוז GEN1. (ד) לדאוג היסטגרמות של התווית הסמוכה Nk-X0 על ריכוזי GEN1 שונים. האזור שמתחת לסריג הנמוך (E = ~ 0.25) מקביל לאחוז האוכלוסיה המאוגדת. (ה) ה- Kd-monomer-app של nk-X0 נקבע מפני ההתאמה ההיפרבולי של אוכלוסיה GEN1. קווי השגיאה מייצגים את הסטיות הסטנדרטיות משני ניסיונות או יותר. דמות זו השתנתה מהספרות הקודמת שפורסמה בשנת30. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4: האיגוד החורג של GEN1 ל ג'ונסון.
(א) החלפת משמרת חשמלית אלקטרופלטית (emsa) של GEN1 בשעה 50 pM X0. החלונית העליונה: הספרות הרומיות מציינות את מספר ה-GEN1 ונומרים במכלול. החלונית התחתונה: איגוד של GEN1 מונומר ל-X0. קבועי הדיסוציאציה לכאורה הושגו מתוך התאמה מתאימה של המינים המתאימים ומייצגים את הממוצע של שני ניסויים. (ב) emsa of GEN1 ב 50 pM nk-X0 מדגים את כריכת המונומר הבולטת כפי שמצוין על-ידי ה- Kd-מונומר-app-emsa. (ג) לדאוג זמן מעקב של מאוגד אך בלתי מוגבל תווית הסמוכה X0 ב Mg2 +. עירור התורמים ל-~ 1.3 min בוצעה ולאחריה עירור הסדר הישיר (אזור ורוד מוצל). (ד) לדאוג זמן מעקב של מאוגד אך בלתי מוגבל התווית הסמוכה Nk-X0 ב Mg2 +. דמות זו השתנתה מהספרות הקודמת שפורסמה בשנת30. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 5: שיטת הפענוח של ה-SMFRET של ג'ונסון.
(א) סכימטי של התווית הסמוכה X0 Iso (1, 3) לאחר עיוות ידי GEN1. המצע מחובר למשטח הפונקציונל באמצעות הצמדה לביוטין/avidin. הדיסוציאציה של GEN1 אחרי שני החתכים מביא לאבדן התורם והקבלה הנכנסים לפיתרון. (ב) סכימטי של הרזולוציה של התווית הסמוכה Nk-X0 על ידי השארת סטרנד 1. (ג) מעקב הזמן (שחור) ב 2 מ ג2 + של המחשוף של Iso (1, 3). התחלתה של GEN1 מחייב צורות יציבות נמוכה יציבה עד האות סריג הוא איבד בפתאומיות בשל המחשוף. בהתאמה, העליה של התורם וירידת הירידה לקבלה של עוצמות הקרינה על הכריכה GEN1 מלווה בהעלמות הסימולטני של הקרינה הפלואורסצנטית משתי הצבעים על המחשוף. (ד) באופן דומה, מעקב הזמן של Nk-X0 מראה מצב יציב נמוך מדינה על הכריכה GEN1 אשר מסתיים על ידי אובדן פתאומי של האות סריג. דמות זו השתנתה מהספרות הקודמת שפורסמה בשנת30. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 6: קינטיקה של GEN1 דימרזציה על GEN1 מונמר מאוגד.
(א) התוויה של פונקציית צפיפות ההסתברות (PDF) של התפלגות הτלפני המחשוף של X0 ממחישה את התלות בריכוז GEN1. תקופות לשכון של המצב τ נמוך (לפני המחשוף) בריכוז GEN1 בהתאמה הושגו משני ניסויים או יותר משמש כדי להשיג שיעורי ממוצע (kapp). שיעורי kהאפליקציה המפורטים נקבעים מן ההופכי של τ ממוצעלפני המחשוף על הריכוז GEN1 בהתאמה. שיעורי ההתאגדות (kon-דימר) והדיסוציאציה (k-דיימר) עבור היווצרות דיימר מחושבים מדגם bi-מעריכי38. השגיאות מייצגותיישוםSEM של k. (ב) מגרש PDF של הפצות τלפני המחשוף של Nk-X0 ואת שיעורי ה- kapp המתאימים. (ג) העלילה של kAPP לעומת GEN1 ריכוז מותאם פונקציה היפרבולי כדי לקבוע את קצב קטליטי לכאורה (kMax-app). העלילה של kapp עבור X0 ו-nk-X0 ממחיש אתהאפליקציה הראשוניתמהיר יותר של X0 אשר הוא עלה לאחר מכן על ידי nk-X0 מעל [GEN1] ~ 5.6 nM. דמות זו השתנתה מהספרות הקודמת שפורסמה בשנת30. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| אגר | רכב | ||
| מאגר כריכה | 40 mM טריס-HCl pH 7.5, 40 mM הנאל, 2 מ ' CaCl2, 1 מ"מ dtt, 0.1% bsa ו 5% (v/v) גליצרול | ||
| מאגר A | 20 mM טריס-HCl pH 8.0, 1 מ"מ DTT ו 300 מ"מ היאl | ||
| מאגר B | 20 mM טריס-HCl pH 8.0, 1 מ"מ DTT ו 100 מ"מ היאl | ||
| מאגר C | 20 mM טריס-HCl pH 8.0 ו 1 מ"מ DTT | ||
| מאגר פצילות | 40 mM טריס-HCl pH 7.5, 40 mM הנאקל, 2 מ"מ MgCl2, 1 מ"מ dtt, 0.1% bsa ו 5% (v/v) גליצרול | ||
| מאגר כריכה של EMSA | 40 mM טריס-HCl pH 7.5, 40 mM הנאקל, 1 מ"מ DTT, 2 מ"מ CaCl2, 0.1 mg/ML bsa, 5% (v/v) גליצרול ו 5 ng/Μl פולי dC | ||
| מאגר הדמיה (איגוד) | 40 μL (±) -6-הידרוxy-2, 5, 7, 8-טטרמתיל כרומאן-2-חומצה קרבוקסילית (4 μM), 60 μL PCA (6 ננומטר), 60 μL PCA (60 nM) ו-840 μL של מאגר הכריכה | ||
| מאגר הדמיה (מחשוף) | 40 μL (±) -6-הידרוxy-2, 5, 7, 8-טטרמתיל כרומאן-2-חומצה קרבוקסילית (4 μM), 60 μL PCA (6 ננומטר), 60 μL PCA (60 nM) ו-840 μL של מאגר המחשוף | ||
| מאגר לוליזיס | 20 mM טריס-HCl pH 8.0, 10 מ"מ β-mercaptoethanol, 300 מ"מ הנאל ו 2 מ"מ PMSF | ||
| מאגר אחסון של PCD | 100 mM טריס-HCl pH 7.5, 1 מ"מ EDTA, 50 mM KCl ו 50% גליצרול | ||
| מאגר אחסון | 20 mM טריס-HCl pH 8.0, 1 מ"מ DTT, 0.1 mM EDTA, 100 מ"מ הנאל ו 10% גליצרול | ||
| מאגר TBE | 89 mM טריס-HCl, 89 מ"מ חומצה Boric ו 2 מ"מ EDTA | ||
| מאגר TE100 | 10 מילימטר טריס. HCl pH 8.0 ו 100 מ"מ הנאל | ||
| מאגר טריס-EDTA | 50 mM טריס-HCl pH 8.0 ו 1 מ"מ EDTA pH 8.0 | ||
טבלה 1: רשימת המאגרים וקומפוזיציות שלהם בשימוש במחקר זה.
| אוליגו | רצף | ||
| X0-st1 | מרכז ה, הובלה באמצעות כמוסות לאטיקצ'וב במרכז הקהילתי | ||
| X0-st2 | מiCy3/משחק הגנה מפני בעלי ה, מדריך כמוסות-מדיה והפקות | ||
| X0-st3 | מiAF647 הגנה/בדיקת מלאי-הגנה מפני בעלי ה, מדריך כיצד לשחק | ||
| X0-st4 | 5 ' התקני בדיקת מלאי ' התקני בדיקת מלאי בעלי ה, הגהקיקאור | ||
| X0-(ת') | X0-St1, x0-st2, x0-st3 & x0-st4 | ||
| X0In_st2 | מתקני המלון הינם בעלי מטבח ומתקני הגנה מפני ההתרקהסינית | ||
| X0In_st4 | מוצר/מiCy3/TGCGATCTCCTA/כמוסות מ, מדיה ומ, הובלה. | ||
| Nk-X0 | X0-St1, x0-st2, x0-nk3a, x0-nk3b & x0-st4 | ||
| X0-nk3a | מiAF647/הגנה מפני כוהל | ||
| X0-nk3b | מוזיאון האחים ברונטה | ||
שולחן 2: SMFRET ו EMSA מצעים ג'ונסון. רשימת ה-פורוזימטר המשמשים להכנת הה, המתווית הפלואורוסקופים עבור smfret ו-emsa. . האוליגוס התקבלו באופן מסחרי האוליגוס המסומן בתווית היו מטוהרים וכמובן, כאשר הדבר אפשרי, oligos של ≥ 60 bp היו מטוהרים הדף.
Discussion
במחקר זה, טכניקות smFRET שונים יושמו כדי לקבוע את הקינטיקה של הרזולוציה ג'ונסון על ידי GEN130. דומה הגישות smfret שימשו כדי לעקוב אחר לקפל דנ א התאמות דרישה והמחשוף על ידי שכפול ה-dna תיקון endonuclease 142,43,44. כאן, נדונים צעדים קריטיים בפרוטוקול זה. תגובת הסילניזציה צריכה להיות חופשית. מכל סימן של לחות הפתרון הפטאני צריך להיות מיושם במהירות על זכוכית silanized פעם יתד מומס כדי למנוע הידרוליזה. בתא הזרימה רב-הערוצים, יש להסיר את כל האוויר הנלכד בסדין הדביק כדי למנוע דליפה בין ערוצים שכנים. הפתרון PCA צריך להיות טרי מוכן מאז הוא מחמצן לאורך זמן. תוספת של 10 N NaOH צריך להיות dropwise, עם vortexing בין. הרקע הפלואורסצנטית ב coverslip צריך להיות מינימלי לפני הזרמת את התווית fluorescently מסומן. יש לבצע את ההדמיה בתא הזרימה בכיוון אחד כדי למנוע הדמיה של אזורים מולבן. בניסויים אלכס, את הכוח של הלייזר האדום צריך להיות מופחת כדי למנוע הלבנת מהירה של המאשר. בניסויים בזמן הקפיצה, זמן המחזור צריך להיות קצר יותר מהאירוע המהיר ביותר.
smFRET היא טכניקה רגיש שיכול לספק תובנות בזמן אמת יקר בתגובות ביוקולריות. עם זאת, לשיטה זו יש מספר אתגרים טכניים, ביניהם השגת שינוי מדיד ב-"סריג" במהלך התגובה הביוכימית. זה הכרחי כדי לקבל תכונות מופרדים היטב היסטגרמות ומדינות להבדיל בזמן עקבות. במקרים רבים, smFRET דורש עיצוב קפדני של מצעים, הבחירה של זוגות fluorophore ומיקומם, הגברה של שינויי שינויים במצע ה-DNA בגלל שינויים מבניים קטנים במצע45. גישה נוספת לביצוע השיטה היא להשתמש בחלבונים46. חלון התצפית בסריג מוגבל על ידי יציבות הקבלה כגון Cy5 או אלקסה Fluor 647 אשר נוטה להלבין במהירות רבה יותר מאשר התורם (Cy3 במקרה זה). לכן, מחייב חיפוש מתמשך של fluorophores יציבה כדי להאריך את משך הניסוי והמאמצים לפתח מערכות ניקוי חמצן כדי להאריך את האות הזריחה ולמקסם את היחס אות לרעש47,48 .
בין הטיפים לפתרון בעיות ב-smFRET הוא איזון מספר פרמטרים המעורבים הדמיה כגון כוח הלייזר, זמן חשיפה, זמן מחזור, ומספר מחזורים כדי למקסם את פליטת הזריחה, להאריך את משך הניסוי, ולהשיג רווחי דגימה מתאימים עבור דינמיקת האנזים. זמני התבוננות ארוכים יותר ואפקטים מינימליים של הלבנה הם חיוניים להשגת נאמנות גבוהה לשכון הפצות הזמן המייצגים את דינמיקת האנזים. אלכס מייצרת היסטגרמות טובות יותר מאז שיטה זו נתונה לתרומות נמוכות יותר מחלקיקים פוטומוקיים בהשוואה ללפרט בצבע אחד. עם זאת, הרזולוציה הטמפורלית ב-ALEX נמוכה יותר מאשר בתוך מפרט הצבע היחיד.
בסופו של דבר, הדגש של smFRET על גילוי קונפורתיות/שינויים מבניים במולקולות בודדות בגשרים בזמן אמת את הפער בין טכניקות מבניות ברזולוציה גבוהה (כלומר, קריסטלוגרפיה באמצעות קרני רנטגן, תהודה מגנטית גרעינית, מיקרוסקופ אלקטרוני), המספקת פרטים מבניים של רזולוציה אטומית תחת תנאים סטטיים ושיטות צובר המפיקות את ממוצע ההרכב של מאפיין מדיד. בהיבטים רבים, smFRET הוכיחה להיות טכניקה רבת עוצמה עבור לימוד מערכות ביולוגיות בזמן אמת.
Disclosures
המחברים לא מצהירים על אינטרסים פיננסיים מתחרים.
Acknowledgements
עבודה זו נתמכת על ידי אוניברסיטת עבדאללה המלך של מדע וטכנולוגיה באמצעות מימון ליבה ופרס מחקר תחרותי (CRG3) ל-S. M. H.
Materials
| Name | Company | Catalog Number | Comments |
| (±)-6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid (Trolox) | Sigma-Aldrich | 238813 | |
| 0.1 M sodium bicarbonate buffer | Fisher | 144-55-8 | |
| 10 % Novex Tris-Borate-EDTA gel | Thermo Fisher Scientific | EC6275BOX | |
| 100 X TIRF objective | Olympus | NAPO 1.49 | |
| 3,4-dihroxybenzoic acid (PCA) | Sigma-Aldrich | P5630 | |
| 3-aminopropyltriethoxysilane (APTES) | Sigma-Aldrich | 741442 | |
| 6% Novex Tris-Borate-EDTA gel | Thermo Fisher Scientific | EC6265BOX | |
| Adhesive sheet | Grace bio-labs | SA-S-1L | |
| Benchtop refrigerated centrifuge | Eppendorf | Z605212 | |
| Biotin-PEG | Laysan Bio | Biotin-PEG-SVA 5000 | |
| Bovine Serum Albumin (BSA) | New England Biolabs | B9001S | |
| Calcium Chloride Dihydrate | Sigma-Aldrich | 31307 | |
| cation exchange column | GE healthcare | MonoS (4.6/100) | |
| Cell distruptor | Constant Cell Disruption System | TS5/40/CE/GA | |
| Coomassie Brilliant Blue | MP Biomedicals | 808274 | |
| Cy3 emission filter | Chroma | HQ600/40M-25 | |
| Cy5/Alexa Fluor 647 emission filter | Chroma | HQ700/40M-25 | |
| Dichroic for DV2 filter cube | Photometrics | 630dcxr-18x26 | |
| Dithiothreitol (DTT) | Thermo Scientific | R0861 | |
| Drill | Dremel | 200-1/21 | |
| Electronic cutter | Copam | CP-2500 | |
| EMCCD camera | Hamamatsu | C9100-13 | |
| Epoxy glue | Devcon | 14250 | |
| FPLC Aktapurifier UPC 10 | GE Healthcare | 28406268 | |
| GelQuant.NET software | biochemlabsolutions.com | Version 1.8.2 | |
| GEN1 entry vector | Harvard plasmid repository | HSCD00399935 | |
| Glycerol | Sigma Life Science | G5516 | |
| green laser (emission 532 nm) | Coherent | Compass 315M-100 | |
| Heparin column | GE healthcare | HiTrap Heparin column | |
| HEPES | BDH | BDH4162 | |
| Image splitter | Photometrics | Dualview (DV2) | |
| Imidazole | Sigma-Aldrich | I2399 | |
| Inverted microscope | Olympus | IX81 | |
| Isopropyl-ß-D-thiogalactoside (IPTG) | Goldbio. | 12481C100 | |
| Laser scanner | GE healthcare | Typhoon Trio | |
| LB Broth | Fisher Scientific | BP1426-500 | |
| Long pass 532nm filter | Semrock | LPD02-532RU-25 | |
| Magnesium Chloride | Sigma Life Science | M8266 | |
| mPEG | Laysan Bio | mPEG-SVA 5000 | |
| Neutravidin | Pierce | 31000 | |
| Ni-NTA column | GE healthcare | HisTrap FF | |
| NuPAGE 10% Bis-Tris gels | Novex Life technologies | NP0301BOX | |
| NuPAGE 10% Bis-Tris Protein Gels | Thermo Fisher Scientific | NP0302PK2 | |
| Origin software | OriginLab Corporation | Version 8.5 | |
| Phenylmethylsulfonyl fluoride (PMSF) | Alexis Biochemicals | 270-184-G025 | |
| Phosphate-buffered saline | GIBCO | 14190 | |
| Polyethylene Tubing (I.D. 0.76 mm O.D. 1.22mm) | Fisher (Becton Dickinson) | 427416 | |
| Protocatechuate 3,4-dioxygenase (3,4-PCD) | Sigma-Aldrich | P8279-25UN | |
| Quad-band dichroic | Chroma Inc | Z405/488/532/640rpc | |
| red laser (emission 640 nm) | Coherent | Cube 640 100C | |
| Sodium Chloride | Fisher Chemical | S271 | |
| Sorvall RC-6 plus centrifuge | Thermo Fisher Scientific | 46910 | |
| Spectrophotometer | Thermo Fisher Scientific | Nanodrop 2000 | |
| Syringe pump | Harvard Apparatus | 70-3007 | |
| Teflon tweezers | Rubis | K35A | |
| Tris Base | Promega | H5135 | |
| Ultracentrifuge | Beckman Coulter | Optima L-90K | |
| Ultrafiltration membrane | Millipore | UFC90300 |
References
- Moerner, W. E., Fromm, D. P. Methods of single-molecule fluorescence spectroscopy and microscopy. Review of Scientific Instruments. 74 (8), 3597-3619 (2003).
- Ha, T. Single-molecule fluorescence resonance energy transfer. Methods. 25 (1), 78-86 (2001).
- Weiss, S. Fluorescence spectroscopy of single biomolecules. Science. 283 (5408), 1676-1683 (1999).
- Stryer, L. Fluorescence energy transfer as a spectroscopic ruler. Annual Review of Biochemistry. 47, 819-846 (1978).
- Roy, R., Hohng, S., Ha, T. A practical guide to single-molecule FRET. Nature Methods. 5 (6), 507-516 (2008).
- Walter, N. G., Huang, C. Y., Manzo, A. J., Sobhy, M. A. Do-it-yourself guide: how to use the modern single-molecule toolkit. Nature Methods. 5 (6), 475-489 (2008).
- Conchello, J. A., Lichtman, J. W. Optical sectioning microscopy. Nature Methods. 2 (12), 920-931 (2005).
- Axelrod, D. Total internal reflection fluorescence microscopy in cell biology. Methods in Enzymology. 361, 1-33 (2003).
- Kim, H. D., et al. Mg2+-dependent conformational change of RNA studied by fluorescence correlation and FRET on immobilized single molecules. Proceedings of the National Academy of Sciences of the United States of America. 99 (7), 4284-4289 (2002).
- Lee, T. H., et al. Measuring the folding transition time of single RNA molecules. Biophysical Journal. 92 (9), 3275-3283 (2007).
- Holliday, R. Mechanism for Gene Conversion in Fungi. Genetical Research. 5 (2), 282-304 (1964).
- West, S. C., et al. The Formation and Resolution of Holliday Junctions during the Recombinational Repair of DNA Damages. Journal of Cellular Biochemistry. , 269-269 (1995).
- Cox, M. M., et al. The importance of repairing stalled replication forks. Nature. 404 (6773), 37-41 (2000).
- West, S. C. Molecular views of recombination proteins and their control. Nature Reviews: Molecular Cell Biology. 4 (6), 435-445 (2003).
- Duckett, D. R., et al. The structure of the Holliday junction, and its resolution. Cell. 55 (1), 79-89 (1988).
- Clegg, R. M., et al. Fluorescence resonance energy transfer analysis of the structure of the four-way DNA junction. Biochemistry. 31 (20), 4846-4856 (1992).
- McKinney, S. A., Declais, A. C., Lilley, D. M., Ha, T. Structural dynamics of individual Holliday junctions. Nature Structural Biology. 10 (2), 93-97 (2003).
- Joo, C., McKinney, S. A., Lilley, D. M., Ha, T. Exploring rare conformational species and ionic effects in DNA Holliday junctions using single-molecule spectroscopy. Journal of Molecular Biology. 341 (3), 739-751 (2004).
- Hyeon, C., Lee, J., Yoon, J., Hohng, S., Thirumalai, D. Hidden complexity in the isomerization dynamics of Holliday junctions. Nature Chemistry. 4 (11), 907-914 (2012).
- Ip, S. C., et al. Identification of Holliday junction resolvases from humans and yeast. Nature. 456 (7220), 357-361 (2008).
- Rass, U., et al. Mechanism of Holliday junction resolution by the human GEN1 protein. Genes & Development. 24 (14), 1559-1569 (2010).
- Liu, Y., et al. Crystal Structure of a Eukaryotic GEN1 Resolving Enzyme Bound to DNA. Cell Reports. 13 (11), 2565-2575 (2015).
- Chan, Y. W., West, S. GEN1 promotes Holliday junction resolution by a coordinated nick and counter-nick mechanism. Nucleic Acids Research. 43 (22), 10882-10892 (2015).
- van Gool, A. J., Hajibagheri, N. M., Stasiak, A., West, S. C. Assembly of the Escherichia coli RuvABC resolvasome directs the orientation of holliday junction resolution. Genes & Development. 13 (14), 1861-1870 (1999).
- Lee, S. H., et al. Human Holliday junction resolvase GEN1 uses a chromodomain for efficient DNA recognition and cleavage. eLife. 4, (2015).
- Chan, Y. W., West, S. C. Spatial control of the GEN1 Holliday junction resolvase ensures genome stability. Nature Communications. 5, 4844(2014).
- Liu, Y., Freeman, A. D., Declais, A. C., Lilley, D. M. J. A monovalent ion in the DNA binding interface of the eukaryotic junction-resolving enzyme GEN1. Nucleic Acids Research. 46 (20), 11089-11098 (2018).
- Zhou, R., et al. Junction resolving enzymes use multivalency to keep the Holliday junction dynamic. Nature Chemical Biology. 15 (3), 269-275 (2019).
- Bellendir, S. P., et al. Substrate preference of Gen endonucleases highlights the importance of branched structures as DNA damage repair intermediates. Nucleic Acids Research. 45 (9), 5333-5348 (2017).
- Sobhy, M. A., et al. Resolution of the Holliday junction recombination intermediate by human GEN1 at the single-molecule level. Nucleic Acids Research. 47 (4), 1935-1949 (2019).
- Sobhy, M. A., et al. Versatile single-molecule multi-color excitation and detection fluorescence set-up for studying biomolecular dynamics. Review of Scientific Instruments. 82 (11), 113702(2011).
- Kapanidis, A. N., et al. Fluorescence-aided molecule sorting: analysis of structure and interactions by alternating-laser excitation of single molecules. Proceedings of the National Academy of Sciences of the United States of America. 101 (24), 8936-8941 (2004).
- Lee, N. K., et al. Accurate FRET measurements within single diffusing biomolecules using alternating-laser excitation. Biophysical Journal. 88 (4), 2939-2953 (2005).
- Rashid, F., et al. Initial state of DNA-Dye complex sets the stage for protein induced fluorescence modulation. Nature Communications. 10 (1), 2104(2019).
- Sambrook, J., Russell, D. W. Standard ethanol precipitation of DNA in microcentrifuge tubes. Cold Spring Harbor Protocols. 2006 (1), (2006).
- Holden, S. J., et al. Defining the limits of single-molecule FRET resolution in TIRF microscopy. Biophysical Journal. 99 (9), 3102-3111 (2010).
- Bronson, J. E., Fei, J., Hofman, J. M., Gonzalez, R. L. Jr, Wiggins, C. H. Learning rates and states from biophysical time series: a Bayesian approach to model selection and single-molecule FRET data. Biophysical Journal. 97 (12), 3196-3205 (2009).
- Kou, S. C., Cherayil, B. J., Min, W., English, B. P., Xie, X. S. Single-molecule Michaelis-Menten equations. Journal of Physical Chemistry B. 109 (41), 19068-19081 (2005).
- Clegg, R. M., Murchie, A. I., Lilley, D. M. The solution structure of the four-way DNA junction at low-salt conditions: a fluorescence resonance energy transfer analysis. Biophysical Journal. 66 (1), 99-109 (1994).
- Pohler, J. R., Duckett, D. R., Lilley, D. M. Structure of four-way DNA junctions containing a nick in one strand. Journal of Molecular Biology. 238 (1), 62-74 (1994).
- Fogg, J. M., Lilley, D. M. Ensuring productive resolution by the junction-resolving enzyme RuvC: large enhancement of the second-strand cleavage rate. Biochemistry. 39 (51), 16125-16134 (2000).
- Sobhy, M. A., Joudeh, L. I., Huang, X., Takahashi, M., Hamdan, S. M. Sequential and multistep substrate interrogation provides the scaffold for specificity in human flap endonuclease 1. Cell Reports. 3 (6), 1785-1794 (2013).
- Rashid, F., et al. Single-molecule FRET unveils induced-fit mechanism for substrate selectivity in flap endonuclease 1. eLife. 6, e21884(2017).
- Zaher, M. S., et al. Missed cleavage opportunities by FEN1 lead to Okazaki fragment maturation via the long-flap pathway. Nucleic Acids Research. 46 (6), 2956-2974 (2018).
- Didenko, V. V. DNA probes using fluorescence resonance energy transfer (FRET): designs and applications. BioTechniques. 31 (5), 1106-1116 (2001).
- Toseland, C. P. Fluorescent labeling and modification of proteins. Journal of Chemical Biology. 6 (3), 85-95 (2013).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An oxygen scavenging system for improvement of dye stability in single-molecule fluorescence experiments. Biophysical Journal. 94 (5), 1826-1835 (2008).
- Swoboda, M., et al. Enzymatic oxygen scavenging for photostability without pH drop in single-molecule experiments. ACS Nano. 6 (7), 6364-6369 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved