Method Article
في المختبر تقييم وظيفة القلب باستخدام خلايا القلب skinned
* These authors contributed equally
In This Article
Summary
يهدف هذا البروتوكول إلى وصف تقنية استخراج وتقييم وظيفة القلب خطوة بخطوة باستخدام خلايا القلب ذات البشرة. تسمح هذه المنهجية بقياس وظيفة myofilament والتحويل الحاد لها باستخدام خزعات صغيرة مجمدة يمكن جمعها من مواقع قلبية مختلفة ، من الفئران إلى الرجال.
Abstract
في هذه المقالة، نحن وصف الخطوات المطلوبة لعزل واحد permeabilized ("skinned") cardiomyocyte وإرفاقه إلى جهاز قياس القوة ومحرك لإجراء دراسات وظيفية. وسوف تسمح هذه الدراسات قياس تصلب القلب و القلب (القوة السلبية) وتفعيله مع الكالسيوم مختلفة (كاليفورنيا2+) التي تحتوي على حلول لتحديد، من بين أمور أخرى: الحد الأقصى لتطوير القوة، myofilament كاليفورنيا2 +حساسية (pCa50)،التعاونية (nHill) ومعدل إعادة تطوير القوة (KTR). هذه الطريقة تمكن أيضا من تحديد آثار المخدرات التي تعمل مباشرة على myofilaments والتعبير عن البروتينات المؤتلفة الخارجية على كل من الخصائص النشطة والسلبية للقلب العضلي. سريريا، دراسات cardiomyocyte البشرة تسليط الضوء على الفيزيولوجيا المرضية من العديد من أمراض عضلة القلب والسماح في المختبر التقييم لتأثير التدخلات العلاجية التي تستهدف myofilaments. وإجمالاً، تمكّن هذه التقنية من توضيح الفيزيولوجيا القلبية من خلال التحقيق في الارتباطات بين المعلمات في المختبر وفي الجسم الحي في النماذج الحيوانية والأنسجة البشرية التي يتم الحصول عليها أثناء جراحة القلب المفتوح أو الزراعة.
Introduction
تقليديا، وقد حاول تقييم الخصائص الميكانيكية عضلة القلب في الغالب في المستحضرات متعددة الخلايا، مثل عضلات الحليمات وtrabeculae1،2. تشمل شرائط عضلات القلب متعددة الخلايا مجموعة غير متجانسة من الخلايا، بما في ذلك خلايا القلب العضلية المتقلصة مع نمط غير معروف من التوجيه وتوليد القوة والنشاط الكهربائي وتوزيعات الإجهاد/السلالات بالإضافة إلى مصفوفة الأنسجة الضامة المحيطة3،4. ومن شأن إعداد دون الكولاجين وتحتوي على cardiomyocyte واحد يسمح قياس طول الساركومير والخصائص العقدية عبر الجسر بطريقة دقيقة جدا وتسيطرعليها 5،6. ولذلك، على مدى العقود الأربعة الماضية، وضعت العديد من المنهجيات التي تسمح التحقيق الميكانيكية، وانكماشية، وخصائص الاسترخاء من القلب واحد6،7. وظيفة العقد من هذه الخلايا تعتمد بقوة على طول الساركومير وعبر الجسر الدراجاتالحركية 3. وبالتالي، فمن المستحسن للتحقيق وظيفة العضلات مباشرة في خلايا القلب المعزولة واحدة، معتبرا أنه يسمح لتقييم طول السارومير والأداء، فضلا عن وظيفة عبر الجسر وخصائص انقبائية. ومع ذلك ، فإن عزل وربط cardiomyocytes وظيفية مع دقة ساركومير بصرية معقولة في حين تسجيل قياس القوة على مستوى μN لا يزال تحديا ومتطورا3،6. التحديات الأخرى هي الخدمات اللوجستية التي تحتاج إلى تثبيت لعزل cardiomyocytes من الخزعات التي تم جمعها حديثا. فعلى سبيل المثال، قد يعرض عدم القدرة على التنبؤ بجمع الخزعات البشرية للخطر جدوى التجارب.
وعلاوة على ذلك، فإن الشواغل الأخلاقية المتعلقة باستبدال التجارب الحيوانية والحد منها وتنقيحها لأغراض الإجراءات العلمية (مبادئ 3Rs) قد شجعت على إجراء تغييرات في الدراسة على مستوى الخلايا والأنسجة، ويفضل أن تكون في الخزعات البشرية، أو في عينات الحيوانات الصغيرة. في الواقع الصقل التدريجي لمنهجيات لتقييم وظيفة القلب في المختبر على مستوى أصغر من التعقيد يسمح التكامل السليم للنتائج إلى الجسم كله وترجمتها إلى السيناريو السريري7. بالإجمال, استخدام العينات المخزنة في -80 درجة مئوية لاستخراج cardiomyocytes قد يكون بديلا جذابا.
يتم قطع الأنسجة عضلة القلب إلى قطع صغيرة ومتجانسة مع هاون وحشرات. نتيجة هذا التجانس هو تعليق من خلايا مُجمّعة ومُعزلة ذات درجات متفاوتة من التلف الساركليمي، حيث يتعرض myoplasm لوسيلة الاستحمام ويتم غسل جميع المكونات الخلوية. يتم الحفاظ على هياكل مثل myofibrils التي هي أبعد من ساركلوما. وهكذا، يتم الاحتفاظ الساركومير تقصير والخصائص الوظيفية المرتبطة جهاز myofibrillar سليمة ويمكنتسجيلها 8،9.
يتكون نظام قياس قوة القلب من محرك كهرومغناطيسي، يستخدم لضبط طول القلب، و محول القوة، الذي يقيس انكماش القلبية متساوي القياس. يتم وضع القلب المثقب ، أو المسلخ ، في غرفة تجريبية تحتوي على حل مريح ([Ca2+] < 10 nM) ولصق السيليكون إلى إبرتين رقيقتين: واحدة تعلق على المحرك والأخرى على محول القوة. ويستخدم نظام بصري لتحديد morphology القلبية وsarcomere الطول. البروتوكول التجريبي غالبا ما يتكون من سلسلة من تسجيلات القوة على حلول العازلة التي تحتوي على مختلف التركيزات كاليفورنيا2 + ، وتحديد حركية عبر الجسر actin - myosin وقياس التوتر السلبي من cardiomyocytes شنت على أطوال ساركومير محددة مسبقا (الشكل 1). عزل القلب العضلي الوعائي المثقب من عينات عضلة القلب المجمدة في النيتروجين السائل (وتخزينها بعد ذلك في -80 درجة مئوية) هي تقنية تستخدم الميكانيكا الخلوية والكيمياء الحيوية البروتينية لقياس أقصى قدر كاليفورنيا2 +تنشيط (نشط) قوة لكل منطقة مقطعية(T نشطة، kN•m -2) ، كاليفورنيا2 +-مستقلة (السلبي) التوتر (Tالسلبي,kN∙m-2),myofilaments Ca2+-حساسية (pCa50),myofilaments التعاونية (NHill), معدل إعادة تطوير القوة (ktr) وكذلك تبعيات sarcomere من Tالنشط,Tالسلبي,pCa50,nHill و KTR.
الهدف من هذا البروتوكول هو توضيح وتلخيص إمكانات نظام قياس قوة القلب و القلبية أوسكوت كإجراء موثوق به لتقييم الخصائص الميكانيكية الوظيفية للقلبيات أحادية البشرة معزولة عن العينات المجمدة من أنواع مختلفة.
Protocol
تمتثل جميع التجارب على الحيوانات لدليل رعاية الحيوانات المختبرية واستخدامها (مطبوعة المعاهد القومية للصحة رقم 85-23، المنقحة لعام 2011) والقانون البرتغالي بشأن رعاية الحيوان (DL 129/92, DL 197/96؛ P 1131/97). وقد وافقت السلطات المحلية المختصة على هذا البروتوكول التجريبي (018833).
1. إعداد حل الأسهم (الجدول 1)
- إعداد 1000 مل من حل الاسترخاء لعزلة القلبية من خلال ISO (RELAX-ISO) باتباع التعليمات الواردة في الجدول 2. قم بحل الكاشف أعلاه في ≈500 مل وضبط درجة اله pH إلى 7.0 مع KOH. ضبط حجم النهائي إلى 1000 مل.
- توزيع ريلاكس-ايزو في أنابيب 50 مل. يُخزن عند -20 درجة مئوية.
- إعداد 250 مل من تفعيل الحل باتباع التعليمات الواردة في الجدول 3. قم بحل الكواشف أعلاه في ≈100 مل من المياه النقية جدا. ضبط درجة الحرارة إلى 7.1 مع 5 M كوه في 15 درجة مئوية.
ملاحظة: عادة، من الضروري إضافة كمية كبيرة من KOH للوصول إلى درجة الHH المطلوبة. وضع البالون الحجمي في مربع مع الجليد لتهدئة الحل إلى 15 درجة مئوية.- ضبط مستوى الصوت النهائي إلى 250 مل. تهيج هذا الحل باستمرار مع مُحرك مغناطيسي حتى لحظة خلطه مع حل الاسترخاء.
- إعداد 100 مل من حل الاسترخاء باتباع التعليمات الواردة في الجدول 4. قم بحل الكواشف أعلاه في ≈50 مل من المياه النقية جدا. ضبط درجة اله إلى 7.1 مع KOH 5 M عند 15 درجة مئوية.
ملاحظة: عادةً، من الضروري إضافة كمية كبيرة من KOH للوصول إلى درجة PH 7.1. ضع البالون الحجمي في صندوق مملوء بالثلج لتهدئة المحلول إلى 15 درجة مئوية. بلغت قوة الأيونية من الحلول المستخدمة خلال القياسات إلى 180 mM.- ضبط مستوى الصوت النهائي إلى 100 مل. تهيج هذا الحل باستمرار مع مُحرك مغناطيسي حتى لحظة خلطه مع محلول تنشيطي.
- مزيج تفعيل والاسترخاء حلول في النسب المعروضة في الجدول 5 للحصول على حلول PCa بين 5.0 و 6.0.
- دائماً الحفاظ على الاسترخاء وتفعيل الحلول التحريضية في حين خلط كليهما.
- Aliquot كل خليط إلى 2 مل microtubes. تخزين جميع microtubes في -20 درجة مئوية.
- تحضير دفعة مختلفة من حل pCa (4.5 إلى 6.0) لكل بروتوكول.
2. معايرة محول القوة
ملاحظة: معايرة محول القوة هو إجراء روتيني يجب أن يتم تنفيذ كل شهرين أو كلما كان يشتبه في أن يكون غير معايرة. محول القوة حساس للغاية و مكسور بسهولة. وينبغي أن تعالج بلطف في كل خطوة من استخدامه، بما في ذلك المعايرة، الإلتصاق من cardiomyocyte والتنظيف.
- فصل محول القوة من بقية الجهاز.
- مع مساعدة من المشبك، ووضع محول القوة أفقيا في مثل هذه الطريقة التي تشير الإبرة إلى أسفل في نفس الاتجاه أن cardiomyocyte سوف تتطور قوة. وهذا سيسهل شنقا سلسلة من الجماهير مع الأوزان المعروفة (الفرقة المرنة، خياطة أو دبوس).
ملاحظة: تحقق من خصائص محول القوة قبل الانتقال إلى هذه الخطوة للتحقق من عامل المقياس [ملغ /فولت] وتجنب الوزن الزائد على المحول. بالنسبة لنموذج محول القوة ، فإن عامل المقياس هو 50 (50 ملغ 1 فولت) ، ونستخدم 5 أوزان بين 12.5 و 250 ملغ. - بدوره محول القوة على والسماح لها الاحماء لمدة 30 دقيقة.
- ابدأ بتعليق الكتلة الخفيفة على محول القوة وتسجيل الجهد المقابل الذي تم قياسه في FORCE OUT.
- كرر هذا الإجراء لمدة تصل إلى خمسة أوزان.
- مؤامرة القوة المطبقة على محول القوة (تحميل) مقابل الجهد والتحقق من الخطية.
- إذا لم يكن هناك خطية، وضبط الصفر والحصول على مقاييس التقوية في لوحة الدوائر من محول. راجع تعليماتها المحددة للحصول على مزيد من المعلومات.
- بدوره قوة صفر حتى الجهد الناتج يقرأ 0.0 V.
- يد متوسطة الوزن على إبرة محول وضبط قوة كسب لقراءة الجهد المقابل (على سبيل المثال، 50 ملغ تتوافق مع 1 V). إزالة الوزن وإعادة ضبط مقياس القوة صفر إلى 0.0.
- كرر الخطوة 2.6.2 حتى الإخراج مع وبدون الوزن صحيحة.
- جبل محول القوة مرة أخرى إلى الجهاز.
3. وضع جهاز تجريبي
- ذوبان قارورة واحدة من كل من تفعيل، 4.5، 5.0، 5.2، 5.4، 5.6، 5.8، 6.0 والحلول الاسترخاء والحفاظ عليها على الجليد.
ملاحظة: ATP وPCr هي مركبات لتيل التي ينبغي الحفاظ عليها في درجات الحرارة الباردة. - إعداد المجهر وجهاز الاختبار والكمبيوتر المرتبط به للاستخدام (الشكل 1).
- ضبط درجة الحرارة بحيث يقرأ ميزان الحرارة في الغرفة 15 درجة مئوية. إجراء جميع التجارب في هذه الدرجة باستثناء كيناز وفوسباتيز حضانات (20 درجة مئوية).
- بدوره على القوة محول والمحرك.
4. استخراج و Permeabilization من cardiomyocytes البشرة
- إزالة الجليد 50 مل من حل RELAX-ISO.
- تشغيل جهاز الطرد المركزي وسرعة تبريده تصل إلى 4 درجة مئوية.
- ذوبان 3-5 ميكروغرام من عينة عضلة القلب في طبق بيتري التي تحتوي على 2.5 مل من حل RELAX-ISO.
- قطع الأنسجة في قطع صغيرة مع شفرة مشرط (الشكل 2). قطع العينة بطريقة دقيقة لتجنب تلف الخلايا غير الضرورية.
- نقل 2.5 مل من حل RELAX-ISO مع الأنسجة إلى زجاج بوتر Elvehjem باستخدام طرف ماصة قطع.
- ميكانيكيا تعطيل الأنسجة مع طاحونة في سرعة دوران 30-40 دورة في الدقيقة. اضغط على الأنسجة 3 مرات لمدة 2 s كل للحصول على تعليق خلية جيدة.
- إعداد 10٪ تريتون في حل RELAX-ISO (250 ميكرولتر من تريتون مع 2.25 مل من RELAX-ISO) في أنبوب 15 مل وإضافة هذا الحل إلى تعليق الخلية.
- مزيج بلطف عن طريق عكس الأنبوب 3 مرات.
- احتضان في درجة حرارة الغرفة لمدة 1 دقيقة و 4 دقائق على الجليد.
- غسل تريتون عن طريق إضافة RELAX-ISO تصل إلى أعلى أنبوب 15 مل; خلط بلطف (عكس 3 مرات الأنبوب) وأخيرا الغزل أسفل الخلايا في جهاز طرد مركزي الزاوية (1 دقيقة في 348 × ز). إزالة فائقة تصل إلى 3 مل فوق بيليه الخلية.
ملاحظة: إزالة افرنح بلطف لتجنب إزعاج بيليه الخلية. ومع ذلك، فإن بعض الخلايا في مُنَتَهَم سوف تضيع حتماً. - كرر الخطوة 4.10 على الأقل 4 مرات أو حتى لا يتم ملاحظة المزيد من الفقاعات التي تنتجها بقايا تريتون.
ملاحظة: يتم إجراء المزيد من الخطوات الغسل، يتم فقدان المزيد من الخلايا مع supernatant المهملة. - في الغسيل الأخير، إزالة supernatant تصل إلى حجم 5-10 مل من تعليق الخلية.
5. اختيار وإلتصاق القلب الجلد
- وضع قطرة تعليق الخلية على غطاء على رأس شريحة زجاجية في حامل الشريحة المجهر(الشكل 1).
- حدد واحد على شكل قضيب cardiomyocyte مع نمط جيد striation والحجم (الشكل 2).
- العثور على نصائح إبرة من القوة محول والمحرك باستخدام أدنى التكبير من المجهر المقلوب.
- تدوير غطاء لوضع cardiomyocyte مختارة أفقيا بحيث يتم محاذاة نهاياته مع إبرة محول القوة والمحرك(الشكل 2).
- ضع خط رفيع من الغراء على جانب الغطاء بمساعدة طرف مسحة (الشكل 2).
- تزج نصائح إبرة من محول القوة والمحرك في خط الغراء لخلق هالة الغراء حول كل من النصائح.
ملاحظة: يتم إنجاز الخطوات 5.6-5.10 من خلال الاستخدام الدقيق للمحركات الصغيرة الآلية. - بسرعة نقل نصائح إبرة قريبة من الطائرة البؤرية من cardiomyocyte.
- نقل طرف إبرة من محول القوة إلى أسفل بحيث الغراء إلى حافة واحدة من cardiomyocyte.
- كرر هذا الإجراء مع طرف المحرك والأطراف الأخرى من الخلية.
ملاحظة: يجب أن يستغرق هذا الإجراء أقل من 2-3 دقيقة كما يبدأ الغراء لعلاج سريع جدا. - بعد 5-8 دقائق، ارفع الإبر ≈15 ميكرومتر لتجنب إلتصاق الخلية بالأغطية. ويتم ذلك عن طريق تحريك كل من micromanipulators في وقت واحد.
- دع الغراء يشفي يمكن أن يستمر هذا الإجراء من 15 إلى 45 دقيقة ، اعتمادًا على نوع الغراء. في حالتنا، يتم لصقها بشكل كاف cardiomyocyte بعد ≈15 دقيقة.
6. تسجيل قياسات القوة من حساسية النشط والسلبي وCa2+
- ملء البئر التجريبية الأولى مع حل الاسترخاء (55-100 ميكرولتر في الجهاز التجريبي) والثانية التجريبية جيدا مع تنشيط الحل.
- باستخدام برنامج الكاميرا، ضع منطقة الاهتمام (ROI) في منطقة من عضلة القلب مع نمط واضح من التصدع.
ملاحظة: بالنسبة إلى الخلايا الميوسيتي القلبية، يختلف طول الساركومير العامل بين 1.8 و2.2 ميكرومتر، وطول الساركومير الأمثل حوالي 2.15 ميكرومتر. - قياس المسافة بين النقيضين من cardiomyocyte (من المحرك إلى هالوة الغراء محول، الشكل 3)بعد تم تعيين طول ساركومير الأمثل (2.2 ميكرومتر). تسجيل القيمة كطول myocyte في البرنامج.
- قياس عرض القلب والعمق، وهذا الأخير مع المعونة من مرآة المنشور وضعت عمودي على الخلية.
ملاحظة: سوف تكون هناك حاجة إلى مصدر ضوء خارجي قوي لتصور الخلية من خلال المنشور. في حالة عدم وجود المنشور، وعلى افتراض أن الخلايا القلبية لها شكل بيضاوي الشكل، يمكن الاستدلال على عمق القلب و القلب و 70٪ من عرض القلب. - حساب منطقة المقطعية (CSA، مم2) على افتراض شكل بيضاوي الشكل من القلب.

- نقل بلطف مرحلة المجهر بحيث ينتقل الخلية من غطاء إلى البئر التي تحتوي على حل الاسترخاء على الجزء الخلفي من المرحلة.
ملاحظة: يمكن أن يؤدي هذا الإجراء إلى تلف الخلية بسهولة. قبل تحريك الخلية، قم بتحريك الإبر بلطف أكثر قليلاً. تجنب إزالة الخلية من الحل. - حدد البروتوكول في البرنامج الذي يحتوي على اثنين من تقصير الخلية (80٪ من طوله الأولي)، التي سوف تحدث عندما تظهر الخلية في حل كاليفورنيا2+ وفي حل الاسترخاء، على التوالي (الشكل 1، ملف تكميلي).
ملاحظة: سيتم تنفيذ أول "الركود" من الخلية ضمن تنشيط الحل والثانية "الركود" داخل حل الاسترخاء. من خلال القيام بذلك، فإن المستخدم تكون قادرة على حساب القوة الإجمالية(المجموعF) من الخلية من 1st والقوة السلبية (Fالسلبي)من الخلية من2nd. استخدام الصيغة لحساب القوة النشطة، Fنشط =F المجموع - Fالسلبي. يتم اختصار الخلية 80٪ من أجل فصل جميع قوة السجل عبر الجسور. - الحصول على انكماش متساوي القياس عن طريق تحريك مرحلة المجهر بحيث ينتقل القلب من الاسترخاء إلى حل التنشيط (pCa = 4.5 (1)).
ملاحظة: إذا كانت الخلية تعمل، سيتم التعاقد مباشرة. - عند الوصول إلى هضبة القوة، ابدأ في تسجيل بيانات القوة.
ملاحظة: يمكن إجراء الاختبارات بشكل فردي. اعتمادا على البرمجيات هناك إمكانية لإنشاء سلسلة من الاختبارات التي سوف تتوافق مع مختلف حلول كاليفورنيا2 + داخل بروتوكول كاليفورنيا2 +حساسية(الشكل 1، ملف تكميلي). - انتظر ~ 10 ق ومن ثم التبديل الخلية مغمورة في تفعيل الحل.
ملاحظة: من المهم الانتظار 10 ق قبل غمر الخلية في حل الاسترخاء. إذا تم نقل الخلية مبكراً جداً قد يتم فقدان البيانات الهامة لحساب قوة إعادة تطوير الخلية (قيمة ktr). - سرعان ما تحرك على المسرح بحيث يغطس القلب في حل الاسترخاء.
- انتظر حتى يتوقف الاختبار.
- كرر الخطوات 6.8 -6.12 بحيث يتم تنشيط الخلية مرتين في تنشيط الحل (pCa = 4.5 (2)).
ملاحظة: عادة، بعد التنشيط الأول، ينتهي cardiomyocyte يمكن أن تنفصل قليلاً عن نصائح إبرة، وتغيير طول القلب، CSA و / أو طول ساركوموير. تعديل لطول ساركومير المطلوبة وإدخال الأبعاد المصححة في البرنامج.- الاستمرار في الخطوة 6.13.2 لبروتوكول حساسية Ca2+ أو حفظ البيانات، إذا قيم القوة السلبية والفاعلة للخلية هي المعلمات الوحيدة اللازمة وفصل الخلية من الإبر وتنظيفها مع الأسيتون لإزالة الغراء.
- ضبط طول ساركومير من الخلية إلى 2.2 μm عن طريق التمدد قليلا مرة أخرى، إذا لزم الأمر.
- استبدال حل تفعيل من قبل المقبل Ca2 + الحل (55-100 μL هنا). كرر الخطوات 6.8 - 6.12.
- استبدل حل التنشيط بحل Ca2+ التالي (55-100 ميكرولتر هنا) وكرر الخطوات 6.8 - 6.12 حتى يتم اختبار جميع الحلول (5.0، 5.2، 5.4، 5.6، 5.8، 6.0).
- وأخيراً، إعادة تنشيط الخلية مع تنشيط الحل (pCa4.5 (3)). كرر الخطوات 6.8-6.12.
7. حضانة مع كينازات والفوسفاتات
- بعد تنفيذ بروتوكول خط الأساس المحدد، تمييع كيناز/فوسفاتاز في حل الاسترخاء في التركيز الموصى به.
ملاحظة: يوصى بتنفيذ منحنى استجابة للجرعة قبل التجربة. - تعيين درجة حرارة الآبار التجريبية إلى 20 درجة مئوية.
- ملء الآبار التجريبية مع كيناز / فوسفاتاز، حل الاسترخاء وتفعيل الحل (55-100 ميكرولتر).
- نقل بلطف مرحلة المجهر بحيث تصبح الخلية مغمورة في بئر يحتوي على كيناز / فوسفاتاز.
- احتضان القلبmyocyte مع كيناز / فوسباتاز لمدة 30 دقيقة على الأقل أو وفقا لتعليمات المصنعين.
- كرر بروتوكول الأساس المحدد.
8- الانتهاء من التجربة
- فك القلب من أطراف محول القوة والمحرك عن طريق تمديد الخلية.
- إزالة بعناية هالة الغراء من نصائح إبرة باستخدام مسحة القطن غارقة في الأسيتون.
- أغلق المعدات
9. تحليل البيانات
- جمع جميع الملفات من كل cardiomyocyte اختبارها.
ملاحظة: كل اختبار سوف تتوافق مع ملف واحد. وهذا يعني أن لكل Ca2 + حل أو طول sarcomere ، سيكون هناك ملف المقابلة. - حساب القوى النشطة والسلبية من القلب واحد.
- فتح الملف المقابلة للتنشيط الأول (pCa = 4.5 (1)) باستخدام جدول البيانات (الشكل 3A، الملحق A في ملف تكميلي).
ملاحظة: استخدمنا برنامج مخصص لإجراء التحليل. يرجى الاطلاع على الملحق ألف في الملف التكميلي. - متوسط القيم ≈60 قبل ومتوسط القيم ≈60 بعد فترة سماح 1st من الخلية (عندما تكون الخلية مغمورة في حل Ca2+ ). تتطابق قيمتان مع a و b على التوالي.
- كرر نفس التحليل لرسوب2 من الخلية (عندما تكون الخلية مغمورة في حل الاسترخاء). تتطابق قيمتان مع c و d على التوالي.
- حساب الفرق بين a و b (إجمالي القوة،إجماليF).
- حساب الفرق بين c و d (القوة السلبية، Fالسلبي).
- حساب القوة النشطة، Fنشط =F المجموع - Fالسلبي.
- تطبيع جميع قيم القوة إلى CSA (انظر الصيغة أعلاه) للحصول على التوتر الكلي(T المجموع)،والتوتر السلبي (Tالسلبي)والتوتر النشط (Tنشط).
- كرر الخطوة 9.2.1 إلى 9.2.5 التنشيط2 nd (pCa = 4.5 (2)).
- النظر في هذه القيم كتلك التي تمثل Tالمجموع، Tالنشط و Tالسلبي من cardiomyocyte تحت التحليل.
ملاحظة: عادةً ما يقترن التنشيط الأول للخلية باستخدام pCa4.5(1) بتغييرات في أبعاد الخلية. لهذا السبب، التنشيط الثاني مع pCa4.5 هو أكثر دقة وهو واحد ليتم استخدامه. - كرر الخطوات 9.2.1 إلى 9.2.5 لكل ملف/pCa اختبار الحلول (5.0، 5.2، 5.4، 5.6، 5.8، 6.0، 4.5 (3)).
- فتح الملف المقابلة للتنشيط الأول (pCa = 4.5 (1)) باستخدام جدول البيانات (الشكل 3A، الملحق A في ملف تكميلي).
- حساب pCa50 وnHill من القلب واحد.
ملاحظة: لهذا التحليل استخدام القيمالنشطة غير تسوية F من الملفات 4.5(2) ، 5.0 5.2 5.4 5.6 5.8 6 و 4.5(3).- ضع في ملف جدول البيانات كافة القيم غير المطبعية Fالنشطة لكل حل Ca2+ اختبار (4.5 (2)، 5.0، 5.2، 5.4، 5.6، 5.8، 6.0، 4.5 (3)).
- حساب عامل التصحيح = Fنشط [4.5 (2)] - Fنشط [4.5 (3)] / 7.
- حساب القيم المصححة لـ Fالنشطة لكل حل Ca2+ (5.0، 5.2، 5.4، 5.6، 5.8، 6.0) بطرح عامل تصحيحF النشط.
- حساب القوة النسبية(F النسبي)لكل حل Ca2+ عن طريق تسوية كل قيمF النشطة بواسطة القيمة المصححة المقابلة.
ملاحظة: يجب أن يساويالنسبي F [4.5 (3)] 1. يبدأ كل بروتوكول تجريبي وينتهي بتنشيط التحكم في تشبع تركيز Ca2+ (pCa 4.5 (2) و 4.5 (3)). وهذا يسمح التطبيع قوة وتقييم المتهدمة من الاستعدادات من خلال مقارنة التغيرات في أقصى كاليفورنيا2 +تفعيل القوة (Fماكس). إذا كان في نهاية البروتوكول التجريبي، تنتج القلبية أقل من 70٪ على الأقل من القوة القصوى للانكماش الأول، ينبغي استبعاد تلك الخلية / القياس من التحليل. - استخدامF النسبية والقيم PCa المقابلة لتناسب منحنى السيني مع المعادلة التالية F(Ca) = CanHill/ (Ca50nHill + CanHill).
- استقراء pCa وnHill القيم من المعادلة المذكورة أعلاه.
- حساب معدل إعادة تطوير القوة (ktr) من عضلة القلب واحد.
- تنفيذ ملائمة إلى المنحنى الذي يتوافق مع القيم مباشرة بعد فترة سماح الخلية 1st.
- حساب المنحدر من المنحنى وهذه القيمة سوف تتوافق مع معدل إعادة تطوير القوة.
- كرر الخطوة 9.4.1 و 9.4.2 لكل حل Ca2+ .
ملاحظة: سوف يتم الحصول على احتواء منحنى ضعيف لأدنى Ca-الحلول (R تربيع≤0.90).
النتائج
يجب أن تظهر cardiomyocytes وظيفية مُنمَّة بشكل منتظم ومع نمط تماثل متناسق طوال التجربة بأكملها. وعلى الرغم من توقع حدوث درجة معينة من التدهور وانخفاض القوة بعد التجارب المطولة، فإن قيم التوتر النشط ينبغي أن تكون مستقرة نسبيا. الخلايا التي تظهر علامات واضحة على فقدان التصدع أو انخفاض كبير في القوة (< 15 كيلو إن-m -2 أو < 80٪ من قوتها النشطة الأولية) يجب استبعادها. ويبين الجدول 6 القيم العادية المتوقعة لأهم البارامترات المستمدة من القوارض والخنازير والعينات البشرية.
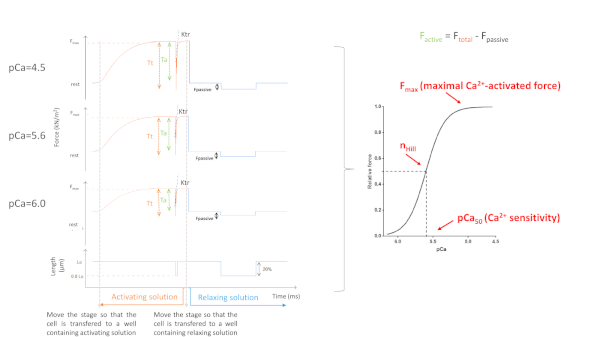
تعتمد المعلمات التي تم الحصول عليها بشكل رئيسي على البروتوكول المختار. ويبين الشكل 5 آثار القوة التمثيلية من 3، من أصل 8، تسجيلات القوة اللازمة لتنفيذ بروتوكول myofilaments Ca2 +حساسية. عن طريق نقل الخلية إلى بئر يحتوي على حل تفعيل، ويبدأ cardiomyocyte لتطوير القوة حتى تصل إلى الهضبة. بعد اختبار فترة سماح سريعة (مدة 1 مللي ثانية)، حيث يقصّر القلب إلى 80٪ من طوله، نحصل على قيم خط الأساس للقوة الصفرية. بعد اختبار فترة الركود، تستمر الخلية في تطوير القوة كما هي مغمورة في حل التنشيط. يتم حساب إجمالي القوة(F المجموع)عن طريق طرح قيمة الهضبة من القيمة الدنيا. إن انحدار الجزء الأخير من هذا المنحنى يعطينا قيمة معدل إعادة تطوير القوة (KTR) (الشكل 6) ، وهو مقياس لمعدل واضح من المرفق عبر الجسر ومفرزة(و التطبيق وgaap)10. عندما تكون قيمة KTR R2 < 0.90 يجب استبعاد قيمة ktr وعادة يحدث هذا عند تركيزات Ca2+ أقل (pCa 5.6 و 5.8 و 6.0). بعد نقل الخلية مرة أخرى إلى بئر يحتوي على حل الاسترخاء، وترتاح الخلية وتسقط قوتها. يتم حساب القوة السلبية (Fالكامنة)عن طريق طرح القيمة الدنيا (التي تم الحصول عليها بعد تقصير خلية طويلة) لهذه القيمة الجديدة للقوة. القوة النشطة تنتج عن الفرق بينF المجموع و Fالسلبي.
القوة النشطة والسلبية القصوى التي تميز عضلة القلب هي تلك المستمدة من تنشيط الخلية الثانية مع تشبع كاليفورنيا2 +حل (pCa = 4.5). يتم عادة التخلص من التنشيط الأول حيث أن طول الساركومير غالباً ما يحتاج إلى إعادة ضبطه.
لتنفيذ بروتوكول myofilament Ca2+-حساسية، من الضروري إجراء ما لا يقل عن 9 اختبارات التنشيط (4.5; 4.5; 5.2; 5.6; 6.0; 5.0; 5.4; 5.8 و 4.5). هذا التسلسل هو مجرد مثال ولكن يجب أن تبدأ دائماً مع 4.5 (مرتين) وتنتهي مع 4.5. يتم تصوير برمجة برنامج الحصول على البيانات لبروتوكول myofilament Ca2+حساسية في الشكل 1 من الملف التكميلي.
بعد حساب القوة النشطة لجميع حلول التنشيط هذه، تحقق مما إذا كان التنشيط الأخير قد أسفر عن أكثر من 80٪ من القوة القصوى الأولية (وإلا يجب تجاهل نتائج هذه الخلية، كما ذكر أعلاه). لتصحيح الانخفاض فيF الحد الأقصى خلال السلسلة التجريبية، يمكن استخدام قيم Fالقصوى المُستَدَرِعَة لتطبيع نقاط البيانات. يمكن أن تكون البيانات تطبيع صالح لمنحنى السيني مع المعادلة التالية F(Ca) = CanHill/ (Ca50nHill + CanHill). تمثل قيم المعلمة التي تم الحصول عليها حساسية الكالسيوم (Ca50، والتي يمكن تحويلها إلى pCa50) والتعاونية (nHill). يمكن تحويل كافة قيم القوة إلى قيم التوتر بعد التطبيع إلى منطقة المقطع المستعرض. بالإضافة إلى myofilament Ca2 +حساسية وبروتوكولات التنشيط المعتمدة على الطول، يمكن إجراء اختبارات أخرى. هذه هي حالة تبعيات طول الساركومير من Tالنشط، Tالسلبي (الشكل 7)، وقوة القلب المتبقية. وتُحسب تسجيلات القوة المتبقية من عملية استعادة القوة الأولية (pCa 4.5) التي تم التوصل إليها بعد تغيير طول الخلية (80٪) وتطبيع لكل مجموع ثابت الدولة قوة وصلت قبل طول تغيير11. الزيادة في القوة المتبقية عادة ما يدل على عبور الجسور مع حركية مفرزة بطيئة وارتفاع صلابة.
وأخيراً، ينبغي أن نؤكد أن هذه التقنية يمكن أن تنفذ في خلايا القلب ذات البشرة المُستخلصة ميكانيكياً من العينات المجمّدة أو التي تم جمعها حديثاً، فضلاً عن أنها معزولة تليها عملية الغشاء الخمس للأغشية. الطريقة التي يتم بها عزل عضلة القلب تؤثر بشكل كبير على النتائج المستمدة من هذه التقنية. ويبين الشكل 8 الاختلافات التي لوحظت بين إجراءات العزل الثلاثة.

الشكل 1: مخطط متكامل لجهاز الاختبار. ويشمل جهاز الاختبار المجهر، وmicromanipulators والكمبيوتر المرتبطة بها. الجزء السفلي من هذا الرقم يظهر cardiomyocyte البشرة لصقها بين المحرك ومحول القوة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: مخطط تدفق بروتوكول عزل الخلية، permeabilization والالتصاق. تتكون صورة الزاوية اليسرى العليا من 4 صور تظهر قطعًا من عينة القلب في حل RELAX-ISO (A) في طبق بيتري ،(B)في أنبوب يستخدم للتجانس الميكانيكي للأنسجة ، (C) المُتجانس ، (D) الأنسجة مباشرة بعد التجانس و (E) عندما تكون في أنبوب لـ Triton Permeabilization. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
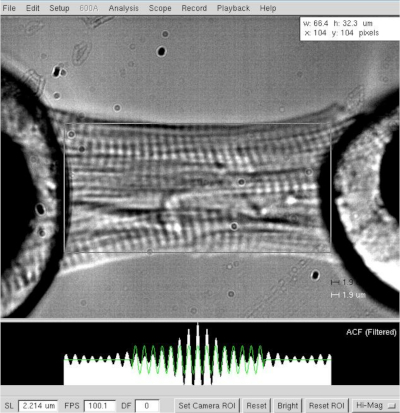
الشكل 3: تحديد طول وطول الساركومير من القلب المسلخ. طول الخلية وتحديد العرض بطول ساركومير ≈2.2 ميكرومتر.
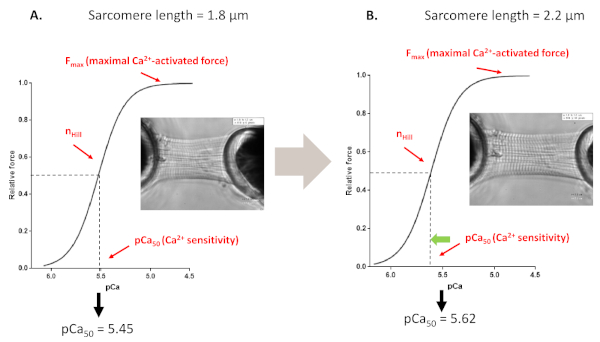
الشكل 4: بروتوكول التنشيط المعتمد على الطول (يحاكي آلية فرانك ستارلينغ في المختبر). آثار القوة التمثيلية والمعلمات المستمدة من myofilaments 'Ca2+ بروتوكولات حساسية التي أجريت من قبل (A, 1.8 μm) وبعد تمديد عضلة القلب تصل إلى 2.2 μm (B). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 5: Myofilaments Ca2+-حساسية البروتوكول. تتبع القوة التمثيلية والمعلمات المشتقة. من أجل البساطة ، يتم تصوير 3 فقط من أصل 8 منحنيات القوة. وهي cardiomyocyte تنشيط مع تشبع, وسيطة وأدنى كاليفورنيا2 +التي تحتوي على حل (4.5, 5,6 و 6.0, على التوالي). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: آثار تمثيلية من خلية قلبية فئران تم تنشيطها في حلول الكالسيوم المختلفة ومنحنى KTR المناسب. (أ) 4.5 pCa؛ (ب) 5.0 pCa؛ (C) pCa 5.2؛ (D) 5.4 pCa؛ (E) pCa 5.6؛ (F) pCa 6.0 و E قيم لمجموع، السلبية و النشطة التوتر، قيمة KTR و Rsquare لتناسب ktr. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
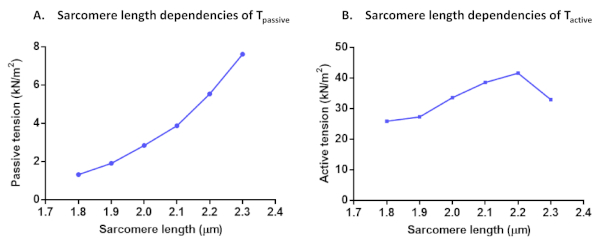
الشكل 7: بروتوكولات تبعيات طول الساركومير لـ Tالخامل (A) و Tالنشط (B). تم حساب التوتر السلبي والتوتر النشط في عضلة القلب الواحدة بطول ساركومير 1.8 ميكرومتر إلى 2.3 ميكرومتر.
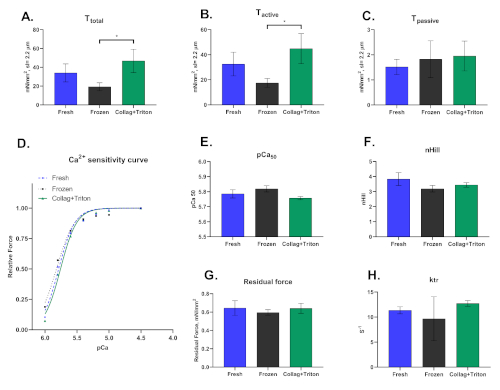
الشكل 8: النتائج التمثيلية لـ cardiomyocytes معزولة ميكانيكيا من الطازجة ("الطازجة") وعينات عضلة القلب المجمدة ("المجمدة") وكذلك من القلب الكولاجين هضم (تعديل تقنية Langgendorf) مع permeabilization الخلفي مع تريتون ("Collag + تريتون"). قيم (A) التوتر الكلي, (B) التوتر النشط و (C) التوتر الباسفي من cardiomyocytes تفعيلها مع pCa 4.5 حل في طول ساركومير ≈2.2 ميكرومتر . (D) منحنى حساسية الكالسيوم والقيم الخاصة بـ (E) pCa50 و (F) nHill. (G) القوة المتبقية و (H) قيم ktr المحسوبة في الحل التنشيط الأقصى (pCa 4.5). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
ملف إضافي. الرجاء النقر هنا لتحميل هذا الملف.
| تخزين في | حلول الأسهم | [م] | المجلد النهائي (مل) | الوزن/ الحجم | تلاحظ |
| 4 درجة مئوية | هيدروكسيد البوتاسيوم (KOH) | 1 | 100 | 5.611 غرام | لضبط درجة الـ PH |
| 4 درجة مئوية | هيدروكسيد البوتاسيوم (KOH) | 5 | 50 | 14.03 غ | لضبط درجة الـ PH |
| 4 درجة مئوية | بيز | 1 | 50 | 10.66 غ | |
| 4 درجة مئوية | حمض البربيونيك | 1 | 100 | 7.483 مل | ضبط درجة اله pH إلى 7.0 مع 5M أو 1M كوه |
| 4 درجة مئوية | CaEGTA تتألف من: | 0.1 | 100 | اخلطي واسخني الحل إلى 60 درجة مئوية لأكثر من ساعة واحدة. ضبط درجة PH إلى 5-6 مع 1M كوه. | |
| - كاكو3 | 0.1 | 1.001 غرام | |||
| - تيتريبليك (EGTA) | 0.1 | 3.804 |
الجدول 1: تعليمات لإعداد حلول المخزون.
| الاسترخاء-ISO (لعزلة القلبية أو الخلايا) | [mM] | الوزن |
| Na2ATP | 5.95 | 3.28 غ |
| MgCl2.6H2O | 6.04 | 1.23 غ |
| Tritiplex (EGTA) | 2 | 0.76 غ |
| KCl | 139.6 | 10.41 غرام |
| إيميدازول | 10 | 0.68 غرام |
الجدول 2: تعليمات لإعداد حل الاسترخاء-ISO.
| تفعيل الحل (للقياسات) | [mM] | الوزن / الحجم |
| Na2ATP | 5.97 | 0.823 جم |
| MgCl 1M | 6.28 | 1.57 مل |
| حمض البربيونيك | 40.64 | 10.16 مل |
| بيز | 100 | 25 مل |
| CaEGTA (حل الأسهم التي أعدت سابقا) | 7 | 17.5 مل |
| Na2PCr | 14.5 | 0.925 غ |
الجدول 3: تعليمات لتفعيل إعداد الحل.
| حل الاسترخاء (للقياسات) | [mM] | الوزن / الحجم |
| Na2ATP | 5.89 | 0.325 غ |
| MgCl 1M | 6.48 | 0.65 مل |
| حمض البربيونيك | 40.76 | 4.08 مل |
| بيز | 100 | 10 مل |
| تيتريبليك (EGTA) | 6.97 | 0.265 غرام |
| Na2PCr | 14.5 | 0.370 غ |
الجدول 4: تعليمات لإعداد حل الاسترخاء.
| pCa = -Log [Ca2+] | الاسترخاء (pCa = 9.0) مل | التخمين (pCa = 4.5) مل |
| 5 | 0.86 | 39.14 |
| 5.1 | 1.2 | 38.80 |
| 5.2 | 1.54 | 38.46 |
| 5.3 | 2 | 38.00 |
| 5.4 | 2.51 | 37.49 |
| 5.5 | 3.14 | 36.86 |
| 5.6 | 3.89 | 36.11 |
| 5.7 | 4.8 | 35.20 |
| 5.8 | 5.89 | 34.11 |
| 5.9 | 7.14 | 32.86 |
| 6 | 8.57 | 31.43 |
الجدول 5: تعليمات لإعداد حلول pCa.
| المعلمه | القوارض | خنزير | الانسان |
| التوتر النشط، kN.m-2 (عند 2.2 ميكرومتر) | 17 – 28 | 19 – 40 | 19 – 36 |
| التوتر السلبي، kN.m-2 (عند 2.2 ميكرومتر) | 3.6 – 5.5 | 1.9 – 6.8 | 1.8 – 2.3 |
| pCa50 | 5.58 – 5.64 | 5.40 – 5.50 | 5.43 – 5.82 |
| nHill | 2.60 – 2.76 | 2.95 – 3.36 | 2.99 – 3.10 |
| ktr، s-1 | 4.00 – 8.00 | 1.00 – 3.00 | 0.90 – 2.00 |
الجدول 6: البارامترات والمؤشرات النموذجية المستمدة من أمراض القلب الوحيدة المميّزة من القوارض والخنازير والبشر. مقتبسة من12.
| المشكله | السبب المحتمل | حل |
| القلبيات تُفصل أثناء التنشيط الأقصى | عدم كفاية وقت الإلتصاق؛ الغراء قديم وقد جفت | زيادة الوقت من خطوة الإلتصاق؛ النظر في فتح أنبوب الغراء الجديد. |
| هناك تريتون® في حل تعليق الخلية، والتي لم يعد من الممكن إزالتها | كرر إجراء الاستخراج مع واحد أو اثنين من خطوات إضافية من الترتون® | |
| و cardiomyocyte لديه قوة منخفضة تحت ظروف السيطرة | ذهب الاستخراج الخطأ وتسليم خلايا منخفضة الجودة | زيادة حجم العينة والقيام استخراج جديد. إذا استمرت المشكلة ربما بسبب مجموعة عينة غير صحيح - تجاهل هذه العينة |
| فالخلية تتقلص بشكل واضح ولكن لم تسجل أي قوة؛ الخلية لديها قيم قوة غير عادية | محول القوة هو خارج | تشغيله |
| محول القوة ليس مُعاَيَرَاً بشكل جيد | معايرة محول القوة باستخدام مجموعة من الأوزان المعروفة (تحقق من دليل إرشادات الشركة المصنعة). | |
| إبرة محول القوة فضفاضة | الغراء الإبرة مرة أخرى باستخدام الكريستال السندات 509 أو المجوهرات الشمع. | |
| نمط التصدع ليست جيدة بما فيه الكفاية لتحديد طول الساركومير | ضوء غير كاف | زيادة ضوء المجهر أو نقل الخلية مرة أخرى إلى غطاء وتقييم طول الساركومير مرة أخرى (الآبار لديها أقل شدة الضوء) |
| ذهب الاستخراج الخطأ وتسليم خلايا منخفضة الجودة | زيادة حجم العينة والقيام استخراج جديد | |
| نصائح الإبر ليست في نفس الطائرة | باستخدام micromanipulators، وضبط نصائح الإبر 'صعودا أو للأسفل حتى العثور على ساركوميريس مركزة | |
| لا اختلاف في الطول و/أو القوة أثناء الاقتناء | المحرك أو محول القوة خارج | تشغيلها |
| المحرك مكسورة وليس إنتاج تقصير الخلية | استبدالها أو محاولة معايرته باستخدام مولد وظيفة | |
| الكثير من الضوضاء على تسجيلات الاستحواذ | تدفق الهواء أكثر من اللازم حول المعدات | حماية المعدات من تدفق الهواء المباشر |
| الاهتزازات كثيرة جدا حول المعدات | ومن المستحسن جدول الاستقرار. حتى في ذلك الحين، فمن المستحسن لإزالة أي المعدات التي قد يكون لها ضاغط أو تنبعث منها الاهتزازات (الفريزر، الثلاجات) | |
| Ca2 +منحنى حساسية له قيم غريبة وقيم القوة لا تزيد مع [كاليفورنيا2 +]. | لم يتم الخليط من تفعيل والاسترخاء حل بشكل صحيح (الاختيار 3.10 إلى 3.14 من قسم الأساليب، وربما بسبب عدم كفاية الاختلاط) | قم بتذويب القنينات بنفس التركيز، وجمع كل محتوى القارورة في نفس القارس، وخلطها مع التحريك وتقسيمها مرة أخرى. اختبار هذه الحلول مرة أخرى في خلية جديدة. إذا كان هذا لا يحل المشكلة، وإعداد دفعة جديدة من Ca2 +- تحتوي على حلول |
الجدول 7: جدول استكشاف الأخطاء وإصلاحها.
Discussion
في المختبر تقييم وظيفة القلب باستخدام cardiomyocytes البشرة يمثل تقنية هامة لتوضيح التعديلات التي تحدث على مستوى cardiomyocyte في الفسيولوجية (على سبيل المثال، تمتد) والسياق المرضي (على سبيل المثال، نقص التروية). هذه المنهجية لها العديد من المزايا مثل اشتراط الحد الأدنى من عضلة القلب لتقييم وظيفة في عضلة القلب التي تم الحصول عليها من عينات المذابة; باستخدام cardiomyocytes من مجموعة واسعة من الأنواع (الفئران13، الفئران1،14،15، الأرنب16، خنزير17، الكلب18، خنزير غينيا19 والإنسان20) ومواقع مختلفة القلب ، بما في ذلك الأذين ، والبطينين الأيسر والأيّن أو منطقة معينة من القلب المهاد. وعلاوة على ذلك، تسمح هذه التقنية بتقديم تركيزات محددة من Ca2+ والطاقة (ATP) مع قياس وظيفة الهياكل التنظيمية والانكماشية في تكوينها الأصلي.
على الرغم من بساطة هذه التقنية ، هناك بعض الخطوات الحاسمة. من الضروري ضمان جودة كل خطوة من البداية، بما في ذلك جمع العينات. Myofilament البروتينات عرضة للبروتيازات21. وبالتالي فإنه من الضروري تخزين العينات في النيتروجين السائل مباشرة بعد جمعها. وسوف تطور العينات الجديدة، التي لم تكن مجمدة من قبل، قوى أعلى بكثير، لذلك ليس من المستحسن خلط القياسات التي تتم في عينات جديدة ومجمدة في نفس البروتوكول. الخطوة الثانية الأكثر أهمية هي استخراج القلبية أوسميس. خلال هذا الإجراء، من المهم الحفاظ على العينة على الجليد معظم الوقت. ويمكن استخدام كوكتيل مثبطات البروتياز للحد من خطر تدهور البروتين خلال استخراج / permeabilization22. ثالثا، ينبغي قطع العينات في قطع أصغر باستخدام حركات مشرط دقيقة منذ لاحظنا انخفاض نوعية cardiomyocytes عندما تم تجاهل هذه الخطوة. آخر خطوة حرجة غسل القلبية حيث أنه من الصعب أن يكون التوازن الصحيح بين غسل خارج تريتون (permeabilizes الخلية ولكن يعزز من ungluing) والحفاظ على أكبر عدد ممكن من الخلايا في supernatant ممكن. من المهم أولاً أن نحاول استخراج وعدد الاغتسال لكل عينة أو أنواع أو بروتوكول. على سبيل المثال، في أيدينا، لاحظنا أن استخراج أنسجة الفئران البدناء ZSF1 له جانب "دهنية"، مما جعل هذه الخلايا أكثر زلقًا أثناء الإلتصاق ولكن ليس من الصعب قياسه. الطريقة التي نتحايل على هذه المشكلة كانت عن طريق إجراء المزيد من التجارب أن يكون عدد معقول من الخلايا لكل. وعلاوة على ذلك، فمن الأهمية بمكان لتحديد خلية جيدة الغراء، أي مع التصدع جيدة وطول معقول. إذا لم يكن لديك cardiomyocyte هذه الميزات، فإنه سيتم فصل في الغالب من نصائح إبرة أو تطوير قوة لا / منخفضة. من المهم أيضا استخدام الغراء الصحيح للالمرفق cardiomyocyte، معتبرا الوقت من الالتصاق وفعاليتها للصق الخلية إلى الإبرة. في أيدينا، واللصق سيليكون (جدول المواد)يشفي بسرعة (10-15 دقيقة) وقوية بما فيه الكفاية. وأخيراً، ترتبط الخطوة الحرجة الأخيرة برفع القلب بعناية 5 دقائق بعد الإلتصاق بالخلية (لتجنب الالتصاق بالخلية إلى الأغطية) وقبل نقلها إلى الآبار (لتجنب سحب الخلية من مرحلة المجهر). يلخص الجدول 7 استكشاف الأخطاء وإصلاحها المرتبطة بهذه التقنية، والأسباب الكامنة والحلول الممكنة للتغلب على المشاكل المتكررة.
القيد الرئيسي لهذا الأسلوب هو أنه لا يمكن الإجابة على كافة الأسئلة المتعلقة بالتقلص myofilament، مثل سرعة myofilaments تنشيط /إلغاء تنشيط. في وضع في الجسم الحي، والغشاء إزالة القطبية، وفيما بين الخلايا كاليفورنيا2 + زيادة وانتشاره إلى myofilaments تحتاج إلى أن تحدث لmyocytes إلى العقد، في حين في cardiomyocytes2+ الجلد انتشار إلى myofilaments يحدث على الفور عندما يتم غمر الخلية في الحل كاليفورنيا2+ . هذا معدل أسرع من كاليفورنيا2 + نشر سوف التحيز myofilaments تنشيط / تعطيل تحليل23.
وتتأثر هذه التجارب من قبل عوامل مختلفة، بما في ذلك درجة الحرارة، حل درجة الحرارة، والانزعاج الميكانيكي (الركود إعادة تمتد مقابل الركود) وإجراءات مرفق الخلية (دبوس التعادل مقابل الغراء)، كل هذه المتغيرات المحاسبة لتناقضات الأدب من حيث KTR وزيادة طول الساركومير تعتمد في قوة4،12.
التقدم المستقبلي لهذه التقنية يشمل إجراء دراسات وظيفية في أمراض القلب سليمة بدلا من نفاذها. هذه التقنية لديها عيب الاعتماد على cardiomyocytes معزولة حديثا (لم يتم تجميدها سابقا). وثمة مسألة هامة أخرى لا تتصل مباشرة بهذه المنهجية ولكنها قد تؤثر تأثيراً كبيراً على هذه المنهجية، وهي تتعلق بالفترة القصوى من التخزين المجمد للعينات. على وجه التحديد، من الضروري تحديد درجة تدهور myofilament طوال وقت التخزين (أي، لمدى الوقت الذي يمكن تخزين العينات المجمدة من أجل ضمان بيانات وظيفية ذات نوعية جيدة المستمدة من الخلايا القلبية المستخرجة).
Disclosures
ولا يوجد تضارب في المصالح بين أصحاب البلاغ.
Acknowledgements
يشكر المؤلفون المؤسسة البرتغالية للعلوم والتكنولوجيا (FCT) والاتحاد الأوروبي و Quadro de referência Estratégico Nacional (QREN) و Fundo Europeu de Desenvolvimento Regional (FEDER) و Programa Operacional Factores de Competitividade (COMPET) لتمويل وحدة البحث UnIC (UID/IC/00051/2013). هذا المشروع مدعوم من قبل فيدر من خلال COMPETE 2020 - Programa Operacional Competitividade E Internacionalização (POCI)، ومشروع DOCNET (NORTE-01-0145-FEDER-000003)، بدعم من برنامج التشغيل الإقليمي نورتي البرتغال (NORTE 2020)، بموجب اتفاقية الشراكة البرتغال 2020، من خلال الصندوق الأوروبي للتنمية الإقليمية (ERDF)، ومشروع NETDIAMOND (POCI-01-0145-FEDER-016385)، بدعم من الصناديق الهيكلية والاستثمارية الأوروبية، برنامج لشبونة التشغيلي الإقليمي 2020. تم تمويل باتريا رودريغز من قبل FCT (SFRH/BD/96026/2013) وكان جواو ألميدا كويلو من قبل جامعة دو بورتو / FMUP و FSE -Fundo الاجتماعية Europeu ، NORTE 2020-Programa Operacional الإقليمية تفعل نورتي، (NORTE-08-5369-FSE-000024-Programas Doutorais).
Materials
| Name | Company | Catalog Number | Comments |
| Acetone | Sigma | 34580 | |
| Adenosine 5’-triphosphate disodium salt hydrate (Na2ATP) | Sigma | A2383 | |
| Calcium carbonate (CaCO3) | Merck | 1.02067.0500 | |
| Imidazole | VWR | 24720.157 | |
| Magnesium chloride hexahydrate (MgCl2.6H2O) | Merck | 1.05833.0250 | |
| Magnesium chloride solution (MgCl2 1M) | Sigma | M1028 | |
| N,N-Bis(2-hydroxyethyl)taurine (BES) | Sigma | B9879 | |
| Phosphocreatine dissodium salt hydrate (Na2PCr) | Sigma | P7936 | |
| Potassium chloride (KCl) | Merck | 1.04936.1000 | |
| Potassium hydroxide (KOH) | Merck | 8.14353.1000 | |
| Propionic acid (C3H6O2) | Merck | 8.00605.0500 | |
| Silicone Squeeze Tube | Marineland | 31003 | |
| Tritiplex (EGTA) | Merck | 1.08435.0025 | |
| Triton® X-100 10% | Merck | 648463 | |
| Tissue homogeneizer (GKH GT Motor Control) | Terre Haute Glas-col | ||
| Length Controller (Model 315C-I) | Aurora Scientific | ||
| Force Transducer (Model 403 A) | Aurora Scientific | ||
| Software ASI 600A | Aurora Scientific | ||
| Sotware VSL (Model 900B) | Aurora Scientific | ||
| Inverted Microscope (IX51) | Olympus |
References
- Leite-Moreira, A. M., et al. Stretch-induced compliance: a novel adaptive biological mechanism following acute cardiac load. Cardiovascular Research. 114 (5), 656-667 (2018).
- Falcao-Pires, I., Fontes-Sousa, A. P., Lopes-Conceicao, L., Bras-Silva, C., Leite-Moreira, A. F. Modulation of myocardial stiffness by β-adrenergic stimulation - its role in normal and failing heart. Physiological Research. 60 (4), 599-609 (2011).
- Cokkinos, D. V. . Introduction to Translational Cardiovascular Research. , 371-387 (2015).
- van der Velden, J., Stienen, G. J. M. Cardiac Disorders and Pathophysiology of Sarcomeric Proteins. Physiological Reviews. 99 (1), 381-426 (2019).
- Garnier, D. Attachment procedures for mechanical manipulation of isolated cardiac myocytes: a challenge. Cardiovascular Research. 28 (12), 1758-1764 (1994).
- Brady, A. J. Mechanical properties of isolated cardiac myocytes. Physiological Reviews. 71 (2), 413-428 (1991).
- Falcao-Pires, I., Leite-Moreira, A. F., Cokkinos, D. V. Chapter 20. Introduction to Translational Cardiovascular Research. 20, 371-387 (2015).
- Liang, W. Teaching calcium-induced calcium release in cardiomyocytes using a classic paper by Fabiato. Advances Physiology Education. 32 (1), 1-10 (2008).
- Roche, S. M., Gumucio, J. P., Brooks, S. V., Mendias, C. L., Claflin, D. R. Measurement of Maximum Isometric Force Generated by Permeabilized Skeletal Muscle Fibers. Journal of Visualized Experiments. (100), e52695 (2015).
- Huxley, A. F. Muscle structure and theories of contraction. Progress Biophysics and Biophysical Chemistry. 7, 255-318 (1957).
- Sequeira, V., et al. Synergistic role of ADP and Ca(2+) in diastolic myocardial stiffness. Journal Physiology. 593 (17), 3899-3916 (2015).
- Edes, I. F., et al. Rate of tension redevelopment is not modulated by sarcomere length in permeabilized human, murine, and porcine cardiomyocytes. American Journal Physiology Regulatory Integrative Comparative Physiology. 293 (1), R20-R29 (2007).
- King, N. M., et al. Mouse intact cardiac myocyte mechanics: cross-bridge and titin-based stress in unactivated cells. Journal General Physiology. 137 (1), 81-91 (2011).
- Hamdani, N., et al. Myocardial titin hypophosphorylation importantly contributes to heart failure with preserved ejection fraction in a rat metabolic risk model. Circulation Heart Failure. 6 (6), 1239-1249 (2013).
- Miranda-Silva, D., et al. Characterization of biventricular alterations in myocardial (reverse) remodelling in aortic banding-induced chronic pressure overload. Scientific Reports. 9 (1), 2956 (2019).
- Rodrigues, P. G., et al. Early myocardial changes induced by doxorubicin in the nonfailing dilated ventricle. American Journal Physiology Heart Circulatory Physiology. 316 (3), H459-H475 (2019).
- van der Velden, J., et al. Alterations in myofilament function contribute to left ventricular dysfunction in pigs early after myocardial infarction. Circulation Research. 95 (11), e85-e95 (2004).
- Wakili, R., et al. Multiple potential molecular contributors to atrial hypocontractility caused by atrial tachycardia remodeling in dogs. Circulation: Arrhythmia Electrophysiology. 3 (5), 530-541 (2010).
- Ait Mou, Y., le Guennec, J. Y., Mosca, E., de Tombe, P. P., Cazorla, O. Differential contribution of cardiac sarcomeric proteins in the myofibrillar force response to stretch. Pflugers Archiv. 457 (1), 25-36 (2008).
- Falcao-Pires, I., et al. Diabetes mellitus worsens diastolic left ventricular dysfunction in aortic stenosis through altered myocardial structure and cardiomyocyte stiffness. Circulation. 124 (10), 1151-1159 (2011).
- Lim, C. C., et al. Anthracyclines induce calpain-dependent titin proteolysis and necrosis in cardiomyocytes. Journal Biology Chemistry. 279 (9), 8290-8299 (2004).
- Woulfe, K. C., et al. A Novel Method of Isolating Myofibrils From Primary Cardiomyocyte Culture Suitable for Myofibril Mechanical Study. Frontiers Cardiovascular Medicine. 6, 12 (2019).
- Ait Mou, Y., Bollensdorff, C., Cazorla, O., Magdi, Y., de Tombe, P. P. Exploring cardiac biophysical properties. Global Cardiology Science Practice. 2015, 10 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved