Method Article
使用皮肤心肌细胞进行心脏功能的体外评估
* 这些作者具有相同的贡献
摘要
该协议旨在逐步描述使用皮肤心肌细胞提取和评估心脏功能的技术。这种方法允许测量和急性调节肌黄化功能使用小型冷冻活检,可以从不同的心脏位置,从小鼠到男性收集。
摘要
在这篇文章中,我们描述了分离单个渗透("皮肤")心肌细胞并将其连接到力测量装置和运动以进行功能研究所需的步骤。这些研究将允许测量心肌细胞刚度(被动力)及其激活与不同的钙(Ca2+)包含的解决方案,以确定,除其他外:最大力的发展,肌功能Ca2+-敏感性(pCa50),合作率(nHill)和力重建率(ktr)。这种方法还能够确定药物对肌黄细胞的作用,以及外源重组蛋白对心肌细胞的活性和被动特性的表达。临床上,皮肤心肌细胞研究突出了许多心肌疾病的病理生理学,并允许体外评估针对心肌病的治疗干预的影响。总之,这项技术通过研究动物模型中的体外和体内参数与开放心脏或移植手术中获得的人体组织中的相关性,从而能够澄清心脏病理生理学。
引言
传统上,心肌机械性能的评估主要尝试在多细胞制剂,如心肌和脑膜1,2。多细胞心脏肌肉条包括细胞的异质群,包括具有未知方向和力生成模式的收缩性心肌细胞、电活动和应力/应变分布以及周围的结缔组织基质3、4。没有胶原蛋白和含有单个心肌细胞的制备将允许以非常精确和控制的方式测量沙康长度和跨桥收缩特性5,6。因此,在过去四十年中,开发了几种方法,允许研究单个心肌细胞6,7的机械、收缩和松弛特性。这些细胞的收缩功能强烈依赖于沙康长度和跨桥循环动力学3。因此,最好直接研究单个分离心脏细胞中的肌肉功能,因为它允许评估沙康长度和性能,以及跨桥功能和收缩特性。然而,在 +N 级别记录力测量时,以合理的光学沙康分辨率隔离和附加功能性心肌细胞仍然是具有挑战性的,并且正在演变 3,6。其他挑战是需要安装的物流,以将心肌细胞从新收集的活检中分离。例如,人类活检收集的不可预测性可能危及实验的可行性。
此外,关于科学程序(3R原则)动物实验的替换、减少和细化的伦理问题促进了细胞和组织层面的研究变化,最好是在人体活检中,或在较小的动物样本中。事实上,逐步改进的方法,以评估心脏功能在体外在较小的复杂水平允许适当的整合的结果到全身,并把它们转化为临床场景7。总之,使用储存在-80°C的样品提取心肌细胞可能是一个有吸引力的替代方案。
心肌组织被切成小块,用迫击炮和刺骨均匀化。这种均质化的结果是悬浮皮肤捆绑和分离的细胞与不同程度的肉瘤损伤,其中短质暴露在沐浴介质和所有细胞成分被冲走。结构,如肌骨,远离肉瘤被保留。因此,与 myofibrillar 仪器相关的沙康缩短和功能属性保持不变,可以记录8,9。
心肌细胞力测量系统由用于调整心肌细胞长度的电磁电机和测量等轴测心肌细胞收缩的力传感器组成。渗透或剥皮的心肌细胞被放置在一个实验室中,其中包含一个放松溶液([Ca2]& lt; 10 nM),硅粘附在2根细针上:一根连接到电机,另一根连接到力传感器。光学系统用于确定心肌细胞形态和沙康长度。实验方案通常包括一系列在缓冲溶液上进行力记录,这些缓冲溶液包含不同的Ca2+浓度,确定行为素-肌素跨桥动力学,以及测量在预定义sarcomere长度下所装心肌细胞的被动张力(图1)。从冷冻在液氮中的心肌样品中分离渗透性心肌细胞(随后储存在-80°C)是一种利用细胞力学和蛋白质生物化学测量最大Ca2+-激活(活性)力的技术(T活性,kN+m-2),Ca2°-独立(被动)张力(T被动,kN=m-2),myofilamentsCa2+-灵敏度(pCa50),myofilaments合作率(nHill),力重建率(ktr)以及T主动、T被动、pCa50、nHill和ktr的sarcome长度依赖关系。
该协议的目标是说明和总结心肌细胞力测量系统作为评估从不同物种冷冻样本中分离出的单皮心肌细胞的功能力学特性的可靠程序的潜力。
研究方案
所有动物实验均符合《实验室动物护理和使用指南》(NIH出版物第85-23号,2011年修订)和葡萄牙动物福利法(DL 129/92,DL 197/96);P 1131/97)。地方当局批准了这项实验议定书(018833)。
1. 库存溶液制备 (表1)
- 按照表2中的说明,为心肌细胞的分离(RELAX-ISO)准备1,000 mL的 放松溶液。在 500 mL 中≈上述试剂,用 KOH 将 pH 调整为 7.0。将最终音量调整到 1000 mL。
- 在 50 mL 管中分配 RELAX-ISO。储存在-20°C。
- 按照表3中的说明 准备 250 mL 的激活溶液。将上述试剂溶解在≈100 mL的超纯水中。在 15 °C 下,用 5 M KOH 将 pH 调节至 7.1。
注:通常,需要添加大量 KOH 才能达到所需的 pH 值。将体积气球放入带冰的盒子里,将溶液冷却至15°C。- 将最终音量调整到 250 mL。使用磁力搅拌器持续搅拌此溶液,直到与放松溶液混合。
- 按照表4中的 说明准备 100 mL 的放松溶液。将上述试剂溶解在≈50 mL的超纯水中。在 15 °C 下,用 KOH 5 M 将 pH 调节至 7.1。
注:通常,需要添加大量的 KOH 才能达到 pH 7.1。将体积气球放在装满冰的盒子里,将溶液冷却至15°C。 测量过程中使用的溶液的离子强度为 180 mM。- 将最终音量调整为 100 mL。使用磁力搅拌器持续搅拌此溶液,直到将溶液与激活溶液混合。
- 混合激活和放松解决方案的比例在表 5 中显示,以获得 5.0 和 6.0 之间的 pCa 解决方案。
- 始终保持放松和激活解决方案,同时混合两者。
- 将每种混合物加入2 mL微管。将所有微管储存在-20°C。
- 为每个协议准备一批不同的 pCa 解决方案 (4.5 到 6.0)。
2. 力传感器的校准
注:力传感器的校准是一个常规程序,应每隔几个月或何时怀疑未校准。力传感器高度敏感,容易损坏。在使用的每一步中,都应轻轻处理,包括校准、粘胶心肌细胞和清洁。
- 将力传感器从设备的其余部分中拆下。
- 在夹子的帮助下,将力传感器水平放置,使针头向下指向心肌细胞将形成力的同一方向。这将促进悬挂一系列已知重量(弹性带、缝合线或针)的质量。
注:在继续此步骤之前,请检查力传感器的特性,以检查刻度因子 [mg/volt],并避免传感器的重量过大。对于力传感器模型,比例因子为 50(50 mg 对应于 1 伏),我们使用 5 个重量介于 12.5 和 250 mg 之间。 - 打开力传感器,让它预热 30 分钟。
- 首先将较轻的质量悬挂在力传感器上,然后记录在力输出时测量的相应电压。
- 对最多五个权重重复此过程。
- 应用于力传感器(负载)与电压的绘图力,并检查线性度。
- 如果没有线性度,则调整传感器电路板中的零并获取电位计。请查看其特定说明以了解更多信息。
- 转动零电位计,直到输出电压读数为 0.0 V。
- 在传感器指针上施加中等重量,并调整增益电位计以读取相应的电压(例如,50 mg 对应于 1 V)。移除重量,将零电位计重新调整为 0.0。
- 重复步骤 2.6.2,直到带重量和没有重量的输出正确。
- 将力传感器安装回设备。
3. 设置实验装置
- 解冻每个激活的一小瓶, 4.5, 5.0, 5.2, 5.4, 5.6, 5.8, 6.0 和放松溶液,并保持他们在冰上。
注:ATP 和 PCr 是应在低温下保持的实验室化合物。 - 准备显微镜、测试仪器和相关计算机使用(图1)。
- 调节温度,使室内温度计读数为 15 °C。 在此温度下执行所有实验,但激酶和磷酸酶孵化(20°C)除外。
- 打开力传感器和电机。
4. 皮肤心肌细胞的提取和渗透
- 解冻 50 mL 的 RELAX-ISO 溶液。
- 打开离心机,快速冷却至 4 °C。
- 在含有 2.5 mL 的 RELAX-ISO 溶液的培养皿中解冻 3-5 μg 的心肌样品。
- 用手术刀刀片将组织切成小块(图2)。精确切割样品,避免不必要的细胞损伤。
- 使用切割移液器尖端将 2.5 mL 的 RELAX-ISO 溶液与组织一起转移到 Potter-Elvehjem 玻璃上。
- 以转速为 30-40 rpm 的磨床机械地破坏组织。按组织3次,每次2s,以获得良好的细胞悬浮液。
- 在 RELAX-ISO 溶液中制备 10% Triton(250 μL 的 Triton,2.25 mL 的 RELAX-ISO)在 15 mL 管中,并将此溶液添加到细胞悬浮液中。
- 通过反转管子轻轻混合3次。
- 在室温下孵育1分钟,在冰上孵育4分钟。
- 通过将 RELAX-ISO 添加到 15 mL 管的顶部来清洗 Triton;轻轻混合(反转3倍管),最后在倾斜的离心机中旋转细胞(348 x g时为1 分钟)。将上一液去除至细胞颗粒上方 3 mL。
注:轻轻取出上一提液,避免干扰细胞颗粒。尽管如此,上一液中的一些细胞将不可避免地丢失。 - 重复步骤 4.10 至少 4 次,或直到不再观察到 Triton 残留物产生的气泡。
注:洗出步骤越快,丢弃的上一级细胞丢失的细胞就多。 - 在上次洗涤时,去除高达 5-10 mL 细胞悬浮液的上一级。
5. 选择和粘合皮肤心肌细胞
- 将电池悬架滴放在显微镜幻灯片架玻璃滑梯顶部的盖玻片上(图 1)。
- 选择具有良好条纹模式和大小的单杆形心肌细胞(图2)。
- 使用倒置显微镜的最低放大倍率查找力传感器和电机的针尖。
- 旋转盖玻片以水平定位选定的心肌细胞,以便其末端与力传感器和电机的指针对齐(图 2)。
- 在拭子尖端的帮助下,在盖玻片的一侧放置一条细细的胶水线(图2)。
- 将力传感器和电机的针尖浸入胶线,在两个尖端周围形成胶晕。
注:步骤 5.6 - 5.10 是通过小心使用电动微定位器完成的。 - 快速移动针尖靠近心肌细胞的焦平面。
- 向下移动力传感器的针尖,使其粘附到心肌细胞的一个边缘。
- 使用马达的尖端和细胞的其他四肢重复此过程。
注:此过程必须少于 2-3 分钟,因为胶水开始固化非常快。 - 5-8分钟后,将针头≈15μm,以避免将细胞粘合到盖玻片上。这是通过同时向上移动两个微操纵器完成的。
- 让胶水固化。此过程可以持续 15 到 45 分钟,具体取决于胶水的类型。在我们的案例中,心肌细胞在15分钟后被≈充分粘。
6. 记录主动、被动和 Ca2+ 灵敏度的力 测量
- 用放松溶液(实验装置中的55-100μL)填充第一个实验井,用激活溶液填充第二个实验井。
- 使用相机软件,将感兴趣区域 (ROI) 放在心肌细胞的一个区域,并具有清晰的条纹模式。
注:对于心脏菌体,手术沙康长度在1.8和2.2μm之间变化,最佳沙体长度约为2.15μm。 - 在设置最佳沙球长度(2.2 μm)后,测量心肌细胞的两个极端(从电机到传感器胶水光晕,图 3)之间的距离。在软件中将值记录为菌细胞长度。
- 测量心肌细胞的宽度和深度,后者借助垂直于细胞的棱镜。
注:需要强大的外部光源,通过棱镜使细胞可视化。如果没有棱镜,假设心脏细胞具有椭圆形,心肌细胞深度可以推断为70%的心肌细胞宽度。 - 计算横截面面积(CSA,mm2),假设心肌细胞的椭圆形。

- 轻轻移动显微镜舞台,使细胞从盖玻片移动到舞台背面含有放松溶液的井。
注:此过程很容易损坏电池。在移动细胞之前,轻轻向上移动针头。避免将单元格从溶液中移除。 - 在包含两个单元格缩短(初始长度的 80%)的软件中选择协议,当单元格出现在 Ca2+ 解决方案和放松解决方案中时,将分别出现该协议(图 1,补充文件)。
注:第一个"松弛"的细胞将在激活溶液中执行,第二个"松弛"将在放松的溶液中执行。通过这样做,用户将能够计算从 1 的单元格的总力(F总计)和从 2 的单元格的被动力(F被动) 。使用公式计算有动力,F主动= F总- F无源。细胞缩短80%,以分离所有跨桥记录力。 - 通过移动显微镜阶段来激发等轴对称收缩,使心肌细胞从放松移动到激活溶液(pCa=4.5(1)。。
注:如果单元格正常工作,它将立即收缩。 - 到达力高原时,开始记录力数据。
注:测试可以单独完成。根据软件的不同,可以创建一系列测试,这些测试将对应于 Ca2+ 灵敏度协议中不同的 Ca2+解决方案(图 1,补充文件)。 - 等待 ±10 s,然后切换浸入激活溶液中的单元。
注意:重要的是等待10s之前,浸入放松的解决方案细胞。如果单元格移动太早,则计算单元格重新开发力(ktr 值)的重要数据可能会丢失。 - 快速移动舞台,使心肌细胞沉浸在放松的解决方案中。
- 等待测试停止。
- 重复步骤 6.8 - 6.12,使单元在激活溶液中激活两次 (pCa=4.5(2)。)。
注:通常,在第一次激活后,心肌细胞末端可以稍微脱离针尖,改变心肌细胞长度、CSA和/或沙康长度。重新调整所需的沙康长度,并在软件中引入校正尺寸。- 继续步骤 6.13.2 为 Ca2+ 灵敏度协议或 保存数据,如果细胞的被动和主动力值是所需的唯一参数,并分离细胞从针和清洁他们用丙酮去除胶水。
- 如有必要,通过稍微拉伸细胞,将细胞的沙状长度调整为2.2 μm。
- 将激活溶液替换为下一个 Ca2+ 解决方案 (此处为 55-100 μL)。重复步骤 6.8 - 6.12。
- 将激活解决方案替换为下一个 Ca2+ 解决方案(此处为 55-100 μL),并重复步骤 6.8 - 6.12,直到所有解决方案都经过测试(5.0、5.2、5.4、5.6、5.8、6.0)。
- 最后,使用激活溶液(pCa4.5(3)重新激活单元。重复步骤 6.8- 6.12。
7. 与激酶和磷酸盐的孵育
- 执行选定的基线协议后,在推荐浓度下稀释放松溶液中的激酶/磷酸酶。
注:建议在实验前执行剂量-响应曲线。 - 将实验井的温度设置为 20°C。
- 用激酶/磷酸酶、放松溶液和活化溶液(55-100μL)填充实验井。
- 轻轻移动显微镜阶段,使细胞浸入含有激酶/磷酸酶的井中。
- 使用激酶/磷酸酶孵育心肌细胞至少30分钟,或根据制造商的说明。
- 重复选定的基线协议。
8. 完成实验
- 通过拉伸细胞,将心肌细胞从力传感器和马达的尖端解合。
- 使用浸在丙酮中的棉签小心地从针尖上取下胶水晕。
- 关闭设备。
9. 分析数据
- 收集每个经测试的心肌细胞的所有文件。
注:每个测试将对应于一个文件。这意味着对于每个 Ca2+ 解决方案或 sarcomere 长度,将有一个相应的文件。 - 计算单个心肌细胞的主动和被动力。
- 使用电子表格打开与首次激活对应的文件(pCa=4.5(1))(图3A,补充文件中的附录A)。
注意:我们使用定制的程序来执行分析。请参阅 补充文件中的 附录 A。 - 单元格≈第1 个松弛后(当单元格浸入 Ca 2+ 溶液时),平均值 ≈60 值)之前和平均值≈60 值 )。这 2 个值分别对应于 a 和 b。
- 对细胞的二次松弛重复 相同的分析(当细胞浸入放松溶液中时)。这 2 个值分别对应于 c 和 d。
- 计算 a 和 b 之间的差值(总力,F总计)。
- 计算 c 和 d 之间的差值(被动力,F被动)。
- 计算有源力,F主动 =F 总计 - F被动。
- 将所有力值标准化为 CSA(见上文公式),以获得总张力(T总计)、被动张力(T被动)和主动张力(T主动)。
- 对于第 2 次激活(pCa=4.5(2))重复步骤 9.2.1 到 9.2.5。
- 将这些值视为在分析中表示心肌细胞的T总计、T主动值和T源值。
注:使用 pCa4.5(1) 首次激活单元格通常与单元格尺寸的更改相关。因此,使用 pCa4.5 进行第二次激活更准确,并且是要使用的激活。 - 对于每个文件/pCa 测试的解决方案(5.0、5.2、5.4、5.6、5.8、6.0、4.5(3),重复步骤 9.2.1 到 9.2.5。
- 使用电子表格打开与首次激活对应的文件(pCa=4.5(1))(图3A,补充文件中的附录A)。
- 计算单个心肌细胞的 pCa50 和 nHill。
注意:对于此分析,请使用文件 4.5(2)、5.0、5.2、5.4、5.6、5.8、6.0 和 4.5(3) 中的非规范化F 活动值。- 将测试的每个 Ca2+ 解决方案(4.5(2)、5.0、5.2、5.4、5.6、5.8、6.0、4.5(3))的所有非规范化 F 值放在电子表格文件中。
- 计算校正系数 = F活动 [4.5(2)] - F活动 [4.5(3)] / 7。
- 通过减去 F 活动校正系数 ,计算每个 Ca2+ 解决方案(5.0、5.2、5.4、5.6、5.8、6.0)的 F活动 值。
- 通过按相应的修正值对每个 F 活动值进行规范化,计算每个Ca 2+解决方案的相对力 (F 相对 )。
注:F相对 [4.5(3)] 应等于 1。每个实验协议以饱和 Ca 2+ 浓度(pCa4.5(2) 和 4.5(3))的控制激活开始和结束。这允许通过比较最大 Ca2+激活力(F最大值 ) 的变化,使准备的运行与评估生效。如果在实验方案结束时,心肌细胞产生的不到第一次收缩最大力的70%,则该细胞/测量应排除在分析之外。 - 使用 F相对值 和相应的 pCa 值适合与以下方程 F(Ca) = Canhill/ (Ca50 nHill = Canhill 的 sigmoidal曲线。
- 从上述方程中推断 pCa 和 nHill 值。
- 计算单个心肌细胞的力重建率(ktr)。
- 对曲线执行与 1 st 单元格松弛后的值对应的拟 合。
- 计算曲线的斜率,此值将对应于力重建速率。
- 对每个 Ca 2+ 解决方案重复步骤 9.4.1 和9.4.2。
注:对于最低的 Ca 解决方案 (R 平方≤ 0.90),曲线拟合不良。
结果
功能渗透性心肌细胞应在整个实验中均匀且具有一致的条纹模式。虽然经过长期实验,预计有一定程度的恶化和力降低,但活动张力值应相对稳定。应排除表现出条纹损失或显著力下降的明显迹象的细胞(< 15kN=m-2 或 <80% 的初始活动力)。 表6 显示了从啮齿动物、猪和人类样本中得出的最重要参数的预期正常值。
获得的参数主要取决于所选协议。图 5显示了 3 的代表性力跟踪,8 个中,执行 myofilaments Ca2+ 灵敏度协议所需的力记录。通过将细胞转移到含有激活溶液的井中,心肌细胞开始形成力量,直到它到达高原。经过快速松弛测试(持续时间为 1 ms),心肌细胞缩短到其长度的 80%,我们获得零力的基线值。松弛测试后,细胞继续形成力量,因为它浸入激活溶液。总力(F总计 ) 通过从最小值中减去高原值来计算。此曲线最后一部分的斜率为我们提供了力重建率 (ktr) 的值 (图6),这是跨桥连接和分离 (fapp和 gaap)10的明显速率的度量。当 ktr R2值为 <0.90 时,应排除 ktr 值,并且通常发生在较低的 Ca2+浓度(pCa 5.6、5.8 和 6.0)。将细胞转移回含有放松溶液的井后,细胞放松,其力下降。被动力(F无源)的计算方法是将最小值(在长时间细胞缩短后获得)减去到这一新的力值。主动力产生于F总和F无源之间的差值。
心肌细胞特征的最大主动和被动力是从第二细胞激活中派生的,具有饱和的 Ca2+-解 (pCa = 4.5)。第一次激活通常被丢弃,因为通常需要重新调整沙康长度。
要执行 myofilament Ca2+- 灵敏度协议,必须至少执行 9 次激活测试(4.5;4.5;5.2;5.6;6.0;5.0;5.4;5.8 和 4.5)。此序列只是示例,但应始终以 4.5 (两次) 开始,以 4.5 结束。补充文件图1中描述了用于图像Ca2+灵敏度协议的数据采集软件的编程。
计算所有这些激活解决方案的主动力后,检查上次激活是否产生超过初始最大力的 80%(否则,此单元格结果应丢弃,如上所述)。为了纠正实验系列中F最大值的下降,可以使用插值的F最大值来规范化数据点。规范化数据可以适合与以下方程F(Ca)= Canhill/(Ca50nHill = Canhill的西形曲线)。获得的参数值表示钙敏感性(Ca50,可转换为 pCa50)和合作性(nHill)。将所有力值规范化为横截面区域后,都可以转换为张力值。除了 myofilament Ca2+- 灵敏度和长度相关的激活协议,还可以执行其他测试。T主动、T无源(图7)和心肌细胞残余力的沙康长度依赖性就是这种情况。残余力记录根据在细胞长度变化(80%)后达到的初始力恢复(pCa 4.5)计算并规范化到长度变化11之前达到的每个总稳态力。残余力的增加通常表示具有缓慢分离动力学和较高刚度的跨桥。
最后,我们应该强调,这种技术可以在从冷冻或新鲜收集的样品中机械提取的剥皮心肌细胞中进行,以及分离的酶,然后其膜的渗透。心肌细胞的分离方式对该技术得出的结果有显著影响。 图 8 显示了三种隔离程序之间的差异。

图1:测试装置的集成方案。 测试仪器包括显微镜、微机和相关计算机。图的底部显示一个皮肤心肌细胞粘在电机和力传感器之间。 请单击此处查看此图的较大版本。

图2:细胞分离、渗透和粘合协议的流程图。 左上角的图像由4个图像组成,显示Petri盘中的 RELAX-ISO 溶液(A) 中的心脏样本片段,( B) 在用于组织机械均质的管子中,( C) 均质器, (D) 组织在均质化后立即和 ( E ) 组织在三元渗透管中。 请单击此处查看此图的较大版本。
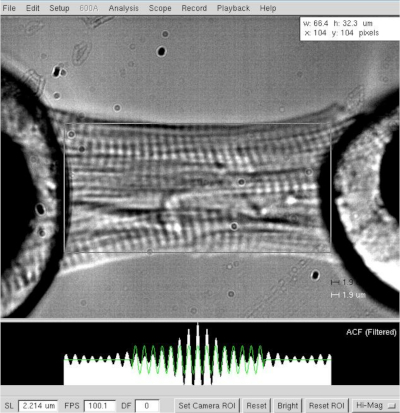
图3:皮肤心肌细胞的长度和沙康长度的测定。 以≈2.2 μm的像素长度和宽度确定 。请点击这里查看这个数字的较大版本。
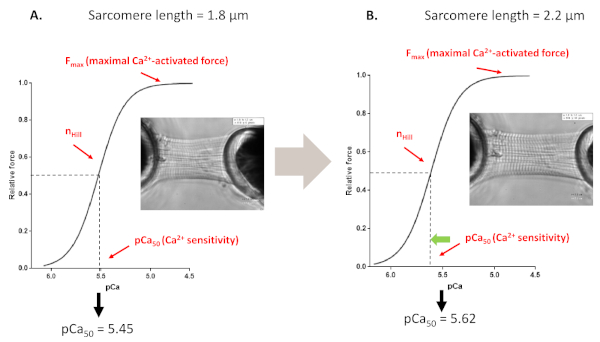
图4:长度依赖的激活协议(在体外模仿弗兰克星形机制)。在(A,1.8 μm)之前和将心肌细胞拉伸至 2.2 μm(B)之前执行的 Ca 2+ 灵敏度协议得出的代表性力跟踪和参数。请单击此处查看此图的较大版本。
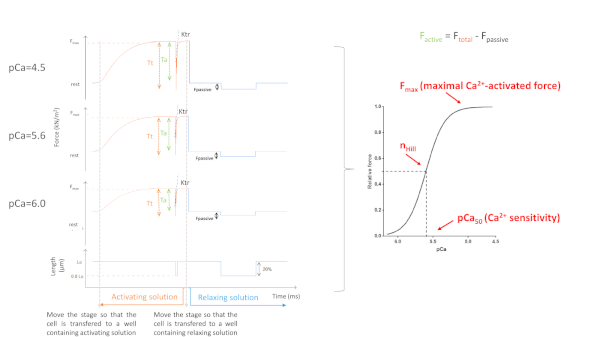
图5:MyofilamentsCa2+-灵敏度协议。代表性力跟踪和派生参数。为了简单起见,仅描绘了 8 条力曲线的 3 条。即与饱和性激活的心肌细胞,中间和最低 Ca2+含溶液(分别 4.5、5、6 和 6.0)。请单击此处查看此图的较大版本。

图6:在不同钙溶液和各自的ktr拟合曲线上激活的小鼠心脏细胞的代表性痕迹。 (A) pCa 4.5;(B) pCa 5.0;(C) pCa 5.2;(D) pCa 5.4;(E) pCa 5.6;(F) pCa 6.0 和 E 值,用于总、被动和主动张力、ktr 值和 Rsquare 表示 ktr 拟合。 请单击此处查看此图的较大版本。
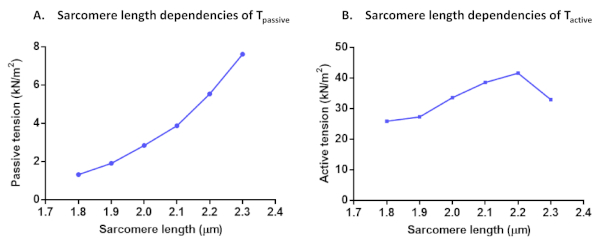
图 7:T 无源 (A) 和T 主动 (B) 的沙康长度依赖性协议。被动张力和主动张力在单一心肌细胞中计算,长度为1.8μm至2.3μm。请点击这里查看这个数字的较大版本。
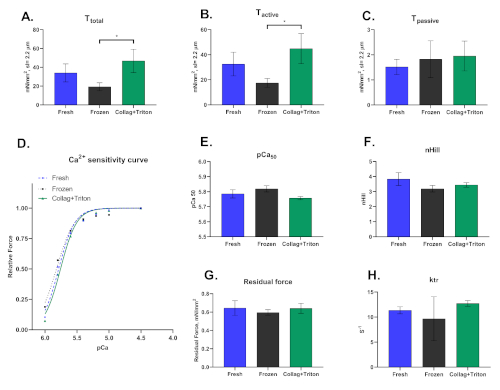
图8:心肌细胞机械分离从新鲜("新鲜")和冷冻心肌样本("冻结")以及胶原酶消化的心脏(修改朗根多夫技术)与后渗透与特里顿("科拉格-特里顿")代表性的结果。( A )总张力值 ,(B) 活性张力和 ( C ) 心肌细胞的帕西斯维张力在 2.2 μm. ≈ (D) 钙敏感度曲线和 ( E ) pCa50 和 (F) nHill) 的相同值下用 pCa 4.5 溶液激活。(G) 残力和 (H) ktr 值以最大激活溶液 (pCa 4.5) 计算。请单击此处查看此图的较大版本。
补充文件。请点击这里下载此文件。
| 存储在 | 库存解决方案 | [M] | 最终音量(mL) | 重量/体积 | 笔记 |
| 4°C | 氢氧化钾 | 1 | 100 | 5.611 克 | 调整 pH |
| 4°C | 氢氧化钾 | 5 | 50 | 14.03 克 | 调整 pH |
| 4°C | Bes | 1 | 50 | 10.66 克 | |
| 4°C | 丙酸 | 1 | 100 | 7.483 mL | 使用 5M 或 1M KOH 将 pH 调整为 7.0 |
| 4°C | CaEGTA 由以下部分组成: | 0.1 | 100 | 将溶液混合加热至60°C超过1小时。使用 1M KOH 将 pH 调整为 5-6。 | |
| - 可可3 | 0.1 | 1.001 g | |||
| - 奶嘴 (EGTA) | 0.1 | 3.804 |
表1:库存解决方案准备说明。
| 放松-ISO(用于心肌细胞的隔离) | [m] | 重量 |
| Na2ATP | 5.95 | 3.28 克 |
| MgCl2.6H2O | 6.04 | 1.23 克 |
| 特里蒂普莱斯 (EGTA) | 2 | 0.76 克 |
| Lck | 139.6 | 10.41 克 |
| 米达佐尔 | 10 | 0.68 克 |
表 2:放松-ISO 解决方案制备说明。
| 激活解决方案(用于测量) | [m] | 重量/体积 |
| Na2ATP | 5.97 | 0.823 克 |
| Mgcl 1M | 6.28 | 1.57 mL |
| 丙酸 | 40.64 | 10.16 mL |
| Bes | 100 | 25 mL |
| CaEGTA(以前准备的库存解决方案) | 7 | 17.5 mL |
| Na2PCr | 14.5 | 0.925 克 |
表 3:激活解决方案准备的说明。
| 放松解决方案(用于测量) | [m] | 重量/体积 |
| Na2ATP | 5.89 | 0.325 克 |
| Mgcl 1M | 6.48 | 0.65 mL |
| 丙酸 | 40.76 | 4.08 mL |
| Bes | 100 | 10 mL |
| 提特里普莱斯 (EGTA) | 6.97 | 0.265 克 |
| Na2PCr | 14.5 | 0.370 克 |
表4:放松溶液制备的说明。
| pCa = - 日志 [Ca2]| | 放松 (pCa=9.0) 毫升 | 设想 (pCa=4.5) 毫升 |
| 5 | 0.86 | 39.14 |
| 5.1 | 1.2 | 38.80 |
| 5.2 | 1.54 | 38.46 |
| 5.3 | 2 | 38.00 |
| 5.4 | 2.51 | 37.49 |
| 5.5 | 3.14 | 36.86 |
| 5.6 | 3.89 | 36.11 |
| 5.7 | 4.8 | 35.20 |
| 5.8 | 5.89 | 34.11 |
| 5.9 | 7.14 | 32.86 |
| 6 | 8.57 | 31.43 |
表 5:pCa 解决方案制备说明。
| 参数 | 啮齿动物 | 猪 | 人类 |
| 活动张力,kN.m-2 (在 2.2 μm) | 17 – 28 | 19 – 40 | 19 – 36 |
| 被动张力,kN.m-2 (在 2.2 μm) | 3.6 – 5.5 | 1.9 – 6.8 | 1.8 – 2.3 |
| pCa50 | 5.58 – 5.64 | 5.40 – 5.50 | 5.43 – 5.82 |
| 恩希尔 | 2.60 – 2.76 | 2.95 – 3.36 | 2.99 – 3.10 |
| ktr, s- 1 | 4.00 – 8.00 | 1.00 – 3.00 | 0.90 – 2.00 |
表6:从啮齿动物、猪和人类的单一渗透性心肌细胞中得出的典型参数和指数。 改编自12.
| 问题 | 可能的原因 | 解决 方案 |
| 心肌细胞在最大激活期间分离 | 粘合时间不足;胶水很旧,已经干了 | 增加粘合步骤的时间;考虑打开一个新的胶管。 |
| 细胞悬浮®中存在 Triton,无法再移除 | 使用一个或两个额外的 Triton ®步骤重复提取过程 | |
| 心肌细胞在控制条件下具有低力 | 提取出错,并交付低质量的细胞 | 增加样本大小并进行新的提取。如果问题仍然存在可能是由于样本收集不当 - 丢弃此示例 |
| 细胞明显收缩,但没有力记录;单元格具有异常的力值 | 力传感器关闭 | 打开它 |
| 力传感器校准良好 | 使用一组已知重量校准力传感器(检查制造商的说明手册)。 | |
| 力传感器指针松动 | 再次使用水晶粘结509或珠宝商蜡粘合针头。 | |
| 条纹模式不够好,无法确定沙康长度 | 光线不足 | 增加显微镜光或将细胞移回盖玻片,并再次评估沙康长度(孔具有较低的光强) |
| 提取出错,并交付低质量的细胞 | 增加样本大小并进行新的提取 | |
| 针头不在同一平面上 | 使用微操纵器,向上或向下调整针头,直到找到一个聚焦的沙康 | |
| 采集过程中无长度和/或力变化 | 电机或力传感器关闭 | 打开它们 |
| 电机损坏,不产生电池缩短 | 更换或尝试使用功能生成器校准 | |
| 采集录像上噪音太大 | 设备周围气流太多 | 保护设备免受直接气流的直接影响 |
| 设备周围振动太多 | 建议使用稳定表。即便如此,建议移除任何可能具有压缩机或发出振动的设备(冰柜、冰箱) | |
| Ca2+- 灵敏度曲线具有奇怪的值,并且力值不会随着 [Ca2] 而增加。 | 激活和放松溶液的混合物没有正确完成(检查方法部分的 3.10 到 3.14,可能是因为混合不足) | 以相同的浓度解冻小瓶,在同一杯杯机中收集所有小瓶的含量,与搅拌器混合并再次分裂。在新单元格中再次测试这些解决方案。如果这确实解决了问题,请准备一批新的包含 Ca2+的解决方案 |
表 7:故障排除表。
讨论
使用皮肤心肌细胞对心脏功能进行体外评估是澄清在生理(如拉伸)和病理环境中(如缺血)中发生在心肌细胞水平的修饰的重要技术。这种方法有几个优点,例如需要少量的心肌评估从解冻样品中获得的心肌细胞的功能;使用来自各种物种(小鼠13,大鼠1,14,15,兔子16,猪17,狗18,豚鼠19和人类20)和人类20)和人类20)和不同的心脏位置,包括心室,左心和右心室或梗塞心脏的特定区域。此外,该技术允许在测量调节结构和收缩结构在本机配置中的功能的同时,提供特定浓度的 Ca2+和能量 (ATP)。
尽管这种技术简单,但有一些关键步骤。从一开始就保证每个步骤的质量,包括样品收集,这一点至关重要。myofilament蛋白质易受蛋白酶21的影响。因此,在收集样品后立即将样品储存在液氮中。以前未冷冻的新鲜样品的力会显著提高,因此不建议在同一协议中混合在新鲜样品和冷冻样品中进行测量。第二个最关键的步骤是心肌细胞的提取。在此过程期间,在冰上保持样品的大部分时间都至关重要。蛋白酶抑制剂鸡尾酒可用于降低提取/渗透过程中蛋白质降解的风险。第三,样品应该削减在较小的部分使用精确的手术刀运动,因为我们注意到质量下降心肌细胞时,这一步骤被忽略。另一个关键步骤是清洗心肌细胞,因为很难在洗掉Triton(渗透细胞,但促进其脱粘)和保持尽可能多的细胞在上一代之间保持正确的平衡。重要的是首先尝试每个样品,物种或协议的抽取和洗涤数量。例如,在我们的手中,我们注意到ZSF1肥胖大鼠组织提取有一个"脂肪"方面,这使得这些细胞在粘合过程中更滑,但不难测量。我们绕过这个问题的方法是进行更多的实验,让每只动物拥有合理数量的细胞。此外,选择良好的细胞粘附,即具有良好的条纹和合理的长度,是至关重要的。如果心肌细胞没有这些功能,它大多会脱离针尖或发展无/低力。考虑到粘合的时间及其将细胞粘到针头的功效,使用正确的胶水进行心肌细胞附着也很重要。在我们手中, 硅胶胶 ( 材料表 )固化快 (10-15 分钟) 和足够强.最后,最后一个关键步骤与在粘合细胞后 5 分钟小心地抬起心肌细胞(避免将细胞粘合到盖玻片)和移动到孔之前(避免细胞被显微镜阶段拖动有关)。 表 7 总结了与此技术相关的故障排除、其根本原因以及克服常见问题的可能解决方案。
这种方法的主要限制是,它不能回答与 myofilament 收缩相关的所有问题,例如 imofilament 激活/停用的速度。在体内设置中,膜去极化,细胞内 Ca2+ 增加,其扩散到肌黄体需要发生,使肌细胞收缩,而在皮肤心肌细胞 Ca2+扩散到肌黄体时,当细胞被淹没在Ca2+ 溶液中时,立即发生。这种更快的Ca2+扩散速度将偏向我的失物激活/停用分析23。
这些实验受不同因素的影响,包括温度、溶液pH值、机械扰动(松弛-再拉伸与松弛)和细胞附着程序(针扎与胶水),所有这些变量都考虑到ktr和沙康长度依赖力4、12的相数差异。
该技术的未来进展包括进行功能研究,在完好无损,而不是渗透心肌细胞。这种技术缺点是依靠新鲜分离的心肌细胞(以前没有冷冻)。另一个与这种方法没有直接关系但可能严重影响它的重要问题与样品冷冻储存的最大期限有关。具体来说,必须确定整个储存时间(即冷冻样品的储存时间),以确保从提取的心肌细胞中提取的高质量功能数据)。
披露声明
提交人没有利益冲突。
致谢
作者感谢葡萄牙科学和技术基金会、欧洲联盟、国家环境研究所、欧洲区域科学基金会和竞争方案(COMPETE),为统一国际中心(UID/IC/00051/2013)研究单位提供资金。该项目由联邦贸易部通过竞争2020年支持 - 国际合作方案(POCI),项目DOCNET(NORTE-01-0145-FEDER-000003),由北葡萄牙区域业务方案(NORTE 2020)根据葡萄牙2020年伙伴关系协定支持, 通过欧洲区域发展基金(ERDF),NETDIAMOND项目(POCI-01-0145-FEDER-016385),由里斯本2020年区域业务项目欧洲结构和投资基金支持。Patrécia Rodrigues由FCT(SFRH/BD/96026/2013)资助,若昂·阿尔梅达-科埃略由波尔图大学/FMUP和FSE-Fundo欧洲社会大学资助, NOR 2020-计划地区多特,(NORTE-08-5369-FSE-000024-程序杜托莱。
材料
| Name | Company | Catalog Number | Comments |
| Acetone | Sigma | 34580 | |
| Adenosine 5’-triphosphate disodium salt hydrate (Na2ATP) | Sigma | A2383 | |
| Calcium carbonate (CaCO3) | Merck | 1.02067.0500 | |
| Imidazole | VWR | 24720.157 | |
| Magnesium chloride hexahydrate (MgCl2.6H2O) | Merck | 1.05833.0250 | |
| Magnesium chloride solution (MgCl2 1M) | Sigma | M1028 | |
| N,N-Bis(2-hydroxyethyl)taurine (BES) | Sigma | B9879 | |
| Phosphocreatine dissodium salt hydrate (Na2PCr) | Sigma | P7936 | |
| Potassium chloride (KCl) | Merck | 1.04936.1000 | |
| Potassium hydroxide (KOH) | Merck | 8.14353.1000 | |
| Propionic acid (C3H6O2) | Merck | 8.00605.0500 | |
| Silicone Squeeze Tube | Marineland | 31003 | |
| Tritiplex (EGTA) | Merck | 1.08435.0025 | |
| Triton® X-100 10% | Merck | 648463 | |
| Tissue homogeneizer (GKH GT Motor Control) | Terre Haute Glas-col | ||
| Length Controller (Model 315C-I) | Aurora Scientific | ||
| Force Transducer (Model 403 A) | Aurora Scientific | ||
| Software ASI 600A | Aurora Scientific | ||
| Sotware VSL (Model 900B) | Aurora Scientific | ||
| Inverted Microscope (IX51) | Olympus |
参考文献
- Leite-Moreira, A. M., et al. Stretch-induced compliance: a novel adaptive biological mechanism following acute cardiac load. Cardiovascular Research. 114 (5), 656-667 (2018).
- Falcao-Pires, I., Fontes-Sousa, A. P., Lopes-Conceicao, L., Bras-Silva, C., Leite-Moreira, A. F. Modulation of myocardial stiffness by β-adrenergic stimulation - its role in normal and failing heart. Physiological Research. 60 (4), 599-609 (2011).
- Cokkinos, D. V. . Introduction to Translational Cardiovascular Research. , 371-387 (2015).
- van der Velden, J., Stienen, G. J. M. Cardiac Disorders and Pathophysiology of Sarcomeric Proteins. Physiological Reviews. 99 (1), 381-426 (2019).
- Garnier, D. Attachment procedures for mechanical manipulation of isolated cardiac myocytes: a challenge. Cardiovascular Research. 28 (12), 1758-1764 (1994).
- Brady, A. J. Mechanical properties of isolated cardiac myocytes. Physiological Reviews. 71 (2), 413-428 (1991).
- Falcao-Pires, I., Leite-Moreira, A. F., Cokkinos, D. V. Chapter 20. Introduction to Translational Cardiovascular Research. 20, 371-387 (2015).
- Liang, W. Teaching calcium-induced calcium release in cardiomyocytes using a classic paper by Fabiato. Advances Physiology Education. 32 (1), 1-10 (2008).
- Roche, S. M., Gumucio, J. P., Brooks, S. V., Mendias, C. L., Claflin, D. R. Measurement of Maximum Isometric Force Generated by Permeabilized Skeletal Muscle Fibers. Journal of Visualized Experiments. (100), e52695 (2015).
- Huxley, A. F. Muscle structure and theories of contraction. Progress Biophysics and Biophysical Chemistry. 7, 255-318 (1957).
- Sequeira, V., et al. Synergistic role of ADP and Ca(2+) in diastolic myocardial stiffness. Journal Physiology. 593 (17), 3899-3916 (2015).
- Edes, I. F., et al. Rate of tension redevelopment is not modulated by sarcomere length in permeabilized human, murine, and porcine cardiomyocytes. American Journal Physiology Regulatory Integrative Comparative Physiology. 293 (1), R20-R29 (2007).
- King, N. M., et al. Mouse intact cardiac myocyte mechanics: cross-bridge and titin-based stress in unactivated cells. Journal General Physiology. 137 (1), 81-91 (2011).
- Hamdani, N., et al. Myocardial titin hypophosphorylation importantly contributes to heart failure with preserved ejection fraction in a rat metabolic risk model. Circulation Heart Failure. 6 (6), 1239-1249 (2013).
- Miranda-Silva, D., et al. Characterization of biventricular alterations in myocardial (reverse) remodelling in aortic banding-induced chronic pressure overload. Scientific Reports. 9 (1), 2956 (2019).
- Rodrigues, P. G., et al. Early myocardial changes induced by doxorubicin in the nonfailing dilated ventricle. American Journal Physiology Heart Circulatory Physiology. 316 (3), H459-H475 (2019).
- van der Velden, J., et al. Alterations in myofilament function contribute to left ventricular dysfunction in pigs early after myocardial infarction. Circulation Research. 95 (11), e85-e95 (2004).
- Wakili, R., et al. Multiple potential molecular contributors to atrial hypocontractility caused by atrial tachycardia remodeling in dogs. Circulation: Arrhythmia Electrophysiology. 3 (5), 530-541 (2010).
- Ait Mou, Y., le Guennec, J. Y., Mosca, E., de Tombe, P. P., Cazorla, O. Differential contribution of cardiac sarcomeric proteins in the myofibrillar force response to stretch. Pflugers Archiv. 457 (1), 25-36 (2008).
- Falcao-Pires, I., et al. Diabetes mellitus worsens diastolic left ventricular dysfunction in aortic stenosis through altered myocardial structure and cardiomyocyte stiffness. Circulation. 124 (10), 1151-1159 (2011).
- Lim, C. C., et al. Anthracyclines induce calpain-dependent titin proteolysis and necrosis in cardiomyocytes. Journal Biology Chemistry. 279 (9), 8290-8299 (2004).
- Woulfe, K. C., et al. A Novel Method of Isolating Myofibrils From Primary Cardiomyocyte Culture Suitable for Myofibril Mechanical Study. Frontiers Cardiovascular Medicine. 6, 12 (2019).
- Ait Mou, Y., Bollensdorff, C., Cazorla, O., Magdi, Y., de Tombe, P. P. Exploring cardiac biophysical properties. Global Cardiology Science Practice. 2015, 10 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。