Method Article
Avaliação in vitro da função cardíaca usando cardiomócitos esfolados
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo visa descrever passo a passo a técnica de extração e avaliação da função cardíaca utilizando cardiomiócitos esfolados. Esta metodologia permite a medição e a sintomadulação aguda da função de miofilament usando pequenas biópsias congeladas que podem ser coletadas de diferentes locais cardíacos, de camundongos a homens.
Resumo
Neste artigo, descrevemos as etapas necessárias para isolar um único cardiomiócito permeabilizado ("esfolado") e anexá-lo a um aparelho de medição de força e a um motor para realizar estudos funcionais. Esses estudos permitirão a medição da rigidez cardiomiócito (força passiva) e sua ativação com diferentes soluções contendo cálcio (Ca2+)-contendo soluções para determinar, entre outros: desenvolvimento de força máxima, miofilação Ca2+-sensibilidade (pCa50),cooperatividade (nHill) e taxa de redesenvolvimento da força (ktr). Este método também permite a determinação dos efeitos das drogas que atuam diretamente nos miofilamentos e na expressão de proteínas recombinantes exógenas em propriedades ativas e passivas de cardiomiócitos. Clinicamente, estudos de cardiomiócitos esfolados destacam a fisiopatologia de muitas doenças do miocárdio e permitem a avaliação in vitro do impacto das intervenções terapêuticas direcionadas aos miofilaments. Ao todo, essa técnica permite o esclarecimento da fisiopatologia cardíaca, investigando correlações entre parâmetros in vitro e in vivo em modelos animais e tecido humano obtidos durante cirurgia de coração aberto ou transplante.
Introdução
Tradicionalmente, a avaliação das propriedades mecânicas do miocárdio tem sido tentada principalmente em preparações multicelulares, como músculos papilares e trabeculas1,2. As tiras de músculos cardíacos multicelulares incluem uma população heterogênea de células, incluindo cardiomiócitos contílicos com um padrão desconhecido de orientação e geração de força, atividade elétrica e distribuições de estresse/tensão, bem como uma matriz de tecido conjuntivo circundante3,4. Uma preparação sem colágeno e contendo um único cardiomiócito permitiria a medição do comprimento sarcomere e propriedades contíteis de ponte transversal de forma muito precisa e controlada5,6. Portanto, ao longo das últimas quatro décadas, foram desenvolvidas diversas metodologias permitindo a investigação das propriedades mecânicas, contratuais e de relaxamento de um único cardiomiócito6,7. A função contractile dessas células é fortemente dependente do comprimento sarcomere e cinética de ciclismo de ponte cruzada3. Assim, é desejável investigar a função muscular diretamente em células cardíacas isoladas únicas, considerando que permite avaliar o comprimento e o desempenho do sarcomere, bem como a função transfronteiriço e propriedades contratuais. No entanto, isolar e anexar cardiomiócitos funcionais com uma resolução óptica razoável de sarcomere, enquanto a medição da força de gravação no nível de μN ainda é desafiadora e emevolução 3,6. Outros desafios são a logística que precisa ser instalada para isolar cardiomiócitos de biópsias recém-coletadas. A imprevisibilidade da coleta de biópsias humanas, por exemplo, pode comprometer a viabilidade dos experimentos.
Além disso, preocupações éticas quanto à Substituição, Redução e Refinamento da experimentação animal para procedimentos científicos (princípios dos 3Rs) promoveram mudanças de estudo no nível celular e tecidual, preferencialmente em biópsias humanas, ou em amostras de animais menores. De fato, um refinamento progressivo das metodologias para avaliar a função cardíaca in vitro em um nível menor de complexidade permite a integração adequada dos resultados para todo o corpo e traduzi-los para o cenário clínico7. Ao todo, o uso de amostras armazenadas a -80 °C para extrair cardiomiócitos pode ser uma alternativa atraente.
O tecido miocárdio é cortado em pequenos pedaços e homogeneizado com uma argamassa e um pilão. O resultado dessa homogeneização é a suspensão de células empacotadas e isoladas com diferentes graus de dano sarcolemmal, em que o mioplasma é exposto ao meio de banho e todos os componentes celulares são lavados. Estruturas como os miofibrils que estão mais distantes do sarcolemma são preservadas. Assim, o encurtamento sarcomere e as propriedades funcionais associadas ao aparelho miofibrilar são mantidos intactos e podem ser registrados8,9.
O sistema de medição da força cardiomiocócica consiste em um motor eletromagnético, usado para ajustar o comprimento do cardiomiócito, e um transdutor de força, que mede a contração do cardiomiócito isométrico. Um cardiomiócito permeabilizado, ou esfolado, é colocado em uma câmara experimental contendo uma solução relaxante ([Ca2+] < 10 nM) e colado em silício a 2 agulhas finas: uma presa ao motor e outra ao transdutor de força. Um sistema óptico é usado para determinar a morfologia cardiomiócito e o comprimento do sarcomere. O protocolo experimental muitas vezes consiste em uma série de gravações de força sobre soluções tampão contendo diferentes concentrações de Ca2+, a determinação da cinética transversal actin-myosin e a medição da tensão passiva dos cardiomiócitos montados em comprimentos de sarcomere pré-definidos(Figura 1). Isolamento de cardiomiócitos permeabilizados de amostras de miocárdio congelados em nitrogênio líquido (e posteriormente armazenados a -80 °C) é uma técnica que utiliza mecânica celular e bioquímica proteica para medir força máxima Ca2+ativada (ativa) por área transversal (Tativa, kN∙m-2), Ca2 2+-tensão independente (passiva) (Tpassiva, kN∙m-2), mistilaments Ca2+-sensibilidade (pCa50),cooperatividade myofilaments (nHill), taxa de redesenvolvimento de força (ktr) bem como dependências de comprimento sarcomere de Tativo,T passivo, pCa50, nHill e ktr.
O objetivo deste protocolo é ilustrar e resumir o potencial do sistema de medição da força cardiomiocócica como um procedimento confiável para avaliar as propriedades mecânicas funcionais de cardiomiócitos de pele única isolados de amostras congeladas de diferentes espécies.
Protocolo
Todos os experimentos em animais estão em conformidade com o Guia de Cuidado e Uso de Animais de Laboratório (NNI Publicação nº 85-23, revisado em 2011) e a lei portuguesa sobre bem-estar animal (DL 129/92, DL 197/96; P 1131/97). As autoridades locais competentes aprovaram este protocolo experimental (018833).
1. Preparação da solução de estoque(Tabela 1)
- Prepare 1.000 mL de solução relaxante para o isolamento dos cardiomiócitos (RELAX-ISO) seguindo instruções na Tabela 2. Dissolva o reagente acima em ≈500 mL e ajuste o pH para 7.0 com KOH. Ajuste o volume final para 1000 mL.
- Distribua RELAX-ISO em tubos de 50 mL. Armazenar a -20 °C.
- Prepare 250 mL de solução de ativação seguindo as instruções na Tabela 3. Dissolva os reagentes acima em ≈100 mL de água ultra-pura. Ajuste o pH para 7,1 com 5 M KOH a 15 °C.
NOTA: Normalmente, é necessário adicionar uma quantidade significativa de KOH para alcançar o pH desejado. Coloque o balão volumoso em uma caixa com gelo para esfriar a solução a 15 °C.- Ajuste o volume final para 250 mL. Agitar esta solução continuamente com um agitador magnético até o momento de misturá-la com a solução relaxante.
- Prepare 100 mL de solução relaxante seguindo as instruções na Tabela 4. Dissolva os reagentes acima em ≈50 mL de água ultra-pura. Ajuste o pH para 7,1 com KOH 5 M a 15 °C.
NOTA: Normalmente, é necessário adicionar uma quantidade significativa de KOH para atingir um pH de 7,1. Coloque o balão volumoso em uma caixa cheia de gelo para esfriar a solução a 15 °C. A resistência iônica das soluções utilizadas durante as medições foi de 180 mM.- Ajuste o volume final para 100 mL. Agitar esta solução continuamente com um agitador magnético até o momento de misturá-la com a solução ativante.
- Misturar soluções de ativação e relaxamento nas proporções apresentadas na Tabela 5 para obter soluções pCa entre 5.0 e 6.0.
- Mantenha sempre relaxando e ativando soluções agitando enquanto mistura ambos.
- Alíquotar cada mistura a microtubos de 2 mL. Armazene todos os microtubos a -20 °C.
- Prepare um lote diferente de solução pCa (4.5 a 6.0) para cada protocolo.
2. Calibração do transdutor de força
NOTA: A calibração do transdutor de força é um procedimento de rotina que deve ser realizado a cada dois meses ou sempre que se suspeitar que não esteja calibrado. O transdutor de força é altamente sensível e é facilmente quebrado. Deve ser manuseado suavemente em todas as etapas de seu uso, incluindo calibração, colagem do cardiomiócito e limpeza.
- Retire o transdutor de força do resto do aparelho.
- Com a ajuda de um grampo, coloque o transdutor de força horizontalmente de tal forma que a agulha aponta para baixo na mesma orientação que o cardiomiócito desenvolverá força. Isso facilitará o enforcamento de uma série de massas com pesos conhecidos (banda elástica, sutura ou pino).
NOTA: Verifique as características do transdutor de força antes de prosseguir para esta etapa para verificar o fator de escala [mg/volt] e evitar o excesso de peso no transdutor. Para o modelo transdutor de força, o fator de escala é de 50 (50 mgs correspondem a 1 volt) e usamos 5 pesos entre 12,5 e 250 mgs. - Ligue o transdutor de força e deixe aquecer por 30 minutos.
- Comece pendurando a massa mais leve no transdutor de força e registrando a tensão correspondente medida no FORCE OUT.
- Repita este procedimento para até cinco pesos.
- Força de parcela aplicada ao transdutor de força (carga) versus tensão e verifique se há linearidade.
- Se não houver linearidade, ajuste o zero e ganhe potencializadores na placa de circuito do transdutor. Verifique suas instruções específicas para mais informações.
- Gire o potencialômetro zero até que a tensão de saída leia 0,0 V.
- Entregue um peso médio na agulha do transdutor e ajuste o potencialiômetro de ganho para ler a tensão correspondente (por exemplo, 50 mgs correspondem a 1 V). Retire o peso e ajuste o potencialômetro zero para 0,0.
- Repita o passo 2.6.2 até que a saída com e sem o peso esteja correta.
- Monte o transdutor de força de volta ao aparelho.
3. Definindo o aparelho experimental
- Descongele um frasco de cada um dos ativados, 4.5, 5.0, 5.2, 5.4, 5.6, 5.8, 6.0 e soluções relaxantes e mantê-los no gelo.
NOTA: ATP e PCr são compostos labile que devem ser mantidos a temperaturas frias. - Prepare o microscópio, o aparelho de teste e o computador associado para uso(Figura 1).
- Ajuste a temperatura para que o termômetro da câmara leia 15 °C. Realize todos os experimentos nesta temperatura, exceto para incubações de quinase e fosfatase (20 °C).
- Ligue o transdutor de força e o motor.
4. Extração e permeabilização de cardiomiócitos esfolados
- Descongele 50 mL de solução RELAX-ISO.
- Ligue a centrífuga e esfrie-a rapidamente até 4 °C.
- Descongele 3-5 μg de uma amostra de miocárdio em uma placa de Petri contendo 2,5 mL de solução RELAX-ISO.
- Corte o tecido em pequenos pedaços com uma lâmina de bisturi(Figura 2). Corte a amostra de forma precisa para evitar danos desnecessários às células.
- Transfira os 2,5 mL de solução RELAX-ISO com o tecido para um vidro Potter-Elvehjem usando uma ponta de pipeta cortada.
- Interrompa mecanicamente o tecido com um moedor a uma velocidade de rotação de 30-40 rpm. Pressione o tecido 3 vezes por 2 s cada para obter uma boa suspensão celular.
- Prepare 10% Triton em solução RELAX-ISO (250 μL de Triton com 2,25 mL de RELAX-ISO) em um tubo de 15 mL e adicione esta solução à suspensão da célula.
- Misture suavemente invertendo o tubo 3 vezes.
- Incubar em temperatura ambiente por 1 min e 4 minutos no gelo.
- Lave o Tritão adicionando RELAX-ISO até o topo do tubo de 15 mL; mistura suavemente (invertendo 3 vezes o tubo) e finalmente girando as células em uma centrífuga angular (1 min a 348 x g). Remova o sobrenatante até 3 mL acima da pelota celular.
NOTA: Remova o supernatante suavemente para evitar perturbar a pelota celular. Ainda assim, algumas células em supernasce serão inevitavelmente perdidas. - Repita o passo 4.10 pelo menos 4 vezes ou até que não sejam observadas mais bolhas produzidas pelos resíduos de Tritão.
NOTA: Quanto mais os passos de lavagem são feitos, mais células são perdidas com o supernanato descartado. - Na última lavagem, remova o supernatante até um volume de 5-10 mL de suspensão celular.
5. Selecionar e colar o cardiomiócito esfolado
- Coloque uma queda de suspensão celular em uma mancha de cobertura em cima de um slide de vidro no suporte de slides do microscópio(Figura 1).
- Selecione um único cardiomiócito em forma de haste com um bom padrão e tamanho de estriação(Figura 2).
- Encontre as pontas da agulha do transdutor de força e do motor usando a menor ampliação do microscópio invertido.
- Gire a tampa para posicionar o cardiomiócito selecionado horizontalmente para que suas extremidades estejam alinhadas com a agulha do transdutor de força e do motor(Figura 2).
- Coloque uma fina linha de cola na lateral da tampa com a ajuda de uma ponta de cotonete(Figura 2).
- Mergulhe as pontas da agulha do transdutor de força e do motor na linha de cola para criar um halo de cola em torno de ambas as pontas.
NOTA: As etapas 5.6 - 5.10 são realizadas através do uso cuidadoso dos micropositores motorizados. - Mova rapidamente as pontas da agulha para perto do plano focal do cardiomiócito.
- Mova a ponta da agulha do transdutor de força para baixo para que cola em uma borda do cardiomiócito.
- Repita este procedimento com a ponta do motor e a outra extremidade da célula.
NOTA: Este procedimento deve levar menos de 2-3 minutos à medida que a cola começa a curar muito rapidamente. - Depois de 5-8 min, levante as agulhas ≈ 15 μm para evitar colar a célula na tampa. Isso é feito movendo-se para cima de ambos os micromanipuladores simultaneamente.
- Deixe a cola curar. Este procedimento pode durar de 15 a 45 min, dependendo do tipo de cola. No nosso caso, o cardiomiócito é adequadamente colado após ≈ 15 min.
6. Medições de força de gravação de sensibilidade ativa, passiva e Ca2+
- Preencha o primeiro bem experimental com a solução relaxante (55-100 μL no aparelho experimental) e o segundo poço experimental com solução de ativação.
- Utilizando o software da câmera, coloque a região de interesse (ROI) em uma área do cardiomiócito com um padrão claro de estriação.
NOTA: Para miócitos cardíacos, o comprimento de sarcomere operacional varia entre 1,8 e 2,2 μm, e o comprimento ideal de sarcomere é de cerca de 2,15 μm. - Meça a distância entre os dois extremos do cardiomiócito (do motor ao halo de cola transdutor, Figura 3) após o comprimento ideal de sarcomere ter sido definido (2,2 μm). Registo o valor como comprimento do miócito no software.
- Meça a largura e a profundidade do cardiomiócito, este último com o auxílio de um espelho prisma colocado perpendicular à célula.
NOTA: Uma fonte de luz externa poderosa será necessária para visualizar a célula através do prisma. Caso não haja prisma, e assumindo que as células cardíacas têm uma forma elíptica, a profundidade do cardiomiócito pode ser inferida como 70% da largura do cardiomiócito. - Calcular a área transversal (CSA, mm2) assumindo uma forma elíptica do cardiomiócito.

- Mova suavemente o estágio do microscópio para que a célula se mova do deslizamento de cobertura para a solução relaxante que contém poço na parte de trás do palco.
NOTA: Este procedimento pode danificar facilmente a célula. Antes de mover a célula, mova suavemente as agulhas um pouco mais. Evite remover a célula da solução. - Selecione o protocolo em software que contenha dois encurtamento de células (80% do seu comprimento inicial), que ocorrerá quando a célula surgir na solução Ca2+ e em solução relaxante, respectivamente (Figura 1, Arquivo Suplementar).
NOTA: O primeiro "Slack" da célula será realizado dentro da solução de ativação e o segundo "Slack" dentro da solução relaxante. Ao fazer isso, o usuário poderá calcular a força total (Ftotal) da célula a partir do1º e a força passiva (Fpassiva) da célula a partir do2º. Use a fórmula para calcular a força ativa, Fativo = Ftotal - Fpassivo. A célula é encurtada em 80% para desacopr todas as pontes cruzadas. - Contração isométrica provocada movendo o estágio do microscópio para que o cardiomiócito se mova do relaxante para a solução ativante (pCa=4.5(1)).
NOTA: Se a célula estiver funcional, ela contrairá imediatamente. - Ao chegar ao planalto de força, comece a registrar os dados da força.
NOTA: Os testes podem ser feitos individualmente. Dependendo do software, existe a possibilidade de criar uma sequência de testes que corresponderão às diferentes soluções Ca2+ dentro de um protocolo de sensibilidade Ca2+(Figura 1,Arquivo Suplementar). - Aguarde ~10 s e, em seguida, troque a célula imersa na solução de ativação.
NOTA: É importante esperar 10 s antes de mergulhar a célula na solução relaxante. Se a célula for movida muito cedo, dados importantes para calcular a força de redesenvolvimento da célula (valor ktr) podem ser perdidos. - Mova rapidamente o palco para que o cardiomiócito mergulhe na solução relaxante.
- Espere até o teste parar.
- Repita as etapas 6.8 - 6.12 para que a célula seja ativada duas vezes na solução de ativação (pCa=4.5(2)).
NOTA: Normalmente, após a primeira ativação, as extremidades do cardiomiócito podem se desprender ligeiramente das pontas da agulha, alterando o comprimento do cardiomiócito, CSA e/ou o comprimento do sarcomere. Reajuste ao comprimento desejado do sarcomere e introduza as dimensões corrigidas no software.- Continue a etapa 6.13.2 para o protocolo de sensibilidade Ca2+ ou salve os dados, se os valores de força passiva e ativa da célula são os únicos parâmetros necessários e desprendem a célula das agulhas e limpá-las com acetona para remover a cola.
- Ajuste o comprimento do sarcomere da célula para 2,2 μm, esticando-o ligeiramente novamente, se necessário.
- Substitua a solução de ativação pela próxima solução Ca2+ (55-100 μL aqui). Repetir as etapas 6.8 - 6.12.
- Substitua a solução de ativação pela próxima solução Ca2+ (55-100 μL aqui) e repita as etapas 6.8 - 6.12 até que todas as soluções tenham sido testadas (5.0, 5.2, 5.4, 5.6, 5.8, 6.0).
- Por fim, reativar a célula com solução de ativação (pCa4.5(3)). Repita as etapas 6.8- 6.12.
7. Incubação com quinases e fosfates
- Após a realização do protocolo de linha de base selecionado, diluir a quinase/fosfatase na solução Relaxante na concentração recomendada.
NOTA: Recomenda-se realizar uma curva dose-resposta antes do experimento. - Coloque a temperatura dos poços experimentais em 20 °C.
- Encha os poços experimentais com quinase/fosfatase, solução relaxante e solução de ativação (55-100 μL).
- Mova suavemente o estágio do microscópio para que a célula fique imersa no poço que contém quinase/fosfatase.
- Incubar o cardiomiócito com a quinase/fosfatase por pelo menos 30 min ou de acordo com as instruções dos fabricantes.
- Repita o protocolo de linha de base selecionado.
8. Finalizando o experimento
- Desgruda o cardiomiócito das pontas do transdutor de força e motor, esticando a célula.
- Remova cuidadosamente o halo de cola das pontas da agulha usando um cotonete encharcado em acetona.
- Desligue o equipamento.
9. Analisando os dados
- Colete todos os arquivos de cada cardiomiócito testado.
NOTA: Cada teste corresponderá a um arquivo. Isso significa que para cada solução Ca2+ ou comprimento sarcomere, haverá um arquivo correspondente. - Calcule forças ativas e passivas de um único cardiomiócito.
- Abra o arquivo correspondente à primeira ativação (pCa=4.5(1)) usando uma planilha (Figura 3A, Apêndice A em Arquivo Suplementar).
NOTA: Usamos um programa personalizado para realizar a análise. Consulte o apêndice A no Arquivo Suplementar. - Valores médios ≈60 valores antes e médios ≈60 valores após a1ª folga da célula (quando a célula está imersa na solução Ca2+). Esses dois valores correspondem a a e b, respectivamente.
- Repita a mesma análise para a2ª folga da célula (quando a célula estiver imersa em solução relaxante). Esses 2 valores correspondem a c e d, respectivamente.
- Calcule a diferença entre a e b (força total,totalF ).
- Calcular a diferença entre c e d (força passiva,F passiva).
- Calcular força ativa, Fativo = Ftotal - Fpassivo.
- Normalizar todos os valores de força para CSA (ver fórmula acima) para obter a tensão total(totalT), tensão passiva(T passiva) e tensão ativa (Tativo).
- Repita a etapa 9.2.1 a 9.2.5 para a ativação 2 (pCa=4.5(2)).
- Considere esses valores como aqueles que representam Ttotal,Tativo e Tpassivo do cardiomiócito em análise.
NOTA: A primeira ativação da célula com pCa4.5(1) geralmente está associada a alterações nas dimensões celulares. Por essa razão, a 2ª ativação com pCa4.5 é mais precisa e é a que deve ser usada. - Repita as etapas 9.2.1 a 9.2.5 para cada arquivo/pCa soluções testadas (5.0, 5.2, 5.4, 5.6, 5.8, 6.0, 4.5(3)).
- Abra o arquivo correspondente à primeira ativação (pCa=4.5(1)) usando uma planilha (Figura 3A, Apêndice A em Arquivo Suplementar).
- Calcule pCa50 e nHill de um único cardiomiócito.
NOTA: Para esta análise, utilize os valoresativos F não normalizados dos arquivos 4.5(2), 5.0, 5.2, 5.4, 5.6, 5.8, 6.0 e 4.5(3).- Coloque em um arquivo de planilha todos os valores não normalizados de Fativos para cada solução Ca2+ testada (4.5(2),5.0, 5.2, 5.4, 5.6, 5.8, 6.0, 4.5(3)).
- Calcule o fator de correção = Fativo [4.5(2)] - Fativo [4.5(3)] / 7.
- Calcule os valores corrigidos de Fativo para cada solução Ca2+ (5.0, 5.2, 5.4, 5.6, 5.8, 6.0) subtraindo Fativo - fator de correção.
- Calcule a força relativa(F relativa) para cada solução Ca2+ normalizando cada valorativo F pelo valor corrigido correspondente.
NOTA: Oparente F [4.5(3)] deve ser igual a 1. Cada protocolo experimental começa e termina com uma ativação de controle na concentração saturada de Ca2+ (pCa 4.5(2) e 4.5(3)). Isso permite a normalização da força e a avaliação do resumo dos preparativos através da comparação de alterações na força ativada por Ca2+máximo (Fmax). Se ao final do protocolo experimental, o cardiomiócito produz menos de 70% da força máxima da primeira contração, essa célula/medida deve ser excluída da análise. - Use oparente F e os valores pCa correspondentes para caber em uma curva sigmoidal com a seguinte equação F(Ca) = CanHill/ (Ca50nHill + CanHill).
- Extrapolar os valores pCa e nHill da equação acima mencionada.
- Calcule a taxa de redesenvolvimento da força (ktr) de um único cardiomiócito.
- Realize um ajuste na curva que corresponde aos valores imediatamente após a folga dacélula 1.
- Calcule a inclinação da curva e esse valor corresponderá à taxa de redesenvolvimento da força.
- Repita o passo 9.4.1 e 9.4.2 para cada solução Ca2+.
NOTA: Um ajuste de curva ruim será obtido para as soluções ca mais baixas (R ao quadrado≤0,90).
Resultados
Cardiomiócitos permeabilizados funcionais devem parecer uniformes e com um padrão de estriação consistente durante todo o experimento. Embora um certo grau de deterioração e diminuição da força seja esperado após experimentos prolongados, os valores de tensão ativa devem ser relativamente estáveis. As células que apresentarem sinais claros de perda de estriação ou diminuição significativa da força (< 15 kN∙m-2 ou <80% de sua força ativa inicial) devem ser excluídas. A Tabela 6 apresenta os valores normais esperados para os parâmetros mais importantes derivados de roedores, suínos e amostras humanas.
Os parâmetros obtidos dependem principalmente do protocolo escolhido. A Figura 5 mostra traços de força representativa de 3, de 8, gravações de força necessárias para realizar um protocolo de miofilaments Ca2+-sensibilidade. Ao transferir a célula para um poço contendo a solução ativante, o cardiomiócito começa a desenvolver força até chegar a um platô. Após um teste rápido de folga (duração de 1 ms), pelo qual o cardiomiócito encurta para 80% do seu comprimento, obtemos os valores básicos de força zero. Após o teste de folga, a célula continua a desenvolver força à medida que está imersa na solução de ativação. A força total(F total) é calculada subtraindo o valor do planalto do valor mínimo. A inclinação da última parte desta curva nos dá o valor da taxa de redesenvolvimento da força (ktr) (Figura 6), que é uma medida da taxa aparente de fixação e desprendimento de ponte cruzada (fapp e gaap)10. Quando o valor ktr R2 é <0,90 o valor ktr deve ser excluído e geralmente isso acontece em concentrações ca2+ mais baixas (pCa 5.6, 5.8 e 6.0). Depois de transferir a célula de volta para um poço contendo a solução relaxante, a célula relaxa e sua força cai. A força passiva (Fpassiva)é calculada subtraindo o valor mínimo (obtido após um encurtamento celular prolongado) a este novo valor de força. A força ativa resulta da diferença entre ftotal eF passivo.
A força ativa e passiva máxima que caracteriza um cardiomiócito é a derivada da ativação da segunda célula com uma solução saturante ca2+(pCa = 4,5). A primeira ativação é geralmente descartada, pois o comprimento do sarcomere muitas vezes precisa ser reajustado.
Para realizar um protocolo de mistilação Ca2+-sensibilidade, é necessário realizar pelo menos 9 testes de ativação (4.5; 4.5; 5.2; 5.6; 6.0; 5.0; 5.4; 5.8 e 4.5). Esta sequência é meramente exemplificante, mas deve sempre começar com 4.5 (duas vezes) e terminar com 4.5. A programação do software de aquisição de dados para um protocolo de sensibilidade myofilament Ca2+é retratada na Figura 1 do Arquivo Suplementar.
Após calcular a força ativa para todas essas soluções de ativação, verifique se a última ativação rendeu mais de 80% da força máxima inicial (caso contrário, os resultados desta célula devem ser descartados, como mencionado acima). Para corrigir o declínio noF max durante a série experimental, os valoresf máximos interpolados podem ser usados para normalizar os pontos de dados. Os dados normalizados podem ser adequados a uma curva sigmoidal com a seguinte equação F(Ca) = CanHill/(Ca50nHill + CanHill). Os valores dos parâmetros obtidos representam a sensibilidade ao cálcio (Ca50, que pode ser convertida em pCa50) e a cooperatividade (nHill). Todos os valores de força podem ser convertidos em valores de tensão após a normalização para a área transversal. Além da sensibilidade do Myofilament Ca2+e dos protocolos de ativação dependentes de comprimento, outros testes podem ser realizados. É o caso das dependências de comprimento sarcomere de Tativo,T passivo (Figura 7)e força residual de cardiomiócito. Os registros de força residual são calculados a partir da recuperação da força inicial (pCa 4.5) alcançada após a mudança de comprimento da célula (80%) e normalizada a cada força total de estado estável alcançada antes da mudança de comprimento11. O aumento da força residual é geralmente indicativo de pontes cruzadas com cinética de desprendimento lento e maior rigidez.
Por fim, ressalta-se que essa técnica pode ser realizada em cardiomiócitos esfolados extraídos mecanicamente de amostras congeladas ou recém-coletadas, bem como isoladas enzimáticas seguidas pela permeabilização de suas membranas. A forma como os cardiomiócitos são isolados impacta significativamente os resultados derivados dessa técnica. A Figura 8 mostra as diferenças observadas entre os três procedimentos de isolamento.

Figura 1: Esquema integrado do aparelho de teste. O aparelho de teste inclui o microscópio, os micromanipuladores e o computador associado. A parte inferior da figura mostra um cardiomiócito esfolado colado entre o motor e o transdutor de força. Clique aqui para ver uma versão maior desta figura.

Figura 2: Fluxograma do protocolo de isolamento celular, permeabilização e colagem. A imagem do canto superior esquerdo é composta por 4 imagens que mostram pedaços da amostra do coração na solução RELAX-ISO (A) em uma placa de Petri, (B) em um tubo usado para homogeneização mecânica do tecido, (C) o homogeneizador, (D) o tecido imediatamente após a homogeneização e (E) quando está em um tubo para permeabilização triton. Clique aqui para ver uma versão maior desta figura.
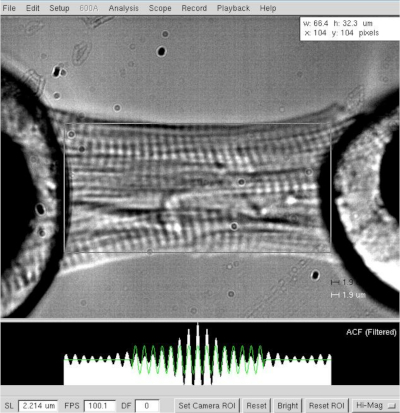
Figura 3: Determinação do comprimento e comprimento sarcomere de um cardiomiócito esfolado. Comprimento da célula e determinação de largura em um comprimento sarcomere de ≈2,2 μm. Clique aqui para ver uma versão maior desta figura.
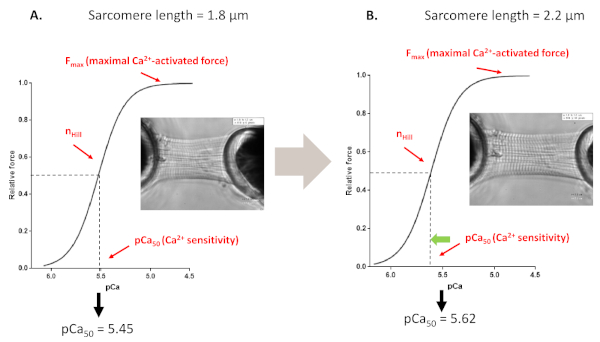
Figura 4: Protocolo de ativação dependente de comprimento (imita o mecanismo de estrela franca in vitro). Traços e parâmetros de força representativa derivados dos protocolos de sensibilidade Ca2+ de miofilaments realizados antes (A, 1,8 μm) e após esticar um cardiomiócito até 2,2 μm(B). Clique aqui para ver uma versão maior desta figura.
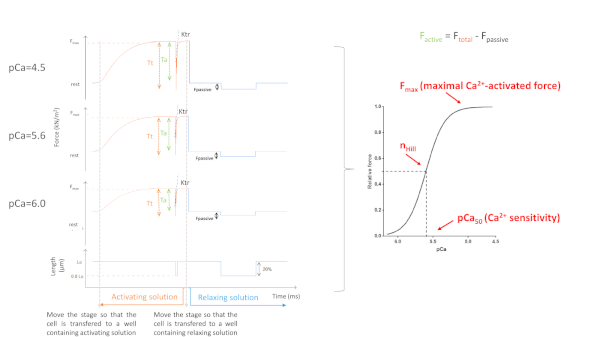
Figura 5: Myofilaments Ca2+-protocolo de sensibilidade. Traços de força representativa e parâmetros derivados. Por uma questão de simplicidade, apenas 3 das 8 curvas de força são retratadas. Ou seja, um cardiomiócito ativado com a saturação, uma solução intermediária e a mais baixa ca2+(4,5, 5,6 e 6,0, respectivamente). Clique aqui para ver uma versão maior desta figura.

Figura 6: Traços representativos de uma célula cardíaca de camundongos ativados em diferentes soluções de cálcio e a respectiva curva de ajuste ktr. (A) pCa 4.5; (B) pCa 5.0; (C) pCa 5.2; (D) pCa 5.4; (E) pCa 5.6; (F) pCa 6.0 e E valores para tensão total, passiva e ativa, valor ktr e Rsquare para ktr fit. Clique aqui para ver uma versão maior desta figura.
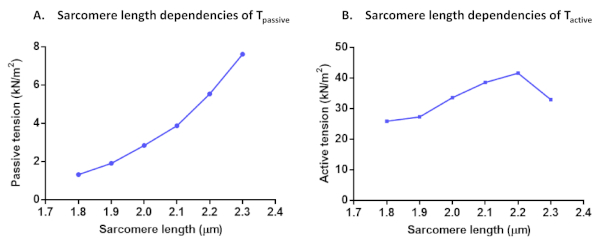
Figura 7: Protocolos de dependências de comprimento sarcomere de Tpassivo (A) e Tativo (B). A tensão passiva e a tensão ativa foram calculadas em um único cardiomiócito em um comprimento sarcomere de 1,8 μm a 2,3 μm. Por favor clique aqui para ver uma versão maior desta figura.
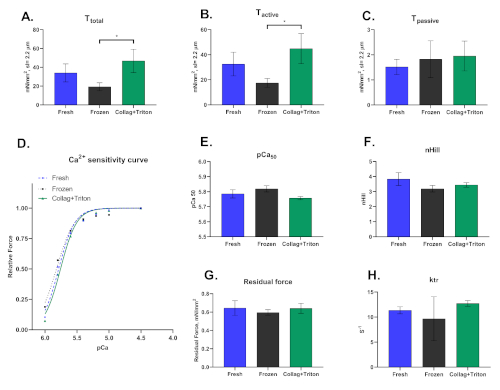
Figura 8: Resultados representativos para cardiomiócitos mecanicamente isolados de amostras de miocárdio frescos ("Frescos") e congelados ("Congelados") bem como de cologenias de coração digerido (técnica de Langgendorf modificada) com permeabilização posterior com Triton ("Collag+Triton"). Valores de (A) Tensão total, (B) Tensão Ativa e (C) Tensão pasisve de cardiomiócitos ativados com solução pCa 4.5 em um comprimento sarcomere de ≈2,2 μm. (D) Curva de sensibilidade ao cálcio e os respectivos valores para (E) pCa50 e (F) nHill. (G) Força Residual e (H) valores ktr calculados na solução de ativação máxima (pCa 4.5). Clique aqui para ver uma versão maior desta figura.
Arquivo Suplementar. Clique aqui para baixar este arquivo.
| Armazene em | Soluções de estoque | [M] | Volume final (mL) | Peso/volume | Notas |
| 4°C | Hidróxido de potássio (KOH) | 1 | 100 | 5.611 g | Para ajustar pH |
| 4°C | Hidróxido de potássio (KOH) | 5 | 50 | 14,03 g | Para ajustar pH |
| 4°C | Bes | 1 | 50 | 10.64 % | |
| 4°C | Ácido propiônico | 1 | 100 | 7.483 mL | Ajuste o pH para 7.0 com 5M ou 1M KOH |
| 4°C | CaEGTA composta de: | 0.1 | 100 | Misture e aqueça a solução a 60°C por mais de 1 hora. Ajuste o pH para 5-6 com KOH 1M. | |
| - CaCO3 | 0.1 | 1.001 g | |||
| - Titriplex (EGTA) | 0.1 | 3.804 |
Tabela 1: Instruções para preparação da solução de estoque.
| RELAX-ISO (para isolamento de cardiomiócitos) | [mM] | Peso |
| Na2ATP | 5.95 | 3,28 g |
| MgCl2.6H2O | 6.04 | 1,23 g |
| Tritiplex (EGTA) | 2 | 0,76 g |
| Kcl | 139.6 | 10,41 g |
| Imidazol | 10 | 0,68 g |
Tabela 2: Instruções para a preparação da solução Relax-ISO.
| Solução de ativação (para as medidas) | [mM] | Peso / volume |
| Na2ATP | 5.97 | 0,823 g |
| MgCl 1M | 6.28 | 1,57 mL |
| Ácido propiônico | 40.64 | 10,16 mL |
| Bes | 100 | 25 mL |
| CaEGTA (solução de estoque previamente preparada) | 7 | 17,5 mL |
| Na2PCr | 14.5 | 0,925 g |
Tabela 3: Instruções para ativar a preparação da solução.
| Solução relaxante (para as medidas) | [mM] | Peso / volume |
| Na2ATP | 5.89 | 0,325 g |
| MgCl 1M | 6.48 | 0,65 mL |
| Ácido propiônico | 40.76 | 4,08 mL |
| Bes | 100 | 10 mL |
| Titriplex (EGTA) | 6.97 | 0,265 g |
| Na2PCr | 14.5 | 0,370 g |
Tabela 4: Instruções para a preparação da solução relaxante.
| pCa = -Log [Ca2+] | Relaxante (pCa=9.0) Ml | Ativação (pCa=4,5) Ml |
| 5 | 0.86 | 39.14 |
| 5.1 | 1.2 | 38.80 |
| 5.2 | 1.54 | 38.46 |
| 5.3 | 2 | 38.00 |
| 5.4 | 2.51 | 37.49 |
| 5.5 | 3.14 | 36.86 |
| 5.6 | 3.89 | 36.11 |
| 5.7 | 4.8 | 35.20 |
| 5.8 | 5.89 | 34.11 |
| 5.9 | 7.14 | 32.86 |
| 6 | 8.57 | 31.43 |
Tabela 5: Instruções para a preparação de soluções pCa.
| Parâmetro | Roedor | Porco | Humano |
| Tensão ativa, kN.m-2 (a 2,2 μm) | 17 – 28 | 19 – 40 | 19 – 36 |
| Tensão passiva, kN.m-2 (a 2,2 μm) | 3.6 – 5.5 | 1.9 – 6.8 | 1.8 – 2.3 |
| pCa50 | 5.58 – 5.64 | 5.40 – 5.50 | 5.43 – 5.82 |
| nHill | 2.60 – 2.76 | 2.95 – 3.36 | 2.99 – 3.10 |
| ktr, s-1 | 4.00 – 8.00 | 1.00 – 3.00 | 0.90 – 2.00 |
Tabela 6: Parâmetros e índices típicos derivados de cardiomiócitos permeabilizados únicos de roedores, porcos e humanos. Adaptado a partir de12.
| Problema | Possível razão | Solução |
| O cardiomiócito se desprende durante a ativação máxima | Tempo insuficiente de colagem; A cola é velha e seca | Aumentar o tempo da etapa de colagem; considere abrir um novo tubo de cola. |
| Há Triton® na solução de suspensão celular, que não pode mais ser removida | Repita o procedimento de extração com um ou dois triton adicionais® lavar os passos | |
| O cardiomiócito tem baixa força sob condições de controle | A extração deu errado e entregou células de baixa qualidade | Aumente o tamanho da amostra e faça uma nova extração. Se o problema persistir é provavelmente devido à coleta de amostras inadequada - descarte esta amostra |
| A célula está visivelmente contraindo, mas nenhuma força é registrada; A célula tem valores de força incomuns | O transdutor de força está desligado. | Ligue-o. |
| O transdutor de força não está bem calibrado | Calibrar o transdutor de força usando um conjunto de pesos conhecidos (verifique o manual de instruções do fabricante). | |
| A agulha transdutor de força está solta | Cole novamente a agulha usando laço de cristal 509 ou cera de joalheiro. | |
| O padrão de estriação não é bom o suficiente para determinar o comprimento de sarcomere | Luz insuficiente | Aumente a luz do microscópio ou mova a célula de volta para o deslizamento de cobertura e avalie novamente o comprimento do sarcomere (os poços têm menor intensidade de luz) |
| A extração deu errado e entregou células de baixa qualidade | Aumente o tamanho da amostra e faça uma nova extração | |
| As pontas das agulhas não estão no mesmo avião. | Usando micromanipuladores, ajuste as pontas das agulhas para cima ou para baixo até encontrar um sarcomeres focado | |
| Sem variação de comprimento e/ou força durante a aquisição | O motor ou o transdutor de força estão desligados. | Ligá-los |
| O motor está quebrado e não produzindo encurtamento celular | Substitua-o ou tente calibrar usando um gerador de função | |
| Muito barulho nas gravações de aquisição | Muito fluxo de ar ao redor do equipamento | Proteja o equipamento do fluxo de ar direto |
| Muitas vibrações ao redor do equipamento | Uma tabela de estabilização é aconselhável. Mesmo assim, recomenda-se remover qualquer equipamento que possa ter um compressor ou emitir vibrações (freezer, geladeiras) | |
| A curva de sensibilidade ca2+tem valores estranhos e os valores de força não aumentam com [Ca2+]. | A mistura de solução ativada e relaxante não foi feita corretamente (verifique 3.10 a 3.14 da seção de métodos, possivelmente devido à mistura insuficiente) | Descongele os frascos com a mesma concentração, colete todo o conteúdo do frasco no mesmo béquer, misture com um agitador e divida-os novamente. Teste essas soluções novamente em uma nova célula. Se isso resolver o problema, prepare um novo lote de soluções contendo Ca2+ |
Tabela 7: Tabela de solução de problemas.
Discussão
A avaliação in vitro da função cardíaca utilizando cardiomiócitos esfolados representa uma técnica importante para esclarecer as modificações ocorridas ao nível de cardiomiócitos no contexto fisiológico (por exemplo, alongamento) e patológico (por exemplo, isquemia). Essa metodologia possui diversas vantagens, como a exigência de uma quantidade mínima de miocárdio para avaliar a função em cardiomiócitos obtidos a partir de amostras descongeladas; utilizando cardiomiócitos de uma ampla gama de espécies (camundongos13, rato1,14,15, coelho16, porco17, cão18, cobaia19 e humano20) e diferentes locais cardíacos, incluindo os átrios, ventrículos esquerdo e direito ou uma região específica do coração infartado. Além disso, essa técnica permite fornecer concentrações específicas de Ca2+ e energia (ATP) ao medir a função de estruturas regulatórias e contratuais em sua configuração nativa.
Apesar da simplicidade dessa técnica, existem alguns passos críticos. É essencial garantir a qualidade de cada passo desde o início, incluindo a coleta de amostras. As proteínas de miofilamento são suscetíveis às proteases21. Assim, é obrigatório armazenar amostras em nitrogênio líquido imediatamente após sua coleta. Amostras frescas, que não foram previamente congeladas, desenvolverão forças significativamente maiores, por isso não é aconselhável misturar a medição feita em amostras frescas e congeladas no mesmo protocolo. O segundo passo mais crítico é a extração dos cardiomiócitos. Durante este procedimento, é crucial manter a amostra no gelo na maior parte do tempo. Um coquetel inibidor de protease pode ser usado para reduzir o risco de degradação proteica durante a extração/permeabilização22. Em terceiro lugar, as amostras devem ser cortadas em pedaços menores usando movimentos precisos do bisturi, uma vez que notamos cardiomiócitos de qualidade reduzida quando esta etapa foi desconsiderada. Outro passo crítico é lavar os cardiomiócitos, pois é difícil ter o equilíbrio certo entre lavar Tritão (permeabilize a célula, mas promove sua descolagem) e manter o maior número possível de células no sobrenante. É importante primeiro experimentar a extração e o número de lavagens para cada amostra, espécie ou protocolo. Por exemplo, em nossas mãos, notamos que as extrações de tecido de rato obeso ZSF1 têm um aspecto "gorduroso", o que tornou essas células mais escorregadias durante a colagem, mas não mais difíceis de medir. A maneira como contornamos esse problema foi realizando mais experimentos para ter um número razoável de células por animal. Além disso, é crucial selecionar uma boa célula para colar, ou seja, com boa estriação e comprimento razoável. Se o cardiomiócito não tiver essas características, ele se desprenderá principalmente das pontas da agulha ou desenvolverá nenhuma/baixa força. Também é importante usar a cola correta para fixação de cardiomiócito, considerando o tempo de colagem e sua eficácia para colar a célula à agulha. Em nossas mãos, a cola de silicone(Tabela de Materiais)cura rápido (10-15 min) e forte o suficiente. Finalmente, o último passo crítico está relacionado com o levantamento cuidadoso do cardiomiócito 5 minutos depois de colar a célula (para evitar colar a célula no deslizamento) e antes de movê-la para os poços (para evitar que a célula seja arrastada pelo estágio do microscópio). A Tabela 7 resume a solução de problemas associada a essa técnica, suas causas subjacentes e possíveis soluções para superar problemas frequentes.
A maior limitação deste método é que ele não pode responder a todas as questões relacionadas à contratilidade do miofilament, como a rapidez com que os miofilamentos ativam/desativam. No cenário in vivo, a despolarização da membrana, o aumento intracelular ca2+ e sua difusão aos miofilamentos precisam ocorrer para que os miócitos se contraam, enquanto nos cardiomiócitos esfolados Ca2+ a difusão aos miofilamentos ocorre imediatamente quando a célula está submersa na solução Ca2+. Esta taxa mais rápida de difusão de Ca2+ influenciará a análise de ativação/desativação de myofilaments23.
Esses experimentos são influenciados por diferentes fatores, incluindo temperatura, pH de solução, perturbação mecânica (slack-re-stretch vs. slack) e procedimentos de fixação celular (pin tie vs. cola), todas essas variáveis que contabilizam discrepâncias na literatura em termos de ktr e o aumento de sarcomere dependente de comprimento em força4,12.
O progresso futuro da técnica inclui a realização de estudos funcionais em cardiomiócitos intactos e não permeabilizados. Esta técnica tem a desvantagem de depender de cardiomiócitos recém-isolados (não previamente congelados). Outra questão importante não está diretamente relacionada a essa metodologia, mas que pode impactar significativamente está relacionada ao período máximo de armazenamento congelado da amostra. Especificamente, é obrigatório estabelecer o grau de degradação do miofilamento durante todo o tempo de armazenamento (ou seja, por quanto tempo as amostras congeladas podem ser armazenadas para garantir dados funcionais de boa qualidade derivados dos cardiomiócitos extraídos).
Divulgações
Os autores não têm conflito de interesses.
Agradecimentos
Os autores agradecem à Fundação Portuguesa de Ciência e Tecnologia (FCT), União Europeia, Quadro de Referência Estratégica Nacional (QREN), Fundo Europeu de Desenvolvimento Regional (FEDER) e Programa Operacional Factores de Competitividade (COMPETE) pelo financiamento da unidade de pesquisa da UnIC (UID/IC/00051/2013). Este projeto é apoiado pela FEDER por meio do COMPETE 2020 - Programa Operacional Competitividade E Internacionalização (POCI), projeto DOCNET (NORTE-01-0145-FEDER-000003), apoiado pelo Programa Operacional Norte Portugal (NORTE 2020), sob o acordo de parceria Portugal 2020, por meio do Fundo Europeu de Desenvolvimento Regional (ERDF), o projeto NETDIAMOND (POCI-01-0145-FEDER-016385), apoiado pelos Fundos Estruturais e de Investimento Europeus, programa operacional regional de Lisboa 2020. Patrícia Rodrigues foi financiada pela FCT (SFRH/BD/96026/2013) e João Almeida-Coelho foi financiada pela Universidade do Porto/FMUP e FSE-Fundo Social Europeu, NORTE 2020-Programa Operacional Regional do Norte, (NORTE-08-5369-FSE-000024-Programas Doutorais).
Materiais
| Name | Company | Catalog Number | Comments |
| Acetone | Sigma | 34580 | |
| Adenosine 5’-triphosphate disodium salt hydrate (Na2ATP) | Sigma | A2383 | |
| Calcium carbonate (CaCO3) | Merck | 1.02067.0500 | |
| Imidazole | VWR | 24720.157 | |
| Magnesium chloride hexahydrate (MgCl2.6H2O) | Merck | 1.05833.0250 | |
| Magnesium chloride solution (MgCl2 1M) | Sigma | M1028 | |
| N,N-Bis(2-hydroxyethyl)taurine (BES) | Sigma | B9879 | |
| Phosphocreatine dissodium salt hydrate (Na2PCr) | Sigma | P7936 | |
| Potassium chloride (KCl) | Merck | 1.04936.1000 | |
| Potassium hydroxide (KOH) | Merck | 8.14353.1000 | |
| Propionic acid (C3H6O2) | Merck | 8.00605.0500 | |
| Silicone Squeeze Tube | Marineland | 31003 | |
| Tritiplex (EGTA) | Merck | 1.08435.0025 | |
| Triton® X-100 10% | Merck | 648463 | |
| Tissue homogeneizer (GKH GT Motor Control) | Terre Haute Glas-col | ||
| Length Controller (Model 315C-I) | Aurora Scientific | ||
| Force Transducer (Model 403 A) | Aurora Scientific | ||
| Software ASI 600A | Aurora Scientific | ||
| Sotware VSL (Model 900B) | Aurora Scientific | ||
| Inverted Microscope (IX51) | Olympus |
Referências
- Leite-Moreira, A. M., et al. Stretch-induced compliance: a novel adaptive biological mechanism following acute cardiac load. Cardiovascular Research. 114 (5), 656-667 (2018).
- Falcao-Pires, I., Fontes-Sousa, A. P., Lopes-Conceicao, L., Bras-Silva, C., Leite-Moreira, A. F. Modulation of myocardial stiffness by β-adrenergic stimulation - its role in normal and failing heart. Physiological Research. 60 (4), 599-609 (2011).
- Cokkinos, D. V. . Introduction to Translational Cardiovascular Research. , 371-387 (2015).
- van der Velden, J., Stienen, G. J. M. Cardiac Disorders and Pathophysiology of Sarcomeric Proteins. Physiological Reviews. 99 (1), 381-426 (2019).
- Garnier, D. Attachment procedures for mechanical manipulation of isolated cardiac myocytes: a challenge. Cardiovascular Research. 28 (12), 1758-1764 (1994).
- Brady, A. J. Mechanical properties of isolated cardiac myocytes. Physiological Reviews. 71 (2), 413-428 (1991).
- Falcao-Pires, I., Leite-Moreira, A. F., Cokkinos, D. V. Chapter 20. Introduction to Translational Cardiovascular Research. 20, 371-387 (2015).
- Liang, W. Teaching calcium-induced calcium release in cardiomyocytes using a classic paper by Fabiato. Advances Physiology Education. 32 (1), 1-10 (2008).
- Roche, S. M., Gumucio, J. P., Brooks, S. V., Mendias, C. L., Claflin, D. R. Measurement of Maximum Isometric Force Generated by Permeabilized Skeletal Muscle Fibers. Journal of Visualized Experiments. (100), e52695 (2015).
- Huxley, A. F. Muscle structure and theories of contraction. Progress Biophysics and Biophysical Chemistry. 7, 255-318 (1957).
- Sequeira, V., et al. Synergistic role of ADP and Ca(2+) in diastolic myocardial stiffness. Journal Physiology. 593 (17), 3899-3916 (2015).
- Edes, I. F., et al. Rate of tension redevelopment is not modulated by sarcomere length in permeabilized human, murine, and porcine cardiomyocytes. American Journal Physiology Regulatory Integrative Comparative Physiology. 293 (1), R20-R29 (2007).
- King, N. M., et al. Mouse intact cardiac myocyte mechanics: cross-bridge and titin-based stress in unactivated cells. Journal General Physiology. 137 (1), 81-91 (2011).
- Hamdani, N., et al. Myocardial titin hypophosphorylation importantly contributes to heart failure with preserved ejection fraction in a rat metabolic risk model. Circulation Heart Failure. 6 (6), 1239-1249 (2013).
- Miranda-Silva, D., et al. Characterization of biventricular alterations in myocardial (reverse) remodelling in aortic banding-induced chronic pressure overload. Scientific Reports. 9 (1), 2956 (2019).
- Rodrigues, P. G., et al. Early myocardial changes induced by doxorubicin in the nonfailing dilated ventricle. American Journal Physiology Heart Circulatory Physiology. 316 (3), H459-H475 (2019).
- van der Velden, J., et al. Alterations in myofilament function contribute to left ventricular dysfunction in pigs early after myocardial infarction. Circulation Research. 95 (11), e85-e95 (2004).
- Wakili, R., et al. Multiple potential molecular contributors to atrial hypocontractility caused by atrial tachycardia remodeling in dogs. Circulation: Arrhythmia Electrophysiology. 3 (5), 530-541 (2010).
- Ait Mou, Y., le Guennec, J. Y., Mosca, E., de Tombe, P. P., Cazorla, O. Differential contribution of cardiac sarcomeric proteins in the myofibrillar force response to stretch. Pflugers Archiv. 457 (1), 25-36 (2008).
- Falcao-Pires, I., et al. Diabetes mellitus worsens diastolic left ventricular dysfunction in aortic stenosis through altered myocardial structure and cardiomyocyte stiffness. Circulation. 124 (10), 1151-1159 (2011).
- Lim, C. C., et al. Anthracyclines induce calpain-dependent titin proteolysis and necrosis in cardiomyocytes. Journal Biology Chemistry. 279 (9), 8290-8299 (2004).
- Woulfe, K. C., et al. A Novel Method of Isolating Myofibrils From Primary Cardiomyocyte Culture Suitable for Myofibril Mechanical Study. Frontiers Cardiovascular Medicine. 6, 12 (2019).
- Ait Mou, Y., Bollensdorff, C., Cazorla, O., Magdi, Y., de Tombe, P. P. Exploring cardiac biophysical properties. Global Cardiology Science Practice. 2015, 10 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados