Method Article
Evaluación In Vitro de la Función Cardíaca usando Cardiomiocitos Pielados
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo tiene como objetivo describir paso a paso la técnica de extracción y evaluación de la función cardíaca utilizando cardiomiocitos despellejados. Esta metodología permite la medición y la agudomodulación de la función de miofilamento utilizando pequeñas biopsias congeladas que se pueden recoger de diferentes lugares cardíacos, desde ratones hasta hombres.
Resumen
En este artículo, describimos los pasos necesarios para aislar un solo cardiomiocito permeabilizado ("piel") y conectarlo a un aparato de medición de fuerza y un motor para realizar estudios funcionales. Estos estudios permitirán medir la rigidez cardiomiocitos (fuerza pasiva) y su activación con diferentes soluciones que contienen calcio (Ca2+)para determinar, entre otros: desarrollo de fuerza máxima, sensibilidad a miofilamento Ca2+(pCa50),cooperatividad (nHill) y la tasa de reurbanización de fuerza (ktr). Este método también permite determinar los efectos de los fármacos que actúan directamente sobre los miofilamentos y de la expresión de proteínas recombinantes exógenas en las propiedades activas y pasivas de los cardiomiocitos. Clínicamente, los estudios de cardiomiocitos despellejados ponen de relieve la fisiopatología de muchas enfermedades miocárdicas y permiten la evaluación in vitro del impacto de las intervenciones terapéuticas dirigidas a los miofilamentos. En conjunto, esta técnica permite la clarificación de la fisiopatología cardíaca mediante la investigación de correlaciones entre parámetros in vitro e in vivo en modelos animales y tejido humano obtenido durante la cirugía de corazón abierto o trasplante.
Introducción
Tradicionalmente, la evaluación de las propiedades mecánicas del miocardio se ha intentado principalmente en preparaciones multicelulares, tales como músculos papilares y trabeculae1,2. Las tiras de músculos cardíacos multicelulares incluyen una población heterogénea de células, incluyendo cardiomiocitos contráctiles con un patrón desconocido de orientación y generación de fuerza, actividad eléctrica y distribuciones de estrés/deformación, así como una matriz de tejido conectivo circundante3,4. Una preparación sin colágeno y que contenga un solo cardiomiocitos permitiría medir la longitud de los sarcomos y las propiedades contráctiles de puente cruzado de una manera muy precisa y controlada5,6. Por lo tanto, en las últimas cuatro décadas, se desarrollaron varias metodologías que permitieron investigar las propiedades mecánicas, contráctiles y de relajación de un solo cardiomiocitos6,7. La función contráctil de estas células depende en gran medida de la longitud de los sarcomos y de la cinética ciclista de puente cruzado3. Por lo tanto, es deseable investigar la función muscular directamente en células cardíacas aisladas individuales, teniendo en cuenta que permite evaluar la longitud y el rendimiento de los sarcomos, así como la función de puente cruzado y las propiedades contráctiles. Sin embargo, aislar y conectar cardiomiocitos funcionales con una resolución de sarcomere óptico razonable, mientras que la medición de la fuerza de grabación a nivel de N sigue siendo difícil y evoluciona3,6. Otros desafíos son la logística que debe instalarse para aislar los cardiomiocitos de las biopsias recién recolectadas. La imprevisibilidad de la recolección de biopsias humanas, por ejemplo, puede poner en peligro la viabilidad de los experimentos.
Además, las preocupaciones éticas relativas a la sustitución, reducción y refinamiento de la experimentación animal para procedimientos científicos (principios de los 3R) han promovido cambios de estudio a nivel celular y tisular, preferiblemente en biopsias humanas, o en muestras de animales más pequeños. De hecho, un refinamiento progresivo de las metodologías para evaluar la función cardíaca in vitro en un nivel más pequeño de complejidad permite una adecuada integración de los resultados a todo el cuerpo y traducirlos al escenario clínico7. En conjunto, el uso de muestras almacenadas a -80 oC para extraer cardiomiocitos puede ser una alternativa atractiva.
El tejido miocárdico se corta en trozos pequeños y se homogeneiza con un mortero y un pestillo. El resultado de esta homogeneización es una suspensión de células agrupadas y aisladas con diferentes grados de daño sarcolemmal, en la que el mioplasmo se expone al medio de baño y se lavan todos los componentes celulares. Se conservan estructuras como las miofibrils que están más lejos del sarcolemma. Así, el acortamiento de los sarcomos y las propiedades funcionales asociadas con el aparato miofibrilar se mantienen intactas y se pueden registrar8,9.
El sistema de medición de la fuerza del cardiomiocitos consiste en un motor electromagnético, utilizado para ajustar la longitud de los cardiomiocitos, y un transductor de fuerza, que mide la contracción isométrica del cardiomiocitos. Un cardiomiocitos permeabilizado o despellejado se coloca en una cámara experimental que contiene una solución relajante ([Ca2+] < 10 nM) y está pegado al silicio a 2 agujas delgadas: una unida al motor y la otra al transductor de fuerza. Un sistema óptico se utiliza para determinar la morfología de los cardiomiocitos y la longitud de los sarcomeres. El protocolo experimental a menudo consiste en una serie de grabaciones de fuerza sobre soluciones tampón que contienen diferentes concentraciones de Ca2+, la determinación de la cinética de puente cruzado de actina-miosina y la medición de la tensión pasiva de los cardiomiocitos montados a longitudes de sarcomer predefinidas (Figura 1). El aislamiento de cardiomiocitos permeabilizados a partir de muestras miocárdicas congeladas en nitrógeno líquido (y almacenadas posteriormente a -80 oC) es una técnica que utiliza mecánica celular y bioquímica de proteínas para medir la fuerza máxima de Ca2+activada (activa) por área transversal (Tactivo,kN-m-2),Ca2 +Tensión independiente (pasiva) (Tpasiva,kN-m-2), miofilamentos Ca2+-sensibilidad (pCa50),miofilamentos cooperatividad (nHill), la tasa de reurbanización de fuerza (ktr) así como las dependencias de longitud de sarcomere de Tactivo, Tpasivo,pCa50, nHill y ktr.
El objetivo de este protocolo es ilustrar y resumir el potencial del sistema de medición de la fuerza cardiomiocitos como un procedimiento fiable para evaluar las propiedades mecánicas funcionales de los cardiomiocitos de una sola piel aislados de muestras congeladas de diferentes especies.
Protocolo
Todos los experimentos con animales cumplen con la Guía para el Cuidado y Uso de Animales de Laboratorio (NiH Publication no 85-23, revisada 2011) y la ley portuguesa sobre bienestar animal (DL 129/92, DL 197/96; P 1131/97). Las autoridades locales competentes aprobaron este protocolo experimental (018833).
1. Preparación de la solución de stock (Tabla 1)
- Preparar 1.000 ml de solución relajante para el aislamiento de cardiomiocitos (RELAX-ISO) siguiendo las instrucciones de la Tabla 2. Disuelva el reactivo anterior en ≈500 ml y ajuste el pH a 7.0 con KOH. Ajuste el volumen final a 1000 mL.
- Distribuya RELAX-ISO en tubos de 50 ml. Conservar a -20oC.
- Preparar 250 ml de solución activador siguiendo las instrucciones de la Tabla 3. Disolver los reactivos anteriores en ≈100 ml de agua ultrapura. Ajuste el pH a 7.1 con 5 M KOH a 15 oC.
NOTA: Por lo general, es necesario añadir una cantidad significativa de KOH para alcanzar el pH deseado. Coloque el balón volumétrico en una caja con hielo para enfriar la solución a 15 oC.- Ajuste el volumen final a 250 ml. Agitar esta solución continuamente con un agitador magnético hasta el momento de mezclarla con la solución relajante.
- Preparar 100 ml de solución relajante siguiendo las instrucciones de la Tabla 4. Disolver los reactivos anteriores en ≈50 ml de agua ultrapura. Ajuste el pH a 7.1 con KOH 5 M a 15 oC.
NOTA: Por lo general, es necesario añadir una cantidad significativa de KOH para alcanzar un pH de 7.1. Coloque el balón volumétrico en una caja llena de hielo para enfriar la solución a 15 oC. La resistencia iónica de las soluciones utilizadas durante las mediciones ascendió a 180 mM.- Ajuste el volumen final a 100 ml. Agitar esta solución continuamente con un agitador magnético hasta el momento de mezclarla con la solución de activación.
- Mezclar soluciones de activación y relajación en las proporciones presentadas en la Tabla 5 para obtener soluciones pCa entre 5.0 y 6.0.
- Mantenga siempre relajadas y activando las soluciones agitando mientras mezcla ambas.
- Aliquot cada mezcla a 2 ml de microtubos. Almacene todos los microtubos a -20 oC.
- Prepare un lote diferente de solución pCa (4.5 a 6.0) para cada protocolo.
2. Calibración del transductor de fuerza
NOTA: La calibración del transductor de fuerza es un procedimiento de rutina que debe realizarse cada dos meses o siempre que se sospeche que no está calibrado. El transductor de fuerza es muy sensible y se rompe fácilmente. Debe ser manejado suavemente en cada paso de su uso, incluyendo la calibración, encolado del cardiomiocitos y la limpieza.
- Separe el transductor de fuerza del resto del aparato.
- Con la ayuda de una abrazadera, coloque el transductor de fuerza horizontalmente de tal manera que la aguja apunte hacia abajo en la misma orientación que el cardiomiocitos desarrollará fuerza. Esto facilitará el suspensión de una serie de masas con pesos conocidos (banda elástica, sutura o pasador).
NOTA: Compruebe las características del transductor de fuerza antes de continuar con este paso para comprobar el factor de escala [mg/volt] y evitar el peso excesivo en el transductor. Para el modelo de transductor de fuerza, el factor de escala es 50 (50 mg corresponden a 1 voltio) y utilizamos 5 pesos entre 12,5 y 250 mg. - Encienda el transductor de fuerza y déjelo calentar durante 30 minutos.
- Comience colgando la masa más ligera en el transductor de fuerza y registrando la tensión correspondiente medida en FORCE OUT.
- Repita este procedimiento para un máximo de cinco pesos.
- Fuerza de trazado aplicada al transductor de fuerza (carga) frente a la tensión y comprobar la linealidad.
- Si no hay linealidad, ajuste los potenciómetros cero y de ganancia en la placa de circuito del transductor. Consulte sus instrucciones específicas para obtener más información.
- Gire el potenciómetro cero hasta que la tensión de salida diga 0,0 V.
- Entregue un peso medio en la aguja del transductor y ajuste el potenciómetro de ganancia para leer la tensión correspondiente (por ejemplo, 50 mg corresponden a 1 V). Retire el peso y vuelva a ajustar el potenciómetro cero a 0.0.
- Repita el paso 2.6.2 hasta que la salida con y sin el peso sea correcta.
- Vuelva a montar el transductor de fuerza en el aparato.
3. Ajuste del aparato experimental
- Descongelar un vial de cada una de las soluciones de activación, 4.5, 5.0, 5.2, 5.4, 5.6, 5.8, 6.0 y relajantes y mantenerlas en hielo.
NOTA: ATP y PCr son compuestos lábiles que deben mantenerse a temperaturas frías. - Preparar el microscopio, el aparato de ensayo y el ordenador asociado para su uso(Figura 1).
- Ajuste la temperatura de modo que el termómetro en la cámara lea 15 oC. Realizar todos los experimentos a esta temperatura excepto las incubaciones de quinasa y fosfatasa (20 oC).
- Encienda el transductor de fuerza y el motor.
4. Extracción y permeabilización de cardiomiocitos despellejados
- Descongelación 50 mL de solución RELAX-ISO.
- Encienda la centrífuga y enfríe rápidamente hasta 4 oC.
- Descongelar 3-5 g de una muestra de miocárdico en un plato de Petri que contenga 2,5 ml de solución RELAX-ISO.
- Cortar el tejido en trozos pequeños con una cuchilla de bisturí(Figura 2). Corte la muestra de una manera precisa para evitar daños innecesarios en las células.
- Transfiera los 2,5 ml de solución RELAX-ISO con el tejido a un vaso Potter-Elvehjem utilizando una punta de pipeta cortada.
- Interrumpir mecánicamente el tejido con una amoladora a una velocidad de rotación de 30-40 rpm. Presione el tejido 3 veces durante 2 s cada uno para obtener una buena suspensión celular.
- Preparar un 10% de la solución Tritón en RELAX-ISO (250 l de Tritón con 2,25 ml de RELAX-ISO) en un tubo de 15 ml y añadir esta solución a la suspensión celular.
- Mezcle suavemente invirtiendo el tubo 3 veces.
- Incubar a temperatura ambiente durante 1 min y 4 min sobre hielo.
- Lavar el Tritón añadiendo RELAX-ISO hasta la parte superior del tubo de 15 ml; mezcla suavemente (invirtiendo 3 veces el tubo) y finalmente girando hacia abajo las células en una centrífuga en ángulo (1 min a 348 x g). Retire el sobrenadante hasta 3 ml por encima del pellet celular.
NOTA: Retire suavemente el sobrenadante para evitar molestar el pellet celular. Aún así, algunas células en el sobrenadante inevitablemente se perderán. - Repita el paso 4.10 al menos 4 veces o hasta que no se observen más burbujas producidas por residuos de Tritón.
NOTA: Cuantos más pasos se realicen, más células se perderán con el sobrenadante descartado. - En el último lavado, retire el sobrenadante hasta un volumen de 5-10 ml de suspensión celular.
5. Seleccionar y pegar el cardiomiocitos despellejado
- Coloque una gota de suspensión celular en un cubreobjetos en la parte superior de una corredera de vidrio en el portaobjetos del microscopio (Figura 1).
- Seleccione un cardiomiocitos en forma de varilla con un buen patrón y tamaño de estriación(Figura 2).
- Encuentre las puntas de la aguja del transductor de fuerza y el motor utilizando el aumento más bajo del microscopio invertido.
- Gire el cubreobjetos para colocar el cardiomiocito seleccionado horizontalmente de modo que sus extremos estén alineados con la aguja del transductor de fuerza y el motor (Figura 2).
- Coloque una delgada línea de pegamento en el lado del cubreobjetos con la ayuda de una punta de hisopo (Figura 2).
- Sumerja las puntas de la aguja del transductor de fuerza y el motor en la línea de pegamento para crear un halo de pegamento alrededor de ambas puntas.
NOTA: Los pasos 5.6 - 5.10 se logran mediante un uso cuidadoso de los microposidores motorizados. - Mueva rápidamente las puntas de la aguja cerca del plano focal del cardiomiocitos.
- Mueva la punta de la aguja del transductor de fuerza hacia abajo para que se pegue a un borde del cardiomiocitos.
- Repita este procedimiento con la punta del motor y la otra extremidad de la célula.
NOTA: Este procedimiento debe tomar menos de 2-3 min como el pegamento comienza a curarse muy rápido. - Después de 5-8 min, levante las agujas ≈15 m para evitar pegar la célula al cubreobjetos. Esto se hace moviendo hacia arriba ambos micromanipuladores simultáneamente.
- Deja que el pegamento se cure. Este procedimiento puede durar de 15 a 45 min, dependiendo del tipo de pegamento. En nuestro caso, el cardiomiocitos se pega adecuadamente después de ≈15 min.
6. Medición de la fuerza de grabación de la sensibilidad activa, pasiva y Ca2+
- Llenar el primer pozo experimental con la solución relajante (55-100 l en el aparato experimental) y el segundo pozo experimental con solución de activación.
- Usando el software de la cámara, coloque la región de interés (ROI) en un área del cardiomiocitos con un patrón claro de estría.
NOTA: En el caso de los miocitos cardíacos, la longitud de los sarcomeres de funcionamiento varía entre 1,8 y 2,2 m, y la longitud óptima de la sarcomere es de alrededor de 2,15 m. - Mida la distancia entre los dos extremos del cardiomiocitos (desde el motor hasta el halo de pegamento del transductor, Figura 3) después de que se haya establecido la longitud óptima de sarcomere (2,2 m). Registre el valor como longitud de miocito en el software.
- Mida el ancho y la profundidad de los cardiomiocitos, este último con la ayuda de un espejo de prisma colocado perpendicular a la célula.
NOTA: Se necesitará una fuente de luz externa potente para visualizar la célula a través del prisma. En caso de que no haya prisma, y suponiendo que las células cardíacas tienen una forma elíptica, la profundidad de los cardiomiocitos se puede inferir como 70% de ancho de cardiomiocitos. - Calcular el área transversal (CSA, mm2) suponiendo una forma elíptica del cardiomiocitos.

- Mueva suavemente la etapa del microscopio para que la célula se mueva del cubreobjetos a la solución relajante que contiene bien en la parte posterior del escenario.
NOTA: Este procedimiento puede dañar fácilmente la célula. Antes de mover la célula, mueva suavemente las agujas hacia arriba un poco más. Evite retirar la célula de la solución. - Seleccione el protocolo en software que contiene el acortamiento de dos celdas (80% de su longitud inicial), que ocurrirá cuando la celda se emerge en la solución Ca2+ y en la solución relajante, respectivamente (Figura 1, Archivo Suplementario).
NOTA: La primera "Slack" de la célula se realizará dentro de la solución de activación y la segunda "Slack" dentro de la solución relajante. Al hacer esto, el usuario será capaz de calcular la fuerza total(F total) de la celda desde el 1pt y la fuerza pasiva (Fpasiva)de la celda de la2a. Utilice la fórmula para calcular la fuerza activa, Factiva -F total - Fpasiva. La célula se acorta 80% para separar todas las fuerzas récord de los puentes cruzados. - Provoca la contracción isométrica moviendo la etapa del microscopio para que el cardiomiocitos se mueva de la solución relajante a la solución activador (pCa-4.5(1)).
NOTA: Si la celda es funcional, se contraerá inmediatamente. - Al llegar a la meseta de fuerza, comience a registrar los datos de fuerza.
NOTA: Las pruebas se pueden realizar individualmente. Dependiendo del software existe la posibilidad de crear una secuencia de pruebas que corresponderán a las diferentes soluciones de Ca2+ dentro de un protocolo de sensibilidad Ca2+(Figura 1, Archivo Complementario). - Espere 10 s y, a continuación, cambie la celda sumergida en la solución de activación.
NOTA: Es importante esperar 10 s antes de sumergir la celda en una solución relajante. Si la celda se mueve demasiado pronto, es posible que se pierdan datos importantes para calcular la fuerza de reurbanización de la celda (valor ktr). - Mueva rápidamente el escenario para que el cardiomiocitos sumerja en la solución relajante.
- Espere hasta que se detenga la prueba.
- Repita los pasos 6.8 a 6.12 para que la celda se active dos veces en la solución de activación (pCa-4.5(2)).
NOTA: Por lo general, después de la primera activación, los extremos del cardiomiocitos pueden desprenderse ligeramente de las puntas de la aguja, cambiando la longitud del cardiomiocitos, CSA y/o la longitud del sarcomere. Reajuste a la longitud de sarcomere deseada e introduzca las dimensiones corregidas en el software.- Continúe con el paso 6.13.2 para el protocolo de sensibilidad Ca2+ o guarde los datos, si los valores de fuerza pasiva y activa de la celda son los únicos parámetros necesarios y desensabra la celda de las agujas y límpiela con acetona para eliminar el pegamento.
- Ajuste la longitud de los sarcomos de la célula a 2,2 m estirándola ligeramente de nuevo, si es necesario.
- Sustituya la solución de activación por la siguiente solución de Ca2+ (aquí 55-100 l). Repita los pasos 6.8 - 6.12.
- Sustituya la solución de activación por la siguiente solución ca2+ (55-100 l aquí) y repita los pasos 6.8 - 6.12 hasta que se hayan probado todas las soluciones (5.0, 5.2, 5.4, 5.6, 5.8, 6.0).
- Por último, vuelva a activar la célula con la solución activadora (pCa4.5(3)). Repita los pasos 6.8 a 6.12.
7. Incubación con quinasas y fosfatasas
- Después de realizar el protocolo de referencia seleccionado, diluya la quinasa/fosfatasa en Solución relajante a la concentración recomendada.
NOTA: Se recomienda llevar a cabo una curva de dosis-respuesta antes del experimento. - Ajuste la temperatura de los pozos experimentales a 20 oC.
- Llenar los pozos experimentales con quinasa/fosfatasa, solución relajante y solución activadora (55-100 l).
- Mueva suavemente la etapa del microscopio para que la célula se sumerja en el pozo que contiene quinasa/fosfatasa.
- Incubar el cardiomiocitos con la quinasa/fosfatasa durante al menos 30 min o según las instrucciones del fabricante.
- Repita el protocolo de línea base seleccionado.
8. Finalización del experimento
- Desencolar el cardiomiocito de las puntas del transductor de fuerza y el motor estirando la célula.
- Retire con cuidado el halo de pegamento de las puntas de la aguja con un hisopo de algodón empapado en acetona.
- Apaguen el equipo.
9. Análisis de los datos
- Recoger todos los archivos de cada cardiomiocitos probados.
NOTA: Cada prueba corresponderá a un archivo. Esto significa que para cada solución de Ca2+ o longitud de sarcomere, habrá un archivo correspondiente. - Calcular las fuerzas activas y pasivas de un solo cardiomiocitos.
- Abra el archivo correspondiente a la primera activación (pCa-4.5(1)) utilizando una hoja de cálculo (Figura 3A, Apéndice A en archivo suplementario).
NOTA: Utilizamos un programa personalizado para realizar el análisis. Consulte el Apéndice A en el archivo suplementario. - Promedio ≈60 valores antes y promedio ≈60 valores después de la holgura de 1pt de la celda (cuando la celda se sumerge en la solución Ca2+). Estos 2 valores corresponden a a y b, respectivamente.
- Repita el mismo análisis para la2a holgura de la celda (cuando la celda se sumerge en una solución relajante). Estos 2 valores corresponden a c y d, respectivamente.
- Calcular la diferencia entre a y b (fuerza total,F total).
- Calcular la diferencia entre c y d (fuerza pasiva, Fpasiva).
- Calcular la fuerza activa, Factiva - Ftotal - Fpasiva.
- Normalizar todos los valores de fuerza a CSA (ver fórmula anterior) para obtener la tensión total(T total),la tensión pasiva (Tpasiva)y la tensión activa (Tactivo).
- Repita los pasos 9.2.1 a 9.2.5 para la2a activación (pCa-4.5(2)).
- Considere estos valores como aquellos que representan Ttotal,Tactivo yT pasivo del cardiomiocitos bajo análisis.
NOTA: La primera activación de la celda con pCa4.5(1) se asocia generalmente con alteraciones en las dimensiones de la celda. Por esta razón, la 2a activación con pCa4.5 es más precisa y es la que se debe utilizar. - Repita los pasos 9.2.1 a 9.2.5 para cada archivo/pCa probado soluciones (5.0, 5.2, 5.4, 5.6, 5.8, 6.0, 4.5(3)).
- Abra el archivo correspondiente a la primera activación (pCa-4.5(1)) utilizando una hoja de cálculo (Figura 3A, Apéndice A en archivo suplementario).
- Calcular pCa50 y nHill de un solo cardiomiocitos.
NOTA: Para este análisis, utilice los valoresactivos F no normalizados de los archivos 4.5(2), 5.0, 5.2, 5.4, 5.6, 5.8, 6.0 y 4.5(3).- Coloque en un archivo de hoja de cálculo todos los valores no normalizados de Factivo para cada solución Ca2+ probada (4.5(2),5.0, 5.2, 5.4, 5.6, 5.8, 6.0, 4.5(3)).
- Calcular el factor de corrección - Factivo [4.5(2)] - Factivo [4.5(3)] / 7.
- Calcule los valores corregidos de Factivo para cada ca2+ soluciones (5.0, 5.2, 5.4, 5.6, 5.8, 6.0) restando Factivo - factor de corrección.
- Calcule la fuerza relativa (Frelativa)para cada ca2+ soluciones normalizando cada F valoresactivos por el valor corregido correspondiente.
NOTA: Elpariente F [4.5(3)] debe ser igual a 1. Cada protocolo experimental comienza y termina con una activación de control en saturación de la concentración de Ca2+ (pCa 4.5(2) y 4.5(3)). Esto permite la normalización de la fuerza y la evaluación del desglose de los preparativos a través de la comparación de los cambios en la fuerza máxima activada por Ca2+(Fmax). Si al final del protocolo experimental, el cardiomiocitos produce menos del 70% de la fuerza máxima de la primera contracción, dicha célula/medida debe excluirse del análisis. - Utilice los valoresde P relativo y pCa correspondientes para ajustarse a una curva sigmoideal con la siguiente ecuación F(Ca) - CanHill/ (Ca50nHill + CanHill).
- Extrapolar valores pCa y nHill de la ecuación mencionada anteriormente.
- Calcular la tasa de reurbanización de fuerza (ktr) de un solo cardiomiocitos.
- Realice un ajuste a la curva que corresponda a los valores inmediatamente después de la holgura de la celda 1pt.
- Calcule la pendiente de la curva y este valor corresponderá a la tasa de reurbanización de fuerza.
- Repita los pasos 9.4.1 y 9.4.2 para cada solución Ca2+.
NOTA: Se obtendrá un ajuste de curva deficiente para las soluciones Ca más bajas (R al cuadrado≤0.90).
Resultados
Los cardiomiocitos permeabilizados funcionales deben parecer uniformes y con un patrón de estrías consistente a lo largo de todo el experimento. Aunque se espera un cierto grado de deterioro y disminución de la fuerza después de experimentos prolongados, los valores de tensión activa deben ser relativamente estables. Se deben excluir las células que muestren signos claros de pérdida de estrías o disminución significativa de la fuerza (<15 kN-m -2 o <80% de su fuerza activa inicial). La Tabla 6 muestra los valores normales esperados para los parámetros más importantes derivados de roedores, cerdos y muestras humanas.
Los parámetros obtenidos dependen principalmente del protocolo elegido. La Figura 5 muestra trazas de fuerza representativas de 3, de 8, grabaciones de fuerza necesarias para llevar a cabo un protocolo de miofilamentos Ca2+-sensibilidad. Al transferir la célula a un pozo que contiene la solución activadora, el cardiomiocitos comienza a desarrollar fuerza hasta que alcanza una meseta. Después de una prueba de holgura rápida (duración de 1 ms), por la cual el cardiomiocitos se acorta al 80% de su longitud, obtenemos los valores basales de fuerza cero. Después de la prueba de holgura, la célula continúa desarrollando fuerza a medida que se sumerge en la solución de activación. La fuerza total(totalF) se calcula restando el valor de la meseta del valor mínimo. La pendiente de la última parte de esta curva nos da el valor de la tasa de reurbanización de fuerza (ktr) (Figura 6), que es una medida de la tasa aparente de fijación y desprendimiento de puente cruzado (fapp y gaap)10. Cuando el valor de ktr R2 es <0.90, se debe excluir el valor ktr y, por lo general, esto sucede en concentraciones inferiores de Ca2+ (pCa 5.6, 5.8 y 6.0). Después de transferir la célula de nuevo a un pozo que contiene la solución relajante, la célula se relaja y su fuerza cae. La fuerza pasiva (Fpasiva)se calcula restando el valor mínimo (obtenido después de un acortamiento prolongado de la celda) a este nuevo valor de fuerza. La fuerza activa resulta de la diferencia entre Ftotal y Fpasivo.
La fuerza activa y pasiva máxima que caracteriza a un cardiomiocitos es la derivada de la segunda activación celular con una solución saturante de Ca2+(pCa 4.5). La primera activación generalmente se descarta ya que la longitud de la sarcomere a menudo necesita ser reajustada.
Para llevar a cabo un protocolo de miofilamento Ca2+-sensibilidad, es necesario realizar al menos 9 pruebas de activación (4.5; 4.5; 5.2; 5.6; 6.0; 5.0; 5.4; 5.8 y 4.5). Esta secuencia es simplemente ejemplificante, pero siempre debe comenzar con 4.5 (dos veces) y terminar con 4.5. La programación del software de adquisición de datos para un protocolo de sensibilidad myofilament Ca2+se describe en la Figura 1 del Archivo Suplementario.
Después de calcular la fuerza activa para todas estas soluciones de activación, compruebe si la última activación produjo más del 80% de la fuerza máxima inicial (de lo contrario, los resultados de esta celda deben descartarse, como se mencionó anteriormente). Para corregir la disminución en Fmax durante la serie experimental, los valoresmáximos F interpolados se pueden utilizar para normalizar los puntos de datos. Los datos normalizados se pueden ajustar a una curva sigmoidal con la siguiente ecuación F(Ca) - CanHill/(Ca50nHill + CanHill). Los valores de los parámetros obtenidos representan la sensibilidad al calcio (Ca50,que se puede convertir en pCa50) y la cooperatividad (nHill). Todos los valores de fuerza se pueden convertir en valores de tensión después de normalizarse al área transversal. Además de la sensibilidad myofilament Ca2+y los protocolos de activación dependientes de la longitud, se pueden realizar otras pruebas. Tal es el caso de las dependencias de longitud de sarcomere de Tactivo,Tpasivo (Figura 7), y fuerza residual de cardiomiocitos. Las grabaciones de fuerza residual se calculan a partir de la recuperación de fuerza inicial (pCa 4.5) alcanzada después del cambio de longitud de la célula (80%) y normalizado a cada fuerza total de estado estacionario alcanzada antes del cambio de longitud11. El aumento de la fuerza residual suele ser indicativo de puentes cruzados con cinética de desprendimiento lento y mayor rigidez.
Por último, debemos destacar que esta técnica se puede llevar a cabo en cardiomiocitos despellejados extraídos mecánicamente de muestras congeladas o recién recogidas, así como aislados enzimáticos seguidos de la permeabilización de sus membranas. La forma en que los cardiomiocitos son aislados afecta significativamente los resultados derivados de esta técnica. La Figura 8 muestra las diferencias observadas entre los tres procedimientos de aislamiento.

Figura 1: Esquema integrado del aparato de ensayo. El aparato de prueba incluye el microscopio, los micromanipuladores y el ordenador asociado. La parte inferior de la figura muestra un cardiomiocito de piel pegado entre el motor y el transductor de fuerza. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Diagrama de flujo del protocolo de aislamiento celular, permeabilización y encolado. La imagen de esquina superior izquierda se compone de 4 imágenes que muestran piezas de la muestra del corazón en la solución RELAX-ISO (A) en una placa Petri, (B) en un tubo utilizado para la homogeneización mecánica del tejido, (C) el homogeneizador, (D) el tejido inmediatamente después de la homogeneización y (E) cuando está en un tubo para la permeabilización Tritón. Haga clic aquí para ver una versión más grande de esta figura.
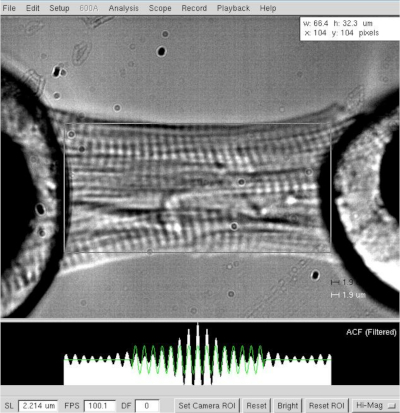
Figura 3: Determinación de la longitud y la longitud de la sarcomere de un cardiomiocitos de piel. Determinación de la longitud y la anchura de la celda a una longitud de sarcomere de ≈2,2 m. Haga clic aquí para ver una versión más grande de esta figura.
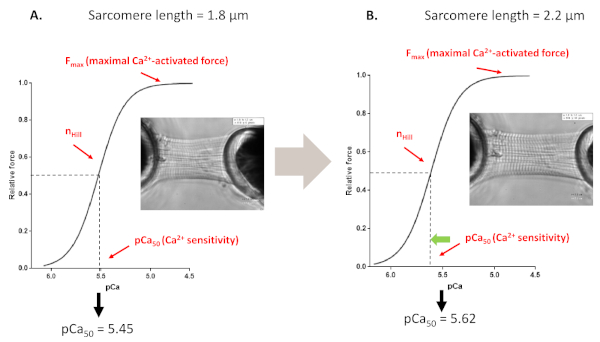
Figura 4: Protocolo de activación dependiente de la longitud (imita el mecanismo De Frank-starling in vitro). Trazas y parámetros de fuerza representativas derivados de los protocolos de sensibilidad Ca2+ de myofilaments realizados antes(A, 1,8 m) y después de estirar un cardiomiocito hasta 2,2 m (B). Haga clic aquí para ver una versión más grande de esta figura.
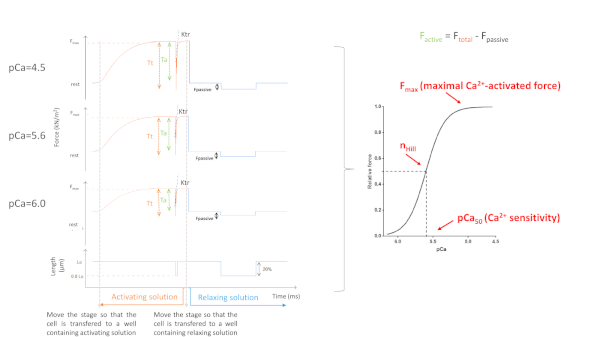
Figura 5: Myofilaments Ca2+-protocolo de sensibilidad. Trazas de fuerza representativas y parámetros derivados. En aras de la simplicidad, sólo se representan 3 de 8 curvas de fuerza. A saber, un cardiomiocitos activado con la saturación, una solución intermedia y la más baja de Ca2+(4.5, 5,6 y 6.0, respectivamente). Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Rastros representativos de una célula cardíaca de ratones activadas en diferentes soluciones de calcio y la curva de ajuste ktr respectiva. (A) pCa 4.5; (B) pCa 5.0; (C) pCa 5.2; (D) pCa 5.4; (E) pCa 5.6; (F) valores pCa 6.0 y E para tensión total, pasiva y activa, valor ktr y Rsquare para ktr ajuste. Haga clic aquí para ver una versión más grande de esta figura.
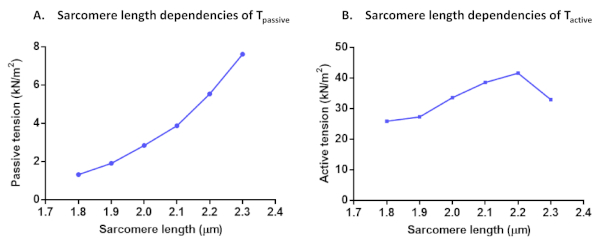
Figura 7: Protocolos de dependencias de longitud de sarcomere de Tpasivo (A) y Tactivo (B). La tensión pasiva y la tensión activa se calcularon en un solo cardiomiocito a una longitud de sarcomere de 1,8 a 2,3 m. Haga clic aquí para ver una versión más grande de esta figura.
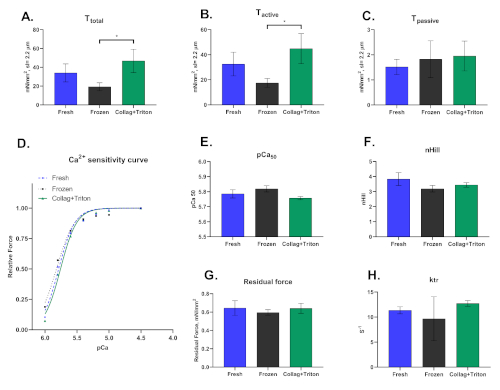
Figura 8: Resultados representativos para cardiomiocitos aislados mecánicamente de muestras de miocardio frescas ("Frescas") y congeladas ("Frozen"), así como del corazón digerido de colagenasa (técnica Langgendorf modificada) con permeabilización posterior con Tritón ("Collag+Triton"). Valores de (A) Tensión total,( B) Tensión activa y (C) Tensión pasoíptica de cardiomiocitos activados con solución pCa 4.5 a una longitud de sarcomere de ≈2,2 m. (D) Curva de sensibilidad al calcio y los valores respectivos para (E) pCa50 y (F) nHill. (G) Valores de fuerza residual y ktr (H) calculados en la solución de activación máxima (pCa 4.5). Haga clic aquí para ver una versión más grande de esta figura.
Archivo Suplementario. Haga clic aquí para descargar este archivo.
| Almacenar en | Soluciones de stock | [M] | Volumen final (ml) | Peso/volumen | Notas |
| 4oC | Hidróxido de potasio (KOH) | 1 | 100 | 5.611 g | Para ajustar el pH |
| 4oC | Hidróxido de potasio (KOH) | 5 | 50 | 14,03 g | Para ajustar el pH |
| 4oC | Bes | 1 | 50 | 10,66 g | |
| 4oC | Acido propiónico | 1 | 100 | 7.483 mL | Ajuste el pH a 7.0 con 5M o 1M KOH |
| 4oC | CaEGTA compuesto por: | 0.1 | 100 | Mezclar y calentar la solución a 60oC durante más de 1 hora. Ajuste el pH a 5-6 con 1M KOH. | |
| - CaCO3 | 0.1 | 1.001 g | |||
| - Titriplex (EGTA) | 0.1 | 3.804 |
Tabla 1: Instrucciones para la preparación de la solución en stock.
| RELAX-ISO (para aislamiento de cardiomiocitos) | [mM] | Peso |
| Na2ATP | 5.95 | 3,28 g |
| MgCl2.6H2O | 6.04 | 1.23 g |
| Tritiplex (EGTA) | 2 | 0,76 g |
| UC2 | 139.6 | 10,41 g |
| Imidazol | 10 | 0,68 g |
Tabla 2: Instrucciones para la preparación de la solución Relax-ISO.
| Activación de la solución (para las mediciones) | [mM] | Peso / volumen |
| Na2ATP | 5.97 | 0.823 g |
| MgCl 1M | 6.28 | 1,57 mL |
| Acido propiónico | 40.64 | 10,16 mL |
| Bes | 100 | 25 mL |
| CaEGTA (solución de stock previamente preparada) | 7 | 17,5 mL |
| Na2PCr | 14.5 | 0.925 g |
Tabla 3: Instrucciones para activar la preparación de la solución.
| Solución relajante (para las mediciones) | [mM] | Peso / volumen |
| Na2ATP | 5.89 | 0.325 g |
| MgCl 1M | 6.48 | 0,65 mL |
| Acido propiónico | 40.76 | 4.08 mL |
| Bes | 100 | 10 mL |
| Titriplex (EGTA) | 6.97 | 0,265 g |
| Na2PCr | 14.5 | 0.370 g |
Tabla 4: Instrucciones para relajar la preparación de la solución.
| pCa -Log [Ca2+] | Relajante (pCa-9,0) Ml | Ativating (pCa-4.5) Ml |
| 5 | 0.86 | 39.14 |
| 5.1 | 1.2 | 38.80 |
| 5.2 | 1.54 | 38.46 |
| 5.3 | 2 | 38.00 |
| 5.4 | 2.51 | 37.49 |
| 5.5 | 3.14 | 36.86 |
| 5.6 | 3.89 | 36.11 |
| 5.7 | 4.8 | 35.20 |
| 5.8 | 5.89 | 34.11 |
| 5.9 | 7.14 | 32.86 |
| 6 | 8.57 | 31.43 |
Tabla 5: Instrucciones para la preparación de soluciones pCa.
| Parámetro | Roedor | Cerdo | Humano |
| Tensión activa, kN.m-2 (a 2,2 m) | 17 – 28 | 19 – 40 | 19 – 36 |
| Tensión pasiva, kN.m-2 (a 2,2 m) | 3.6 – 5.5 | 1.9 – 6.8 | 1.8 – 2.3 |
| pCa50 | 5.58 – 5.64 | 5.40 – 5.50 | 5.43 – 5.82 |
| Nhill | 2.60 – 2.76 | 2.95 – 3.36 | 2.99 – 3.10 |
| ktr, s-1 | 4.00 – 8.00 | 1.00 – 3.00 | 0.90 – 2.00 |
Tabla 6: Parámetros e índices típicos derivados de cardiomiocitos permeabilizados individuales de roedores, cerdos y humanos. Adaptado a partir de12.
| Problema | Posible razón | Solución |
| El cardiomiocitos se separa durante la activación máxima | Tiempo de encolado insuficiente; El pegamento es viejo y se ha secado | Aumentar el tiempo del paso de encolado; considerar la posibilidad de abrir un nuevo tubo de pegamento. |
| Hay Triton® en la solución de suspensión celular, que ya no se puede quitar | Repita el procedimiento de extracción con uno o dos pasos adicionales de Tritón® lave los pasos | |
| El cardiomiocitos tiene baja fuerza bajo en condiciones de control | La extracción salió mal y entregó células de baja calidad | Aumente el tamaño de la muestra y realice una nueva extracción. Si el problema persiste es probablemente debido a la recolección incorrecta de muestras - deseche esta muestra |
| La célula se contrae visiblemente, pero no se registra ninguna fuerza; La célula tiene valores de fuerza inusuales | El transductor de fuerza está apagado | Enciéndalo |
| El transductor de fuerza no está bien calibrado | Calibre el transductor de fuerza utilizando un conjunto de pesos conocidos (consulte el manual de instrucciones del fabricante). | |
| La aguja del transductor de fuerza está suelta | Pegue la aguja de nuevo usando el enlace de cristal 509 o la cera de los joyeros. | |
| El patrón de estriación no es lo suficientemente bueno para determinar la longitud de la sarcomere | Luz insuficiente | Aumente la luz del microscopio o mueva la célula de nuevo a la cubierta y evalúe la longitud de los sarcomeres de nuevo (los pozos tienen menor intensidad de luz) |
| La extracción salió mal y entregó células de baja calidad | Aumente el tamaño de la muestra y realice una nueva extracción | |
| Las puntas de las agujas no están en el mismo plano | Con micromanipuladores, ajuste las puntas de las agujas hacia arriba o hacia abajo hasta encontrar un sarcomeres enfocado | |
| Sin variación de longitud y/o fuerza durante la adquisición | El motor o el transductor de fuerza están apagados | Enciéndalos |
| El motor está roto y no produce acortamiento celular | Reemplácelo o intente calibrarlo usando un generador de funciones | |
| Demasiado ruido en las grabaciones de adquisición | Demasiado flujo de aire alrededor del equipo | Proteja el equipo del flujo de aire directo |
| Demasiadas vibraciones alrededor del equipo | Se recomienda una tabla de estabilización. Incluso entonces, se recomienda retirar cualquier equipo que pueda tener un compresor o emitir vibraciones (congelador, neveras) | |
| La curva de sensibilidad Ca2+tiene valores extraños y los valores de fuerza no aumentan con [Ca2+]. | La mezcla de solución de activación y relajación no se realizó correctamente (comprobar 3.10 a 3.14 de la sección de métodos, posiblemente debido a la mezcla insuficiente) | Descongelar los viales con la misma concentración, recoger todo el contenido del vial en el mismo vaso de precipitados, mezclar con un agitador y dividirlos de nuevo. Pruebe estas soluciones de nuevo en una nueva celda. Si esto resuelve el problema, prepare un nuevo lote de soluciones que contengan Ca2+ |
Tabla 7: Tabla de solución de problemas.
Discusión
La evaluación in vitro de la función cardíaca utilizando cardiomiocitos despellejados representa una técnica importante para aclarar las modificaciones que se producen a nivel de cardiomiocitos en contextos fisiológicos (por ejemplo, estiramiento) y patológicos (por ejemplo, isquemia). Esta metodología tiene varias ventajas como exigir una cantidad mínima de miocardio para evaluar la función en cardiomiocitos obtenidos a partir de muestras descongeladas; utilizando cardiomiocitos de una amplia gama de especies (ratones13, rata1,14,15, conejo16, cerdo17, perro18, conejillo de indias19 y humano20) y diferentes lugares cardíacos, incluyendo las aurículas, ventrículos izquierdo y derecho o una región específica del corazón infarto. Además, esta técnica permite la entrega de concentraciones específicas de Ca2+ y energía (ATP) mientras mide la función de las estructuras regulatorias y contráctiles en su configuración nativa.
A pesar de la simplicidad de esta técnica, hay algunos pasos críticos. Es esencial garantizar la calidad de cada paso desde el principio, incluida la recogida de muestras. Las proteínas de miofilación son susceptibles a las proteasas21. Por lo tanto, es obligatorio almacenar las muestras en nitrógeno líquido inmediatamente después de su recogida. Las muestras frescas, que no estaban previamente congeladas, desarrollarán fuerzas significativamente más altas, por lo que no es aconsejable mezclar la medición realizada en muestras frescas y congeladas en el mismo protocolo. El segundo paso más crítico es la extracción de los cardiomiocitos. Durante este procedimiento, es crucial mantener la muestra sobre hielo la mayor parte del tiempo. Se puede utilizar un cóctel inhibidor de la proteasa para reducir el riesgo de degradación de proteínas durante la extracción/permeabilización22. En tercer lugar, las muestras deben cortarse en trozos más pequeños utilizando movimientos precisos del bisturí, ya que observamos cardiomiocitos de calidad reducida cuando se descartó este paso. Otro paso crítico es lavar los cardiomiocitos ya que es difícil tener el equilibrio adecuado entre lavar Tritón (permeabiliza la célula pero promueve su desencolado) y mantener tantas células en el sobrenadante como sea posible. Es importante probar primero la extracción y el número de lavados para cada muestra, especie o protocolo. Por ejemplo, en nuestras manos, observamos que las extracciones de tejido de rata obesos ZSF1 tienen un aspecto "graso", lo que hizo que estas células fueran más resbaladizas durante el encolado, pero no más difíciles de medir. La forma en que eludimos este problema fue realizando más experimentos para tener un número razonable de células por animal. Además, es crucial seleccionar una buena celda para pegar, a saber, con buena estrías y longitud razonable. Si el cardiomiocitos no tiene estas características, en su mayoría se desprenderá de las puntas de la aguja o desarrollará una fuerza baja o nula. También es importante utilizar el pegamento correcto para la fijación de cardiomiocitos, teniendo en cuenta el tiempo de encolado y su eficacia para pegar la célula a la aguja. En nuestras manos, el pegamento de silicona (Tabla de Materiales) cura rápido (10-15 min) y lo suficientemente fuerte. Finalmente, el último paso crítico está relacionado con levantar cuidadosamente el cardiomiocitos 5 min después de pegar la célula (para evitar pegar la célula al cubreobjetos) y antes de moverla a los pozos (para evitar que la célula sea arrastrada por la etapa del microscopio). La Tabla 7 resume la solución de problemas asociada con esta técnica, sus causas subyacentes y las posibles soluciones para superar problemas frecuentes.
La principal limitación de este método es que no puede responder a todas las preguntas relacionadas con la contractilidad de miofilament, como la rapidez con la que se activan/desactivan los miofilamentos. En el entorno in vivo, la despolarización de membrana, el aumento intracelular de Ca2+ y su difusión a misofilamentos deben ocurrir para que los miocitos se contraigan, mientras que en cardiomiocitos despellejados Ca2+ difusión a misofilamentos se produce inmediatamente cuando la célula está sumergida en la solución Ca2+. Esta velocidad más rápida de difusión de Ca2+ sesgará miofilamentos de activación / desactivación23.
Estos experimentos están influenciados por diferentes factores, incluyendo la temperatura, el pH de la solución, la perturbación mecánica (slack-re-stretch vs. slack) y los procedimientos de fijación de celdas (pin tie vs. glue), todas estas variables que tienen en cuenta las discrepancias de la literatura en términos de ktr y el aumento dependiente de la longitud de los sarcomere en la fuerza4,12.
El progreso futuro de la técnica incluye la realización de estudios funcionales en intacto en lugar de cardiomiocitos permeabilizados. Esta técnica tiene la desventaja de depender de cardiomiocitos recién aislados (no previamente congelados). Otra cuestión importante que no está directamente relacionada con esta metodología, pero que puede afectar significativamente a ella está relacionada con el período máximo de almacenamiento congelado de muestras. Específicamente, es obligatorio establecer el grado de degradación del miofilamento a lo largo del tiempo de almacenamiento (es decir, durante cuánto tiempo se pueden almacenar muestras congeladas con el fin de asegurar datos funcionales de buena calidad derivados de los cardiomiocitos extraídos).
Divulgaciones
Los autores no tienen conflicto de intereses.
Agradecimientos
Los autores agradecen a la Fundación Portuguesa para la Ciencia y la Tecnología (FCT), a la Unión Europea, al Quadro de Referencia Estratégico Nacional (QREN), a Fundo Europeu de Desenvolvimento Regional (FEDER) y a la unidad de investigación Factores Operacionales de Competitividad (COMPETE) por financiar la unidad de investigación UnIC (UID/IC/00051/2013). Este proyecto cuenta con el apoyo de FEDER a través de COMPETE 2020 - Programa Operacional Competitividade E Internacionalizao (POCI), el proyecto DOCNET (NORTE-01-0145-FEDER-000003), apoyado por el programa operativo regional Norte Portugal (NORTE 2020), en el marco del acuerdo de colaboración Portugal 2020, a través del Fondo Europeo de Desarrollo Regional (FEDER), el proyecto NETDIAMOND (POCI-01-0145-FEDER-016385), apoyado por los Fondos Estructurales y de Inversión Europeos, el programa operativo regional de Lisboa 2020. Patrícia Rodrigues fue financiada por FCT (SFRH/BD/96026/2013) y Joao Almeida-Coelho fue de la Universidade do Porto/FMUP y FSE-Fundo Social Europeu, NORTE 2020-Programación Operacional Operación Regional do Norte, (NORTE-08-5369-FSE-000024-Programas Dorais).
Materiales
| Name | Company | Catalog Number | Comments |
| Acetone | Sigma | 34580 | |
| Adenosine 5’-triphosphate disodium salt hydrate (Na2ATP) | Sigma | A2383 | |
| Calcium carbonate (CaCO3) | Merck | 1.02067.0500 | |
| Imidazole | VWR | 24720.157 | |
| Magnesium chloride hexahydrate (MgCl2.6H2O) | Merck | 1.05833.0250 | |
| Magnesium chloride solution (MgCl2 1M) | Sigma | M1028 | |
| N,N-Bis(2-hydroxyethyl)taurine (BES) | Sigma | B9879 | |
| Phosphocreatine dissodium salt hydrate (Na2PCr) | Sigma | P7936 | |
| Potassium chloride (KCl) | Merck | 1.04936.1000 | |
| Potassium hydroxide (KOH) | Merck | 8.14353.1000 | |
| Propionic acid (C3H6O2) | Merck | 8.00605.0500 | |
| Silicone Squeeze Tube | Marineland | 31003 | |
| Tritiplex (EGTA) | Merck | 1.08435.0025 | |
| Triton® X-100 10% | Merck | 648463 | |
| Tissue homogeneizer (GKH GT Motor Control) | Terre Haute Glas-col | ||
| Length Controller (Model 315C-I) | Aurora Scientific | ||
| Force Transducer (Model 403 A) | Aurora Scientific | ||
| Software ASI 600A | Aurora Scientific | ||
| Sotware VSL (Model 900B) | Aurora Scientific | ||
| Inverted Microscope (IX51) | Olympus |
Referencias
- Leite-Moreira, A. M., et al. Stretch-induced compliance: a novel adaptive biological mechanism following acute cardiac load. Cardiovascular Research. 114 (5), 656-667 (2018).
- Falcao-Pires, I., Fontes-Sousa, A. P., Lopes-Conceicao, L., Bras-Silva, C., Leite-Moreira, A. F. Modulation of myocardial stiffness by β-adrenergic stimulation - its role in normal and failing heart. Physiological Research. 60 (4), 599-609 (2011).
- Cokkinos, D. V. . Introduction to Translational Cardiovascular Research. , 371-387 (2015).
- van der Velden, J., Stienen, G. J. M. Cardiac Disorders and Pathophysiology of Sarcomeric Proteins. Physiological Reviews. 99 (1), 381-426 (2019).
- Garnier, D. Attachment procedures for mechanical manipulation of isolated cardiac myocytes: a challenge. Cardiovascular Research. 28 (12), 1758-1764 (1994).
- Brady, A. J. Mechanical properties of isolated cardiac myocytes. Physiological Reviews. 71 (2), 413-428 (1991).
- Falcao-Pires, I., Leite-Moreira, A. F., Cokkinos, D. V. Chapter 20. Introduction to Translational Cardiovascular Research. 20, 371-387 (2015).
- Liang, W. Teaching calcium-induced calcium release in cardiomyocytes using a classic paper by Fabiato. Advances Physiology Education. 32 (1), 1-10 (2008).
- Roche, S. M., Gumucio, J. P., Brooks, S. V., Mendias, C. L., Claflin, D. R. Measurement of Maximum Isometric Force Generated by Permeabilized Skeletal Muscle Fibers. Journal of Visualized Experiments. (100), e52695 (2015).
- Huxley, A. F. Muscle structure and theories of contraction. Progress Biophysics and Biophysical Chemistry. 7, 255-318 (1957).
- Sequeira, V., et al. Synergistic role of ADP and Ca(2+) in diastolic myocardial stiffness. Journal Physiology. 593 (17), 3899-3916 (2015).
- Edes, I. F., et al. Rate of tension redevelopment is not modulated by sarcomere length in permeabilized human, murine, and porcine cardiomyocytes. American Journal Physiology Regulatory Integrative Comparative Physiology. 293 (1), R20-R29 (2007).
- King, N. M., et al. Mouse intact cardiac myocyte mechanics: cross-bridge and titin-based stress in unactivated cells. Journal General Physiology. 137 (1), 81-91 (2011).
- Hamdani, N., et al. Myocardial titin hypophosphorylation importantly contributes to heart failure with preserved ejection fraction in a rat metabolic risk model. Circulation Heart Failure. 6 (6), 1239-1249 (2013).
- Miranda-Silva, D., et al. Characterization of biventricular alterations in myocardial (reverse) remodelling in aortic banding-induced chronic pressure overload. Scientific Reports. 9 (1), 2956 (2019).
- Rodrigues, P. G., et al. Early myocardial changes induced by doxorubicin in the nonfailing dilated ventricle. American Journal Physiology Heart Circulatory Physiology. 316 (3), H459-H475 (2019).
- van der Velden, J., et al. Alterations in myofilament function contribute to left ventricular dysfunction in pigs early after myocardial infarction. Circulation Research. 95 (11), e85-e95 (2004).
- Wakili, R., et al. Multiple potential molecular contributors to atrial hypocontractility caused by atrial tachycardia remodeling in dogs. Circulation: Arrhythmia Electrophysiology. 3 (5), 530-541 (2010).
- Ait Mou, Y., le Guennec, J. Y., Mosca, E., de Tombe, P. P., Cazorla, O. Differential contribution of cardiac sarcomeric proteins in the myofibrillar force response to stretch. Pflugers Archiv. 457 (1), 25-36 (2008).
- Falcao-Pires, I., et al. Diabetes mellitus worsens diastolic left ventricular dysfunction in aortic stenosis through altered myocardial structure and cardiomyocyte stiffness. Circulation. 124 (10), 1151-1159 (2011).
- Lim, C. C., et al. Anthracyclines induce calpain-dependent titin proteolysis and necrosis in cardiomyocytes. Journal Biology Chemistry. 279 (9), 8290-8299 (2004).
- Woulfe, K. C., et al. A Novel Method of Isolating Myofibrils From Primary Cardiomyocyte Culture Suitable for Myofibril Mechanical Study. Frontiers Cardiovascular Medicine. 6, 12 (2019).
- Ait Mou, Y., Bollensdorff, C., Cazorla, O., Magdi, Y., de Tombe, P. P. Exploring cardiac biophysical properties. Global Cardiology Science Practice. 2015, 10 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados