Method Article
皮膚心筋細胞を用いた心機能のインビトロ評価
* これらの著者は同等に貢献しました
要約
このプロトコルは、皮をむいた心筋細胞を用いた心機能の抽出および評価の技術を段階的に記述することを目的とする。この方法論は、マウスから男性まで、異なる心臓の場所から収集することができる小さな凍結生検を使用して、myofilament機能の測定および急性調節を可能にする。
要約
本稿では、単一の透過性(「皮をむいた」)心筋細胞を分離し、力測定装置とモーターに取り付けて機能研究を行うために必要な手順について説明します。これらの研究は、心筋細胞の剛性(受動的な力)とその異なるカルシウム(Ca2+)含有溶液による活性化を測定することを可能にする:最大力の発達、筋状放射状Ca2+感受性(pCa50)、協同性(nHill)および力再発達率(ktr)を決定する。この方法はまた、筋膜に直接作用する薬物の効果と、心筋細胞の活性および受動的特性の両方に対する外因性組換えタンパク質の発現の決定を可能にする。臨床的に、皮膚の心筋細胞研究は、多くの心筋疾患の病態生理を強調し、筋膜を標的とする治療介入の影響のインビトロ評価を可能にする。全体として、この技術は、開胸手術または移植手術中に得られた動物モデルとヒト組織におけるin vitroおよびin vivoパラメータの間の相関関係を調査することによって、心臓病理生理学の解明を可能にする。
概要
従来、心筋の機械的特性の評価は、主に乳頭筋や柱状筋筋1,2などの多細胞製剤において試みられてきた。多細胞性心筋ストリップには、異種細胞集団が含まれ、その中には、オリエンテーションと力の発生、電気活動およびストレス/歪み分布、ならびに周囲の結合組織マトリックス3,4を含む収縮性心筋細胞が含まれる。コラーゲンを含まず、単一の心筋細胞を含む調製物は、サルコメア長さおよび交差ブリッジ収縮特性を非常に正確かつ制御された方法で測定することを可能にする5,6.したがって、過去40年間に、いくつかの方法論が開発され、単一の心筋細胞6,7の機械的、収縮性、および緩和特性を調査できる。これらの細胞の収縮機能は、サルコメア長さおよびクロスブリッジサイクリングキネティクス3に強く依存している。したがって、サルコメアの長さや性能、ならびにクロスブリッジ機能および収縮特性を評価することを考慮して、単一の単一の単一の心臓細胞で直接筋肉機能を調査することが望ましい。しかし、μNレベルでの力測定を記録しながら、合理的な光学サルコメア分解能を有する機能的心筋細胞の単離および取り付けは、依然として困難であり、3,6.その他の課題は、新たに採取した生検から心筋細胞を分離するために設置する必要がある物流です。例えば、ヒト生検コレクションの予測不可能性は、実験の実現可能性を危険にさらす可能性があります。
さらに、科学的手順(3Rの原理)のための動物実験の置き換え、削減および改良に関する倫理的な懸念は、細胞および組織レベル、好ましくはヒト生検、またはより小さな動物サンプルでの研究の変化を促進している。実際に、より小さなレベルの複雑さの中でインビトロで心機能を評価するための方法論の進歩的な改良は、結果を全身に適切に統合し、臨床シナリオ7に翻訳することを可能にする。全体として、-80°Cで保存されたサンプルを使用して心筋細胞を抽出することは魅力的な代替手段であり得る。
心筋組織は小片に切断され、モルタルと害虫で均質化される。この均質化の結果は、皮質変化の損傷を伴う皮の束と単離された細胞の懸濁液であり、そこで近視が入浴媒体にさらされ、すべての細胞成分が洗い流される。サルコレンマから遠く離れた筋線維のような構造は保存される。従って、筋細動装置に関連するサルコメアの短縮および機能的特性はそのまま保持され、8,9を記録することができる。
心筋細胞力測定システムは、心筋細胞長の調整に用いられる電磁モータと、等角心筋細胞収縮を測定する力トランスデューサーから構成されています。透過性、または皮をむいた心筋細胞は、リラックスした溶液([Ca 2+]<10nM)を含む実験室に配置され、シリコン接着は2本の細い針に接着され、1つはモーターに取り付けられ、もう1つは力トランスデューサに取り付けられる。心筋細胞の形態とサルコメアの長さを決定するために光学系が使用されます。実験プロトコルは、多くの場合、異なるCa2+濃度を含むバッファ溶液上の一連の力記録、アクチンミオシン架橋運動学の決定、およびあらかじめ定義されたサルコメア長さでの取り付けられた心筋細胞の受動的緊張の測定からなる(図1)。液体窒素で凍結した心筋試料からの透過性心筋細胞の分離(そしてその後-80°Cで保存される)は、細胞力学とタンパク質生化学を利用して断面積当たりの最大Ca2+活性化(活性)力(T∙活性、kN m-2)を測定する技術です。 受動)緊張(Tパッシブ、kN∙m-2)、筋ヒフィラメントCa2+感度(pCa50)、筋ヒフィラメント協同率(nヒル)、力再発達率(ktr)、ならびにTアクティブのサルコメア長依存性、Tパッシブ、pCa50、nHillおよびktr。
このプロトコルの目的は、異なる種の凍結サンプルから分離された単一の皮膚心筋細胞の機能的機械的特性を評価する信頼できる手順として、心筋細胞力測定システムの可能性を説明し、要約することです。
プロトコル
すべての動物実験は、実験動物のケアと使用のためのガイド(NIH出版第85-23号、改訂2011)および動物福祉に関するポルトガルの法律(DL 129/92、DL 197/96;P 1131/97)。有能な地方自治体は、この実験プロトコルを承認しました (018833).
1. ストック液の調製 (表 1)
- 表2の指示に従って、心筋細胞の分離(RELAX-ISO)のためのリラックスした溶液の1,000 mLを準備します。上記の試薬を≈500 mLに溶解し、PHをKOHで7.0に調整します。最終ボリュームを1000 mLに調整します。
- 50 mLチューブにリラックスISOを配る。-20°Cで保管してください。
- 表 3の指示に従って、250 mL のアクティブ化ソリューションを準備します。上記の試薬を≈100mLの超純水に溶解します。15°Cで5 M KOHでpHを7.1に調整します。
注: 通常、所望の pH に到達するためには、大量の KOH を追加する必要があります。体積バルーンを氷付きの箱に入れ、溶液を15°Cに冷却します。- 最終ボリュームを250 mLに調整します。リラックスした溶液と混合する瞬間まで、磁気攪拌機で連続的にこの溶液を攪拌します。
- 表4の指示に従って、リラックスした溶液の100 mLを準備します。上記の試薬を超純水≈50mLに溶解します。15 °CのKOH 5 MでpHを7.1に調整します。
注: 通常、7.1 の pH に到達するには、大量の KOH を追加する必要があります。氷で満たされた箱に体積バルーンを入れ、溶液を15°Cに冷却します。 測定中に使用した溶液のイオン強度は180 mMに及んだ。- 最終ボリュームを100 mLに調整します。この溶液を活性化溶液と混合する瞬間まで、磁気攪拌機で連続的に撹拌します。
- 5.0 と 6.0 の間の pCa 溶液を得るために 表 5 で示される比率で活性化および緩和のソリューションを混合します。
- 常にリラックスして、両方を混合しながら、攪拌ソリューションを活性化し続けます。
- アリコート各混合物を2 mLマイクロチューブにする。すべてのマイクロチューブを-20 °Cに保管してください。
- プロトコルごとに異なる pCa ソリューション (4.5 ~ 6.0) のバッチを準備します。
2. 力変換器の校正
注: 力トランスデューサのキャリブレーションは、数ヶ月ごとに、または校正が行われないと疑われる場合に実行する必要があるルーチン手順です。力のトランスデューサーは非常に敏感であり、容易に壊れる。キャリブレーション、心筋細胞の接着、洗浄など、その使用のあらゆる段階で穏やかに処理する必要があります。
- 装置の残りの部分から力のトランスデューサーを取り外します。
- クランプの助けを借りて、針が心筋細胞が力を発達させるのと同じ方向に下向きになるように、力トランスデューサを水平に置きます。これは、既知の重み(弾性バンド、縫合またはピン)を持つ一連の質量を吊り下げやすくします。
注:このステップに進む前に力変換器の特性を確認して、スケールファクター[mg/volt]をチェックし、トランスデューサの過度の重量を避けてください。力トランスデューサモデルの場合、スケール係数は50(50mgは1ボルトに相当)であり、12.5〜250mgの間で5つの重みを使用します。 - 力のトランスデューサーをオンにし、30分間ウォームアップします。
- まず、フォーストランスデューサに軽い質量を掛け、FORCE OUTで測定された対応する電圧を登録します。
- 最大 5 つのウェイトに対してこの手順を繰り返します。
- 力トランスデューサ(負荷)対電圧に適用されるプロット力と直線性のチェック。
- 直線性がない場合は、トランスデューサの回路基板のゼロとゲインポテンショメータを調整します。詳細については、その特定の命令を確認してください。
- 出力電圧が0.0Vになるまでゼロポテンショメータを回します。
- トランスデューサ針に中程度の重量を渡し、ゲインポテンショメータを調整して対応する電圧を読み取ります(例えば、50 mgは1Vに対応)。重量を取り除き、ゼロポテンショメータを0.0に再調整します。
- 重み付きと重量なしの出力が正しくなるまで、ステップ 2.6.2 を繰り返します。
- フォーストランスデューサを装置に取り付け直します。
3. 実験装置の設定
- 活性化、4.5、5.0、5.2、5.4、5.6、5.8、6.0の各バイアルを解凍し、リラックスしたソリューションを氷の上に維持します。
注: ATP および PCr は、寒い温度で維持する必要がある不安定な化合物です。 - 顕微鏡、試験装置、関連するコンピュータを使用できるように準備します(図1)。
- 室内温度計が15°Cを読み取るように温度を調整します。 キナーゼおよびホスファターゼインキュベーション(20°C)を除くすべての実験をこの温度で行います。
- フォーストランスデューサとモーターをオンにします。
4. 皮膚心筋細胞の抽出と透過
- リラックス-ISO溶液の50 mLを解凍します。
- 遠心分離機をオンにし、4°Cまで速く冷却します。
- 2.5 mLのRELAX-ISO溶液を含むペトリ皿の心筋サンプルの3〜5 μgを解凍します。
- メスの刃でティッシュを小さく切る(図2)。不必要な細胞の損傷を避けるために正確な方法でサンプルをカットします。
- 切断されたピペットチップを使用して、組織とのリラックス-ISO溶液の2.5 mLをポッター・エルヴェイェムガラスに移します。
- 機械的に30〜40 rpmの回転速度でグラインダーで組織を破壊する。組織をそれぞれ2回押し、良好な細胞懸濁液を得た。
- 15 mLチューブに、リラックスISO溶液(2.25 mLのリラックス-ISOを有するトリトン250 μL)で10%トリトンを調製し、この溶液を細胞懸濁液に加えます。
- 管を3回逆にして軽く混ぜます。
- 氷上で1分4分室温でインキュベートします。
- 15 mLチューブの上部にRELAX-ISOを追加してトリトンを洗い流します。穏やかに混合(3倍のチューブを反転)し、最後に斜めの遠心分離機で細胞を回転させる(348 x gで1分)。細胞ペレットの上に3 mLまでの上清を取り除きます。
注:セルペレットを乱さないように上澄み剤をそっと取り除いてください。それでも、上清の一部の細胞は必然的に失われます。 - ステップ4.10を少なくとも4回、またはトリトン残基によって生成された気泡が見られないまで繰り返す。
注: 洗い流しの手順が多いほど、廃棄された上清で失われるセルが多くなります。 - 最後の洗い流しでは、上清を5〜10mLのセル懸濁液の体積まで取り除きます。
5. 皮をむいた心筋細胞の選択と接着
- 顕微鏡スライドホルダーのガラススライドの上のカバースリップにセルサスペンションドロップを置きます(図1)。
- 良好な線条パターンとサイズを持つ単一の棒状の心筋細胞を選択します(図2)。
- 逆顕微鏡の最も低い倍率を使用して、力トランスデューサとモータの針先を見つけます。
- カバースリップを回転させて、選択した心筋細胞を水平に配置し、その端点が力変換器とモーターの針に合うようにします(図2)。
- 綿棒の先端の助けを借りてカバースリップの側面に接着剤の細い線を置く(図2)。
- 力トランスデューサとモーターの針先を接着剤ラインに浸し、両方の先端の周りに接着剤ハローを作成します。
注: ステップ 5.6 から 5.10 はモーター付きマイクロポジショナーの注意深い使用によって達成される。 - 針先を心筋細胞の焦点面の近くに素早く動かします。
- 力トランスデューサの針の先端を下に移動して、心筋細胞の1つの端に接着します。
- この手順を、モーターの先端とセルのもう一方の端数で繰り返します。
注:接着剤が非常に速く治り始めるので、この手順は2〜3分未満でなければなりません。 - 5~8分後、針を≈15 μm持ち上げて、細胞をカバースリップに接着しないようにします。これは、両方のマイクロマニピュレータを同時に上に移動することによって行われます。
- 接着剤を治しましょう。この手順は、接着剤の種類に応じて、15〜45分持続することができます。我々の場合、心筋細胞は15分後に十分に接着≈。
6. 能動、受動、Ca2+ 感度の記録力測定
- 第1実験をリラックスした溶液(実験装置では55-100 μL)、第2の実験井戸を活性化溶液で充満します。
- カメラソフトウェアを使用して、関心領域(ROI)を線条の明確なパターンで心筋細胞の領域に配置します。
注意:心臓筋細胞の場合、手術サルコメアの長さは1.8~2.2μm、最適サルコメア長は約2.15μmです。 - 最適なサルコメア長さ(2.2 μm)を設定した後、心筋細胞の2つの両極端(モーターからトランスデューサの接着剤ハロー、 図3)の間の距離を測定します。ソフトウェアにミオサイト長として値を記録します。
- 心筋細胞の幅と深さを測定し、後者は細胞に垂直に置かれたプリズムミラーの助けを借りて。
注: プリズムを通してセルを視覚化するには、強力な外部光源が必要になります。プリズムがない場合、心細胞が楕円形であると仮定すると、心筋細胞の深さは心筋細胞の幅の70%と推定することができる。 - 心筋細胞の楕円形状を仮定して断面積(CSA,mm2)を計算する。

- 顕微鏡のステージを静かに動かし、細胞がカバースリップからステージ背面のリラックスできる溶液を含むウェルに移動するようにします。
メモ:この手順は、簡単にセルを損傷することができます。細胞を動かす前に、針をもう少しゆっくり上に動かします。ソリューションからセルを削除しないようにします。 - 2つのセル短縮(初期長の80%)を含むソフトウェアでプロトコルを選択し、セルがCa2+ ソリューションとリラックスソリューションで出現したときに発生します(図1、補足ファイル)。
注:セルの最初の「Slack」は、活性化ソリューション内で実行され、リラックスしたソリューション内の2番目の「Slack」が実行されます。これにより、ユーザは、2番目からセルの1stと受動力(F受動)からセルの総力(F合計)を計算できるようになります。有効な力を計算するために式を使用して、Fアクティブ= F合計- Fパッシブ。セルは、すべてのクロスブリッジの記録力を取り外すために80%短縮されます。 - 顕微鏡ステージを動かして、心筋細胞がリラックスした溶液から活性化溶液(pCa=4.5(1))に移動するようにして、等角体収縮を引き出します。
メモ: セルが機能している場合は、すぐに縮小します。 - 力高原に達すると、力データの記録を開始します。
注: テストは個別に行うことができます。ソフトウェアによっては、Ca2+感度プロトコル内の異なるCa2+ソリューションに対応する一連のテストを作成する可能性があります(図1、補足ファイル)。 - ~10 s待ってから、活性化溶液に浸したセルを切り替えます。
注:リラックスした溶液にセルを浸す前に10 s待つことが重要です。セルの移動が早すぎると、セルの再開発力(ktr値)を計算する重要なデータが失われる可能性があります。 - 心筋細胞がリラックスした溶液に浸るようにステージを素早く動かします。
- テストが停止するまで待ちます。
- ステップ 6.8 ~ 6.12 を繰り返して、セルが活性化ソリューションで 2 回アクティブになるようにします (pCa=4.5(2))。
注:通常、最初の活性化後、心筋細胞の端部は、心筋細胞の長さ、CSAおよび/またはサルコメアの長さを変更し、針の先端からわずかに切り離すことができます。目的のサルコメアの長さに再調整し、ソフトウェアで修正された寸法を導入します。- ステップ 6.13.2 に進む Ca2+ 感度プロトコルの場合、またはデータを保存します(セルの受動力とアクティブな力の値が必要なパラメータが唯一のパラメータである場合は、針からセルを取り外し、アセトンで除去して接着剤を除去します)。
- 必要に応じて、セルのサルコメアの長さを2.2 μmに調整し、もう一度少し伸ばします。
- 活性化ソリューションを次のCa2+ ソリューション(ここでは55-100 μL)に置き換えてください。手順 6.8 ~ 6.12 を繰り返します。
- 活性化ソリューションを次のCa2+ 溶液(ここでは55-100 μL)に置き換え、すべてのソリューションがテストされるまでステップ6.8~6.12を繰り返します(5.0、5.2、5.4、5.6、5.8、6.0)。
- 最後に、活性化溶液(pCa4.5(3))でセルを再活性化します。手順 6.8 ~ 6.12 を繰り返します。
キナーゼとホスファターゼを用いてインキュベーション
- 選択したベースラインプロトコルを実行した後、推奨濃度でリラックス溶液中のキナーゼ/ホスファターゼを希釈します。
注:実験の前に線量応答曲線を実行することをお勧めします。 - 実験井戸の温度を20°Cに設定します。
- 実験井戸にキナーゼ/ホスファターゼ、リラックスした溶液、活性化溶液(55-100 μL)を充填してください。
- 顕微鏡を穏やかに動かし、細胞がキナーゼ/ホスファターゼを含むウェルに浸るようにします。
- キナーゼ/ホスファターゼを用いて、30分以上かメーカーの指示に従って心筋細胞をインキュベートします。
- 選択したベースライン・プロトコルを繰り返します。
8. 実験の最終化
- 細胞を伸ばして力トランスデューサとモーターの先端から心筋細胞を接着解除します。
- アセトンに浸した綿棒を使用して、針の先端から接着剤ハローを慎重に取り除きます。
- 機器をシャットダウンします。
9. データの分析
- テストした各心筋細胞からすべてのファイルを収集します。
注: 各テストは 1 つのファイルに対応します。これは、Ca2+ 溶液またはサルコメアの長さごとに、対応するファイルがあることを意味します。 - 単一心筋細胞の活動力と受動力を計算する。
- スプレッドシートを使用して最初のアクティベーション(pCa=4.5(1)))に対応するファイルを開きます(図3A、補足ファイルの付録A)。
注: 分析を実行するためにカスタムメイドのプログラムを使用しました。補足ファイルの付録 Aを参照してください。 - セルの1st slack後の平均≈60値および平均≈60値(細胞がCa2+ 溶液に浸漬されている場合)これらの2つの値は、それぞれaとbに対応する。
- 細胞の2番目 のたるみについても同じ分析を繰り返します(細胞がリラックスした溶液に浸漬されている場合)。これらの2つの値は、それぞれcとdに対応する。
- a と b の差を計算します (総力、F合計)。
- cとdの差を計算します(受動力、Fパッシブ)。
- アクティブな力を計算し、Fアクティブ = F合計 - Fパッシブ。
- 全力値を CSA (上記の式参照) に正規化して、総張力(T合計)、受動的テンション(Tパッシブ)、アクティブテンション(Tアクティブ)を求めます。
- 2回目 のアクティブ化(pCa=4.5(2))について、ステップ 9.2.1 から 9.2.5 を繰り返します。
- これらの値は、分析中の心筋細胞のT総、Tアクティブ およびT受動 を表すものと考えてください。
注: pCa4.5(1) を使用したセルの最初のアクティブ化は、通常、セルの寸法の変更に関連付けられます。このため、pCa4.5 による 2 回目のアクティベーションはより正確で、使用する必要があります。 - 各ファイル/pCa テスト済みソリューション(5.0、5.2、5.4、5.6、5.8、6.0、4.5(3)について、手順9.2.1~9.2.5を繰り返します。
- スプレッドシートを使用して最初のアクティベーション(pCa=4.5(1)))に対応するファイルを開きます(図3A、補足ファイルの付録A)。
- 単一の心筋細胞のpCa50およびnHillを計算する。
注: この解析では、ファイル 4.5(2)、5.0、5.2、5.4、5.6、5.8、6.0、4.5(3) ファイルの非正規化 Fアクティブ 値を使用します。- テストした Ca2+ソリューションごとに、Fの正規化されていない値をすべてスプレッドシート ファイルに配置します (4.5(2)、5.0、5.2、5.4、5.6、5.8、6.0、4.5(3))。
- 補正係数 = Fアクティブ [4.5(2)] - F アクティブ[4.5(3)] / 7 を計算します。
- 各 Ca2+ソリューション (5.0、5.2、5.4、5.6、5.8、6.0) の Fアクティブ補正係数を減算して、アクティブなF の補正値を計算します。
- 各Ca2+解の相対力(F相対)を計算するには、対応する補正値で各Fアクティブ値を正規化します。
注: F相対 [4.5(3)] は 1 に等しい必要があります。各実験プロトコルは、Ca2+ 濃度(pCa 4.5(2)および4.5(3))を飽和させると制御活性化で始まり、終了します。これにより、最大Ca2+活性化力(Fmax)の変化の比較を通じて、準備のランダウンの強制正規化と評価が可能になります。実験プロトコルの最後に、心筋細胞が最初の収縮の最大力の少なくとも70%未満を産生する場合、その細胞/測定は分析から除外されるべきである。 - F相対値と対応する pCa 値を使用して、次の式 F(Ca) = Ca nHill / (Ca50nHill + CanHill)を持つシグモイド曲線に適合します。
- 上記の方程式から pCa 値と nHill 値を推定します。
- 単一の心筋細胞の力再開発率(ktr)を計算します。
- 1st セルの余裕期間の直後の値に対応するカーブにフィットを実行します。
- 曲線の傾きを計算すると、この値は力再開発の速度に対応します。
- 各 Ca2+ ソリューションについて、ステップ 9.4.1 と 9.4.2 を繰り返します。
注: 最も低い Ca ソリューション (R 2 乗≤0.90) に対して、カーブフィットが低い値が得られます。
結果
機能的透過性心筋細胞は、実験全体を通して均一で一貫した線種パターンを持って現れるべきである。長時間実験した後、ある程度の劣化や力の低下が予想されますが、アクティブテンションの値は比較的安定している必要があります。ストリエーション損失または有意な力低下の明確な兆候を示す細胞(< 15 kN∙m-2 または <80%の初期活性力)を除外する必要があります。 表 6 は、げっ歯類、ブタ、およびヒトのサンプルから得られる最も重要なパラメーターに対して期待される通常値を示しています。
取得されるパラメータは、主に選択したプロトコルによって異なります。 図5 は、3の代表的な力痕跡を示し、8のうち、myofiラメントCa2+感度のプロトコルを実行するために必要な力記録を示す。活性化溶液を含むウェルに細胞を移すことによって、心筋細胞は高原に達するまで力を発達し始める。迅速なスラック試験(持続時間1ms)の後、心筋細胞はその長さの80%に短縮し、ゼロフォースのベースライン値を得る。たるみ試験の後、細胞は活性化溶液に浸漬され、力を発達させ続ける。総力(F合計)は、最小値からプラトー値を差し引いて計算されます。この曲線の最後の部分の傾きは、力再開発率(ktr)(図6)の値を与え、これはクロスブリッジの接続と剥離(fapp およびgaap)の見かけの速度の尺度である10。ktr R2値が <0.90 の場合、ktr 値は除外されるべきであり、通常は、より低い Ca2+ 濃度 (pCa 5.6、5.8 および 6.0) で起こります。リラックスした溶液を含むウェルに細胞を戻した後、細胞は弛緩し、その力が低下する。受動力(F受動)は、この新しい力の値に最小値(長期の細胞短縮後に得られる)を減算することによって計算される。アクティブフォースは、F合計 とF受動の差から生じる。
心筋細胞を特徴づける最大の能動的および受動的な力は、飽和Ca2+溶液(pCa = 4.5)を用いた第2の細胞活性化から導出されるものです。サルコメアの長さはしばしば再調整する必要が生じるために、最初の活性化は通常廃棄される。
myofilament Ca2+感度プロトコルを実行するには、少なくとも9回の活性化テスト(4.5;4.5;5.2;5.6;6.0;5.0;5.4;5.8および4.5)を実行する必要があります。このシーケンスは単なる例示ですが、常に 4.5 (2 回) で始まり、4.5 で終わる必要があります。myofilament Ca2+感度プロトコルのデータ取得ソフトウェアのプログラミングは、補足ファイルの図1に示されています。
これらすべての活性化ソリューションのアクティブフォースを計算した後、最後の活性化が初期最大力の80%以上を生み出したかどうかを確認します(そうでなければ、上記のようにこのセルの結果は破棄する必要があります)。実験シリーズ中のFmaxの減少を補正するために、補間されたF最大値を使用してデータポイントを正規化することができます。正規化されたデータは、次の式 F(Ca) = Ca nHill /(Ca50nHill + CanHill)を使用してシグモイド曲線に適合させることができます。得られたパラメータ値はカルシウム感受性(ca50、pCa50に変換することができる)と協同率(nHill)を表す。すべての力の値は、断面領域に正規化した後、テンション値に変換することができます。myofilamentCa2+感度および長さに依存する活性化プロトコル以外にも、他の試験も行うことができる。このようなサルコメア長さの依存性の場合は、T能動、Tパッシブ(図7)、および心筋細胞残留力が残っている。残差力記録は、セルの長さの変化後に到達した初期力回復(pCa 4.5)から計算されます(80%)長さが変わる前に到達した各全定常力に正規化された11.残留力の増加は、通常、遅い剥離キネティックスと高い剛性を持つ架橋を示しています。
最後に、この技術は、凍結または採取したサンプルから機械的に抽出された皮膚心筋細胞で行うことができるだけでなく、その膜の透過化に続いて酵素的に単離できることを強調する必要があります。心筋細胞が分離される方法は、この技術から得られた結果に大きく影響する。 図 8 は、3 つの分離手順の間で観察される相違点を示しています。

図1:試験装置の統合スキーム。 試験装置は、顕微鏡、マイクロマニピュレータおよび関連するコンピュータを含む。図の下部は、モーターと力トランスデューサーの間に接着された皮膚付き心筋細胞を示しています。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:細胞分離、透過および接着のプロトコルのフローチャート。左上隅の画像は、トリトン透過化用のチューブ内にある場合は、リラックス-ISO溶液中の心臓試料(A)をペトリ皿に、(B)組織の機械的均質化に使用されるチューブ内の(C)ホモジナイザー(D)組織(E)で構成されています。この図の大きなバージョンを表示するには、ここをクリックしてください。
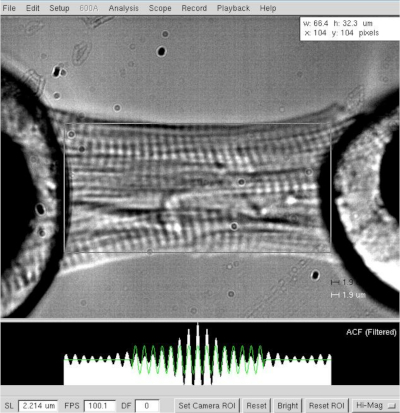
図3:皮膚心筋細胞の長さとサルコメア長さの決定。 セルの長さと幅の長さ≈2.2 μmの幅の決定 。
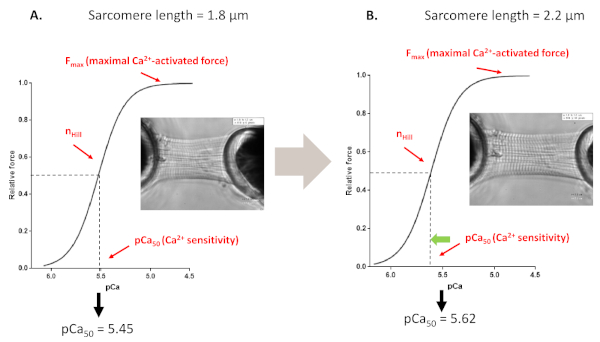
図4:長さに依存する活性化プロトコル(アンクドリク機構を模したインビトロ)。 myofilamentsのCa2+ 感度プロトコルから得られた代表的な力の痕跡およびパラメータは、前(A,1.8μm)および心筋細胞を2.2μmまで伸ばした後(B)にまで行った。 この図の大きなバージョンを表示するには、ここをクリックしてください。
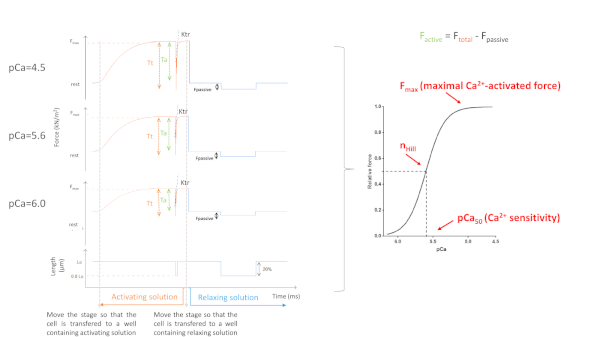
図5:ミオリラメントCa2+感度プロトコル 代表的なフォース トレースと派生パラメーター。簡単にするために、8つの力のカーブのうち3つだけが描かれています。すなわち、飽和、中間および最も低いCa2+含有溶液(それぞれ4.5、5、6および6.0)で活性化された心筋細胞。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図6:異なるカルシウム溶液およびそれぞれのktr適合曲線で活性化されたマウス心臓細胞からの代表的な微量。 (A) pCa 4.5;(B) pCa 5.0;(C) pCa 5.2;(D) pCa 5.4;(E) pCa 5.6;(F) pCa 6.0 および E 値の合計、受動およびアクティブな張力、ktr 値、および ktr フィットの Rsquare。 この図の大きなバージョンを表示するには、ここをクリックしてください。
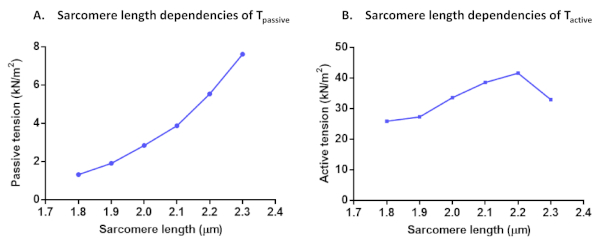
図7:Tパッシブ (A)とTアクティブ (B)のサルコメア長さの依存関係のプロトコル。 1.8μm~2.3μmのサルコメア長さの単一心筋細胞で受動的な張力とアクティブテンションを計算 しました。
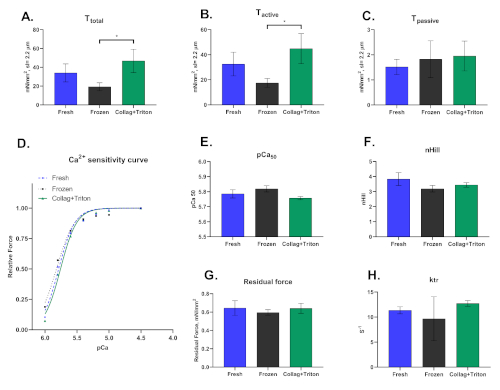
図8:新鮮な(「フレッシュ」)および凍結した心筋サンプル(「フローズン」)およびトリトン(「コララグ+トリトン」)による後パーメアライゼーションを用いたコラゲターゼ消化心臓(「修飾されたラングゲンドルフ技術」)から機械的に分離された心筋細胞の代表的な結果。(A)総張力、(B)活性緊張および(C)サルコメア長さ≈2.2μm(D)カルシウム感受性曲線および(E)pCa50および(F)nHillのそれぞれの値でpCa 4.5溶液で活性化された心筋細胞からの腹筋緊張。(G)残留力および(H)ktr値は、最大活性化解(pCa 4.5)で計算した。この図の大きなバージョンを表示するには、ここをクリックしてください。
補足ファイル。このファイルをダウンロードするには、ここをクリックしてください。
| 店舗の場所 | ストックソリューション | [M] | 最終ボリューム (mL) | 重量/容積 | ノート |
| 4°C | 水酸化カリウム(KOH) | 1 | 100 | 5.611 g | pH を調整するには |
| 4°C | 水酸化カリウム(KOH) | 5 | 50 | 14.03 g | pH を調整するには |
| 4°C | Bes | 1 | 50 | 10.66 g | |
| 4°C | プロピオン酸 | 1 | 100 | 7.483 mL | 5M または 1M KOH で pH を 7.0 に調整します。 |
| 4°C | CaEGTA は、次の構成で構成されます。 | 0.1 | 100 | 溶液を60°Cに混ぜて1時間以上加熱します。1M KOH で pH を 5-6 に調整します。 | |
| - カコ3 | 0.1 | 1.001 g | |||
| - ティトリプレックス (EGTA) | 0.1 | 3.804 |
表1:ストックソリューションの準備手順
| RELAX-ISO (心筋細胞の分離のための) | [mM] | 重量 |
| ナ2ATP | 5.95 | 3.28g |
| MgCl2.6H2O | 6.04 | 1.23 g |
| トリティプレックス (EGTA) | 2 | 0.76 g |
| Kcl | 139.6 | 10.41 g |
| イミダゾール | 10 | 0.68 g |
表 2: リラックス ISO ソリューションの準備の手順
| ソリューションの活性化(測定用) | [mM] | 重量/容積 |
| ナ2ATP | 5.97 | 0.823 g |
| MgCl 1M | 6.28 | 1.57 mL |
| プロピオン酸 | 40.64 | 10.16 mL |
| Bes | 100 | 25 mL |
| CaEGTA(以前に準備されたストックソリューション) | 7 | 17.5 mL |
| ナ2PCr | 14.5 | 0.925 g |
表3:ソリューションの準備を活性化する手順
| リラックスしたソリューション(測定用) | [mM] | 重量/容積 |
| ナ2ATP | 5.89 | 0.325 g |
| MgCl 1M | 6.48 | 0.65 mL |
| プロピオン酸 | 40.76 | 4.08 mL |
| Bes | 100 | 10 mL |
| ティトリプレックス (EGTA) | 6.97 | 0.265 g |
| ナ2PCr | 14.5 | 0.370 g |
表 4: リラックスソリューションの準備手順
| pCa = -ログ [Ca2+] | リラックス (pCa=9.0) Ml | アティベート (pCa=4.5) Ml |
| 5 | 0.86 | 39.14 |
| 5.1 | 1.2 | 38.80 |
| 5.2 | 1.54 | 38.46 |
| 5.3 | 2 | 38.00 |
| 5.4 | 2.51 | 37.49 |
| 5.5 | 3.14 | 36.86 |
| 5.6 | 3.89 | 36.11 |
| 5.7 | 4.8 | 35.20 |
| 5.8 | 5.89 | 34.11 |
| 5.9 | 7.14 | 32.86 |
| 6 | 8.57 | 31.43 |
表 5: pCa ソリューションの準備手順
| パラメーター | 齧歯類 | 豚 | 人間 |
| アクティブテンション、kN.m-2 (2.2 μm) | 17 – 28 | 19 – 40 | 19 – 36 |
| 受動テンション、kN.m-2 (2.2 μm) | 3.6 – 5.5 | 1.9 – 6.8 | 1.8 – 2.3 |
| pCa50 | 5.58 – 5.64 | 5.40 – 5.50 | 5.43 – 5.82 |
| nヒル | 2.60 – 2.76 | 2.95 – 3.36 | 2.99 – 3.10 |
| ktr、s-1 | 4.00 – 8.00 | 1.00 – 3.00 | 0.90 – 2.00 |
表6:げっ歯類、豚およびヒトから単一の透過性心筋細胞に由来する典型的なパラメータおよび指標。12から適応.
| 問題 | 考えられる理由 | ソリューション |
| 心筋細胞は最大の活性化の間に取り外す | 不十分な接着時間;接着剤は古く、乾燥しています | 接着ステップの時間を増やします。新しいグルーチューブを開くのを検討してください。 |
| 細胞懸濁液にはトリトン®があり、もはや除去できない | 1つまたは2つの追加のトリトンで抽出手順を繰り返®ステップを洗い流す | |
| 心筋細胞は制御条件下で低い力を有する | 抽出がうまくいかなかったし、低品質の細胞を提供しました | サンプルサイズを大きくして、新しい抽出を行います。問題が引き続き、サンプルの収集が不適切なことが原因である可能性がある場合は、このサンプルを破棄します。 |
| セルは目に見えて収縮していますが、力は記録されません。セルに異常な力の値があります | 力のトランスデューサーはオフです | オンにする |
| 力のトランスデューサーはよく調整されない | 一連の既知の重みを使用して、力変換器を校正します(メーカーの取扱説明書を確認してください)。 | |
| 力のトランスデューサーの針は緩んでいる | クリスタルボンド509または宝石ワックスを使用して再び針を接着します。 | |
| ストリエーションパターンはサルコメアの長さを決定するのに十分ではありません | 不十分な光 | 顕微鏡の光を増やすか、またはカバースリップに戻って細胞を移動し、サルコメアの長さを再び評価する(ウェルは光強度が低い) |
| 抽出がうまくいかなかったし、低品質の細胞を提供しました | サンプルサイズを大きくして新しい抽出を行う | |
| 針の先端は同じ平面にない | マイクロマニピュレータを使用して、焦点を当てたサルコメアを見つけるまで針の先端を上下に調整する | |
| 取得時に長さや力の変動なし | モーターまたは力トランスデューサがオフ | それらをオンにする |
| モーターが壊れていて、セルの短縮を生じていない | それを置き換えるか、関数ジェネレータを使用してキャリブレーションを試みる | |
| 取得記録のノイズが多すぎる | 機器の周囲に空気の流れが多すぎる | 直接空気の流れから装置を保護する |
| 機器の周囲の振動が多すぎます | 安定化テーブルをお勧めします。それでも、圧縮機を持っているか、振動(冷凍庫、冷蔵庫)を放出する可能性のある機器を取り外すことをお勧めします | |
| ●Ca2+感度曲線は変な値を持ち、[Ca2+]では力の値は増加しません。 | 活性化とリラックスソリューションの混合物が適切に行われなかった(場合によっては混合が不十分なため、メソッドセクションの3.10〜3.14をチェック) | 同じ濃度でバイアルを解凍し、同じビーカーにバイアルの含有量をすべて収集し、攪拌機と混合し、再びそれらを分割します。新しいセルでこれらのソリューションを再度テストします。これで問題が解決する場合は、Ca2+を含むソリューションの新しいバッチを準備します。 |
表 7: トラブルシューティングの表
ディスカッション
皮膚付き心筋細胞を用いた心機能のインビトロ評価は、生理学的(例えば、ストレッチ)および病的文脈(例えば虚血)において心筋細胞レベルで起こる修飾を明らかにするための重要な技術を表す。この方法論は、解凍されたサンプルから得られた心筋細胞の機能を評価するために最小限の量の心筋を必要とするなどのいくつかの利点を有する。広範囲の種(マウス13、ラット1、14、15、ウサギ16、ブタ17、犬18、モルモット19およびヒト20)および心房、左および右心室または梗塞心臓の特定の領域を含む異なる心臓の位置を使用して、心筋細胞を使用する。さらに、この技術は、Ca2+およびエネルギー(ATP)の特定の濃度を提供しながら、そのネイティブ構成における規制および収縮構造の機能を測定することを可能にする。
この手法のシンプルさにもかかわらず、いくつかの重要な手順があります。サンプルコレクションを含め、最初から各ステップの品質を保証することが不可欠です。ミオフィラメントタンパク質はプロテアーゼ21に感受性である。したがって、収集直後に液体窒素にサンプルを保存することが義務付けられています。以前は凍結されていなかった新鮮なサンプルは、有意に高い力を発生させるので、同じプロトコルで新鮮なサンプルと凍結したサンプルで行われた測定を混合することはお勧めできません。2番目に重要なステップは、心筋細胞の抽出です。この手順の間、ほとんどの場合、氷上のサンプルを維持することが重要です。プロテアーゼ阻害剤カクテルは、抽出/透過性22中のタンパク質分解のリスクを低減するために使用することができる。第三に、このステップが無視されたときに質の高い心筋細胞を減らすことに注意したので、サンプルは正確なメスの動きを使用して小さな部分にカットする必要があります。もう一つの重要なステップは、トリトンを洗浄すること(細胞を透過させるが、その不活性化を促進する)とできるだけ多くの細胞を上清に保つこととの間の適切なバランスを持つことが困難であるため、心筋細胞を洗浄することです。まず、抽出と各サンプル、種またはプロトコルの洗い流しの数を試してみることが重要です。例えば、私たちの手の中で、ZSF1肥満ラット組織抽出は「脂肪」の側面を持っており、接着中にこれらの細胞はより滑りやすいが、測定することはより困難ではないことを指摘した。この問題を回避する方法は、動物1匹につき妥当な数の細胞を持つために、より多くの実験を行うことでした。さらに、良好な線条と妥当な長さで、接着する良いセルを選択することが重要です。心筋細胞がこれらの特徴を持たない場合、それは主に針の先端から切り離されるか、または無/低力を開発する。また、接着の時間と細胞を針に接着する有効性を考慮して、心筋細胞の付着に正しい接着剤を使用することも重要です。私たちの手の中で、シリコーン接着剤(材料のテーブル)は速く(10-15分)、十分に強く治ります。最後の重要なステップは、細胞を接着した後5分の心筋細胞を慎重に持ち上げ(細胞をカバースリップに接着することを避けるため)、ウェルに移動する前に(顕微鏡ステージで引きずられる細胞を避けるために)関連しています。 表 7 に、この手法に関連するトラブルシューティング、その根本的な原因、および頻繁な問題を解決するための可能な解決策をまとめます。
この方法の主な制限は、myofilamentの収縮性に関連するすべての質問(myofilamentが活性化/非アクティブ化する速度など)に答えることができないということです。in vivo設定では、細胞内脱分極、細胞内Ca2+ の増加および筋糸状細胞への拡散が収縮するために起こる必要があるのに対し、皮膚付き心筋細胞ではCa2+ の筋糸に対する拡散は、細胞がCa2+ 溶液に沈下されるとすぐに起こる。このより速い速度のCa2+ 拡散は、ミオブフィラメントの活性化/非活性化分析23にバイアスを与える。
これらの実験は、温度、溶液pH、機械的摂動(緩み再伸縮対緩み)および細胞付着手順(ピンタイ対接着剤)を含む異なる要因の影響を受けるが、これらの変数の全てはktrの点で文献の不一致を説明し、サルコメアの長さ依存的な力4,12の増加を示す。
この技術の将来の進歩には、透過性心筋細胞ではなく無傷で機能研究を行うすることが含まれる。この技術は、新たに単離された心筋細胞(以前は凍結されていない)に頼るという欠点を有する。この方法論に直接関係しない別の重要な問題は、それが大きく影響する可能性があり、それはサンプル凍結ストレージの最大期間に関連しています。具体的には、保存時間を通じてmyofilament分解の程度を確立することが必須である(すなわち、抽出された心筋細胞から導出された良好な品質の機能データを保証するために、凍結したサンプルを保存できる期間)。
開示事項
著者には利益相反はない。
謝辞
著者らは、ポルトガル科学技術財団(FCT)、欧州連合、クエロ・デリメンシア・エストラテジコ・ナシオナル(QREN)、フンド・ヨーロッパ・デ・デセンボルヴィメント地域(FEDER)、プログラム・オペラシオナル・ファクタレス・デ・コンペティティビダード(COMPETE)に感謝する。このプロジェクトは、COMPETEERによってサポートされています COMPETE2020 - プログラムオペラシオナルコンペティティビダーデEインテルナシオナリザサン(POCI)、プロジェクトDOCNET(NORTE-01-0145-FEDER-000003)、ノルテポルトガル地域運用プログラム(NORTE 2020)、ポルトガル2020パートナーシップの下で、合意、 欧州地域開発基金(ERDF)を通じて、リスボンの地域運用プログラムである欧州構造投資ファンドが支援するプロジェクトNETDIAMOND(POCI-01-0145-FEDER-016385)を通じて行います。パティシア・ロドリゲスはFCT(SFRH/BD/96026/2013)によって資金提供され、ジョアン・アルメイダ=コエーリョはユニバーシダード・ド・ポルト/FMUPとFSEフンド・ソーシャル・ヨーロッパによって資金提供されました。 NORTE 2020-プログラムオペラシオナル地域ドノルテ、(NORTE-08-5369-FSE-000024-プログラム・ドゥートレ)。
資料
| Name | Company | Catalog Number | Comments |
| Acetone | Sigma | 34580 | |
| Adenosine 5’-triphosphate disodium salt hydrate (Na2ATP) | Sigma | A2383 | |
| Calcium carbonate (CaCO3) | Merck | 1.02067.0500 | |
| Imidazole | VWR | 24720.157 | |
| Magnesium chloride hexahydrate (MgCl2.6H2O) | Merck | 1.05833.0250 | |
| Magnesium chloride solution (MgCl2 1M) | Sigma | M1028 | |
| N,N-Bis(2-hydroxyethyl)taurine (BES) | Sigma | B9879 | |
| Phosphocreatine dissodium salt hydrate (Na2PCr) | Sigma | P7936 | |
| Potassium chloride (KCl) | Merck | 1.04936.1000 | |
| Potassium hydroxide (KOH) | Merck | 8.14353.1000 | |
| Propionic acid (C3H6O2) | Merck | 8.00605.0500 | |
| Silicone Squeeze Tube | Marineland | 31003 | |
| Tritiplex (EGTA) | Merck | 1.08435.0025 | |
| Triton® X-100 10% | Merck | 648463 | |
| Tissue homogeneizer (GKH GT Motor Control) | Terre Haute Glas-col | ||
| Length Controller (Model 315C-I) | Aurora Scientific | ||
| Force Transducer (Model 403 A) | Aurora Scientific | ||
| Software ASI 600A | Aurora Scientific | ||
| Sotware VSL (Model 900B) | Aurora Scientific | ||
| Inverted Microscope (IX51) | Olympus |
参考文献
- Leite-Moreira, A. M., et al. Stretch-induced compliance: a novel adaptive biological mechanism following acute cardiac load. Cardiovascular Research. 114 (5), 656-667 (2018).
- Falcao-Pires, I., Fontes-Sousa, A. P., Lopes-Conceicao, L., Bras-Silva, C., Leite-Moreira, A. F. Modulation of myocardial stiffness by β-adrenergic stimulation - its role in normal and failing heart. Physiological Research. 60 (4), 599-609 (2011).
- Cokkinos, D. V. . Introduction to Translational Cardiovascular Research. , 371-387 (2015).
- van der Velden, J., Stienen, G. J. M. Cardiac Disorders and Pathophysiology of Sarcomeric Proteins. Physiological Reviews. 99 (1), 381-426 (2019).
- Garnier, D. Attachment procedures for mechanical manipulation of isolated cardiac myocytes: a challenge. Cardiovascular Research. 28 (12), 1758-1764 (1994).
- Brady, A. J. Mechanical properties of isolated cardiac myocytes. Physiological Reviews. 71 (2), 413-428 (1991).
- Falcao-Pires, I., Leite-Moreira, A. F., Cokkinos, D. V. Chapter 20. Introduction to Translational Cardiovascular Research. 20, 371-387 (2015).
- Liang, W. Teaching calcium-induced calcium release in cardiomyocytes using a classic paper by Fabiato. Advances Physiology Education. 32 (1), 1-10 (2008).
- Roche, S. M., Gumucio, J. P., Brooks, S. V., Mendias, C. L., Claflin, D. R. Measurement of Maximum Isometric Force Generated by Permeabilized Skeletal Muscle Fibers. Journal of Visualized Experiments. (100), e52695 (2015).
- Huxley, A. F. Muscle structure and theories of contraction. Progress Biophysics and Biophysical Chemistry. 7, 255-318 (1957).
- Sequeira, V., et al. Synergistic role of ADP and Ca(2+) in diastolic myocardial stiffness. Journal Physiology. 593 (17), 3899-3916 (2015).
- Edes, I. F., et al. Rate of tension redevelopment is not modulated by sarcomere length in permeabilized human, murine, and porcine cardiomyocytes. American Journal Physiology Regulatory Integrative Comparative Physiology. 293 (1), R20-R29 (2007).
- King, N. M., et al. Mouse intact cardiac myocyte mechanics: cross-bridge and titin-based stress in unactivated cells. Journal General Physiology. 137 (1), 81-91 (2011).
- Hamdani, N., et al. Myocardial titin hypophosphorylation importantly contributes to heart failure with preserved ejection fraction in a rat metabolic risk model. Circulation Heart Failure. 6 (6), 1239-1249 (2013).
- Miranda-Silva, D., et al. Characterization of biventricular alterations in myocardial (reverse) remodelling in aortic banding-induced chronic pressure overload. Scientific Reports. 9 (1), 2956 (2019).
- Rodrigues, P. G., et al. Early myocardial changes induced by doxorubicin in the nonfailing dilated ventricle. American Journal Physiology Heart Circulatory Physiology. 316 (3), H459-H475 (2019).
- van der Velden, J., et al. Alterations in myofilament function contribute to left ventricular dysfunction in pigs early after myocardial infarction. Circulation Research. 95 (11), e85-e95 (2004).
- Wakili, R., et al. Multiple potential molecular contributors to atrial hypocontractility caused by atrial tachycardia remodeling in dogs. Circulation: Arrhythmia Electrophysiology. 3 (5), 530-541 (2010).
- Ait Mou, Y., le Guennec, J. Y., Mosca, E., de Tombe, P. P., Cazorla, O. Differential contribution of cardiac sarcomeric proteins in the myofibrillar force response to stretch. Pflugers Archiv. 457 (1), 25-36 (2008).
- Falcao-Pires, I., et al. Diabetes mellitus worsens diastolic left ventricular dysfunction in aortic stenosis through altered myocardial structure and cardiomyocyte stiffness. Circulation. 124 (10), 1151-1159 (2011).
- Lim, C. C., et al. Anthracyclines induce calpain-dependent titin proteolysis and necrosis in cardiomyocytes. Journal Biology Chemistry. 279 (9), 8290-8299 (2004).
- Woulfe, K. C., et al. A Novel Method of Isolating Myofibrils From Primary Cardiomyocyte Culture Suitable for Myofibril Mechanical Study. Frontiers Cardiovascular Medicine. 6, 12 (2019).
- Ait Mou, Y., Bollensdorff, C., Cazorla, O., Magdi, Y., de Tombe, P. P. Exploring cardiac biophysical properties. Global Cardiology Science Practice. 2015, 10 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved