Method Article
In Vitro-Bewertung der Herzfunktion mit gehäuteten Kardiomyozyten
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll zielt darauf ab, Schritt für Schritt die Technik der Extraktion und Bewertung der Herzfunktion mit enthäuten Kardiomyozyten zu beschreiben. Diese Methode ermöglicht die Messung und akute Modulation der Myofilament-Funktion mit kleinen gefrorenen Biopsien, die von verschiedenen Herzstellen, von Mäusen bis zu Männern, gesammelt werden können.
Zusammenfassung
In diesem Artikel beschreiben wir die Schritte, die erforderlich sind, um eine einzelne permeabilisierte ("gehäutete") Kardiomyozyten zu isolieren und sie an einem Kraftmessgerät und einem Motor zu befestigen, um funktionelle Studien durchzuführen. Diese Studien ermöglichen die Messung der Kardiomyozytensteifigkeit (passive Kraft) und deren Aktivierung mit verschiedenen Calcium (Ca2+)-haltigen Lösungen, um unter anderem zu bestimmen: maximale Kraftentwicklung, Myofilament Ca2+-Empfindlichkeit (pCa50), Zusammenarbeit (nHill) und die Rate der Kraftsanierung (ktr). Diese Methode ermöglicht auch die Bestimmung der Auswirkungen von Arzneimitteln, die direkt auf Myofilamente wirken, und der Expression exogener rekombinanter Proteine auf aktive und passive Eigenschaften von Kardiomyozyten. Klinisch zeigen gehäutete Kardiomyozytenstudien die Pathophysiologie vieler Myokarderkrankungen und ermöglichen eine in vitro-Bewertung der Auswirkungen therapeutischer Interventionen, die auf die Myofilamente abzielen. Insgesamt ermöglicht diese Technik die Klärung der kardialen Pathophysiologie, indem Korrelationen zwischen In-vitro- und In-vivo-Parametern in Tiermodellen und menschlichem Gewebe untersucht werden, das während der Operation am offenen Herzen oder transplantationen gewonnen wird.
Einleitung
Traditionell wurde die Beurteilung der mechanischen Eigenschaften der Myokarde vor allem in mehrzelligen Präparaten wie Papillenmuskeln und Trabeculae1,2versucht. Multizelluläre Herzmuskelstreifen umfassen eine heterogene Population von Zellen, einschließlich kontraktiler Kardiomyozyten mit einem unbekannten Muster der Orientierung und Kraftgenerierung, elektrische Aktivität und Spannungs-/Dehnungsverteilungen sowie eine umgebende Bindegewebsmatrix3,4. Ein Präparat ohne Kollagen und mit einer einzigen Kardiomyozyten würde die Messung der Sarkomelänge und der querüberbrückungskontraktilen Eigenschaften in einer sehr präzisen und kontrollierten Weise ermöglichen5,6. Daher wurden in den letzten vier Jahrzehnten mehrere Methoden entwickelt, die die Untersuchung der mechanischen, kontraktilen und entspannenden Eigenschaften einer einzelnen Kardiomyozyten6,7ermöglichen. Die kontraktile Funktion dieser Zellen ist stark abhängig von sarcomere Länge und Querbrücke Radfahren Kinetik3. Daher ist es wünschenswert, die Muskelfunktion direkt in einzelnen isolierten Herzzellen zu untersuchen, wenn man bedenkt, dass es die Beurteilung von Sarkomelänge und Leistung sowie überbrückender Funktion und kontraktilen Eigenschaften ermöglicht. Die Isolierung und Befestigung funktioneller Kardiomyozyten mit einer angemessenen optischen Sarcomere-Auflösung während der Aufzeichnung der Kraftmessung auf der Ebene von N ist jedoch immer noch anspruchsvoll und entwickelt sich3,6. Weitere Herausforderungen sind die Logistik, die installiert werden muss, um Kardiomyozyten von frisch gesammelten Biopsien zu isolieren. Die Unvorhersehbarkeit der Sammlung menschlicher Biopsien kann beispielsweise die Durchführbarkeit der Experimente gefährden.
Darüber hinaus haben ethische Bedenken in Bezug auf die Ersetzung, Reduktion und Verfeinerung von Tierversuchen für wissenschaftliche Verfahren (Prinzipien der 3Rs) Studienänderungen auf Zell- und Gewebeebene gefördert, vorzugsweise in menschlichen Biopsien oder in kleineren Tierproben. In der Tat ermöglicht eine fortschreitende Verfeinerung der Methoden zur Beurteilung der Herzfunktion in vitro auf einer kleineren Komplexitätsebene eine ordnungsgemäße Integration der Ergebnisse in den ganzen Körper und übersetzt sie in das klinische Szenario7. Insgesamt kann die Verwendung von Proben, die bei -80 °C gelagert werden, um Kardiomyozyten zu extrahieren, eine attraktive Alternative sein.
Das Myokardgewebe wird in kleine Stücke geschnitten und mit einem Mörtel und einem Stößel homogenisiert. Das Ergebnis dieser Homogenisierung ist eine Suspension von gehäuteten gebündelten und isolierten Zellen mit unterschiedlichen Sarkolummaler Schäden, wobei das Myoplasma dem Bademedium ausgesetzt ist und alle zellulären Komponenten ausgewaschen werden. Strukturen wie die Myofibrils, die weiter vom Sarcolemma entfernt sind, bleiben erhalten. So bleiben Sarcomere-Verkürzungen und funktionelle Eigenschaften im Zusammenhang mit dem myofibrillaren Apparat erhalten und können8,9aufgezeichnet werden.
Das Kardiomyozyten-Kraftmesssystem besteht aus einem elektromagnetischen Motor, der zur Einstellung der Kardiomyozytenlänge verwendet wird, und einem Kraftwandler, der die isometrische Kardiomyozytenkontraktion misst. Eine permeabilisierte oder gehäutete Kardiomyozyten wird in eine Versuchskammer gelegt, die eine entspannende Lösung ([Ca2+] < 10 nM) und Silikon verklebt auf 2 dünne Nadeln enthält: eine, die am Motor und die andere am Kraftwandler befestigt ist. Ein optisches System wird verwendet, um Kardiomyozytenmorphologie und Sarcomere-Länge zu bestimmen. Das experimentelle Protokoll besteht oft aus einer Reihe von Kraftaufzeichnungen auf Pufferlösungen mit unterschiedlichen Ca2+-Konzentrationen, der Bestimmung der Actin-Myosin-Querbrückenkinetik und der Messung der passiven Spannung der montierten Kardiomyozyten in vordefinierten Sarkomelängen ( Abbildung1). Die Isolierung permeabilisierter Kardiomyozyten aus myokardischen Proben, die in flüssigem Stickstoff eingefroren sind (und anschließend bei -80 °C gelagert werden), ist eine Technik, die zelluläre Mechanik und Proteinbiochemie zur Messung der maximalen Ca2+-aktivierten (aktiven) Kraft pro Querschnittsfläche (Taktiv,kN-m -2), Ca2+-unabhängig (passiv) Spannung (Tpassiv,kN'm -2), Myofilamente Ca2+-Empfindlichkeit (pCa50), Myofilamente Cooperativity (nHill), die Rate der Kraftsanierung (ktr) sowie Sarcomere Länge Abhängigkeiten von Taktiv, T passiv , pCa50, nHill und ktr.
Ziel dieses Protokolls ist es, das Potenzial des Kardiomyozytenkraftmesssystems als zuverlässiges Verfahren zur Beurteilung der funktionellen mechanischen Eigenschaften von eingehäuten Kardiomyozyten, die aus gefrorenen Proben verschiedener Arten isoliert sind, zu veranschaulichen und zusammenzufassen.
Protokoll
Alle Tierversuche entsprechen dem Leitfaden für die Pflege und Verwendung von Labortieren (NIH-Veröffentlichung Nr. 85-23, überarbeitet 2011) und dem portugiesischen Tierschutzgesetz (DL 129/92, DL 197/96; P 1131/97). Die zuständigen lokalen Behörden genehmigten dieses Versuchsprotokoll (018833).
1. Vorbereitung der Lagerlösung (Tabelle 1)
- Bereiten Sie 1.000 ml Entspannungslösung für die Isolierung von Kardiomyozyten (RELAX-ISO) vor, indem Sie die Anweisungen in Tabelle 2befolgen. Lösen Sie das Reagenz oben in ≈500 ml auf und stellen Sie den pH-Wert mit KOH auf 7,0 ein. Stellen Sie das Endvolumen auf 1000 ml ein.
- RELAX-ISO in 50 ml-Rohren verteilen. Bei -20 °C lagern.
- Bereiten Sie 250 ml der aktivierenden Lösung vor, indem Sie die Anweisungen in Tabelle 3befolgen. Lösen Sie die oben genannten Reagenzien in ≈100 ml reinem Wasser auf. Stellen Sie den pH-Wert auf 7,1 bei 5 M KOH bei 15 °C ein.
HINWEIS: Normalerweise ist es notwendig, eine erhebliche Menge an KOH hinzuzufügen, um den gewünschten pH-Wert zu erreichen. Legen Sie den volumetrischen Ballon in eine Kiste mit Eis, um die Lösung auf 15 °C abzukühlen.- Stellen Sie das Endvolumen auf 250 ml ein. Rühren Sie diese Lösung kontinuierlich mit einem Magnetischen Rührer bis zum Zeitpunkt des Mischens mit der entspannenden Lösung.
- Bereiten Sie 100 ml Entspannungslösung vor, indem Sie die Anweisungen in Tabelle 4befolgen. Lösen Sie die oben genannten Reagenzien in ≈50 ml reinem Wasser auf. Stellen Sie den pH-Wert auf 7,1 bei KOH 5 M bei 15 °C ein.
HINWEIS: Normalerweise ist es notwendig, eine signifikante Menge an KOH hinzuzufügen, um einen pH-Wert von 7,1 zu erreichen. Legen Sie den Volumetballon in eine mit Eis gefüllte Box, um die Lösung auf 15 °C abzukühlen. Die Ionenstärke der bei den Messungen verwendeten Lösungen betrug 180 mM.- Stellen Sie das Endvolumen auf 100 ml ein. Rühren Sie diese Lösung kontinuierlich mit einem Magnetischen Rührer bis zum Zeitpunkt des Mischens mit einer aktivierenden Lösung.
- Mischen Sie aktivierende und entspannende Lösungen in den in Tabelle 5 dargestellten Proportionen, um pCa-Lösungen zwischen 5.0 und 6.0 zu erhalten.
- Immer entspannende und aktivierende Lösungen agitieren, während beide mischen.
- Aliquot jede Mischung zu 2 ml Mikroröhren. Alle Mikroröhren bei -20 °C aufbewahren.
- Bereiten Sie für jedes Protokoll eine andere PCa-Lösung (4.5 bis 6.0) vor.
2. Kalibrierung des Kraftwandlers
HINWEIS: Die Kalibrierung des Kraftaufnehmers ist ein Routineverfahren, das alle paar Monate oder bei Verdacht auf nicht kalibriert durchgeführt werden sollte. Der Kraftaufnehmer ist hochempfindlich und leicht zu brechen. Es sollte sanft in jedem Schritt seiner Verwendung behandelt werden, einschließlich Kalibrierung, Klebung der Kardiomyozyten und Reinigung.
- Lösen Sie den Kraftwandler vom Rest des Geräts.
- Platzieren Sie den Kraftwandler mit Hilfe einer Klemme horizontal so, dass die Nadel in der gleichen Ausrichtung nach unten zeigt, wie die Kardiomyozyten Kraft entwickeln. Dies erleichtert das Aufhängen einer Reihe von Massen mit bekannten Gewichten (elastisches Band, Naht oder Stift).
HINWEIS: Überprüfen Sie die Eigenschaften des Kraftwandlers, bevor Sie mit diesem Schritt fortfahren, um den Skalierungsfaktor [mg/Volt] zu überprüfen und übermäßiges Gewicht am Messumformer zu vermeiden. Für das Kraftaufnehmermodell beträgt der Skalierungsfaktor 50 (50 mg entsprechen 1 Volt) und wir verwenden 5 Gewichte zwischen 12,5 und 250 mg. - Schalten Sie den Kraftaufnehmer ein und lassen Sie ihn 30 min aufwärmen.
- Beginnen Sie, indem Sie die hellere Masse am Kraftwandler aufhängen und die entsprechende Spannung registrieren, die bei FORCE OUT gemessen wird.
- Wiederholen Sie diesen Vorgang für bis zu fünf Gewichtungen.
- Plotkraft auf den Kraftwandler (Last) im Vergleich zur Spannung angewendet und auf Linearität überprüft.
- Wenn keine Linearität vorhanden ist, stellen Sie die Null ein und gewinnen Sie Potentiometer in der Platine des Messumformers. Weitere Informationen finden Sie in der jeweiligen Anleitung.
- Drehen Sie das Nullpotentiometer, bis die Ausgangsspannung 0,0 V liest.
- Geben Sie ein mittleres Gewicht auf die Gebernadel und stellen Sie das Gain-Potentiometer ein, um die entsprechende Spannung zu lesen (z. B. 50 mg entsprechen 1 V). Entfernen Sie das Gewicht und stellen Sie das Nullpotentiometer auf 0,0 ein.
- Wiederholen Sie Schritt 2.6.2, bis die Ausgabe mit und ohne Gewicht korrekt ist.
- Montieren Sie den Kraftaufnehmer wieder in das Gerät.
3. Einstellung des Versuchsgeräts
- Eine Durchstechflasche jeder der aktivierenden 4.5, 5.0, 5.2, 5.4, 5.6, 5.8, 6.0 und entspannenden Lösungen auftauen und auf Eis halten.
HINWEIS: ATP und PCr sind labile Verbindungen, die bei kalten Temperaturen gehalten werden sollten. - Bereiten Sie das Mikroskop, das Prüfgerät und den zugehörigen Computer für den Einsatz vor (Abbildung 1).
- Stellen Sie die Temperatur so ein, dass das In-Kammer-Thermometer 15 °C liest. Führen Sie alle Experimente bei dieser Temperatur mit Ausnahme von Kinase- und Phosphatase-Inkubationen (20 °C) durch.
- Schalten Sie den Kraftwandler und den Motor ein.
4. Extraktion und Permeabilisierung von enthäuten Kardiomyozyten
- 50 ml RELAX-ISO Lösung auftauen.
- Die Zentrifuge einschalten und schnell auf 4 °C abkühlen.
- In einer Petrischale mit 2,5 ml RELAX-ISO-Lösung 3-5 g einer Myokardprobe auftauen.
- Schneiden Sie das Gewebe in kleine Stücke mit einer Skalpellklinge(Abbildung 2). Schneiden Sie die Probe präzise, um unnötige Zellschäden zu vermeiden.
- Übertragen Sie die 2,5 ml RELAX-ISO Lösung mit dem Gewebe mit einer geschnittenen Pipettenspitze in ein Potter-Elvehjem-Glas.
- Mechanisch stören das Gewebe mit einem Schleifer bei einer Drehzahl von 30-40 Rpm. Drücken Sie das Gewebe 3 mal für 2 s, um eine gute Zellsuspension zu erhalten.
- Bereiten Sie 10% Triton in RELAX-ISO-Lösung (250 l Triton mit 2,25 ml RELAX-ISO) in einem 15 ml Rohr vor und fügen Sie diese Lösung der Zellsuspension hinzu.
- Mischen Sie vorsichtig, indem Sie das Rohr 3 mal invertieren.
- Bei Raumtemperatur für 1 min und 4 min auf Eis inkubieren.
- Waschen Sie den Triton aus, indem Sie RELAX-ISO bis zur Oberseite des 15 ml Rohres hinzufügen; sanft mischen (3-faches Rohr umkehren) und schließlich die Zellen in einer abgewinkelten Zentrifuge abspinnen (1 min bei 348 x g). Entfernen Sie den Überstand bis zu 3 ml über dem Zellpellet.
HINWEIS: Entfernen Sie den Überstand vorsichtig, um eine Störung des Zellpellets zu vermeiden. Dennoch werden einige Zellen im Überstand unweigerlich verloren gehen. - Wiederholen Sie den Schritt 4.10 mindestens 4 Mal oder bis keine weiteren Blasen von Triton-Rückständen beobachtet werden.
HINWEIS: Je mehr Auswaschschritte gemacht werden, desto mehr Zellen gehen mit dem ausrangierten Überstand verloren. - Beim letzten Auswaschen den Überstand bis zu einem Volumen von 5-10 ml Zellsuspension entfernen.
5. Auswahl und Verklebung der gehäuten Kardiomyozyten
- Legen Sie einen Zellaufhängungstropfen auf einen Deckelschlupf auf einen Glasschlitten im Mikroskop-Diahalter(Abbildung 1).
- Wählen Sie eine einzelne stabförmige Kardiomyozyten mit einem guten Striationsmuster und größe (Abbildung 2).
- Finden Sie die Nadelspitzen des Kraftwandlers und des Motors mit der niedrigsten Vergrößerung des invertierten Mikroskops.
- Drehen Sie den Coverslip, um die ausgewählte Kardiomyozyten horizontal zu positionieren, so dass ihre Enden mit der Nadel des Kraftwandlers und des Motors ausgerichtet sind (Abbildung 2).
- Legen Sie eine dünne Leimlinie an der Seite des Deckels mit Hilfe einer Tupferspitze (Abbildung 2).
- Tauchen Sie die Nadelspitzen des Kraftwandlers und des Motors in die Klebelinie ein, um einen Leim-Halo um beide Spitzen zu schaffen.
HINWEIS: Die Schritte 5.6 - 5.10 werden durch den sorgfältigen Einsatz der motorisierten Mikropositionierer erreicht. - Bewegen Sie die Nadelspitzen schnell in die Nähe der Brennebene der Kardiomyozyten.
- Bewegen Sie die Nadelspitze des Kraftwandlers nach unten, so dass sie an eine Kante der Kardiomyozyten klebt.
- Wiederholen Sie diesen Vorgang mit der Spitze des Motors und der anderen Extremität der Zelle.
HINWEIS: Dieses Verfahren muss weniger als 2-3 min dauern, da der Kleber sehr schnell zu heilen beginnt. - Heben Sie nach 5-8 min die Nadeln ≈15 m an, um zu vermeiden, dass die Zelle an den Deckelschlupf klebt. Dies geschieht, indem beide Mikromanipulatoren gleichzeitig nach oben bewegt werden.
- Lassen Sie den Kleber aushärten. Dieses Verfahren kann von 15 bis 45 min dauern, abhängig von der Art des Klebers. In unserem Fall wird die Kardiomyozyten nach ≈15 min ausreichend verklebt.
6. Aufzeichnung von Kraftmessungen der aktiven, passiven und Ca2+ Empfindlichkeit
- Füllen Sie den ersten experimentellen Brunnen mit der Entspannungslösung (55-100 l im Versuchsapparat) und den zweiten experimentellen Brunnen mit aktivierender Lösung.
- Platzieren Sie mit der Kamerasoftware den Interessenbereich (ROI) in einem Bereich der Kardiomyozyten mit einem klaren Muster der Striation.
HINWEIS: Bei Herzmyozyten schwankt die Operationssarkeslänge zwischen 1,8 und 2,2 m, und die optimale Sarkome-Länge beträgt etwa 2,15 m. - Messen Sie den Abstand zwischen den beiden Extremen der Kardiomyozyten (vom Motor bis zum Wandlerkleber Halo, Abbildung 3), nachdem die optimale Sarkomelänge eingestellt wurde (2,2 m). Zeichnen Sie den Wert als Myozytenlänge in der Software auf.
- Messen Sie die Kardiomyozytenbreite und -tiefe, letztere mit Hilfe eines Prismenspiegels, der senkrecht zur Zelle platziert ist.
HINWEIS: Eine leistungsstarke, externe Lichtquelle wird benötigt, um die Zelle durch das Prisma zu visualisieren. Falls es kein Prisma gibt und unter der Annahme, dass Herzzellen eine elliptische Form haben, kann die Kardiomyozytentiefe als 70% der Kardiomyozytenbreite abgeleitet werden. - Berechnen Sie die Querschnittsfläche (CSA, mm2) unter der Annahme einer elliptischen Form der Kardiomyozyten.

- Bewegen Sie die Mikroskopstufe vorsichtig, so dass sich die Zelle vom Deckelrutsch zu der gut haltigen Entspannungslösung auf der Rückseite der Bühne bewegt.
HINWEIS: Dieses Verfahren kann die Zelle leicht beschädigen. Bevor Sie die Zelle bewegen, bewegen Sie die Nadeln vorsichtig ein wenig mehr nach oben. Vermeiden Sie das Entfernen der Zelle aus der Lösung. - Wählen Sie das Protokoll in der Software, das zwei Zellverkürzungen (80 % der ursprünglichen Länge) enthält, die auftreten, wenn die Zelle in Ca2+ Lösung bzw. in entspannender Lösung auftaucht (Abbildung 1, Ergänzende Datei).
HINWEIS: Erste "Slack" der Zelle wird innerhalb der aktivierenden Lösung und die zweite "Slack" in entspannende Lösung durchgeführt werden. Auf diese Weise kann der Benutzer die Gesamtkraft (Fgesamt)der Zelle aus der1. und die passive Kraft (Fpassiv)der Zelle aus dem2. jahrhundertberechnen. Verwenden Sie die Formel, um die aktive Kraft zu berechnen, Faktiv = Ftotal - Fpassiv. Die Zelle wird um 80 % verkürzt, um alle Überbrückungsrekordkräfte zu lösen. - Entlocken Sie die isometrische Kontraktion, indem Sie die Mikroskopstufe so bewegen, dass sich die Kardiomyozyten von der entspannenden zur aktivierenden Lösung bewegt (pCa=4.5(1)).
HINWEIS: Wenn die Zelle funktionsfähig ist, wird sie sofort zusammenziehen. - Wenn Sie das Kraftplateau erreichen, beginnen Sie mit der Aufzeichnung der Kraftdaten.
HINWEIS: Die Tests können einzeln durchgeführt werden. Je nach Software besteht die Möglichkeit, eine Abfolge von Tests zu erstellen, die den verschiedenen Ca2+ Lösungen innerhalb eines Ca2+-Sensitivitätsprotokolls entsprechen (Abbildung 1, Zusatzdatei). - Warten Sie 10 s, und wechseln Sie dann die Zelle, die in die Aktivierungslösung eingetaucht ist.
HINWEIS: Es ist wichtig, 10 s zu warten, bevor Sie die Zelle in entspannende Lösung eintauchen. Wenn die Zelle zu früh verschoben wird, gehen wichtige Daten zur Berechnung der Sanierungskraft der Zelle (ktr-Wert) möglicherweise verloren. - Bewegen Sie die Bühne schnell, so dass die Kardiomyozyten in die entspannende Lösung eintaucht.
- Warten Sie, bis der Test beendet wird.
- Wiederholen Sie die Schritte 6.8 - 6.12, so dass die Zelle zweimal in der aktivierenden Lösung aktiviert wird (pCa=4.5(2)).
HINWEIS: In der Regel können sich nach der ersten Aktivierung die Cardiomyozytenen den Nadelspitzen leicht lösen und die Kardiomyozytenlänge, CSA und/oder die Sarcomere-Länge ändern. Korrigieren Sie die gewünschte Sarcomere-Länge und führen Sie die korrigierten Abmessungen in die Software ein.- Fahren Sie mit Schritt 6.13.2 für Ca2+ Empfindlichkeitsprotokoll oder speichern Sie die Daten, wenn Werte der passiven und aktiven Kraft der Zelle sind die einzigen Parameter benötigt und lösen Sie die Zelle von Nadeln und reinigen Sie sie mit Aceton, um den Kleber zu entfernen.
- Stellen Sie die Sarcomere-Länge der Zelle bei Bedarf auf 2,2 m ein, indem Sie sie bei Bedarf wieder leicht dehnen.
- Ersetzen Sie die aktivierende Lösung durch die nächste Ca2+ Lösung (55-100 l hier). Wiederholen Sie die Schritte 6.8 - 6.12.
- Ersetzen Sie die aktivierende Lösung durch die nächste Ca2+-Lösung (55-100 l hier) und wiederholen Sie die Schritte 6.8 - 6.12, bis alle Lösungen getestet wurden (5.0, 5.2, 5.4, 5.6, 5.8, 6.0).
- Schließlich die Zelle mit einer aktivierenden Lösung (pCa4.5(3)) reaktivieren. Wiederholen Sie die Schritte 6.8- 6.12.
7. Inkubation mit Kiinasen und Phosphatasen
- Nach Der Durchführung des gewählten Basisprotokolls die Kinase/Phosphatase in Relaxing-Lösung in der empfohlenen Konzentration verdünnen.
HINWEIS: Es wird empfohlen, vor dem Experiment eine Dosis-Wirkungs-Kurve durchzuführen. - Stellen Sie die Temperatur der Versuchsbrunnen auf 20 °C ein.
- Füllen Sie die Versuchsbrunnen mit Kinase/Phosphatase, Entspannungslösung und Aktivierungslösung (55-100 l).
- Bewegen Sie die Mikroskopstufe vorsichtig, so dass die Zelle in die brunnenhaltige Kinase/Phosphatase eingetaucht wird.
- Inkubieren Sie die Kardiomyozyten mindestens 30 min mit der Kinase/Phosphatase oder gemäß den Anweisungen des Herstellers.
- Wiederholen Sie das ausgewählte Baseline-Protokoll.
8. Abschluss des Experiments
- Entkleben Sie die Kardiomyozyten von den Spitzen des Kraftwandlers und des Motors, indem Sie die Zelle dehnen.
- Entfernen Sie den Leim-Halo vorsichtig von den Nadelspitzen mit einem in Aceton getränkten Wattestäbchen.
- Fahren Sie das Gerät herunter.
9. Analysieren der Daten
- Sammeln Sie alle Dateien von jedem getesteten Kardiomyozyten.
HINWEIS: Jeder Test entspricht einer Datei. Dies bedeutet, dass für jede Ca2+ Lösung oder Sarcomere-Länge eine entsprechende Datei vorhanden ist. - Berechnen Sie aktive und passive Kräfte einer einzelnen Kardiomyozyten.
- Öffnen Sie die Datei, die der ersten Aktivierung entspricht (pCa=4.5(1)) mit einer Kalkulationstabelle (Abbildung 3A, Anhang A in Ergänzender Datei).
HINWEIS: Wir haben ein maßgeschneidertes Programm verwendet, um die Analyse durchzuführen. Siehe Anhang A in der Zusatzdatei. - Durchschnittliche ≈60 Werte vor und durchschnittliche ≈60 Werte nach dem1. Puffer der Zelle (wenn die Zelle in Ca2+ Lösung eingetaucht ist). Diese 2 Werte entsprechen a bzw. b.
- Wiederholen Sie die gleiche Analyse für die2. Pufferzeit der Zelle (wenn die Zelle in eine entspannende Lösung getaucht ist). Diese 2 Werte entsprechen c bzw. d.
- Berechnen Sie die Differenz zwischen a und b (Gesamtkraft, Fgesamt).
- Berechnen Sie die Differenz zwischen c und d (passive Kraft, Fpassiv).
- Aktive Kraft berechnen, Faktiv = Ftotal - Fpassiv.
- Normalisieren Sie alle Kraftwerte auf CSA (siehe Formel oben), um die Gesamtspannung (Ttotal), passive Spannung (Tpassiv)und aktive Spannung (Taktiv)zu erhalten.
- Wiederholen Sie Schritt 9.2.1 bis 9.2.5 für die2. Aktivierung (pCa=4.5(2)).
- Betrachten Sie diese Werte als werte, die Ttotal, Taktiv und Tpassiv der zu analysierenden Kardiomyozyten darstellen.
HINWEIS: Die erste Aktivierung der Zelle mit pCa4.5(1) ist in der Regel mit Veränderungen der Zellabmessungen verbunden. Aus diesem Grund ist die zweite Aktivierung mit pCa4.5 genauer und wird verwendet. - Wiederholen Sie die Schritte 9.2.1 bis 9.2.5 für jede getestete Datei/pCa(3) (5.0, 5.2, 5.4, 5.6, 5.8, 6.0, 4.5(3)).
- Öffnen Sie die Datei, die der ersten Aktivierung entspricht (pCa=4.5(1)) mit einer Kalkulationstabelle (Abbildung 3A, Anhang A in Ergänzender Datei).
- Berechnen Sie pCa50 und nHill von einer einzelnen Kardiomyozyten.
HINWEIS: Verwenden Sie für diese Analyse die nicht normalisiertenaktiven F-Werte aus den Dateien 4.5(2), 5.0, 5.2, 5.4, 5.6, 5.8, 6.0 und 4.5(3).- Platzieren Sie in einer Tabellenkalkulationsdatei alle nicht-normalisierten Werte von Faktiv für jede getestete Ca2+-Lösung (4.5(2),5.0, 5.2, 5.4, 5.6, 5.8, 6.0, 4.5(3)).
- Berechnen Sie den Korrekturfaktor = Faktiv [4.5(2)] - Faktiv [4.5(3)] / 7.
- Berechnen Sie die korrigierten Werte von Faktiv für jede Ca2+ Lösung (5.0, 5.2, 5.4, 5.6, 5.8, 6.0), indem Sie Factive - Korrekturfaktor subtrahieren.
- Berechnen Sie die relative Kraft (Frelativ) für jede Ca2+ Lösung, indem Sie jedenF-Aktivwert um den entsprechenden korrigierten Wert normalisieren.
HINWEIS: DerF-Verwandte [4.5(3)] sollte gleich 1 sein. Jedes experimentelle Protokoll beginnt und endet mit einer Kontrollaktivierung bei der Sättigung ca2+ Konzentration (pCa 4.5(2) und 4.5(3)). Dies ermöglicht eine Zwangsnormalisierung und Bewertung des Ablaufs der Präparate durch den Vergleich von Änderungen der maximalen Ca2+-aktivierten Kraft (Fmax). Wenn die Kardiomyozyten am Ende des Versuchsprotokolls weniger als 70 % der maximalen Kraft der ersten Kontraktion erzeugt, sollte diese Zelle/Messung von der Analyse ausgeschlossen werden. - Verwenden Sie dieF-Relativen und die entsprechenden pCa-Werte, um an eine sigmoidale Kurve mit der folgenden Gleichung F(Ca) = CanHill/ (Ca50nHill + CanHill) anzupassen.
- Extrapolieren Sie pCa- und nHill-Werte aus der oben genannten Gleichung.
- Berechnen Sie die Rate der Kraftsanierung (ktr) einer einzelnen Kardiomyozyten.
- Führen Sie eine Anpassung an die Kurve aus, die den Werten unmittelbar nach der1. Zellpufferung entspricht.
- Berechnen Sie die Steigung der Kurve und dieser Wert entspricht der Rate der Kraftsanierung.
- Wiederholen Sie Schritt 9.4.1 und 9.4.2 für jede Ca2+-Lösung.
HINWEIS: Für die niedrigsten Ca-Lösungen (R-Quadrat≤0,90) wird eine schlechte Kurvenanpassung erzielt.
Ergebnisse
Funktionelle permeabilisierte Kardiomyozyten sollten während des gesamten Experiments einheitlich und mit einem konsistenten Striationsmuster erscheinen. Obwohl nach längeren Experimenten mit einer gewissen Verschlechterung und Kraftabnahme zu rechnen ist, sollten die Werte der aktiven Spannung relativ stabil sein. Zellen, die deutliche Anzeichen eines Sttriationsverlustes oder einer signifikanten Kraftabnahme aufweisen (< 15kN-m -2 oder <80% ihrer anfänglichen aktiven Kraft) sollten ausgeschlossen werden. Tabelle 6 zeigt die erwarteten Normalwerte für die wichtigsten Parameter, die von Nagetieren, Schweinen und menschlichen Proben abgeleitet werden.
Die erhaltenen Parameter hängen hauptsächlich vom gewählten Protokoll ab. Abbildung 5 zeigt repräsentative Kraftspuren von 3, von 8, Kraftaufzeichnungen, die erforderlich sind, um ein Protokoll der Myofilamente Ca2+-Empfindlichkeit durchzuführen. Durch die Übertragung der Zelle auf einen Brunnen, der die aktivierende Lösung enthält, beginnt die Kardiomyozyten Kraft zu entwickeln, bis sie ein Plateau erreicht. Nach einem schnellen Puffertest (Dauer 1 ms), bei dem die Kardiomyozyten auf 80% ihrer Länge verkürzt, erhalten wir die Basiswerte von Null kraft. Nach dem Slack-Test entwickelt die Zelle weiterhin Kraft, während sie in die aktivierende Lösung eingetaucht ist. Die Gesamtkraft(F-Gesamt) wird berechnet, indem der Plateauwert vom Minimalwert subtrahiert wird. Die Steigung des letzten Teils dieser Kurve gibt uns den Wert der Kraftsanierung (ktr) (Abbildung 6), die ein Maß für die scheinbare Rate der Querbrückenbefestigung und -ablösung (fapp und gaap)10ist. Wenn der ktrR2-Wert <0.90 ist, sollte der ktr-Wert ausgeschlossen werden, und in der Regel geschieht dies bei niedrigeren Ca2+-Konzentrationen (pCa 5.6, 5.8 und 6.0). Nach der Rückübertragung der Zelle in einen Brunnen, der die entspannende Lösung enthält, entspannt sich die Zelle und ihre Kraft fällt. Passive Kraft (Fpassiv) wird berechnet, indem der Minimalewert (erhalten nach einer längeren Zellverkürzung) auf diesen neuen Kraftwert subtrahiert wird. Aktive Kraft ergibt sich aus der Differenz zwischen Ftotal und Fpassiv.
Die maximale aktive und passive Kraft, die eine Kardiomyozyten charakterisiert, ist diejenige, die von der zweiten Zellaktivierung mit einer sättigenden Ca2+-Lösung abgeleitet wird (pCa = 4.5). Die erste Aktivierung wird in der Regel verworfen, da die Sarcomere-Länge häufig nachjustiert werden muss.
Um ein Myofilament Ca2+-Sensitivitätsprotokoll durchzuführen, ist es notwendig, mindestens 9 Aktivierungstests durchzuführen (4.5; 4.5; 5.2; 5.6; 6.0; 5.0; 5.4; 5.8 und 4.5). Diese Sequenz ist nur beispielhaft, sollte aber immer mit 4,5 (zweimal) beginnen und mit 4,5 enden. Die Programmierung der Datenerfassungssoftware für ein myofilament Ca2+-Sensitivitätsprotokoll ist in Abbildung 1 der Zusatzdateidargestellt.
Überprüfen Sie nach der Berechnung der Aktivenkraft für alle diese Aktivierungslösungen, ob die letzte Aktivierung mehr als 80 % der anfänglichen maximalen Kraft ergibt (andernfalls sollten diese Zellergebnisse verworfen werden, wie oben erwähnt). Um den Rückgang in Fmax während der Versuchsreihe zu korrigieren, können die interpolierten Fmax-Werte verwendet werden, um die Datenpunkte zu normalisieren. Die normalisierten Daten können mit der folgenden Gleichung F(Ca) = CanHill/(Ca50nHill + CanHill) an eine sigmoidalkurve anpasst. Die erhaltenen Parameterwerte stellen die Calciumempfindlichkeit (Ca50, die in pCa50 umgewandelt werden kann) und die Zusammenarbeit (nHill) dar. Alle Kraftwerte können nach der Normalisierung in den Querschnittsbereich in Spannungswerte konvertiert werden. Neben der myofilament Ca2+-Empfindlichkeit und den längenabhängigen Aktivierungsprotokollen können weitere Tests durchgeführt werden. Dies ist der Fall von Sarcomere-Längenabhängigkeiten von Taktiv, Tpassiv (Abbildung 7), und Kardiomyozyten-Restkraft. Restkrafterfassungen werden aus der anfänglichen Kraftrückgewinnung (pCa 4.5) berechnet, die nach der Längenänderung der Zelle (80%) erreicht wurde. und normalisiert auf jede gesamte stationäre Kraft, die vor Längenänderung11erreicht wurde. Die Erhöhung der Restkraft ist in der Regel ein Hinweis auf Querbrücken mit langsamer Ablösungskinetik und höherer Steifigkeit.
Schließlich sollten wir betonen, dass diese Technik in gehäuften Kardiomyozyten durchgeführt werden kann, die mechanisch aus gefrorenen oder frisch entnommenen Proben extrahiert wurden, sowie isoliert enzymatisch gefolgt von der Permeabilisierung ihrer Membranen. Die Art und Weise, wie die Kardiomyozyten isoliert sind, wirkt sich signifikant auf die Ergebnisse aus dieser Technik. Abbildung 8 zeigt die Unterschiede zwischen den drei Isolationsverfahren.

Abbildung 1: Integriertes Schema des Prüfgeräts. Das Prüfgerät umfasst das Mikroskop, die Mikromanipulatoren und den zugehörigen Computer. Der Boden der Abbildung zeigt eine gehäutete Kardiomyozyten zwischen dem Motor und dem Kraftwandler geklebt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Flussdiagramm des Protokolls der Zellisolierung, Permeabilisierung und Verklebung. Das bildende obere linke Ecke besteht aus 4 Bildern, die Teile der Herzprobe in der RELAX-ISO-Lösung (A) in einer Petrischale, (B) in einem Rohr zur mechanischen Homogenisierung von Gewebe, (C) dem Homogenisator, (D) dem Gewebe unmittelbar nach der Homogenisierung und (E) zeigen, wenn es sich in einem Rohr für Diepermeabilisierung befindet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
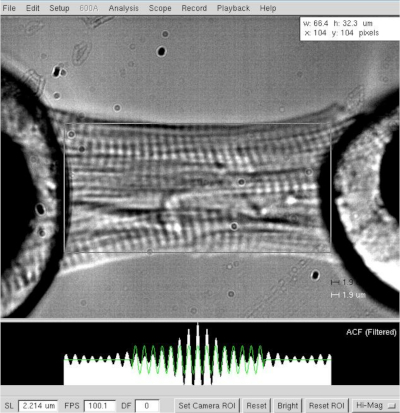
Abbildung 3: Bestimmung der Länge und Sarcomere-Länge einer gehäuten Kardiomyozyten. Zelllänge und Breite bestimmen bei einer Sarcomere-Länge von ≈2,2 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
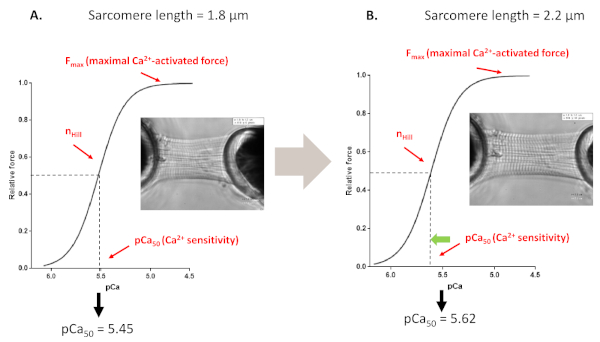
Abbildung 4: Längenabhängiges Aktivierungsprotokoll (imitiert den Frank-Starling-Mechanismus in vitro). Repräsentative Kraftspuren und Parameter, die aus den Ca2+-Empfindlichkeitsprotokollen von Myofilamenten abgeleitet wurden, die vor (A, 1,8 m) und nach dem Dehnen einer Kardiomyozyten bis zu 2,2 m (B) durchgeführt wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
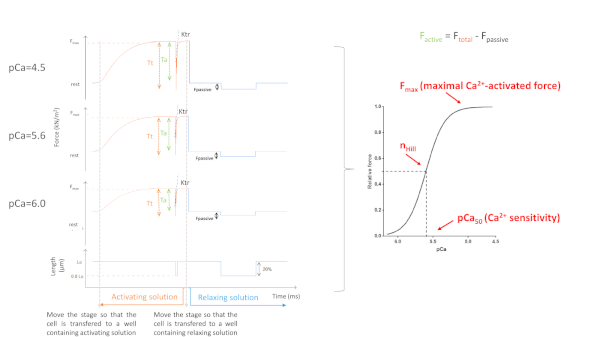
Abbildung 5: Myofilaments Ca2+-Sensitivitätsprotokoll. Repräsentative Kraftspuren und abgeleitete Parameter. Der Einfachheit halber werden nur 3 von 8 Kraftkurven dargestellt. Nämlich eine Kardiomyozyten aktiviert mit der Sättigung, eine zwischengeschaltete und die niedrigste Ca2+-haltige Lösung (4.5, 5,6 und 6.0, bzw.). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Repräsentative Spuren einer Mäuseherzzelle, die bei verschiedenen Calciumlösungen aktiviert wurde, und der jeweiligen ktr-Fit-Kurve. (A) pCa 4.5; (B) pCa 5.0; (C) pCa 5.2; (D) pCa 5.4; (E) pCa 5.6; (F) pCa 6.0 und E Werte für Gesamt-, Passiv- und Aktivspannung, ktr-Wert und Rsquare für ktr fit. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
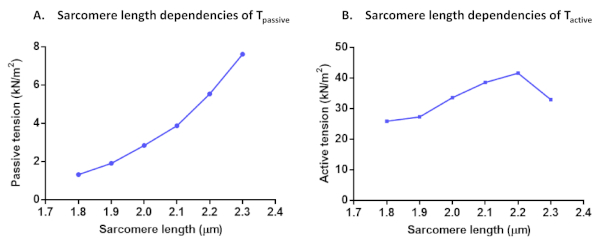
Abbildung 7: Protokolle von Sarcomere-Längenabhängigkeiten von Tpassiv (A) und Taktiv (B). Passive Spannung und aktive Spannung wurden in einer einzigen Kardiomyozyten mit einer Sarkome-Länge von 1,8 bis 2,3 m berechnet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
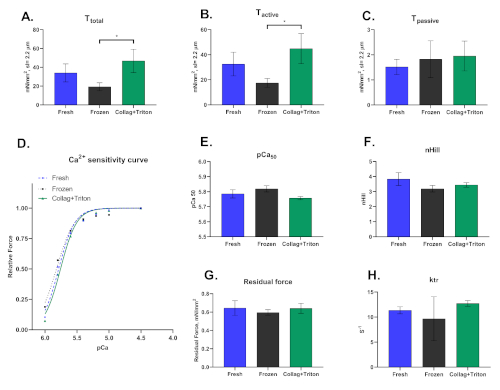
Abbildung 8: Repräsentative Ergebnisse für Kardiomyozyten, die mechanisch aus frischen ("fresh") und gefrorenen Myokardproben ("Frozen") sowie aus kollagennase verdautem Herzen (modifizierte Langgendorf-Technik) mit hinterer Permeabilisation mit Triton ("Collag+Triton") isoliert sind. Werte von (A) Gesamtspannung, (B) Aktive Spannung und (C) Pasisve Spannung aus Kardiomyozyten aktiviert mit pCa 4.5 Lösung bei einer Sarcomere-Länge von ≈2,2 m . (D) Calciumempfindlichkeitskurve und die entsprechenden Werte für (E) pCa50 und (F) nHill. (G) Restkraft- und (H) ktr-Werte, berechnet bei maximaler Aktivierungslösung (pCa 4.5). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Datei. Bitte klicken Sie hier, um diese Datei herunterzuladen.
| Store bei | Aktienlösungen | [M] | Endvolumen (mL) | Gewicht/Volumen | Notizen |
| 4°C | Kaliumhydroxid (KOH) | 1 | 100 | 5.611 g | So passen Sie pH an |
| 4°C | Kaliumhydroxid (KOH) | 5 | 50 | 14,03 g | So passen Sie pH an |
| 4°C | Bes | 1 | 50 | 10,66 g | |
| 4°C | Propionsäure | 1 | 100 | 7.483 ml | PH auf 7,0 mit 5M oder 1M KOH einstellen |
| 4°C | CaEGTA bestehend aus: | 0.1 | 100 | Mischen und erhitzen Sie die Lösung auf 60°C für mehr als 1 Stunde. Stellen Sie den pH-Wert auf 5-6 mit 1M KOH ein. | |
| - CaCO3 | 0.1 | 1.001 g | |||
| - Titriplex (EGTA) | 0.1 | 3.804 |
Tabelle 1: Anleitung zur Herstellung von Lagerlösungen.
| RELAX-ISO (zur Isolierung von Kardiomyozyten) | [mM] | Gewicht |
| Na2ATP | 5.95 | 3,28 g |
| MgCl2.6H2O | 6.04 | 1,23 g |
| Tritiplex (EGTA) | 2 | 0,76 g |
| Kcl | 139.6 | 10,41 g |
| Imidazol | 10 | 0,68 g |
Tabelle 2: Anleitung zur Relax-ISO Lösungsvorbereitung.
| Aktivierungslösung (für die Messungen) | [mM] | Gewicht / Volumen |
| Na2ATP | 5.97 | 0,823 g |
| MgCl 1m | 6.28 | 1,57 ml |
| Propionsäure | 40.64 | 10,16 ml |
| Bes | 100 | 25 ml |
| CaEGTA (Lagerlösung, die zuvor vorbereitet wurde) | 7 | 17,5 ml |
| Na2PCr | 14.5 | 0,925 g |
Tabelle 3: Anweisungen zur Aktivierung der Lösungsvorbereitung.
| Entspannungslösung (für die Messungen) | [mM] | Gewicht / Volumen |
| Na2ATP | 5.89 | 0,325 g |
| MgCl 1m | 6.48 | 0,65 ml |
| Propionsäure | 40.76 | 4,08 ml |
| Bes | 100 | 10 ml |
| Titriplex (EGTA) | 6.97 | 0,265 g |
| Na2PCr | 14.5 | 0,370 g |
Tabelle 4: Anleitung zur Entspannende Lösungsvorbereitung.
| pCa = -Log [Ca2+] | Entspannend (pCa=9.0) Ml | Ativieren (pCa=4.5) Ml |
| 5 | 0.86 | 39.14 |
| 5.1 | 1.2 | 38.80 |
| 5.2 | 1.54 | 38.46 |
| 5.3 | 2 | 38.00 |
| 5.4 | 2.51 | 37.49 |
| 5.5 | 3.14 | 36.86 |
| 5.6 | 3.89 | 36.11 |
| 5.7 | 4.8 | 35.20 |
| 5.8 | 5.89 | 34.11 |
| 5.9 | 7.14 | 32.86 |
| 6 | 8.57 | 31.43 |
Tabelle 5: Anleitung zur Vorbereitung von pCa-Lösungen.
| Parameter | Nagetier | Schwein | Menschlichen |
| Aktivspannung, kN.m-2 (bei 2,2 m) | 17 – 28 | 19 – 40 | 19 – 36 |
| Passive Spannung, kN.m-2 (bei 2,2 m) | 3.6 – 5.5 | 1.9 – 6.8 | 1.8 – 2.3 |
| pCa50 | 5.58 – 5.64 | 5.40 – 5.50 | 5.43 – 5.82 |
| nHill | 2.60 – 2.76 | 2.95 – 3.36 | 2.99 – 3.10 |
| ktr, s-1 | 4.00 – 8.00 | 1.00 – 3.00 | 0.90 – 2.00 |
Tabelle 6: Typische Parameter und Indizes, die aus einzelnen permeabilisierten Kardiomyozyten von Nagetieren, Schweinen und Menschen abgeleitet werden. Angepasst ab12.
| Problem | Möglicher Grund | Lösung |
| Die Cardiomyozyten-Ablösung während der maximalen Aktivierung | Unzureichende Klebezeit; Der Kleber ist alt und hat getrocknet | Erhöhen Sie die Zeit des Klebeschritts; ein neues Leimrohr zu öffnen. |
| Es gibt Triton® in der Zellsuspensionslösung, die nicht mehr entfernt werden kann | Wiederholen Sie den Extraktionsvorgang mit einem oder zwei zusätzlichen Triton® Auswaschschritten | |
| Die Kardiomyozyten hat geringe Kraft unter Kontrollbedingungen | Die Extraktion ging schief und lieferte minderwertige Zellen | Erhöhen Sie die Stichprobengröße und machen Sie eine neue Extraktion. Wenn das Problem weiterhin besteht, ist wahrscheinlich auf eine unsachgemäße Probensammlung zurückzuführen - verwerfen Sie diese Stichprobe |
| Die Zelle ist sichtbar kontrahiert, aber es wird keine Kraft aufgezeichnet; Die Zelle hat ungewöhnliche Kraftwerte | Der Kraftwandler ist ausgeschaltet | Schalten Sie es ein |
| Der Kraftaufnehmer ist nicht gut kalibriert | Kalibrieren Sie den Kraftaufnehmer mit einer Reihe bekannter Gewichte (überprüfen Sie die Bedienungsanleitung des Herstellers). | |
| Die Kraftaufnehmernadel ist lose | Kleben Sie die Nadel wieder mit Kristallbindung 509 oder Juwelierwachs. | |
| Das Striationsmuster ist nicht gut genug, um die Sarcomere-Länge zu bestimmen | Unzureichendes Licht | Erhöhen Sie das Mikroskoplicht oder bewegen Sie die Zelle zurück zum Coverslip und bewerten Sie die Sarcomere-Länge erneut (die Brunnen haben eine geringere Lichtintensität) |
| Die Extraktion ging schief und lieferte minderwertige Zellen | Erhöhen Sie die Stichprobengröße und machen Sie eine neue Extraktion | |
| Nadelspitzen befinden sich nicht im selben Flugzeug | Mit Mikromanipulatoren, passen Sie die Spitzen der Nadeln nach oben oder unten, bis sie eine fokussierte Sarkom | |
| Keine Längen- und/oder Kraftschwankungen während der Erfassung | Der Motor oder der Kraftaufnehmer sind ausgeschaltet | Schalten Sie sie ein |
| Der Motor ist kaputt und erzeugt keine Zellverkürzung | Ersetzen Sie es oder versuchen Sie, es mit einem Funktionsgenerator zu kalibrieren | |
| Zu viel Lärm bei den Erfassungsaufzeichnungen | Zu viel Luftstrom um die Anlage | Schützen Sie das Gerät vor dem direkten Luftstrom |
| Zu viele Vibrationen rund um das Gerät | Ein Stabilisierungstisch ist ratsam. Selbst dann wird empfohlen, alle Geräte zu entfernen, die einen Kompressor haben oder Vibrationen aussenden können (Gefrierschrank, Kühlschränke) | |
| Ca2+-Empfindlichkeitskurve hat seltsame Werte und die Kraftwerte erhöhen sich nicht mit [Ca2+]. | Die Mischung aus aktivierender und entspannender Lösung wurde nicht richtig durchgeführt (prüfe 3.10 bis 3.14 des Methodenabschnitts, möglicherweise aufgrund unzureichender Durchmischung) | Die Fläschchen mit der gleichen Konzentration auftauen, den gesamten Inhalt der Durchstechflasche im selben Becher auftauen, mit einem Rührwerk vermischen und wieder teilen. Testen Sie diese Lösungen erneut in einer neuen Zelle. Wenn dies das Problem löst, bereiten Sie eine neue Charge von Ca2+-haltigen Lösungen vor. |
Tabelle 7: Fehlerbehebungstabelle.
Diskussion
Die In-vitro-Bewertung der Herzfunktion mit gehäuteten Kardiomyozyten stellt eine wichtige Technik dar, um die Aufmachungen auf Kardiomyozytenebene im physiologischen (z. B. Stretch) und pathologischen Kontext (z. B. Ischämie) zu klären. Diese Methode hat mehrere Vorteile, wie z. B. eine minimale Menge myokardum zur Beurteilung der Funktion in Kardiomyozyten, die aus aufgetauten Proben gewonnen werden; mit Kardiomyozyten aus einer Vielzahl von Arten (Mäuse13, Ratte1,14,15, Kaninchen16, Schwein17, Hund18, Meerschweinchen19 und Mensch20) und verschiedenen Herzstellen, einschließlich der Vorhöfe, linke und rechte Ventrikel oder eine bestimmte Region des infarktierten Herzens. Darüber hinaus ermöglicht diese Technik die Bereitstellung spezifischer Konzentrationen von Ca2+ und Energie (ATP) bei gleichzeitiger Messung der Funktion von regulatorischen und kontraktilen Strukturen in ihrer nativen Konfiguration.
Trotz der Einfachheit dieser Technik gibt es einige kritische Schritte. Es ist wichtig, die Qualität jedes Schritts von Anfang an zu gewährleisten, einschließlich der Probensammlung. Myofilamentproteine sind anfällig für Proteasen21. Daher ist es zwingend erforderlich, Proben unmittelbar nach ihrer Entnahme in flüssigem Stickstoff zu lagern. Frische Proben, die vorher nicht eingefroren wurden, entwickeln deutlich höhere Kräfte, so dass es nicht ratsam ist, Messungen in frischen und gefrorenen Proben in demselben Protokoll zu mischen. Der zweitwichtigste Schritt ist die Extraktion der Kardiomyozyten. Während dieses Verfahrens ist es entscheidend, die Probe die meiste Zeit auf Eis zu halten. Ein Protease-Hemmer-Cocktail kann verwendet werden, um das Risiko des Proteinabbaus während der Extraktion/Permeabilisation zu reduzieren22. Drittens sollten Proben in kleinere Stücke mit präzisen Skalpellbewegungen geschnitten werden, da wir reduzierte Qualität Kardiomyozyten festgestellt haben, wenn dieser Schritt ignoriert wurde. Ein weiterer kritischer Schritt ist das Waschen der Kardiomyozyten, da es schwierig ist, die richtige Balance zwischen dem Auswaschen von Triton (permeabiliert die Zelle, aber fördert seine unluing) und halten so viele Zellen im Überstand wie möglich zu haben. Es ist wichtig, zuerst die Extraktion und Anzahl der Auswaschungen für jede Probe, Art oder Protokoll zu versuchen. Zum Beispiel haben wir in unseren Händen festgestellt, dass ZSF1 fettleibige RattengewebeExtraktionen einen "fettigen" Aspekt haben, der diese Zellen während des Klebens rutschiger, aber nicht schwieriger zu messen machte. Die Art und Weise, wie wir dieses Problem umgehen, bestand darin, mehr Experimente durchzuführen, um eine angemessene Anzahl von Zellen pro Tier zu haben. Darüber hinaus ist es wichtig, eine gute Zelle zu kleben, nämlich mit guter Striation und angemessene Länge. Wenn die Kardiomyozyten diese Eigenschaften nicht hat, löst sie sich meist von den Nadelspitzen oder entwickelt keine/niedrige Kraft. Es ist auch wichtig, den richtigen Kleber für Diekardiomyozyten-Anhaftung zu verwenden, unter Berücksichtigung der Zeit des Klebens und seiner Wirksamkeit, um die Zelle an die Nadel zu kleben. In unseren Händen härtet der Silikonkleber (Tisch aus Materialien) schnell (10-15 min) und stark genug aus. Schließlich ist der letzte kritische Schritt mit dem vorsichtigen Heben der Kardiomyozyten 5 min nach dem Kleben der Zelle (um zu vermeiden, die Zelle auf den Deckelzuschlag zu kleben) und vor dem Verschieben in die Brunnen (um zu vermeiden, dass die Zelle durch das Mikroskop-Stadium gezogen werden). Tabelle 7 fasst die mit dieser Technik verbundenen Fehlerbehebungen, die zugrunde liegenden Ursachen und mögliche Lösungen zur Überwindung häufiger Probleme zusammen.
Die Hauptbeschränkung dieser Methode ist, dass sie nicht alle Fragen im Zusammenhang mit der Myofilament-Kontraktilität beantworten kann, wie z. B. wie schnell die Myofilamente aktiviert/deaktiviert werden. In der In-vivo-Einstellung müssen die Membrandepolarisation, die intrazelluläre Ca2+-Erhöhung und ihre Diffusion zu Myofilamenten auftreten, damit sich die Myozyten zusammenziehen, während bei gehäuten Kardiomyozyten die Ca2+-Diffusion zu Myofilamenten sofort auftritt, wenn die Zelle in die Ca2+-Lösung eingetaucht ist. Diese schnellere Rate der Ca2+ Diffusion wird die Aktivierungs-/Deaktivierungsanalyse von Myofilamenten voreingenommen23.
Diese Experimente werden durch verschiedene Faktoren beeinflusst, einschließlich der Temperatur, Lösung pH, mechanische Störung (Slack-Re-Stretch vs. Slack) und Zellanhaftungsverfahren (Pin-Tie vs. Kleber), all diese Variablen, die für LiteraturAbweichungen in Bezug auf ktr und die sarcomere längenabhängige Erhöhung der Kraft4,12verantwortlich sind.
Zukünftige Fortschritte der Technik umfasst die Durchführung von funktionellen Studien in intakten statt permeabilisierten Kardiomyozyten. Diese Technik hat den Nachteil, dass sie sich auf kardiomyozyten, frisch isoliert (nicht zuvor gefroren), verlässt. Ein weiteres wichtiges Thema, das nicht direkt mit dieser Methode zusammenhängt, aber erhebliche Auswirkungen auf sie haben kann, hängt mit der maximalen Periode der Tiefkühllagerung in der Probe zusammen. Insbesondere ist es obligatorisch, den Grad des Myofilamentabbaus während der gesamten Lagerzeit zu bestimmen (d. h. wie lange gefrorene Proben gelagert werden können, um eine qualitativ hochwertige funktionelle Daten aus den extrahierten Kardiomyozyten zu gewährleisten).
Offenlegungen
Die Autoren haben keinen Interessenkonflikt.
Danksagungen
Die Autoren danken der Portugiesischen Stiftung für Wissenschaft und Technologie (FCT), der Europäischen Union, Quadro de Referéncia Estratégico Nacional (QREN), Fundo Europeu de Desenvolvimento Regional (FEDER) und Programa Operacional Factores de Competitividade (COMPETE) für die Finanzierung der Forschungseinheit UnIC (UID/IC/00051/2013). Dieses Projekt wird von FEDER durch COMPETE 2020 - Programa Operacional Competitividade E Internacionalizao (POCI), das Projekt DOCNET (NORTE-01-0145-FEDER-000003), unterstützt vom regionalen operationellen Programm Norte Portugal (NORTE 2020), im Rahmen der Partnerschaftsvereinbarung Portugal 2020, unterstützt. über den Europäischen Fonds für regionale Entwicklung (EFRE), das Projekt NETDIAMOND (POCI-01-0145-FEDER-016385), unterstützt durch die Europäischen Struktur- und Investitionsfonds, Lissabons regionales operationelles Programm 2020. Patrécia Rodrigues wurde von FCT (SFRH/BD/96026/2013) und Joo Almeida-Coelho von Universidade do Porto/FMUP und FSE-Fundo Social Europeu, NORTE 2020-Programa Operacional Regional do Norte, (NORTE-08-5369-FSE-000024-Programas Doutorais).
Materialien
| Name | Company | Catalog Number | Comments |
| Acetone | Sigma | 34580 | |
| Adenosine 5’-triphosphate disodium salt hydrate (Na2ATP) | Sigma | A2383 | |
| Calcium carbonate (CaCO3) | Merck | 1.02067.0500 | |
| Imidazole | VWR | 24720.157 | |
| Magnesium chloride hexahydrate (MgCl2.6H2O) | Merck | 1.05833.0250 | |
| Magnesium chloride solution (MgCl2 1M) | Sigma | M1028 | |
| N,N-Bis(2-hydroxyethyl)taurine (BES) | Sigma | B9879 | |
| Phosphocreatine dissodium salt hydrate (Na2PCr) | Sigma | P7936 | |
| Potassium chloride (KCl) | Merck | 1.04936.1000 | |
| Potassium hydroxide (KOH) | Merck | 8.14353.1000 | |
| Propionic acid (C3H6O2) | Merck | 8.00605.0500 | |
| Silicone Squeeze Tube | Marineland | 31003 | |
| Tritiplex (EGTA) | Merck | 1.08435.0025 | |
| Triton® X-100 10% | Merck | 648463 | |
| Tissue homogeneizer (GKH GT Motor Control) | Terre Haute Glas-col | ||
| Length Controller (Model 315C-I) | Aurora Scientific | ||
| Force Transducer (Model 403 A) | Aurora Scientific | ||
| Software ASI 600A | Aurora Scientific | ||
| Sotware VSL (Model 900B) | Aurora Scientific | ||
| Inverted Microscope (IX51) | Olympus |
Referenzen
- Leite-Moreira, A. M., et al. Stretch-induced compliance: a novel adaptive biological mechanism following acute cardiac load. Cardiovascular Research. 114 (5), 656-667 (2018).
- Falcao-Pires, I., Fontes-Sousa, A. P., Lopes-Conceicao, L., Bras-Silva, C., Leite-Moreira, A. F. Modulation of myocardial stiffness by β-adrenergic stimulation - its role in normal and failing heart. Physiological Research. 60 (4), 599-609 (2011).
- Cokkinos, D. V. . Introduction to Translational Cardiovascular Research. , 371-387 (2015).
- van der Velden, J., Stienen, G. J. M. Cardiac Disorders and Pathophysiology of Sarcomeric Proteins. Physiological Reviews. 99 (1), 381-426 (2019).
- Garnier, D. Attachment procedures for mechanical manipulation of isolated cardiac myocytes: a challenge. Cardiovascular Research. 28 (12), 1758-1764 (1994).
- Brady, A. J. Mechanical properties of isolated cardiac myocytes. Physiological Reviews. 71 (2), 413-428 (1991).
- Falcao-Pires, I., Leite-Moreira, A. F., Cokkinos, D. V. Chapter 20. Introduction to Translational Cardiovascular Research. 20, 371-387 (2015).
- Liang, W. Teaching calcium-induced calcium release in cardiomyocytes using a classic paper by Fabiato. Advances Physiology Education. 32 (1), 1-10 (2008).
- Roche, S. M., Gumucio, J. P., Brooks, S. V., Mendias, C. L., Claflin, D. R. Measurement of Maximum Isometric Force Generated by Permeabilized Skeletal Muscle Fibers. Journal of Visualized Experiments. (100), e52695 (2015).
- Huxley, A. F. Muscle structure and theories of contraction. Progress Biophysics and Biophysical Chemistry. 7, 255-318 (1957).
- Sequeira, V., et al. Synergistic role of ADP and Ca(2+) in diastolic myocardial stiffness. Journal Physiology. 593 (17), 3899-3916 (2015).
- Edes, I. F., et al. Rate of tension redevelopment is not modulated by sarcomere length in permeabilized human, murine, and porcine cardiomyocytes. American Journal Physiology Regulatory Integrative Comparative Physiology. 293 (1), R20-R29 (2007).
- King, N. M., et al. Mouse intact cardiac myocyte mechanics: cross-bridge and titin-based stress in unactivated cells. Journal General Physiology. 137 (1), 81-91 (2011).
- Hamdani, N., et al. Myocardial titin hypophosphorylation importantly contributes to heart failure with preserved ejection fraction in a rat metabolic risk model. Circulation Heart Failure. 6 (6), 1239-1249 (2013).
- Miranda-Silva, D., et al. Characterization of biventricular alterations in myocardial (reverse) remodelling in aortic banding-induced chronic pressure overload. Scientific Reports. 9 (1), 2956 (2019).
- Rodrigues, P. G., et al. Early myocardial changes induced by doxorubicin in the nonfailing dilated ventricle. American Journal Physiology Heart Circulatory Physiology. 316 (3), H459-H475 (2019).
- van der Velden, J., et al. Alterations in myofilament function contribute to left ventricular dysfunction in pigs early after myocardial infarction. Circulation Research. 95 (11), e85-e95 (2004).
- Wakili, R., et al. Multiple potential molecular contributors to atrial hypocontractility caused by atrial tachycardia remodeling in dogs. Circulation: Arrhythmia Electrophysiology. 3 (5), 530-541 (2010).
- Ait Mou, Y., le Guennec, J. Y., Mosca, E., de Tombe, P. P., Cazorla, O. Differential contribution of cardiac sarcomeric proteins in the myofibrillar force response to stretch. Pflugers Archiv. 457 (1), 25-36 (2008).
- Falcao-Pires, I., et al. Diabetes mellitus worsens diastolic left ventricular dysfunction in aortic stenosis through altered myocardial structure and cardiomyocyte stiffness. Circulation. 124 (10), 1151-1159 (2011).
- Lim, C. C., et al. Anthracyclines induce calpain-dependent titin proteolysis and necrosis in cardiomyocytes. Journal Biology Chemistry. 279 (9), 8290-8299 (2004).
- Woulfe, K. C., et al. A Novel Method of Isolating Myofibrils From Primary Cardiomyocyte Culture Suitable for Myofibril Mechanical Study. Frontiers Cardiovascular Medicine. 6, 12 (2019).
- Ait Mou, Y., Bollensdorff, C., Cazorla, O., Magdi, Y., de Tombe, P. P. Exploring cardiac biophysical properties. Global Cardiology Science Practice. 2015, 10 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten