Method Article
피부 심근세포를 이용한 심장 기능의 체외 평가
* 이 저자들은 동등하게 기여했습니다
요약
이 프로토콜은 피부 심장 근구를 사용하여 심장 기능의 추출 및 평가 기술을 단계별로 설명하는 것을 목표로합니다. 이 방법론은 마우스에서 남성에 이르기까지 다른 심장 위치에서 수집 할 수있는 작은 냉동 생검을 사용하여 myofilament 기능의 측정 및 급성 변조를 허용합니다.
초록
이 기사에서는 단일 과구("skinned") 심근세포를 분리하고 기능적 연구를 수행하기 위해 힘 측정 장치 및 모터에 부착하는 데 필요한 단계를 설명합니다. 이러한 연구는 심근세포 강성(수동력)과 다른 칼슘(Ca2+)함유 솔루션으로 활성화하여 최대 력 개발, 근안타멘트 Ca2+-감도(pCa50),쿠퍼티움(nHill) 및 힘 재개발 속도(ktr)를 측정할 수 있습니다. 이 방법은 또한 근막에 직접 작용하는 약물의 효과와 심근세포의 활성 및 수동 적 특성모두에 외인성 재조합 단백질의 발현을 가능하게합니다. 임상적으로, 피부 심근 세포 연구는 많은 심근 질환의 병리생리학을 강조하고 myofilaments를 대상으로 치료 개입의 영향의 체외 평가를 허용. 전부, 이 기술은 열린 심혼 또는 이식 수술 도중 얻은 동물 모형 및 인간 조직에서 시험관 내 및 생체 내 파라미터 사이 상관관계를 조사하여 심장 병리생리학의 설명을 가능하게 합니다.
서문
전통적으로 심근 기계적 특성에 대한 평가는 주로 유두 근육 및 trabeculae1,2와같은 다세포제제에서시도되었습니다. 다세포 심장 근육 스트립은 방향 및 힘 생성의 알 수없는 패턴을 가진 수축 심근 세포를 포함하는 세포의 이질적인 인구, 전기 활동 및 스트레스 / 변형 분포뿐만 아니라 주변 결합 조직 매트릭스3,4을포함한다. 콜라겐없이 준비하고 단일 심근 세포를 포함하는 것은 매우 정확하고 제어 된 방식으로 sarcomere 길이와 크로스 브리지 수축 특성의 측정을 허용할것이다5,6. 따라서, 지난 4년 동안, 단일 심근세포6,7의기계적, 수축 및 이완 특성을 조사할 수 있도록 여러 가지 방법론이 개발되었다. 이들 세포의 수축 기능은 사코메 길이 및 크로스 브리지 사이클링 운동학3에크게 의존한다. 따라서, 단 하나 고립 된 심장 세포에서 근육 기능을 직접 조사하는 것이 바람직하다, 그것은 사메레 길이 및 성능뿐만 아니라 크로스 브리지 기능 및 수축 특성을 평가 할 수 있다는 점을 고려. 그러나, μN 수준에서 힘 측정을 기록하는 동안 합리적인 광학 sarcomere 해상도로 기능성 심근세포를 분리하고 부착하는 것은 여전히 도전적이고진화3,6이다. 다른 과제는 갓 수거된 생검에서 심근세포를 분리하기 위해 설치해야 하는 물류입니다. 인간 생검 수집의 예측 불가능성은, 예를 들면, 실험의 타당성을 위태롭게 할 수 있습니다.
더욱이, 과학적 절차에 대한 동물 실험의 교체, 감소 및 정제에 관한 윤리적 관심사 (3R의 원칙)는 세포 및 조직 수준, 바람직하게는 인간의 생검 또는 작은 동물 샘플에서 연구 변화를 촉진했다. 실제로 복잡성의 작은 수준에서 시험관 내 심장 기능을 평가하는 방법론의 점진적 개선은 전신에 결과의 적절한 통합을 허용하고 임상 시나리오7로변환할 수 있습니다. 전부, 심근구를 추출하기 위해 -80°C에 저장된 샘플을 사용하는 것이 매력적인 대안일 수 있다.
심근 조직은 작은 조각으로 절단하고 박격포와 봉제와 균질화된다. 이러한 균질화의 결과는 다양한 정도의 사콜렘말 손상을 가진 피부 뭉닝 및 분리된 세포의 현탁액으로, 이 때 근근증이 입욕 매체에 노출되고 모든 세포 성분이 씻겨나난다. 사콜마에서 멀리 떨어져 있는 근시릴과 같은 구조물은 보존되어 있습니다. 따라서, 근시릴라 장치와 관련된 사컴레 단축 및 기능성 특성은 그대로 유지되며8,9를기록할 수 있다.
심근세포 력 측정 시스템은 심근세포 길이를 조정하는 데 사용되는 전자기 모터와 동급성 심근세포 수축을 측정하는 힘 트랜스듀서로 구성됩니다. 투과, 또는 피부, 심근세포는 편안한 용액 ([Ca2+] < 10 nM)을 포함하는 실험 챔버에 배치되고 실리콘 접착2 얇은 바늘 : 하나는 모터에 부착되고 다른 하나는 힘 트랜스듀서에 부착됩니다. 광학 시스템은 심근세포 형태와 사코프레 길이를 결정하는 데 사용됩니다. 실험 프로토콜은 종종 상이한 Ca2+ 농도를 포함하는 완충액의 일련의 힘 기록, 액틴-미오신 크로스 브리지 운동제의 결정 및 미리 정의된 sarcomere 길이에서 장착된 심근세포의 수동 장력측정(그림 1)으로구성된다. 액체 질소에서 동결된 심근 샘플로부터 의 분리(그리고 이후 -80°C에 저장됨)는 단단 면적당 최대 Ca2+활성화(활성) 힘을 측정하기 위한 세포 역학 및 단백질 생화학을 활용하는 기술입니다(T 활성, kN∙m-2), Ca 2+ 독립(T 활성, kN+m-2), Ca 2+-독립(T 활성, kN+m-2), Ca 2+ 독립(T 활성, kN+m-2), Ca 2+ 독립(T활성,kN+m-2), Ca2+독립(패시브) 장력(T패시브,kN+m-2), 근안회카2+민감도(pCa50),근안회(nHill), 힘 재개발(ktr) 및 T활성,T패시브,pCa50,nHill 및 ktr의 사코머 길이 종속성.
이 프로토콜의 목표는 다른 종에서 냉동 된 샘플에서 분리 된 단일 피부 심근 세포의 기능적 기계적 특성을 평가하는 신뢰할 수있는 절차로 심근 세포 력 측정 시스템의 잠재력을 설명하고 요약하는 것입니다.
프로토콜
모든 동물 실험은 실험실 동물의 관리 및 사용에 대한 가이드 (NIH 출판 번호 85-23, 개정 2011) 및 동물 복지에 대한 포르투갈법 (DL 129/92, DL 197/96)을 준수합니다. P 1131/97). 유능한 지방 당국은이 실험 프로토콜 (018833)을 승인했습니다.
1. 주식 솔루션 준비(표 1)
- 표 2의지시에 따라 심근세포 분리(RELAX-ISO)를 위한 1,000mL의 이완 솔루션을 준비한다. 위의 시약을 ≈500mL로 용해하고 KOH를 사용하여 pH를 7.0으로 조정합니다. 최종 볼륨을 1000mL로 조정합니다.
- 50mL 튜브에 RELAX-ISO를 배포합니다. -20 °C에 보관하십시오.
- 표 3의지침에 따라 250mL의 활성화 솔루션을 준비한다. 위의 시약을 초순수 ≈100mL로 용해하십시오. 15°C에서 5M KOH로 pH를 7.1로 조정합니다.
참고 : 일반적으로 원하는 pH에 도달하기 위해 상당한 양의 KOH를 추가해야합니다. 15°C로 용액을 식히기 위해 얼음이 있는 상자에 체피 풍선을 넣습니다.- 최종 볼륨을 250mL로 조정합니다. 이 용액을 마그네틱 교반기와 함께 지속적으로 교반하여 편안한 용액과 혼합하는 순간까지 이 솔루션을 지속적으로 교반합니다.
- 표 4의지침에 따라 100mL의 편안한 솔루션을 준비한다. 위의 시약을 ≈50mL의 초순수수로 녹입니다. 15°C에서 KOH 5M로 pH를 7.1로 조정합니다.
참고: 일반적으로 7.1의 pH에 도달하기 위해 상당한 양의 KOH를 추가해야합니다. 체적 풍선을 얼음으로 가득 찬 상자에 놓아 용액을 15 °C로 식힙니다. 측정 중에 사용되는 솔루션의 이온 강도는 180mM에 달했습니다.- 최종 볼륨을 100mL로 조정합니다. 활성 액액과 혼합하는 순간까지 자기 교반기와 함께 이 솔루션을 지속적으로 교반합니다.
- 5표에 제시된 비율로 활성화 및 이완 솔루션을 혼합하여 5.0에서 6.0 사이의 pCa 솔루션을 얻습니다.
- 항상 긴장을 풀고 두 가지를 혼합하면서 교반 솔루션을 활성화하십시오.
- 알리쿼트 각 혼합물을 2mL 마이크로튜브에 대고 한다. 모든 마이크로튜브를 -20°C에 저장합니다.
- 각 프로토콜에 대해 다른 pCa 솔루션 배치(4.5 ~ 6.0)를 준비합니다.
2. 힘 변환기의 교정
참고: 힘 변환기의 교정은 몇 달마다 또는 교정되지 않은 것으로 의심되는 경우 수행해야 하는 일상적인 절차입니다. 힘 트랜스듀서는 매우 민감하며 쉽게 파손됩니다. 그것은 부드럽게 그것의 사용의 모든 단계에서 처리 해야 합니다., 교정 을 포함 하 여, 심 근 세포의 접착제 및 청소.
- 장치의 나머지 부분에서 힘 변환기를 분리합니다.
- 클램프의 도움으로, 바늘이 심근세포가 힘을 개발할 것과 같은 방향으로 아래쪽으로 가리키는 방식으로 힘 변환기를 수평으로 놓습니다. 이렇게 하면 알려진 가중치(탄성 밴드, 봉합사 또는 핀)가 있는 일련의 질량을 매달아 쉽게 할 수 있습니다.
참고: 이 단계로 진행하기 전에 힘 변환기의 특성을 확인하여 스케일 팩터[mg/volt]를 확인하고 트랜스듀서에 과도한 무게를 피하십시오. 힘 트랜스듀서 모델의 경우, 스케일 인자는 50(50 mg은 1볼트에 해당) 12.5에서 250 mg 사이의 5개의 가중치를 사용합니다. - 포스 트랜스듀서를 켜고 30분 동안 따뜻하게 해보세요.
- 먼저 포스 트랜스듀서에 가벼운 질량을 걸고 FORCE OUT에서 측정된 해당 전압을 등록합니다.
- 최대 5개의 가중치에 대해 이 절차를 반복합니다.
- 힘 변환기(load)와 전압에 적용된 플롯 력과 선형성을 확인합니다.
- 선형성이 없는 경우 변환기의 회로 기판에서 0을 조정하고 전위요계를 얻습니다. 자세한 내용은 해당 특정 지침을 확인합니다.
- 출력 전압이 0.0 V를 읽을 때까지 0 potentiometer를 켭니다.
- 트랜스듀서 바늘에 중간 중량을 손과 상기 게인 전위오차계를 조절하여 해당 전압을 읽습니다(예를 들어, 50 mg은 1V에 해당). 무게를 제거하고 0.0으로 0 potentiometer를 다시 조정합니다.
- 무게가 있는 출력이 정확할 때까지 2.6.2단계를 반복합니다.
- 힘 변환기를 장치에 다시 장착합니다.
3. 실험 장치 설정
- 각 활성화, 4.5, 5.0, 5.2, 5.4, 5.6, 5.8, 6.0 및 편안한 솔루션의 하나의 유리병을 해동하고 얼음에 유지합니다.
참고: ATP와 PCr은 추운 온도에서 유지되어야 하는 음순 화합물입니다. - 현미경, 테스트 장치 및 관련 컴퓨터를 준비하여 사용할 수있습니다(그림 1).
- 실내 온도계가 15°C를 읽게 되도록 온도를 조정합니다. 키나아제 및 인산염 인큐베이션(20°C)을 제외한 모든 실험을 이 온도에서 수행한다.
- 힘 변환기와 모터를 켭니다.
4. 피부 심근세포의 추출 및 투과성
- 릴렉스-ISO 솔루션의 해동 50mL.
- 원심분리기를 켜고 최대 4°C까지 빠르게 식힙니다.
- RELAX-ISO 용액 2.5mL를 함유한 페트리 접시에 심근 샘플의 3-5 μg를 해동하십시오.
- 메스 블레이드로 작은 조각으로 조직을 잘라(그림 2). 불필요한 세포 손상을 방지하기 위해 정확한 방법으로 샘플을 잘라.
- 2.5mL의 RELAX-ISO 용액을 티슈로 포터-엘베젬 유리로 옮기는 컷 파이펫 팁을 사용한다.
- 30-40 rpm의 회전 속도로 분쇄기로 조직을 기계적으로 방해합니다. 좋은 세포 현탁액을 얻기 위해 각각 2 s에 대한 조직을 3 회 누릅니다.
- 15mL 튜브에 RELAX-ISO 용액(릴렉스-ISO 2.25mL의 트리톤의 250 μL)에서 10% 트리톤을 준비하고 이 솔루션을 셀 서스펜션에 추가합니다.
- 튜브를 3번 반전시켜 부드럽게 섞습니다.
- 실온에서 1분 4분 동안 얼음을 배양합니다.
- 15mL 튜브의 상단에 RELAX-ISO를 추가하여 트리톤을 씻어; 부드럽게 혼합 (튜브의 3 배를 반전) 마지막으로 각진 원심 분리기 (348 x g에서1 분)에서 세포를 회전. 셀 펠릿 위의 상체를 최대 3mL까지 제거합니다.
참고: 셀 펠릿을 방해하지 않도록 상체를 부드럽게 제거합니다. 여전히, 상체에 있는 몇몇 세포는 필연적으로 분실될 것입니다. - 4.10 단계를 4회 이상 반복하거나 트리톤 잔류물이 생성한 더 이상 거품이 관찰되지 않습니다.
참고: 세척 단계가 많을수록 폐기된 상체로 셀이 더 많이 손실됩니다. - 마지막 세척에서, 셀 서스펜션의 5-10 mL의 부피까지 상체를 제거합니다.
5. 피부심근세포를 선택하고 접착
- 현미경 슬라이드홀더(도 1)에유리 슬라이드 위에 커버슬립에 셀 서스펜션 드롭을 놓습니다.
- 좋은 줄무늬와 크기(그림 2)와단일 막대 모양의 심근구를 선택합니다.
- 반전된 현미경의 가장 낮은 배율을 사용하여 포스 트랜스듀서와 모터의 바늘 끝을 찾아보십시오.
- 커버슬립을 회전하여 선택된 심근세포가 수평으로 배치되어 끝이 힘 트랜스듀서및모터(도 2)의바늘과 정렬되도록 한다.
- 면봉팁(그림 2)의도움으로 커버슬립 측면에 얇은 접착제 라인을 놓습니다.
- 힘 트랜스듀서와 모터의 바늘 끝을 접착제 라인에 담그고 두 팁 주위에 접착제 후광을 만듭니다.
참고: 단계 5.6 - 5.10은 전동 마이크로 포치셔를 신중하게 사용하여 수행됩니다. - 바늘 끝을 심근세포의 초점 평면에 가깝게 빠르게 이동합니다.
- 힘 트랜스듀서의 바늘 끝을 아래로 이동하여 심근세포의 한 가장자리에 붙입니다.
- 모터의 끝과 셀의 다른 단각으로이 절차를 반복합니다.
참고: 접착제가 매우 빠르게 치료하기 시작하면 이 절차는 2-3분 미만이어야 합니다. - 5-8 분 후, 바늘을 들어 ≈15 μm을 들어 올려 덮개 슬립에 셀을 붙이지 않도록하십시오. 이 작업은 두 미세 조작기를 동시에 이동하여 수행됩니다.
- 접착제를 치료하자. 이 절차는 접착제의 종류에 따라 15 분에서 45 분까지 지속될 수 있습니다. 우리의 경우, 심근 세포는 ≈ 15 분 후에 적절하게 접착됩니다.
6. 활성, 수동 및 Ca2+ 감도의 기록 힘 측정
- 이완 용액(실험 용장치에서 55-100 μL)과 제2 실험용액을 잘 채우는 제1 실험용액을 잘 채운다.
- 카메라 소프트웨어를 사용하여, 사루의 명확한 패턴으로 심근 세포의 영역에 관심 영역 (ROI)을 배치합니다.
참고: 심장 심근세포의 경우 작동 sarcomere 길이는 1.8과 2.2 μm 사이이며 최적의 사코프레 길이는 약 2.15 μm입니다. - 최적의 사코메 길이가 설정된 후 심근세포(모터에서 트랜스듀서 접착제 후광, 도 3)의두 극한 사이의 거리를 측정한다(2.2 μm). 값을 소프트웨어에서 근세포 길이로 기록합니다.
- 세포에 수직으로 배치 된 프리즘 거울의 도움으로 심근 세포 폭과 깊이를 측정합니다.
참고: 프리즘을 통해 셀을 시각화하려면 강력한 외부 광원이 필요합니다. 프리즘이 없고 심장 세포가 타원형 모양을 가지고 있다고 가정하면 심근세포 깊이는 심근세포 폭의 70 %로 유추 될 수 있습니다. - 심근세포의 타원형 형상을 가정하면 단면 영역(CSA, mm2)을계산합니다.

- 현미경 스테이지를 부드럽게 이동하여 세포가 커버슬립에서 무대 뒤쪽에 있는 이완용액을 함유하는 우물로 이동하도록 합니다.
참고: 이 절차는 셀을 쉽게 손상시킬 수 있습니다. 세포를 움직이기 전에 바늘을 조금 더 부드럽게 움직입니다. 용액에서 셀을 제거하지 마십시오. - 셀이 Ca2+ 솔루션및 이완 솔루션에서 발생할 때 발생하는 두 개의 셀 단축(초기 길이의 80%)이 포함된 소프트웨어에서 프로토콜을 선택합니다(그림1,보충 파일).
참고: 셀의 첫 번째 "슬랙"은 활성화 용액 과 편안한 솔루션 내에서 두 번째 "슬랙"내에서 수행됩니다. 이를 통해, 사용자는2nd로부터세포의1st 및패시브포스(F 수동)로부터 셀의 총력(Ftotal)을계산할 수 있을 것이다. 수식을 사용하여 활성 력, F활성 = F합계 - F패시브를 계산합니다. 모든 크로스 브리지 레코드 힘을 분리하기 위해 셀이 80% 단축됩니다. - 심근세포가 이완에서 활성화 용액(pCa=4.5(1)으로 이동하도록 현미경 단계를 이동시킴으로써 등자극성 수축을 유도한다.
참고: 셀이 작동하는 경우 즉시 수축됩니다. - 힘 고원에 도달하면 힘 데이터를 기록하기 시작합니다.
참고: 테스트를 개별적으로 수행할 수 있습니다. 소프트웨어에 따라 Ca2+ -감도 프로토콜 내에서 다른 Ca2+솔루션에 해당하는 일련의 테스트 시퀀스를 만들 수 있습니다(그림1,보충 파일). - ~10s를 기다린 다음 활성화 용액에 침지된 셀을 전환합니다.
참고: 편안한 솔루션에 셀을 몰입하기 전에 10초를 기다려야 합니다. 셀이 너무 일찍 이동하면 셀(ktr 값)의 재개발 력을 계산하는 중요한 데이터가 손실될 수 있습니다. - 심근세포가 편안한 용액에 몰입할 수 있도록 신속하게 스테이지를 이동합니다.
- 테스트가 중지될 때까지 기다립니다.
- 반복 단계 6.8 - 6.12세포가 활성화 용액(pCa=4.5(2)에서 두 번 활성화되도록 한다.
참고: 일반적으로 첫 번째 활성화 후 심근세포 끝은 바늘 끝에서 약간 분리되어 심근세포 길이, CSA 및/또는 사코프레 길이를 변경할 수 있습니다. 원하는 sarcomere 길이로 재조정하고 소프트웨어에서 수정된 치수를 소개합니다.- Ca2+ 감도 프로토콜에 대해 6.13.2 단계를 계속하거나 데이터를 저장, 셀의 수동 및 활성 힘의 값이 필요한 유일한 매개 변수인 경우 바늘에서 세포를 분리하고 접착제를 제거하기 위해 아세톤으로 청소.
- 필요한 경우 셀의 사코리 길이를 2.2 μm로 조정하여 다시 약간 스트레칭합니다.
- 활성화 용액을 다음 Ca2+ 솔루션(55-100 μL)으로 바꿉니다. 6.8 - 6.12 단계를 반복합니다.
- 활성화 용액을 다음 Ca2+ 솔루션(55-100 μL)으로 교체하고 모든 솔루션이 테스트될 때까지 6.8 - 6.12 단계를 반복합니다(5.0, 5.2, 5.4, 5.6, 5.8, 6.0).
- 마지막으로 활성화 용액(pCa4.5(3)을 통해 셀을 다시 활성화합니다. 6.8- 6.12 단계를 반복합니다.
7. 키나아제와 인산염을 가진 배양
- 선택한 기준 프로토콜을 수행한 후, 권장 농도에서 편안한 용액에서 키나아제/인산염을 희석시.
참고: 실험 전에 용량 반응 곡선을 수행하는 것이 좋습니다. - 실험 우물의 온도를 20°C로 설정합니다.
- 키나아제/인산염, 릴렉스 솔루션 및 활성화 용액(55-100 μL)으로 실험용 우물을 채웁니다.
- 현미경 단계를 부드럽게 이동하여 세포가 키나아제/인산염을 함유하는 우물에 침지되도록 합니다.
- 키나아제/포스파아아제와 심근세포에 적어도 30분 동안 또는 제조업체의 지시에 따라 배양합니다.
- 선택한 기준 프로토콜을 반복합니다.
8. 실험 마무리
- 세포를 스트레칭하여 힘 트랜스듀서와 모터의 끝에서 심근세포를 풀십시오.
- 아세톤에 담근 면봉을 사용하여 바늘 끝에서 접착제 후광을 조심스럽게 제거합니다.
- 장비를 종료합니다.
9. 데이터 분석
- 테스트된 각 심근세포에서 모든 파일을 수집합니다.
참고: 각 테스트는 하나의 파일에 해당합니다. 즉, 각 Ca2+ 솔루션 또는 사코레 길이에 대해 해당 파일이 있습니다. - 단일 심근세포의 활성 및 수동 력을 계산합니다.
- 스프레드시트(그림3A, 부록 A를 보충 파일)를사용하여첫 번째 활성화(pCa=4.5(1)에 해당하는 파일을 엽니다.
참고: 분석을 수행하기 위해 맞춤 제작 프로그램을 사용했습니다. 추가 파일에 부록 A를 참조하십시오. - 셀의 1st 슬랙(셀이 Ca2+ 용액에 침지될 때) 전과 평균 ≈60값의 평균 ≈60값). 이 2값은 각각 a 및 b에 해당합니다.
- 셀의2nd 여유(셀이 이완용에 침지될 때)에 대해 동일한 분석을 반복합니다. 이 2값은 각각 c및 d에 해당합니다.
- a와 b(총력, F 합계)의 차이를계산합니다.
- c와 d(수동 력, F패시브)의 차이를 계산합니다.
- 활성 력, F활성 = F합계 - F패시브를 계산합니다.
- 모든 힘 값을 CSA로 정규화하여 총 장력(Ttotal),수동 장력(T수동)및 활성 장력(T활성)을얻습니다.
- 2nd 활성화를 위한 9.2.1 ~ 9.2.5(pCa=4.5(2)를 반복합니다.
- 이러한 값을 분석 중인 심근세포의 T합계,T활성 및 T패시브를 나타내는 값으로 간주하십시오.
참고: pCa4.5(1)를 가진 세포의 첫번째 활성화는 일반적으로 셀 치수에 있는 변경과 연관됩니다. 이러한 이유로 pCa4.5를 사용한 2차 활성화가 더 정확하며 사용할 수 있습니다. - 각 파일/pCa 테스트 솔루션(5.0, 5.2, 5.4, 5.6, 5.8, 6.0, 4.5(3)에 대해 9.2.1 ~ 9.2.5단계를 반복합니다.
- 스프레드시트(그림3A, 부록 A를 보충 파일)를사용하여첫 번째 활성화(pCa=4.5(1)에 해당하는 파일을 엽니다.
- 단일 심근세포의 pCa50 및 nHill을 계산합니다.
참고: 이 해석의 경우 파일 4.5(2), 5.0, 5.2, 5.4, 5.6, 5.8, 6.0 및 4.5(3)에서 정규화되지 않은 F활성 값을 사용합니다.- 스프레드시트 파일에 배치하여 테스트한 각 Ca2+ 솔루션에 대해F 활성의 모든 비정규화 값을 배치합니다(4.5(2),5.0, 5.2, 5.4, 5.6, 5.8, 6.0, 4.5(3)).
- 보정 계수 = F활성 [4.5(2)] - F활성 [4.5(3)] / 7을 계산합니다.
- F활성 - 보정 계수를 빼서 각 Ca2+ 솔루션(5.0, 5.2, 5.4, 5.6, 5.8, 6.0)에 대해F 활성의 수정된 값을 계산합니다.
- 각C 활성 값을 해당 수정값으로 정규화하여 각 Ca2+ 솔루션에 대한 상대력(F상대성)을계산합니다.
참고: F상대 [4.5(3)]는 1과 같아야 합니다. 각 실험 프로토콜은 Ca2+ 농도(pCa 4.5(2) 및 4.5(3)를 포화시 제어 활성화로 시작하고 종료합니다. 이를 통해 최대 Ca2+활성화 력(Fmax)의변경 사항을 비교하여 준비 의 런다운을 강제로 정규화하고 평가할 수 있습니다. 실험 프로토콜의 끝에서 심근세포는 첫 번째 수축의 최대 힘의 70% 미만을 생성하며, 그 세포/측정은 분석에서 제외되어야 한다. - F상대체 및 해당 pCa 값을 사용하여 다음 방정식 F(Ca)= CanHill/(Ca50nHill + Ca nHill)을 사용하여 시그노이드 곡선에맞습니다.
- 위에서 언급한 방정식에서 pCa 및 nHill 값을 추정합니다.
- 단일 심근세포의 힘 재개발(ktr)의 비율을 계산합니다.
- 1st 셀 여유 직후값에 해당하는 곡선에 맞게 수행합니다.
- 곡선의 경사를 계산하면 이 값은 강제 재개발 속도에 해당합니다.
- 각 Ca2+ 솔루션에 대해 9.4.1 및 9.4.2 단계를 반복합니다.
참고: 가장 낮은 Ca-솔루션(R 제곱≤0.90)에 대해 곡선 적합성이 떨어집니다.
결과
기능성 투과성 심근세포는 전체 실험 전반에 걸쳐 균일하고 일관된 결과물 패턴을 가져야 합니다. 장기간 실험 후 어느 정도의 열화와 힘 감소가 예상되지만, 활성 장력의 가치는 상대적으로 안정되어야 한다. 현물 손실 또는 상당한 힘 감소의 명확한 징후를 보여주는 세포 (< 15 kN∙m-2 또는 초기 활성 력의 80%)는 제외되어야 합니다. 표 6은 설치류, 돼지 및 인간 샘플에서 파생된 가장 중요한 매개 변수에 대해 예상되는 일반 값을 표시합니다.
얻은 매개 변수는 주로 선택한 프로토콜에 따라 달라집니다. 그림 5는 8점 만점에 3의 대표적인 힘 흔적을 보여 주며, 근필라멘트 Ca2+-감도의 프로토콜을 수행하는 데 필요한 힘 기록. 활성 용액을 함유하는 우물으로 세포를 이송함으로써 심근세포는 고원에 도달할 때까지 힘을 개발하기 시작합니다. 빠른 여유 테스트 (1 ms의 지속 시간)를 통해 심근세포가 길이의 80 %로 단축되면 제로 힘의 기준값을 얻습니다. 슬랙 테스트 후, 세포는 활성화 용액에 몰입할 때 계속해서 힘을 개발하고 있습니다. 총 힘(Ftotal)은고원 값을 최소 값에서 빼서 계산합니다. 이 곡선의 마지막 부분의 경사는 우리에게 크로스 브리지 부착 및 분리 (f응용 프로그램 및 gaap)10의명백한 속도의 척도인 힘 재개발 (ktr)(도6)의값값을 제공합니다. ktr R2 값이 & 0.90이면 ktr 값을 배제해야 하며 일반적으로 이는 낮은 Ca2+ 농도(pCa 5.6, 5.8 및 6.0)에서 발생합니다. 편안한 용액을 포함하는 우물로 세포를 다시 옮김한 후 셀이 이완되고 힘이 떨어집니다. 패시브 힘(F수동)은최소한의 값(장시간 세포 단축 후 얻어진)을 이 새로운 힘의 값으로 빼서 계산한다. 액티브 포스는 F토탈과 F패시브의차이로부터 발생합니다.
심근세포를 특징짓는 최대 활성 및 수동 력은 포화 Ca2+-솔루션(pCa = 4.5)을 가진 제2 세포 활성화에서 유래된 힘이다. 첫 번째 활성화는 일반적으로 sarcomere 길이를 재조정해야 하므로 폐기됩니다.
근필라멘트 Ca2+-감도 프로토콜을 수행하려면 최소 9개의 활성화 테스트(4.5; 4.5; 5.2; 5.6; 6.0; 5.0; 5.4; 5.4; 5.8 및 4.5)를 수행해야 합니다. 이 시퀀스는 예시일 뿐이지만 항상 4.5(두 번)로 시작하여 4.5로 끝나야 합니다. myofilament Ca2+-감도 프로토콜에 대한 데이터 수집 소프트웨어프로그래밍은 보충 파일의 그림 1에 묘사됩니다.
이러한 모든 활성화 솔루션에 대한 활성 력을 계산한 후 마지막 활성화가 초기 최대 력의 80% 이상을 산출했는지 확인합니다(그렇지 않으면 위에서 언급한 대로 이 셀 결과를 폐기해야 합니다). 실험 계열 중 Fmax의 감소를 보정하기 위해 보간 Fmax 값을 사용하여 데이터 점을 정규화할 수 있습니다. 정규화된 데이터는 다음 방정식 F(Ca) = CanHill/(Ca50nHill + CanHill)을사용하여 시그오이질 곡선에 적합할 수 있습니다. 얻어진 파라미터 값은 칼슘 민감도(ca50,pCa50로 변환될 수 있음) 및 응고성(nHill)을 나타낸다. 모든 힘 값은 단면 영역으로 정규화한 후 장력 값으로 변환할 수 있습니다. 근안 회 Ca2+-감도 및 길이 종속 활성화 프로토콜 외에 다른 테스트를 수행할 수 있습니다. 이러한 T활성,T패시브 (도 7)및 심근 세포 잔류력의 사코메 길이 종속성의 경우입니다. 잔류력 기록은 셀의 길이 변경 후 도달한 초기 힘 회수(pCa 4.5)로부터 계산됩니다(80%) 길이변경(11)전에 도달한 각 정상 상태 힘에 정규화. 잔류력의 증가는 일반적으로 느린 분리 운동과 더 높은 강성을 가진 교차 교량을 나타낸다.
마지막으로, 우리는 이 기술이 냉동 또는 갓 수집된 샘플에서 기계적으로 추출된 피부 심근세포에서 수행될 수 있을 뿐만 아니라 효소로 분리된 멤브레인의 투과화에서 수행될 수 있음을 강조해야 합니다. 심근세포가 분리되는 방식은 이 기술에서 파생된 결과에 크게 영향을 미칩니다. 도 8은 세 가지 격리 절차 중 관찰된 차이를 나타낸다.

그림 1: 테스트 장치의 통합 구성표입니다. 시험 장치는 현미경, 현미경 및 관련 컴퓨터를 포함한다. 그림의 바닥은 모터와 힘 트랜스듀서 사이에 접착된 피부 심근세포가 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 세포 절연, 투과화 및 접착 프로토콜의 흐름 차트입니다. 왼쪽 상단 모서리 이미지는 페트리 접시에서 RELAX-ISO용액(A)에서심장 샘플의 조각을 보여주는 4개의 이미지로 구성되며,(B)조직의 기계적 균질화에 사용되는 튜브에서,(C)균질화 후 조직,(D)조직은 균질화 직후 및(E)트리톤 퍼메아빌화를 위한 튜브에 있을 때. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
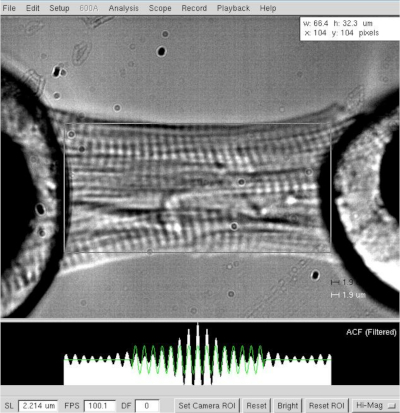
그림 3: 피부심근세포의 길이와 사코프레 길이의 결정. 셀 길이 및 폭 측정≈2.2 μm.이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
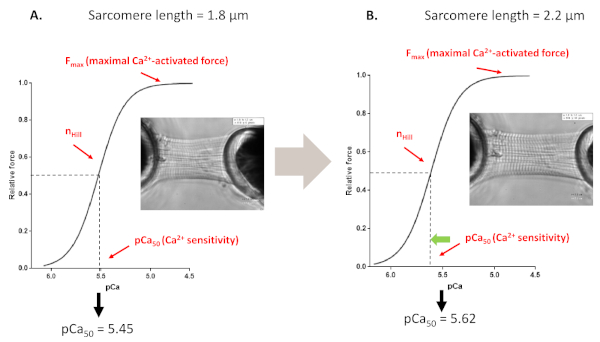
그림 4: 길이 종속 활성화 프로토콜(시험관내 프랭크 별별 메커니즘을 모방). 근안기밀라멘트의 Ca2+ 감도프로토콜(A,1.8 μm) 및 최대 2.2 μm(B)까지 심근세포를스트레칭한 후, 근안회에서 유래한 대표적인 힘 추적 및 파라미터. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
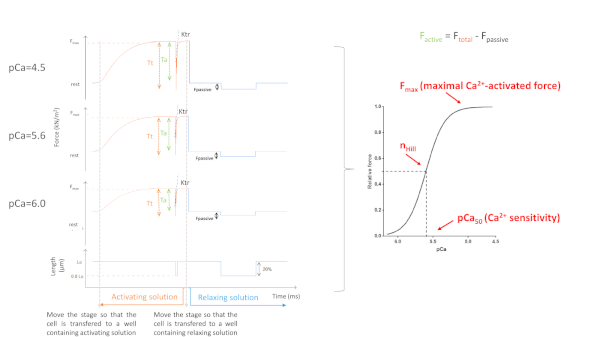
그림 5: Myofilaments Ca2+-감도 프로토콜. 대표적인 힘 추적 및 파생 된 매개 변수. 단순성을 위해 8개의 힘 곡선 중 3개만 묘사됩니다. 즉 포화, 중급 및 가장 낮은 Ca2+함유 용액(각각 4.5, 5,6 및 6.0)으로 활성화된 심근세포입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 상이한 칼슘 솔루션과 각각의 ktr 핏 곡선에서 활성화된 마우스 심장 세포에서 대표적인 흔적. (A)pCa 4.5; (B)pCa 5.0; (C)pCa 5.2; (D)pCa 5.4; (E)pCa 5.6; (F)pCa 6.0 및 E 값은 총, 수동 및 활성 장력, ktr 값 및 rsquare용 ktr 핏용입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
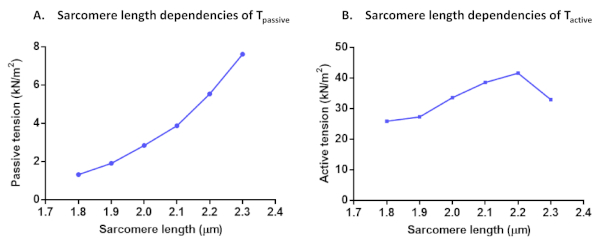
그림 7: T패시브(A) 및 T 활성(B)의 사코레 길이 종속성 프로토콜. 수동장력과 활성 장력은 1.8 μm에서 2.3 μm의 사코프레 길이로 단일 심근세포로 계산하였다.
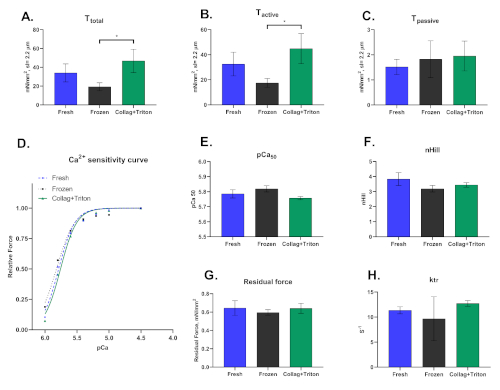
그림 8: 신선("Fresh") 및 냉동 심근 샘플("냉동")과 트리톤("Collag+Triton")을 사용한 후방 투과성으로 콜라게나아제 소화 심장(수정된 랑겐도르프 기술)에서 기계적으로 분리된 심근세포에 대한 대표적인 결과. (A) 총 장력,(B)활성 장력 및(C)≈2.2 μm의 사코메르 길이에서 pCa 4.5 용액으로 활성화된 심근세포로부터의파시스프 장력 및 (F) pCa50 및(F)nHill에 대한 각각의 값. (G)잔류력 및(H)ktr 값은 최대 활성화 용액(pCa 4.5)으로 계산된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
추가 파일. 이 파일을 다운로드하려면 여기를 클릭하십시오.
| 에 저장 | 스톡 솔루션 | [M] | 최종 볼륨(mL) | 무게/볼륨 | 노트 |
| 4°C | 수산화 칼륨 (KOH) | 1 | 100 | 5.611 g | pH를 조정하려면 |
| 4°C | 수산화 칼륨 (KOH) | 5 | 50 | 14.03 g | pH를 조정하려면 |
| 4°C | Bes | 1 | 50 | 10.66 g | |
| 4°C | 프로피오닉산 | 1 | 100 | 7.483 mL | 5M 또는 1M KOH로 pH를 7.0으로 조정 |
| 4°C | 다음과 같은 것으로 구성된 CaEGTA: | 0.1 | 100 | 용액을 60°C로 1시간 이상 혼합하여 가열합니다. 1M KOH로 pH를 5-6으로 조정합니다. | |
| - 카코3 | 0.1 | 1.001 g | |||
| - 티트리플렉스 (EGTA) | 0.1 | 3.804 |
표 1: 재고 솔루션 준비 지침입니다.
| 릴렉스-ISO (심근세포 분리용) | [mM] | 무게 |
| 나2ATP | 5.95 | 3.28 g |
| MgCl2.6H2O | 6.04 | 1.23 g |
| 트리티플렉스 (EGTA) | 2 | 0.76 g |
| KCl | 139.6 | 10.41 g |
| 이미다졸 | 10 | 0.68 g |
표 2: Relax-ISO 솔루션 준비를 위한 지침입니다.
| 용액 활성화(측정용) | [mM] | 중량/볼륨 |
| 나2ATP | 5.97 | 0.823 g |
| MgCl 1M | 6.28 | 1.57 mL |
| 프로피오닉산 | 40.64 | 10.16 mL |
| Bes | 100 | 25 mL |
| CaEGTA (이전에 준비된 스톡 솔루션) | 7 | 17.5 mL |
| 나2PCr | 14.5 | 0.925 g |
표 3: 솔루션 준비 활성화 지침입니다.
| 편안한 솔루션(측정용) | [mM] | 중량/볼륨 |
| 나2ATP | 5.89 | 0.325 g |
| MgCl 1M | 6.48 | 0.65 mL |
| 프로피오닉산 | 40.76 | 4.08 mL |
| Bes | 100 | 10mL |
| 티트리플렉스 (EGTA) | 6.97 | 0.265 g |
| 나2PCr | 14.5 | 0.370 g |
표 4: 편안한 솔루션 준비 지침입니다.
| pCa = -Log [Ca2+] | 휴식 (pCa=9.0) Ml | 인티베이팅(pCa=4.5) Ml |
| 5 | 0.86 | 39.14 |
| 5.1 | 1.2 | 38.80 |
| 5.2 | 1.54 | 38.46 |
| 5.3 | 2 | 38.00 |
| 5.4 | 2.51 | 37.49 |
| 5.5 | 3.14 | 36.86 |
| 5.6 | 3.89 | 36.11 |
| 5.7 | 4.8 | 35.20 |
| 5.8 | 5.89 | 34.11 |
| 5.9 | 7.14 | 32.86 |
| 6 | 8.57 | 31.43 |
표 5: pCa 솔루션 준비 지침입니다.
| 매개 변수 | 설치류 | 돼지 | 인간의 |
| 액티브 텐션, kN.m-2 (2.2 μm) | 17 – 28 | 19 – 40 | 19 – 36 |
| 패시브 장력, kN.m-2 (2.2 μm에서) | 3.6 – 5.5 | 1.9 – 6.8 | 1.8 – 2.3 |
| pCa50 | 5.58 – 5.64 | 5.40 – 5.50 | 5.43 – 5.82 |
| n힐 | 2.60 – 2.76 | 2.95 – 3.36 | 2.99 – 3.10 |
| ktr, s-1 | 4.00 – 8.00 | 1.00 – 3.00 | 0.90 – 2.00 |
표 6: 설치류, 돼지 및 인간으로부터 단일 투과성 심근세포에서 파생된 일반적인 매개 변수 및 지수. 12에서적응 .
| 문제 | 가능한 이유 | 솔루션 |
| 최대 활성화 시 심근세포 분리 | 불충분 한 접착 시간; 접착제는 오래되어 건조되었습니다. | 접착 단계의 시간을 증가; 새로운 접착제 튜브를 여는 것을 고려하십시오. |
| 더 이상 제거할 수 없는 셀 서스펜션 솔루션에는 Triton® | 하나 또는 두 개의 추가 트리톤으로 추출 절차를 반복® 단계를 씻어 | |
| 심근세포는 통제 조건하에서 낮은 힘을 가지고 있습니다. | 추출이 잘못되어 저품질 셀을 전달했습니다. | 샘플 크기를 늘리고 새 추출을 수행합니다. 문제가 지속되는 경우 부적절한 샘플 수집 때문일 수 있습니다 - 이 샘플을 폐기합니다. |
| 셀은 눈에 띄게 수축하지만 힘이 기록되지 않습니다. 셀에는 비정상적인 힘 값이 있습니다. | 힘 변환기가 꺼져 있습니다. | 켜기 |
| 힘 변환기가 잘 보정되지 않음 | 알려진 가중치 집합을 사용하여 힘 변환기를 교정합니다(제조업체의 사용 설명서 확인). | |
| 힘 트랜스듀서 바늘이 느슨합니다. | 크리스탈 본드 509 또는 보석 상 왁스를 사용하여 다시 바늘을 붙입니다. | |
| 사리메트 길이를 결정하기에 충분하지 않은 트러리 패턴 | 불충분 한 빛 | 현미경 광을 증가하거나 커버 슬립으로 다시 세포를 이동하고 다시 sarcomere 길이를 평가 (우물은 낮은 빛 강도를 가지고) |
| 추출이 잘못되어 저품질 셀을 전달했습니다. | 샘플 크기를 늘리고 새 추출을 수행합니다. | |
| 바늘의 팁은 같은 평면에 없습니다 | 미세 조작기 사용, 집중 된 sarcomeres를 찾을 때까지 바늘의 팁을 위아래로 조정 | |
| 획득 시 길이 및/또는 힘 변형 없음 | 모터 또는 포스 트랜스듀서가 꺼져 있습니다. | 켜기 |
| 모터가 고장나셀 단축을 생성하지 않음 | 그것을 교체하거나 함수 생성기를 사용하여 보정하려고 | |
| 인수 녹음에 너무 많은 소음 | 장비 주위의 공기 흐름이 너무 많습니다. | 직접 공기 흐름으로부터 장비 보호 |
| 장비 주변의 진동이 너무 많습니다. | 안정화 테이블은 권장됩니다. 그럼에도 불구하고 압축기가 있거나 진동(냉동고, 냉장고)을 방출할 수 있는 장비를 제거하는 것이 좋습니다. | |
| Ca2+-감도 곡선에는 이상한 값이 있으며 [Ca2+]로힘 값이 증가하지 않습니다. | 활성화 및 이완 용액의 혼합물이 제대로 수행되지 않았습니다 (3.10 ~ 3.14 개의 방법 섹션, 혼합이 부족하여 확인하십시오). | 바이알을 동일한 농도로 해동하고, 동일한 비커로 모든 바이알의 함량을 수집하고, 교반기와 섞고 다시 나눕니다. 새로운 셀에서 이러한 솔루션을 다시 테스트합니다. 이 문제가 해결되면 Ca2+-포함 솔루션의 새 배치를 준비합니다. |
표 7: 문제 해결 테이블.
토론
피부 심근세포체를 사용하여 심장 기능의 체외 평가는 생리학적(예를 들어, 스트레치) 및 병리학적 문맥(예를 들어, 허혈)에서 심근세포 수준에서 발생하는 수정을 명확히 하는 중요한 기술을 나타냅니다. 이 방법론은 해동 된 샘플에서 얻은 심근세포에서 기능을 평가하기 위해 최소한의 심근을 요구하는 것과 같은 몇 가지 장점이 있습니다. 광범위한 종(마우스13,쥐1,14,15,토끼16,돼지17,개18,기니피그19 및 인간20)으로부터심근세포및 상이한 심장 위치를 사용하여 아리아, 좌우 심실 또는 경색 심장의 특정 부위를 포함한다. 또한 이 기술은 기본 구성에서 규제 및 수축 구조의 기능을 측정하는 동시에 Ca2+ 및 에너지(ATP)의 특정 농도를 제공할 수 있습니다.
이 기술의 단순성에도 불구하고 몇 가지 중요한 단계가 있습니다. 샘플 수집을 포함하여 처음부터 각 단계의 품질을 보장하는 것이 필수적입니다. 미오필라멘트 단백질은프로테아제(21)에취약하다. 따라서 수집 직후 액체 질소에 샘플을 보관해야 합니다. 이전에 동결되지 않은 신선한 샘플은 훨씬 더 높은 힘을 개발하므로 동일한 프로토콜에서 신선하고 냉동된 샘플에서 수행되는 측정을 혼합하는 것이 좋습니다. 두 번째로 가장 중요한 단계는 심근세포의 추출입니다. 이 절차 동안 대부분의 경우 얼음 샘플을 유지하는 것이 중요합니다. 프로테아제 억제제 칵테일은추출/투과화(22)동안 단백질 분해의 위험을 감소시키는 데 사용될 수 있다. 셋째, 이 단계를 무시했을 때 품질 이내 세포가 감소했다고 지적했기 때문에 정확한 메스 움직임을 사용하여 샘플을 작은 조각으로 절단해야 합니다. 또 다른 중요한 단계는 트리톤을 씻어내고 (세포를 퍼미컬화하지만 그 접착을 촉진) 가능한 한 많은 세포를 유지하는 것 사이의 적절한 균형을 갖기 어렵기 때문에 심근세포를 세척하는 것입니다. 먼저 각 샘플, 종 또는 프로토콜에 대한 추출 및 세척 수를 시도하는 것이 중요합니다. 예를 들어, 우리의 손에, 우리는 ZSF1 비만 쥐 조직 추출은 "지방" 양상을 가지고 있음을 지적, 접착제 동안 이러한 세포를 더 미끄러운 만든 하지만 측정하기 더 어렵지 않다. 우리가 이 문제를 우회하는 방법은 동물 당 세포의 합리적인 수를 가지고 더 많은 실험을 수행하여이었다. 또한, 접착제좋은 세포를 선택하는 것이 중요합니다, 즉 좋은 줄무늬와 합리적인 길이. 심근 세포에는 이러한 기능이 없는 경우 주로 바늘 끝에서 분리되거나 힘이 없음을 일으킵니다. 또한 세포를 바늘에 붙이는 접착제 의 시간과 효능을 고려하여 심근세포 부착에 올바른 접착제를 사용하는 것도 중요합니다. 우리의 손에, 실리콘 접착제(재료의 테이블)빠른 (10-15 분) 충분히 강한 치료. 마지막으로, 마지막 중요한 단계는 세포를 붙인 후 5 분 심근세포를 조심스럽게 들어 올리고 (커버 슬립에 세포를 붙이는 것을 피하기 위해) 우물로 이동하기 전에 (현미경 단계에 의해 끌리는 세포를 피하기 위해)와 관련이 있습니다. 표 7은 이 기술과 관련된 문제 해결, 그 근본 원인 및 빈번한 문제를 극복할 수 있는 가능한 해결 방법을 요약합니다.
이 방법의 주요 제한은 myofilaments활성화 /비활성화 얼마나 빨리 와 같은 myofilament 수축과 관련된 모든 질문에 대답 할 수 없다는 것입니다. 생체 내 설정에서 막 탈극성, 세포내 Ca2+ 증가 및 근안세포에 대한 확산은 심근세포가 수축하는 반면, 피부심근세포Ca2+ 확산에서 근막에 대한 확산은 세포가 Ca2+ 용액에 침수될 때 즉시 발생합니다. Ca2+ 확산의 이 빠른 속도는 근필라멘트 활성화/비활성화분석(23)을편향시킬 것이다.
이러한 실험은 온도, 용액 pH, 기계적 변속(느슨한 재스트레칭 대 느슨함) 및 세포 부착 절차(핀 넥타이 대 접착제)를 포함한 다양한 요인에 의해 영향을받습니다.
기술의 미래 진행은 투과성 심근세포보다는 그대로 기능적 연구를 수행하는 것을 포함한다. 이 기술은 심근세포가 갓 분리된 것에 의존하는 단점이 있습니다(이전에는 동결되지 않음). 이 방법론과 직접적인 관련이 없는 또 다른 중요한 문제는 샘플 냉동 저장의 최대 기간과 관련이 있는 데 큰 영향을 미칠 수 있습니다. 구체적으로, 저장 시간 전반에 걸쳐 근안의 분해 정도를 확립하는 것이 필수적이다(즉, 추출된 심근세포로부터 파생된 양질의 기능데이터를 보장하기 위해 냉동 시료를 얼마나 오래 저장할 수 있는지).
공개
저자는 이해상충이 없습니다.
감사의 말
저자는 과학 기술 (FCT), 유럽 연합( EU), 쿼드로 드 Referência 에스트라테기코 나시오날 (QREN), 푼도 유럽 유 데센볼비멘토 지역 (FEDER) 및 Programa Operacional Factores 드 Competitividade (경쟁) UnIC (UID / IC / 00051/ 2013) 연구 단위에 대한 포르투갈어 재단에 감사드립니다. 이 프로젝트는 경쟁 2020 - 프로비타 오페라 경쟁 E Internacionaléação (POCI), 프로젝트 DOCNET (NORTE-01-0145-FEDER-000003) 포르투갈 2020 파트너십 계약에 의해 지원 , 포르투갈 2020 파트너십을 통해 FEDER에 의해 지원됩니다 유럽 지역 개발 기금(ERDF)을 통해 리스본의 지역 운영 프로그램인 2020년 유럽 구조 및 투자 펀드가 지원하는 프로젝트 NETDIAMOND(POCI-01-0145-FEDER-016385)를 통해. Patrícia 로드리게스FCT (SFRH / BD / 96026/2013)에 의해 투자되었고 주앙 알메이다 - 코엘호는 유니버시다데 두 포르투 / FMUP 및 FSE - 펀도 사회 유럽u에 의해, NORTE 2020-Programa Operacional 지역 도 노르테, (NORTE-08-5369-FSE-000024-Programas Doutorais).
자료
| Name | Company | Catalog Number | Comments |
| Acetone | Sigma | 34580 | |
| Adenosine 5’-triphosphate disodium salt hydrate (Na2ATP) | Sigma | A2383 | |
| Calcium carbonate (CaCO3) | Merck | 1.02067.0500 | |
| Imidazole | VWR | 24720.157 | |
| Magnesium chloride hexahydrate (MgCl2.6H2O) | Merck | 1.05833.0250 | |
| Magnesium chloride solution (MgCl2 1M) | Sigma | M1028 | |
| N,N-Bis(2-hydroxyethyl)taurine (BES) | Sigma | B9879 | |
| Phosphocreatine dissodium salt hydrate (Na2PCr) | Sigma | P7936 | |
| Potassium chloride (KCl) | Merck | 1.04936.1000 | |
| Potassium hydroxide (KOH) | Merck | 8.14353.1000 | |
| Propionic acid (C3H6O2) | Merck | 8.00605.0500 | |
| Silicone Squeeze Tube | Marineland | 31003 | |
| Tritiplex (EGTA) | Merck | 1.08435.0025 | |
| Triton® X-100 10% | Merck | 648463 | |
| Tissue homogeneizer (GKH GT Motor Control) | Terre Haute Glas-col | ||
| Length Controller (Model 315C-I) | Aurora Scientific | ||
| Force Transducer (Model 403 A) | Aurora Scientific | ||
| Software ASI 600A | Aurora Scientific | ||
| Sotware VSL (Model 900B) | Aurora Scientific | ||
| Inverted Microscope (IX51) | Olympus |
참고문헌
- Leite-Moreira, A. M., et al. Stretch-induced compliance: a novel adaptive biological mechanism following acute cardiac load. Cardiovascular Research. 114 (5), 656-667 (2018).
- Falcao-Pires, I., Fontes-Sousa, A. P., Lopes-Conceicao, L., Bras-Silva, C., Leite-Moreira, A. F. Modulation of myocardial stiffness by β-adrenergic stimulation - its role in normal and failing heart. Physiological Research. 60 (4), 599-609 (2011).
- Cokkinos, D. V. . Introduction to Translational Cardiovascular Research. , 371-387 (2015).
- van der Velden, J., Stienen, G. J. M. Cardiac Disorders and Pathophysiology of Sarcomeric Proteins. Physiological Reviews. 99 (1), 381-426 (2019).
- Garnier, D. Attachment procedures for mechanical manipulation of isolated cardiac myocytes: a challenge. Cardiovascular Research. 28 (12), 1758-1764 (1994).
- Brady, A. J. Mechanical properties of isolated cardiac myocytes. Physiological Reviews. 71 (2), 413-428 (1991).
- Falcao-Pires, I., Leite-Moreira, A. F., Cokkinos, D. V. Chapter 20. Introduction to Translational Cardiovascular Research. 20, 371-387 (2015).
- Liang, W. Teaching calcium-induced calcium release in cardiomyocytes using a classic paper by Fabiato. Advances Physiology Education. 32 (1), 1-10 (2008).
- Roche, S. M., Gumucio, J. P., Brooks, S. V., Mendias, C. L., Claflin, D. R. Measurement of Maximum Isometric Force Generated by Permeabilized Skeletal Muscle Fibers. Journal of Visualized Experiments. (100), e52695 (2015).
- Huxley, A. F. Muscle structure and theories of contraction. Progress Biophysics and Biophysical Chemistry. 7, 255-318 (1957).
- Sequeira, V., et al. Synergistic role of ADP and Ca(2+) in diastolic myocardial stiffness. Journal Physiology. 593 (17), 3899-3916 (2015).
- Edes, I. F., et al. Rate of tension redevelopment is not modulated by sarcomere length in permeabilized human, murine, and porcine cardiomyocytes. American Journal Physiology Regulatory Integrative Comparative Physiology. 293 (1), R20-R29 (2007).
- King, N. M., et al. Mouse intact cardiac myocyte mechanics: cross-bridge and titin-based stress in unactivated cells. Journal General Physiology. 137 (1), 81-91 (2011).
- Hamdani, N., et al. Myocardial titin hypophosphorylation importantly contributes to heart failure with preserved ejection fraction in a rat metabolic risk model. Circulation Heart Failure. 6 (6), 1239-1249 (2013).
- Miranda-Silva, D., et al. Characterization of biventricular alterations in myocardial (reverse) remodelling in aortic banding-induced chronic pressure overload. Scientific Reports. 9 (1), 2956 (2019).
- Rodrigues, P. G., et al. Early myocardial changes induced by doxorubicin in the nonfailing dilated ventricle. American Journal Physiology Heart Circulatory Physiology. 316 (3), H459-H475 (2019).
- van der Velden, J., et al. Alterations in myofilament function contribute to left ventricular dysfunction in pigs early after myocardial infarction. Circulation Research. 95 (11), e85-e95 (2004).
- Wakili, R., et al. Multiple potential molecular contributors to atrial hypocontractility caused by atrial tachycardia remodeling in dogs. Circulation: Arrhythmia Electrophysiology. 3 (5), 530-541 (2010).
- Ait Mou, Y., le Guennec, J. Y., Mosca, E., de Tombe, P. P., Cazorla, O. Differential contribution of cardiac sarcomeric proteins in the myofibrillar force response to stretch. Pflugers Archiv. 457 (1), 25-36 (2008).
- Falcao-Pires, I., et al. Diabetes mellitus worsens diastolic left ventricular dysfunction in aortic stenosis through altered myocardial structure and cardiomyocyte stiffness. Circulation. 124 (10), 1151-1159 (2011).
- Lim, C. C., et al. Anthracyclines induce calpain-dependent titin proteolysis and necrosis in cardiomyocytes. Journal Biology Chemistry. 279 (9), 8290-8299 (2004).
- Woulfe, K. C., et al. A Novel Method of Isolating Myofibrils From Primary Cardiomyocyte Culture Suitable for Myofibril Mechanical Study. Frontiers Cardiovascular Medicine. 6, 12 (2019).
- Ait Mou, Y., Bollensdorff, C., Cazorla, O., Magdi, Y., de Tombe, P. P. Exploring cardiac biophysical properties. Global Cardiology Science Practice. 2015, 10 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유