Method Article
In Vitro Оценка сердечной функции с использованием кожистого кардиомиоцита
* Эти авторы внесли равный вклад
В этой статье
Резюме
Данный протокол призван пошаговую описывать технику извлечения и оценки сердечной функции с помощью кожурных кардиомиоцитов. Эта методология позволяет измерять и оструюмодуляцию функции миофиламента с помощью небольших замороженных биопсий, которые могут быть собраны из различных сердечных мест, от мышей до мужчин.
Аннотация
В этой статье мы описываем шаги, необходимые для изоляции одного промеабилизированного ("кожи") кардиомиоцита и прикрепляем его к аппарату измерения силы и мотору для проведения функциональных исследований. Эти исследования позволят измерения жесткости кардиомиоцитов (пассивная сила) и его активации сразличными кальция(Ca 2 ") -содержащие решения, чтобы определить, среди прочего: максимальная сила развития, myofilament Ca2"-чувствительность (pCa50), кооператорство (nHill) и скорость редевелопмента силы (ktr). Этот метод также позволяет определить влияние препаратов, действующих непосредственно на миофиламенты, и экспрессии экзогенных рекомбинантных белков как на активные, так и на пассивные свойства кардиомиоцитов. Клинически, кожурой кардиомиоцитов исследования подчеркивают патофизиологии многих заболеваний миокарда и позволяют в пробирке оценки воздействия терапевтических мероприятий, направленных на миофиламенты. В целом, этот метод позволяет уточнить сердечную патофизиологию путем исследования корреляций между параметрами in vitro и in vivo в моделях животных и тканей человека, полученных во время операции на открытом сердце или трансплантации.
Введение
Традиционно, оценка механических свойств миокарда была предпринята в основном в многоклеточных препаратов, таких как папиллярные мышцы и трабекулы1,2. Многоклеточные полосы сердечной мышцы включают неоднородную популяцию клеток, включая контрактильные кардиомиоциты с неизвестной моделью ориентации и генерации силы, электрическую активность и распределение напряжения/напряжения, а также окружающую матрицусоединительной ткани 3,4. Препарат без коллагена и содержащий один кардиомиоцит позволит измерять длину саркомера и поперечные контрактильные свойства в очень точной иконтролируемой манере 5,6. Поэтому за последние четыре десятилетия было разработано несколько методологий, позволяющих исследовать механические, контрактильные и релаксационные свойства одногокардиомиоцита 6,7. Контрактильной функции этих клеток сильно зависит от длины саркомера и кросс-мост велосипедной кинетики3. Таким образом, желательно исследовать мышечную функцию непосредственно в отдельных изолированных сердечных клетках, учитывая, что это позволяет оценить длину саркомера и производительность, а также функции поперечного моста и контрактные свойства. Тем не менее, изоляция и присоединение функциональных кардиомиоцитов с разумным оптическим разрешением саркомера при записи измерения силы на уровне НН по-прежнему является сложной задачейи развивается 3,6. Другими проблемами являются логистика, которая должна быть установлена, чтобы изолировать кардиомиоциты от свежесобранных биопсий. Например, непредсказуемость сбора биопсии человека может поставить под угрозу осуществимость экспериментов.
Кроме того, этические проблемы, связанные с заменой, сокращением и уточнением экспериментов на животных для научных процедур (принципы 3Rs), способствовали изменениям в исследованиях на клеточном и тканевом уровне, предпочтительно в биопсии человека, или в небольших образцах животных. Действительно, прогрессивное уточнение методологий для оценки сердечной функции in vitro на меньший уровень сложности позволяет правильной интеграции результатов на весь организм и перевести их в клиническийсценарий 7. В общей сложности, использование образцов, хранящихся при -80 градусов по Цельсию для извлечения кардиомиоцитов может быть привлекательной альтернативой.
Ткань миокарда разрезается на мелкие кусочки и гомогенизируется раствором и пестиком. Результатом этой гомогенизации является суспензия кожурой в комплекте и изолированных клеток с различной степенью сарколеммального повреждения, в котором миоплазма подвергается воздействию среды купания и все клеточные компоненты вымываются. Сохранились такие структуры, как миофибрильки, которые находятся дальше от сарколеммы. Таким образом, саркомерное укорочение и функциональные свойства, связанные с миофибрилляторным аппаратом, остаются нетронутымии могут быть записаны 8,9.
Система измерения силы кардиомиоцитов состоит из электромагнитного двигателя, используемого для регулировки длины кардиомиоцитов, и форс-предуцера, который измеряет изометрическое сокращение кардиомиоцитов. Промеабилизированный, или кожурой, кардиомиоцит помещается в экспериментальную камеру, содержащую расслабляющий раствор («Ca2»;10 nM) и кремниевые клееные до 2 тонких игл: одна прикреплена к мотору, а другая к препонатору силы. Оптическая система используется для определения морфологии кардиомиоцитов и длины саркомера. Экспериментальный протокол часто состоит из серии силовых записей на буферныерастворы, содержащие различные концентрации Ca 2 ", определение актин-миозин кросс-мост кинетики и измерения пассивного напряжения установленных кардиомиоцитов на заранее определенных длин саркомера (Рисунок 1). Изоляция пермеабилизованных кардиомиоцитов из образцов миокарда, замороженных в жидком азоте (и впоследствии хранящихся при -80 градусов по Цельсию) является методом, которыйиспользует клеточной механики и биохимии белка для измерения максимальной Ca2"-активированной (активной) силы на поперечную область (T активный , kN'm -2), Ca2 "-независимое (пассивное) напряжение (Tпассивное,kN'm -2), myofilaments Ca2 "-чувствительность(pCa50), миофиламенты кооператорность (nHill), скорость редевелопмента силы (ktr), а также саркомер длины зависимостей Tактивных, Tпассивных, pCa50, nHill и ktr.
Цель этого протокола – проиллюстрировать и обобщить потенциал системы измерения силы кардиомиоцитов как надежной процедуры оценки функциональных механических свойств однокожих кардиомиоцитов, изолированных от замороженных образцов различных видов.
протокол
Все эксперименты на животных соответствуют Руководству по уходу и использованию лабораторных животных (Публикация NIH No 85-23, пересмотренная в 2011 году) и Португальскому закону о защите животных (DL 129/92, DL 197/96; P 1131/97). Компетентные местные органы власти утвердили этот экспериментальный протокол (018833).
1. Подготовка решения по акциям(таблица 1)
- Подготовка 1000 мл расслабляющего раствора для изоляции кардиомиоцитов (RELAX-ISO), следуя инструкциям в таблице 2. Растворите реагент выше в ≈500 мл и отрегулируйте рН до 7,0 с KOH. Отрегулируйте конечный объем до 1000 мл.
- Распространение RELAX-ISO в 50 мл труб. Хранить при -20 градусов по Цельсию.
- Подготовьте 250 мл активированного раствора, следуя инструкциям в таблице 3. Растворите реагенты выше в ≈100 мл ультра-чистой воды. Отрегулируйте рН до 7,1 с 5 M KOH при 15 градусов по Цельсию.
ПРИМЕЧАНИЕ: Как правило, необходимо добавить значительное количество KOH для достижения желаемого рН. Положите объемный шарик в коробку со льдом, чтобы охладить раствор до 15 градусов по Цельсию.- Отрегулируйте конечный объем до 250 мл. Агитировать это решение непрерывно с магнитным мешалка до момента смешивания его с расслабляющим раствором.
- Подготовьте 100 мл расслабляющего раствора, следуя инструкциям в таблице 4. Растворите реагенты выше в ≈50 мл ультра-чистой воды. Отрегулируйте рН до 7,1 с KOH 5 M при 15 градусов по Цельсию.
ПРИМЕЧАНИЕ: Как правило, необходимо добавить значительное количество KOH для достижения рН 7,1. Поместите объемный шарик в коробку, наполненную льдом, чтобы охладить раствор до 15 градусов по Цельсию. Ионическая прочность растворов, используемых во время измерений, составила 180 мМ.- Отрегулируйте конечный объем до 100 мл. Агитировать это решение непрерывно с магнитным мешалка до момента смешивания его с активацией раствора.
- Смешайте активированные и расслабляющие решения в пропорциях, представленных в таблице 5, чтобы получить решения pCa между 5.0 и 6.0.
- Всегда держите расслабляющий и активации решений агитации при смешивании обоих.
- Aliquot каждой смеси до 2 мл микротрубок. Храните все микротрубки при -20 градусов по Цельсию.
- Подготовь для каждого протокола другую партию решения pCa (от 4,5 до 6,0).
2. Калибровка преминдатора силы
ПРИМЕЧАНИЕ: Калибровка превантикера силы является обычной процедурой, которая должна выполняться каждые пару месяцев или всякий раз, когда она подозревается в некалибровании. Превантукер силы очень чувствителен и легко нарушается. Его следует аккуратно обрабатывать на каждом этапе его использования, включая калибровку, склеивания кардиомиоцитов и очистку.
- Отсоедините превратно-двигатель силы от остального аппарата.
- С помощью зажима поместите силу предуцера горизонтально таким образом, чтобы игла указывает вниз в той же ориентации, что кардиомиоцит будет развиваться сила. Это облегчит вися серию масс с известными весами (резинка, шов или булавка).
ПРИМЕЧАНИЕ: Проверьте характеристики преминдактора силы, прежде чем перейти к этому шагу, чтобы проверить коэффициент масштаба «мг/вольт» и избежать чрезмерного веса на превлододер. Для модели превдерищика силы, коэффициент масштаба 50 (50 мг соответствуют 1 вольт), и мы используем 5 весов между 12,5 и 250 мг. - Включите превратодер силы и дайте ему прогреться в течение 30 минут.
- Начните с подвешивания более легкой массы на преобразовавающий силу и регистрации соответствующего напряжения, измеренного на FORCE OUT.
- Повторите эту процедуру до пяти весов.
- Сила участка применяется к силовому преобразоваю (нагрузке) по сравнению с напряжением и проверяется на линейность.
- Если нет линейности, отрегулируйте ноль и приобретйте потенциометры в кольцевой доске препоньщика. Проверьте его конкретные инструкции для получения дополнительной информации.
- Поверните нулевой potentiometer до тех пор, пока выходное напряжение читает 0.0 V.
- Рука средний вес на трансдуцерной иглы и настроить усиления потенциометра для чтения соответствующего напряжения (например, 50 мг соответствуют 1 V). Снимите вес и перерегулируйте нулевой потенциометр до 0,0.
- Повторите шаг 2.6.2 до тех пор, пока выход с весом и без него не будет правильным.
- Намонтировать превратно-двигатель силы обратно в аппарат.
3. Установка экспериментального аппарата
- Оттепель по одному флакону каждого из активации, 4,5, 5,0, 5,2, 5,4, 5,6, 5,8, 6,0 и расслабляющие растворы и поддерживать их на льду.
ПРИМЕЧАНИЕ: АТФ и PCr являются половые соединения, которые должны поддерживаться при низких температурах. - Подготовка микроскопа, испытательного аппарата и связанного с ним компьютера для использования(рисунок 1).
- Отрегулируйте температуру так, чтобы внутрикомерный термометр считывает 15 градусов по Цельсию. Выполните все эксперименты при такой температуре, кроме инкубации киназы и фосфатазы (20 градусов по Цельсию).
- Включите форс-трансдуцера и двигатель.
4. Извлечение и пермеабилизация кожи кардиомиоцитов
- Разморозить 50 мл раствора RELAX-ISO.
- Включите центрифугу и быстро охладите ее до 4 градусов по Цельсию.
- Оттепель 3-5 мкг образца миокарда в чашке Петри, содержащей 2,5 мл раствора RELAX-ISO.
- Разрежьте ткань на мелкие кусочки скальпелем(рисунок 2). Вырежьте образец точным способом, чтобы избежать ненужных повреждений клеток.
- Перенесите 2,5 мл раствора RELAX-ISO с тканью в стекло Potter-Elvehjem с помощью наконечника пипетки.
- Механически нарушить работу ткани мясорубки со скоростью вращения 30-40 об/мин. Нажмите ткани 3 раза по 2 с каждый, чтобы получить хорошую подвеску клетки.
- Подготовьте 10% Triton в растворе RELAX-ISO (250 мкл Triton с 2,25 мл RELAX-ISO) в трубке 15 мл и добавьте это решение в подвеску клетки.
- Аккуратно перемешайте трубку 3 раза.
- Инкубировать при комнатной температуре в течение 1 мин и 4 мин на льду.
- Вымойте Тритон, добавив RELAX-ISO до верхней части 15 мл трубки; мягко смешивания (инвертирование 3 раза трубки) и, наконец, спиннинг вниз клетки в угловой центрифуги (1 мин при 348 х г). Удалите супернатант до 3 мл над клеточной гранулой.
ПРИМЕЧАНИЕ: Удалите супернатант осторожно, чтобы избежать нарушений гранулы клетки. Тем не менее, некоторые клетки в supernatant неизбежно будут потеряны. - Повторите шаг 4.10 по крайней мере 4 раза или до тех пор, пока больше не будут наблюдаться пузырьки, производимые остатками Triton.
ПРИМЕЧАНИЕ: Чем больше шагов вымываются, тем больше клеток теряется с отбрасываются supernatant. - В последней вымыве снимите супернатант до объема 5-10 мл клеточной подвески.
5. Выбор и склеивания кожурой кардиомиоцитов
- Положите падение подвески клетки на крышку поверх стеклянной горки в держателе слайда микроскопа(рисунок 1).
- Выберите один родообразный кардиомиоцит с хорошим рисунком и размером(рисунок 2).
- Найдите кончики иглы форс-трансдуцера и мотора с помощью наименьшего увеличения перевернутого микроскопа.
- Поверните крышку, чтобы распоставить выбранный кардиомиоцит горизонтально так, чтобы его концы выровнялись с иглой препоньщика силы и двигателя(рисунок 2).
- Поместите тонкую линию клея на стороне крышки с помощью кончика тампона(рисунок 2).
- Погрузите кончики иглы превлодщика силы и мотора в линию клея для того чтобы создать гало клея вокруг обоих подсказок.
ПРИМЕЧАНИЕ: Шаги 5.6 - 5.10 выполнены путем тщательного использования моторизованных микропозиционеров. - Быстро перемести кончики иглы близко к фокусной плоскости кардиомиоцита.
- Перемести кончик иглы предуцера силы вниз так, чтобы она приклеивалась к одному краю кардиомиоцита.
- Повторите эту процедуру с кончиком двигателя и другой конечности клетки.
ПРИМЕЧАНИЕ: Эта процедура должна занять менее 2-3 минут, как клей начинает лечить очень быстро. - Через 5-8 минут поднимите иглы ≈15 мкм, чтобы избежать приклеивания клетки к крышке. Это делается путем перемещения вверх обоих микроманипуляторов одновременно.
- Пусть клей вылечить. Эта процедура может длиться от 15 до 45 мин, в зависимости от типа клея. В нашем случае кардиомиоцит адекватно склеивается после ≈15 мин.
6. Запись измерения силы активной, пассивной и чувствительности Ca2
- Заполните первую экспериментальную колодец расслабляющим раствором (55-100 МКЛ в экспериментальном аппарате), а вторую экспериментальную хорошо с активироваваемым раствором.
- Используя программное обеспечение камеры, поместите область интереса (ROI) в области кардиомиоцита с четким рисунком полосы.
ПРИМЕЧАНИЕ: Для сердечных миоцитов, операционная длина саркомера колеблется между 1,8 и 2,2 мкм, а оптимальная длина саркомера составляет около 2,15 мкм. - Измерьте расстояние между двумя крайностями кардиомиоцита (от мотора до гало трансдуцера клея, рисунок 3) после оптимальной длины саркомера (2,2 мкм). Запись значения, как длина миоцитов в программном обеспечении.
- Измерьте ширину и глубину кардиомиоцитов, последний с помощью призмы зеркала помещается перпендикулярно клетке.
ПРИМЕЧАНИЕ: Для визуализации ячейки через призму потребуется мощный внешний источник света. В случае, если нет призмы, и предполагая, что сердечные клетки имеют эллиптической формы, глубины кардиомиоцитов можно сделать вывод, как 70% ширины кардиомиоцитов. - Рассчитайте поперечную область (CSA,мм 2) при условии эллиптической формы кардиомиоцита.

- Аккуратно переместите стадию микроскопа так, чтобы клетка перемещается от крышки к хорошо содержащем расслабляющий раствор на задней части сцены.
ПРИМЕЧАНИЕ: Эта процедура может легко повредить клетку. Перед перемещением клетки, осторожно переместить иглы вверх немного больше. Избегайте удаления ячейки из раствора. - Выберите протокол в программном обеспечении, которое содержит две ячейки сокращения (80% от его первоначальной длины), что произойдет,когда ячейка возникает в Ca 2 "решение и в расслабляющем решении, соответственно (Рисунок 1, Дополнительный файл).
ПРИМЕЧАНИЕ: Первый "Slack" ячейки будет выполняться в активированном растворе, а второй "Slack" в расслабляющем растворе. Делая это, пользователь сможет рассчитать общую силу (Fвсего)ячейки от1 й и пассивной силы (Fпассивный) ячейки от2 nd. Используйте формулу для расчета активной силы, Fактивный и Fвсего - Fпассивный. Ячейка сокращена на 80%, чтобы отсоединить все перекрестные мосты рекордной силы. - Вызвать изометрическое сокращение, перемещая стадию микроскопа так, что кардиомиоцит переходит от расслабляющего к активенющему раствору (pCa-4.5(1)).
ПРИМЕЧАНИЕ: Если ячейка функциональна, она немедленно ско ему заключается. - По достижении силового плато начните записывать данные о силе.
ПРИМЕЧАНИЕ: Тесты могут быть сделаны индивидуально. В зависимости от программного обеспечения есть возможность создать последовательностьтестов,которыебудут соответствовать различным решениям Ca 2 "в протоколе чувствительности Ca2"(рисунок 1, Дополнительный файл ). - Подождите 10 с, а затем включите ячейку, погруженную в активированный раствор.
ПРИМЕЧАНИЕ: Важно подождать 10 с, прежде чем погрузить клетку в расслабляющий раствор. Если ячейка перемещается слишком рано, важные данные для расчета силы перепланировки ячейки (значение ktr) могут быть потеряны. - Быстро двигайте сцену так, чтобы кардиомиоцит погрузился в расслабляющий раствор.
- Подождите, пока тест не прекратится.
- Повторите шаги 6.8 - 6.12 так, чтобы ячейка дважды активировалась в активируя растворе (pCa-4.5(2)).
ПРИМЕЧАНИЕ: Как правило, после первой активации, концы кардиомиоцитов может слегка отделиться от иглы советы, изменение длины кардиомиоцитов, CSA и / или длины саркомера. Отрегулируйте желаемую длину саркомера и ввемийте исправленные размеры в программное обеспечение.- Продолжайте шаг 6.13.2 для протокола чувствительности Ca2 "или сохранить данные, если значения пассивной и активной силы клетки являются единственными параметрами, необходимыми и отделить клетку от игл и очистить их ацетоном, чтобы удалить клей.
- При необходимости отрегулируйте длину саркомера ячейки до 2,2 мкм, слегка растягивая ее снова.
- Замените активированное решение следующим раствором Ca2 (55-100 йл здесь). Повторите шаги 6,8 - 6,12.
- Замените активированное решение следующим решением Ca2 (55-100 йл здесь) и повторите шаги 6.8 - 6.12 до тех пор, пока все решения не будут протестированы (5.0, 5.2, 5.4, 5.6, 5.8, 6.0).
- Наконец, повторно активировать ячейку с активацией раствора (pCa4.5(3)). Повторите шаги 6.8- 6.12.
7. Инкубация с киназами и фосфатами
- После выполнения выбранного базового протокола разбавляют киназу/фосфатазу в расслабляющем растворе в рекомендуемой концентрации.
ПРИМЕЧАНИЕ: Рекомендуется провести кривую реакции дозы до начала эксперимента. - Установите температуру экспериментальных скважин до 20 градусов по Цельсию.
- Заполните экспериментальные скважины киназой/фосфатазой, расслабляющим раствором и активироваваемым раствором (55-100 МЛ).
- Аккуратно переместите стадию микроскопа так, чтобы клетка погрузилась в колодец, содержащий киназу/фосфатазу.
- Инкубировать кардиомиоцит с киназы / фосфатазы, по крайней мере 30 мин или в соответствии с инструкциями производителей.
- Повторите выбранный базовый протокол.
8. Финал эксперимента
- Отклеить кардиомиоцит от кончиков препоньщика силы и двигателя путем растяжения клетки.
- Тщательно удалите клей гало из иглы советы с помощью ватного тампона пропитанной ацетоном.
- Выключите оборудование.
9. Анализ данных
- Соберите все файлы из каждого протестированных кардиомиоцитов.
ПРИМЕЧАНИЕ: Каждый тест будет соответствовать одному файлу. Это означает, что для каждого решения Ca2 "или sarcomere длины, будет соответствующий файл. - Рассчитайте активные и пассивные силы одного кардиомиоцита.
- Откройте файл, соответствующий первой активации (pCa'4.5(1)) с помощью электроннойтаблицы (рисунок 3A, приложение A в дополнительном файле).
ПРИМЕЧАНИЕ: Мы использовали заказную программу для выполнения анализа. Пожалуйста, смотрите приложение A в дополнительном файле. - Среднее ≈60 значений до и в среднем ≈60 значения после 1-й слабину ячейки (когда ячейка погружается в Ca2 "решение). Эти 2 значения соответствуют a и b, соответственно.
- Повторите тот же анализ для2-й слабину клетки (когда клетка погружается в расслабляющий раствор). Эти 2 значения соответствуют c и d соответственно.
- Рассчитайте разницу между a и b (общая сила, Fвсего).
- Рассчитайте разницу между c и d (пассивная сила, Fпассивный).
- Рассчитайте активную силу, Fактивный и Fвсего - Fпассивный.
- Нормализация всех значений силы к CSA (см. формулу выше), чтобы получить общее напряжение (Tвсего), пассивное напряжение (Tпассивное)и активное напряжение (Tактивный).
- Повторите шаг 9.2.1 до 9.2.5 для2-й активации (pCa-4.5(2)).
- Рассмотрим эти значения, как те, представляющие Tвсего, Tактивных и Tпассивных кардиомиоцитов в стадии анализа.
ПРИМЕЧАНИЕ: Первая активация клетки с pCa4.5(1) обычно связана с изменениями в размерах клеток. По этой причине, 2-й активации с pCa4.5 является более точным и тот, который будет использоваться. - Повторите шаги от 9,2,1 до 9,2,5 для каждого проверенных решений файла/pCa (5,0, 5,2, 5,4, 5,6, 5,8, 6,0, 4,5(3)).
- Откройте файл, соответствующий первой активации (pCa'4.5(1)) с помощью электроннойтаблицы (рисунок 3A, приложение A в дополнительном файле).
- Рассчитайте pCa50 и nHill одного кардиомиоцита.
ПРИМЕЧАНИЕ: Для этого анализа используйте не нормализованные активные значения F из файлов 4.5(2), 5.0, 5.2, 5.4, 5.6, 5.8, 6.0 и 4.5(3).- Поместите в файл электронной таблицы все не нормализованные значения F, активные для каждого протестированного решения Ca2 (4.5(2),5.0, 5.2, 5.4, 5.6, 5.8, 6.0, 4.5(3)).
- Рассчитайте коэффициент коррекции - Fактивный (4,5(2)" - Fактивный (4,5(3)" / 7.
- Рассчитайте скорректированные значения Fактивных для каждого решения Ca2 "(5.0, 5.2, 5.4, 5.6, 5.8, 6.0) путем вычитания F активного - коррекционого фактора.
- Рассчитайте относительнуюсилу(родственник F) для каждого решения Ca2 , нормализуякаждое активное значение F соответствующим исправленным значением.
ПРИМЕЧАНИЕ: Родственник F (4,5(3)) должен равняться 1. Каждый экспериментальный протокол начинается и заканчивается активацией управления принасыщении концентрации Ca 2 (pCa 4.5(2) и 4.5(3)). Это позволяет нормализации силы и оценки изношенном подготовки путем сравнения изменений в максимальной Ca2"-активированной силы (Fмакс). Если в конце экспериментального протокола, кардиомиоцит производит менее 70% от максимальной силы первого сокращения, что клетка / измерение должно быть исключено из анализа. - Используйтеотносительные F и соответствующие значения pCa, чтобы соответствовать сигмоидной кривой со следующим уравнением F(Ca) и CanHill/ (Ca50nHill и CanHill).
- Экстраполировать значения pCa и nHill из вышеупомянутого уравнения.
- Рассчитайте скорость силовой перепланировки (ктр) одного кардиомиоцита.
- Выполните припадок к кривой, которая соответствует значениям сразу после 1-йячейки слабину.
- Рассчитайте наклон кривой, и это значение будет соответствовать скорости редевелопмента силы.
- Повторите шаг 9.4.1 и 9.4.2 для каждого решения Ca2.
ПРИМЕЧАНИЕ: Плохой кривой подходят будут получены для самых низких Ca-решений (R в квадрате≤0,90).
Результаты
Функциональные протеабилизированные кардиомиоциты должны казаться однородными и с последовательной моделью стримации на протяжении всего эксперимента. Хотя после длительных экспериментов ожидается некоторое ухудшение состояния и уменьшение силы, значения активной напряженности должны быть относительно стабильными. Клетки, показывающие явные признаки потери полосы или значительного снижения силы (lt; 15kN-m -2 или lt;80% от его первоначальной активной силы), должны быть исключены. В таблице 6 отображаются нормальные значения, ожидаемые для наиболее важных параметров, полученных от грызунов, свиней и образцов человека.
Полученные параметры зависят главным образом от выбранного протокола. Рисунок 5 показывает репрезентативные следы силы 3, из 8, силовые записи, необходимые для выполнения протокола myofilaments Ca2"-чувствительность. Передавая клетку в колодец, содержащий активированный раствор, кардиомиоцит начинает развивать силу, пока не достигнет плато. После быстрого вялого теста (длительность 1 мс), при котором кардиомиоцит сокращается до 80% своей длины, мы получаем базовые значения нулевой силы. После вялого теста, клетка продолжает развивать силу, как он погружается в активации раствора. Общая сила (Fвсего) рассчитывается путем вычитания значения плато из минимального значения. Склон последней части этой кривой дает нам значение скорости редевелопмента силы (ktr) (Рисунок 6), который является мерой очевидной скорости перекрестного моста крепления и отряда (fapp и gaap)10. Когда значение ktr R2 составляет lt;0.90 значение ktr должно быть исключено, и обычно это происходит при более низких концентрациях Ca2 (pCa 5.6, 5.8 и 6.0). После переноса клетки обратно в колодец, содержащий расслабляющий раствор, клетка расслабляется и ее сила падает. Пассивнаясила (F пассивная) рассчитывается путем вычитания минимального значения (полученного после длительного сокращения ячейки) к этому новому значению силы. Активная сила является результатом разницы между Fвсего и Fпассивным.
Максимальная активная и пассивная сила, характеризующая кардиомиоцит, является одной, полученной от активациивторой клетки снасыщая Ca 2'-solution (pCa No 4.5). Первая активация обычно отбрасывается, так как длина саркомера часто нуждается в корректировке.
Для выполнения протокола миофиламента Ca2'-чувствительности необходимо выполнить не менее 9 тестов активации (4,5; 4,5; 5,2; 5,6; 6,0; 5,0; 5,4; 5,8 и 4,5). Эта последовательность просто является примером, но всегда должна начинаться с 4,5 (дважды) и заканчивается с 4,5. Программирование программного обеспечения для получения данных для протокола чувствительности myofilament Ca2"изображено на рисунке 1 Дополнительного файла.
После расчета активной силы для всех этих решений активации, проверьте, если последняя активация дала более 80% от первоначальной максимальной силы (в противном случае эти результаты ячейки должны быть отброшены, как упоминалось выше). Чтобы исправить снижение F max во времяэкспериментальной серии, интерполированные значения Fmax могут быть использованы для нормализации точек данных. Нормализованные данные могут быть приспособлены к сигмоидной кривой со следующим уравнением F(Ca) - CanHill/(Ca50nHill и CanHill). Полученные значения параметров отражают чувствительность кальция (Ca50, которые могут быть преобразованы в pCa50) и cooperativity (nHill). Все значения силы могут быть преобразованы в значения напряжения после нормализации в поперечную область. Помимо myofilament Ca2"-чувствительность и длина-зависимых протоколов активации, другие тесты могут быть выполнены. Так обстояет случай саркомерной длины зависимостей Tактивной,Т пассивной (рисунок7)и остаточной силы кардиомиоцитов. Остаточные записи силы рассчитываются из первоначального восстановления силы (pCa 4.5), достигнутого после изменения длины ячейки (80%) и нормализуется к каждой общей устойчивой государственной силы, достигнутой до изменениядлины 11. Увеличение остаточной силы обычно свидетельствует о поперечных мостах с медленной отслоением кинетики и более высокой жесткостью.
Наконец, следует подчеркнуть, что этот метод может быть выполнен в кожуре кардиомиоцитов, извлеченных механически из замороженных или свежесобранных образцов, а также изолированных энзиматично следуют проницаемые его мембраны. То, как кардиомиоциты изолированы, значительно влияет на результаты, полученные из этого метода. На рисунке 8 показаны различия, наблюдаемые между тремя процедурами изоляции.

Рисунок 1: Интегрированная схема испытательного аппарата. Испытательный аппарат включает в себя микроскоп, микроманипуляторы и связанный с ним компьютер. В нижней части фигуры показан кожурой кардиомиоцита, склеенных между двигателем и силой превысятеля. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: Диаграмма потока протокола изоляции клеток, протеабилизации и склеивания. Изображение верхнего левого угла состоит из 4 изображений, показывающих фрагменты образца сердца в растворе RELAX-ISO(A)в чашкеПетри,( B ) в трубке, используемой для механической гомогенизациитканей,( C ) гомогенизатор, (D) ткани сразу после гомогенизации и (E), когда он находится в трубке для Triton permeabilization. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
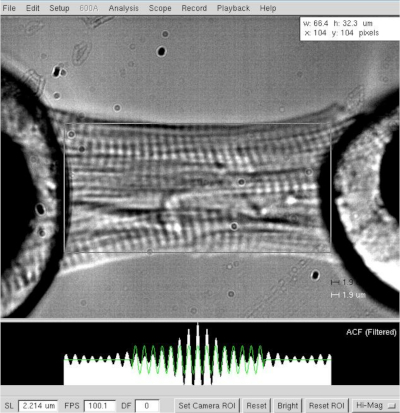
Рисунок 3: Определение длины и саркомерной длины скошенного кардиомиоцита. Определение длины и ширины ячейки при длине саркомера ≈2,2 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть более широкую версию этой фигуры.
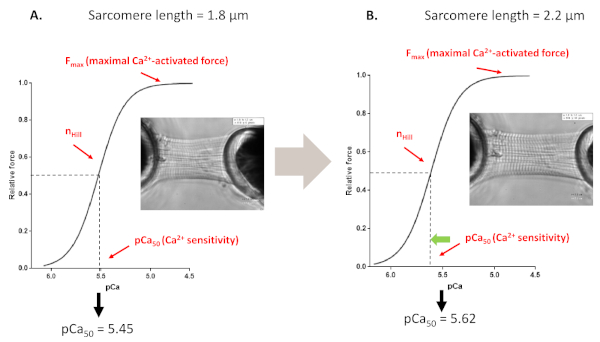
Рисунок 4: Протокол активации, зависящий от длины (имитирует механизм Франк-старлинг в пробирке). Репрезентативные следы силы и параметры, полученные изпротоколов чувствительности Myofilaments' Ca 2 , выполненных до(A, 1,8 мкм) и после растяжения кардиомиоцита до 2,2 мкм(B). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
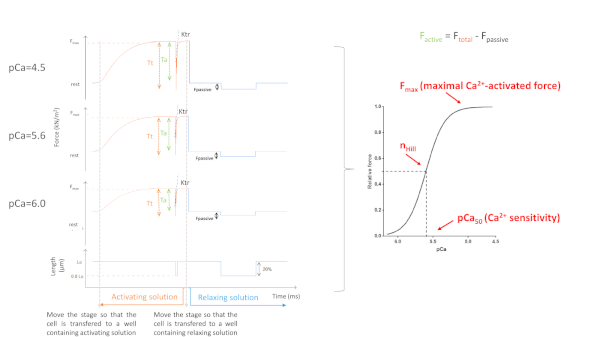
Рисунок 5: Myofilaments Ca2"-чувствительность протокола. Репрезентативные следы силы и производные параметры. Для простоты, только 3 из 8 кривых силы изображены. А именно кардиомиоцит, активированный с насыщением, промежуточныйи самый низкийCa 2 ", содержащий раствор (4,5, 5,6 и 6,0, соответственно). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 6: Репрезентативные следы от сердечной клетки мышей, активированной в различных растворах кальция и соответствующей кривой ktr fit. (A)pCa 4.5; (B)pCa 5.0; (C)pCa 5.2; (D)pCa 5.4; (E)pCa 5.6; (F) pCa 6.0 и E значения для общего, пассивного и активного напряжения, значение ktr и Rsquare для ktr fit. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
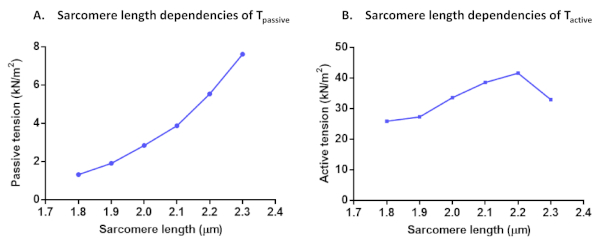
Рисунок 7: Протоколы зависимостей длины саркомера Tпассивных (A) и Tактивных (B). Пассивное напряжение и активное напряжение были рассчитаны в одном кардиомиоците на саркомерной длине от 1,8 мкм до 2,3 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть более широкую версию этой цифры.
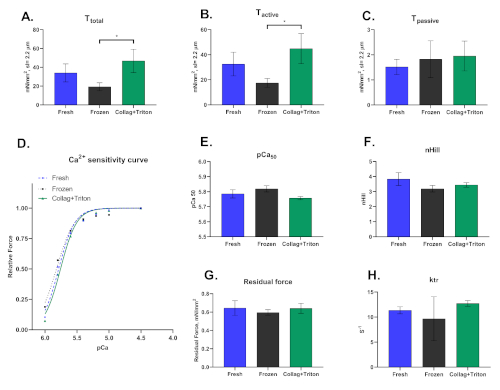
Рисунок 8: Репрезентативные результаты для кардиомиоцитов, механически изолированных от свежих ("свежих") и замороженных образцов миокарда ("Замороженные"), а также из коллагеназы переваренного сердца (модифицированная техника Ланггендорфа) с задней проницаемой с Тритоном ("Коллаг-Тритон"). Значения(A) Полное напряжение, (B) Активное напряжение и (C) Pasisve Напряжение от кардиомиоцитов активируется с pCa 4.5 раствор на саркомерной длины ≈2,2 мкм. ( D )Криваячувствительности кальция и соответствующие значения для ( E )pCa50и (F) nHill. (G)Остаточная сила и ( H )ktrзначения, рассчитанные на решение максимальной активации (pCa 4.5). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Дополнительный файл. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
| Хранить в | Фондовые решения | (М) | Окончательный том (mL) | Вес/объем | Заметки |
| 4 градусов по Цельсию | Гидроксид калия (KOH) | 1 | 100 | 5,611 г | Для регулировки рН |
| 4 градусов по Цельсию | Гидроксид калия (KOH) | 5 | 50 | 14,03 г | Для регулировки рН |
| 4 градусов по Цельсию | Bes | 1 | 50 | 10,66 г | |
| 4 градусов по Цельсию | Пропионовая кислота | 1 | 100 | 7.483 мл | Отрегулируйте рН до 7.0 с 5M или 1M KOH |
| 4 градусов по Цельсию | CaEGTA состоит из: | 0.1 | 100 | Смешайте и нагрейте раствор до 60 градусов по Цельсию в течение более 1 часа. Отрегулируйте рН до 5-6 с 1M KOH. | |
| - CaCO3 | 0.1 | 1.001 г | |||
| - Титриплекс (EGTA) | 0.1 | 3.804 |
Таблица 1: Инструкции по подготовке запасного раствора.
| RELAX-ISO (для изоляции кардиомиоцитов) | (mM) | Вес |
| Na2ATP | 5.95 | 3,28 г |
| MgCl2.6H2O | 6.04 | 1,23 г |
| Тритиплекс (EGTA) | 2 | 0,76 г |
| Kcl | 139.6 | 10,41 г |
| Имидазол | 10 | 0,68 г |
Таблица 2: Инструкции по подготовке решения Relax-ISO.
| Активированное решение (для измерений) | (mM) | Вес / объем |
| Na2ATP | 5.97 | 0,823 г |
| MgCl 1M | 6.28 | 1,57 мл |
| Пропионовая кислота | 40.64 | 10.16 мл |
| Bes | 100 | 25 мл |
| CaEGTA (предварительно подготовленное решение по акциям) | 7 | 17,5 мл |
| Na2PCr | 14.5 | 0,925 г |
Таблица 3: Инструкции по активации подготовки раствора.
| Расслабляющее решение (для измерений) | (mM) | Вес / объем |
| Na2ATP | 5.89 | 0,325 г |
| MgCl 1M | 6.48 | 0,65 мл |
| Пропионовая кислота | 40.76 | 4,08 мл |
| Bes | 100 | 10 мл |
| Титриплекс (EGTA) | 6.97 | 0,265 г |
| Na2PCr | 14.5 | 0,370 г |
Таблица 4: Инструкции по расслабляющей подготовке раствора.
| pCa -Вход (Ca2) | Расслабляющий (pCa-9.0) Мл | Ативация (pCa-4.5) Мл |
| 5 | 0.86 | 39.14 |
| 5.1 | 1.2 | 38.80 |
| 5.2 | 1.54 | 38.46 |
| 5.3 | 2 | 38.00 |
| 5.4 | 2.51 | 37.49 |
| 5.5 | 3.14 | 36.86 |
| 5.6 | 3.89 | 36.11 |
| 5.7 | 4.8 | 35.20 |
| 5.8 | 5.89 | 34.11 |
| 5.9 | 7.14 | 32.86 |
| 6 | 8.57 | 31.43 |
Таблица 5: Инструкции по подготовке решений pCa.
| Параметр | Грызунов | Свинья | Человека |
| Активное напряжение, kN.m-2 (на 2,2 мкм) | 17 – 28 | 19 – 40 | 19 – 36 |
| Пассивное напряжение, kN.m-2 (на 2,2 мкм) | 3.6 – 5.5 | 1.9 – 6.8 | 1.8 – 2.3 |
| pCa50 | 5.58 – 5.64 | 5.40 – 5.50 | 5.43 – 5.82 |
| nХилл | 2.60 – 2.76 | 2.95 – 3.36 | 2.99 – 3.10 |
| ктр, с-1 | 4.00 – 8.00 | 1.00 – 3.00 | 0.90 – 2.00 |
Таблица 6: Типичные параметры и индексы, полученные из одиночных пермякированных кардиомиоцитов от грызунов, свиней и людей. Адаптированоиз 12.
| Проблема | Возможная причина | Решение |
| Кардиомиоцит отсоединяется во время максимальной активации | Недостаточное время склеивания; Клей старый и высох | Увеличьте время шага склеивания; рассмотреть вопрос об открытии новой трубки клея. |
| Существует Triton® в растворе подвески ячейки, который больше не может быть удален | Повторите процедуру извлечения с помощью одного или двух дополнительных ® triton и вымойте шаги | |
| Кардиомиоцит имеет низкую силу в условиях контроля | Добыча пошла не так и доставила некачественные клетки | Увеличьте размер выборки и сделайе новую добычу. Если проблема сохраняется, вероятно, из-за неправильного сбора образцов - отбросить этот образец |
| Ячейка заметно затихает, но сила не регистрируется; Ячейка имеет необычные значения силы | Превантукер силы выключен | Включите его |
| Прецидуц сил не очень хорошо откалиброван | Калибровка превантикера силы с использованием набора известных весов (проверить инструкцию производителя руководства). | |
| Игла предуцера силы свободна | Клей иглы снова с помощью кристаллической связи 509 или ювелиров воска. | |
| Шаблон striation не достаточно хорош, чтобы определить длину саркомера | Недостаток света | Увеличьте свет микроскопа или переместите клетку обратно в крышку и снова оцените длину саркомера (колодцы имеют более низкую интенсивность света) |
| Добыча пошла не так и доставила некачественные клетки | Увеличьте размер выборки и сделайе новую добычу | |
| Советы игл не в одной плоскости | Используя микроманипуляторы, отрегулируйте кончики игл вверх или вниз до тех пор, пока не найме сфокусированных сармеров | |
| Отсутствие изменения длины и/или силы во время приобретения | Двигатель или препондер силы выключены | Включите их |
| Двигатель сломан и не производит сокращение клеток | Замените его или попытайтесь откалибровать с помощью генератора функций | |
| Слишком много шума на записи приобретения | Слишком много потока воздуха вокруг оборудования | Защита оборудования от прямого воздушного потока |
| Слишком много вибраций вокруг оборудования | Рекомендуется таблица стабилизации. Даже в этом случае рекомендуется удалить любое оборудование, которое может иметь компрессор или излучать вибрации (морозильник, холодильники) | |
| Кривая чувствительности Ca2имеет странные значения, и значения силы не увеличиваются с помощью«Ca 2». | Смесь активации и расслабляющего раствора не была выполнена должным образом (проверить 3.10 до 3.14 раздела методов, возможно, из-за недостаточного смешивания) | Разморозить флаконы с той же концентрацией, собрать все содержимое флакона в том же стакане, смешать с мешалки и разделить их снова. Проверьте эти решения снова в новой ячейке. Если это решит проблему, подготовь новую партию решений, содержащих Ca2 |
Таблица 7: Таблица устранения неполадок.
Обсуждение
В пробирке оценка сердечной функции с использованием кожи кардиомиоцитов представляет собой важный метод для уточнения изменений, происходящих на уровне кардиомиоцитов в физиологическом (например, стрейч) и патологического контекста (например, ишемия). Эта методология имеет ряд преимуществ, таких как требование минимального количества миокарда для оценки функции в кардиомиоцитах, полученных из разморофлированных образцов; с помощью кардиомиоцитов из широкого спектра видов(мыши 13,крыса 1,14,15, кролик16, свинья17, собака18,морская свинка 19 и человека20) и различных сердечных местах, в том числе атрии, левой и правой желудочков или конкретной области infarcted сердца. Кроме того, этот метод позволяет поставлять конкретные концентрации Ca2 и энергии (АТФ) при измерении функции нормативных и контрактных структур в их родной конфигурации.
Несмотря на простоту этой техники, есть некоторые важные шаги. Важно гарантировать качество каждого шага с самого начала, включая сбор образцов. Белки миофиламента восприимчивы к протеаз21. Таким образом, необходимо хранить образцы в жидком азоте сразу после его сбора. Свежие образцы, которые ранее не были заморожены, будут развиваться значительно выше сил, поэтому не рекомендуется смешивать измерения, выполненные в свежих и замороженных образцах в том же протоколе. Вторым наиболее важным шагом является экстракция кардиомиоцитов. Во время этой процедуры очень важно поддерживать образец на льду большую часть времени. Коктейль ингибитора вероятности может быть использован для снижения риска деградации белка во время экстракции/пермеабилизации22. В-третьих, образцы должны быть разрезаны на более мелкие кусочки с использованием точных движений скальпеля, так как мы отметили снижение качества кардиомиоцитов, когда этот шаг был проигнорирован. Другим важным шагом является мытье кардиомиоцитов, так как трудно иметь правильный баланс между промыванием Тритона (проницает клетку, но способствует ее нелюбви) и сохранением как можно большего количеством клеток в супернатанте. Важно сначала попробовать добычу и количество смывов для каждого образца, вида или протокола. Например, в наших руках, мы отметили, что зСФ1 ожирением крысы ткани извлечения имеют "жирный" аспект, который сделал эти клетки более скользкими во время склеивания, но не более трудно измерить. Мы обходят эту проблему, выполняя больше экспериментов, чтобы иметь разумное количество клеток на животное. Кроме того, очень важно выбрать хорошую ячейку для клея, а именно с хорошей полосой и разумной длины. Если кардиомиоцит не имеет этих особенностей, он будет в основном отделяться от иглы советы или развивать нет / низкая сила. Важно также использовать правильный клей для вложения кардиомиоцитов, учитывая время склеивания и его эффективность, чтобы приклеить клетку к игле. В наших руках силиконовый клей(Таблица материалов)быстро лечится (10-15 мин) и достаточно силен. Наконец, последний критический шаг связан с тщательным подъемом кардиомиоцита через 5 минут после склеивания клетки (чтобы избежать приклеивания клетки к крышке) и перед перемещением ее в скважины (чтобы клетка не тянулась к стадии микроскопа). В таблице 7 кратко излагается устранение неполадок, связанных с этим методом, его основные причины и возможные решения для преодоления частых проблем.
Основным ограничением этого метода является то, что он не может ответить на все вопросы, связанные с миофиламентом, например, как быстро активация/деактивация миофиламентов. В настройках in vivo, мембранная деполяризация, внутриклеточное увеличение Ca2 и его диффузия к миофиламентам должны произойти для того, чтобы миоциты заразились, в то время как в кожурекардиомиоцитов Ca 2 "диффузия к миофиламентам происходит сразуже, когда клетка погружается в раствор Ca 2". Это более быстрая скорость Ca2 "диффузии будет смещения myofilaments активации / деактивации анализа23.
Эти эксперименты находятся под влиянием различных факторов, в том числе температуры, раствор рН, механические возмущения (slack-re-stretch против слабину) и процедуры крепления клеток (контактный галстук против клея), все эти переменные, учитывающие литературные расхождения с точки зрения ktr и саркомерадлина-зависимое увеличение в силе 4,12.
Будущий прогресс техники включает в себя выполнение функциональных исследований в нетронутых, а не пермеабилизированных кардиомиоцитов. Этот метод имеет недостаток полагаться на кардиомиоциты свежеиспеченные (ранее не замороженные). Другой важный вопрос, непосредственно не связанный с этой методологией, но который может существенно повлиять на нее, связан с максимальным периодом замороженного хранения образцов. В частности, необходимо установить степень деградации миофиламентов на протяжении всего времени хранения (т.е. о том, как долго можно хранить замороженные образцы для обеспечения хорошего качества функциональных данных, полученных из извлеченных кардиомиоцитов).
Раскрытие информации
У авторов нет конфликта интересов.
Благодарности
Авторы благодарят Португальский фонд науки и техники (FCT), Европейский союз, Квадро де Референсия Эстратегико Насьональ (ЗРЕН), Фонд Европу де Десенвименто Региональный (FEDER) и Programa Operacional Factores de Competitividade (COMPETE) для финансирования UnIC (UID/IC/00051/2013) исследовательского подразделения. Этот проект поддерживается FEDER через COMPETE 2020 - Programa Operacional Competitividade E Internacionaliza'o (POCI), проект DOCNET (NORTE-01-0145-FEDER-000003), поддерживаемый региональной оперативной программой Norte Portugal (NORTE 2020), в рамках соглашения о партнерстве Португалии 2020, через Европейский фонд регионального развития (ERDF), проект NETDIAMOND (POCI-01-0145-FEDER-016385), поддерживаемый Европейскими структурными и инвестиционными фондами, региональная оперативная программа Лиссабона до 2020 года. Патрисия Родригес финансировалась FCT (SFRH/BD/96026/2013) и Jo'o Almeida-Coelho была Университет порту / FMUP и FSE-Fundo Социальная Европа, NORTE 2020-Programa Operacional Regional do Norte, (NORTE-08-5369-FSE-000024-Programas Doutorais).
Материалы
| Name | Company | Catalog Number | Comments |
| Acetone | Sigma | 34580 | |
| Adenosine 5’-triphosphate disodium salt hydrate (Na2ATP) | Sigma | A2383 | |
| Calcium carbonate (CaCO3) | Merck | 1.02067.0500 | |
| Imidazole | VWR | 24720.157 | |
| Magnesium chloride hexahydrate (MgCl2.6H2O) | Merck | 1.05833.0250 | |
| Magnesium chloride solution (MgCl2 1M) | Sigma | M1028 | |
| N,N-Bis(2-hydroxyethyl)taurine (BES) | Sigma | B9879 | |
| Phosphocreatine dissodium salt hydrate (Na2PCr) | Sigma | P7936 | |
| Potassium chloride (KCl) | Merck | 1.04936.1000 | |
| Potassium hydroxide (KOH) | Merck | 8.14353.1000 | |
| Propionic acid (C3H6O2) | Merck | 8.00605.0500 | |
| Silicone Squeeze Tube | Marineland | 31003 | |
| Tritiplex (EGTA) | Merck | 1.08435.0025 | |
| Triton® X-100 10% | Merck | 648463 | |
| Tissue homogeneizer (GKH GT Motor Control) | Terre Haute Glas-col | ||
| Length Controller (Model 315C-I) | Aurora Scientific | ||
| Force Transducer (Model 403 A) | Aurora Scientific | ||
| Software ASI 600A | Aurora Scientific | ||
| Sotware VSL (Model 900B) | Aurora Scientific | ||
| Inverted Microscope (IX51) | Olympus |
Ссылки
- Leite-Moreira, A. M., et al. Stretch-induced compliance: a novel adaptive biological mechanism following acute cardiac load. Cardiovascular Research. 114 (5), 656-667 (2018).
- Falcao-Pires, I., Fontes-Sousa, A. P., Lopes-Conceicao, L., Bras-Silva, C., Leite-Moreira, A. F. Modulation of myocardial stiffness by β-adrenergic stimulation - its role in normal and failing heart. Physiological Research. 60 (4), 599-609 (2011).
- Cokkinos, D. V. . Introduction to Translational Cardiovascular Research. , 371-387 (2015).
- van der Velden, J., Stienen, G. J. M. Cardiac Disorders and Pathophysiology of Sarcomeric Proteins. Physiological Reviews. 99 (1), 381-426 (2019).
- Garnier, D. Attachment procedures for mechanical manipulation of isolated cardiac myocytes: a challenge. Cardiovascular Research. 28 (12), 1758-1764 (1994).
- Brady, A. J. Mechanical properties of isolated cardiac myocytes. Physiological Reviews. 71 (2), 413-428 (1991).
- Falcao-Pires, I., Leite-Moreira, A. F., Cokkinos, D. V. Chapter 20. Introduction to Translational Cardiovascular Research. 20, 371-387 (2015).
- Liang, W. Teaching calcium-induced calcium release in cardiomyocytes using a classic paper by Fabiato. Advances Physiology Education. 32 (1), 1-10 (2008).
- Roche, S. M., Gumucio, J. P., Brooks, S. V., Mendias, C. L., Claflin, D. R. Measurement of Maximum Isometric Force Generated by Permeabilized Skeletal Muscle Fibers. Journal of Visualized Experiments. (100), e52695 (2015).
- Huxley, A. F. Muscle structure and theories of contraction. Progress Biophysics and Biophysical Chemistry. 7, 255-318 (1957).
- Sequeira, V., et al. Synergistic role of ADP and Ca(2+) in diastolic myocardial stiffness. Journal Physiology. 593 (17), 3899-3916 (2015).
- Edes, I. F., et al. Rate of tension redevelopment is not modulated by sarcomere length in permeabilized human, murine, and porcine cardiomyocytes. American Journal Physiology Regulatory Integrative Comparative Physiology. 293 (1), R20-R29 (2007).
- King, N. M., et al. Mouse intact cardiac myocyte mechanics: cross-bridge and titin-based stress in unactivated cells. Journal General Physiology. 137 (1), 81-91 (2011).
- Hamdani, N., et al. Myocardial titin hypophosphorylation importantly contributes to heart failure with preserved ejection fraction in a rat metabolic risk model. Circulation Heart Failure. 6 (6), 1239-1249 (2013).
- Miranda-Silva, D., et al. Characterization of biventricular alterations in myocardial (reverse) remodelling in aortic banding-induced chronic pressure overload. Scientific Reports. 9 (1), 2956 (2019).
- Rodrigues, P. G., et al. Early myocardial changes induced by doxorubicin in the nonfailing dilated ventricle. American Journal Physiology Heart Circulatory Physiology. 316 (3), H459-H475 (2019).
- van der Velden, J., et al. Alterations in myofilament function contribute to left ventricular dysfunction in pigs early after myocardial infarction. Circulation Research. 95 (11), e85-e95 (2004).
- Wakili, R., et al. Multiple potential molecular contributors to atrial hypocontractility caused by atrial tachycardia remodeling in dogs. Circulation: Arrhythmia Electrophysiology. 3 (5), 530-541 (2010).
- Ait Mou, Y., le Guennec, J. Y., Mosca, E., de Tombe, P. P., Cazorla, O. Differential contribution of cardiac sarcomeric proteins in the myofibrillar force response to stretch. Pflugers Archiv. 457 (1), 25-36 (2008).
- Falcao-Pires, I., et al. Diabetes mellitus worsens diastolic left ventricular dysfunction in aortic stenosis through altered myocardial structure and cardiomyocyte stiffness. Circulation. 124 (10), 1151-1159 (2011).
- Lim, C. C., et al. Anthracyclines induce calpain-dependent titin proteolysis and necrosis in cardiomyocytes. Journal Biology Chemistry. 279 (9), 8290-8299 (2004).
- Woulfe, K. C., et al. A Novel Method of Isolating Myofibrils From Primary Cardiomyocyte Culture Suitable for Myofibril Mechanical Study. Frontiers Cardiovascular Medicine. 6, 12 (2019).
- Ait Mou, Y., Bollensdorff, C., Cazorla, O., Magdi, Y., de Tombe, P. P. Exploring cardiac biophysical properties. Global Cardiology Science Practice. 2015, 10 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены