Method Article
التصور والتقدير الكمي للبيانات الخلوية عاليه الابعاد باستخدام سيتوسياست وأساليب التجميع المنبع FlowSOM و Cytosplore
In This Article
Summary
سيتوصوم هو أداه التصور المستخدمة لتحليل المخرجات من التجميع. يمكن استخدام سيتوسياست للمقارنة بين طريقتين للتجميع: Flowsom و cytosplore. يمكن ان تولد السرعة الخلوية نظره عامه كميه ونوعيه لبيانات القياس الخلوي الشامل وتسلط الضوء علي الاختلافات الرئيسية بين خوارزميات التجميع المختلفة.
Abstract
وقد استلزم تعقيد البيانات المتولدة عن القياس الخلوي الشامل أدوات جديده لتصور النتائج التحليلية بسرعة. تستخدم أساليب التجميع مثل Cytosplore أو flowsom لتصور وتحديد كتل الخلايا. للتحليل المصب ، حزمه R المطورة حديثا ، سيتوصوم، يمكن ان تولد التصور السريع للنتائج من أساليب التجميع. ياخذ النظام الخلوي بعين الاعتبار التوصيف الظاهري لمجموعات الخلايا ، ويحسب وفره كتله الخلية ، ثم يقارن كميا بين المجموعات. يشرح هذا البروتوكول تطبيقات الخلايا الخلوية لاستخدام البيانات الخلوية الشاملة استنادا إلى تحوير الجهاز المناعي في البيئة المجهرية للورم (اي القاتل الطبيعي [NK] استجابه الخلية) عند التحدي الورم يليه العلاج المناعي (الحصار PD-L1). يظهر إظهار فائده السرعة الخلوية مع Flowsom و cytosplore . السيتوسريع يولد بسرعة تمثيلات بصريه من مجموعات الخلايا المناعية المرتبطة بالمجموعة والعلاقات مع تكوين الجهاز المناعي. يتم ملاحظه الاختلافات في تحليل التجميع ولكن الفصل بين المجموعات مرئية مع كل من أساليب التجميع. السيتوسريع يظهر بصريا أنماط الناجمة عن العلاج PD-L1 التي تشمل وفره اعلي من المجموعات الفرعية الخلية المنشطة NK ، معربا عن كثافة اعلي من علامات التنشيط (اي ، CD54 أو CD11c).
Introduction
يتيح القياس الخلوي الشامل (قياس الخلايا الخلوية عن طريق وقت الطيران ، أو سايتوف) الكشف عن مجموعه واسعه من المؤشرات الحيوية داخل الخلية أو خارجها في ملايين الكريات الواحدة. الطبيعة العالية الابعاد للبيانات الخلوية الشاملة تتطلب أدوات تحليل معينه ، مثل تقنيات تجميع الخلايا مثل الأسماء المسمية1، مخططات الانسيابية2، flowmaps3، الفيغراف4، الدوامة5، وخرائط السقالة6. الاضافه إلى ذلك ، تم تطوير تقنيات الحد من الابعاد المختلفة (اي تحليل المكونات الرئيسية [PCA]7، t-توزيع الجار العشوائية تضمين [t-sne]8، الهرمية المجاورة العشوائية تضمين [hsne]9، تقريب متعددة موحده والإسقاط [umap]10، ونشر الخرائط11
غالبا ما يفتقر التحليل النهائي للتدفق العالي الابعاد والبيانات الخلوية الجماعية إلى عمليات تلقائية لاجراء اختبارات احصائيه علي تردد المجموعات والروابط مع النتائج السريرية. في السابق ، قمنا بتطوير سير العمل القائم علي R المعروف باسم السيتوسريع12، والذي يسمح بالتحليلات المرئية والكمية لتقنيات التجميع بواسطة Cytosplore أو flowsom.
يوضح البروتوكول الموصوف هنا استخدام السرعة الخلوية في R ويوضح كيفيه توليد خرائط الحرارة الكمية والنوعية والرسوم البيانية. وعلاوة علي ذلك ، فانه يسهل تحديد الصلات بين الظواهر المناعية التي لوحظت والنتائج السريرية. يصف هذا التقرير أيضا تحليل مجموعه بيانات قياس الخلايا الخلوية المحددة باستخدام اثنين من إجراءات التجميع المختلفة: Flowsom و Cytosplore. باستخدام سيتوصوم مع كل من أساليب التجميع ، فانه يظهر في المقابل ان النمط الظاهري التنشيط من الخلايا NK يتاثر بالحصار نقطه التفتيش المناعي PD-L1.
Protocol
تمت الموافقة علي جميع التجارب الحيوانية من قبل لجنه التجارب الحيوانية من LUMC وأعدم وفقا للمبادئ التوجيهية التجارب الحيوانية لل LUMC امتثالا للمبادئ التوجيهية للجان الهولندية والاوروبيه.
ملاحظه: بالنسبة لمجموعه تجريبية ، C57BL/6 الفئران جلد تطعيم علي الجناح الأيمن مع ورم القولون MURINE MC38 في تركيز 0.3 × 106 خلايا/200 μl من الفوسفات-مخزنه المالحة (تلفزيوني). بعد 10 أيام ، عندما كانت الأورام محسوسة ، عولجت الفئران مع الأجسام المضادة لحجب PD-L1 (استنساخ MIH ، 200 ميكروغرام/الماوس ، حقن داخل الصفاق) أو كانت وهميه المعالجة. وقد تم تقسيم الأورام بعد 3 أيام بعد حقن PD-L1 ، ومعالجتها الجسم السابق ، وتحليلها من قبل سيتوف الكتلة الخلوية باستخدام علامات 3813.
1. المعدات والبرمجيات لتحليل البيانات
ملاحظه: استخدام الكمبيوتر (ويندوز 7 أو أحدث) والمعالج I5 في 2.4 GHz أو ما يعادلها ، والذاكرة المثبتة RAM 6 غيغابايت ، و 10 غيغابايت من مساحة القرص الصلب الحرة. الحزمة R سيتوسريع يستخدم الوظائف الموجودة: أساسا flowcore، فياتماب، و ggplot. يتم تضمين أسطر الأوامر التي سيتم تنفيذها في R في البروتوكول. يمكن العثور علي المورد للحصول علي تعليمات R في https://education.rstudio.com/.
- لتثبيت حزمه سيتوfast ، بدء R (الإصدار "3.6") وتثبيت بيوككتور الإصدار 3.9 عن طريق إدخال التعليمه البرمجية التالية:
إذا كان (! ريكورينامسبيس ("الاداره الحيوية" ، بهدوء = TRUE))
تثبيت. حزم ("الحيوية مدير")
الاداره الحيوية:: تثبيت ("السرعة الخلوية") - تاكد من تحميل الحزمة في البيئة المطلوبة عن طريق تشغيل ما يلي:
مكتبه (سيتوصوم)
2-إنشاء التكتلات
ملاحظه: لعرض طريقتي التجميع Cytosplore و flowsom مع سيتوصوم، وخلايا NK (CD161 +) في الورم الصغرى البيئة 3 أيام بعد تحليل PD-L1 العلاج.
- التجميع الذي يقوم بهCytosplore
- بعد تحميل وتثبيت Cytosplore، استضافت في < www. > ، تحميل ملفات. fcs (الملفاتالتكميلية 1.1 – 1.8 [cytosplore ملفات الإدخال]) بالنقر فوق ملف | فتح FCS ملف (s) في Cytosplore. أضافه علامة نموذج فريد كقناة بالنقر فوق أضافه علامة نموذج فريد كقناة عند المطالبة وتحديد عامل مساعد لتحويل arcsinh القطعي (الافتراضي هو 5).
- حدد تشغيل H-SNE، قم بتشغيل مستوي hsne من 3 ، وانتظر حتى يتم إنشاء الخريطة.
ملاحظه: قد تتطلب هذه الخطوة بعض الوقت ، اعتمادا علي عدد الخلايا التي تم تحليلها ومستوي HSNE الذي تم اختياره. - علي مستوي HSNE الأول ، تحقق من الخلايا التي تكون موجبه ل CD161. حدد الخلاياCD161 + وانقر بزر الماوس الأيمن فوق تكبير/تصغير في التحديد. في المستوي الثاني ، كرر الاجراء للوصول إلى المستوي الثالث مع فقطCD161 + الاحداث.
- مره واحده يتم إنشاء الخريطة tSNE آخر ، حفظ الكتل المعرفة من قبل Cytosplore عن طريق النقر بزر الأيمن علي الخريطة tsne واختيار حفظ الكتل. اختر دليل ملفات الإخراج كما هو مدفوع من قبل Cytosplore ولاحظ هذا الموقع ، لأنه سيتم استخدام هذا الدليل ثم تحميل ملفات. Fcs إلى R.
ملاحظه: يمكن تغيير عدد المجموعات الفرعية يدويا عن طريق تغيير قيمه سيغما. يتم تعيين قيمه سيغما بشكل افتراضي في 30; ومع ذلك ، يعتمد العدد الفعلي لمجموعات فرعيه علي الإدخال. هنا ، اكتشفت Cytosplore 10 مجموعات فرعيه مختلفه ، مع كل ملف يمثل مجموعه جزئيه واحده. - استخدم اسما بسيطا (الأحرف فقط) عند أعاده تسميه ملفات الإخراج ، والتي ستجعل التعريف والمزيد من المعالجة أسهل. حفظ ملفات الإخراج عن طريق تحديد حفظ.
ملاحظه: بعد الحفظ ، يتم إنشاء مجلد بواسطة cytosplore مع ملفات. fcs ، مع كل ملف المطابق للمجموعات المحددة في cytosplore. الخطوة التالية سيتم تحميل الملفات إلى R بمساعده سيتوصوم. هنا ، يتم توفير ملفات الإخراج التي تم إنشاؤها في ملفات تكميليه 2.1 – 2.10 (ملفات إخراج cytosplore). - تحميل ملفات الإخراج التي تم إنشاؤها بواسطة Cytosplore إلى R مع الدالة المعينة: readCytosploreFCS.
ال< dirFCS-"C:\\users\username\\doctortolort"
cfData <-readCytosploreFCS (dir = dirFCS ، colNames = "الوصف") - تنظيف البيانات عن طريق أزاله بعض المعلمات مثل "الوقت" و "الخلفية". تحقق من موضع العمود المتعلق بمعلماته غير الضرورية وقم بإزالته من المصفوفة.
الأسماء (cfData@expr)
cfData@expr <-cfData@expr [،-ج (3 ، 4 ، 6 ، 8:10 ، 46:49 ، 51:54)]
ملاحظه: يمكن مشاهده الاعمده غير الضرورية عن طريق قراءه أسماء الاعمده من المصفوفة التي تم إنشاؤها. عن طريق تشغيل colnames (cfData@expr) مره أخرى ، تاكد من ان يتم الحصول علي المعلمات المطلوبة فقط. - أعد ترتيب العلامات بحيث يتم عرض علامات النسب أولا ، متبوعه بعلامات وظيفية.
cfData@expr <-cfData@expr [، ج (1 ، 2 ، 3 ، 35 ، 36 ، 31 ، 9 ، 10 ، 18 ، 8 ، 37 ، 20 ،
29 ، 40 ، 5 ، 30 ، 33 ، 11 ، 34 ، 14 ، 19 ،
32 ، 28 ، 6 ، 7 ، 4 ، 12 ، 13 ، 17 ، 16 ، 15 ،
21 و 22 و 24 و 25 و 26 و 27 و 38 و 39) [
ملاحظه: الخطوة 2-1-8 اختياريه. - ربط ملف بيانات الفوقية للبيانات التي تم إنشاؤها من cytosplore عن طريق تحميل ملف تعريف جدول البيانات التي تحتوي علي المعلومات السريرية (التكميلية 3).
مكتبه (readxl)
ال< الفوقية-read_excel ("C:\\users\username\\doct\\\ sample_id. xlsx")
cfData@samples <-البيانات. الإطار (meta)
ملاحظه: يتم الآن الانتهاء من التجميع الذي يتم تنفيذه بواسطة Cytosplore . خيار التجميع بديل ل Cytosplore هو flowsom وهو موضح في القسم 2.2. بمجرد تنفيذ أحدي خطوتي التجميع ، تابع خطوه المرئيات (القسم 3).
- التجميع الذي يقوم بهFlowSOM
- أولا تثبيت Flowsom في R عن طريق تشغيل الأمر التالي:
إذا كان (! ريكورينامسبيس ("الاداره الحيوية" ، بهدوء = TRUE))
تثبيت. حزم ("الحيوية مدير")
بيومانجر:: تثبيت ("FlowSOM")
مكتبه (فلوسوم) - قم بتثبيت حزمه flowCore باستخدام أسلوب مشابه وتحميله في البيئة عن طريق تشغيل ما يلي:
إذا كان (! ريكورينامسبيس ("الاداره الحيوية" ، بهدوء = TRUE))
تثبيت. حزم ("الحيوية مدير")
بيومانجر:: تثبيت ("flowCore")
مكتبه (فلوسوم) - تحميل البيانات الاوليه المتوفرة في الملفات التكميلية 4.1 – 4.8 (FCS flowsom الإدخال) ، التي كانت بوابات مسبقا علي CD161 + الاحداث ، في R مع الدالة قراءه. فلوتيمجموعه.
fcs_raw <-القراءة. flowSet (المسار = "C:\\users\username\\doct\\tolettatit" ، نقش = "fcs" ، التحويل = FALSE ، truncate_max_range = FALSE ، البذور = 123) - حدد العلامات البيولوجية ذات الصلة (أزاله "الخلفية" أو "الوقت") عن طريق تحديد الاعمده المناسبة وتحويل البيانات بطريقه arcsinh5 كما هو موضح في التعليمات البرمجية أدناه (هنا ، أزاله الاعمده 1 ، 2 ، 4 ، 5 ، 6 ، 17 ، 21 ، 24 ، 25 ، 34 ، 35 ، 51 38 37 تطبيق عامل مساعد من 5 كما سبق تطبيقها مع cytosplore، عن طريق اختيار مساعد = 5 في الدالة أدناه.
fcs_raw <-fsApply (fcs_raw ، وظيفة (س ، العامل المساعد = 5) {
الأسماء (x) < fcs_raw [[1]] @parameters @data $ desc
expr <-exprs (x)
expr <-asinh (expr [،-c (1 ، 2 ، 4 ، 5 ، 6 ، 17 ، 21 ، 24 ، 25 ، 34 ، 35 ، 37 ، 38 ، 51)]/cofactor)
exprs (x) <-expr
العودة (x)}) - كتله البيانات باستخدام الدالة Flowsom . لمقارنه Flowsom و cytosplore، اختر لتجميع البيانات في عشر مجموعات فرعيه كالاخراج الذي تم إنتاجه مسبقا بواسطة cytosplore.
fsom <-فلوسوم (fcs_raw ، التحويلية = FALSE ، مقياس = FALSE ،
تحجيم. توسيط = FALSE ، تحجيم. مقياس = FALSE ، صامت = FALSE ، colsToUse = c (1:37) ،
nClus = 10 ، maxMeta = 10 ، اهميه = NULL ، البذور = 123)
ملاحظه: يمكن تغيير هذا يدويا بواسطة المستخدم. - تعيين كل خليه إلى المجموعة الفرعية المحددة ومعرف العينة.
subset_id <-كعامل (fsom $ فلوسوم $ خريطة $ رسم الخرائط [, 1])
المستويات (subset_id) <
رئيس (subset_id) - تحميل ملف بيانات التعريف في R (متوفر في الملف التكميلي 5) الذي يحتوي علي تعيين المجموعة وربطه بملفات. fcs.
sampleid <-الread_excel ("C:\\users\username\\doct\\\ sample_id. xlsx")
سامبلييد <-نا. حذف (سامبلييد)
sampleid $ sampleID <-كعامل (sampleid $ sampleID)
مجموعه سامبلييد $ <-كعامل (مجموعه سامبلييد $)
sampleid $ CSPLR_ST <-كعامل (sampleid $ CSPLR_ST)
سامبلييد <-كاطار البيانات (سامبلييد)
الأسماء (sampleid) [3] <-"sampleID"
sampleID <-lapply (fsom $ FlowSOM $ البيانات الوصفية ، وظيفة (س) {rep (x [1] ، كل = طول (x [1]: x [2])))})
attr (sampleID ، ' أسماء ') <-NULL
sampleID < كعامل (إلغاء القائمة (سامبلييد))
sampleid <-البيانات. الإطار (سامبلييد)
المستويات (sampleID) <-لصق ("ID" ، 1: dim (sampleid) [1] ، sep = "_")
df <-البيانات. الإطار (subset_id ، sampleID ، fsom $ فلوسوم $ البيانات [، c (1:37)])
أعاده تسميه <-البيانات. الإطار (colpar = fcs_raw [[1]] @parameters @data $ desc)
الأسماء (df) <-c ("كلوستريد" ، "sampleID" ، أعاده تسميه $ colnames [c (1:37)])
df $ كلوسترينيد <-كعامل (df $ كلوسترريد)
df $ sampleID <-كعامل (df $ sampleID) - إنشاء cfList استنادا إلى dataframe الحصول عليها من Flowsom بواسطة تشغيل البرنامج النصي التالي:
cfData <-cfList (عينات = sampleid ،
expr = df) - أعاده ترتيب علامات لتظهر علي نحو مماثل للإخراج من تحليل Cytosplore .
cfData@expr <-cfData@expr [، جيم (1 ، 2 ، 34 ، 36 ، 37 ، 10 ، 23 ، 24 ، 31 ، 22 ،
38 ، 15 ، 8 ، 3 ، 27 ، 9 ، 11 ، 28 ، 35 ، 26 ،
14 ، 33 ، 17 ، 20 ، 21 ، 18 ، 25 ، 29 ، 13 ،
30 ، 12 ، 16 ، 32 ، 4 ، 5 ، 6 ، 7 ، 19 ، 39)]
ملاحظه: تم الآن الانتهاء من التجميع بواسطة flowsom . بعد ذلك ، قم بتنفيذ التصور لإخراج التجميع.
- أولا تثبيت Flowsom في R عن طريق تشغيل الأمر التالي:
3. التصور: تحليل التجميع بعد المعالجة
ملاحظه: هذه الخطوة هي الطريقة الشائعة لكل من أساليب التجميع. ولذلك ، يمكن تنفيذه بعد تجميع اما مع Flowsom أو Cytosplore.
- قبل إنشاء خرائط الحرارة ، إنشاء جدول العد لكل نموذج باستخدام الخلايا الدالة كما هو موضح في التعليمات البرمجية أدناه. وبما ان بعض التكتلات تحتوي علي خلايا اقل من غيرها ، فانها تقوم بقياس البيانات لكل مجموعه عن طريق تحديد "المقياس = TRUE" داخل الخلية الوظيفية ، بحيث يمكن رؤية التشتت بين العينات بسهوله.
cfData <-سيلتهم (cfData ، التردد = TRUE ، مقياس = TRUE)
ملاحظه: يمكن الآن تصور البيانات. - تصور مع خريطة الحرارة.
ملاحظه: واحده من الوظائف الرئيسية لهذه الحزمة هي الخرائط الخلوية ، والتي تستخدم لتصور النمط الظاهري للمجموعات التي تم إنشاؤها ، فضلا عن تغايرها فيما يتعلق بالعينات.
الخرائط الخلوية (cfData ، المجموعة = "المجموعة" ، وسيله الإيضاح = TRUE) - التصور مع boxplotsات
ملاحظه: يمكن تمثيل البيانات بطريقه كميه عن طريق استدعاء داله cytoBoxplotsات. يمثل إخراج هذه الدالة نسبه كل نموذج لكل مجموعه.- إنشاء عدد الخلايا كما تم في الخطوة 3.1 ولكن لا تحجيم البيانات للحصول علي تكرار كل كتله.
cfData <-سيلتهم (cfData ، التردد = TRUE ، مقياس = FALSE)
cytoBoxplotsات (cfData ، المجموعة = "المجموعة")
- إنشاء عدد الخلايا كما تم في الخطوة 3.1 ولكن لا تحجيم البيانات للحصول علي تكرار كل كتله.
- التصور مع متوسط كثافة اشاره الرسم البياني
ملاحظه: يمكن أيضا تصور البيانات من خلال تمثيل الرسم البياني اشاره كثافة متوسط.- تصور شده التعبير من ثلاث علامات: CD45 ، CD11c ، و CD54.
- تحقق من أسماء العلامات المطلوبة عن طريق استدعاء السطر التالي. لاحظ أسماء العلامات وتضمينها في الدالة مسارسم.
الأسماء (cfData@expr)
ملاحظه: هنا ، التركيز علي CD45 ، CD11c ، و CD54. تحقق من الإملاء الدقيق للعلامات واضبط إذا لزم الأمر:
المؤامرة (cfData ، علامات = c ("89Y_CD45" ، "167Er_CD11c" ، "164Dy_CD54") ، byGroup = ' المجموعة ')
النتائج
الهدف من سير العمل السريع (الشكل 1) هو توفير نظره عامه كميه ونوعيه للبيانات التي تم تجميعها أصلا بواسطة برمجيات التحليل (اي Flowsom أو cytosplore). يعمل السيتوسريع علي العديد من المخرجات الممكنة ، بما في ذلك خريطة الحرارة لجميع المجموعات المحددة في التحليل واستنادا إلى تعبير العلامة (الشكل 2 والشكل 3). تمثل الكتل الموجودة في الأعلى التشابه الهرمي بين المجموعات المحددة. تعرض اللوحة العلوية خريطة للحرارة أخرى تبين الكمية النسبية لمجموعات فرعيه مناظره في كل عينه. يظهر ال [شروغرم] علي الحق التشابه بين عينات وأسست علي تجميع هرمية ينجز علي ال [اقليدين] ابعاد بين عينات. يتم عرض خرائط الحرارة المجمعة ل Flowsom متبوعه بالسرعة الخلوية في الشكل 2 و Cytosplore متبوعا بالسرعة الخلوية في الشكل 3. ويمكن أيضا ان تستخدم سيتوسياست لتقديم البيانات كميا وعرض النتائج في boxplotsات (باستخدام cytoBoxplotsات وظيفة) ، كما هو مبين في الشكل 4 والشكل 5.
وتم العثور علي مجموعات مماثله بين الطريقتين المختلفتين (علي سبيل المثال ، المجموعة 8 من Cytosplore تقابل المجموعة 10 من فلوسوم) ، وكان التعبير المشترك لبعض العلامات المثبطة مثل PD-1 و LAG-3 لا يزال ظاهرا في كلا الأسلوبين). وقد سمحت كلتا طريقتي التجميع بالتمييز بين PD-L1 مقابل. [ببس] يعامل فيران. وفي المقابل ، يمكن تسليط الضوء علي بعض الاختلافات بين الأسلوبين. ويحدد فلوسوم مجموعتين (mhc-ii +) ، بينما يظهر cytosplore كتله واحده فقط (mhc-ii + dim). ويرجع ذلك إلى استراتيجية النابضة الاوليه التي تم فيها بوابات الخلايا NK يدويا عليCD161 + الخلايا ، ثم معالجتها من قبل flowsom. ومع ذلك ، Cytosplore تلقائيا بوابات الخلايا منCD45 + السكان علي مستوي hsne الاولي ، التي تم تجميعها ثم في مستوي اعلي التسلسل الهرمي. وهكذا ، Cytosplore تعريف الخلايا الفرعية الخلية NK أكثر دقه من كيفيه الصب اليدوي تركز علي CD161. ومع ذلك ، فقد تم الحفاظ علي التجميع الهرمي للعينات ، كما هو مبين في الخشب الفاصل علي اليمين ، مشيرا إلى ان الفصل بين المجموعتين (PD-L1 والتلفزيوني) لا يعتمد علي طريقه التجميع المختارة.
يمكن تعريف عدد الكتل يدويا باستخدام كلا الأسلوبين. تمكن الخلوي المستخدم من تقييم تغاير بياناته ويمكنه تقديم نظره ثاقبه حول كيفيه اختيار عدد المجموعات التي يجب تقسيم البيانات اليها. يتم تضمين الميزات الأخرى في حزمه سيتوسباست ، مثل وظيفة مسارض (الخطوة 3.4) ، والتي تبين متوسط كثافة اشاره (MSI) المؤامرة من كل علامة لكل مجموعه (الشكل 6 والشكل 7). تسمح هذه الدالة بالكشف عن التغييرات العالمية ، مثل الزيادات في التعبير CD54 أو CD11c في خلايا ناغورني كاراباخ من المجموعة المعالجة PD-L1. يمكن دمج الميزات الاختيارية في الحزمة الخلوية السريعة ، مثل عرض البيانات في الرسوم البيانية الشريطية وغيرها من أساليب تمثيل البيانات. ويتطلب هذا الأخير أضافه أدوات ggplot ، والتي يمكن ان تتولد من R.
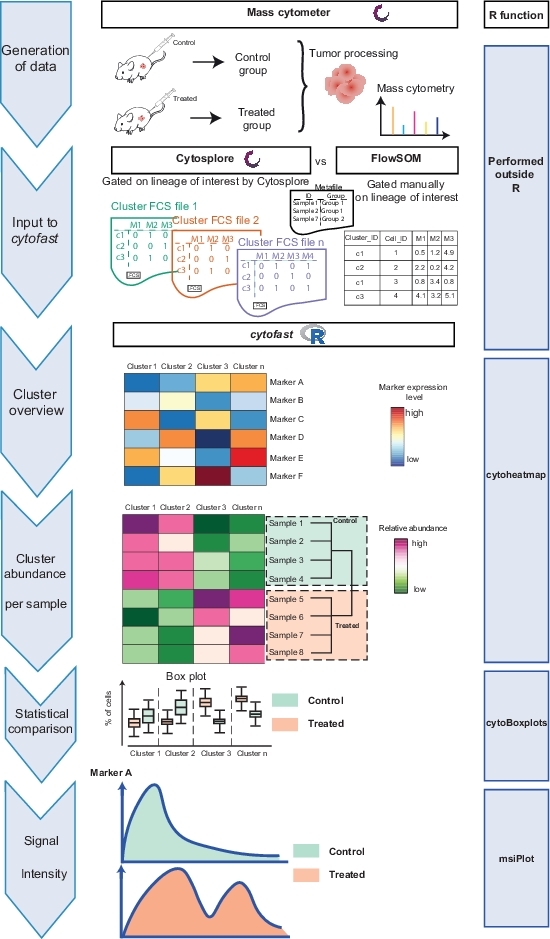
الشكل 1: سير العمل في حزمه السرعة الخلوية . وقد تم توليد البيانات عن طريق القياس الخلوي الجماعي من الورم بعد 3 أيام من العلاج بالمعالجة المناعية أو ترك دون علاج. تمت مقارنه اثنين من تقنيات التجميع المختلفة: Cytosplore و flowsom. واستخدمت السرعة الخلوية لتصور الاختلافات بين التقنيتين. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
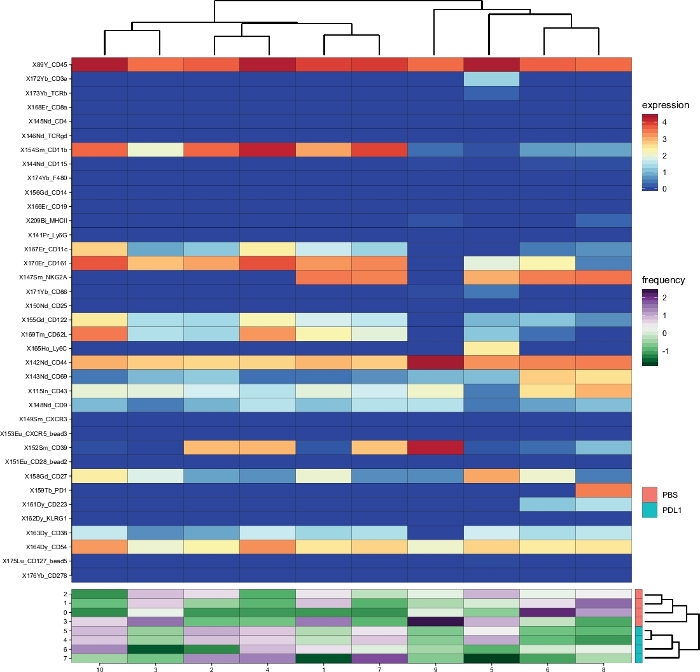
الشكل 2: نظره عامه علي المجموعة ووفره المجموعات لكل مجموعه كما تم تحليلها بواسطة سيتوبلوتورالتالي للخلايا الخلوية . خريطة الحرارة لجميع الكتل الخلية NK (CD161 + الخلايا المعرفة تلقائيا من قبل Cytosplore) ، التي تم تحديدها بعد 3 أيام من العلاج المناعي (PD-L1). وتستند البيانات المعروضة علي التكتلات Cytosplore وتجميعها من المجموعات المعالجة وغير المعالجة PD-L1. يتم عرض مستويات علامة التعبير المحولة ArcSinh5 علي مقياس قوس قزح. وفي اللوحة السفلي ، يتم تمثيل الوفرة النسبية لكل عينه بالمقياس الأخضر إلى الأرجواني. يمثل الشكل الموجود علي اليمين التشابه بين العينات استنادا إلى الترددات الفرعية. يمثل مقياس التردد تشتت الوسط. يتم تمثيل منخفضه أو عاليه التردد باللون الأخضر أو الأرجواني ، علي التوالي. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
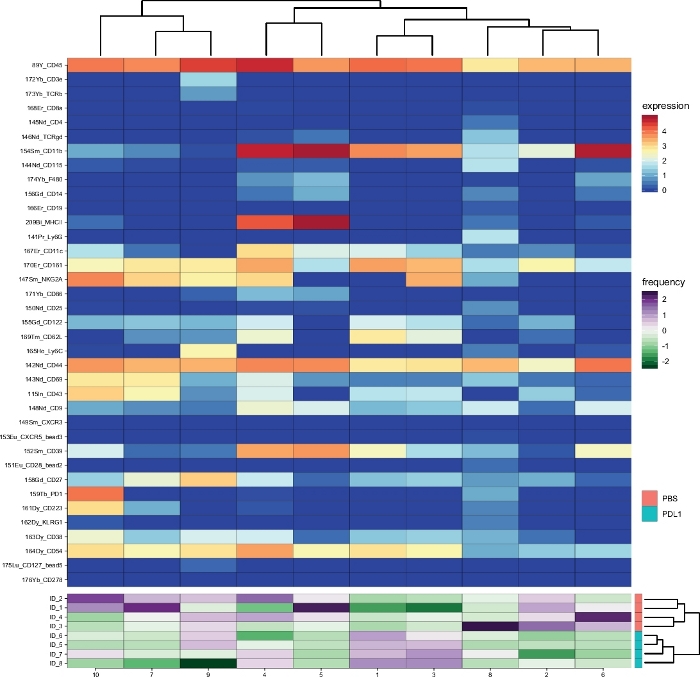
الشكل 3: نظره عامه علي المجموعة ووفره المجموعات لكل مجموعه كما تم تحليلها بواسطة سيتوسوم التالية. خريطة الحرارة لجميع الكتل الخلية NK (قبل بوابات عليCD161 + الاحداث) ، التي تم تحديدها بعد 3 أيام من العلاج المناعي (PD-L1). وتستند البيانات المعروضة علي التكتلات Flowsom وتجميعها من المجموعات المعالجة و PD-L1 معالجتها. يتم عرض مستويات علامة التعبير المحولة ArcSinh5 علي مقياس قوس قزح. وفي اللوحة السفلي ، يتم تمثيل الوفرة النسبية لكل عينه بالمقياس الأخضر إلى الأرجواني. يمثل الشكل الموجود علي اليمين التشابه بين العينات استنادا إلى الترددات الفرعية. يمثل مقياس التردد تشتت الوسط. يتم تمثيل منخفضه أو عاليه التردد باللون الأخضر أو الأرجواني ، علي التوالي. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
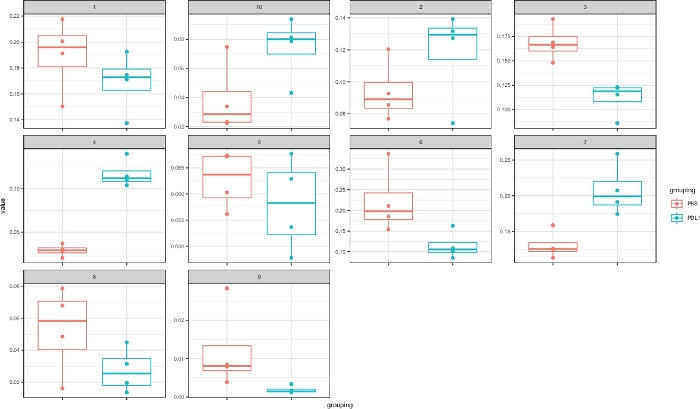
الشكل 4: التمثيل السريع للخلايا مع مربعات الكتل المحددة بواسطة cytosplore. يتم تمثيل تردد كل كتله في مخطط مربع ، مفصوله إلى مجموعتين (التلفزيونية و PD-L1). واحده نقطه فرديه يماثل إلى واحده فاره. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
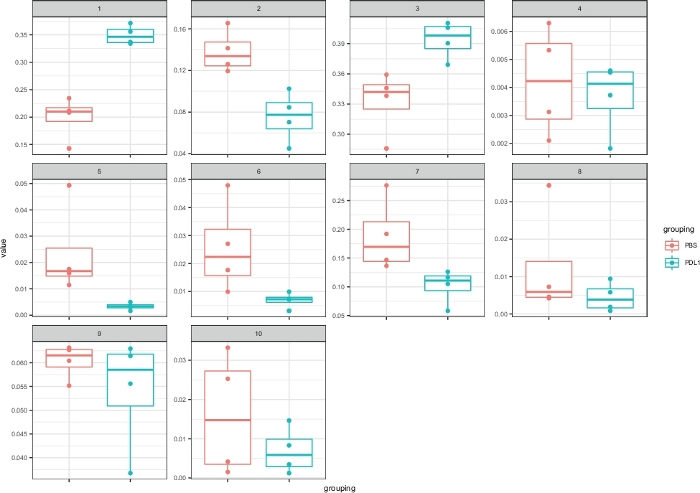
الشكل 5: التمثيل السريع للخلايا مع مربعات الكتل المحددة بواسطة flowsom. يتم تمثيل تردد كل كتله في مخطط مربع ، مفصوله إلى مجموعتين (التلفزيونية و PD-L1). واحده نقطه فرديه يماثل إلى واحده فاره. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
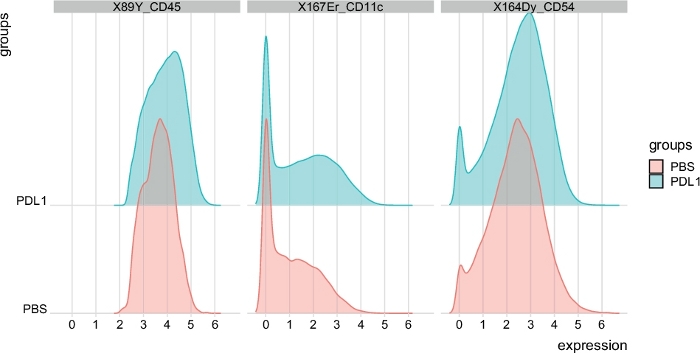
الشكل 6: توزيع مخططات كثافة الإشارات من خلايا ناغورني كاراباخ التي يتم بواباتها تلقائيا بواسطة Cytosplore. يتم عرض توزيع كثافة الاشاره في الرسم البياني لثلاث علامات محدده: CD45 ، CD11c ، و CD54. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
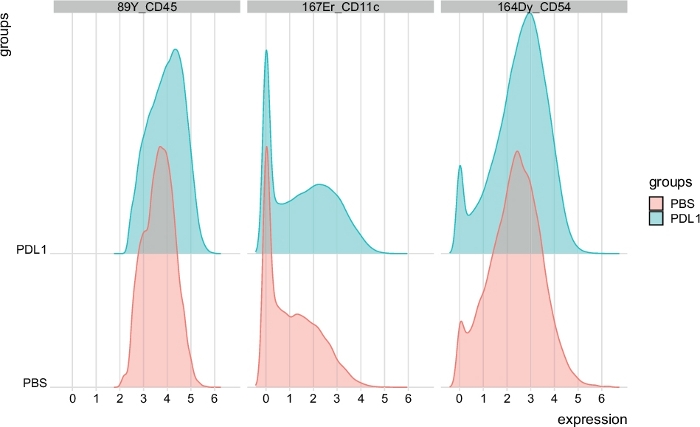
الشكل 7: توزيع مخططات كثافة الإشارات من خلايا ناغورني كاراباخ التي يتم بواباتها تلقائيا بواسطة فلوسوم. يتم عرض توزيع كثافة الاشاره في الرسم البياني لثلاث علامات محدده: CD45 ، CD11c ، و CD54 ، مفصوله بمجموعات تلفزيونيه و PD-L1. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
الملفات التكميلية 1.1 – 1.8. الرجاء انقر هنا لعرض هذا الملف (انقر بزر الماوس الأيمن للتحميل).
الملفات التكميلية 2.1 – 2.10. الرجاء انقر هنا لعرض هذا الملف (انقر بزر الماوس الأيمن للتحميل).
الملف التكميلي 3. الرجاء انقر هنا لعرض هذا الملف (انقر بزر الماوس الأيمن للتحميل).
الملفات التكميلية 4.1 – 4.8. الرجاء انقر هنا لعرض هذا الملف (انقر بزر الماوس الأيمن للتحميل).
الملف التكميلي 5. الرجاء انقر هنا لعرض هذا الملف (انقر بزر الماوس الأيمن للتحميل).
Discussion
سيتوكويك هي أداه حسابيه سريعة توفر استكشافا سريعا وعالميا لبيانات القياس الخلوي من خلال تسليط الضوء علي المجموعات الفرعية الخلوية الخاصة بالعلاج وتحديدها كميا. يهدف البروتوكول الموصوف إلى اجراء المزيد من تحليلات التجميع مع Cytosplore أو flowsom. أدوات تحليل التجميع الأخرى مناسبه للسيتوصوم، ولكن هذا يتطلب استخدام سيتوصوم لتعيين كل خليه إلى مجموعه فرعيه. السيتوسريع، ومع ذلك ، ليس أسلوب تجميع ، التالي يتطلب تجميع الإجراءات قبل الاستخدام.
واظهر التحليل الذي اجري هنا ان بعضCD161 + NK خليه مجموعات فرعيه في البيئة المجهرية الورم كانت حساسة للحصار PD-L1. وقد تجلي ذلك في التغيرات في النمط الظاهري والوفرة ، التي لوحظت باستخدام كل من Cytosplore و flowsom كاساليب التجميع. تميز كلا الأسلوبين كتله الخلية NK الرئيسية (CD11b + NKG2A +) مع ترددات مختلفه قليلا (15 ٪-20 ٪ ل cytosplore، 30 ٪-40 ٪ ل flowsom). ولم تؤثر الاختلافات في الوفرة وهذا التقريب علي النمط العالمي ، لان كلا من الشروج المعروضة في اللوحات اليمني من الشكل 2 والشكل 3 أظهرت نتائج مماثله. باستخدام سيتوصوم، التالي فمن الممكن (مستقله عن طريقه التجميع المختار) لفصل الفئران PD-L1 المعالجة وغير المعالجة علي أساس تحليلات من النمط الظاهري كتله الخلية NK ووفره.
وتبعا للمعلمات المسجلة ، يلزم إدخال تعديلات علي البروتوكول. وعلي وجه التحديد ، يجب أزاله بعض المعلمات مثل الوقت والخلفية اثناء تنفيذ تحليل التجميع. بالاضافه إلى ذلك ، من المهم ان يتم تعيين كل خليه إلى مجموعه فرعيه. ستقوم الدالة cfData ببساطه باضافه تعداد الخلايا الاوليه لكل كتله لكل نموذج في cfList. من هذه الخطوة ، يمكن بناء خريطة الحرارة الخلوية كما هو موضح في القسم 3.
وقد تم استخدام سيتوصوم بنجاح كاداه التصور والقياس للمقارنة بين أساليب التجميع المختلفة13. هذه الحزمة R متوافقة أيضا مع الميزات المتقدمة ، مثل globaltest14، والتي يمكن اختبار الاقترانات بين مجموعات من الكتل باستخدام المتغيرات السريرية. وفي المستقبل ، يمكن دمج أداه globaltest و الخوارزميات الأخرى مع السرعة الخلوية لمزيد من التصور المتعمق والقياس الكمي.
Disclosures
وليس لدي المؤلفين ما يفصحون عنه.
Acknowledgements
ونحن نعترف بالتمويل المقدم من المفوضية الاوروبيه لجائزه مبادرة أفق 2020 MSCA ببموجب الاقتراح رقم 675743 (ISPIC). نشكر تيلجي فان دير سلريس وإيريس باردييك لاختبار البروتوكول.
Materials
| Name | Company | Catalog Number | Comments |
| Computer | Dell | NA | NA |
References
- Anchang, B., et al. Visualization and cellular hierarchy inference of single-cell data using SPADE. Nature Protocols. 11 (7), 1264-1279 (2016).
- Zunder, E. R., Lujan, E., Goltsev, Y., Wernig, M., Nolan, G. P. A continuous molecular roadmap to iPSC reprogramming through progression analysis of single-cell mass cytometry. Cell Stem Cell. 16 (3), 323-337 (2015).
- Van Gassen, S., et al. FlowSOM: Using self-organizing maps for visualization and interpretation of cytometry data. Cytometry A. 87 (7), 636-645 (2015).
- Levine, J. H., et al. Data-Driven Phenotypic Dissection of AML Reveals Progenitor-like Cells that Correlate with Prognosis. Cell. 162 (1), 184-197 (2015).
- Samusik, N., Good, Z., Spitzer, M. H., Davis, K. L., Nolan, G. P. Automated mapping of phenotype space with single-cell data. Nature Methods. 13 (6), 493-496 (2016).
- Spitzer, M. H., et al. An interactive reference framework for modeling a dynamic immune system. Science. 349 (6244), 1259425 (2015).
- Hotelling, H. Analysis of a complex of statistical variables into principal components. Journal of Educational Psychology. 24 (6), 417-441 (1933).
- van der Maaten, L., Hinton, G. Visualizing Data using t-SNE. Journal of Machine Learning Research. , (2008).
- Pezzotti, N., Hollt, T., Lelieveldt, B., Eisemann, E., Vilanova, A. Hierarchical Stochastic Neighbor Embedding. Computer Graphics Forum. 35 (3), 21-30 (2016).
- Becht, E., et al. Dimensionality reduction for visualizing single-cell data using UMAP. Nature Biotechnology. 37, 38 (2018).
- Haghverdi, L., Buettner, F., Theis, F. J. Diffusion maps for high-dimensional single-cell analysis of differentiation data. Bioinformatics. 31 (18), 2989-2998 (2015).
- Beyrend, G., Stam, K., Höllt, T., Ossendorp, F., Arens, R. Cytofast: A workflow for visual and quantitative analysis of flow and mass cytometry data to discover immune signatures and correlations. Computational and Structural Biotechnology Journal. 16, 435-442 (2018).
- Beyrend, G., et al. PD-L1 blockade engages tumor-infiltrating lymphocytes to co-express targetable activating and inhibitory receptors. Journal for ImmunoTherapy of Cancer. 7 (1), 217 (2019).
- Goeman, J. J., van de Geer, S. A., de Kort, F., van Houwelingen, H. C. A global test for groups of genes: testing association with a clinical outcome. Bioinformatics. 20 (1), 93-99 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved