Method Article
Visualizzazione e quantificazione dei dati di citometria ad alta dimensione utilizzando Cytofast e i metodi di clustering a monte FlowSOM e Cytosplore
In questo articolo
Riepilogo
Cytofast è uno strumento di visualizzazione utilizzato per analizzare l'output dal clustering. Cytofast può essere utilizzato per confrontare due metodi di clustering: FlowSOM e Cytosplore. Cytofast può generare rapidamente una panoramica quantitativa e qualitativa dei dati sulla citometria di massa ed evidenziare le principali differenze tra i diversi algoritmi di clustering.
Abstract
La complessità dei dati generati dalla citometria di massa ha reso necessari nuovi strumenti per visualizzare rapidamente i risultati analitici. Metodi di clustering come Cytosplore o FlowSOM vengono utilizzati per la visualizzazione e l'identificazione di cluster cellulari. Per l'analisi a valle, un pacchetto R appena sviluppato, Cytofast, può generare una rapida visualizzazione dei risultati dei metodi di clustering. Cytofast prende in considerazione la caratterizzazione fenotipica degli ammassi cellulari, calcola l'abbondanza di ammassi di cellule, quindi confronta quantitativamente i gruppi. Questo protocollo spiega le applicazioni di Cytofast all'uso di dati di citometria di massa basati sulla modulazione del sistema immunitario nel microambiente tumorale (cioè la risposta cellulare killer naturale [NK]) su una sfida tumorale seguita da immunoterapia (blocco PD-L1). Viene mostrata la dimostrazione dell'utilità di Cytofast con FlowSOM e Cytosplore. Cytofast genera rapidamente rappresentazioni visive di cluster di cellule immunitarie correlate al gruppo e correlazioni con la composizione del sistema immunitario. Le differenze si osservano nell'analisi del clustering, ma la separazione tra gruppi è visibile con entrambi i metodi di clustering. Cytofast mostra visivamente i modelli indotti dal trattamento PD-L1 che includono una maggiore abbondanza di sottoinsiemi di cellule NK attivati, esprimendo una maggiore intensità di marcatori di attivazione (ad esempio, CD54 o CD11c).
Introduzione
La citometria di massa (citometria per tempo di volo, o CyTOF) consente il rilevamento di un'ampia gamma di biomarcatori intracellulari o extracellulari in milioni di singole cellule. La natura ad alta dimensione dei dati di citometria di massa richiede alcuni strumenti di analisi, come le tecniche di clustering delle cellule come SPADE1, FlowMaps2, FlowSOM3, Phenograph4, VorteX5e mappe scaffold6. Inoltre, sono state sviluppate varie tecniche basate sulla riduzione della dimensionalità (cioè, analisi dei componenti principali [PCA]7, vicini stocastici distribuiti in t incorporando [t-SNE]8, vicina stocastica gerarchica incorporando [HSNE]9, approssimazione e proiezione dei collettori uniformi [UMAP]10e mappe11)per migliorare la velocità, l'interpretazione e la visualizzazione di set di dati dimensionali elevati.
L'analisi a valle dei dati citometrici di massa e di flusso tridimensionale elevato spesso manca di processi automatici per eseguire test statistici sulla frequenza dei cluster e collegamenti con i risultati clinici. In precedenza, abbiamo sviluppato un flusso di lavoro basato su R noto come Cytofast12, che consente analisi a valle visive e quantitative delle tecniche di clustering di Cytosplore o FlowSOM.
Il protocollo qui descritto chiarisce l'uso di Cytofast in R e mostra come generare mappe di calore e grafici quantitativi e qualitativi. Inoltre, facilita la determinazione delle connessioni tra i fenotipi immunitari osservati e gli esiti clinici. Questo report descrive anche l'analisi di un set di dati di citometria di massa specifico utilizzando due diverse procedure di clustering: FlowSOM e Cytosplore. Utilizzando Cytofast con entrambi i metodi di clustering, si di conseguenza è dimostrato che il fenotipo di attivazione delle cellule NK è influenzato dal blocco del checkpoint immunitario PD-L1.
Protocollo
Tutti gli esperimenti sugli animali sono stati approvati dal comitato per gli esperimenti sugli animali del LUMC e sono stati eseguiti secondo le linee guida per la sperimentazione animale del LUMC in conformità con le linee guida dei comitati olandesi ed europei.
NOTA: Per l'allestimento sperimentale, i topi C57BL/6 sono stati sottocutaneamente inoculati sul fianco destro con il tumore del colon murno MC38 ad una concentrazione di 0,3 x 106 cellule/200L di salina con buffer di fosfato (PBS). Dopo 10 giorni, quando i tumori erano palpabili, i topi sono stati trattati con anticorpi di blocco PD-L1 (clone MIH-5, 200 g/topo, iniezione intraperinoale) o sono stati trattati in modo fittizio. I tumori sono stati resisioni 3 giorni dopo l'iniezione PD-L1, elaborati ex vivo, e analizzati dalla citometria di massa CyTOF utilizzando 38 marcatori13.
1. Attrezzature e software per l'analisi dei dati
NOTA: utilizzare un computer (Windows 7 o versione successiva) e un processore I5 a 2,4 GHz o equivalente, la memoria installata RAM 6 GB e 10 GB di spazio libero sul disco rigido. Il pacchetto R Cytofast utilizza le funzioni esistenti: principalmente flowCore, pheatmape ggplot. Le righe di comando da eseguire in R sono incluse nel protocollo. La risorsa per le istruzioni R è disponibile in https://education.rstudio.com/.
- Per installare il pacchetto Cytofast, avviare R (versione "3.6") e installare Bioconductor versione 3.9 immettendo il codice seguente:
if (!requireNamespace("BiocManager", quietly - TRUE))
install.packages("BiocManager")
BiocManager::install("cytofast") - Assicurarsi che il pacchetto venga caricato nell'ambiente desiderato eseguendo quanto segue:
library(cytofast)
2. Creazione di cluster
NOTA: Per mostrare i due metodi di clustering Cytosplore e FlowSOM con Cytofast, le cellule NK (CD161)nel microambiente tumorale 3 giorni dopo il trattamento PD-L1 vengono analizzate.
- Clustering eseguito daCytosplore
- Dopo aver scaricato e installato Cytosplore, ospitato in Cytosplore.org>, caricare i file .fcs (File supplementari 1.1–1.8 [File di input Cytosplore]) facendo clic su File Aprire file FCS in Cytosplore. Aggiungere un tag di esempio univoco come canale facendo clic su Aggiungi tag di esempio univoco come canale quando richiesto e selezionare un cofattore per la trasformazione dell'arcosinh iperbolico (il valore predefinito è 5).
- Selezionare Esegui H-SNE, eseguire un livello HSNE pari a 3 e attendere la generazione della mappa.
NOTA: Questo passaggio può richiedere del tempo, a seconda del numero di celle analizzate e del livello di HSNE scelto. - Al primo livello HSNE, controllare le celle positive per IL CD161. Selezionare le celle CD161e fare clic con il pulsante destro del mouse su Ingrandimento selezione. Al secondo livello, ripetere la procedura per raggiungere il terzo livello con solo CD161- eventi.
- Una volta generata l'ultima mappa tSNE, salvare i cluster definiti da Cytosplore facendo clic con il pulsante destro del mouse sulla mappa tSNE e scegliere Salva cluster. Scegliere la directory dei file di output come richiesto da Cytosplore e prendere nota di questo percorso, perché questa directory verrà quindi utilizzata per caricare i file .fcs in R.
NOTA: Il numero di sottoinsiemi può essere modificato manualmente modificando il valore sigma. Il valore sigma è impostato per impostazione predefinita su 30; tuttavia, il numero effettivo di sottoinsiemi dipende dall'input. In questo caso, Cytosplore ha rilevato 10 sottoinsiemi diversi, con ogni file che rappresenta un sottoinsieme. - Utilizzare un nome semplice (solo caratteri) quando si rinominano i file di output, in modo da semplificare l'identificazione e l'ulteriore gestione. Salvare i file di output selezionando Salva.
NOTA: Dopo il salvataggio, Cytosplore viene creata una cartella con i file .fcs, con ogni file corrispondente ai cluster identificati in Cytosplore. Il passo successivo sarà il caricamento dei file in R con l'aiuto di Cytofast. In questo caso, i file di output generati vengono forniti in File supplementari 2.1–2.10 (file di output di Cytosplore). - Caricare i file di output generati da Cytosplore in R con la funzione designata: readCytosploreFCS.
dirFCS <- "C:" Utenti nomeutente Desktop a studio"
cfData <- readCytosploreFCS(dir- dirFCS, colNames - "description") - Pulire i dati rimuovendo alcuni parametri come "Time" e "Background". Controllare la posizione della colonna correlata ai parametri non necessari e rimuoverla dalla matrice.
connomi(cfData@expr)
cfData@expr <- cfData@expr[,-c(3,4,6,8:10,46:49,51:54)]
NOTA: Le colonne non necessarie possono essere visualizzate leggendo i nomi delle colonne della matrice generata. Eseguendo nuovamente colnames(cfData@expr), assicurarsi che vengano ottenuti solo i parametri desiderati. - Riordinare i marcatori in modo che i marcatori di derivazione vengano visualizzati per primi, seguiti dai marcatori funzionali.
cfData@expr <- cfData@expr[,c(1,2,3,35,36,31,9,10,18,8,37,20,
29,40,5,30,33,11,34,14,19,
32,28,6,7,4,12,13,17,16,15,
21,22,24,25,26,27,38,39)]
NOTA:il passaggio 2.1.8 è facoltativo. - Collegare il meta file ai dati generati da Cytosplore caricando il metafile del foglio di calcolo contenente informazioni cliniche (Supplementary File 3).
library(readxl)
meta <- read_excel("C:" Utenti nomeutente Desktop sample_id.xlsx")
cfData@samples <- data.frame(meta)
NOTA: il clustering eseguito da Cytosplore è terminato. Un'opzione di clustering alternativa a Cytosplore è FlowSOM ed è descritta nella sezione 2.2. Dopo aver eseguito uno dei due passaggi di clustering, procedere con il passaggio di visualizzazione (sezione 3).
- Clustering eseguito daFlowSOM
- Installare innanzitutto FlowSOM in R eseguendo il comando seguente:
if (!requireNamespace("BiocManager", quietly - TRUE))
install.packages("BiocManager")
BiocManager::install("FlowSOM")
library(FlowSOM) - Installare il pacchetto flowCore usando un metodo simile e caricarlo nell'ambiente eseguendo quanto segue:Install the flowCore package using a similar method and load it in the environment by running the following:
if (!requireNamespace("BiocManager", quietly - TRUE))
install.packages("BiocManager")
BiocManager::install("flowCore")
library(FlowSOM) - Caricare i dati non elaborati forniti in Supplementary Files 4.1–4.8 (input FCS FlowSOM), precedentemente gestiti in caso di eventi CD161, in R con la funzione read.flowSet.
fcs_raw <- read.flowSet(percorso "C:"C:"Utenti"nomeutente"Desktop"tocluster", pattern : ".fcs", trasformazione , FALSE, truncate_max_range , FALSE, seed , 123) - Selezionare i marcatori biologici pertinenti (rimuovere "Sfondo" o "Tempo") selezionando le colonne appropriate e trasformare i dati in modo arcosinh5 come mostrato nel codice seguente (qui, rimuovere le colonne 1, 2, 4, 5, 6, 17, 21, 24, 25, 25, 34, 35, 37, 38, 51, che non corrispondono ad alcun marcatore biologico). Applicare un cofattore pari a 5 come applicato in precedenza con Cytosplore, scegliendo cofattore 5 nella funzione riportata di seguito.
fcs_raw <- fsApplica(fcs_raw, funzione(x, cofattore 5)
connames(x) <- fcs_raw[[1]]@parameters@data
expr <- exprs(x)
expr <- asinh(expr[,-c(1,2,4,5,6,17,21,24,25,34,35,37,38,51)]/ cofattore)
exprs(x) <- expr
ritorno(x)) - Raggruppare i dati utilizzando la funzione FlowSOM. Per confrontare FlowSOM e Cytosplore, scegliere di raggruppare i dati in dieci sottoinsiemi come output precedentemente prodotto da Cytosplore.
fsom <- FlowSOM(fcs_raw, transformFunction - FALSE, scala - FALSE,
scaled.center : FALSE, scaled.scale , FALSE, invisibile all'utente , FALSE, colsToUse , c(1:37),
nClus - 10, maxMeta : 10, importanza : NULL, seme : 123)
NOTA: Questo può essere modificato manualmente dall'utente. - Assegnare ogni cella al relativo sottoinsieme identificato e all'ID campione.
subset_id <- as.factor(fsom' FlowSOM, mappe, mapping[,1])
livelli(subset_id) <- fsom-metaclustering
head(subset_id) - Caricare il file di metadati in R (disponibile in Supplementary File 5)contenente l'assegnazione del gruppo e collegarlo ai file fcs.
sampleid <- read_excel("C:"Utenti/nomeutente/Desktop/sample_id.xlsx")
sampleid <- na.omit(sampleid)
sampleid-sampleID <- as.factor(sampleid-sampleID)
sampleid-group <- as.factor(sampleid-group)
sampleid-CSPLR_ST <- as.factor(sampleid-CSPLR_ST)
sampleid <- as.data.frame(sampleid)
names(sampleid)[3] <- "sampleID"
sampleID <- lapply(fsom,FlowSOM,metaData, function(x)'rep(x[1], each : length(x[1]:x[2])))
attr(sampleID, 'names') <- NULL
sampleID <- as.factor(unlist(sampleID))
sampleid <- data.frame(sampleid)
levels(sampleID) <- paste("ID", 1:dim(sampleid)[1], set
df <- data.frame(subset_id, sampleID, fsom, FlowSOM-data[, c(1:37)])
Rinominare <- data.frame(colpar'fcs_raw[[1]]@parameters@data'desc)
colnames(df) <- c("clusterID", "sampleID", rename
df: idcluster <- as.factor(df' clusterID)
df-sampleID <- as.factor(df-sampleID) - Creare un cfList basato sul frame di dati ottenuto da FlowSOM eseguendo lo script seguente:
cfData <- cfList(samples: sampleid,
espr - df) - Riordinare i marcatori in modo che appaiano in modo simile all'output dell'analisi Cytosplore.
cfData@expr <- cfData@expr[,c(1,2,34,36,37,10,23,24,31,22,
38,15,8,3,27,9,11,28,35,26,
14,33,17,20,21,18,25,29,13,
30,12,16,32,4,5,6,7,19,39)]
NOTA:il clustering di FlowSOM è terminato. Eseguire quindi la visualizzazione dell'output del clustering.
- Installare innanzitutto FlowSOM in R eseguendo il comando seguente:
3. Visualizzazione: Analisi clustering post-elaborazione
NOTA:questo passaggio è un metodo comune a entrambi i metodi di clustering. Pertanto, può essere eseguita dopo il clustering con FlowSOM o Cytosplore.
- Prima di creare le mappe di calore, generare la tabella count per esempio utilizzando la funzione cellCounts come illustrato nel codice seguente. Poiché alcuni cluster contengono meno celle rispetto ad altri, ridimensionare i dati per cluster specificando "scala : TRUE" all'interno della cella della funzioneConta, in modo che la dispersione tra i campioni possa essere facilmente visibile.
cfData <- cellCounts(cfData, frequenza: VERO, scala : VERO)
NOTA: I dati possono ora essere visualizzati. - Visualizza con heatmap.
NOTA: Una delle funzioni principali di questo pacchetto è cytoHeatmaps, che viene utilizzato per visualizzare il fenotipo degli ammassi creati e la loro eterogeneità rispetto ai campioni.
cytoHeatmaps (cfData, gruppo: "gruppo", leggenda/VERO) - Visualizzazione con boxplot
NOTA: I dati possono essere rappresentati in modo quantitativo chiamando la funzione cytoBoxplots. L'output di questa funzione rappresenta la proporzione di ogni campione per ogni cluster.- Generare il numero di celle come completato nel passaggio 3.1, ma non ridimensionare i dati per ottenere la frequenza di ogni cluster.
cfData <- cellCounts(cfData, frequenza: VERO, scala - FALSE)
cytoBoxplots(cfData, group : "gruppo")
- Generare il numero di celle come completato nel passaggio 3.1, ma non ridimensionare i dati per ottenere la frequenza di ogni cluster.
- Visualizzazione con istogramma del segnale di intensità mediana
NOTA: I dati possono anche essere visualizzati rappresentando l'istogramma del segnale di intensità mediana.- Visualizzare l'intensità dell'espressione di tre marcatori: CD45, CD11c e CD54.
- Controllare i nomi dei marcatori desiderati chiamando la riga seguente. Prendere nota dei nomi dei marcatori e includerlo nella funzione msiPlot.
nomi(cfData@expr)
NOTA: Concentrarsi su CD45, CD11c e CD54. Controllare l'esatta ortografia dei marcatori e regolare se necessario:
msiPlot(cfData, marcatori: c("89Y_CD45", "167Er_CD11c","164Dy_CD54"), daGruppo: 'gruppo')
Risultati
Il flusso di lavoro Cytofast (Figura 1) ha lo scopo di fornire una panoramica quantitativa e qualitativa dei dati originariamente raggruppati dal software di analisi (ad esempio, FlowSOM o Cytosplore). Cytofast esegue diverse uscite possibili, inclusa la mappa termica di tutti i cluster identificati nell'analisi e basata sull'espressione del marcatore (Figura 2 e Figura 3). Il dendrogramma in alto rappresenta la somiglianza gerarchica tra i cluster identificati. Il pannello superiore visualizza un'altra mappa termica che mostra la quantità relativa di sottoinsiemi corrispondenti in ogni campione. Il dendrogramma a destra mostra la somiglianza tra i campioni e si basa sul clustering gerarchico eseguito sulle distanze euclidee tra i campioni. Le mappe di calore combinate sono mostrate per FlowSOM seguito da Cytofast nella Figura 2 e per Cytosplore seguito da Cytofast nella Figura 3. Cytofast può essere utilizzato anche per presentare i dati quantitativamente e visualizzare i risultati in boxplot (utilizzando la funzione cytoBoxplots), come illustrato nella Figura 4 e Figura 5.
Cluster simili sono stati trovati tra i due diversi metodi (ad esempio, il cluster 8 di Cytosplore corrisponde al cluster 10 di FlowSOM) e la co-espressione di alcuni marcatori inibitori come PD-1 e LAG-3 erano ancora visibili in entrambi i metodi). Entrambi i metodi di clustering consentivano la discriminazione tra PD-L1 e. Topi trattati con PBS. Al contrario, è possibile evidenziare alcune differenze tra entrambi i metodi. FlowSOM identifica 2 cluster (MHC-II)mentre Cytosplore mostra un solo cluster (MHC-II. Ciò è dovuto alla strategia iniziale di gating in cui le cellule NK sono state manualmente gated su CD161- cellule, poi ulteriormente elaborati da FlowSOM. Tuttavia, Cytosplore ha automaticamente sbarrato le cellule del CD45- popolazione al primo livello HSNE, che sono state poi raggruppate in un livello gerarchico superiore. Così, Cytosplore ha definito i sottoinsiemi di cellule NK in modo più preciso di come il gating manuale si è concentrato sul CD161. Tuttavia, il clustering gerarchico dei campioni è stato preservato, come mostrato nel dendrogramma a destra, indicando che la segregazione tra i due gruppi (PD-L1 e PBS) non dipendeva dal metodo di clustering scelto.
Il numero di cluster può essere definito manualmente utilizzando entrambi i metodi. Cytofast consente all'utente di valutare l'eterogeneità dei propri dati e può fornire informazioni su come scegliere il numero di cluster in cui i dati devono essere suddivisi. Altre funzionalità sono incluse nel pacchetto Cytofast, ad esempio la funzione msiPlot (passaggio 3.4.2), che mostra il grafico di intensità del segnale mediano (MSI) di ogni marcatore per gruppo (Figura 6 e Figura 7). Questa funzione consente il rilevamento di cambiamenti globali, come aumenti nell'espressione di CD54 o CD11c nelle cellule NK del gruppo trattato con PD-L1. Le funzionalità facoltative possono essere incorporate nel pacchetto Cytofast, ad esempio la visualizzazione dei dati nei grafici a barre e in altri metodi di rappresentazione dei dati. Quest'ultimo richiede l'aggiunta di strumenti ggplot, che possono essere generati da R.
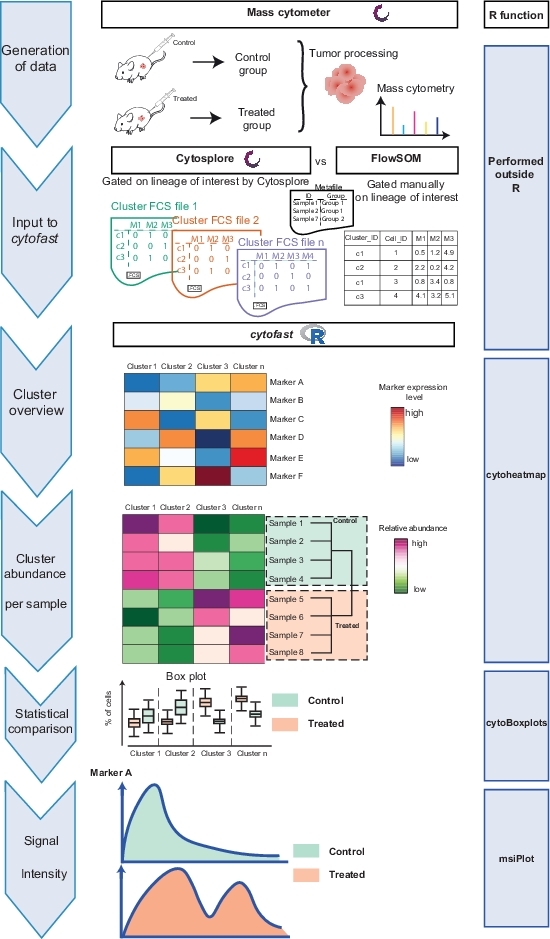
Figura 1: flusso di lavoro del pacchetto Cytofast. I dati sono stati generati da citometria di massa da un tumore 3 giorni dopo il trattamento con immunoterapia o non trattati. Sono state confrontate due diverse tecniche di clustering: Cytosplore e FlowSOM. Cytofast è stato utilizzato per visualizzare le differenze tra le due tecniche. Fare clic qui per visualizzare una versione più grande di questa figura.
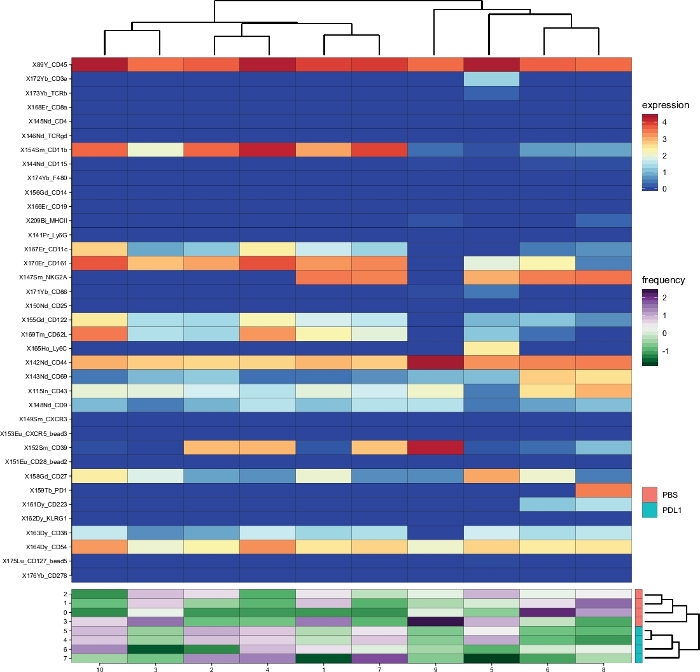
Figura 2: Panoramica dei cluster e abbondanza di cluster per gruppo, come analizzato da Cytofast che segue Cytosplore. Mappa di calore di tutti gli ammassi di cellule NK (CD161- cellule definite automaticamente da Cytosplore), che sono state identificate 3 giorni dopo l'immunoterapia (PD-L1). I dati mostrati si basano sul clustering Cytosplore e raggruppati dai gruppi trattati non trattati e PD-L1. I livelli di marcatore di espressione trasformata in ArcSinh5 vengono visualizzati su una scala arcobaleno. Sul pannello inferiore, l'abbondanza relativa di ogni campione è rappresentata dalla scala verde-viola. Il dendrogramma a destra rappresenta la somiglianza tra i campioni in base alle frequenze dei sottoinsiemi. La scala di frequenza rappresenta la dispersione della media. Una frequenza bassa o alta è rappresentata da un colore verde o viola, rispettivamente. Fare clic qui per visualizzare una versione più grande di questa figura.
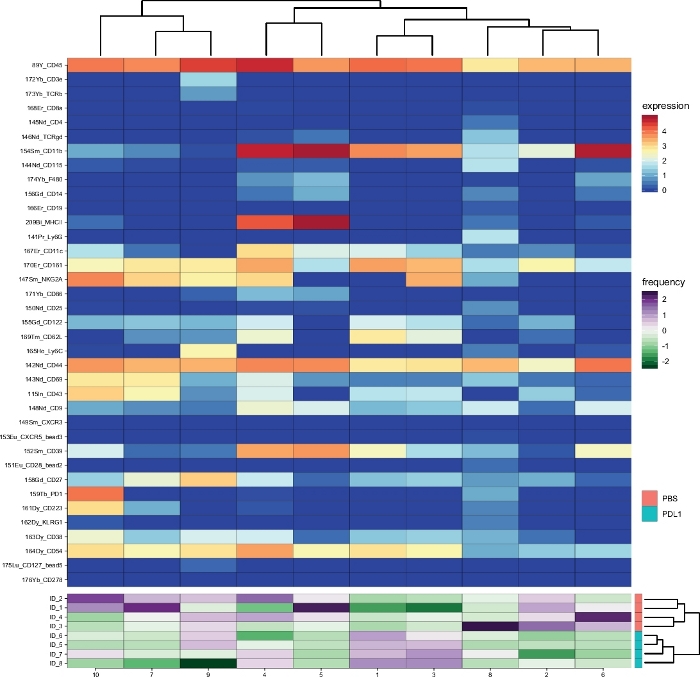
Figura 3: Panoramica del cluster e abbondanza di cluster per gruppo, come analizzato da Cytofast che segue FlowSOM. Mappa di calore di tutti gli ammassi di cellule NK (pre-gated su CD161) eventi), che sono stati identificati 3 giorni dopo l'immunoterapia (PD-L1). I dati mostrati si basano sul clustering FlowSOM e sono raggruppati dai gruppi trattati non trattati e PD-L1. I livelli di marcatore di espressione trasformata in ArcSinh5 vengono visualizzati su una scala arcobaleno. Sul pannello inferiore, l'abbondanza relativa di ogni campione è rappresentata dalla scala verde-viola. Il dendrogramma a destra rappresenta la somiglianza tra i campioni in base alle frequenze dei sottoinsiemi. La scala di frequenza rappresenta la dispersione della media. Una frequenza bassa o alta è rappresentata da un colore verde o viola, rispettivamente. Fare clic qui per visualizzare una versione più grande di questa figura.
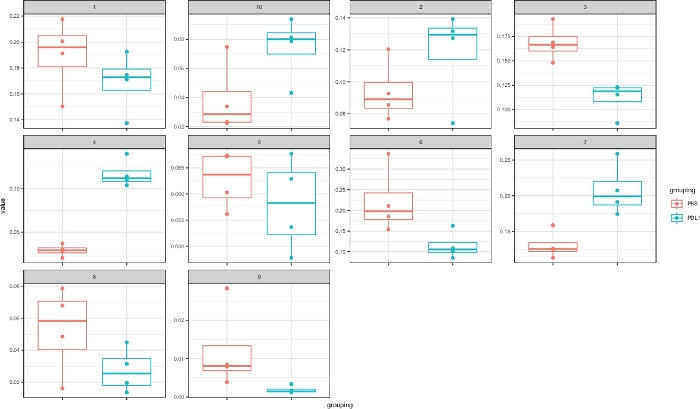
Figura 4: Rappresentazione Cytofast con boxplot dei cluster definiti da Cytosplore. La frequenza di ogni cluster è rappresentata in un boxplot, separato nei due gruppi (PBS e PD-L1). Un singolo punto corrisponde a un mouse. Fare clic qui per visualizzare una versione più grande di questa figura.
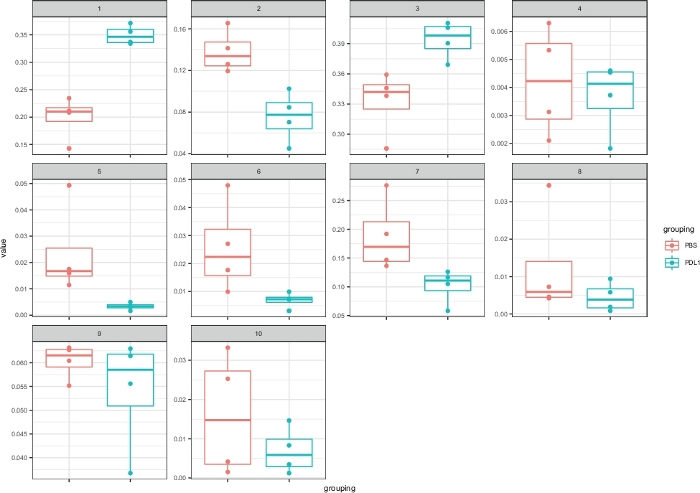
Figura 5: Rappresentazione Cytofast con boxplot dei cluster definiti da FlowSOM. La frequenza di ogni cluster è rappresentata in un boxplot, separato nei due gruppi (PBS e PD-L1). Un singolo punto corrisponde a un mouse. Fare clic qui per visualizzare una versione più grande di questa figura.
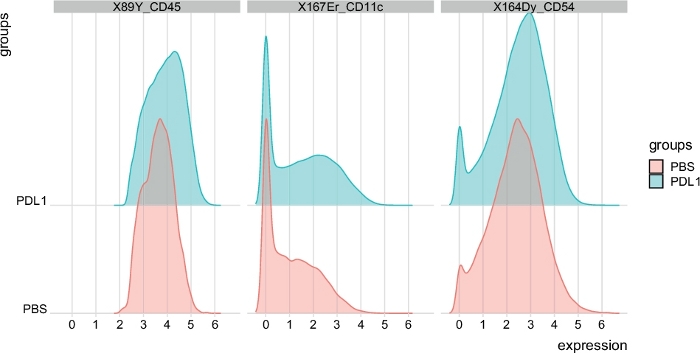
Figura 6: Distribuzione dei grafici di intensità del segnale dalle cellule NK automaticamente gated da Cytosplore. La distribuzione delle intensità del segnale è mostrata in un istogramma per tre marcatori specifici: CD45, CD11c e CD54. Fare clic qui per visualizzare una versione più grande di questa figura.
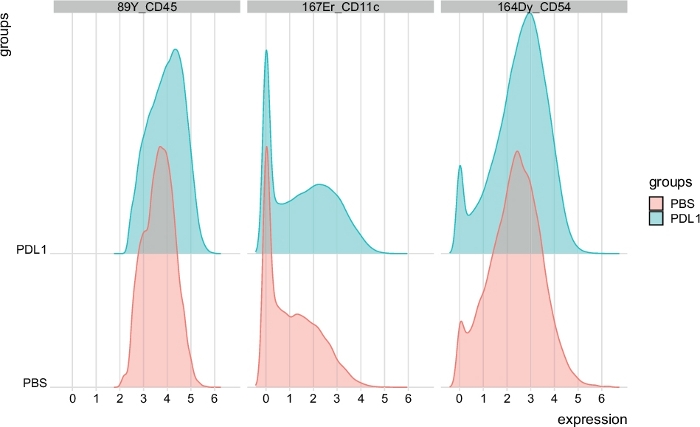
Figura 7: Distribuzione dei grafici di intensità del segnale dalle celle NK automaticamente gated da FlowSOM. La distribuzione delle intensità del segnale è mostrata in un istogramma per tre marcatori specifici: CD45, CD11c e CD54, separati da gruppi PBS e PD-L1. Fare clic qui per visualizzare una versione più grande di questa figura.
File supplementari 1.1–1.8. Fare clic qui per visualizzare questo file (fare clic con il pulsante destro del mouse per scaricare).
File supplementari 2.1–2.10. Fare clic qui per visualizzare questo file (fare clic con il pulsante destro del mouse per scaricare).
File supplementare 3. Fare clic qui per visualizzare questo file (fare clic con il pulsante destro del mouse per scaricare).
File supplementari 4.1–4.8. Fare clic qui per visualizzare questo file (fare clic con il pulsante destro del mouse per scaricare).
File supplementare 5. Fare clic qui per visualizzare questo file (fare clic con il pulsante destro del mouse per scaricare).
Discussione
Cytofast è uno strumento computazionale rapido che fornisce un'esplorazione rapida e globale dei dati citometrici evidenziando e quantificando sottoinsiemi cellulari specifici del trattamento. Il protocollo descritto mira a elaborare ulteriormente le analisi di clustering con Cytosplore o FlowSOM. Altri strumenti di analisi del clustering sono adatti per Cytofast, ma ciò richiede l'utilizzo di Cytofast per assegnare ogni cella a un sottoinsieme. Cytofast, tuttavia, non è un metodo di clustering e pertanto richiede procedure di clustering prima dell'uso.
L'analisi eseguita qui ha mostrato che alcuni sottoinsiemi di cellule CD161- NK nel microambiente tumorale erano sensibili a un blocco PD-L1. Ciò è stato dimostrato da cambiamenti nel loro fenotipo e abbondanza, che sono stati osservati utilizzando sia Cytosplore che FlowSOM come metodi di clustering. Entrambi i metodi distinguevano il principale cluster di cellule NK (CD11b, NKG2A)con frequenze leggermente diverse (15%-20% per Cytosplore, 30%–40% per FlowSOM). Le differenze in abbondanza e questa approssimazione non hanno influenzato il modello globale, perché entrambi i dendrogrammi visualizzati nei pannelli di destra di Figura 2 e Figura 3 ha mostrato risultati simili. Utilizzando Cytofast, è quindi possibile (indipendente mente dal metodo di clustering scelto) separare i topi trattati con PD-L1 e non trattati sulla base di analisi del fenotipo e dell'abbondanza di cluster di cellule NK.
A seconda dei parametri registrati, sono necessarie modifiche al protocollo. In particolare, alcuni parametri, ad esempio il tempo e lo sfondo, devono essere rimossi durante l'esecuzione dell'analisi del clustering. Inoltre, è importante che ogni cella sia assegnata a un sottoinsieme. La funzione cfData aggiungerà semplicemente i conteggi di celle non elaborate per cluster per campione in cfList. Da questa fase, la mappa del citoheat può essere costruita come spiegato nella sezione 3.
Cytofast è stato utilizzato con successo come strumento di visualizzazione e quantificazione per confrontare diversi metodi di clustering13. Questo pacchetto R è compatibile anche con funzionalità avanzate, come globaltest14, che possono testare le associazioni tra gruppi di cluster utilizzando variabili cliniche. In futuro, lo strumento globaltest e altri algoritmi possono essere integrati con Cytofast per una visualizzazione e una quantificazione più approfondite.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Riconosciamo il finanziamento da parte della Commissione europea di un premio H2020 MSCA nell'ambito della proposta numero 675743 (ISPIC). Ringraziamo Tetje van der Sluis e Iris Pardieck per aver testato il protocollo.
Materiali
| Name | Company | Catalog Number | Comments |
| Computer | Dell | NA | NA |
Riferimenti
- Anchang, B., et al. Visualization and cellular hierarchy inference of single-cell data using SPADE. Nature Protocols. 11 (7), 1264-1279 (2016).
- Zunder, E. R., Lujan, E., Goltsev, Y., Wernig, M., Nolan, G. P. A continuous molecular roadmap to iPSC reprogramming through progression analysis of single-cell mass cytometry. Cell Stem Cell. 16 (3), 323-337 (2015).
- Van Gassen, S., et al. FlowSOM: Using self-organizing maps for visualization and interpretation of cytometry data. Cytometry A. 87 (7), 636-645 (2015).
- Levine, J. H., et al. Data-Driven Phenotypic Dissection of AML Reveals Progenitor-like Cells that Correlate with Prognosis. Cell. 162 (1), 184-197 (2015).
- Samusik, N., Good, Z., Spitzer, M. H., Davis, K. L., Nolan, G. P. Automated mapping of phenotype space with single-cell data. Nature Methods. 13 (6), 493-496 (2016).
- Spitzer, M. H., et al. An interactive reference framework for modeling a dynamic immune system. Science. 349 (6244), 1259425 (2015).
- Hotelling, H. Analysis of a complex of statistical variables into principal components. Journal of Educational Psychology. 24 (6), 417-441 (1933).
- van der Maaten, L., Hinton, G. Visualizing Data using t-SNE. Journal of Machine Learning Research. , (2008).
- Pezzotti, N., Hollt, T., Lelieveldt, B., Eisemann, E., Vilanova, A. Hierarchical Stochastic Neighbor Embedding. Computer Graphics Forum. 35 (3), 21-30 (2016).
- Becht, E., et al. Dimensionality reduction for visualizing single-cell data using UMAP. Nature Biotechnology. 37, 38 (2018).
- Haghverdi, L., Buettner, F., Theis, F. J. Diffusion maps for high-dimensional single-cell analysis of differentiation data. Bioinformatics. 31 (18), 2989-2998 (2015).
- Beyrend, G., Stam, K., Höllt, T., Ossendorp, F., Arens, R. Cytofast: A workflow for visual and quantitative analysis of flow and mass cytometry data to discover immune signatures and correlations. Computational and Structural Biotechnology Journal. 16, 435-442 (2018).
- Beyrend, G., et al. PD-L1 blockade engages tumor-infiltrating lymphocytes to co-express targetable activating and inhibitory receptors. Journal for ImmunoTherapy of Cancer. 7 (1), 217 (2019).
- Goeman, J. J., van de Geer, S. A., de Kort, F., van Houwelingen, H. C. A global test for groups of genes: testing association with a clinical outcome. Bioinformatics. 20 (1), 93-99 (2004).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon