Method Article
Visualisation et quantification des données de cytométrie à haute dimension à l'aide de Cytofast et des méthodes de clustering en amont FlowSOM et Cytosplore
Dans cet article
Résumé
Cytofast est un outil de visualisation utilisé pour analyser la sortie du clustering. Cytofast peut être utilisé pour comparer deux méthodes de clustering: FlowSOM et Cytosplore. Cytofast peut rapidement générer un aperçu quantitatif et qualitatif des données de cytométrie de masse et mettre en évidence les principales différences entre les différents algorithmes de clustering.
Résumé
La complexité des données générées par la cytométrie de masse a nécessité de nouveaux outils pour visualiser rapidement les résultats analytiques. Des méthodes de clustering comme Cytosplore ou FlowSOM sont utilisées pour la visualisation et l'identification des amas cellulaires. Pour l'analyse en aval, un nouveau paquet R, Cytofast, peut générer une visualisation rapide des résultats des méthodes de clustering. Cytofast prend en compte la caractérisation phénotypique des amas cellulaires, calcule l'abondance des grappes cellulaires, puis compare quantitativement les groupes. Ce protocole explique les applications de Cytofast à l'utilisation de données de cytométrie de masse basées sur la modulation du système immunitaire dans le microenvironnement tumoral (c.-à-d., la réponse cellulaire tueuse naturelle [NK]) sur le défi tumoral suivi de l'immunothérapie (blocus PD-L1). Démonstration de l'utilité de Cytofast avec FlowSOM et Cytosplore est montré. Cytofast génère rapidement des représentations visuelles des amas de cellules immunitaires liées au groupe et des corrélations avec la composition du système immunitaire. Des différences sont observées dans l'analyse de regroupement, mais la séparation entre les groupes est visible avec les deux méthodes de clustering. Cytofast montre visuellement les modèles induits par le traitement PD-L1 qui incluent une plus grande abondance de sous-ensembles activés de cellules DE NK, exprimant une intensité plus élevée des marqueurs d'activation (c.-à-d., CD54 ou CD11c).
Introduction
La cytométrie de masse (cytométrie par heure de vol, ou CyTOF) permet la détection d'un large éventail de biomarqueurs intracellulaires ou extracellulaires dans des millions de cellules individuelles. La nature de haute dimension des données de cytométrie de masse nécessite certains outils d'analyse, tels que les techniques de regroupement cellulaire comme SPADE1, FlowMaps2, FlowSOM3, Phenograph4, VorteX5, et les cartes d'échafaudage6. En outre, diverses techniques basées sur la réduction de la dimensionnalité ont été développées (c.-à-d., l'analyse des composants principaux [PCA]7, t-distribué voisin stochastique intégrant [t-SNE]8, voisin stochastique hiérarchique intégrant [HSNE]9, approximation et projection multiples uniformes [UMAP]10, et cartes de diffusion11) pour améliorer la vitesse, l'interprétation et la visualisation des jeux de données de haute dimension.
L'analyse en aval des données cytométriques de débit et de masse de grande dimension manque souvent de processus automatiques pour effectuer des tests statistiques sur la fréquence des grappes et des liens avec les résultats cliniques. Auparavant, nous avons développé un flux de travail Basé sur R connu sous le nom Cytofast12, qui permet des analyses visuelles et quantitatives en aval des techniques de clustering par Cytosplore ou FlowSOM.
Le protocole décrit ici clarifie l'utilisation de Cytofast en R et montre comment générer des cartes thermiques quantitatives et qualitatives et des graphiques. En outre, il facilite la détermination des connexions entre les phénotypes immunitaires observés et les résultats cliniques. Ce rapport décrit également l'analyse d'un jeu de données de cytométrie de masse spécifique à l'aide de deux procédures de clustering différentes : FlowSOM et Cytosplore. En utilisant Cytofast avec les deux méthodes de clustering, il est en conséquence démontré que le phénotype d'activation des cellules NK est influencé par le blocus de point de contrôle immunitaire PD-L1.
Protocole
Toutes les expériences animales ont été approuvées par le Comité des expériences animales de LUMC et ont été exécutées conformément aux directives d'expérimentation animale du LUMC conformément aux directives des comités néerlandais et européens.
REMARQUE: Pour la mise en place expérimentale, les souris C57BL/6 ont été sous-cutanées inoculées sur le flanc droit avec la tumeur du côlon maurine MC38 à une concentration de 0,3 x 106 cellules/200 l de salline tamponnée de phosphate (PBS). Après 10 jours, quand les tumeurs étaient palpables, les souris ont été traitées avec des anticorps de blocage de PD-L1 (clone MIH-5, 200 g/souris, injection intra-péritonéale) ou ont été simulées-traitées. Les tumeurs ont été réséquées 3 jours plus tard après injection de PD-L1, ex vivo traitée, et analysée par cytometry de masse de CyTOF utilisant 38 marqueurs13.
1. Équipement et logiciel pour l'analyse des données
REMARQUE: Utilisez un ordinateur (Windows 7 ou plus récent) et processeur I5 à 2,4 GHz ou équivalent, mémoire installée RAM 6 Go, et 10 Go d'espace disque dur gratuit. Le paquet R Cytofast utilise des fonctions existantes: principalement flowCore, pheatmap, et ggplot. Les lignes de commande à exécuter en R sont incluses dans le protocole. La ressource pour les instructions R peut être trouvée à https://education.rstudio.com/.
- Pour installer le paquet Cytofast, démarrez R (version "3.6") et installez la version 3.9 de Bioconductor en entrant le code suivant :
si (!requireNamespace ("BiocManager", tranquillement - TRUE))
install.packages ("BiocManager")
BiocManager::install("cytofast") - Assurez-vous que le colis est chargé dans l'environnement désiré en exécutant ce qui suit :
bibliothèque (cytofast)
2. Création de clusters
REMARQUE: Pour présenter les deux méthodes de clustering Cytosplore et FlowSOM avec Cytofast, les cellules NK (CD161) dans le micro-environnement tumoral 3 jours après le traitement PD-L1 sont analysés.
- Clustering effectué parCytosplore
- Après le téléchargement et l'installation de Cytosplore, hébergé à l'adresse suivante : www. Cytosplore.org -gt;, téléchargez les fichiers .fcs(Fichiers supplémentaires 1.1-1.8 [fichiers d'entrée Cytosplore]) en cliquant sur Fichier . Ouvrez les fichiers FCS à Cytosplore. Ajoutez une balise d'échantillon unique comme canal en cliquant Sur Ajouter une balise d'échantillon unique comme canal lorsqu'il est invité et sélectionnez un cofacteur pour la transformation des arcsinhhyperboliques (par défaut est 5).
- Sélectionnez Run H-SNE, exécutez un niveau HSNE de 3, et attendez que la carte soit générée.
REMARQUE: Cette étape peut nécessiter un certain temps, selon le nombre de cellules analysées et le niveau de HSNE choisi. - Au premier niveau HSNE, vérifiez les cellules qui sont positives pour CD161. Sélectionnez les cellules CD161et le zoom droit dans la sélection. Au deuxième niveau, répétez la procédure pour atteindre le troisième niveau avec seulement CD161- événements.
- Une fois la dernière carte tSNE générée, enregistrez les clusters définis par Cytosplore en cliquant à droite sur la carte tSNE et choisissez Save Clusters. Choisissez le répertoire des fichiers de sortie comme incité par Cytosplore et notez cet emplacement, parce que ce répertoire sera ensuite utilisé pour charger les fichiers .fcs en R.
REMARQUE: Le nombre de sous-ensembles peut être modifié manuellement en modifiant la valeur sigma. La valeur sigma est fixée par défaut à 30; cependant, le nombre réel de sous-ensembles dépend de l'entrée. Ici, Cytosplore a détecté 10 sous-ensembles différents, chaque fichier représentant un sous-ensemble. - Utilisez un nom simple (caractères seulement) lors du changement de nom des fichiers de sortie, ce qui facilitera l'identification et la manipulation. Enregistrer les fichiers de sortie en sélectionnant Enregistrer.
REMARQUE: Après l'enregistrement, un dossier est créé par Cytosplore avec les fichiers .fcs, chaque fichier correspondant aux clusters identifiés dans Cytosplore. La prochaine étape sera le chargement des fichiers en R avec l'aide de Cytofast. Ici, les fichiers de sortie générés sont fournis dans les fichiers supplémentaires 2.1-2.10 (fichiers de sortie Cytosplore). - Chargez les fichiers de sortie générés par Cytosplore en R avec la fonction désignée : readCytosploreFCS.
dirFCS 'lt;- "C: 'Users'username''Desktop'tostudy"
cfData 'lt;- readCytosploreFCS(dir ' dirFCS, colNames 'description') - Nettoyez les données en supprimant certains paramètres tels que « Temps » et « Contexte ». Vérifiez la position de la colonne liée à ses paramètres inutiles et retirez-la de la matrice.
colnames (cfData@expr)
cfData@expr 'lt;- cfData@expr[,-c(3,4,6,8:10,46:49,51:54)]
REMARQUE: Les colonnes inutiles peuvent être vues en lisant les noms des colonnes de la matrice générée. En exécutant des colnames (cfData@expr) une fois de plus, assurez-vous que seuls les paramètres souhaités sont obtenus. - Ré-commander les marqueurs de sorte que les marqueurs de lignée sont affichés en premier, suivis par des marqueurs fonctionnels.
cfData@expr 'lt;- cfData@expr[,c(1,2,35,35,36,31,9,10,18,8,37,20,
29,40,5,30,33,11,34,14,19,
32,28,6,7,4,12,13,17,16,15,
21,22,24,25,26,27,38,39)]
REMARQUE: L'étape 2.1.8 est facultative. - Lier le fichier de méta données aux données générées de Cytosplore en téléchargeant le métafichier de feuille de calcul contenant des informations cliniques (Dossier supplémentaire 3).
bibliothèque (readxl)
meta 'lt;- read_excel("C: 'Users''username''Desktop'sample_id.xlsx")
cfData@samples 'lt;- data.frame(meta)
REMARQUE: Le regroupement effectué par Cytosplore est maintenant terminé. Une autre option de regroupement à Cytosplore est FlowSOM et est décrite à la section 2.2. Une fois que l'une des deux étapes de regroupement est effectuée, procédez à l'étape de visualisation (section 3).
- Clustering effectué parFlowSOM
- Installez d'abord FlowSOM en R en exécutant la commande suivante :
si (!requireNamespace ("BiocManager", tranquillement - TRUE))
install.packages ("BiocManager")
BiocManager::install("FlowSOM")
bibliothèque (FlowSOM) - Installez le paquet flowCore en utilisant une méthode similaire et chargez-le dans l'environnement en exécutant ce qui suit :
si (!requireNamespace ("BiocManager", tranquillement - TRUE))
install.packages ("BiocManager")
BiocManager::install("flowCore")
bibliothèque (FlowSOM) - Chargez les données brutes fournies dans les fichiers supplémentaires 4.1-4.8 (entrée FCS FlowSOM), qui étaient auparavant fermées sur les événements CD161, en R avec la fonction read.flowSet.
fcs_raw 'lt;- read.flowSet(path'"C: 'Users'''username''Desktop'tocluster' , modèle '.fcs', transformation 'FALSE, truncate_max_range 'FALSE, seed'123) - Sélectionnez les marqueurs biologiques pertinents (supprimer « Contexte » ou « Temps ») en sélectionnant les colonnes appropriées et transformez les données d'une manière arcsinh5 comme indiqué dans le code ci-dessous (ici, supprimez les colonnes 1, 2, 4, 5, 6, 17, 21, 24, 25, 34, 35, 37, 38, 51, qui ne correspondent à aucun marqueur biologique). Appliquer un cofactor de 5 comme précédemment appliqué avec Cytosplore, en choisissant cofactor 5 dans la fonction ci-dessous.
fcs_raw 'lt;- fsApply(fcs_raw, fonction(x, cofactor'5)
colnames(x) 'lt;- fcs_raw[[1]]@parameters@data$desc
expr 'lt;- exprs(x)
expr 'lt;- asinh(expr[,-c(1,2,4,5,6,17,21,24,25,34,35,37,38,51)]/ cofactor)
exprs(x) 'lt;- expr
retour (x)MD) - Regroupez les données à l'aide de la fonction FlowSOM. Pour comparer FlowSOM et Cytosplore, choisissez de regrouper les données en dix sous-ensembles que la sortie précédemment produite par Cytosplore.
fsom 'lt;- FlowSOM(fcs_raw, transformFunction ' FALSE, balance ' FALSE,
scaled.center - FALSE, scaled.scale - FALSE, silent - FALSE, colsToUse - c(1:37),
nClus 10, maxMeta 10, importance , NULL, graine 123)
REMARQUE: Cela peut être modifié manuellement par l'utilisateur. - Attribuez chaque cellule à son sous-ensemble et à son iD d'échantillon identifié.
subset_id 'lt;- as.factor(fsom$FlowSOM$map$map[,1])
niveaux (subset_id) 'lt;- fsom$metaclustering
tête (subset_id) - Chargez le fichier de métadonnées en R (disponible dans le fichier supplémentaire 5) contenant l'affectation de groupe et liez-le aux fichiers .fcs.
sampleid 'lt;- read_excel("C: 'Users'username''Desktop'sample_id.xlsx")
sampleid 'lt;- na.omit(sampleid)
sampleid$sampleID (lt;- as.factor(sampleid$sampleID)
sampleid$group 'lt;- as.factor(sampleid$group)
sampleid$CSPLR_ST 'lt;- as.factor(sampleid$CSPLR_ST)
sampleid 'lt;- as.data.frame(sampleid)
noms (sampleid)[3] 'lt;- "sampleID"
sampleID 'lt;- lapply(fsom$FlowSOM$metaData, function(x) 'rep[x[x], each 'length(x[x[1]:x[2]))
attr (sampleID, 'noms') 'lt;- NULL
sampleID 'lt;- as.factor(unlist(sampleID))
sampleid 'lt;- data.frame(sampleid)
niveaux (sampleID) 'lt;- coller("ID", 1:dim(sampleid)[1], sep '")
df 'lt;- data.frame(subset_id, sampleID, fsom$FlowSOM$data[, c(1:37)])
renommer le nom de lt;- data.frame(colpar-fcs_raw[[1]]@parameters@data$desc)
colnames (df) 'lt;- c("clusterID", "sampleID", rename$colpar[c(1:37)])
df$ clusterID 'lt;- as.factor(df$ clusterID)
df$sampleID (lt;- as.factor(df$sampleID) - Créez un cfList basé sur le dataframe obtenu de FlowSOM en exécutant le script suivant :
cfData 'lt;- cfList(échantillons ' sampleid,
expr et df) - Réordonnez aux marqueurs d'apparaître de la même manière que la sortie de l'analyse Cytosplore.
cfData@expr 'lt;- cfData@expr[,c(1,2,34,36,37,10,23,24,31,22,
38,15,8,3,27,9,11,28,35,26,
14,33,17,20,21,18,25,29,13,
30,12,16,32,4,5,6,7,19,39)]
REMARQUE: Le clustering par FlowSOM est maintenant terminé. Ensuite, effectuez la visualisation de la sortie de clustering.
- Installez d'abord FlowSOM en R en exécutant la commande suivante :
3. Visualisation : Analyse de clustering post-traitement
REMARQUE: Cette étape est une méthode commune aux deux méthodes de clustering. Par conséquent, il peut être effectué après le regroupement soit avec FlowSOM ou Cytosplore.
- Avant de créer les cartes thermiques, générer le tableau de comptage par échantillon en utilisant la fonction cellCounts comme indiqué dans le code ci-dessous. Étant donné que certains clusters contiennent moins de cellules que d'autres, écaillez les données par cluster en spécifiant « échelle et VRAI » à l'intérieur de la cellule de fonctionCompte, de sorte que la dispersion entre les échantillons peut être facilement visible.
cfData 'lt;- cellCounts(cfData, fréquence 'TRUE, échelle 'TRUE)
REMARQUE: Les données peuvent maintenant être visualisées. - Visualisez avec la carte thermique.
REMARQUE: L'une des principales fonctions de ce paquet est cytoHeatmaps, qui est utilisé pour visualiser le phénotype des clusters créés ainsi que leur hétérogénéité par rapport aux échantillons.
cytoHeatmaps (cfData, groupe "groupe", légende-TRUE) - Visualisation avec boxplots
REMARQUE: Les données peuvent être représentées de manière quantitative en appelant la fonction cytoBoxplots. La sortie de cette fonction représente la proportion de chaque échantillon pour chaque cluster.- Générez le nombre de cellules comme il est fait à l'étape 3.1, mais n'écaillez pas les données pour obtenir la fréquence de chaque cluster.
cfData 'lt;- cellCounts(cfData, fréquence 'TRUE, échelle 'FALSE'
cytoBoxplots (cfData, groupe et "groupe")
- Générez le nombre de cellules comme il est fait à l'étape 3.1, mais n'écaillez pas les données pour obtenir la fréquence de chaque cluster.
- Visualisation avec histogramme de signal d'intensité médiane
REMARQUE: Les données peuvent également être visualisées en représentant l'histogramme du signal d'intensité médiane.- Visualisez l'intensité d'expression de trois marqueurs : CD45, CD11c et CD54.
- Vérifiez les noms des marqueurs souhaités en appelant la ligne suivante. Notez les noms des marqueurs et incluez-les dans la fonction msiPlot.
noms (cfData@expr)
REMARQUE: Ici, concentrez-vous sur CD45, CD11c et CD54. Vérifiez l'orthographe exacte des marqueurs et ajustez-les si nécessaire :
msiPlot (cfData, marqueurs c("89Y_CD45", "167Er_CD11c" 164Dy_CD54"), parGroup''group')
Résultats
Le flux de travail Cytofast (Figure 1) est destiné à fournir un aperçu quantitatif et qualitatif des données initialement regroupées par un logiciel d'analyse (c.-à-d. FlowSOM ou Cytosplore). Cytofast exécute plusieurs sorties possibles, y compris la carte thermique de tous les clusters identifiés dans l'analyse et basés sur l'expression des marqueurs (Figure 2 et Figure 3). Le dendrogramme en haut représente la similitude hiérarchique entre les grappes identifiées. Le panneau supérieur affiche une autre carte thermique indiquant la quantité relative de sous-ensembles correspondants dans chaque échantillon. Le dendrogramme de droite montre la similitude entre les échantillons et est basé sur le clustering hiérarchique effectué sur les distances eucliden entre les échantillons. Les cartes thermiques combinées sont indiquées pour FlowSOM suivie de Cytofast à la figure 2 et de Cytosplore, suivie de Cytofast à la figure 3. Cytofast peut également être utilisé pour présenter les données quantitativement et afficher les résultats dans boxplots (en utilisant la fonction cytoBoxplots), comme indiqué dans la figure 4 et la figure 5.
Des grappes similaires ont été trouvées entre les deux méthodes différentes (p. ex., le cluster 8 de Cytosplore correspond au cluster 10 de FlowSOM), et la co-expression de certains marqueurs inhibiteurs comme le PD-1 et le LAG-3 étaient encore visibles dans les deux méthodes). Les deux méthodes de regroupement ont permis la discrimination entre PD-L1 vs. Souris traitées par PBS. En revanche, certaines différences entre les deux méthodes peuvent être mises en évidence. FlowSOM identifie 2 clusters (MHC-II), alors que Cytosplore ne montre qu'un seul cluster (MHC-IIet dim). Cela est dû à la stratégie initiale de gating dans laquelle les cellules NK ont été fermées manuellement sur les cellules CD161, puis traitées par FlowSOM. Cependant, Cytosplore a automatiquement fermé les cellules de la population CD45- sur le premier niveau HSNE, qui ont ensuite été regroupés dans un niveau hiérarchique plus élevé. Ainsi, Cytosplore a défini les sous-ensembles de cellules NK plus précisément que la façon dont le gating manuel s'est concentré sur CD161. Néanmoins, le regroupement hiérarchique des échantillons a été préservé, comme le montre le dendrogramme de droite, ce qui indique que la ségrégation entre les deux groupes (PD-L1 et PBS) ne dépendait pas de la méthode de clustering choisie.
Le nombre de clusters peut être défini manuellement à l'aide des deux méthodes. Cytofast permet à l'utilisateur d'évaluer l'hétérogénéité de ses données et peut fournir un aperçu de la façon de choisir le nombre de clusters dans lesquels les données doivent être divisées. D'autres caractéristiques sont incluses dans le paquet Cytofast, comme la fonction msiPlot (étape 3.4.2), montrant la parcelle médiane d'intensité du signal (MSI) de chaque marqueur par groupe (figure 6 et figure 7). Cette fonction permet la détection des changements globaux, tels que l'augmentation de l'expression de CD54 ou CD11c dans les cellules NK du groupe Traité PD-L1. Des fonctionnalités facultatives peuvent être incorporées dans le paquet Cytofast, comme l'affichage des données dans des graphiques à barres et d'autres méthodes de représentation des données. Ce dernier nécessite l'ajout d'outils ggplot, qui peuvent être générés par R.
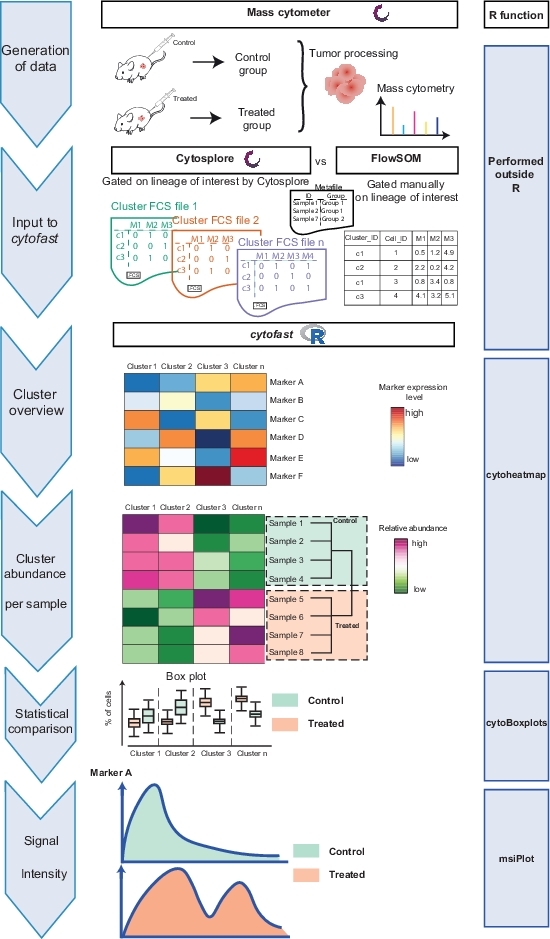
Figure 1 : Flux de travail du paquet Cytofast. Les données ont été produites par cytométrie de masse d'une tumeur 3 jours après traitement avec l'immunothérapie ou laissées non traitées. Deux techniques de clustering différentes ont été comparées : Cytosplore et FlowSOM. Cytofast a été utilisé pour visualiser les différences entre les deux techniques. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
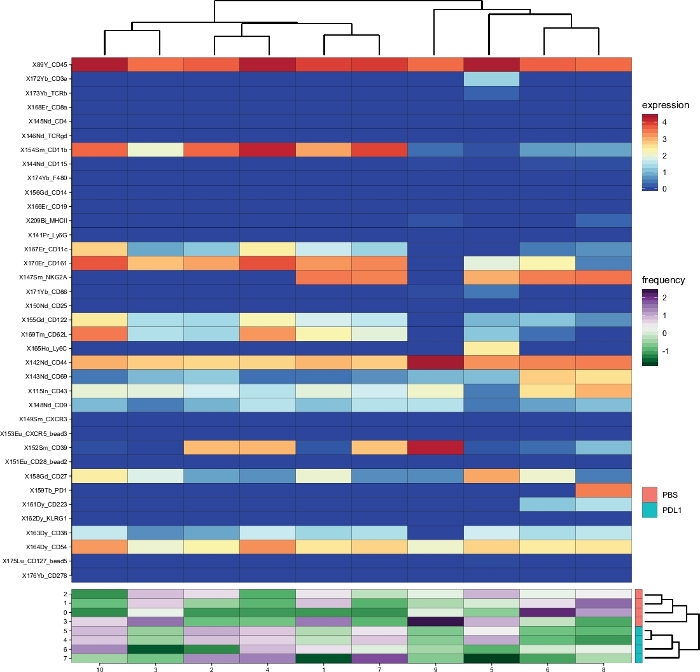
Figure 2 : Aperçu des grappes et abondance des grappes par groupe analysépar par Cytofast après Cytosplore. Heatmap de tous les amas de cellules NK (CD161et cellules définies automatiquement par Cytosplore), qui ont été identifiés 3 jours après l'immunothérapie (PD-L1). Les données présentées sont basées sur le regroupement cytosplore et regroupées à partir des groupes traités non traités et PD-L1. Les niveaux du marqueur d'expression transformé par ArcSinh5 sont affichés sur une échelle arc-en-ciel. Sur le panneau inférieur, l'abondance relative de chaque échantillon est représentée par l'échelle verte à violette. Le dendrogramme de droite représente la similitude entre les échantillons basés sur des fréquences sous-ensembles. L'échelle de fréquence représente la dispersion de la moyenne. Une fréquence basse ou élevée est représentée par une couleur verte ou violette, respectivement. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
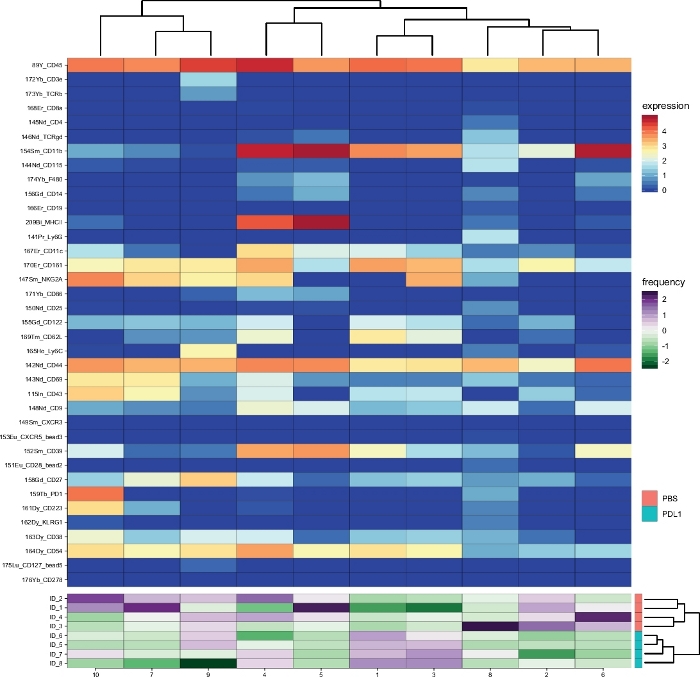
Figure 3 : Aperçu des grappes et abondance des grappes par groupe analysépar par Cytofast après FlowSOM. Heatmap de tous les amas de cellules NK (pré-fermé sur CD161- événements), qui ont été identifiés 3 jours après l'immunothérapie (PD-L1). Les données présentées sont basées sur le regroupement FlowSOM et regroupées à partir des groupes traités non traités et PD-L1. Les niveaux du marqueur d'expression transformé par ArcSinh5 sont affichés sur une échelle arc-en-ciel. Sur le panneau inférieur, l'abondance relative de chaque échantillon est représentée par l'échelle verte à violette. Le dendrogramme de droite représente la similitude entre les échantillons basés sur des fréquences sous-ensembles. L'échelle de fréquence représente la dispersion de la moyenne. Une fréquence basse ou élevée est représentée par une couleur verte ou violette, respectivement. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
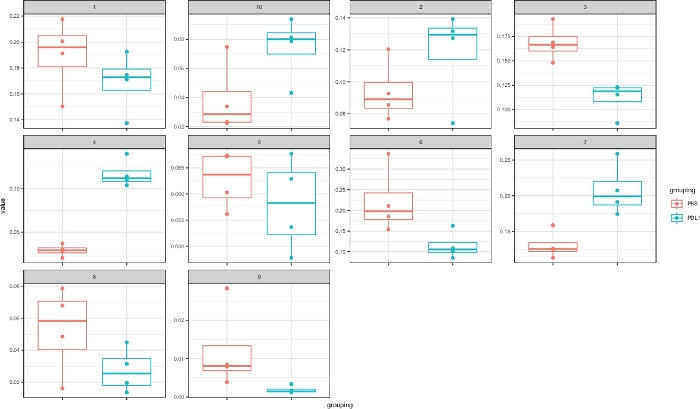
Figure 4 : Représentation cytorapide avec des parcelles de boîtes des clusters définis par Cytosplore. La fréquence de chaque cluster est représentée dans un boxplot, séparés en deux groupes (PBS et PD-L1). Un point individuel correspond à une souris. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
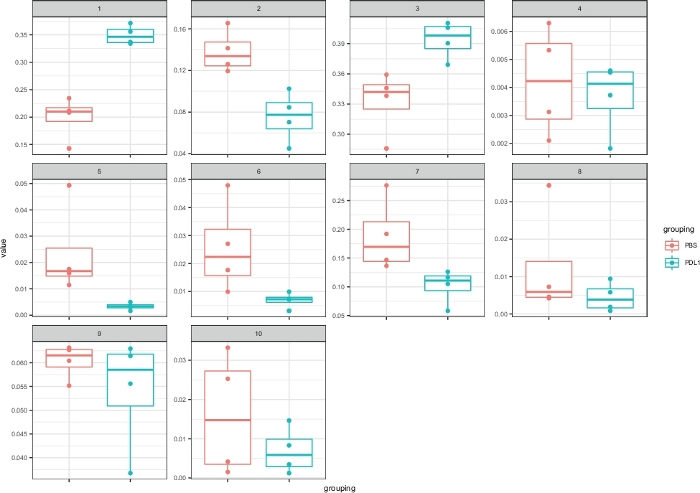
Figure 5 : Représentation cytorapide avec des parcelles de boîtes des clusters définis par FlowSOM. La fréquence de chaque cluster est représentée dans un boxplot, séparés en deux groupes (PBS et PD-L1). Un point individuel correspond à une souris. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
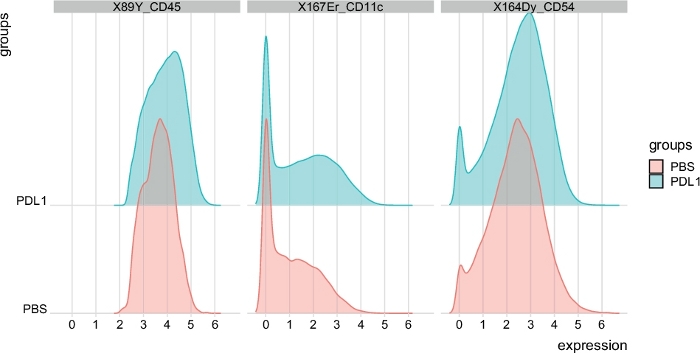
Figure 6 : Répartition des parcelles d'intensité du signal à partir de cellules NK automatiquement fermées par Cytosplore. La distribution des intensités de signal est indiquée dans un histogramme pour trois marqueurs spécifiques : CD45, CD11c et CD54. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
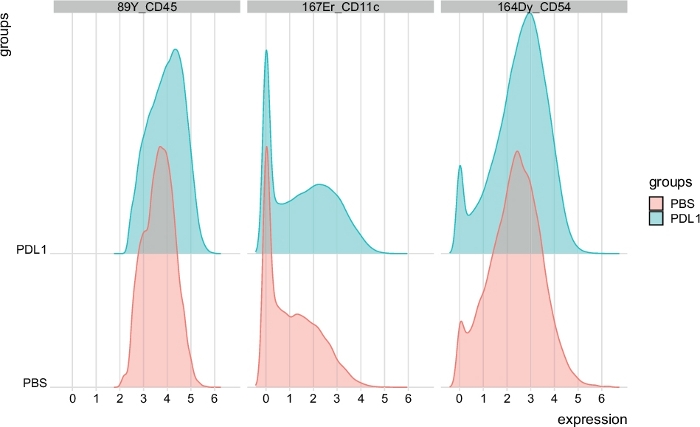
Figure 7 : Répartition des parcelles d'intensité du signal à partir de cellules NK automatiquement fermées par FlowSOM. La répartition des intensités de signal est indiquée dans un histogramme pour trois marqueurs spécifiques : CD45, CD11c et CD54, séparés par les groupes PBS et PD-L1. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Fichiers supplémentaires 1.1-1.8. S'il vous plaît cliquez ici pour voir ce fichier (Clic droit pour télécharger).
Fichiers supplémentaires 2.1-2.10. S'il vous plaît cliquez ici pour voir ce fichier (Clic droit pour télécharger).
Dossier supplémentaire 3. S'il vous plaît cliquez ici pour voir ce fichier (Clic droit pour télécharger).
Fichiers supplémentaires 4.1-4.8. S'il vous plaît cliquez ici pour voir ce fichier (Clic droit pour télécharger).
Dossier supplémentaire 5. S'il vous plaît cliquez ici pour voir ce fichier (Clic droit pour télécharger).
Discussion
Cytofast est un outil de calcul rapide qui fournit une exploration rapide et globale des données cytométriques en mettant en évidence et en quantifiant des sous-ensembles cellulaires spécifiques au traitement. Le protocole décrit vise à traiter davantage les analyses de regroupement avec Cytosplore ou FlowSOM. D'autres outils d'analyse de clustering sont appropriés pour Cytofast,mais cela nécessite l'utilisation de Cytofast pour assigner chaque cellule à un sous-ensemble. Cytofast, cependant, n'est pas une méthode de clustering, et nécessite donc des procédures de regroupement avant utilisation.
L'analyse effectuée ici a montré que certains sous-ensembles de cellules CD161et NK dans le microenvironnement tumoral étaient sensibles à un blocus PD-L1. Ceci a été démontré par des changements dans leur phénotype et leur abondance, qui ont été observés en utilisant à la fois Cytosplore et FlowSOM comme méthodes de regroupement. Les deux méthodes distinguaient le cluster cellulaire principal de NK (CD11bet NKG2A) avec des fréquences légèrement différentes (15 % à 20 % pour Cytosplore, 30 % à 40 % pour FlowSOM). Les différences d'abondance et cette approximation n'ont pas eu d'incidence sur le modèle global, car les deux dendrogrammes affichés dans les panneaux droits de la figure 2 et de la figure 3 ont donné des résultats similaires. En utilisant Cytofast, il est donc possible (indépendant de la méthode de clustering choisie) de séparer les souris traitées par PD-L1 et non traitées sur la base d'analyses de phénotype et d'abondance des amas de cellules NK.
Selon les paramètres enregistrés, des modifications au protocole sont nécessaires. Plus précisément, certains paramètres tels que le temps et l'arrière-plan doivent être supprimés lors de l'analyse de clustering. En outre, il est important que chaque cellule soit assignée à un sous-ensemble. La fonction cfData ajoutera simplement les numérations cellulaires brutes par cluster par échantillon dans la liste cfList. À partir de cette étape, la cytoheatmap peut être construite comme expliqué dans la section 3.
Cytofast a été utilisé avec succès comme outil de visualisation et de quantification pour comparer différentes méthodes de clustering13. Ce paquet R est également compatible avec des fonctionnalités avancées, telles que le globaltest14, qui peut tester les associations entre les groupes de clusters en utilisant des variables cliniques. À l'avenir, l'outil globaltest et d'autres algorithmes pourront être intégrés à Cytofast pour une visualisation et une quantification plus approfondies.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Nous reconnaissons le financement par la Commission européenne d'un prix H2020 MSCA sous la proposition numéro 675743 (ISPIC). Nous remercions Tetje van der Sluis et Iris Pardieck d'avoir testé le protocole.
matériels
| Name | Company | Catalog Number | Comments |
| Computer | Dell | NA | NA |
Références
- Anchang, B., et al. Visualization and cellular hierarchy inference of single-cell data using SPADE. Nature Protocols. 11 (7), 1264-1279 (2016).
- Zunder, E. R., Lujan, E., Goltsev, Y., Wernig, M., Nolan, G. P. A continuous molecular roadmap to iPSC reprogramming through progression analysis of single-cell mass cytometry. Cell Stem Cell. 16 (3), 323-337 (2015).
- Van Gassen, S., et al. FlowSOM: Using self-organizing maps for visualization and interpretation of cytometry data. Cytometry A. 87 (7), 636-645 (2015).
- Levine, J. H., et al. Data-Driven Phenotypic Dissection of AML Reveals Progenitor-like Cells that Correlate with Prognosis. Cell. 162 (1), 184-197 (2015).
- Samusik, N., Good, Z., Spitzer, M. H., Davis, K. L., Nolan, G. P. Automated mapping of phenotype space with single-cell data. Nature Methods. 13 (6), 493-496 (2016).
- Spitzer, M. H., et al. An interactive reference framework for modeling a dynamic immune system. Science. 349 (6244), 1259425 (2015).
- Hotelling, H. Analysis of a complex of statistical variables into principal components. Journal of Educational Psychology. 24 (6), 417-441 (1933).
- van der Maaten, L., Hinton, G. Visualizing Data using t-SNE. Journal of Machine Learning Research. , (2008).
- Pezzotti, N., Hollt, T., Lelieveldt, B., Eisemann, E., Vilanova, A. Hierarchical Stochastic Neighbor Embedding. Computer Graphics Forum. 35 (3), 21-30 (2016).
- Becht, E., et al. Dimensionality reduction for visualizing single-cell data using UMAP. Nature Biotechnology. 37, 38 (2018).
- Haghverdi, L., Buettner, F., Theis, F. J. Diffusion maps for high-dimensional single-cell analysis of differentiation data. Bioinformatics. 31 (18), 2989-2998 (2015).
- Beyrend, G., Stam, K., Höllt, T., Ossendorp, F., Arens, R. Cytofast: A workflow for visual and quantitative analysis of flow and mass cytometry data to discover immune signatures and correlations. Computational and Structural Biotechnology Journal. 16, 435-442 (2018).
- Beyrend, G., et al. PD-L1 blockade engages tumor-infiltrating lymphocytes to co-express targetable activating and inhibitory receptors. Journal for ImmunoTherapy of Cancer. 7 (1), 217 (2019).
- Goeman, J. J., van de Geer, S. A., de Kort, F., van Houwelingen, H. C. A global test for groups of genes: testing association with a clinical outcome. Bioinformatics. 20 (1), 93-99 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon