Method Article
ارتفاع الإنتاجية الخميرة سلالة Phenotyping مع تسلسل الحمض النووي الريبي القائم على دروبليت
In This Article
Summary
والاختناق في دورة "التصميم وبناء الاختبار" من الهندسة الميكروبية هو السرعة التي يمكننا أن تؤدي شاشات وظيفية من سلالات. نحن نصف طريقة عالية الإنتاجية لفحص الإجهاد المطبقة على مئات إلى آلاف خلايا الخميرة لكل تجربة تستخدم تسلسل الحمض النووي الريبي القائم على قطرات.
Abstract
جعلت الأدوات القوية المتاحة لـ تحرير جينوم الخميرة هذا الميكروب منصة قيمة للهندسة. وفي حين أنه من الممكن الآن بناء مكتبات لملايين السلالات المتميزة وراثيا، فإن فحص النمط الظاهري المطلوب لا يزال يشكل عقبة كبيرة. مع تقنيات الفحص الحالية ، هناك مقايضة بين إخراج المعلومات والإنتاجية ، مع إجراء فحص عالي الإنتاجية عادة على منتج واحد من المنتجات ذات الأهمية. لذلك ، نقدم نهجًا لتسريع فحص السلالة عن طريق تكييف تسلسل الحمض النووي الريبي أحادي الخلية لمستعمرات بيكولتر الأيزوجين لسلالات الخميرة المهندسة وراثيًا. للتصدي للتحديات الفريدة من أداء تسلسل الحمض النووي الريبي على خلايا الخميرة، ونحن ثقافة مستعمرات الخميرة الهينة داخل hydrogels وspheroplast قبل تنفيذ تسلسل الحمض النووي الريبي. يمكن استخدام بيانات تسلسل الحمض النووي الريبي لاستنتاج الأنماط الظاهرية الخميرة وفرز المسارات المهندسة. إن قابلية أسلوبنا للانتشار تعالج عقبة حرجة في الهندسة الميكروبية.
Introduction
الهدف الأساسي من الهندسة الميكروبية هو تعديل الميكروبات لحثها على إنتاج مركبات قيمة1،2. S. cerevisiae كان الكائن الرئيسي للهندسة الميكروبية نظرا لسهولة الثقافة واتساع الأدوات المتاحة لهندسة الجينوم3،4،5. ومع ذلك ، لا تزال هناك عقبة في أداء الشاشات الوظيفية على الخميرة المعدلة: يتخلف فحص الإنتاجية عن هندسة الجينوم حسب أوامر الحجم. الفحص عادة ما ينطوي على عزل سلالات في لوحات microwell وphenotyping لهم عن طريق قياس إنتاج مركب معين6,7. ومحدودة الإنتاجية من هذه العملية من قبل كميات كبيرة من الكاشف اللازمة لإجهاد الفردية في ردود فعل مائة ميكرولتر. يوفر السوائل الدقيقة القطرة حلا جذابا لزيادة الإنتاجية من فحص الخميرة من قبل أوامر من حجم عن طريق خفض ردود الفعل التي تؤديها عادة في لوحات جيدا8. ومع ذلك ، كما هو الحال مع شاشات لوحة جيدة ، عادة ما تكتشف شاشات القطرات مركبات المنتج الواحد ، والتي توفر معلومات محدودة في الوظيفة العالمية للمسار المهندس9،10،11.
قد يمكّن تسلسل الحمض النووي الريبي (RNA-seq) من تحديد توصيف أكثر شمولاً لعملية المسار من خلال السماح بتقييم مستويات التعبير لجميع الجينات ذات الصلة في وقت واحد12,13. وعلاوة على ذلك، أساليب قطرة تسمح الآلاف من الخلايا ليتم تعريفها لكل تجربة، وتوفير الإنتاجية اللازمة لفحص المكتبات من المتغيرات المهندسة14،15. ومع ذلك، يتم تحسين أساليب RNA-seq لخلايا الثدييات. الخميرة، على سبيل المقارنة، لديها أقل مرنا لكل خلية وجدار الخلية التي من الصعب إزالة16،مما يمنع تسلسلها بالطرق القائمة. إذا كان يمكن ابتكار طريقة قطرات عالية الإنتاجية لتمكين الخميرة RNA-seq ، فمن شأنه أن يوفر منصة فينومينب قابلة للتطوير وفعالة من حيث التكلفة وغنية بالمعلومات لهندسة الخميرة.
نحن نقدم بروتوكول مفصل من طريقتنا وضعت مؤخرا لتسلسل خلايا الخميرة باستخدام microfluidics قطرات عالية الإنتاجية17. للتغلب على التحدي من الجيش الملكي النيبالي محدودة، ونحن تغليف والثقافة خلايا الخميرة واحد في مجالات هيدروجيل بيكولتر. الثقافة يكرر الخلايا، مما ينتج مئات النسخ تقاسم نفس المسار المهندسة. وهذا يقلل من الاختلاف بسبب التعبير الجيني خلية واحدة في حين زيادة كبيرة في كمية الحمض النووي الريبي المتاحة لتسلسل. بعد التضخيم القائم على الثقافة ، نقوم بتسريع الخلايا ، وإزالة جدار الخلية عن طريق الهضم الأنزيمي السائب. تظل أغشية الخلايا سليمة ، بحيث تظل كل مستعمرة مسببة للتسبب وmRNA المرتبطة بها مغلفة في مجالات الهيدروجيل الخاصة بها. وهذا يسمح لنا لإقران المستعمرات الفردية مع الكواشف التقاط مرنا والعازلة lysis، وmRNA ليتم التقاطها، الباركود، وتسلسل بعد سير عمل قطرة Seq14. لدينا طريقة تسمح النسخ على نطاق واسع فحص الآلاف من مستعمرات الخميرة المسببة للانتشار في كل تجربة.
Protocol
1. تصنيع جهاز Microfluidic
- تصنيع الماجستير SU-8
- تصميم قناع سلبي للقنوات microfluidic للجهاز A و B(ملف تكميلي 1 و 2)باستخدام برامج التصميم بمساعدة الكمبيوتر وطباعتها على فيلم لوحة الدوائر مع دقة 10 ميكرومتر على الأقل.
- ضع رقاقة سيليكون نظيفة من عيار 75 مم على معطف تدور وصب حوالي 1 مل من SU-8 على مركزها. بدوره على فراغ لتأمين رقاقة لتشاك.
- للجهاز A، تدور معطف SU-8 2150 في 500 دورة في الدقيقة لمدة 30 ق، تليها 30 s في 2750 دورة في الدقيقة. للجهاز B، تدور معطف SU-8 2100 في 500 دورة في الدقيقة لمدة 30 ق، تليها 30 s في 2500 دورة في الدقيقة. وسيؤدي ذلك إلى إنتاج طبقات من سمك SU-8 200 ميكرومتر و120 ميكرومتر على التوالي.
- إزالة رقاقة من تدور معطف ووضعها على hotplate في 95 درجة مئوية لمدة 60 دقيقة لخبز لينة.
- إزالة رقاقة من hotplate والسماح لها تهدئة إلى درجة حرارة الغرفة. ضع القناع فوق الرقاقة، واعرض تحت مُرّاب 190 مو و، 365 نانومتر للأشعة فوق البنفسجية LED لمدة دقيقتين.
- ضع الرقاقة على لوحة ساخنة عند درجة حرارة 95 درجة مئوية لمدة 5 دقيقة للخبز بعد التعرض.
- إزالة رقاقة والسماح لها تهدئة إلى درجة حرارة الغرفة. وضع رقاقة في حمام من خلات الأثير أحادي الميثيل البروبيلين غليكول (PGMEA) لمدة 20 دقيقة.
- شطف رقاقة مع PGMEA تليها isopropanol. إذا كان أي بقايا معتمة مرئية خلال هذه العملية، كرر الرعنة مع PGMEA وisopropanol. الهواء يجفف الرقاقة.
- ضع الرقاقة على لوحة ساخنة عند درجة حرارة 95 درجة مئوية لمدة 3 دقيقة.
- إزالة ووضع رقاقة في 90 ملم قطرها طبق بيتري.
- Polydimethylsiloxane (PDMS) الصب على SU-8 الرئيسي
- مزيج معا نسبة كتلة 10:1 من قاعدة السيليكون إلى عامل علاج. Degas PDMS بعد خلط لحوالي 30 دقيقة.
- صب PDMS degassed على رأس سيد SU-8 حتى يتم تشكيل طبقة 5 مم على الأقل سميكة على رأس رقاقة.
- Degas PDMS على رأس رقاقة لمدة 30 دقيقة.
- وضع رقاقة في فرن 65 درجة مئوية لمدة 80 دقيقة على الأقل لعلاج PDMS.
- قطع لوح PDMS الشفاء من رقاقة.
- ضع لوح PDMS مع الميزات الدقيقة التي تواجه صعودا، ولكمة مدخل وفتحات منفذ مع لكمة خزعة 0.75 ملم.
- قم بتنظيف شريحة زجاجية مقاس 50 مم × 75 مم باستخدام isopropanol وإزالة جميع الغبار من جانب الميزات الدقيقة للوح PDMS مع الشريط.
- كشف الشريحة الزجاجية تنظيف ولوح PDMS مع ميزات microfluidic مواجهة تصل إلى 100 باسكال (1 mbar O2)البلازما لمدة 1 دقيقة.
- ضع لوح PDMS مع الميزات وجه لأسفل على الشريحة الزجاجية للسماح بالترابط. ضع الشريحة في فرن 65 درجة مئوية لمدة 30 دقيقة على الأقل لإكمال الترابط.
- علاج جميع القنوات microfluidic عن طريق التنظيف مع السائل المعالجة السطحية المفلورة. يخبز الجهاز في فرن 65 درجة مئوية لمدة 10 دقيقة على الأقل لتبخير السائل.
2. تغليف الخميرة في hydrogels باستخدام الجهاز A
- تأخذ الخميرة المتنامية في ثقافة التعليق والاعتماد على مقياس الهيموكيتومتر.
- إعادة تعليق الخلايا في الفوسفات المالحة المخزنة مؤقتا (PBS) إلى تركيز حوالي 750 ك / مل. وهذا يضمن أن 30٪ من hydrogels سيكون لها خلية خميرة واحدة فيها. فقط حوالي نصف خلايا الخميرة تنمو لتصبح مستعمرات ، مما يؤدي إلى ~ 15 ٪ من الهيدروجيلات التي تحتوي على مستعمرات الخميرة.
- مزيج ultralow نقطة انصهار agarose في 2 ٪ ث / ث في برنامج تلفزيوني والحرارة في 90 درجة مئوية حتى ذاب. هذا يستغرق ~ 10 دقيقة.
- قم بتحميل مزيج agarose في حقنة مع فلتر 0.22 ميكرومتر مرفق في مضخة حقنة أمام سخان الفضاء المحدد إلى 80 درجة مئوية.
- تحميل حقنة مليئة تعليق الخميرة وحقنة تحتوي على النفط المفلور مع 2٪ ث / v الفلوروسورفاكتن18 في مضخات حقنة.
- خذ جهاز تقسيم قطرة التدفق المشترك المصنوعة في القسم 1 وقم بتوصيل الأنابيب من المحاقن إلى الجهاز. دليل أنابيب من منفذ إلى 15 مل أنبوب مخروطي في دلو الثلج لجمع قطرة.
- تدفق في الحلول الثلاثة إلى الجهاز مع معدلات التدفق التالية:
- تدفق تعليق الخميرة مع معدل تدفق 3 مل / ساعة.
- تدفق خليط agarose بمعدل تدفق 3 مل / ساعة.
- تدفق النفط المفلور بمعدل تدفق 15 مل / ساعة.
- جمع حوالي 1 مل من المستحلب. انتظر 5 دقيقة إضافية للسماح للagarose لتعيين تماما.
3. كسر وغسل هلام للثقافة
- إضافة حجم متساو من 20٪ perfluorooctanol (PFO) في النفط المفلور إلى مستحلب. عكس أنبوب مخروطي لعدة مرات للسماح للخلط.
- تدور أسفل مستحلب مكسورة في 2,000 × ز لمدة 2 دقيقة. سوف بيليه المواد الهلامية فوق مراحل النفط وPFO.
- إزالة مرحلة النفط وإضافة 2 مل من العازلة TE-TW (10 mM تريس درجة الحموضة = 8.0، 1 mM EDTA، 0.01٪ Tween-20) لإعادة تعليق المواد الهلامية. نقل التعليق إلى أنبوب مخروطي جديد 15 مل.
- بيليه أسفل المواد الهلامية كما هو الحال في الخطوة 3.2 وغسل مرة واحدة أكثر في TE-TW لما مجموعه اثنين من يغسل.
- إزالة supernatant وإعادة تعليق المواد الهلامية في 2 مل من وسائل الإعلام. نقل إلى أنبوب ثقافة 5 مل.
- احتضان في 30 درجة مئوية بين عشية وضحاها تحت اهتزاز.
ملاحظة: بعد الحضانة بين عشية وضحاها، يمكن الاحتفاظ هيدروجيلات الخميرة في 4 درجة مئوية لعدة أيام.
4. مستعمرة الخميرة lysis
- نقل المواد الهلامية إلى أنبوب مخروطي 15 مل وهيدروجيل بيليه في 2000 × ز لمدة 2 دقيقة.
- غسل الهيدروجيل اتّصال في PBS 2x.
- يغسل في 1x spheroplasting المخزن المؤقت 1x.
- إجراء تخفيف 2-50x من إنزيم spheroplasting في عازلة spheroplasting وإضافة 1 مل إلى hydrogels.
- احتضان في 37 درجة مئوية لمدة 1 ساعة. الخميرة المعالجة سوف تبدو أكثر شفافية(الشكل 3A).
- خذ أسفل 0.8 مل من تعليق الهيدروجيل ونقلها إلى حقنة 1 مل غير المغطاة.
- ضع الحقنة في حامل المحاقن المطبوع ثلاثي الأبعاد(ملف تكميلي 3)وتدور عند 2000 × ز لمدة دقيقتين. وهذا سوف يسبب hydrogels لإغلاق حزمة في رأس حقنة.
5. mRNA التقاط من مستعمرات الخميرة مبلأ باستخدام الجهاز B
- تأخذ 240،000 قطرات Seq الخرز ونقل ها إلى 15 مل أنبوب مخروطي.
- بيليه قطرات Seq الخرز عن طريق الغزل أسفل في 1000 × ز لمدة 1 دقيقة.
- إزالة الخرز supernatant وإعادة تعليق في 2 مل من 0.9x الخميرة محلول الزليس المخزن المؤقت مع كلوريد الصوديوم 500 mM لتركيز تعليق حبة من 120،000 الخرز / مل.
- نقل تعليق البزة إلى حقنة 3 مل مع شريط ضجة إدراجها.
- إعداد حقنة تحتوي على عدة ملليلتر من 2٪ ث / ضد بيرفلوروبوليثر بولي إيثيلين غليكول (PFPE-PEG) السطحي في النفط المفلور.
- أخلي كل رأس الحقنة المائية التي تحتوي على هيدروجيلات قريبة التعبئة وقم بغطاء الحقنة.
- أدخل الهيدروجيل وتعليق الزمرة والمحاقن الزيتية في مضخات الحقنة واتصل عبر الأنابيب في جهاز التغليف المصنوعة في القسم 1.
- تواصل من أنبوب منفذ في أنبوب مخروطي 50 مل على الجليد.
- تدفق في الحلول الثلاثة إلى الجهاز مع معدلات التدفق التالية:
- تدفق hydrogels في 0.4 مل / ساعة.
- تدفق تعليق البزة في 0.4 مل / ساعة.
- تدفق النفط المفلور في 1.6 مل / ساعة.
- جمع ~ 1 مل من مستحلب أو تشغيل الجهاز حتى لا يكون هناك المزيد من hydrogels اليسار.
6. توليد cDNA، وتسلسل إعداد المكتبة، وتسلسل
- إضافة 30 مل من المخزن المؤقت SSC 6x و 1 مل من PFO إلى مستحلب التي تم جمعها كما هو مذكور في بروتوكول Drop-Seq14.
- استمر في اتباع بروتوكول Drop-Seq لتوليد cDNA من mRNA الملتقطة على الخرز وإعداد مكتبة التسلسل وتحليل بيانات التسلسل.
النتائج
قمنا بتكييف سير عمل Drop-Seq14 المنشور سابقًا لتسلسل المستعمرة الأوخمية (ICO-seq) لأداء تنميط التعبير الجيني لمستعمرات الخميرة الإيزوجينية. عزلنا خلايا الخميرة المفردة وغلفناها في ميكروغرام أغاروز(الشكل 1A). بعد الحضانة بين عشية وضحاها من microgels ، نمت هذه الخلايا الخميرة مغلفة في مستعمرات الأيوجينية. قبل تحميل المواد الهلامية في جهاز ميكرووسيكي الثاني لالتقاط مرنا، ونحن هضم جدار خلية الخميرة لجعل مرنا أكثر سهولة(الشكل 1B،اليسار). نحن قريبة معبأة هذه microgels ودمجها الخرز التقاط مرنا والعازلة lysis. بعض قطرات تحتوي على بالضبط واحدة من البزة يقترن مع مستعمرة الخميرة معملية. تم جمع جميع الخرز في المستحلب وتوليفcDNA وتسلسلها بعد بروتوكول Drop-Seq.
قمنا بإنشاء مستعمرات الخميرة الأيزوجينية من خلال تغليف خلية خميرة واحدة داخل الهلام اتاروز باستخدام جهاز ميكروسوليشن مع ثمانية قطرة مقسم المرفقة(الشكل 2A). نحن مخففة تعليق الخميرة المدخلات إلى تركيز ~ 750،000/مل بحيث ~ 30٪ من microgels لديها بالضبط خميرة واحدة في نفوسهم. قبل إدخال درجة حرارة ذوبان رقيقة جدا agarose في الجهاز، ونحن حلها في درجة حرارة مرتفعة والحفاظ على حقنة في هذه الدرجة لمنع هلام قبل الأوان. عند تقاطع جيل القطرة(الشكل 2B)، تم تغليف خلايا الخميرة في البداية إلى قطرات 160 ميكرومتر. بعد تقاطع قطرة جيل مقسم ثمانية أضعاف تقسيم هذه القطرات إلى ثمانية قطرات 80 ميكرومتر(الشكل 2C). تم إرفاق فلتر حقنة بالاغاروز المنصهر لمنع القباقيب من التشكل داخل القنوات ، والتي يمكن أن تكون ضيقة مثل 37 ميكرومتر أثناء تقسيم القطرة. جمعنا المستحلب على الجليد ، والتي بدأت على الفور عملية هلام agarose. حسبنا تعدد التشتت من مستحلب نموذجي ليكون ~ 6٪(الشكل التكميلي 1)،على الرغم من قيم تعدد التشتت تصل إلى 10٪ مقبولة. مرة واحدة في مجموعة المواد الهلامية agarose، كسرنا مستحلب وإزالة مرحلة النفط. تم غسلالمواد الهلامية في عازل مائي قبل الانغماس في وسائل الإعلام النمو. بين عشية وضحاها حضانة microgels أدى إلى المستعمرات المسببة للسرطان تنمو داخل بعض microgels(الشكل 2D). تعتمد النسبة المئوية للهيدروجيلات التي تحتوي على مستعمرات لا تقل عن 20 خلية على ظروف الثقافة، بما في ذلك وقت الحضانة وتكوين وسائل الإعلام. في عرضنا باستخدام C. albicans، قررنا أن حوالي 15٪ من الهيدروجيل تحتوي على مستعمرة بعد 20 ساعة من ثقافة التعليق.
استخرجت جهاز ثاني coencapsulation مرنا من مستعمرات التسبب(الشكل 3A). قبل تحميل microgels الخميرة في الجهاز microfluidic، غسلنا وغمرت المواد الهلامية في حل لهضم جدران خلايا الخميرة. تم التحقق من الهضم السليم لخلايا الخميرة عن طريق المجهر ، مع الخميرة المعالجة وجود مورفولوجيا أكثر انعكاسية(الشكل 3B). نحن قريبة معبأة microgels في حقنة وضبطها معدل تدفق المدخلات هلام مثل أن هلام واحد كان في كل قطرة. تيار من الخرز التقاط مرنا في المخزن المؤقت lysis مختلطة مع تيار هلام وثيق معبأة قبل تقاطع قطرة صنع(الشكل 3C). جمعنا مستحلب الناتجة من قطرات 160 ميكرون ، وبدأت المستعمرات في الليسوو والإطلاق محتوياتها الخلوية. نحن تحميل الخرز في تخفيف الحد لتقليل عدد قطرات تحتوي على حبات متعددة، ولكن إغلاق التعبئة من المواد الهلامية أثناء قطرة صنع أدى في حوالي 10٪ من قطرات جمعت تحتوي على حبة واحدة مع مستعمرة مبلغة(الشكل 3D).
قمنا بتحليل التعبير الجيني لـ C. albicans، وهو نوع من الخميرة موجود في ميكروبيوم الأمعاء البشرية ، باستخدام سير عمل ICO-seq. C. ويلاحظ albicans لقدرته على التبديل بين دولتين خلية مختلفة، ويطلق عليه الأبيض ومبهمة19. نحن نستخدم سلالة البيكان C المهندسة، سلالة RZY122، الذي يحل محل نسخة واحدة من الجين WH11، نشطة فقط في الخلايا البيضاء مع YFP20. حصلنا على مجموعة من ملامح التعبير الجيني باستخدام سير العمل واستخدمناها لتحليل المستعمرات التي تعبر عن ما لا يقل عن 300 جين فريد. كمجموعة بيانات مرجعية ، استخدمنا بيانات التعبير C. Albicans التي تم الحصول عليها من دراسة نشرت سابقا17 وتصفيتها المستعمرات التي تعبر عن أقل من 600 جين فريد. بعد إجراء تحليل المكون الرئيسي (PC) وتضمين جار t-stochastic (tSNE) الحد من الأبعاد21، وجدنا التوافق العام بين مجموعة بيانات العينة لدينا والمرجع(الشكل 4A). وكشف تحليل جهاز الكمبيوتر أن YFP وWH11 ساهمت بشكل كبير في أول اثنين من أجهزة الكمبيوتر. وعلاوة على ذلك، كشف تحليل TSNE عن ثلاث مجموعات(الشكل 4B). وفي حين أن المجموعة 2 تتألف في الغالب من خلايا من مجموعة بيانات العينات، فإن المجموعتين 0 و 1 كانتا تتألفان من خلايا من كلتا العينتين. من خلال تراكب التعبير WH11 على tSNE(الشكل 4C، اللوحة العليا) ، قررنا أن المجموعة 1 تحتوي على الأرجح مستعمرات بيضاء. وجدنا أيضا أن التعبير STF2 زادت في المجموعة 1(الشكل 4C،اللوحة السفلى)، بما يتفق مع البيانات التي تم الحصول عليها سابقا17. في المجموعتين 0 و 2، تم تقليص تنظيم WH11 و STF2 بشكل ملحوظ مقارنة بالمجموعة 1(الشكل 4D). الجينات المشاركة في التخمير, مثل ADH1,كانت مُنظّمة في المجموعة 0, بما يتفق مع الدراسات السابقة للخلايا المبهمة22. وجدنا أن المستعمرات في المجموعة 2 قد انخفضت الحمض النووي الريبي بالمقارنة مع المستعمرات في المجموعتين 0 و 1. على الرغم من أنه تم الحصول على مجموعات البيانات العينة والمرجعية باستخدام نفس المخزون من الخلايا، إلا أن هذه النتيجة تشير إلى أنه حتى الاختلافات الدقيقة في المناولة التجريبية يمكن أن تؤثر على التعبير الجيني.
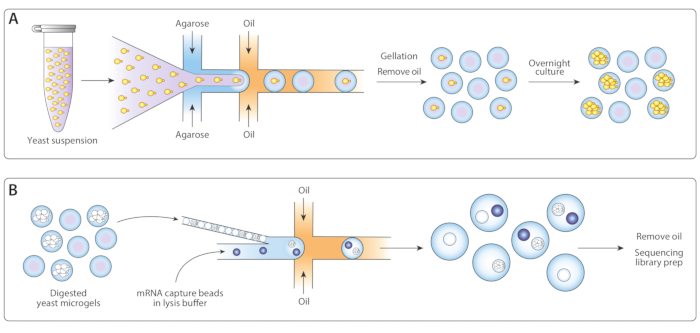
الشكل 1: نظرة عامة على سير عمل ICO-seq. (أ)تم تخفيف الخميرة المتنامية في ثقافة التعليق في العازلة وcoencapsulateed مع agarose المنصهرة في تدفق التركيز جهاز مولد قطرات لتمكين تحميل بواسون من microgels agarose مع خلايا الخميرة واحدة. مجموعة المواد الهلامية عندما تبريد agarose، تم كسر تعليق النفط / الماء، وتمت إزالة النفط، مما أسفر عن تعليق من الخرز هلام في الماء. بعد الثقافة بين عشية وضحاها، نمت خلايا الخميرة إلى مستعمرات المسببة للسرطان داخل microgels. (ب)تعرضت المستعمرات لعازل لتدهور جدار الخلية، وبعد ذلك كانت معبأة ومغلفة بالخرز التقاط مرنا في جهاز ميكرووسيكي ثان. إغلاق التعبئة من microgels ضمان كل قطرة كان هلام واحد، في حين أن تحميل بواسون من الخرز تقليل فرصة الخرز متعددة داخل قطرة واحدة. تمت معالجة القطرات التي تم جمعها لتوليف cDNA وتوليد مكتبة التسلسل. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
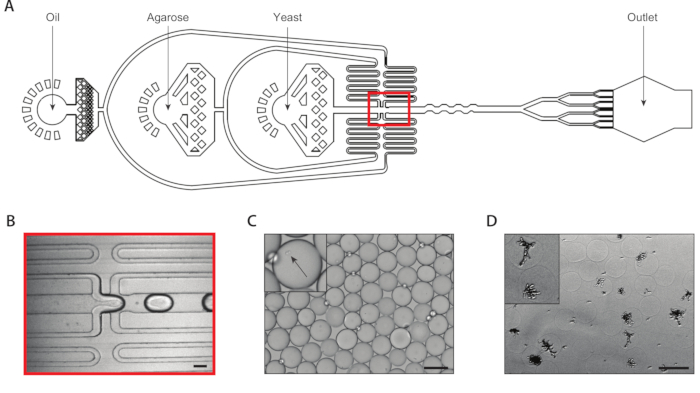
الشكل 2: جيل من مستعمرات الخميرة الأيزوجينية داخل الميكروغرام الآغاروز باستخدام الجهاز A. (أ)التخطيطية للجهاز microfluidic، تبين مواقع المدخلات الثلاثة ومنافذ الإخراج. يتم تمييز تقاطع الإسقاط باللون الأحمر. (ب)عن قرب من تقاطع قطرة صنع أثناء تشغيل الجهاز العادي. (C)ميكروجراف من قطرات جمعت، مع صورة مقربة من قطرة تحتوي على خلية مغلفة (inset). (D)ميكروجراف من مستعمرات الخميرة الإسهوجينية في الهلام اتاروز بعد حضانة على مدار 24 ساعة، مع عن قرب من مستعمرتين (inset). جميع أشرطة مقياس = 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
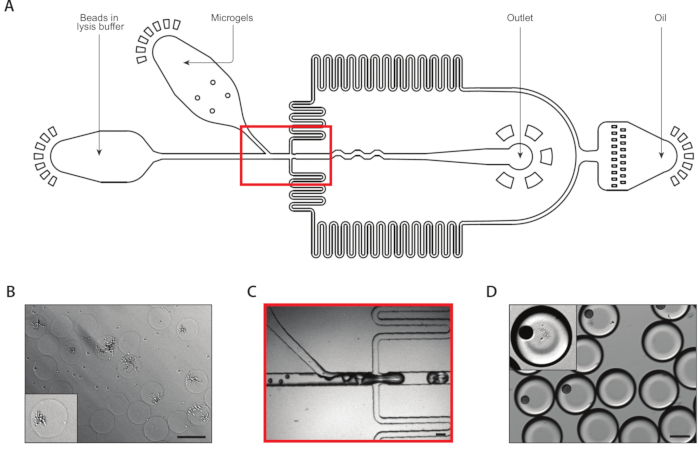
الشكل 3: الليسيس وmRNA التقاط من المستعمرات المسببة للسرطان باستخدام الجهاز B. (أ)التخطيطية للجهاز microfluidic، تبين مواقع المدخلات الثلاثة ومنافذ الإخراج. يتم تمييز تقاطع الإسقاط باللون الأحمر. (ب)ميكروجراف من مستعمرات الخميرة بعد هضم جدار الخلية، مع عن قرب من مستعمرة واحدة (inset). (C)عن قرب من تقاطع قطرة صنع أثناء تشغيل الجهاز العادي. (D)ميكروجراف المستحلبات التي تم جمعها بعد ميكروغرام ومزّق الزّد، مع صورة مقربة تظهر قطرة مع زى ومستعمرة مُلبدة (مُنقّل). جميع أشرطة مقياس = 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
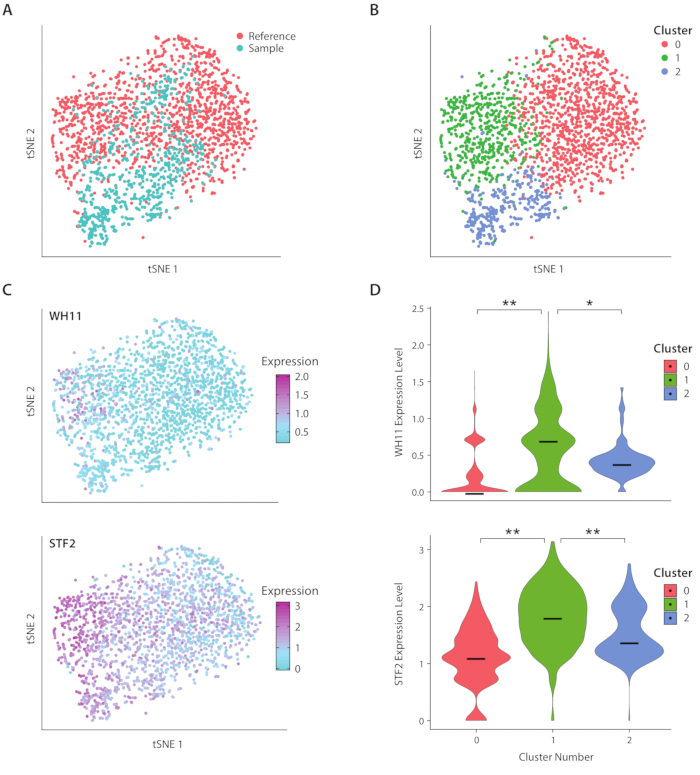
الشكل 4: تحليل استجابة التبديل البيضاء المبهمة في C. albicans. (أ)مؤامرة tSNE من مجموعة بيانات عينة جنبا إلى جنب مع مجموعة بيانات مرجعية من ليو17. (ب)تجميع النسخ يكشف عن ثلاث مجموعات تصور على مؤامرة tSNE. (ج)ساهمت الجينات الرئيسية المشاركة في استجابة التبديل البيضاء المبهمة في الاختلاف كما تم تحديده من خلال تحليل المكون الرئيسي. (D)مؤامرات الكمان من مستويات التعبير العادية من YFP و WH11 من قبل مجموعات ملحوظ على مؤامرة tSNE. ** يشير إلى P يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
الشكلان التكميليان 1 و 2. يرجى الضغط هنا لتحميل هذه filgures.
ملفات تكميلية 1-3. الرجاء الضغط هنا لتحميل هذه الملفات.
Discussion
أسلوبنا لمستعمرة الخميرة isogenic RNA تسلسل (ICO-seq) تتكيف مع نشر خلية واحدة RNA تسلسل منصة، قطرة-Seq، لفحص عالية الإنتاجية من سلالات الخميرة المهندسة. تحتوي خلايا الخميرة على أقل من 10٪ من نسخ مرنا من خلية ثديية نموذجية ولها جدار الخلية التي تحتاج إلى التدهور قبل التقاط مرنا16. هذان العاملان يحولان دون التطبيق المباشر للخميرة على Drop-Seq أو غيرها من منصات scRNA-seq المستندة إلى القطرة. لمعالجة هذه القضايا، ونحن تغليف خلايا واحدة داخل hydrogels ونزرعها في مستعمرات لتوفير ما يكفي من المواد المدخلة لتسلسل الحمض النووي الريبي ونحن هضم جدار خلية الخميرة لتوليد spheroplasts قبل تحلل والتقاط مرنا. تضيف هذه التغييرات تعقيدًا إضافيًا في سير عمل ICO-seq بالمقارنة مع سير عمل Drop-Seq الأصلي وهي خطوات هامة يجب على المستخدمين التأكد من المتابعة بسلاسة.
التشغيل السليم للجهاز A ضروري لتغليف خلايا الخميرة المفردة داخل هيدروجيلات أغاروز. يجب اتباع العد السليم لتعليق الخميرة المدخلات لتقليل عدد من hydrogels مع أكثر من خلية خميرة واحدة، مع ضمان أن تحتوي على ما يكفي من الهيدروجيلات خلية واحدة لضمان كفاءة التقاط الخلية معقولة أثناء التقاط مرنا. أثناء تشغيل الجهاز microfluidic ، يجب أن يكون خليط هلام agarose مذابًا جيدًا ومر عبر فلتر حقنة لتقليل فرصة انسداد الجهاز. خليط هلام agarose هو لزج والمنطقة التي تنقسم قناة واحدة إلى ثمانية عرضة بشكل خاص للانسداد. من خلال توسيط كاميرا عالية السرعة لتصور تشغيل الجهاز في تلك المنطقة من الجهاز ، يمكن للمستخدمين مراقبة توحيد القطرات الناشئة من كل قناة من القنوات الثماني والتفاعل بسرعة إذا تغير التوحيد بسبب القباقيب في أي من القنوات. الفحص من كمية صغيرة من المستحلب التي تم جمعها تحت المجهر يوفر طريقة ثانوية لتأكيد مستحلب عالية الجودة.
بعد نمو مستعمرات الخميرة داخل الهيدروجيلات ، هناك العديد من الاحتياطات اللازمة لضمان جودة استخراج مرنا على مستوى المستعمرة الواحدة. من المهم تحسين الخميرة الوقت في الثقافة الهيدروجيل، لأنه إذا تركت الخميرة في الثقافة لفترة طويلة جدا، وكثير من الهروب من حدود hydrogels، مما يؤدي إلى إشارة خلفية أعلى خلال تسلسل الحمض النووي الريبي وأقل حساسية عند التمييز بين أنواع الخلايا. الجيل السليم من spheroplasts باستخدام Zymolyase يضمن أن يتم الإفراج عن مرنا بعد التعرض للخلايا إلى العازلة حل الخلايا. الفحص البصري لمستعمرات الخميرة التالية Zymolyase يجب أن تسفر عن خلايا الخميرة لامعة. سوف غير لائق هضم جدار الخلية يؤدي إلى انخفاض كفاءة التقاط الحمض النووي الريبي. وأخيراً، ينبغي أن تكون الهيدروجيلات معبأة بشكل وثيق كما يتم حقنها في الجهاز B. رصد مدخلات الهيدروجيل مع كاميرا عالية السرعة سوف تسمح لإنهاء جمع مستحلب مرة واحدة لم يعد هيدروجيلمعبأة قريبة عند إدخال في الجهاز، وإلا فإن كفاءة التقاط تتأثر.
القلق المحتمل مع طريقتنا هو أن ثقافة الميكروجيل من الخميرة قد تغير بشكل كبير التعبير الجيني. العمل السابق التحقيق في التعبير الجيني الخميرة في microgels وعلى أجار تظهر الاختلافات في متوسطات التعبير الجيني ولكن عموما ارتباط إيجابي17، على الرغم من مزيد من التحقيق في هذا الادعاء على مجموعة متنوعة من سلالات الخميرة من الحكمة. الأسلوب لديه أيضا محدودة كفاءة التقاط الخلية بسبب التحميل العشوائي من الخرز التقاط مرنا بعد إحصاءات بواسون14. حاليا حوالي 10٪ من قطرات تحتوي على زى ومستعمرة، ومن المتوقع أن يكون معدل التغليف المزدوج أقل من 1٪. التغليف المزدوج يؤدي إلى عناصر محيرة خلال تحليل البيانات RNA-seq والتصفية لا تزال صعبة23; معدل التقاط 25٪ من شأنه أن يؤدي إلى زيادة مقابلة من التغليف المزدوج إلى 5٪(الشكل التكميلي 2). على الرغم من أننا نظهر ICO-seq باستخدام منصة Drop-Seq ، هناك منصات أخرى دروبليت RNA-seq التي تقدم الخرز التقاط مرنا بشكل قطعي وليس إحصائيًا ، مثل منصة الكروم الجينومية 10x المتاحة تجاريًا15،24. ويمكن أن يعزز دمج هذه المنصات مع ICO-seq كفاءة التقاط ما هو أبعد مما تسمح به إحصاءات بواسون. وأخيراً، فإن القيد الأساسي للقطرة من الحمض النووي الريبي هو عدم القدرة على استعادة خلايا الاهتمام بعد التسلسل. وينبغي أن تؤخذ هذه القيود في الاعتبار عند النظر في أنواع مكتبات الخميرة لتحليل باستخدام هذه الطريقة.
وقد ثبت عدم التجانس من خلية إلى خلية على مستوى البرسيم للميكروبات مثل E. القولونية25 و S. cerevisiae26 الكشف عن خلية جديدة تنص على أن تحليل على مستوى السائبة من شأنه أن يخفي خلاف ذلك. تحليلات الحمض النووي الريبي سق السائبة التي أجريت على C. albicans تميل إما إلى النظر في التغيرات النسخ على نطاق السكان، أو الخلايا البيضاء والشفافة كمجموعتين منفصلتين27،28. ويمكن أن يؤدي تطبيق ICO-seq إلى اكتشاف دول فرعية إضافية وتوفير إطار تحليلي لاكتشاف حالات الخلايا الجديدة داخل أنواع الخميرة الأخرى. ومع ذلك ، فإن نمو الخلايا داخل الهيدروجيللات لا يقتصر على الخميرة: أنواع الخلايا الأخرى ، مثل الثدييات والبكتيرية وغيرها من الخلايا الفطرية يمكن زراعتها أيضًا داخل الهيدروجيلات29،30. تسلسل المستعمرات المسببة للسرطان مقابل الخلايا المفردة يؤدي إلى متوسط الضوضاء البيولوجية بسبب الاختلاف بين الخلايا ، وتحسين التمييز بين أنواع الخلايا. قد يساعد هذا عند تحليل الخلايا حيث يركز التنوع الوراثي على مسارات توليفمحددة. الإمكانيات الموسعة لإدخال نوع الخلية إلى ICO-seq وتكاملها المحتمل مع منصات دروبليت RNA-seq المتاحة تجاريًا يضع ICO-seq كمنصة واعدة لتشريح التغاير الخلوي على المستوى الوراثي.
Disclosures
ويعلن صاحبا البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
تم دعم هذا المشروع من قبل المؤسسة الوطنية للعلوم جائزة الوظيفي DBI-1253293، المعاهد الوطنية للصحة الجديدة مبتكرة جائزة DP2AR068129 ومنح R01HG0008978، والمركز الوطني للعلوم التكنولوجيا منح DBI-1548297، ومركز UCSF للبناء الخلوي. ARA و ZJG هي تشان زوكربيرج بيوهوب المحققين.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 um syringe filter | Milipore Sigma | SLGP033RS | |
| 0.5M EDTA, pH 8.0 | Thermo-Fisher | 15575020 | Used to make TE-TW buffer |
| 0.75 mm biopsy punch | World Precision Instruments | 504529 | |
| 1 mL syringes | BD | 309628 | |
| 1H,1H,2H-Perfluoro-1-Octanol (PFO) | Sigma-Aldrich | 370533 | |
| 1M Tris-HCI, pH 8.0 | Thermo-Fisher | 15568025 | Used to make TE-TW buffer |
| 27 gauge needles | BD | 305109 | |
| 3 mL syringes | BD | 309657 | |
| 3" silicon wafers, P type, virgin test grade | University Wafers | 447 | |
| 3D-printed centrifuge syringe holder | (custom) | (custom) | See Supplemental Files for 3D print file |
| Agarose, low gelling temperature | Sigma-Aldrich | a9414 | |
| Aquapel (hydrophobic glass treatment) | Pittsburgh Glass Works | 47100 | |
| Drop-Seq Beads | ChemGenes | MACOSKO-2011-10 | |
| Glass microscope slides (75 mm x 50 mm) | Corning | 294775X50 | |
| Ionic Krytox Surfactant | Synthesis instructions in ref 14. Can substitute with PEG-PFPE surfactant. | ||
| Isopropanol | Sigma-Aldrich | 109827 | |
| NaCl | Sigma-Aldrich | S9888 | |
| Novec 7500 | 3M | 98-0212-2928-5 | Commonly knowns as HFE 7500 |
| PBS | Fisher Scientific | BP243820 | |
| PE-2 polyethylene tubing | Scientific Commodities | B31695-PE/2 | |
| PEG-PFPE surfactant | Ran Biotechnologies | 008-FluoroSurfactant | |
| PGMEA developer | Sigma-Aldrich | 484431 | |
| Photomasks | CadArt Servcies | (custom) | See Supplemental Files for mask designs |
| Spin coater | Specialty Coating Systems | G3P-8 | |
| SSC Buffer | Sigma-Aldrich | S6639 | |
| SU-8 2100 | MicroChem | Y111075 | |
| SU-8 2150 | MicroChem | Y111077 | |
| Sylgard 184 silicone elastomer kit | Krayden | 4019862 | |
| Tween-20 | Sigma-Aldrich | P1379 | Used to make TE-TW buffer |
| YR Digestion buffer | Zymo Research | R1001-1 | Spheroplasting buffer |
| YR Lysis Buffer | Zymo Research | R1001-2 | |
| Zymolyase | Zymo Research | E1005 | Spheroplasting enzyme mixture |
References
- Peralta-Yahya, P. P., Zhang, F., Del Cardayre, S. B., Keasling, J. D. Microbial engineering for the production of advanced biofuels. Nature. 488 (7411), 320-328 (2012).
- Curran, K. A., Alper, H. S. Expanding the chemical palate of cells by combining systems biology and metabolic engineering. Metabolic Engineering. 14 (4), 289-297 (2012).
- Botstein, D., Chervitz, S. A., Cherry, J. M. Yeast as a model organism. Science. 277 (5330), 1259-1260 (1997).
- Mager, W. H., Winderickx, J. Yeast as a model for medical and medicinal research. Trends in Pharmacological Sciences. 26 (5), 265-273 (2005).
- Krivoruchko, A., Siewers, V., Nielsen, J. Opportunities for yeast metabolic engineering: Lessons from synthetic biology. Biotechnology Journal. 6 (3), 262-276 (2011).
- Vanella, R., et al. Yeast-based assays for screening 11β-HSD1 inhibitors. Microbial Cell Factories. 15 (1), (2016).
- Zhuang, X., Chappell, J. Building terpene production platforms in yeast. Biotechnology and Bioengineering. 112 (9), 1854-1864 (2015).
- Agresti, J. J., et al. Ultrahigh-throughput screening in drop-based microfluidics for directed evolution. Proceedings of the National Academy of Sciences. 107 (9), 4004-4009 (2010).
- Wang, G., et al. RNAi expression tuning, microfluidic screening, and genome recombineering for improved protein production in Saccharomyces cerevisiae. Proceedings of the National Academy of Sciences. 116 (19), 9324-9332 (2019).
- Beneyton, T., et al. Droplet-based microfluidic high-throughput screening of heterologous enzymes secreted by the yeast Yarrowia lipolytica. Microbial Cell Factories. 16 (1), 18(2017).
- Sjostrom, S. L., et al. High-throughput screening for industrial enzyme production hosts by droplet microfluidics. Lab on a Chip. 14 (4), 806-813 (2014).
- Nadal-Ribelles, M., et al. Sensitive high-throughput single-cell RNA-seq reveals within-clonal transcript correlations in yeast populations. Nature Microbiology. 4 (4), 683-692 (2019).
- Gasch, A. P., et al. Single-cell RNA sequencing reveals intrinsic and extrinsic regulatory heterogeneity in yeast responding to stress. PLoS Biology. 15 (12), 2004050(2017).
- Macosko, E. Z., et al. Highly parallel genome-wide expression profiling of individual cells using nanoliter droplets. Cell. 161 (5), 1202-1214 (2015).
- Klein, A. M., et al. Droplet barcoding for single-cell transcriptomics applied to embryonic stem cells. Cell. 161 (5), 1187-1201 (2015).
- von der Haar, T. A quantitative estimation of the global translational activity in logarithmically growing yeast cells. BMC Systems Biology. 2, 87(2008).
- Liu, L., Dalal, C. K., Heineike, B. M., Abate, A. R. High throughput gene expression profiling of yeast colonies with microgel-culture Drop-seq. Lab on a Chip. 19 (10), 1838-1849 (2019).
- Fallah-Araghi, A., Baret, J. C., Ryckelynck, M., Griffiths, A. D. A completely in vitro ultrahigh-throughput droplet-based microfluidic screening system for protein engineering and directed evolution. Lab on a Chip. 12 (5), 882-891 (2012).
- Berman, J., Sudbery, P. E. Candida albicans: A molecular revolution built on lessons from budding yeast. Nature Reviews Genetics. 3 (12), 918-930 (2002).
- Srikantha, T., Soll, D. R. A white-specific gene in the white-opaque switching system of Candida albicans. Gene. 131 (1), 53-60 (1993).
- van der Maaten, L., Hinton, G. Visualizing data using t-SNE. Journal of Machine Learning Research. 9, 2579-2605 (2008).
- Sun, Y., et al. Deletion of a yci1 domain protein of Candida albicans allows homothallic mating in MTL heterozygous cells. mBio. 7 (2), 00465-00516 (2016).
- McGinnis, C. S., Murrow, L. M., Gartner, Z. J. DoubletFinder: Doublet Detection in Single-Cell RNA Sequencing Data Using Artificial Nearest Neighbors. Cell Systems. 8 (4), 329-337 (2019).
- Baran-Gale, J., Chandra, T., Kirschner, K. Experimental design for single-cell RNA sequencing. Briefings in Functional Genomics. 17 (4), 233-239 (2018).
- Silander, O. K., et al. A Genome-Wide Analysis of Promoter-Mediated Phenotypic Noise in Escherichia coli. PLoS Genetics. 8 (1), 1002443(2012).
- Newman, J. R. S., et al. Single-cell proteomic analysis of S. cerevisiae reveals the architecture of biological noise. Nature. 441 (7095), 840-846 (2006).
- Tuch, B. B., et al. The Transcriptomes of Two Heritable Cell Types Illuminate the Circuit Governing Their Differentiation. PLoS Genetics. 6 (8), 1001070(2010).
- Romo, J. A., et al. Global Transcriptomic Analysis of the Candida albicans Response to Treatment with a Novel Inhibitor of Filamentation. mSphere. 4 (5), 00620(2019).
- Huang, H., et al. Generation and manipulation of hydrogel microcapsules by droplet-based microfluidics for mammalian cell culture. Lab on a Chip. 17 (11), 1913-1932 (2017).
- Lin, X., Nishio, K., Konno, T., Ishihara, K. The effect of the encapsulation of bacteria in redox phospholipid polymer hydrogels on electron transfer efficiency in living cell-based devices. Biomaterials. 33 (33), 8221-8227 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved