Method Article
תפוקה גבוהה שמרים להתאמץ פנוטיפים עם רצפי רנ א מבוססי Droplet
In This Article
Summary
צוואר בקבוק במחזור ' עיצוב-לבנות בדיקה ' של הנדסת חיידקים היא המהירות שבה אנחנו יכולים לבצע מסכי פונקציונלי של זנים. אנו מתארים שיטת תפוקה גבוהה לסינון המתח המוחל על מאות אלפי תאים שמרים לכל ניסוי העושה שיטה ברצף RNA מבוסס droplet.
Abstract
הכלים רבי-העוצמה הזמינים לעריכת גנום שמרים הפכו את חיידק זה פלטפורמה רבת ערך עבור הנדסה. אמנם כעת ניתן לבנות ספריות של מיליוני זנים ברורים גנטית, הקרנת הפנוטיפ הרצוי נשאר מכשול משמעותי. בעזרת טכניקות הקרנה קיימות, קיים מבצע מסחרי בין תפוקת המידע לתפוקה, עם הקרנת תפוקה גבוהה המבוצעת בדרך כלל על מוצר אחד של עניין. לכן, אנו מציגים גישה כדי להאיץ את ההקרנה המתח על ידי התאמת רצף RNA תא בודד כדי isogenic picoliter מושבות של זנים שמרים מהונדסים גנטית. כדי להתמודד עם האתגרים הייחודיים של ביצוע רצפי RNA על תאים שמרים, אנו התרבות המושבות שמרים איזוגניים בתוך הידרוג'לים ו spheroplast לפני ביצוע רצפי RNA. הנתונים רצפי RNA ניתן להשתמש כדי להסיק פנוטיפים שמרים ולמיין מסלולים הנדסה. המדרגיות של השיטה מטפלת בחסימה קריטית בהנדסת חיידקים.
Introduction
המטרה העיקרית של הנדסת חיידקים היא לשנות חיידקים כדי לגרום להם לייצר תרכובות ערך1,2. S. cerevisiae ס כבר האורגניזם העיקרי להנדסה חיידקים בשל קלות התרבות שלה ואת היקף הכלים הזמינים עבור הנדסה הגנום שלה3,4,5. עם זאת, משוכה נשאר בביצוע מסכי פונקציונלי על שמרים שונה: התפוקה ההקרנה מאחורי הנדסת הגנום על ידי הזמנות של סדר גודל. הקרנה בדרך כלל כרוכה בבידוד זנים בצלחות המיקרוגל ופנוטיפים על ידי מדידת ייצור של תרכובת מסוימת6,7. התפוקה של תהליך זה מוגבלת על ידי כמויות גדולות של מגיב הצורך לומר זנים בודדים במאות תגובות מיקרוליטר. Droplet מיקרופלואידיקה מספק פתרון אטרקטיבי כדי להגדיל את התפוקה של הקרנת שמרים על ידי הזמנות של גודל על ידי הפחתת שינוי גודל תגובות בדרך כלל ביצוע לוחות טוב8. עם זאת, כמו עם מסכי צלחת, מסכי droplet בדרך כלל לזהות תרכובות מוצר יחיד, אשר מספק מידע מוגבל לתוך הפונקציה הגלובלית של השביל הנדסה9,10,11.
Rna רצפי (rna-seq) עשוי לאפשר אפיון מקיף יותר של פעולת הנתיב על-ידי מתן אפשרות לרמות ביטוי של כל הגנים הרלוונטיים להיות מוערך בו12,13. יתר על כן, שיטות droplet לאפשר לאלפי תאים להיות פרופיל לכל ניסוי, לספק את התפוקה הנחוצה עבור ספריות מסך של משתנים מהונדסים14,15. עם זאת, שיטות RNA-seq ממוטבות לתאי מיונקים; שמרים, על ידי השוואה, יש פחות mRNA לכל תא ותא תא כי קשה להסיר16, מסיר את רצף שלהם על ידי שיטות קיימות. אם שיטת התפוקה הגבוהה droplet יכול להיות מיועד כדי לאפשר שמרים RNA-seq, זה יספק מדרגי, חסכוני, ומידע עשיר הפלטפורמה הפנוטיפים עבור הנדסת שמרים.
אנו מציגים פרוטוקול מפורט של שיטה שפותחה לאחרונה שלנו ברצף של תאים שמרים באמצעות התפוקה הגבוהה droplet מיקרופלואידיקה17. כדי להתגבר על האתגר של רנ א מוגבלת, אנו מכמס ושמרים התרבות תאים בודדים picoliter הידרוג'ל כדורים. התרבות משכפל את התאים, מניב מאות עותקים שחולקים את אותו מסלול מהונדס; זה מפחית את הווריאציה בשל ביטוי גנטי התא בודד תוך הגדלת משמעותית את כמות RNA זמין לרצף. לאחר הגברה מבוססת התרבות, אנו כופלו את התאים ומסירים את קיר התא באמצעות עיכול אנזימטי בצובר. קרום התא נשאר שלם, כך שכל מושבה איזוגנית ו-mRNA המשויך שלה יישארו כמוסות בתחומי ההידרוג'ל שלהם. זה מאפשר לנו לשייך את המושבות הבודדות עם mRNA לכידת ריאגנטים ומאגר לפירוק, ו-mRNA להילכד, ברקוד, ו רצף בעקבות זרימת העבודה Drop-Seq14. השיטה שלנו מאפשרת הקרנת הקרנה נרחבת של אלפי מושבות שמרים איזוגניים לכל ניסוי.
Protocol
1. ייצור מכשיר מיקרופלואידיג
- ייצור בסיס של SU-8
- עצב את המסיכה השלילית עבור ערוצי המיקרו-פלואידים עבור התקן A ו-B (קובץ משלים 1 ו- 2) באמצעות תוכנת עיצוב באמצעות מחשב והודפסו על-גבי סרט מעגלי עם רזולוציה של 10 יקרומטר לפחות.
- מקום נקי 75 מ"מ סיליקון וופל על מרובע ספין לשפוך על 1 מ ל של SU-8 על המרכז שלה. תדליק את הוואקום כדי. לאבטח את הופל לצ
- עבור התקן A, ספין מעיל SU-8 2150 בשעה 500 rpm עבור 30 s, ואחריו 30-s ב 2,750 rpm. עבור התקן ב', ספין-מעיל SU-8 2100 ב 500 rpm עבור 30 s, ואחריו 30 ב 2,500 rpm. זה יהיה להניב SU-8 שכבות של עובי 200 יקרומטר ו 120 יקרומטר, בהתאמה.
- הסר את וופל מן הספין-coater ומקום על פלטה ב 95 ° c עבור 60 דקות לאפות.
- הסירו את הפרוסת מפלטת הפלטה ותנו לו להתקרר לטמפרטורת החדר. מניחים את המסיכה על גבי וופל, ולחשוף תחת מתחת ל190 mW, 365 ננומטר LED UV עבור 2 דקות.
- מניחים את הפרוסת וופל על פלטת הפלטה שנקבעה ב-95 ° c עבור 5 דקות לאפיה בחשיפה לפוסט.
- הסירו את הופל ותנו לו להתקרר לטמפרטורת החדר. מניחים את וופל באמבטיה של פרופילן גליקול מונאואתיל אתר אצטט (PGMEA) עבור 20 דקות.
- לשטוף את הפרוסת עם PGMEA ואחריו האיזופנול. אם משקעים אטומים כלשהם גלויים במהלך תהליך זה, חזרו על השטיפה עם PGMEA ואיזופנול. . האוויר ייבש את הפרוסת
- מניחים את הפרוסת וופל על פלטה ב95 מעלות צלזיוס למשך 3 דקות.
- מסירים ומניחים את הופל בצלחת פטרי בקוטר 90 מ"מ.
- Polydiמתיל siloxane (PDMS) הליהוק ב-SU-8 מאסטר
- מערבבים יחד יחס המוני 10:1 של בסיס סיליקון כדי לרפא את הסוכן. דגה PDMS לאחר ערבוב כ 30 דקות.
- שופכים את ה-PDMS ב-SU-8 על גבי המאסטר, עד ששכבה בעובי של 5 מ"מ בלבד נוצרת על גבי הפרוסת.
- דגה את PDMS על גבי וופל על כ 30 דקות.
- הניחו את הפרוסת בתנור ב65 ° c לפחות 80 דקות כדי לרפא את ה-PDMS.
- גזור את הלוח הנרפא PDMS מן הפרוסת.
- מניחים את הלוח PDMS עם התכונות microfluidic פונה כלפי מעלה, ומפרץ ניקוב חורים שקע עם אגרוף ביופסיה 0.75 מ"מ.
- נקה 50 מ"מ x 75 מ"מ שקופית זכוכית עם איזופנול ולהסיר את כל האבק מן התכונות microfluidic של הלוח PDMS עם קלטת.
- לחשוף את שקופית זכוכית מנוקה ואת הלוח PDMS עם התכונות microflu, הפנים עד 100 אבא (1 mbar O2) פלזמה 1 דקות.
- הצב את הלוח PDMS עם התכונות הפנים כלפי מטה אל שקופית הזכוכית כדי לאפשר התחברות. מניחים את השקופית בתנור של 65 ° c לפחות 30 דקות עד להשלמת ההתחברות.
- לטפל בכל ערוצי microflu, על ידי שטיפה עם נוזל לטיפול במשטח פלואורוקפאין. אופים את המכשיר בתנור של 65 ° c לפחות 10 דקות כדי לאדות את הנוזל.
2. עטיפת שמרים בהידרוג'לים באמצעות התקן A
- לקחת שמרים גדל בתרבות ההשעיה ולסמוך על הומוציטומטר.
- השהה מחדש את התאים בתמיסת מלח (PBS) לריכוז של כ-750 ק מ. זה מבטיח כי 30% של הידרוג'לים יהיה תא אחד שמרים בתוכם. רק כמחצית התאים שמרים לגדול לתוך מושבות, המוביל ~ 15% של הידרוג'לים המכילים מושבות שמרים.
- מערבבים נקודת התכה וזמן ב 2% w/v ב-PBS וחום ב 90 ° צ' עד נמס. . זה לוקח ~ 10 דקות
- טען את תערובת agarose לתוך מזרק עם מסנן 0.22 יקרומטר מוצמד לתוך משאבת מזרק מול דוד החלל להגדיר 80 ° c.
- לטעון מזרק מלא הבולם שמרים ומזרק המכיל שמן fluorinated חולק עם 2% w/v מיכל יוניים ו18 לתוך משאבות מזרק.
- קח את המכשיר מפצל טיפה התחתון עשה בסעיף 1 ולחבר את אבובים מן מזרקים לתוך המכשיר. מדריך אבובים משקע לתוך צינור 15 מ ל חרוט בדלי קרח עבור אוסף שחרור.
- זרימה בשלושת הפתרונות למכשיר עם קצב הזרימה הבא:
- להזרים את הבולם שמרים עם קצב הזרימה של 3 מ ל/h.
- הזרמת התערובת האגבה בקצב הזרימה של 3 מ ל/h.
- הזרמת שמן הפלואורוקפאין בקצב הזרימה של 15 מ ל/h.
- לאסוף כ-1 מ ל אמולסיה. המתן 5 דקות נוספות כדי לאפשר לצמח להגדיר במלואו.
3. שבירת ושטיפת ג'ל לתרבות
- הוסף נפח שווה של 20% הופעת (PFO) בשמן fluorinated חולק אמולסיה. היפוך צינור חרוט כמה פעמים כדי לאפשר ערבוב.
- ספין למטה אמולסיה שבורה ב 2,000 x g עבור 2 דקות. ג'ל יהיה הגלולה מעל הנפט ו PFO שלבים.
- להסיר את שלב הנפט ולהוסיף 2 מ ל של מאגר TE-TW (10 mM טריס pH = 8.0, 1 מ"מ EDTA, 0.01% רצף-20) כדי להשעות מחדש את ג'לים. להעביר את ההשעיה לתוך הצינור החדש 15 מ ל חרוט.
- גלולה למטה ג'לים כמו בשלב 3.2 ולשטוף פעם אחת נוספת TE-TW עבור סך של שתי שטיפות.
- הסר את הסופרנטנט והשהה ג'ל מחדש ב-2 מ ל של מדיה. . העברה לצינור תרבות של 5 מ ל
- מודטה ב -30 ° c לילה תחת טלטול.
הערה: לאחר הדגירה של הלילה, ניתן לשמור הידרו-ג'ל לשמרים ב -4 ° c במשך מספר ימים.
4. שמרים לפירוק המושבה
- ג'ל העברה ל 15 מ"ל שפופרת חרוטי ו גלולה הידרוג'לים ב 2,000 x g עבור 2 דקות.
- שוטפים הידרולים ב-PBS 2x.
- שטוף ב-1x מאגר הנמשך 1 x.
- ביצוע של 2 – 50x דילול של אנזים כפור במאגר לאורך זמן ולהוסיף 1 מ ל הידרולים.
- מודטה ב 37 ° c בשביל 1 h. שמרים מטופלים ייראו שקופים יותר (איור 3A).
- קח את החלק התחתון 0.8 mL של הבולם הידרוג'ל ולהעביר לתוך מזרק 1 mL.
- מניחים את המזרק במחזיק מזרק מודפס תלת-ממד (קובץ משלים 3) ו ספין ב 2,000 x g עבור 2 דקות. זה יגרום הידרוג'לים לסגור לארוז בראש המזרק.
5. mRNA לכידת מושבות שמרים lysed באמצעות התקן B
- קח 240,000 מחרוזת הצללה-Seq והעבר לשפופרת חרוט של 15 מ ל.
- גלולה Drop-Seq חרוזים על ידי ספינינג למטה ב 1,000 x g עבור 1 דקות.
- הסר את מחרוזת supernatant ולהשעות מחדש 2 מ ל של 0.9 x שמרים להסרת מאגר עם 500 mM נתרן כלוריד עבור ריכוז השעיה חרוז של 120,000 חרוזים/mL.
- להעביר את ההשעיה חרוז 3 מ ל מזרק עם בר מהומה מוכנס.
- הכנת מזרק המכיל מספר מילילייטר של 2% w/v הופעת-פוליאתילן גליקול (PFPE-יתד) החומרים בשמן fluorinated חולק.
- לפנות את כל הראש מימית של המזרק המכיל הידרוג'לים ארוזים וכיפה את המזרק.
- הכנס את ההידרוג'ל, חרוז הבולם, ומזרקים שמן לתוך משאבות מזרק ולהתחבר באמצעות אבובים לתוך המכשיר אנקפסולציה שנעשו בסעיף 1.
- התחבר מן אבובים לשקע לתוך שפופרת 50 mL חרוט על קרח.
- זרימה בשלושת הפתרונות למכשיר עם קצב הזרימה הבא:
- להזרים את ההידרוג'לים ב 0.4 mL/h.
- להזרים את ההשעיה חרוז ב 0.4 mL/h.
- הזרמת שמן הפלואורוקפאין ב 1.6 mL/h.
- לאסוף ~ 1 mL של אמולסיה או להפעיל את המכשיר עד שלא נותרו הידרוג'לים יותר.
6. cDNA דור, רצף הכנת הספריה, ורצף
- הוסף 30 מ ל של מאגר האס-פי-אס של 6x ו-1 מ ל של PFO ל אמולסיה שנאספה כאמור בפרוטוקול Drop-Seq14.
- המשך לעקוב אחר פרוטוקול Drop-Seq כדי ליצור cDNA מ-mRNA שנתפסו על חרוזים, הכנת הספרייה ברצף, ורצף ניתוח נתונים.
תוצאות
התאמתי את זרימת העבודה Drop-Seq שפורסמה קודם לכן14 עבור רצף המושבה isogenic (ICO-Seq) כדי לבצע פרופיל ביטוי גנים של המושבות שמרים איזוגניים. בודדנו תאים שמרים יחיד וכו אותם לתוך מיקרוג agarose (איור 1A). בעקבות הדגירה של הלילה של microgels, אלה תאים שמרים באנקפסולציה גדלו לתוך מושבות איזוגניים. לפני טעינת ג'לים לתוך התקן microflu, מיקרופלוג השנייה עבור לכידת mRNA, מעכלנו את הקיר תא שמרים כדי להפוך את mRNA נגיש יותר (איור 1B, שמאל). אנחנו סוגרים את המיקרו-ג'לים האלה וממוזגים את החרוזים של לכידת mRNA ואת מאגר הליזה. טיפות מסוימות הכילו בדיוק חרוז אחד זיווג עם מושבת שמרים למטה. כל החרוזים בתחליב נאספו ו cDNA מסונתז ורצף בעקבות פרוטוקול Drop-Seq.
יצרנו מושבות איזוגניים שמרים באמצעות עטיפת תא בודד שמרים בתוך agarose מיקרוגל באמצעות התקן מיקרופלואידיג עם שמונה מפצל טיפה מצורף (איור 2A). אנו מדולל את הקלט שמרים השעיית ריכוז של ~ 750000/mL כך ~ 30% של microgels יש בדיוק אחד שמרים בהם. לפני החדרת הטמפרטורה וזמן ההיתוך העלה לתוך המכשיר, אנו מומס אותו בטמפרטורה מוגבה ושמרו על המזרק בטמפרטורה זו כדי למנוע הגגנציה מוקדמת. בצומת הדור הנפתח (איור 2b), תאים שמרים הפכו בתחילה בשנת 160 יקרומטר טיפות. בעקבות הצומת הדור השני מפצל שמונה קיפול לחלק טיפות אלה לתוך 8 80 יקרומטר טיפות (איור 2c). מסנן מזרק היה מחובר agarose מותכת כדי למנוע כפכפים להרכיב בתוך הערוצים, אשר יכול להיות צר כמו 37 יקרומטר במהלך הפיצול. אספנו אמולסיה על הקרח, שמיד החלה את תהליך הגרור הצמח. אנו מחשבים את הריבוי של אמולסיה טיפוסית להיות ~ 6% (משלים איור 1), אם כי הערכים הפוליפניים עד 10% מקובלים. לאחר להגדיר ג'ל העלה, שברנו את תחליב והסיר את שלב הנפט. ג'לים נשטפו במאגר מימית לפני טבילה במדיית הצמיחה. הדגירה של לילה של המיקרוג'לים הביא מושבות איזוגניים גדל בתוך כמה מיקרוג'לים (איור 2D). אחוז ההידרוג'לים המכילים מושבות של לפחות 20 תאים תלויים בתנאי התרבות, כולל זמן דגירה והרכב מדיה. בהפגנה שלנו באמצעות C. אלביקנס, קבענו כי כ 15% של הידרוג'לים הכילו מושבה לאחר 20 h של תרבות ההשעיה.
מכשיר כימוס שני שחלץ את mRNA ממושבות איזוגניים (איור 3A). לפני טעינת מיקרוג'לים שמרים לתוך המכשיר microflu, שטפתי ושקוע את הג בפתרון כדי לעכל את קירות התא שמרים. העיכול הנכון של התאים שמרים אומת על ידי מיקרוסקופ, עם שמרים מטופלים בעל מורפולוגיה רפלקטיבית יותר (איור 3B). אנחנו סוגרים את המיקרו-ג'לים במזרק ומכוונים את קצב הזנת הג של הג'ל כך שג אחד היה בכל טיפה. זרם של חרוזי לכידת mRNA במאגר הליזה מעורבב עם זרם ג'ל סגור וגדוש לפני הצומת המסירה (איור 3C). אספנו אמולסיה כתוצאה של טיפות 160 יקרומטר, ומושבות החלו lyse ולשחרר את תוכן הסלולר שלהם. העמיסו חרוזים על דילול מגביל כדי למזער את מספר הטיפות המכילות חרוזים מרובים, אבל לסגור את הג של ג'ל במהלך ירידה לעשות הביא כ 10% של טיפות שנאספו המכיל חרוז אחד עם מושבה למטה (איור 3D).
ניתחנו את הביטוי הגנטי של C. אלביקנס, זן של שמרים נוכח המעי האנושי מיקרובידום, באמצעות זרימת העבודה ICO-seq. ג. אלביקנס הוא ציין כי יכולתה לעבור בין שני מצבי תא שונים, כינה לבן ואטום19. אנו משתמשים במתח מהונדס C אלביקנס , זן RZY122, אשר מחליף עותק אחד של הגן WH11, פעיל רק בתאים לבנים עם yfp20. הצלחנו להשיג סט של פרופילי ביטוי גנים באמצעות זרימת העבודה והשתמשו בהם לניתוח של מושבות המבטא לפחות 300 גנים ייחודיים. כערכת נתונים להתייחסות, השתמשנו C. albicans נתוני ביטוי שהתקבלו מן המחקר שפורסם בעבר17 ו מסוננים מושבות המבטא פחות מ 600 גנים ייחודיים. לאחר ביצוע ניתוח של הרכיב הראשי (PC) ו-t-סטוכסטי הפחתה מימדית (tSNE) הפחתת ממדי21, מצאנו קונקורדנציה כללית בין ערכת הנתונים לדוגמה שלנו לבין ההתייחסות (איור 4a). ניתוח מחשב חשף כי YFP ו WH11 תרמו באופן משמעותי את שני המחשב הראשון של. יתרה מזאת, ניתוח tSNE חשף שלושה אשכולות (איור 4B). בעוד אשכול 2 היה מורכב בעיקר של תאים מתוך ערכת הנתונים לדוגמה, אשכולות 0 ו-1 היו מורכבים תאים משני הדגימות. על ידי הנחת WH11 הביטוי על tSNE (איור 4C, הפאנל העליון), קבענו כי אשכול 1 כנראה הכיל מושבות לבנות. מצאנו גם כי STF2 ביטוי גדל באשכול 1 (איור 4C, פאנל תחתון), עקבי עם נתונים שהתקבלו בעבר17. באשכולות 0 ו-2, WH11 ו STF2 היו מוסדרות באופן משמעותי לעומת אשכול 1 (איור 4D). גנים המעורבים בתסיסה, כגון ADH1, היו upregulated באשכול 0, בעקביות עם מחקרים קודמים של תאים אטומים22. מצאנו כי מושבות באשכול 2 ירדו הריבוזוממה RNA לעומת מושבות באשכולות 0 ו 1. למרות המדגם וערכות נתונים התייחסות הושגו באמצעות אותו מלאי של תאים, תוצאה זו עולה כי אפילו הבדלים עדינים בטיפול ניסיוני יכול להשפיע על ביטוי גנים.
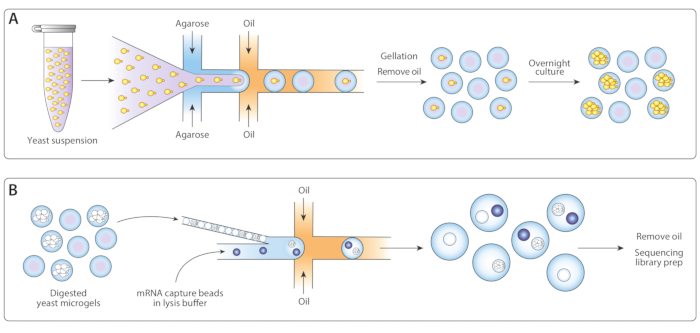
איור 1: מבט כולל על זרימת עבודה של ICO-seq. (א) שמריםגוברת בתרבות ההשעיה היו מדולל במאגר והוא כולף עם agarose מותכת בזרימה-התמקדות מחולל droplet המכשיר כדי לאפשר טעינה פואסון של מיקרוג agarose עם תאים שמרים יחיד. הג להגדיר כאשר התעוררה מקורר, ההשעיה שמן/מים נשברה, והשמן הוסר, מניב התליה של חרוזי ג'ל במים. בעקבות תרבות הלילה, תאי שמרים גדלו לתוך מושבות איזוגניים בתוך מיקרוג ' לים. (ב) המושבות היו חשופים מאגר השפלה הקיר התא, שלאחר מכן הם היו קרובים ומלוכדים עם מחרוזות לכידת mrflu, השני מכשיר מיקרופלואידיג השנייה. סגירת אריזה של מיקרוג'לים הבטיחו כל טיפה היה ג'ל אחד, בעוד טעינת פואסון של החרוזים הפחיתה את הסיכוי של חרוזים מרובים בתוך טיפה אחת. טיפות שנאספו עובדו עבור סינתזה cDNA והדור של ספריית רצף. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
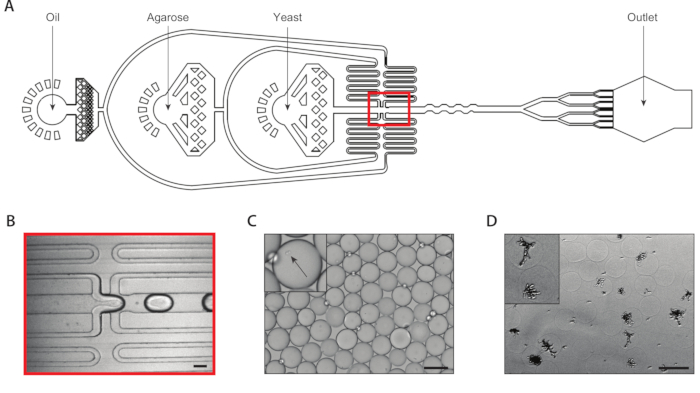
איור 2: הדור של המושבות שמרים איזוגניים בתוך מיקרו-ג'לים באמצעות התקן A. (A) סכימטי של התקן microflu, מציג מיקומים של שלוש כניסות ויציאות פלט. צומת המסירה מודגשת באדום. (ב) תקריב של צומת קבלת השחרור במהלך פעולת התקן רגילה. (ג) מיקרוגרף של טיפות שנאספו, עם תקריב של droplet המכיל תא כדורית (שיבוץ). (ד) מיקרוגרף של מושבות שמרים איזוגניים ב מיקרוג בעקבות דגירה של 24 שעות, עם תקריב של שתי מושבות (שיבוץ). כל ברים בקנה מידה = 100 μm. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
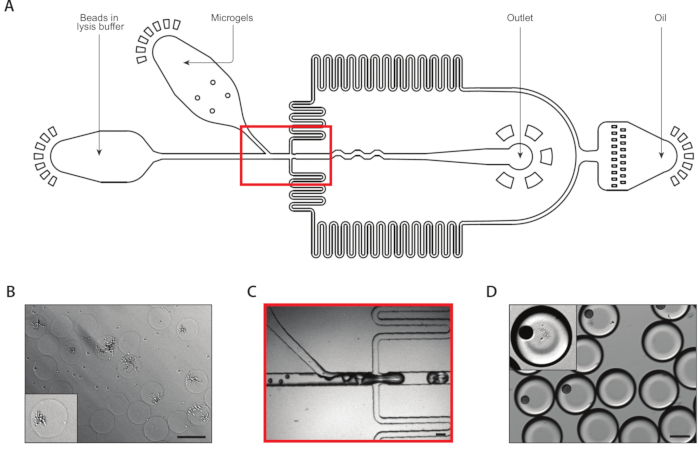
איור 3: הליזה ולכידת mRNA ממושבות איזוגניים באמצעות התקן B. (A) סכימטי של התקן microflu, מציג מיקומים של שלוש כניסות ויציאות פלט. צומת המסירה מודגשת באדום. (ב) מיקרוגרף של מושבות שמרים בעקבות העיכול בקיר התא, עם תקריב של מושבה אחת (שיבוץ). (ג) תקריב של צומת קבלת השחרור במהלך פעולת התקן רגילה. (ד) מיקרוגרף של אמולסיות שנאספו בעקבות מיקרוג'ל וזיווג חרוז, עם תקריב המראה טיפה עם חרוז ומושבה למטה (שיבוץ). כל ברים בקנה מידה = 100 μm. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
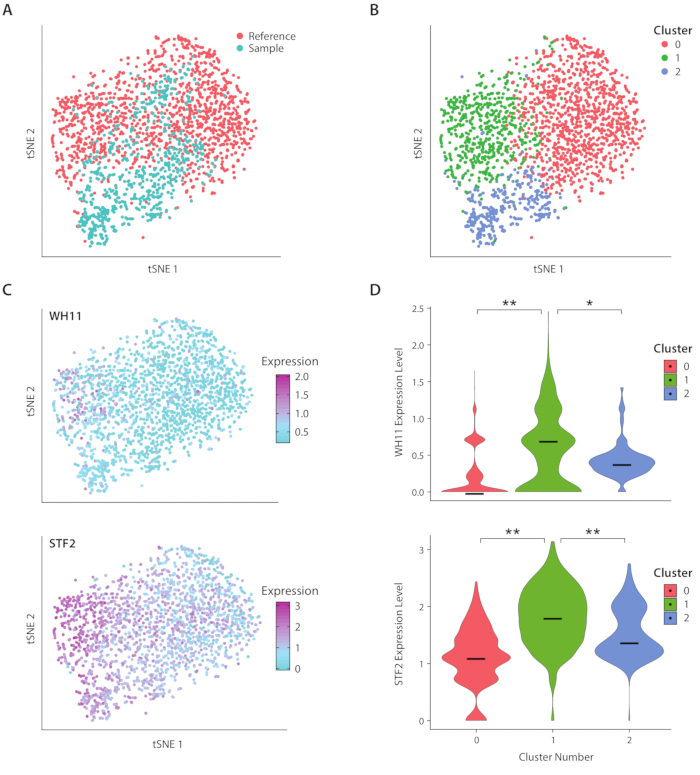
איור 4: ניתוח תגובת מיתוג לבן-אטום ב- C. אלביקנס. (א) מגרש tsne של ערכת נתונים לדוגמה בשילוב עם ערכת נתונים של הפניה מ-Liu17. (ב) קיבוץ אשכולות של הטראנטוסקריפט חושף שלושה אשכולות דמיינו על מזימה tsne. (ג) גנים מרכזיים המעורבים בתגובת המיתוג הלבנה האטומה תרמו לווריאציה כפי שנקבעת באמצעות ניתוח רכיבים ראשיים. (ד) כינור חלקות של רמות ביטוי מנורמלות של yfp ו WH11 על-ידי אשכולות המסומנים בהתוויה של tsne. * * מציין p < < < 0.05 ו * מציין p < < 0.05. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
משלים מספרים 1 ו-2. אנא לחץ כאן כדי להוריד filgures אלה.
קבצים משלימים 1-3. אנא לחץ כאן כדי להוריד קבצים אלה.
Discussion
השיטה שלנו עבור המושבה איזוגניים שמרים ברצף RNA (ICO-seq) מתאים שפורסמו תא יחיד RNA רצף הפלטפורמה, Drop-Seq, עבור תפוקה גבוהה הקרנה של זנים שמרים מהונדסים. תאים שמרים מכילים פחות מ 10% עותקים של mRNA של תא מיונקים טיפוסי יש קיר תא צריך להיות מושפל לפני לכידת mRNA16. שני גורמים אלה משמרים את היישום הישיר של שמרים כדי Drop-Seq או אחרים מבוססי droplet scRNA-seq פלטפורמות. כדי לטפל בנושאים אלה, אנו מכמס תאים יחידים בתוך הידרוג'לים ולגדול אותם לתוך מושבות כדי לספק חומר קלט מספיק עבור רצפי RNA ואנו לעכל את הקיר תא שמרים ליצור כדורית לפני הליזה mRNA ללכוד. שינויים אלה מוסיפים מורכבות נוספת בזרימת העבודה של ICO-seq בהשוואה לזרימת העבודה המקורית של האפשרות Drop-Seq והם שלבים קריטיים שהמשתמשים חייבים להבטיח שימשיכו לפעול בצורה חלקה.
הפעולה הנכונה של התקן A הוא הכרחי עבור תאים שמרים בודדים encapsulating בתוך agarose הידרולים. ספירה נכונה של השעיית שמרים הקלט חייב להיות בעקבותיו כדי למזער את מספר ההידרוג עם יותר תא אחד שמרים, תוך הבטחת כי הידרוג מספיק להכיל תא אחד כדי להבטיח יעילות לכידת התא סבירים במהלך לכידת mRNA. במהלך פעולת המכשיר microflu, הצמח agarose חייב להיות מומס היטב ועבר דרך מסנן מזרק כדי למזער את הסיכוי של סתימת המכשיר. תערובת ג'ל הצמח היא צמיגה והאזור שבו ערוץ יחיד המתפצל לשמונה נוטה במיוחד לסתימת. על-ידי מרכוז מצלמה במהירות גבוהה כדי להמחיש את פעולת המכשיר באזור זה של המכשיר, משתמשים יכולים לפקח על אחידות של טיפות המתעוררים מכל אחד משמונת הערוצים ולהגיב במהירות אם שינויים אחידות עקב כפכפים בכל אחד מהערוצים. בדיקה של כמות קטנה של אמולסיה שנאספה מתחת למיקרוסקופ מספק שיטה משנית לאישור אמולסיה באיכות גבוהה.
בעקבות הצמיחה של מושבות שמרים בתוך הידרוג'לים, אמצעי זהירות מסוימים נחוצים להבטחת החילוץ mRNA איכות ברמת המושבה היחידה. חשוב למטב את הזמן שמרים הם בתרבות הידרוג'ל, כי אם השמרים נותרו בתרבות זמן רב מדי, רבים יברחו מגבולות ההידרוג, המוביל אות הרקע גבוה יותר במהלך רצפי RNA ורגישות נמוכה כאשר מפלים בין סוגי תאים. הדור הנכון של כדורית באמצעות Zymolyase מבטיח כי mRNA ישוחרר בעקבות חשיפת התאים למאגר הליזה. בדיקה חזותית של מושבות שמרים בעקבות Zymolyase צריך להניב תאים שמרים מבריק. העיכול הדופן התא תא יוביל להפחית את היעילות לכידת RNA. לבסוף, ההידרוגים צריכים להיות קרובים וארוזים כפי שהם מוזרק לתוך ההתקן B. ניטור קלט הידרוג'ל עם מצלמה במהירות גבוהה יאפשר להפסקת איסוף אמולסיה פעם הידרוגים הם כבר לא סגור-ארוז על קלט לתוך המכשיר, אחרת ללכוד יעילות יהיה מושפע.
דאגה פוטנציאלית עם השיטה שלנו היא כי תרבות microgel של שמרים עשוי באופן משמעותי לשנות את הביטוי הגנטי. העבודה הקודמת חוקר ביטוי גנים שמרים ב microgels ועל אגר להפגין הבדלים בביטוי גנים ממוצעים אבל הכולל מתאם חיובי17, למרות חקירה נוספת של טענה זו על מגוון של זנים שמרים הוא זהיר. השיטה גם יש יעילות מוגבלת לכידת תאים בשל טעינת סטוכסטי של חרוזי לכידת mRNA בעקבות סטטיסטיקה פואסון14. כיום כ -10% מהטיפות מכילות חרוז ומושבה, ושיעור הencapsulations הכפול צפוי להיות תחת 1%. Encapsulations כפול להוביל אלמנטים מייסדים במהלך ניתוח הנתונים RNA-seq והסינון שלהם נשאר מאתגר23; קצב לכידה של 25% יוביל לעלייה מקבילה של encapsulations כפול עד 5% (איור משלים 2). למרות שאנו מדגימים ICO-seq באמצעות פלטפורמת Drop-seq, ישנם אחרים droplet RNA-seq פלטפורמות המציגות mrna לכידת חרוזים באופן בלתי מבחינה סטטיסטית, כגון מסחרית זמינה 10x כרום גנומיקה הפלטפורמה15,24. שילוב של פלטפורמות אלה עם ICO-seq יכול להגביר את היעילות ללכוד מעבר למה הסטטיסטיקה פואסון לאפשר. לבסוף, מגבלה יסודית של droplet RNA-seq היא חוסר היכולת לשחזר תאים של עניין לאחר רצף. מגבלה זו יש לקחת בחשבון כאשר בהתחשב בסוגים של ספריות שמרים לנתח באמצעות שיטה זו.
תא אל התא טרוגניות הפגינו ברמת המשובטים עבור חיידקים כגון E. coli25 ו- S. cerevisiae ס26 חשיפת התא החדש קובע כי ניתוח ברמת הצובר יהיה אחרת מסכה. בתפזורת RNA-seq מנתח המבוצעים על C. אלביקנס נוטים להסתכל על שינויים ברחבי האוכלוסייה העולמית, או תאים לבנים ואטומים כמו שתי אוכלוסיות נפרדות27,28. היישום של ICO-seq יכול להוביל לגילוי של מדינות נוספות ולספק מסגרת אנליטית לגילוי מצבים סלולריים חדשים בתוך זנים שמרים אחרים. עם זאת, התפתחותם של תאים בתוך הידרוג'לים אינה מוגבלת לשמרים: סוגי תאים אחרים, כגון מיונקים, חיידקים, ותאים פטרייתיים אחרים עשויים גם להיות מעובדים בתוך הידרוג'ל29,30. רצף המושבות האיזוגניים לעומת תאים בודדים מוביל לממוצע מתוך רעש ביולוגי עקב וריאציה של תא לתאים, שיפור האפליה בין סוגי תאים. זה עשוי לעזור בעת ניתוח תאים שבהם מרכזי גיוון גנטיים על מסלולים מסוימים סינתזה. האפשרויות המורחבות של קלט סוג תא כדי ICO-seq ואת האינטגרציה הפוטנציאלית עם מסחרית הזמין מסחרי droplet RNA-seq פלטפורמות מיקומים ICO-seq כמו פלטפורמה מבטיחה לבתר טרוגניות הסלולר ברמה הגנטית.
Disclosures
המחברים אינם מצהירים על ניגודי אינטרסים.
Acknowledgements
פרויקט זה היה נתמך על ידי המדע הלאומי הקרן פרס הקריירה DBI-1253293, המכון הלאומי של בריאות המייצרת חדש פרס DP2AR068129 ולהעניק R01HG008978, המדע הלאומי הטכנולוגיה המרכז הטכנולוגי מענק DBI-1548297, ואת מרכז ה-UCSF שדרתי עבור בנייה סלולרית. ARA ו ZJG הם החוקרים צ'אן-צוקרברג ביורכזת.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 um syringe filter | Milipore Sigma | SLGP033RS | |
| 0.5M EDTA, pH 8.0 | Thermo-Fisher | 15575020 | Used to make TE-TW buffer |
| 0.75 mm biopsy punch | World Precision Instruments | 504529 | |
| 1 mL syringes | BD | 309628 | |
| 1H,1H,2H-Perfluoro-1-Octanol (PFO) | Sigma-Aldrich | 370533 | |
| 1M Tris-HCI, pH 8.0 | Thermo-Fisher | 15568025 | Used to make TE-TW buffer |
| 27 gauge needles | BD | 305109 | |
| 3 mL syringes | BD | 309657 | |
| 3" silicon wafers, P type, virgin test grade | University Wafers | 447 | |
| 3D-printed centrifuge syringe holder | (custom) | (custom) | See Supplemental Files for 3D print file |
| Agarose, low gelling temperature | Sigma-Aldrich | a9414 | |
| Aquapel (hydrophobic glass treatment) | Pittsburgh Glass Works | 47100 | |
| Drop-Seq Beads | ChemGenes | MACOSKO-2011-10 | |
| Glass microscope slides (75 mm x 50 mm) | Corning | 294775X50 | |
| Ionic Krytox Surfactant | Synthesis instructions in ref 14. Can substitute with PEG-PFPE surfactant. | ||
| Isopropanol | Sigma-Aldrich | 109827 | |
| NaCl | Sigma-Aldrich | S9888 | |
| Novec 7500 | 3M | 98-0212-2928-5 | Commonly knowns as HFE 7500 |
| PBS | Fisher Scientific | BP243820 | |
| PE-2 polyethylene tubing | Scientific Commodities | B31695-PE/2 | |
| PEG-PFPE surfactant | Ran Biotechnologies | 008-FluoroSurfactant | |
| PGMEA developer | Sigma-Aldrich | 484431 | |
| Photomasks | CadArt Servcies | (custom) | See Supplemental Files for mask designs |
| Spin coater | Specialty Coating Systems | G3P-8 | |
| SSC Buffer | Sigma-Aldrich | S6639 | |
| SU-8 2100 | MicroChem | Y111075 | |
| SU-8 2150 | MicroChem | Y111077 | |
| Sylgard 184 silicone elastomer kit | Krayden | 4019862 | |
| Tween-20 | Sigma-Aldrich | P1379 | Used to make TE-TW buffer |
| YR Digestion buffer | Zymo Research | R1001-1 | Spheroplasting buffer |
| YR Lysis Buffer | Zymo Research | R1001-2 | |
| Zymolyase | Zymo Research | E1005 | Spheroplasting enzyme mixture |
References
- Peralta-Yahya, P. P., Zhang, F., Del Cardayre, S. B., Keasling, J. D. Microbial engineering for the production of advanced biofuels. Nature. 488 (7411), 320-328 (2012).
- Curran, K. A., Alper, H. S. Expanding the chemical palate of cells by combining systems biology and metabolic engineering. Metabolic Engineering. 14 (4), 289-297 (2012).
- Botstein, D., Chervitz, S. A., Cherry, J. M. Yeast as a model organism. Science. 277 (5330), 1259-1260 (1997).
- Mager, W. H., Winderickx, J. Yeast as a model for medical and medicinal research. Trends in Pharmacological Sciences. 26 (5), 265-273 (2005).
- Krivoruchko, A., Siewers, V., Nielsen, J. Opportunities for yeast metabolic engineering: Lessons from synthetic biology. Biotechnology Journal. 6 (3), 262-276 (2011).
- Vanella, R., et al. Yeast-based assays for screening 11β-HSD1 inhibitors. Microbial Cell Factories. 15 (1), (2016).
- Zhuang, X., Chappell, J. Building terpene production platforms in yeast. Biotechnology and Bioengineering. 112 (9), 1854-1864 (2015).
- Agresti, J. J., et al. Ultrahigh-throughput screening in drop-based microfluidics for directed evolution. Proceedings of the National Academy of Sciences. 107 (9), 4004-4009 (2010).
- Wang, G., et al. RNAi expression tuning, microfluidic screening, and genome recombineering for improved protein production in Saccharomyces cerevisiae. Proceedings of the National Academy of Sciences. 116 (19), 9324-9332 (2019).
- Beneyton, T., et al. Droplet-based microfluidic high-throughput screening of heterologous enzymes secreted by the yeast Yarrowia lipolytica. Microbial Cell Factories. 16 (1), 18(2017).
- Sjostrom, S. L., et al. High-throughput screening for industrial enzyme production hosts by droplet microfluidics. Lab on a Chip. 14 (4), 806-813 (2014).
- Nadal-Ribelles, M., et al. Sensitive high-throughput single-cell RNA-seq reveals within-clonal transcript correlations in yeast populations. Nature Microbiology. 4 (4), 683-692 (2019).
- Gasch, A. P., et al. Single-cell RNA sequencing reveals intrinsic and extrinsic regulatory heterogeneity in yeast responding to stress. PLoS Biology. 15 (12), 2004050(2017).
- Macosko, E. Z., et al. Highly parallel genome-wide expression profiling of individual cells using nanoliter droplets. Cell. 161 (5), 1202-1214 (2015).
- Klein, A. M., et al. Droplet barcoding for single-cell transcriptomics applied to embryonic stem cells. Cell. 161 (5), 1187-1201 (2015).
- von der Haar, T. A quantitative estimation of the global translational activity in logarithmically growing yeast cells. BMC Systems Biology. 2, 87(2008).
- Liu, L., Dalal, C. K., Heineike, B. M., Abate, A. R. High throughput gene expression profiling of yeast colonies with microgel-culture Drop-seq. Lab on a Chip. 19 (10), 1838-1849 (2019).
- Fallah-Araghi, A., Baret, J. C., Ryckelynck, M., Griffiths, A. D. A completely in vitro ultrahigh-throughput droplet-based microfluidic screening system for protein engineering and directed evolution. Lab on a Chip. 12 (5), 882-891 (2012).
- Berman, J., Sudbery, P. E. Candida albicans: A molecular revolution built on lessons from budding yeast. Nature Reviews Genetics. 3 (12), 918-930 (2002).
- Srikantha, T., Soll, D. R. A white-specific gene in the white-opaque switching system of Candida albicans. Gene. 131 (1), 53-60 (1993).
- van der Maaten, L., Hinton, G. Visualizing data using t-SNE. Journal of Machine Learning Research. 9, 2579-2605 (2008).
- Sun, Y., et al. Deletion of a yci1 domain protein of Candida albicans allows homothallic mating in MTL heterozygous cells. mBio. 7 (2), 00465-00516 (2016).
- McGinnis, C. S., Murrow, L. M., Gartner, Z. J. DoubletFinder: Doublet Detection in Single-Cell RNA Sequencing Data Using Artificial Nearest Neighbors. Cell Systems. 8 (4), 329-337 (2019).
- Baran-Gale, J., Chandra, T., Kirschner, K. Experimental design for single-cell RNA sequencing. Briefings in Functional Genomics. 17 (4), 233-239 (2018).
- Silander, O. K., et al. A Genome-Wide Analysis of Promoter-Mediated Phenotypic Noise in Escherichia coli. PLoS Genetics. 8 (1), 1002443(2012).
- Newman, J. R. S., et al. Single-cell proteomic analysis of S. cerevisiae reveals the architecture of biological noise. Nature. 441 (7095), 840-846 (2006).
- Tuch, B. B., et al. The Transcriptomes of Two Heritable Cell Types Illuminate the Circuit Governing Their Differentiation. PLoS Genetics. 6 (8), 1001070(2010).
- Romo, J. A., et al. Global Transcriptomic Analysis of the Candida albicans Response to Treatment with a Novel Inhibitor of Filamentation. mSphere. 4 (5), 00620(2019).
- Huang, H., et al. Generation and manipulation of hydrogel microcapsules by droplet-based microfluidics for mammalian cell culture. Lab on a Chip. 17 (11), 1913-1932 (2017).
- Lin, X., Nishio, K., Konno, T., Ishihara, K. The effect of the encapsulation of bacteria in redox phospholipid polymer hydrogels on electron transfer efficiency in living cell-based devices. Biomaterials. 33 (33), 8221-8227 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved