Method Article
Fenotipagem de tensão de levedura de alta produtividade com sequenciamento de RNA baseado em gotículas
Neste Artigo
Resumo
Um gargalo no ciclo de "projeto-construção-teste" da engenharia microbiana é a velocidade com que podemos executar telas funcionais de cepas. Descrevemos um método de alto throughput para triagem de cepas aplicado a centenas a milhares de células de levedura por experimento que utiliza sequenciamento de RNA baseado em gotículas.
Resumo
As poderosas ferramentas disponíveis para editar genomas de levedura tornaram este micróbio uma plataforma valiosa para a engenharia. Embora agora seja possível construir bibliotecas de milhões de cepas geneticamente distintas, a triagem para um fenótipo desejado continua a ser um obstáculo significativo. Com as técnicas de triagem existentes, há uma troca entre produção de informações e rendimento, com triagem de alto rendimento normalmente sendo realizada em um produto de interesse. Portanto, apresentamos uma abordagem para acelerar o rastreamento de cepas, adaptando o sequenciamento de RNA unicelular a colônias de picolitros isogênicos de cepas de levedura geneticamente modificadas. Para enfrentar os desafios únicos de realizar sequenciamento de RNA em células de levedura, culturamos colônias de leveduras isogênicas dentro de hidrogéis e esheroplasto antes de realizar sequenciamento de RNA. Os dados de sequenciamento de RNA podem ser usados para inferir fenótipos de levedura e classificar caminhos projetados. A escalabilidade do nosso método aborda uma obstrução crítica na engenharia microbiana.
Introdução
Um objetivo primário da engenharia microbiana é modificar micróbios para induzi-los a produzir compostos valiosos1,2. S. cerevisiae tem sido o organismo primário para a engenharia microbiana devido à sua facilidade de cultura e à amplitude de ferramentas disponíveis para a engenharia de seu genoma3,4,5. No entanto, um obstáculo permanece na realização de telas funcionais na levedura modificada: a triagem de throughput fica atrás da engenharia do genoma por ordens de magnitude. A triagem normalmente envolve isolar cepas em placas de micropoço e fenotipá-las medindo a produção de um composto específico6,7. O throughput deste processo é limitado pelas grandes quantidades de reagente necessárias para atribuir cepas individuais em cem reações de microlitros. A microfluido de gotículas fornece uma solução atraente para aumentar o throughput da triagem de leveduras por ordens de magnitude por reações de downscaling normalmente realizadas em placas de poço8. No entanto, como acontece com as telas de placas de poço, as telas de gotículas normalmente detectam compostos de um único produto, o que fornece informações limitadas sobre a função global da via projetada99,10,,11.
O sequenciamento de RNA (RNA-seq) pode permitir uma caracterização mais abrangente da operação do caminho, permitindo que os níveis de expressão de todos os genes relevantes sejam avaliados simultaneamente12,13. Além disso, os métodos de droplet permitem que milhares de células sejam perfiladas por experimento, fornecendo o throughput necessário para tela bibliotecas de variantes projetadas14,15. No entanto, os métodos RNA-seq são otimizados para células de mamíferos; a levedura, em comparação, tem menos mRNA por célula e uma parede celular que é difícil de remover16, impedindo seu sequenciamento pelos métodos existentes. Se um método de droplet de alto throughput pudesse ser criado para permitir o RNA-seq de levedura, ele forneceria uma plataforma de fenotipagem escalável, econômica e rica em informações para engenharia de leveduras.
Apresentamos um protocolo detalhado do nosso método recentemente desenvolvido para sequenciamento de células de levedura usando microfluidos de gotícula de alto throughput17. Para superar o desafio do RNA limitado, encapsulamos e culturamos células de levedura únicas em esferas de hidrogel picolitro. A cultura duplica as células, produzindo centenas de cópias compartilhando o mesmo caminho projetado; isso reduz a variação devido à expressão genética de células únicas, aumentando significativamente a quantidade de RNA disponível para sequenciamento. Após a amplificação baseada na cultura, esferofinaas as células, removendo a parede celular através de digestão enzimática a granel. As membranas celulares permanecem intactas, de modo que cada colônia isogênica e seu mRNA associado permanecem encapsulados em suas esferas de hidrogel. Isso nos permite emparelhar as colônias individuais com reagentes de captura de mRNA e buffer de lysis, e o mRNA a ser capturado, codificado e seqüenciado seguindo o fluxo de trabalho Drop-Seq14. Nosso método permite a triagem em toda a transcrição de milhares de colônias isogênicas de levedura por experimento.
Protocolo
1. Fabricação de dispositivos microfluidos
- Fabricação de mestre su-8
- Projete a máscara negativa para os canais microfluidos para os dispositivos A e B(Arquivo Suplementar 1 e 2)utilizando software de design assistido por computador e manuseie-os em filme de placa de circuito com resolução de pelo menos 10 μm.
- Coloque um wafer de silício limpo de 75 mm em uma coater de spin e despeje cerca de 1 mL de SU-8 em seu centro. Ligue o vácuo para prender o wafer no mandril.
- Para o dispositivo A, o spin coat SU-8 2150 a 500 rpm por 30 s, seguido por 30 s a 2.750 rpm. Para o dispositivo B, spin-coat SU-8 2100 a 500 rpm por 30 s, seguido por 30 s a 2.500 rpm. Isso produzirá camadas SU-8 de espessura de 200 μm e 120 μm, respectivamente.
- Retire o wafer do spin-coater e coloque em uma placa quente a 95 °C por 60 min para assar suavemente.
- Retire o wafer da placa quente e deixe esfriar até a temperatura ambiente. Coloque a máscara em cima do wafer, e exponha sob um collimator de 190 mW, 365 nm DE LED UV por 2 min.
- Coloque o wafer em uma placa de aquecimento fixada a 95 °C por 5 min para assar pós-exposição.
- Remova o wafer e deixe esfriar até a temperatura ambiente. Coloque o wafer em um banho de propilenoglicol monometil acetato de éter (PGMEA) por 20 min.
- Enxágüe o wafer com PGMEA seguido de isopropanol. Se algum resíduo opaco for visível durante este processo, repita a lavagem com PGMEA e isopropanol. Aar seque a wafer.
- Coloque o wafer em uma placa quente a 95 °C por 3 min.
- Remova e coloque o wafer em uma placa de Petri de 90 mm de diâmetro.
- Fundição polidimetilsiloxano (PDMS) no mestre SU-8
- Misture uma proporção de massa de 10:1 da base de silicone ao agente curador. Degas o PDMS depois de misturar por cerca de 30 min.
- Despeje PDMS desgasejado em cima do mestre SU-8 até que pelo menos uma camada de 5 mm de espessura seja formada em cima do wafer.
- Degas o PDMS em cima do wafer por cerca de 30 min.
- Coloque o wafer em um forno de 65 °C por pelo menos 80 min para curar o PDMS.
- Corte a laje pdms curada do wafer.
- Coloque a laje PDMS com as características microfluidas voltadas para cima, e furos de entrada e saída com um soco de biópsia de 0,75 mm.
- Limpe um slide de vidro de 50 mm x 75 mm com isopropanol e remova toda a poeira do lado das características microfluidas da laje PDMS com fita.
- Exponha o deslizamento de vidro limpo e a laje PDMS com as características microfluidas face até 100 Pa (1 mbar O2) plasma por 1 min.
- Coloque a laje PDMS com as características voltadas para baixo no escorregador de vidro para permitir a ligação. Coloque o escorregador em um forno de 65 °C por pelo menos 30 min para completar a ligação.
- Trate todos os canais microfluidos lavando com um fluido de tratamento de superfície fluorada. Asse o aparelho em um forno de 65 °C por pelo menos 10 min para evaporar o fluido.
2. Encapsulamento de levedura em hidrogéis usando o dispositivo A
- Tome fermento crescendo em uma cultura de suspensão e conte com um hemocytometer.
- Resuspender as células em salina tamponada fosfato (PBS) para uma concentração de cerca de 750 k/mL. Isso garante que 30% dos hidrogéis terão uma célula de levedura neles. Apenas cerca de metade das células de levedura crescem em colônias, levando a ~15% dos hidrogéis contendo colônias de leveduras.
- Misture o ponto de fusão ultrabaixo agarose a 2% c/v em PBS e aqueça a 90 °C até derreter. Isso leva ~10 min.
- Carregue a mistura de agarose em uma seringa com um filtro de 0,22 μm preso em uma bomba de seringa na frente do aquecedor espacial definido para 80 °C.
- Carregue uma seringa cheia com a suspensão de levedura e uma seringa contendo óleo fluorado com 2% de fluorosurfactante iônico18 em bombas de seringa.
- Pegue o dispositivo divisor de gota de cofluxo feito na seção 1 e conecte o tubo das seringas ao dispositivo. Guie a tubulação da tomada em um tubo cônico de 15 mL em um balde de gelo para coleta de gotas.
- Flua nas três soluções para o dispositivo com as seguintes taxas de fluxo:
- Flua a suspensão da levedura com a vazão de 3 mL/h.
- Flua a mistura de agarose à taxa de fluxo de 3 mL/h.
- Fluído o óleo fluorado à vazão de 15 mL/h.
- Coletar cerca de 1 mL de emulsão. Aguarde mais 5 min para permitir que a agarose se afina.
3. Quebrando e lavando gel para cultura
- Adicione um volume igual de 20% de perfluorooctanol (PFO) em óleo fluorado à emulsão. Inverta o tubo cônico algumas vezes para permitir a mistura.
- Gire a emulsão quebrada a 2.000 x g por 2 min. Os géis vão pelotar acima das fases de óleo e PFO.
- Remova a fase do óleo e adicione 2 mL de tampão TE-TW (10 mM Tris pH = 8,0, 1 mM EDTA, 0,01% Tween-20) para resuspender os géis. Transfira a suspensão para um novo tubo cônico de 15 mL.
- Pelota para baixo os géis como na etapa 3.2 e lavar mais uma vez em TE-TW para um total de duas lavos.
- Remova o sobrenadante e resuspenda os géis em 2 mL de mídia. Transfira para um tubo de cultura de 5 mL.
- Incubar a 30 °C durante a noite sob agitação.
NOTA: Após a incubação durante a noite, os hidrogéis de levedura podem ser mantidos a 4 °C por vários dias.
4. Lése da colônia de leveduras
- Transfira os géis para um tubo cônico de 15 mL e hidrogéis de pelotas a 2.000 x g por 2 min.
- Lave hidrogéis em PBS 2x.
- Lave em 1x tampão esféponlasting1x.
- Realize uma diluição de 2-50x de enzima esheroplasting em tampão esheroplasting e adicione 1 mL aos hidrogéis.
- Incubar a 37 °C por 1h. A levedura tratada ficará mais transparente(Figura 3A).
- Pegue a parte inferior de 0,8 mL de suspensão de hidrogel e transfira para uma seringa sem tampa de 1 mL.
- Coloque a seringa no suporte de seringa impresso em 3D(arquivo suplementar 3) e gire a 2.000 x g por 2 min. Isso fará com que os hidrogéis fechem a embalagem na cabeça da seringa.
5. captura de mRNA de colônias de leveduras lysed usando o dispositivo B
- Pegue 240.000 contas Drop-Seq e transfira para um tubo cônico de 15 mL.
- Contas de gota drop-seq girando para baixo a 1.000 x g por 1 min.
- Remova o supernadante e resuspenda as contas em 2 mL de levedura de 0,9x tampão de lyse levedura com cloreto de sódio de 500 mM para uma concentração de suspensão de contas de 120.000 contas/mL.
- Transfira a suspensão do talude para uma seringa de 3 mL com uma barra de agitação inserida.
- Prepare uma seringa contendo vários mililitros de 2% de perfluoropolyether-polietileno glicol (PFPE-PEG) em óleo fluorado.
- Evacuar toda a cabeça aquosa da seringa contendo hidrogéis bem embalados e tampar a seringa.
- Insira o hidrogel, a suspensão das abelhas e as seringas de óleo em bombas de seringa e conecte-se através de tubos no dispositivo de encapsulamento feito na seção 1.
- Conecte-se da tubulação de saída a um tubo cônico de 50 mL no gelo.
- Flua nas três soluções para o dispositivo com as seguintes taxas de fluxo:
- Espirre os hidrogéis a 0,4 mL/h.
- Flua a suspensão do talude a 0,4 mL/h.
- Fluído o óleo fluorado a 1,6 mL/h.
- Coletar ~1 mL de emulsão ou executar o dispositivo até que não haja mais hidrogéis.
6. geração de cDNA, seqüenciamento de preparação de biblioteca e sequenciamento
- Adicionar 30 mL de buffer SSC de 6x e 1 mL de PFO à emulsão coletada conforme indicado no protocolo Drop-Seq14.
- Continue a seguir o protocolo Drop-Seq para gerar cDNA a partir de mRNA capturado em contas, sequenciando a preparação da biblioteca e sequenciando a análise de dados.
Resultados
Adaptamos o fluxo de trabalho Drop-Seq anteriormente publicado14 para sequenciamento de colôniais isogênicas (ICO-seq) para realizar o perfil de expressão genética de colônias de leveduras isogênicas. Isolamos as células de levedura únicas e as encapsulamos em microgéis de agarose(Figura 1A). Após a incubação noturna de microgéis, essas células de levedura encapsuladas cresceram em colônias isogênicas. Antes de carregar géis em um segundo dispositivo microfluido para captura de mRNA, digerimos a parede celular de levedura para tornar o mRNA mais acessível(Figura 1B,esquerda). Nós fechamos esses microgéis e fundimos as contas de captura de mRNA e o tampão de lysis. Algumas gotículas continham exatamente uma gota emparelhada com uma colônia de leveduras. Todas as contas na emulsão foram coletadas e o cDNA sintetizado e sequenciado seguindo o protocolo Drop-Seq.
Geramos colônias de levedurais isogênicas através de encapsulamento de células de levedura única dentro de microgéis de agarose usando um dispositivo microfluido de coencapsulação com um divisor de oito gotas conectado(Figura 2A). Diluímos a suspensão de levedura de entrada para uma concentração de ~750.000/mL para que ~30% dos microgéis tenham exatamente uma levedura neles. Antes de inserir a agarose de temperatura de fusão ultrabaixa no dispositivo, dissolvemos-a a uma temperatura elevada e mantivemos a seringa a esta temperatura para evitar a gelação prematura. Na junção de geração de gota(Figura 2B),as células de levedura foram inicialmente encapsuladas em gotículas de 160 μm. Após a junção de geração de queda, um divisor de oito vezes dividiu essas gotículas em oito gotículas de 80 μm(Figura 2C). Um filtro de seringa foi anexado à agarose derretida para evitar que os tamancos se formassem dentro dos canais, que podem ser tão estreitos quanto 37 μm durante a divisão de gota. Coletamos a emulsão no gelo, que imediatamente iniciou o processo de gelação de agarose. Calculamos que a polidispersão de uma emulsão típica era de ~6%(Figura Suplementar 1),embora os valores de polidispersidade até 10% sejam aceitáveis. Uma vez que os géis de agarose se definiram, quebramos a emulsão e removemos a fase do óleo. Os géis foram lavados em tampão aquoso antes da imersão em meios de crescimento. A incubação noturna dos microgéis resultou em colônias isogênicas crescendo dentro de alguns dos microgéis(Figura 2D). A porcentagem de hidrogéis contendo colônias de pelo menos 20 células dependia das condições de cultura, incluindo tempo de incubação e composição da mídia. Em nossa demonstração usando C. albicans,determinamos que cerca de 15% dos hidrogéis continham uma colônia após 20 h de cultura de suspensão.
Um segundo dispositivo de coencapsulação extraiu o mRNA de colônias isogênicas (Figura 3A). Antes de carregar os microgéis de levedura no dispositivo microfluido, lavamos e imervamos os géis em uma solução para digerir as paredes das células de levedura. A digestão adequada das células de levedura foi verificada por microscopia, com levedura tratada com morfologia mais reflexiva(Figura 3B). Nós fechamos os microgéis em uma seringa e ajustamos a taxa de fluxo de entrada de gel de tal forma que um gel estava em cada gota. Um fluxo de contas de captura de mRNA no tampão de lysis misturado com o fluxo de gel fechado antes da junção de drop-making(Figura 3C). Coletamos uma emulsão resultante de gotículas de 160 μm, e colônias começaram a lonsar e liberar seu conteúdo celular. Carregamos contas em uma diluição limitante para minimizar o número de gotas contendo várias contas, mas a embalagem próxima dos géis durante a entrega resultou em cerca de 10% das gotas coletadas contendo uma gota com uma colônia lysed(Figura 3D).
Analisamos a expressão genética de C. albicans, uma espécie de levedura presente no microbioma intestinal humano, utilizando o fluxo de trabalho ICO-seq. C. albicans é notado por sua capacidade de alternar entre dois estados celulares diferentes, denominados branco e opaco19. Utilizamos uma cepa c albicans projetada, cepa RZY122, que substitui uma cópia do gene WH11, apenas ativa em células brancas com YFP20. Obtivemos um conjunto de perfis de expressão genética usando o fluxo de trabalho e os utilizamos para análise de colônias expressando pelo menos 300 genes únicos. Como conjunto de dados de referência, utilizou-se dados de expressão de C. Albicans obtidos a partir de um estudo publicado anteriormente17 e filtramos colônias expressando menos de 600 genes únicos. Após a realização da análise do componente principal (PC) e a redução da dimensionalidade de um vizinho t-estocástico (tSNE)21, encontramos concordância geral entre nosso conjunto de dados amostral e a referência(Figura 4A). A análise do PC revelou que o YFP e o WH11 contribuíram significativamente para os dois primeiros PC's. Além disso, a análise tSNE revelou três clusters(Figura 4B). Enquanto o cluster 2 era predominantemente composto por células do conjunto de dados amostral, os clusters 0 e 1 eram compostos por células de ambas as amostras. Ao sobrepor a expressão WH11 no tSNE(Figura 4C, painel superior), determinamos que o cluster 1 provavelmente continha colônias brancas. Verificou-se também que a expressão STF2 aumentou no cluster 1 (Figura 4C, painel inferior), consistente com os dados obtidos anteriormente17. Nos clusters 0 e 2, WH11 e STF2 foram significativamente desregulados em comparação com o cluster 1 (Figura 4D). Os genes envolvidos na fermentação, como o ADH1,foram regulados no cluster 0, consistentes com estudos anteriores de células opacas22. Descobrimos que as colônias no aglomerado 2 tinham diminuído o RNA ribossômico em comparação com colônias nos aglomerados 0 e 1. Embora os conjuntos de dados de amostra e referência tenham sido obtidos usando o mesmo estoque de células, este resultado sugere que mesmo diferenças sutis no manuseio experimental podem afetar a expressão genética.
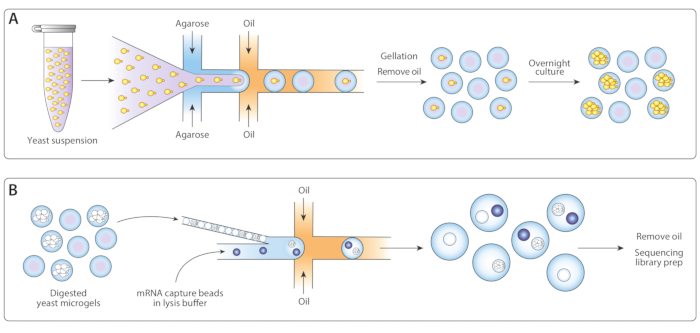
Figura 1: Visão geral do fluxo de trabalho ICO-seq. (A) O cultivo de leveduras em uma cultura de suspensão foi diluído em tampão e coencapsulado com agarose derretida em um dispositivo gerador de gotículas com foco de fluxo para permitir o carregamento de microgéis de agarose com células de levedura únicas. Os géis se fixaram quando a agarose esfriou, a suspensão óleo/água foi quebrada, e o óleo foi removido, produzindo uma suspensão de contas de gel na água. Seguindo a cultura da noite para o dia, as células de levedura cresceram em colônias isogênicas dentro dos microgéis. (B) As colônias foram submetidas a um tampão de degradação da parede celular, após o qual foram embaladas e coencapsuladas com contas de captura de mRNA em um segundo dispositivo microfluido. A embalagem apertada dos microgéis garantiu que cada gota tivesse um gel, enquanto o carregamento de Poisson das contas reduziu a chance de múltiplas contas dentro de uma gota. As gotas coletadas foram processadas para a síntese de CDNA e geração de uma biblioteca de sequenciamento. Clique aqui para ver uma versão maior desta figura.
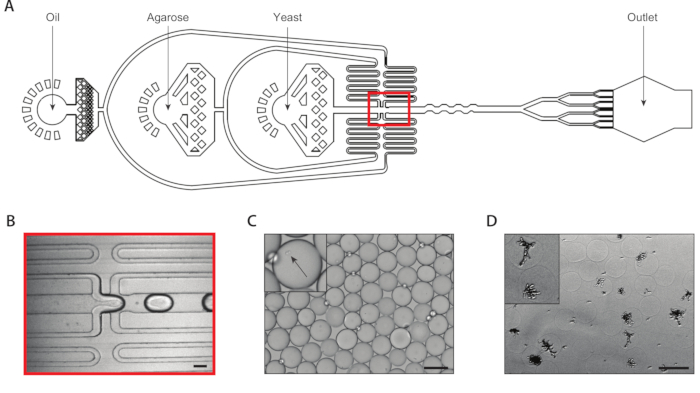
Figura 2: Geração de colônias de leveduras isogênicas dentro de microgéis de agarose usando o Dispositivo A. (A) Esquemático do dispositivo microfluido, mostrando os locais das três entradas e portas de saída. A junção de drop-making é destacada em vermelho. (B) Close-up da junção de queda durante a operação normal do dispositivo. (C) Micrografo de gotículas coletadas, com um close-up de uma gotícula contendo uma célula encapsulada (inset). (D) Micrografia de colônias de leveduras isogênicas em microgéis de agarose após uma incubação de 24 horas, com um close-up de duas colônias (inset). Todas as barras de escala = 100 μm. Por favor, clique aqui para ver uma versão maior desta figura.
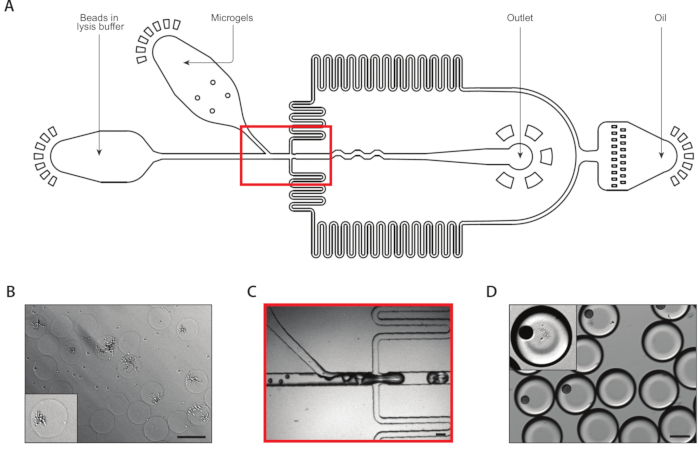
Figura 3: Captura de lysis e mRNA de colônias isogênicas usando o Dispositivo B. (A) Esquemático do dispositivo microfluido, mostrando os locais das três entradas e portas de saída. A junção de drop-making é destacada em vermelho. (B) Micrografo de colônias de leveduras após a digestão da parede celular, com um close-up de uma colônia (inset). (C) Close-up da junção de queda durante o funcionamento normal do dispositivo. (D) Micrografo de emulsões coletadas após o emparelhamento de microgel e esferas, com um close-up mostrando uma gota com uma esfera e uma colônia de lysed (inset). Todas as barras de escala = 100 μm. Por favor, clique aqui para ver uma versão maior desta figura.
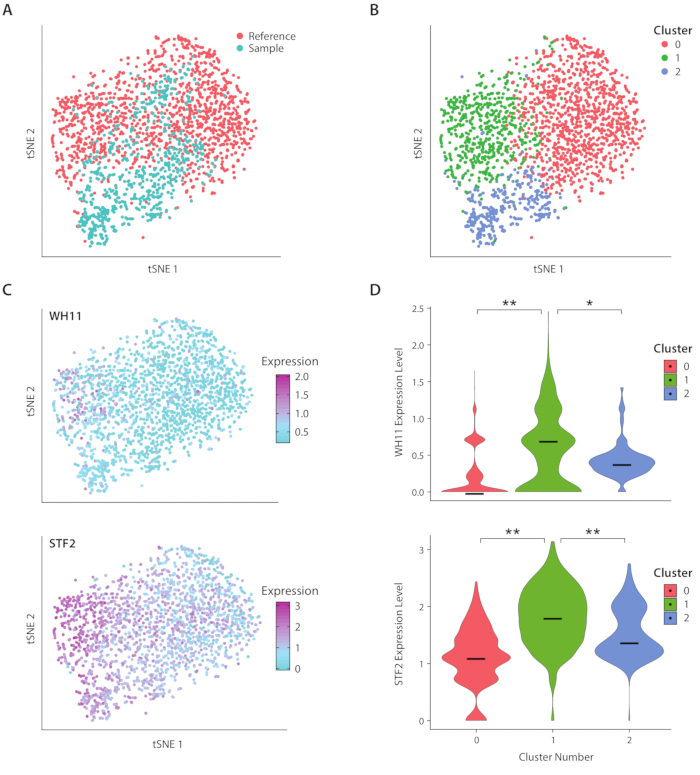
Figura 4: Análise da resposta de comutação branco-opaca em C. albicans. (A) tSNE plot de um conjunto de dados amostral combinado com um conjunto de dados de referência de Liu17. (B)O agrupamento de transcriptomas revela três aglomerados visualizados em um enredo tSNE. (C) Os genes-chave envolvidos na resposta de comutação branco-opaco contribuíram para a variação determinada através da análise dos componentes principais. (D) Parcelas de violino de níveis de expressão normalizados de YFP e WH11 por clusters marcados no enredo tSNE. **indica p <<< 0,05 e * indica p << 0,05. Clique aqui para ver uma versão maior desta figura.
Figuras suplementares 1 e 2. Clique aqui para baixar esses filgures.
Arquivos suplementares 1-3. Clique aqui para baixar esses arquivos.
Discussão
Nosso método para sequenciamento de RNA da colônia isogênica de levedura (ICO-seq) adapta uma plataforma de sequenciamento de RNA de célula única publicada, Drop-Seq, para triagem de alta produtividade de cepas de levedura projetadas. As células de levedura contêm menos de 10% das cópias de mRNA de uma célula típica de mamíferos e possuem uma parede celular que precisa ser degradada antes da captura de mRNA16. Esses dois fatores impedem a aplicação direta de leveduras em Drop-Seq ou outras plataformas scRNA-seq baseadas em gotículas. Para resolver essas questões, encapsulamos células únicas dentro de hidrogéis e as cultivamos em colônias para fornecer material de entrada suficiente para sequenciamento de RNA e digerimos a parede de células de levedura para gerar esheroplastos antes da captura de lysis e mRNA. Essas alterações adicionam complexidade adicional no fluxo de trabalho ICO-seq quando comparadas com o fluxo de trabalho original drop-seq e são etapas críticas que os usuários devem garantir que procedam sem problemas.
O funcionamento adequado do Dispositivo A é necessário para encapsular células de levedura únicas dentro de hidrogéis de agarose. A contagem adequada da suspensão de levedura de entrada deve ser seguida para minimizar o número de hidrogéis com mais de uma célula de levedura, ao mesmo tempo em que garante que hidrogéis suficientes contenham uma única célula para garantir uma eficiência razoável de captura de células durante a captura de mRNA. Durante a operação do dispositivo microfluido, a mistura de gel de agarose deve ser bem dissolvida e passar por um filtro de seringa para minimizar a chance de entupimento do dispositivo. A mistura de gel de agarose é viscosa e a região em que um único canal se divide em oito é especialmente propensa a entupimentos. Ao centralizar uma câmera de alta velocidade para visualizar a operação do dispositivo naquela região do dispositivo, os usuários podem monitorar a uniformidade das gotículas emergindo de cada um dos oito canais e reagir rapidamente se a uniformidade mudar devido a tamancos em qualquer um dos canais. A inspeção de uma pequena quantidade de emulsão coletada sob o microscópio fornece um método secundário para confirmar uma emulsão de alta qualidade.
Após o crescimento das colônias de leveduras dentro de hidrogéis, várias precauções são necessárias para garantir a extração de mRNA de qualidade no nível de uma única colônia. É importante otimizar o tempo que a levedura está na cultura dos hidrogel, pois se a levedura for deixada na cultura por muito tempo, muitos escaparão dos limites dos hidrogéis, levando a um sinal de fundo mais alto durante o sequenciamento do RNA e menor sensibilidade ao discriminar entre os tipos de células. A geração adequada de esheroplastos usando Zymolyase garante que o mRNA será liberado após a exposição celular ao tampão de lyse. A inspeção visual das colônias de leveduras após zymolyase deve produzir células de levedura mais brilhantes. A digestão inadequada da parede celular levará a uma menor eficiência de captura de RNA. Por último, os hidrogéis devem ser embalados de perto, pois são injetados no dispositivo B. O monitoramento da entrada de hidrogel com uma câmera de alta velocidade permitirá o término da coleta de emulsão uma vez que os hidrogéis não estejam mais fechados após a entrada no dispositivo, caso contrário, a eficiência de captura será impactada.
Uma preocupação potencial com nosso método é que a cultura de microgel da levedura pode alterar significativamente a expressão genética. Trabalhos anteriores que investigam a expressão genética da levedura em microgéis e em ágar demonstram diferenças nas médias de expressão genética, mas no geral uma correlação positiva17, embora uma investigação mais aprofundada desta alegação sobre uma variedade de cepas de levedura seja prudente. O método também tem eficiência limitada de captura de células devido ao carregamento estocástico de contas de captura de mRNA seguindo as estatísticas de Poisson14. Atualmente, cerca de 10% das gotas contêm uma conta e uma colônia, e espera-se que a taxa de encapsulamentos duplos seja inferior a 1%. Encapsulamentos duplos levam a elementos confusos durante a análise de dados RNA-seq e sua filtragem permanece desafiadora23; uma taxa de captura de 25% levaria a um aumento correspondente de encapsulamentos duplos para 5%(Figura Suplementar 2). Embora demonstremos ICO-seq usando a plataforma Drop-Seq, existem outras plataformas de Droplet RNA-seq que introduzem contas de captura de mRNA determinicamente e não estatisticamente, como a plataforma 10x Genomics Chromium15,24. A integração dessas plataformas com a ICO-seq poderia aumentar a eficiência de captura além do que as estatísticas de Poisson permitem. Por último, uma limitação fundamental do RNA-seq droplet é a incapacidade de recuperar células de interesse após o sequenciamento. Essa limitação deve ser levada em consideração ao considerar os tipos de bibliotecas de leveduras a serem analisadas usando este método.
A heterogeneidade celular-célula tem sido demonstrada no nível clonal para micróbios como E. coli25 e S. cerevisiae26 revelando novas células afirma que uma análise em nível de volume mascararia de outra forma. As análises de RNA-seq em massa realizadas em C. albicans tendem a olhar para as alterações de transcriptome em toda a população, ou células brancas e opacas como duas populações separadas27,28. A aplicação da ICO-seq poderia levar à descoberta de subestados adicionais e fornecer uma estrutura analítica para a descoberta de novos estados celulares dentro de outras espécies de leveduras. No entanto, o crescimento das células dentro dos hidrogéis não se limita à levedura: outros tipos de células, como mamíferos, bacterianos e outras células fúngicas também podem ser cultivados dentro de hidrogéis29,30. O sequenciamento de colônias isogênicas versus células individuais leva à média do ruído biológico devido à variação celular-célula, melhorando a discriminação entre os tipos de células. Isso pode ajudar na análise de células onde a diversidade genética se concentra em caminhos de síntese específicos. As possibilidades ampliadas de entrada do tipo celular à ICO-seq e sua potencial integração com plataformas de RNA-seq de gotículas disponíveis comercialmente posiciona a ICO-seq como uma plataforma promissora para dissecar a heterogeneidade celular no nível genético.
Divulgações
Os autores não declaram conflitos de interesse.
Agradecimentos
Este projeto foi apoiado pelo National Science Foundation Career Award DBI-1253293, National Institutes of Health New Innovator Award DP2AR068129 e pela concessão R01HG008978, pelo National Science Foundation Technology Center grant DBI-1548297 e pelo UCSF Center for Cellular Construction. ARA e ZJG são Investigadores da Biohub Chan-Zuckerberg.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.22 um syringe filter | Milipore Sigma | SLGP033RS | |
| 0.5M EDTA, pH 8.0 | Thermo-Fisher | 15575020 | Used to make TE-TW buffer |
| 0.75 mm biopsy punch | World Precision Instruments | 504529 | |
| 1 mL syringes | BD | 309628 | |
| 1H,1H,2H-Perfluoro-1-Octanol (PFO) | Sigma-Aldrich | 370533 | |
| 1M Tris-HCI, pH 8.0 | Thermo-Fisher | 15568025 | Used to make TE-TW buffer |
| 27 gauge needles | BD | 305109 | |
| 3 mL syringes | BD | 309657 | |
| 3" silicon wafers, P type, virgin test grade | University Wafers | 447 | |
| 3D-printed centrifuge syringe holder | (custom) | (custom) | See Supplemental Files for 3D print file |
| Agarose, low gelling temperature | Sigma-Aldrich | a9414 | |
| Aquapel (hydrophobic glass treatment) | Pittsburgh Glass Works | 47100 | |
| Drop-Seq Beads | ChemGenes | MACOSKO-2011-10 | |
| Glass microscope slides (75 mm x 50 mm) | Corning | 294775X50 | |
| Ionic Krytox Surfactant | Synthesis instructions in ref 14. Can substitute with PEG-PFPE surfactant. | ||
| Isopropanol | Sigma-Aldrich | 109827 | |
| NaCl | Sigma-Aldrich | S9888 | |
| Novec 7500 | 3M | 98-0212-2928-5 | Commonly knowns as HFE 7500 |
| PBS | Fisher Scientific | BP243820 | |
| PE-2 polyethylene tubing | Scientific Commodities | B31695-PE/2 | |
| PEG-PFPE surfactant | Ran Biotechnologies | 008-FluoroSurfactant | |
| PGMEA developer | Sigma-Aldrich | 484431 | |
| Photomasks | CadArt Servcies | (custom) | See Supplemental Files for mask designs |
| Spin coater | Specialty Coating Systems | G3P-8 | |
| SSC Buffer | Sigma-Aldrich | S6639 | |
| SU-8 2100 | MicroChem | Y111075 | |
| SU-8 2150 | MicroChem | Y111077 | |
| Sylgard 184 silicone elastomer kit | Krayden | 4019862 | |
| Tween-20 | Sigma-Aldrich | P1379 | Used to make TE-TW buffer |
| YR Digestion buffer | Zymo Research | R1001-1 | Spheroplasting buffer |
| YR Lysis Buffer | Zymo Research | R1001-2 | |
| Zymolyase | Zymo Research | E1005 | Spheroplasting enzyme mixture |
Referências
- Peralta-Yahya, P. P., Zhang, F., Del Cardayre, S. B., Keasling, J. D. Microbial engineering for the production of advanced biofuels. Nature. 488 (7411), 320-328 (2012).
- Curran, K. A., Alper, H. S. Expanding the chemical palate of cells by combining systems biology and metabolic engineering. Metabolic Engineering. 14 (4), 289-297 (2012).
- Botstein, D., Chervitz, S. A., Cherry, J. M. Yeast as a model organism. Science. 277 (5330), 1259-1260 (1997).
- Mager, W. H., Winderickx, J. Yeast as a model for medical and medicinal research. Trends in Pharmacological Sciences. 26 (5), 265-273 (2005).
- Krivoruchko, A., Siewers, V., Nielsen, J. Opportunities for yeast metabolic engineering: Lessons from synthetic biology. Biotechnology Journal. 6 (3), 262-276 (2011).
- Vanella, R., et al. Yeast-based assays for screening 11β-HSD1 inhibitors. Microbial Cell Factories. 15 (1), (2016).
- Zhuang, X., Chappell, J. Building terpene production platforms in yeast. Biotechnology and Bioengineering. 112 (9), 1854-1864 (2015).
- Agresti, J. J., et al. Ultrahigh-throughput screening in drop-based microfluidics for directed evolution. Proceedings of the National Academy of Sciences. 107 (9), 4004-4009 (2010).
- Wang, G., et al. RNAi expression tuning, microfluidic screening, and genome recombineering for improved protein production in Saccharomyces cerevisiae. Proceedings of the National Academy of Sciences. 116 (19), 9324-9332 (2019).
- Beneyton, T., et al. Droplet-based microfluidic high-throughput screening of heterologous enzymes secreted by the yeast Yarrowia lipolytica. Microbial Cell Factories. 16 (1), 18(2017).
- Sjostrom, S. L., et al. High-throughput screening for industrial enzyme production hosts by droplet microfluidics. Lab on a Chip. 14 (4), 806-813 (2014).
- Nadal-Ribelles, M., et al. Sensitive high-throughput single-cell RNA-seq reveals within-clonal transcript correlations in yeast populations. Nature Microbiology. 4 (4), 683-692 (2019).
- Gasch, A. P., et al. Single-cell RNA sequencing reveals intrinsic and extrinsic regulatory heterogeneity in yeast responding to stress. PLoS Biology. 15 (12), 2004050(2017).
- Macosko, E. Z., et al. Highly parallel genome-wide expression profiling of individual cells using nanoliter droplets. Cell. 161 (5), 1202-1214 (2015).
- Klein, A. M., et al. Droplet barcoding for single-cell transcriptomics applied to embryonic stem cells. Cell. 161 (5), 1187-1201 (2015).
- von der Haar, T. A quantitative estimation of the global translational activity in logarithmically growing yeast cells. BMC Systems Biology. 2, 87(2008).
- Liu, L., Dalal, C. K., Heineike, B. M., Abate, A. R. High throughput gene expression profiling of yeast colonies with microgel-culture Drop-seq. Lab on a Chip. 19 (10), 1838-1849 (2019).
- Fallah-Araghi, A., Baret, J. C., Ryckelynck, M., Griffiths, A. D. A completely in vitro ultrahigh-throughput droplet-based microfluidic screening system for protein engineering and directed evolution. Lab on a Chip. 12 (5), 882-891 (2012).
- Berman, J., Sudbery, P. E. Candida albicans: A molecular revolution built on lessons from budding yeast. Nature Reviews Genetics. 3 (12), 918-930 (2002).
- Srikantha, T., Soll, D. R. A white-specific gene in the white-opaque switching system of Candida albicans. Gene. 131 (1), 53-60 (1993).
- van der Maaten, L., Hinton, G. Visualizing data using t-SNE. Journal of Machine Learning Research. 9, 2579-2605 (2008).
- Sun, Y., et al. Deletion of a yci1 domain protein of Candida albicans allows homothallic mating in MTL heterozygous cells. mBio. 7 (2), 00465-00516 (2016).
- McGinnis, C. S., Murrow, L. M., Gartner, Z. J. DoubletFinder: Doublet Detection in Single-Cell RNA Sequencing Data Using Artificial Nearest Neighbors. Cell Systems. 8 (4), 329-337 (2019).
- Baran-Gale, J., Chandra, T., Kirschner, K. Experimental design for single-cell RNA sequencing. Briefings in Functional Genomics. 17 (4), 233-239 (2018).
- Silander, O. K., et al. A Genome-Wide Analysis of Promoter-Mediated Phenotypic Noise in Escherichia coli. PLoS Genetics. 8 (1), 1002443(2012).
- Newman, J. R. S., et al. Single-cell proteomic analysis of S. cerevisiae reveals the architecture of biological noise. Nature. 441 (7095), 840-846 (2006).
- Tuch, B. B., et al. The Transcriptomes of Two Heritable Cell Types Illuminate the Circuit Governing Their Differentiation. PLoS Genetics. 6 (8), 1001070(2010).
- Romo, J. A., et al. Global Transcriptomic Analysis of the Candida albicans Response to Treatment with a Novel Inhibitor of Filamentation. mSphere. 4 (5), 00620(2019).
- Huang, H., et al. Generation and manipulation of hydrogel microcapsules by droplet-based microfluidics for mammalian cell culture. Lab on a Chip. 17 (11), 1913-1932 (2017).
- Lin, X., Nishio, K., Konno, T., Ishihara, K. The effect of the encapsulation of bacteria in redox phospholipid polymer hydrogels on electron transfer efficiency in living cell-based devices. Biomaterials. 33 (33), 8221-8227 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados