Method Article
高通量酵母菌株,带基于滴滴的RNA测序
摘要
微生物工程"设计-构建-测试"周期的一个瓶颈是,我们可以执行应变功能屏幕的速度。我们描述了一种高通量方法,用于菌株筛选,应用于每个实验的数百至数千个酵母细胞,利用基于滴滴的RNA测序。
摘要
可用于编辑酵母基因组的强大工具使这种微生物成为工程的宝贵平台。虽然现在有可能构建数百万种基因独特的菌株库,但筛选所需的表型仍然是一个重大障碍。利用现有的筛选技术,信息输出和吞吐量之间存在权衡,高通量筛选通常对一个感兴趣的产品进行。因此,我们提出了一种方法,通过调整单细胞RNA测序到基因工程酵母菌株的等源皮果菌菌落,加速菌株筛选。为了应对在酵母细胞上执行RNA测序的独特挑战,我们在进行RNA测序之前,在水凝胶和球体中培养等源酵母菌菌菌菌菌。RNA测序数据可用于推断酵母表型和整理工程路径。我们方法的可扩展性解决了微生物工程中一个关键障碍。
引言
微生物工程的主要目标是修改微生物,以诱导它们产生有价值的化合物11,2。2由于其易于培养和可用于工程其基因组33、4、54,5的工具,S. cerevisiae一直是微生物工程的主要有机体。然而,在改良酵母上执行功能屏幕仍有一个障碍:筛选吞吐量落后于基因组工程的量级。筛选通常涉及隔离微孔板中的菌株,并通过测量特定化合物66、77的产量来平分。这个过程的吞吐量受到在百微升反应中对单个菌株进行分析所需的大量试剂的限制。液滴微流体提供了一个有吸引力的解决方案,通过缩小通常在孔板8中执行的反应,提高酵母筛选的吞吐量。然而,与井板屏幕一样,滴层屏幕通常检测单个产品化合物,这为工程路径9、10、1110,的全球功能9提供了有限的信息。11
RNA测序(RNA-seq)可以通过允许所有相关基因的表达水平同时评估12,13,,13实现路径操作的更全面的表征。此外,滴脚方法允许每个实验对数千个细胞进行剖查,为筛选工程变体14、15,15的库提供了所需的吞吐量。然而,RNA-seq方法针对哺乳动物细胞进行了优化;相比之下,酵母每个细胞的mRNA较少,细胞壁难以去除16个,用现有方法排除了它们的测序。如果能够设计高通量滴法来实现酵母RNA-seq,它将为酵母工程提供一个可扩展、经济高效且信息丰富的解说平台。
我们介绍了我们最近开发的方法的详细协议,该方法使用高通量液滴微流体17测序酵母细胞。为了克服有限RNA的挑战,我们在皮升水凝胶球中封装并培养单个酵母细胞。培养复制细胞,产生数百份共享相同工程途径的拷贝;这减少了由于单细胞基因表达的变化,同时显著增加可用于测序的RNA量。在基于培养的扩增后,我们通过散装酶消化去除细胞壁。细胞膜保持完整,因此每个等源菌落及其相关的mRNA都封装在其水凝胶球体中。这使我们能够配对单个菌落与mRNA捕获试剂和赖塞缓冲液,和mRNA被捕获,条形码,并排序后,Drop-Seq工作流14。我们的方法允许每个实验对数千个等源酵母菌群进行转录。
研究方案
1. 微流体装置制造
- SU-8 主制造
- 使用计算机辅助设计软件为设备 A 和 B(补充文件 1和2)设计微流体通道的负掩码,并将其打印在至少 10 μm 的电路板薄膜上。
- 将干净的 75 mm 硅片放在旋转涂布器上,将大约 1 mL 的 SU-8 倒入其中心。打开真空将晶圆固定到夹头。
- 对于设备 A,旋转涂层 SU-8 2150 在 500 rpm 时为 30 s,随后在 2,750 rpm 时旋转 30 s。对于设备 B,旋转涂层 SU-8 2100 在 500 rpm 时为 30 s,随后在 2,500 rpm 时旋转涂层 SU-8 2100。这将产生SU-8层厚度分别为200μm和120μm。
- 从自旋涂层中取出晶圆,在 95°C 下放在热板上 60 分钟进行软烤。
- 从热板中取出晶圆,使其冷却至室温。将面罩放在晶圆顶部,并在 190 mW、365 nm 紫外线 LED 下曝光 2 分钟。
- 将晶圆放在 95°C 的热板上 5 分钟,用于曝光后烘烤。
- 取出晶圆,使其冷却至室温。将晶圆放入丙二醇单甲基乙醚醋酸酯 (PGMEA) 浴中 20 分钟。
- 用 PGMEA 冲洗晶圆,然后用异丙醇冲洗。如果在此过程中任何不透明残留物可见,请用 PGMEA 和异丙醇重复 rring。空气干燥晶圆。
- 将晶圆置于 95°C 的热板上 3 分钟。
- 取出晶圆并将其放入直径为 90 mm 的培养皿中。
- SU-8主铸上的多二甲基硅氧烷 (PDMS) 铸造
- 将硅胶碱基与固化剂的 10:1 质量比混合在一起。混合约30分钟后,对PDMS进行脱气。
- 在 SU-8 母版顶部浇注脱气 PDMS,直到晶圆顶部形成至少 5 mm 厚的层。
- 在晶圆顶部对 PDMS 进行约 30 分钟的脱气。
- 将晶圆放入 65°C 烤箱中至少 80 分钟以固化 PDMS。
- 从晶圆中切出固化的 PDMS 板。
- 将带有微流体特征的 PDMS 板朝上放置,用 0.75 mm 活检冲孔打孔和出口孔。
- 用异丙醇清洁 50 mm x 75 mm 玻璃滑道,用胶带清除 PDMS 板微流体功能侧的所有灰尘。
- 将清洁的玻璃滑梯和具有微流体特征的 PDMS 板面面面面为 100 Pa(1 mbar O2) 等离子体,1 分钟。
- 将具有特征的 PDMS 板朝下放在玻璃滑轨上,以便进行粘接。将幻灯片放入 65°C 烤箱中至少 30 分钟以完成粘接。
- 使用氟化表面处理液冲洗处理所有微流体通道。在 65°C 烤箱中烘烤设备至少 10 分钟以蒸发液体。
2. 使用设备 A 在水凝胶中封装酵母
- 以在悬浮培养中生长的酵母为例,依靠测速仪。
- 将磷酸盐缓冲盐水(PBS)中的细胞重新悬浮到约750 k/mL的浓度。这确保了30%的水凝胶将含有一个酵母细胞。只有大约一半的酵母细胞生长成菌落,导致含有酵母菌落的15%的水凝胶。
- 在 PBS 中以 2% v 和 90°C 加热,直到熔化,将超低熔点阿加罗斯混合。这需要10分钟。
- 将阿加罗斯混合物与连接的 0.22 μm 过滤器加载到注射器中,放入空间加热器设置为 80°C 前的注射器泵中。
- 将装有酵母悬浮液的注射器和含有2%v 离子氟化剂18的含氟油的注射器装入注射器泵。
- 取第 1 部分制造的共流跌落分离器设备,并将注射器的管连接到设备。将油管从出口引导到冰桶中的 15 mL 锥形管中,以便收集。
- 以以速将三个解决方案流入设备:
- 以 3 mL/h 的流速流动酵母悬浮液。
- 以 3 mL/h 的流速流动琼脂混合物。
- 以 15 mL/h 的流速流动氟化油。
- 收集约1 mL乳液。再等 5 分钟,让琼脂完全设置。
3. 为培养而破碎和洗涤凝胶
- 在乳液中加入20%全氟辛烷醇(PFO)的同等体积。反转锥形管几次,以允许混合。
- 在 2,000 x g下旋转破碎的乳液 2 分钟。凝胶将颗粒超过油和PFO相位。
- 拆下油相并加入 2 mL TE-TW 缓冲液(10 mM Tris pH = 8.0、1 mM EDTA、0.01% Tween-20)以重新悬浮凝胶。将悬架转移到新的 15 mL 锥形管中。
- 像步骤 3.2 中一样,将凝胶击倒,并在 TE-TW 中再洗一次,总共洗涤两次。
- 在 2 mL 介质中去除上清液并重新悬浮凝胶。转移到5 mL培养管。
- 在摇动下在30°C孵育过夜。
注:过夜孵育后,酵母水凝胶可在4°C下保存数天。
4. 酵母菌菌落
- 将凝胶以 2,000 x g的速度将凝胶转移到 15 mL 锥形管和颗粒水凝胶中 2 分钟。
- 在 PBS 2x 中清洗水凝胶。
- 洗涤在1x孢子缓冲液1x。
- 在孢子缓冲液中进行2~50倍的增压酶稀释,并将1 mL加入水凝胶。
- 在37°C孵育1小时。经过处理的酵母看起来更加透明(图3A)。
- 取下底部 0.8 mL 的水凝胶悬浮液,并转移到 1 mL 未封顶的注射器中。
- 将注射器放入 3D 打印注射器支架(补充文件 3),并在 2,000 x g旋转 2 分钟。这将导致水凝胶关闭注射器头部的包。
5. mRNA 使用设备 B 从落叶菌群捕获
- 取 240,000 滴-Seq 珠子,并转移到一个 15 mL 锥形管。
- 在 1,000 x g下旋转 1 分钟,将小珠滴-塞克珠子向下旋转。
- 在2 mL 0.9x酵母赖塞缓冲液中去除上清液,重新悬浮珠,用500 mM氯化钠,珠子悬浮浓度为120,000珠/mL。
- 将珠子悬架转移到插入搅拌杆的 3 mL 注射器上。
- 在氟化油中制备含有几毫升2%v全氟脂合体-聚乙烯乙二醇(PFPE-PEG)表面活性剂的注射器。
- 疏散装有紧密包装水凝胶的注射器的所有水头,并盖住注射器。
- 将水凝胶、珠子悬浮液和油注射器插入注射器泵,并通过管道连接到第 1 部分制造的封装装置中。
- 从出口管连接到冰上的 50 mL 锥形管。
- 以以速将三个解决方案流入设备:
- 以 0.4 mL/h 的速度流动水凝胶。
- 以 0.4 mL/h 的速度将珠子悬架流动。
- 以 1.6 mL/h 的速度流动氟化油。
- 收集 ±1 mL 乳液或运行设备,直到不再有水凝胶。
6. cDNA 生成、测序库准备和测序
- 在 Drop-Seq 协议14中所述的收集乳液中添加 30 mL 的 6x SSC 缓冲液和 1 mL PFO。
- 继续遵循 Drop-Seq 协议,从珠子上捕获的 mRNA 生成 cDNA、测序库准备和测序数据分析。
结果
我们调整了先前发布的Drop-Seq工作流程14的等源菌种测序(ICO-seq),以执行等源酵母菌菌菌菌群的基因表达分析。我们分离了单个酵母细胞,并将其封装成琼脂胶微凝胶(图1A)。在微凝胶通宵孵育后,这些封装的酵母细胞长成等源菌落。在将凝胶装入第二个微流体装置以进行mRNA捕获之前,我们消化酵母细胞壁,使mRNA更容易获得(图1B,左图)。我们紧密包装这些微凝胶,并合并mRNA捕获珠子和水解缓冲液。有些液滴正好含有一个珠子,与一个落叶菌菌群配对。乳液中的所有珠子都被收集起来,cDNA按照滴-Seq协议进行合成和测序。
我们使用连接8个滴分器的共封装微流体装置,通过单酵母细胞封装在琼脂微凝胶内生成异质酵母菌菌落(图2A)。我们稀释了输入酵母悬浮液的浓度为±750,000/mL,使+30%的微凝胶有一个酵母。在将超低熔融温度阿加罗斯插入设备之前,我们将其溶解在较高的温度下,并将注射器保持在该温度下,以防止过早凝固。在滴生成结(图2B)中,酵母细胞最初被封装到160μm液滴中。在滴落接合后,八折分离器将这些液滴分成八个 80 μm 液滴(图 2C)。注射器过滤器连接到熔融的琼脂,以防止堵塞在通道内形成,在滴裂过程中,堵塞可以缩小到37μm。我们收集了冰上乳液,这立即开始了糖凝乳过程。我们计算出典型乳液的聚分散度为±6%(补充图1),但可接受高达10%的聚分散值。一旦琼脂糖凝胶设置,我们打破了乳液,并删除了油相。凝胶在浸入生长介质之前,被用水缓冲液清洗。微凝胶的过夜孵化导致等源菌落生长在某些微凝胶中(图2D)。含有至少20个细胞菌落的水凝胶的百分比取决于培养条件,包括孵育时间和介质组成。在使用C.白化虫的演示中,我们确定大约15%的水凝胶在悬浮培养20小时后含有一个殖民地。
第二个共封装装置从等源菌落中提取了mRNA(图3A)。在将酵母微凝胶装入微流体装置之前,我们将凝胶洗净并浸入溶液中,以消化酵母细胞壁。通过显微镜验证酵母细胞的正确消化,经过处理的酵母具有更反射的形态(图3B)。我们将微凝胶紧密包装在注射器中,并调整凝胶输入流速,以便每滴一个凝胶。在滴落结之前,在流解缓冲液中捕获珠子与紧密包装的凝胶流混合(图3C)。我们收集了160μm液滴的结果乳液,菌落开始裂解并释放其细胞含量。我们以限稀释度加载珠子,以尽量减少含有多个珠子的滴数,但在滴落过程中对凝胶进行紧密包装,导致大约10%的采集液滴含有一个带落体菌的珠子(图3D)。
我们使用ICO-seq工作流程分析了C.类化树的基因表达,这种酵母存在于人类肠道微生物群系中。C. 白化藻以其在两种不同的细胞状态(称为白色和不透明的19)之间切换的能力而闻名。我们使用一种工程化的C藻化菌株,应变RZY122,它取代了WH11基因的一个副本,只在白细胞中活性为YFP20。20我们利用工作流程获得了一组基因表达特征,并用它来分析至少300个独特基因的菌落。作为参考数据集,我们使用从先前发表的研究17中获得的C.阿尔比坎斯表达数据,并筛选出表达不到600个独特基因的菌落。在执行主组件 (PC) 分析和 t 随机邻域嵌入 (tSNE) 维度减小21后,我们发现示例数据集与参考之间的一般一致性(图 4A)。PC分析表明,YFP和WH11对前两台电脑的显著贡献。此外,tSNE分析揭示了三个聚类(图4B)。虽然群集 2 主要由样本数据集中的单元格组成,但群集 0 和 1 由两个样本的单元格组成。通过在 tSNE 上叠加 WH11 表达式(图 4C,上面板),我们确定群集 1 可能包含白色菌落。我们还发现,STF2表达式在群集 1(图 4C,下面板)中增加,与以前获得的数据17一致。在群集 0 和 2 中,与群集 1 相比,WH11 和 STF2 的调节明显降低(图 4D)。参与发酵的基因,如ADH1,在0组被加强调节,与先前对不透明细胞22的研究一致。我们发现,与组 0 和 1 中的菌落相比,第 2 簇中的菌落减少了核糖核酸RNA。虽然样本和参考数据集是使用相同的细胞储备获得的,但结果表明,即使实验处理中的细微差异也会影响基因表达。
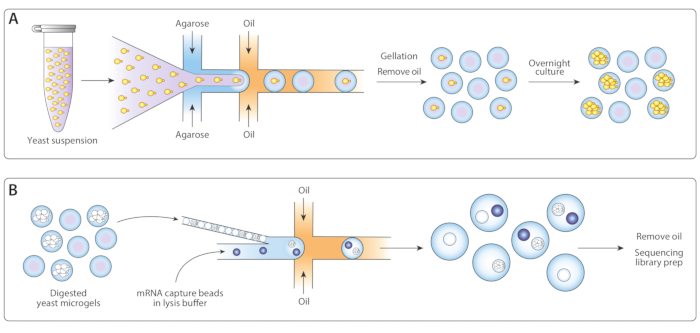
图 1:ICO-seq 工作流概述。(A) 生长在悬浮培养液中的酵母在缓冲液中稀释,并在流聚焦液滴发生器中与熔融的琼脂糖结合,使泊斯微凝胶与单酵母细胞一起加载。凝固糖冷却时,油/水悬浮液破裂,油被去除,导致水中凝胶珠悬浮。在一夜栽培之后,酵母细胞生长成微凝胶内的等感菌群。(B) 菌群受到细胞壁降解缓冲液的影响,之后它们被紧密包装,并在第二个微流体装置中用mRNA捕获珠子进行封装。微凝胶的紧密包装确保每个滴有一个凝胶,而泊松加载珠子减少在一滴内多个珠子的机会。采集的滴液经过处理,用于cDNA合成和生成测序库。请点击此处查看此图形的较大版本。
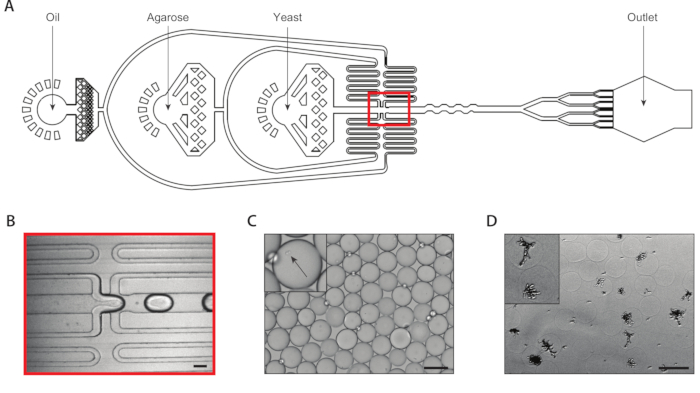
图2:使用设备A在琼脂微凝胶内生成等源酵母菌落。(A) 微流体装置的原理图,显示三个输入和输出端口的位置。滴接点以红色突出显示。(B) 在正常设备操作期间,拉落接线结的特写。(C) 收集液滴的显微图,带有包含封装的单元(内集)的液滴的特写。(D) 在24小时孵育后,在琼脂微凝胶中等源酵母菌菌菌群的微图,特写两个菌落(内侧)。所有刻度柱 = 100 μm。请点击这里查看此图形的较大版本。
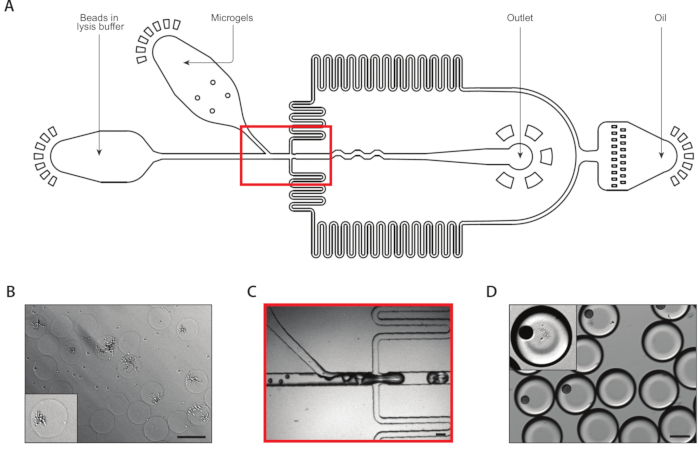
图3:使用设备B从等源菌落捕获的Lysis和mRNA。(A) 微流体装置的原理图,显示三个输入和输出端口的位置。滴接点以红色突出显示。(B) 细胞壁消化后酵母菌群的显微图,带有一个菌落的特写(内部)。(C) 在正常设备操作期间,拉落接线结的特写。(D) 微凝胶和珠子配对后收集的乳液的显微图,特写显示珠子和落叶菌群(内位)的滴落。所有刻度柱 = 100 μm。请点击这里查看此图形的较大版本。
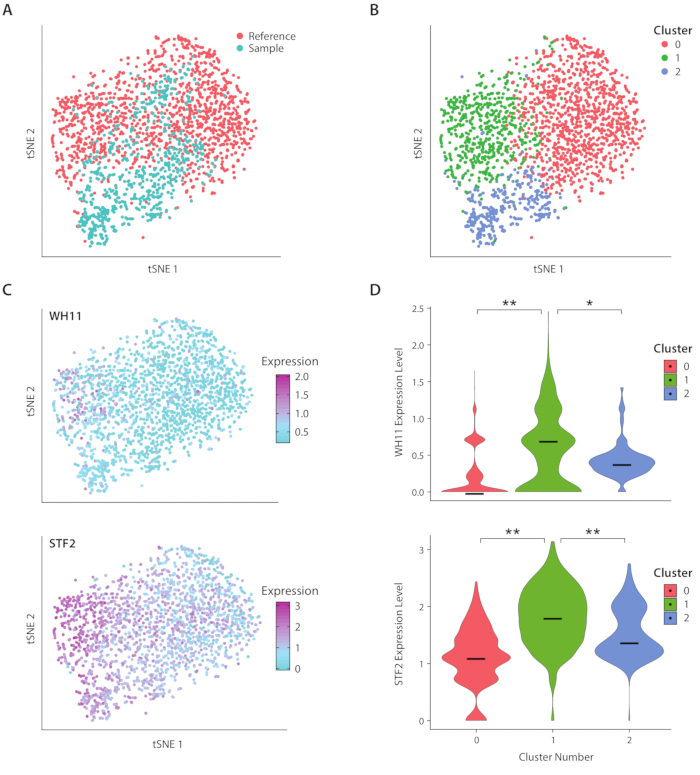
图4:白不透明开关响应分析。(A) 样本数据集的 tSNE 图与 Liu17中的参考数据集结合使用。(B) 转录学的聚类揭示了在 tSNE 图上可视化的三个聚类。(C) 白不透明开关反应中涉及的关键基因通过主要成分分析确定,导致变异。(D) 通过 tSNE 绘图上标记的群集,将 YFP 和 WH11 的规范化表达水平的小提琴绘图。[表示 p <<< 0.05 和 * 表示 p << 0.05。请点击此处查看此图形的较大版本。
补充数字 1 和图 2.请点击这里下载这些污秽。
补充文件 1-3。请点击此处下载这些文件。
讨论
我们的异感酵母菌群RNA测序方法(ICO-seq)适应已发布的单细胞RNA测序平台Drop-Seq,用于工程酵母菌株的高通量筛选。酵母细胞含有不到10%的典型哺乳动物细胞的mRNA拷贝,并且有一个细胞壁,需要在mRNA捕获16之前降解。这两个因素排除了酵母直接应用于滴-Seq或其他基于滴滴的scRNA-seq平台。为了解决这些问题,我们将单个细胞封装在水凝胶内,并将其培养成菌落,为RNA测序提供足够的输入材料,并在水解和mRNA捕获之前消化酵母细胞壁以产生球蛋白。与原始 Drop-Seq 工作流相比,这些更改增加了 ICO-seq 工作流的额外复杂性,是用户必须确保顺利进行的关键步骤。
将单个酵母细胞封装在琼脂水凝胶内,需要正确操作设备 A。必须正确计数输入酵母悬浮液,以尽量减少具有多个酵母细胞的水凝胶数量,同时确保足够的水凝胶包含单个细胞,以确保在mRNA捕获期间合理的细胞捕获效率。在微流体装置操作期间,琼脂凝胶混合物必须很好地溶解并通过注射器过滤器,以尽量减少设备堵塞的可能性。琼脂凝胶混合物是粘稠的,单通道分裂成八的区域特别容易堵塞。通过将高速摄像机居中以可视化设备该区域的设备操作,用户可以监控八个通道中每个通道中每个通道产生的液滴的均匀性,并在任何通道中的堵塞导致均匀性发生变化时快速做出反应。在显微镜下对少量收集的乳液进行检查,为确认高质量的乳液提供了辅助方法。
在水凝胶内酵母菌群生长后,为确保在单一菌体内提取优质mRNA,需要采取若干预防措施。优化酵母在水凝胶培养中的时间很重要,因为如果酵母在培养中离开太久,许多酵母将避开水凝胶的限制,导致RNA测序期间的背景信号较高,在细胞类型之间区分时灵敏度较低。使用Zymolyase正确生成球蛋白,确保mRNA在细胞接触溶酶缓冲液后被释放。继酶酶之后的酵母菌菌群的目视检查应产生更闪亮的酵母细胞。细胞壁消化不当会导致RNA捕获效率降低。最后,水凝胶在注入设备B时应紧密包装。 使用高速摄像机监测水凝胶输入,一旦水凝胶在输入到设备时不再紧密包装,则允许终止乳液收集,否则捕获效率就会受到影响。
我们方法的一个潜在问题是酵母的微凝胶培养可能显著改变基因表达。此前研究微凝胶和agar中的酵母基因表达的工作表明,基因表达平均值存在差异,但总体呈正相关17,不过对各种酵母菌株的进一步调查是谨慎的。该方法也具有有限的细胞捕获效率,由于随机加载mRNA捕获珠后,泊森统计14。目前约10%的滴液含有珠子和菌落,双封装率预计在1%以下。双封装导致在RNA-seq数据分析过程中混淆元素,其过滤仍然具有挑战性23;捕获率为 25% 将导致双倍封装相应增加到 5%(补充图 2)。虽然我们演示ICO-seq使用滴-seq平台,还有其他滴滴RNA-seq平台引入mRNA捕获珠确定,而不是统计,如商业上可用的10倍基因组铬平台15,24。15,将这些平台与 ICO-seq 集成,可以提高捕获效率,超越泊森统计数据所允许的范围。最后,滴滴RNA-seq的一个基本限制是测序后无法恢复感兴趣的细胞。在考虑使用此方法分析酵母库的类型时,应考虑此限制。
细胞对细胞异质性已被证明在克隆水平微生物,如大肠杆菌25和S。cerevisiae26揭示新的细胞指出,大容量级分析否则会掩盖。对C.白化体进行的体积RNA-seq分析倾向于观察全种群转录血转录的变化,或者将白色和不透明细胞作为两个独立的种群27、28。,28ICO-seq的应用可能导致发现更多的子状态,并为发现其他酵母物种中的新细胞状态提供一个分析框架。然而,水凝胶内细胞的生长并不仅限于酵母:其他细胞类型,如哺乳动物、细菌和其他真菌细胞也可以在水凝胶29、30,30内培养。异源菌落与单细胞的测序导致细胞间变异导致生物噪声平均消除,从而改善细胞类型之间的鉴别。这在分析遗传多样性以特定合成途径为核心的细胞时可能会有所帮助。细胞类型输入ICO-seq的可能性扩大,以及其与商用液滴RNA-seq平台的潜在集成,使ICO-seq成为在基因水平上解剖细胞异质性的有希望的平台。
披露声明
提交人声明没有利益冲突。
致谢
该项目得到了国家科学基金会职业奖DBI-1253293、国家卫生研究院新创新者奖DP2AR068129以及授予R01HG0008978、国家科学基金会技术中心授予DBI-1548297和UCSF细胞建设中心的支持。ARA和ZJG是陈-扎克伯格生物枢纽调查员。
材料
| Name | Company | Catalog Number | Comments |
| 0.22 um syringe filter | Milipore Sigma | SLGP033RS | |
| 0.5M EDTA, pH 8.0 | Thermo-Fisher | 15575020 | Used to make TE-TW buffer |
| 0.75 mm biopsy punch | World Precision Instruments | 504529 | |
| 1 mL syringes | BD | 309628 | |
| 1H,1H,2H-Perfluoro-1-Octanol (PFO) | Sigma-Aldrich | 370533 | |
| 1M Tris-HCI, pH 8.0 | Thermo-Fisher | 15568025 | Used to make TE-TW buffer |
| 27 gauge needles | BD | 305109 | |
| 3 mL syringes | BD | 309657 | |
| 3" silicon wafers, P type, virgin test grade | University Wafers | 447 | |
| 3D-printed centrifuge syringe holder | (custom) | (custom) | See Supplemental Files for 3D print file |
| Agarose, low gelling temperature | Sigma-Aldrich | a9414 | |
| Aquapel (hydrophobic glass treatment) | Pittsburgh Glass Works | 47100 | |
| Drop-Seq Beads | ChemGenes | MACOSKO-2011-10 | |
| Glass microscope slides (75 mm x 50 mm) | Corning | 294775X50 | |
| Ionic Krytox Surfactant | Synthesis instructions in ref 14. Can substitute with PEG-PFPE surfactant. | ||
| Isopropanol | Sigma-Aldrich | 109827 | |
| NaCl | Sigma-Aldrich | S9888 | |
| Novec 7500 | 3M | 98-0212-2928-5 | Commonly knowns as HFE 7500 |
| PBS | Fisher Scientific | BP243820 | |
| PE-2 polyethylene tubing | Scientific Commodities | B31695-PE/2 | |
| PEG-PFPE surfactant | Ran Biotechnologies | 008-FluoroSurfactant | |
| PGMEA developer | Sigma-Aldrich | 484431 | |
| Photomasks | CadArt Servcies | (custom) | See Supplemental Files for mask designs |
| Spin coater | Specialty Coating Systems | G3P-8 | |
| SSC Buffer | Sigma-Aldrich | S6639 | |
| SU-8 2100 | MicroChem | Y111075 | |
| SU-8 2150 | MicroChem | Y111077 | |
| Sylgard 184 silicone elastomer kit | Krayden | 4019862 | |
| Tween-20 | Sigma-Aldrich | P1379 | Used to make TE-TW buffer |
| YR Digestion buffer | Zymo Research | R1001-1 | Spheroplasting buffer |
| YR Lysis Buffer | Zymo Research | R1001-2 | |
| Zymolyase | Zymo Research | E1005 | Spheroplasting enzyme mixture |
参考文献
- Peralta-Yahya, P. P., Zhang, F., Del Cardayre, S. B., Keasling, J. D. Microbial engineering for the production of advanced biofuels. Nature. 488 (7411), 320-328 (2012).
- Curran, K. A., Alper, H. S. Expanding the chemical palate of cells by combining systems biology and metabolic engineering. Metabolic Engineering. 14 (4), 289-297 (2012).
- Botstein, D., Chervitz, S. A., Cherry, J. M. Yeast as a model organism. Science. 277 (5330), 1259-1260 (1997).
- Mager, W. H., Winderickx, J. Yeast as a model for medical and medicinal research. Trends in Pharmacological Sciences. 26 (5), 265-273 (2005).
- Krivoruchko, A., Siewers, V., Nielsen, J. Opportunities for yeast metabolic engineering: Lessons from synthetic biology. Biotechnology Journal. 6 (3), 262-276 (2011).
- Vanella, R., et al. Yeast-based assays for screening 11β-HSD1 inhibitors. Microbial Cell Factories. 15 (1), (2016).
- Zhuang, X., Chappell, J. Building terpene production platforms in yeast. Biotechnology and Bioengineering. 112 (9), 1854-1864 (2015).
- Agresti, J. J., et al. Ultrahigh-throughput screening in drop-based microfluidics for directed evolution. Proceedings of the National Academy of Sciences. 107 (9), 4004-4009 (2010).
- Wang, G., et al. RNAi expression tuning, microfluidic screening, and genome recombineering for improved protein production in Saccharomyces cerevisiae. Proceedings of the National Academy of Sciences. 116 (19), 9324-9332 (2019).
- Beneyton, T., et al. Droplet-based microfluidic high-throughput screening of heterologous enzymes secreted by the yeast Yarrowia lipolytica. Microbial Cell Factories. 16 (1), 18(2017).
- Sjostrom, S. L., et al. High-throughput screening for industrial enzyme production hosts by droplet microfluidics. Lab on a Chip. 14 (4), 806-813 (2014).
- Nadal-Ribelles, M., et al. Sensitive high-throughput single-cell RNA-seq reveals within-clonal transcript correlations in yeast populations. Nature Microbiology. 4 (4), 683-692 (2019).
- Gasch, A. P., et al. Single-cell RNA sequencing reveals intrinsic and extrinsic regulatory heterogeneity in yeast responding to stress. PLoS Biology. 15 (12), 2004050(2017).
- Macosko, E. Z., et al. Highly parallel genome-wide expression profiling of individual cells using nanoliter droplets. Cell. 161 (5), 1202-1214 (2015).
- Klein, A. M., et al. Droplet barcoding for single-cell transcriptomics applied to embryonic stem cells. Cell. 161 (5), 1187-1201 (2015).
- von der Haar, T. A quantitative estimation of the global translational activity in logarithmically growing yeast cells. BMC Systems Biology. 2, 87(2008).
- Liu, L., Dalal, C. K., Heineike, B. M., Abate, A. R. High throughput gene expression profiling of yeast colonies with microgel-culture Drop-seq. Lab on a Chip. 19 (10), 1838-1849 (2019).
- Fallah-Araghi, A., Baret, J. C., Ryckelynck, M., Griffiths, A. D. A completely in vitro ultrahigh-throughput droplet-based microfluidic screening system for protein engineering and directed evolution. Lab on a Chip. 12 (5), 882-891 (2012).
- Berman, J., Sudbery, P. E. Candida albicans: A molecular revolution built on lessons from budding yeast. Nature Reviews Genetics. 3 (12), 918-930 (2002).
- Srikantha, T., Soll, D. R. A white-specific gene in the white-opaque switching system of Candida albicans. Gene. 131 (1), 53-60 (1993).
- van der Maaten, L., Hinton, G. Visualizing data using t-SNE. Journal of Machine Learning Research. 9, 2579-2605 (2008).
- Sun, Y., et al. Deletion of a yci1 domain protein of Candida albicans allows homothallic mating in MTL heterozygous cells. mBio. 7 (2), 00465-00516 (2016).
- McGinnis, C. S., Murrow, L. M., Gartner, Z. J. DoubletFinder: Doublet Detection in Single-Cell RNA Sequencing Data Using Artificial Nearest Neighbors. Cell Systems. 8 (4), 329-337 (2019).
- Baran-Gale, J., Chandra, T., Kirschner, K. Experimental design for single-cell RNA sequencing. Briefings in Functional Genomics. 17 (4), 233-239 (2018).
- Silander, O. K., et al. A Genome-Wide Analysis of Promoter-Mediated Phenotypic Noise in Escherichia coli. PLoS Genetics. 8 (1), 1002443(2012).
- Newman, J. R. S., et al. Single-cell proteomic analysis of S. cerevisiae reveals the architecture of biological noise. Nature. 441 (7095), 840-846 (2006).
- Tuch, B. B., et al. The Transcriptomes of Two Heritable Cell Types Illuminate the Circuit Governing Their Differentiation. PLoS Genetics. 6 (8), 1001070(2010).
- Romo, J. A., et al. Global Transcriptomic Analysis of the Candida albicans Response to Treatment with a Novel Inhibitor of Filamentation. mSphere. 4 (5), 00620(2019).
- Huang, H., et al. Generation and manipulation of hydrogel microcapsules by droplet-based microfluidics for mammalian cell culture. Lab on a Chip. 17 (11), 1913-1932 (2017).
- Lin, X., Nishio, K., Konno, T., Ishihara, K. The effect of the encapsulation of bacteria in redox phospholipid polymer hydrogels on electron transfer efficiency in living cell-based devices. Biomaterials. 33 (33), 8221-8227 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。