Method Article
أساليب موحدة لقياس التعريفي من استجابة الصدمة الحرارية في الكينورهابيتس elegans
In This Article
Summary
هنا، يتم تقديم بروتوكولات موحدة لتقييم تحريض استجابة الصدمة الحرارية (HSR) في الكينورهاب elegans باستخدام RT-qPCR على المستوى الجزيئي، المراسلين الفلورسنت على المستوى الخلوي، و ثيرمورcovery على مستوى الكائنات الحية.
Abstract
استجابة الصدمة الحرارية (HSR) هي استجابة الإجهاد الخلوية الناجمة عن التطويع الخاطئ للبروتين الخلوي الذي يعمل على استعادة التوازن البروتيني القابل للطي ، أو البروتيوستاسيس. يحتل اليجانز Caenorhabditis مكانة فريدة وقوية لأبحاث HSR لأنه يمكن تقييم HSR على المستويات الجزيئية والخلوية والكائنات الحية. ولذلك، يمكن تصور التغيرات على المستوى الجزيئي على المستوى الخلوي ويمكن أن تكون آثارها على علم وظائف الأعضاء كمية على مستوى الكائنات الحية. في حين أن عمليات القياس لقياس HSR واضحة ، فإن الاختلافات في التوقيت ودرجة الحرارة والمنهجية الموصوفة في المؤلفات تجعل من الصعب مقارنة النتائج عبر الدراسات. وعلاوة على ذلك، فإن هذه القضايا تشكل حاجزاً أمام أي شخص يسعى إلى دمج تحليل HSR في أبحاثه. هنا، يتم عرض سلسلة من البروتوكولات لقياس التعريفي HSR بطريقة قوية وقابلة للتكرار مع RT-qPCR، والمراسلين الفلورسنت، ومقايسة ثيرموروري كائن حي. بالإضافة إلى ذلك، نُظهر أن فحص الحرارة المستخدم على نطاق واسع لا يعتمد على المنظم الرئيسي الراسخ لـ HSR، HSF-1، وبالتالي لا ينبغي استخدامه في أبحاث HSR. وأخيراً، تناقش الاختلافات في هذه المقايسات الموجودة في المؤلفات وتقترح أفضل الممارسات للمساعدة في توحيد النتائج في جميع أنحاء الميدان، مما يسهل في نهاية المطاف الأمراض العصبية، والشيخوخة، والبحوث HSR.
Introduction
استجابة الصدمة الحرارية (HSR) هي استجابة عالمية للإجهاد الخلوي الناجم عن التطيّع الخاطئ للبروتين الخلوي الناجم عن زيادة درجات الحرارة والضغوط الأخرى المسببة للبروتين. يؤدي تنشيط HSR في Caenorhabditis elegans إلى النسخ إلى أعلى من جينات الصدمة الحرارية مثل hsp-70 و hsp-16.2. تعمل العديد من بروتينات الصدمات الحرارية (HSPs) كمرافقين جزيئيين يستعيدون التوازن القابل للطي للبروتين ، أو البروتيوستاسيس ، من خلال التفاعل المباشر مع البروتينات المُطَوَّلة أو التالفة. المنظم الرئيسي للHSR هو عامل النسخ الحرارة صدمة عامل 1 (HSF-1)، الذي يتم التحكم في تفعيل بأناقة عن طريق آليات متعددة1.
لا يقتصر دور HSF-1 على الإجهاد. HSF-1 مطلوب للنمو والتطور الطبيعي، حيث يؤدي حذف hsf-1 إلى اعتقالاليرقات 2. HSF-1 مهم أيضا خلال الشيخوخة والأمراض العصبية المرتبطة بالعمر التي تتميز بتراكم البروتينات المجاميع وعدم القدرة على الحفاظ على البروتيوستاسيس. الضربة القاضية من hsf-1 يسبب تراكم المجاميع البروتين وعمر تقصير، في حين أن overexpression من hsf-1 يقلل من تجميع البروتين ويطيل عمر3،4. ولذلك، فإن تنظيم النظام HSF-1 على المستوى الجزيئي له آثار واسعة النطاق على فسيولوجيا الكائنات الحية والمرض.
C. elegans هو كائن حي نموذج قوي لبحوث HSR لأن HSR يمكن قياسها في المستويات الجزيئية والخلوية والكائنات الحية4,5,6. تسليط الضوء على قوة هذا النموذج، تم اكتشاف التطورات الرئيسية في تحديد مسار HSR، مثل الاختلافات الخاصة بالأنسجة في تنظيم HSR، في C. elegans7،8. وعلاوة على ذلك، يستخدم على نطاق واسع C. elegans لأبحاث الشيخوخة وهو نظام ناشئ النمذجة الأمراض المرتبطة اضطراب البروتيوستاسيس.
على الرغم من أن تجارب الصدمة الحرارية مع C. elegans يمكن أن تكون سريعة وقابلة للتكرار ، هناك العديد من الأسئلة التي يجب مراعاتها قبل البدء. على سبيل المثال، ما هي درجة الحرارة التي ينبغي استخدامها للتحريض على HSR وإلى متى ينبغي أن تتعرض الديدان؟ هل من الأفضل استخدام حاضنة جافة أو حمام مائي؟ ما هي المرحلة التطويرية التي ينبغي استخدامها؟ لسوء الحظ، تختلف المنهجيات المستخدمة في دراسة HSR بشكل كبير من مختبر إلى مختبر، مما يسبب الارتباك عند اختيار أفضل المنهجيات ويجعل من الصعب مقارنة النتائج عبر الميدان.
نقدم بروتوكولات قوية وموحدة لاستخدام RT-qPCR، ومراسلي الفلورسنت، وثيرموروريتي لقياس HSR. وفي حين أن هذه النهج الثلاثة يكمل بعضها بعضا، فإن لكل منها مزايا وعيوبا فريدة. على سبيل المثال، RT-qPCR هو القياس الأكثر مباشرة والكمية من HSR، ويمكن بسهولة توسيع هذا الفحص لتشمل العديد من الجينات المختلفة للصدمات الحرارية غير القابلة للاختزال. ومع ذلك، RT-qPCR هو أغلى، يمكن أن يكون صعبا من الناحية الفنية، ويتطلب استخدام المعدات المتخصصة. وعلى النقيض من ذلك، يتمتع المراسلون الفلورسنت بميزة قياس الاختلافات الخاصة بالأنسجة في تحريض HSR. ومع ذلك ، من الصعب أن quantitate بدقة ، يمكن قياس الاستقراء فقط فوق عتبة معينة ، وتتطلب استخدام مجهر الفلوريسنس. بالإضافة إلى ذلك ، فإن سلالات المراسل الموصوفة هنا تتأخر تطورًا مقارنة بسلالة N2 القياسية. على الرغم من أن أحدث مراسل سلالات تحتوي على transgenes نسخة واحدة متوفرة، لم يتم اختبارها هنا9. التشايس الثالث، thermorecovery، لديه ميزة توفير قراءات ذات الصلة من الناحية الفسيولوجية على مستوى الكائنات الحية. ومع ذلك، يمكن القول إن هذا الفحص هو الأقل حساسية والأكثر غير مباشر. وأخيراً، نناقش بعض الاختلافات الشائعة الموجودة في هذه المقايسات ونقترح مجموعة من أفضل الممارسات لتسهيل البحث في هذا المجال.
Protocol
1. صيانة وتزامن من C. elegans
- الحفاظ على الديدان في 20 درجة مئوية على نمو النعمة متوسطة (NGM) لوحات بذر مع البكتيريا القولونية OP50 Escherichia عن طريق نقل العديد من البالغين إلى لوحات جديدة حوالي 2x في الأسبوع10. وينبغي توخي الحذر لمنع الديدان من نفاد الطعام، لأن هذا يمكن أن يؤثر على علم وظائف الأعضاء11.
- إعداد لوحات NGM.
- مزيج 3 غرام من NaCl, 2.5 غرام من Bacto-peptone, 20 غرام من أجار, و deionized (DI) H2O تصل إلى 1 لتر في قارورة.
- اتوماتيف الخليط للتعقيم.
- السماح للخليط لتبرد إلى ~ 50 درجة مئوية.
- إضافة 25 مل من 1 م KH2PO4 (pH = 6), 1 مل من 1 م CaCl2,1 مل من 1 م مغسو4,و 1 مل من الكوليسترول (5 ملغم / مل في 100% الإيثانول).
- باستخدام تقنية معقمة، صب الخليط في لوحات 6 سم لتسفر عن ما يقرب من 100 لوحات. صب لوحات أسهل إذا تم نقل الخليط لأول مرة إلى 300 مل من القارص المعقمة.
- السماح لمدة 1 يوم لترسيخ في درجة حرارة الغرفة (RT) قبل البذر مع البكتيريا أو تخزين في 4 درجة مئوية.
- بذر البكتيريا OP50 على لوحات NGM.
- تنمو المشبعة بين عشية وضحاها OP50 الثقافة البكتيرية في LB في 30 درجة مئوية أو 37 درجة مئوية.
- ضع ما يقرب من 300 ميكرولتر من الثقافة على مركز لوحة NGM 6 سم.
- السماح لوحات الجافة في RT لمدة 1-3 أيام حسب الحاجة للحديقة البكتيرية للتمسك لوحة. ويمكن بعد ذلك استخدام اللوحات أو تخزينها عند 4 درجات مئوية.
- إعداد لوحات NGM.
- تنمو الديدان بشكل متزامن إما عن طريق عزل البيض وضعت حديثا (وصفها هنا) أو بدلا من ذلك عن طريق جمع البيض بعد حل الديدان مع التبييض.
- نقل ما يقرب من 10 الديدان الكبار gravid إلى لوحة جديدة باستخدام قطف الأسلاك البلاتينية. تزامن البيض وضع يعمل بشكل أفضل إذا كان الكبار في اليوم الأول من مرحلة البلوغ.
- بعد حوالي 1 ساعة، وإزالة الديدان من لوحة. وينبغي أن يؤدي هذا إلى 40-60 بيضة في لوحة، اعتمادا على الظروف والإجهاد.
2. التصوير الفلوري لمراسلي HSR
- مزامنة الديدان (القسم 1.2) والحفاظ على 20 درجة مئوية حتى مرحلة النمو المرجوة. ل AM446(hsp-70p::gfp)وCL2070(hsp-16.2p::gfp)سلالات مراسل الفلورسنت، يتم إنشاء الديدان الكبار الشباب التي لم تصل بعد مرحلة النضج الإنجابية 64 ساعة بعد تزامن وضع البيض.
ملاحظة: يختلف توقيت النمو باختلاف كل سلالة ودرجة الحرارة التي يتم بها رفع الديدان. كل من سلالات مراسل HSR تظهر تأخير طفيف في النمو بالنسبة لN2. الأهم من ذلك، فإن حجم التعريفي HSR ينخفض حوالي 2-4x بعد بداية النضج الإنجابي (انظر المناقشة). - الحرارة صدمة الديدان عن طريق التفاف لوحات مع فيلم البارافين وغمرها في حمام الماء المتداولة في 33 درجة مئوية لمدة 1 ساعة. وينبغي أن يكون شريط رقيقة من فيلم البارافين ملفوفة 2x حول لوحة لختم حواف. لا تغطي الجزء السفلي من لوحة أو أنها يمكن أن تتداخل مع نقل الحرارة. غمر الأطباق رأسًا على عقب باستخدام رف أنبوب الاختبار والوزن الرصاصي. تذكر أن تشمل عينة التحكم السلبي (لا صدمة حرارية) إذا لزم الأمر.
ملاحظة: إذا لم يكن فيلم البارافين آمنًا، فسيدخل الماء اللوحة ولا يجب استخدام اللوحة لجمع البيانات. - استعادة الديدان عن طريق إزالة لوحات من حمام الماء والتجفيف مع منشفة ورقية. إزالة فيلم البارافين واحتضان الديدان في 20 درجة مئوية لمدة 6-24 ساعة. فترة النقاهة هذه تسمح بوقت كاف لتركيب GFP و قابل للطي قبل التصوير.
- إعداد الشرائح للتصوير. يجب إعداد الشرائح طازجة لكل استخدام.
- جعل 3٪ agarose حل في الماء والحرارة باستخدام الميكروويف حتى يتم حل agarose.
- ضع شريحة مجهرية للتصوير بين شقين مجهرين آخرين يحتويان على شريط من شريط المختبر لإنشاء مفتاح لمنصة agarose.
- باستخدام ماصة 1000 ميكرولتر، ضع قطرة (~ 150 ميكرولتر) من أغاروز 3٪ ساخنة في وسط شريحة المجهر.
- تغطية على الفور شريحة المجهر مع شريحة المجهر فارغة عمودي على الشريحة الأولى بحيث الشريحة العلوية تقع على شريط المختبر على الشرائح المجاورة. هذا ينتشر خارج قطرة agarose لإنشاء لوحة من العرض الموحد.
- قم بإزالة الشريحة العلوية بعناية.
- قم بشل حركة الديدان باستخدام ماصة 200 ميكرولتر لإضافة قطرة صغيرة (~ 5 ميكرولتر) من levamisole 1 mM في M9 العازلة إلى مركز لوحة agarose. ثم نقل 10 الديدان في قطرة من levamisole باستخدام قطف الأسلاك البلاتينية. تغطية مع غطاء. ختم غطاء ليس ضروريًا للمجهر المستقيم. اختياريا، يمكن محاذاة الديدان عندما تصبح مشلولة عن طريق نشر levamisole قبالة، إلى خارج لوحة agarose، ومحاذاة الديدان مع اختيار الأسلاك البلاتينية. بدلا من ذلك، يمكن نقع ليفاميسول حتى باستخدام مسح المختبر.
ملاحظة: الصورة في أقرب وقت ممكن، لأن الحضانة المطولة في ليفاميزول يمكن أن تغير الفلوريسنس. - صورة الديدان باستخدام المجهر المفلور. تختلف تفاصيل التقاط الصور حسب المجهر والبرمجيات.
ملاحظة: لمقارنة كثافة الصورة بشكل مباشر، استخدم إعدادات المجهر المتطابقة في جلسة تصوير واحدة. تجنب الإفراط في التصوير.
3. قياس التعبير الجيني HSR باستخدام RT-qPCR
- تزامن الديدان (القسم 1.2) والحفاظ على 20 درجة مئوية حتى مرحلة النمو المطلوب. بالنسبة للدودة N2، يتم إنشاء الديدان البالغة الشابة التي لم تصل بعد إلى مرحلة النضج الإنجابي 60 ساعة بعد تزامن وضع البيض.
ملاحظة: يختلف توقيت النمو باختلاف كل سلالة ودرجة الحرارة التي يتم بها رفع الديدان. الأهم من ذلك، فإن حجم التعريفي HSR ينخفض حوالي 2-4x بعد بداية النضج الإنجابي (انظر المناقشة). - الديدان صدمة الحرارة كما هو موضح في الخطوة 2.2.
- تأخذ لوحات من حمام الماء، وإزالة فيلم البارافين، وعلى الفور جمع الديدان. يمكن جمع الديدان عن طريق غسل الأطباق بلطف مع 1 مل من M9، وجمع السائل في أنبوب microcentruge، ومن ثم إزالة M9 بعد الطرد المركزي في 400 × ز لمدة 1 دقيقة.
- lyse الديدان وتنقية الحمض النووي الريبي باستخدام استخراج العضوية.
- إضافة 250 ميكرولتر من كاشف العزلة RNA (انظر جدول المواد).
- أنابيب دوامة باليد لمدة 30 ثانية.
- أنابيب دوامة لمدة 20 دقيقة في 4 درجة مئوية باستخدام مرفق أنبوب microcentrifuge (انظر جدول المواد).
- إضافة 50 ميكرولتر من الكلوروفورم.
- دوامة لمدة 30 s.
- احتضان العينات في RT لمدة 3 دقائق.
- أجهزة الطرد المركزي في ≥ 14،000 س ز لمدة 15 دقيقة في 4 درجة مئوية.
- نقل طبقة مائي (أي، الطبقة العليا، ~ 125 ميكرولتر) إلى أنبوب جديد microcentrifuge.
ملاحظة: تجنب الطبقة العضوية والمواد في الواجهة. - إضافة 50 ميكرولتر من الكلوروفورم.
- دوامة لمدة 30 s.
- احتضان العينات في RT لمدة 3 دقائق.
- أجهزة الطرد المركزي في ≥ 14،000 س ز لمدة 5 دقائق في 4 درجة مئوية.
- نقل طبقة مائي (~ 100 ميكرولتر) إلى أنبوب جديد microcentrifuge.
ملاحظة: تجنب الطبقة العضوية والمواد في الواجهة. - يُرَكّب RNA بحجم مساوٍ (أي 100 ميكرولتر) من الأيزوبروبانول.
- احتضان في -20 درجة مئوية لمدة 30 دقيقة على الأقل، ولكن يفضل أن يكون بين عشية وضحاها.
ملاحظة: يمكن إيقاف التجربة مؤقتًا هنا ويمكن تخزين الحمض النووي الريبي عند -20 درجة مئوية. - بيليه الجيش الملكي النيبالي عن طريق الطرد المركزي في ≥ 14،000 س ز ل ≥ 30 دقيقة في 4 درجة مئوية.
- إزالة أكبر قدر من افرات ممكن دون إزعاج بيليه.
ملاحظة: سوف بيليه تكون صغيرة وقد لا تكون مرئية. قد لا تلتزم بيليه بإحكام إلى جانب الأنبوب ، لذلك يجب توخي الحذر لتجنب إزاحته. - غسل بيليه مع 250 ميكرولتر من 70٪ الإيثانول الجليد الباردة المصنوعة من RNase خالية H2O.
- أجهزة الطرد المركزي في ≥ 14،000 س ز ل ≥ 5 دقيقة في 4 درجة مئوية.
- إزالة أكبر قدر ممكن من اللقلق دون إزعاج بيليه.
- أداء تدور سريعة في RT لإزالة أي ما تبقى من الإيثانول 70٪.
- تجفيف بيليه عن طريق ترك الأنابيب مفتوحة في RT طالما الحاجة; عادة ما لا يقل عن 20 دقيقة. يمكن تغطية أنابيب مع الأنسجة خالية من الوبر أو رقائق الألومنيوم لمنع التلوث.
- Resuspend بيليه في 20 ميكرولتر من RNase خالية H2O.
- تحديد تركيز الحمض النووي الريبي باستخدام مقياس طيفي صغير الحجم (2 ميكرولتر).
ملاحظة: يمكن إيقاف التجربة مؤقتًا هنا ويمكن تخزين الحمض النووي الريبي مؤقتًا عند -20 درجة مئوية أو أقل.
- إزالة الحمض النووي المتبقي عن طريق احتضان مع DNase I. من المستحسن استخدام مجموعة متوفرة تجاريا (انظر جدول المواد)واتباع تعليمات الشركة المصنعة.
- مع هذه المجموعة، وإعداد 20 ميكرول مع 500 نانوغرام من الجيش الملكي النيبالي و 1 ميكرولتر من DNase I في حمام الماء 37 درجة مئوية لمدة 30 دقيقة.
- إضافة 2.5 μL من كاشف التنشيط DNase (المدرجة في عدة) إلى كل عينة واحتضان في RT لمدة 5 دقائق مع الخفقان / دوامة عرضية.
- تدور أسفل في 14،000 س ز لمدة 2 دقيقة.
- دون إزعاج بيليه الأبيض، نقل 15 ميكرولتر من سوبرناتانت إلى ميكروتيوب جديد لتوليف cDNA.
- إجراء توليف cDNA. من المستحسن استخدام مجموعة متوفرة تجاريا (انظر جدول المواد)واتباع تعليمات الشركة المصنعة.
- مع عدة، وإعداد 20 μL التفاعل مع 15 ميكرولتر من رنا دنا I-تعامل من الخطوة السابقة و 1 μL من النسخ العكسي.
- استخدام البرنامج التالي لتوليف cDNA: 25 درجة مئوية لمدة 5 دقائق، 46 درجة مئوية لمدة 20 دقيقة، 95 درجة مئوية لمدة 1 دقيقة، 4 ° C عقد.
- تخفيف cDNA عن طريق إضافة 80 ميكرولتر من RNase خالية H2O مباشرة إلى العينة.
- دوامة لفترة وجيزة، ثم تدور أسفل وتخزينها في -20 درجة مئوية حتى الحاجة.
- تنفيذ qPCR. من المستحسن استخدام مجموعة متوفرة تجاريا (انظر جدول المواد)واتباع تعليمات الشركة المصنعة.
- مع مجموعة، وإعداد 25 μL التفاعل التي تحتوي على 2 ميكرولتر من cDNA و 200 nM (كل) من التمهيديات إلى الأمام وعكس في بئر واحد من 96 جيدا لوحة.
- يتم سرد تسلسل التمهيدي لقياس الجينات صدمة الحرارة، hsp-70 وhsp-16.2، و 18S rRNA (لمراقبة التطبيع) في جدول المواد. يمكن استخدام عناصر تحكم التهيئة المتعددة حسب الرغبة.
- تخفيف عينات cDNA 50x قبل قياس 18S للتأكد من أن المقايسة في النطاق الخطي. تختلف شروط qPCR المناسبة مع مجموعة الأدوات وال التمهيديات المستخدمة (انظر نتائج التمثيل).
- استخدم نظام الكشف PCR في الوقت الحقيقي (انظر جدول المواد)لـ qPCR مع 40 دورة من 95 درجة مئوية ل5 تيناترين، 58 درجة مئوية لمدة 30 s الوَلَد، و 72 درجة مئوية لامتداد 30 s.
ملاحظة: يمكن أن تختلف درجات الحرارة المثلى للحنين حسب البهاء والظروف. - قياس باستخدام إما ΔCt أو أسلوب منحنى قياسي12.
4. الندرمورcovery المقايسة لقياس HSR على مستوى الكائنات الحية
- مزامنة الديدان (القسم 1.2) والحفاظ على 20 درجة مئوية حتى مرحلة النمو المرجوة. بالنسبة للدودة N2، يتم إنشاء الديدان البالغة الشابة التي لم تصل بعد إلى مرحلة النضج الإنجابي 60 ساعة بعد تزامن وضع البيض.
ملاحظة: يختلف توقيت النمو باختلاف كل سلالة ودرجة الحرارة التي يتم بها رفع الديدان. الأهم من ذلك، فإن حجم التعريفي HSR ينخفض حوالي 2-4x بعد بداية النضج الإنجابي (انظر المناقشة). - الحرارة صدمة الديدان كما هو موضح في الخطوة 2.2 ل 6 ح.
- إزالة لوحات من حمام الماء، وإزالة فيلم البارافين، والسماح للدودة لاسترداد عن طريق الحضانة في 20 درجة مئوية لمدة 48 ساعة.
- عد عدد الديدان التي يمكن أن تزحف على الفور بعد التحفيز الميكانيكي دون حركة متشنجة أو شلل.
ملاحظة: حضانة 6 ح هو الأمثل لفحص الظروف التي تقلل من 30000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000
النتائج
باستخدام البروتوكولات الموصوفة في هذه المخطوطة، تم قياس تعريف HSR باستخدام المراسلين الفلورسنت، RT-qPCR، ومقاسات التمور. وفي كل حالة، استُخدم الإجراء الوارد في القسم 1-2 لتوليد الديدان الشابة الصغيرة المتزامنة التي لم تبلغ مرحلة النضج الإنجابي.
لتصور التعريفي HSR على المستوى الخلوي، AM446(hsp-70p::gfp)وCL2070(hsp-16.2p::gfp)تم تحليل سلالات مراسل الفلورسنت بعد القسم 2 من البروتوكول. في عينات التحكم السلبي دون صدمة الحرارة، مراسل hsp-16.2 أظهرت فقط autofluorescence العادي، ولكن مراسل HSP-70 كان الفلورينسي التأسيسية في عضلة المثبط الشرج كما ذكرت سابقا4 (الشكل 1A). بعد 1 ساعة من صدمة الحرارة في 33 درجة مئوية، لوحظ التألق القوي في كلا الصحفيين. ومع ذلك، كان نمط التعبير متميزاً اعتماداً على أي المراسلات كان يستخدم(الشكل 1ب). وكان مراسل HSP-70 ألمع في الأمعاء والحيوانات المنوية، في حين أن مراسل Hsp-16.2 كان ألمع في البلعوم. بالإضافة إلى ذلك ، كان مراسل Hsp-16.2 درجة عالية من الدودة إلى الديدان في كمية الحث كما هو موضح سابقًا ، ولكن مراسل Hsp-70 لميكن 13.
وهناك تباين شائع الاستخدام من القسم 2 هو أداء صدمة الحرارة في حاضنة جافة بدلا من حمام المياه المتداولة. ولذلك، تم أيضا اختبار الفرق بين المنهجيتين. ووجد أن كلا البروتوكولين أسفرا عن تحريض قوي من اثنين من المراسلين الفلورسنت باستخدام شروطنا، على الرغم من أن حمام المياه المتداولة ينصح بها كأفضل الممارسات (انظر المناقشة) (الشكل 1باء).
لاختبار اعتماد المراسلين على عامل النسخ HSF-1 ، تم استخدام تغذية RNAi لضرب Hsf-1 قبل قياس التعريفي الصحفي. ووجد أن الفلور من كل من سلالات خفضت بشدة على HSF-1 الضربة القاضية، مشيرا إلى أن هؤلاء المراسلين هم HSF-1 تعتمد على النحو المبين في الأدب4 (الشكل 2). ومع ذلك ، لوحظ أيضا أن الفلورية البلعوم استمرت في كل من المراسلين على hsf-1 الضربة القاضية ، وهو ما يتفق مع التقارير السابقة التي تكون العضلات البلعوم مقاومة لRNAi عن طريق تغذية14.
وكميات الحث دودة كاملة من HSR على المستوى الجزيئي، تم قياس اثنين من HSPs الذاتية مع RT-qPCR باستخدام القسم 3 من البروتوكول. تم قياس العينات في ثلاث ة، تم إنشاء منحنى قياسي لكل من التمهيدي، وتم تحليل منحنى الذوبان لكل عينة لمراقبة الجودة. ووجد أن 33 درجة مئوية صدمة الحرارة ل 1 ح أدى إلى أكثر من 2000x زيادة في التعبير النسبي عن اثنين من الجينات صدمة الحرارة، hsp-70 وhsp-16.2 (الشكل 3). وتبين هذه النتائج أن كلا الجينات الذاتية هي مناسبة لقياس التعريفي HSR وأن 33 درجة مئوية صدمة الحرارة ل 1 ح كافية لتوليد استجابة كبيرة. ومع ذلك، ينبغي استخدام الحذر في تفسير درجة الحرارة المطلقة من الصدمة التعريفي، لأن مستويات مرنا في غياب صدمة الحرارة منخفضة جدا.
لتحليل استجابة فسيولوجية لصدمة الحرارة، تم اختبار فحص جريموري كائني باستخدام القسم 4 من البروتوكول. ووجد أن تعرض الديدان لصدمة حرارية 6 ح عند 33 درجة مئوية أدى إلى انخفاض بنسبة 20٪ في الديدان مع حركة طبيعية بعد استعادة 48 ساعة(الشكل 4A). تم اختبار الاعتماد على هذا الفحص على عامل النسخ HSF-1 باستخدام تغذية RNAi لضربة قاضية hsf-1 قبل تعريض الديدان للإجهاد. ووجد أن الضربة القاضية من hsf-1 تسبب في انخفاض كبير في الحركة العادية، مع > 95٪ من الديدان التي تظهر حركة متشنج أو الشلل بعد حثها مع اختيار الأسلاك البلاتينية.
قارنا هذا الفحص الحراري إلى مقايسة كائنية بديلة مستخدمة على نطاق واسع يشار إليها عادة باسم ترموتلرانس. في اختبار الحرارة، تتعرض الديدان إلى درجة حرارة مستمرة 35 درجة مئوية باستخدام حاضنة جافة، ويتم قياس النسبة المئوية للدود على قيد الحياة في نقاط زمنية مختلفة. وباستخدام هذا الفحص، تبين أن الديدان التي تتعرض باستمرار لـ 35 درجة مئوية قد ماتت بعد حوالي 8 ساعات من التعرض(الشكل 4B). ومع ذلك، عندما تم اختبار الاعتماد على هذا الفحص على HSF-1 باستخدام الضربة القاضية RNAi، وجد أن تثبيط hsf-1 لا يسبب انخفاضا في الحرارة. وقد سبق أن ظهرت نتائج مماثلة باستخدام طفرات HSF-1 (انظر المناقشة). ولذلك، لا ينصح باستخدام المقايسة الحرارية لقياس HSR، وthrmorecovery هو الأسلوب المفضل لفحص HSR على مستوى الكائنات الحية.

الشكل 1: قياس التعريف HSR مع المراسلين الفلورسنت. (أ)وbasal و (B) حرارة غير قابلة للتسامي التعبير عن hsp-70p :: gfp وhsp-16.2p:: gfp مراسل سلالات بعد 1 ساعة من صدمة الحرارة في 33 درجة مئوية في حمام مائي أو حاضنة. تم رفع الديدان على بكتيريا OP50 لمدة 64 ساعة ، وصدمت الحرارة ، ثم تعافت عند 20 درجة مئوية لمدة 8 ساعات قبل التصوير. للرجوع إليها، لم الحرارة صدمة الديدان في (A) تم إعادة تنسيقها في (B) لتتناسب مع مدى وتشبع الديدان صدمت الحرارة. يتم عرض صور تمثيلية من نسختين تجريبيتين. شريط مقياس = 250 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
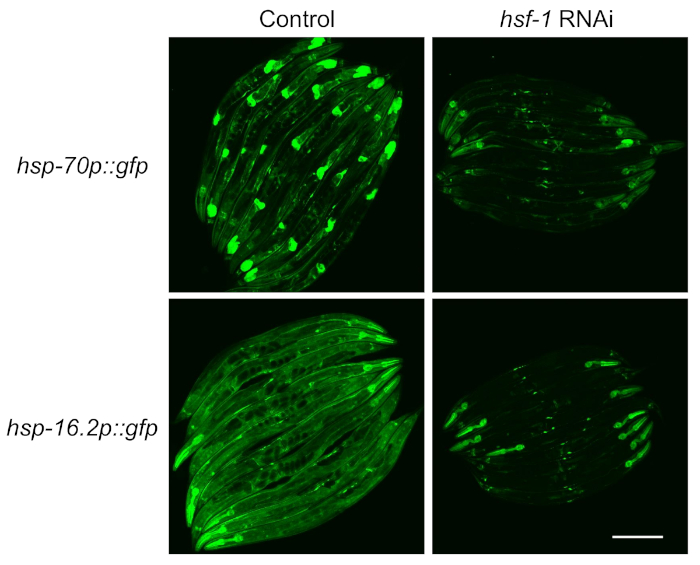
الشكل 2: يعتمد التعريف التعريفي HSR مقاساً مع المراسلين الفلوريين على HSF-1. سلالات تحتوي على hsp-70p::gfp وhsp-16.2p::gfp تم رفع مراسلي على السيطرة (L4440 ناقلات فارغة) أو لوحات HSF-1 RNAi لمدة 64 ساعة، وتعرض لصدمة حرارية 1 ساعة في 33 درجة مئوية في حمام مائي، ثم تعافى في 20 درجة مئوية لمدة 8 ساعات قبل التصوير. يتم عرض صور تمثيلية من نسختين تجريبيتين. شريط مقياس = 250 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
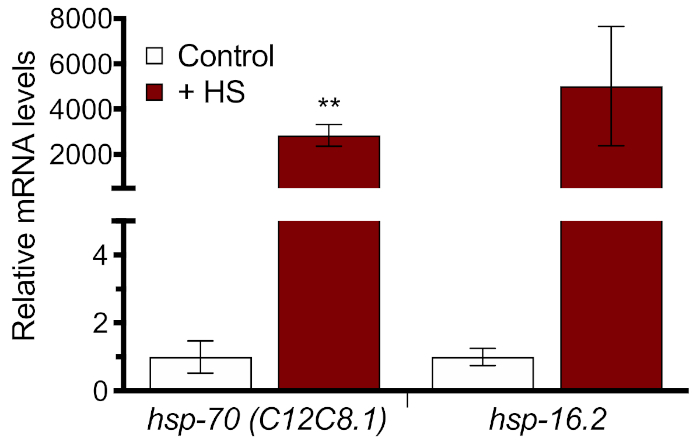
الشكل 3: قياس التعريفي HSR مع RT-qPCR. تم رفع الديدان N2 على بكتيريا HT115 لمدة 60 ساعة ثم صدمت الحرارة لمدة 1 ساعة في حمام مائي 33 درجة مئوية. يتم عرض مستويات الـ mRNA النسبية من hsp-70 (C12C8.1) و hsp-16.2 تطبيعها إلى عدم التحكم في الصدمات الحرارية. القيم المرسومة هي متوسط أربعة نسخ متماثلة بيولوجية وتمثل شرائط الخطأ ± SEM. تم حساب الأهمية الإحصائية باستخدام اختبار t-test لطالب غير مُزَدَد. **p < 0.01. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
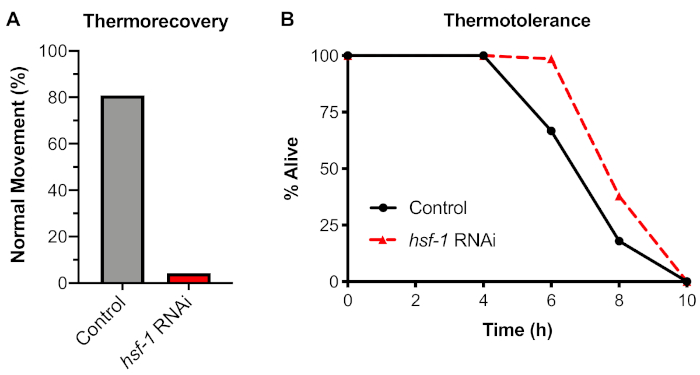
الشكل 4: Thermorecovery، ولكن ليس thermotolerance، يعتمد على HSF-1. تم رفع ديدان N2 على السيطرة (L4440) أو لوحات RNAi Hsf-1 لمدة 60 ساعة ثم تحولت إلى إما: (A) حمام مائي 33 درجة مئوية لمدة 6 ساعات واستعادة في 20 درجة مئوية لمدة 48 ساعة قبل أن يسجل للحركة الطبيعية (thermorecovery) ، أو (B) حاضنة جافة 35 درجة مئوية وإزالة كل 2 ساعة حتى حرارة ميتة ( حرارية ميتة). وقد تم كل إجراء مع ن ≥ 30 الأفراد في 2 أيام مستقلة. يتم عرض المتوسط. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
في الأدب مجموعة واسعة من درجات الحرارة، والأوقات، والمعدات وقد استخدمت لمقارنه HSR، والتي أدخلت المحاذير لا لزوم لها، وأدت إلى صعوبة في مقارنة النتائج بين المختبرات. على سبيل المثال، استخدمت درجات الحرارة التي تتراوح بين 32-37 درجة مئوية والأوقات من 15 دقيقة إلى عدة ساعات للحث على HSR15. ومع ذلك، أفيد أن الفتك يحدث في وقت مبكر من 3 ح في 37 درجة مئوية لجميع المراحل و 1.5 ساعة لليوم 1 الكبار15. وعلاوة على ذلك، فإننا نظهر أن التعرض للدود إلى 35 درجة مئوية يسبب الفتك الذي لا يعتمد HSF-1، مما يجعل هذه الظروف غير مناسبة لتحليل HSR. في المقابل، صدمة حرارية من 33 درجة مئوية لمدة 1 ساعة قوية بما يكفي لإثارة تحريض قوي من الجينات صدمة الحرارة، ومع ذلك خفيفة بما يكفي لعدم التأثير على قابلية بقاء الدودة. في الواقع ، التعرض ل33 درجة مئوية لطالما 6 ح فقط يسبب 20 ٪ من الديدان لعرض حركة غير طبيعية. لذلك، نقترح استخدام درجة حرارة 33 °C ووقت 1 ساعة كشرط موحد لـ RT-qPCR وRr الفلورسنت.
وقد كشفت التجارب الأخيرة أن التدريج التنموي للدودة لتجارب HSR مهم بشكل خاص. وقد تبين مؤخرا أن في C. elegans inducibility من HSR يتراجع (أي، ينهار) من قبل > 50٪ عندما تبدأ hermaphrodites وضع البيض5. التدريج الديدان بشكل صحيح أمر بالغ الأهمية لأن هناك في كثير من الأحيان اختلافات في توقيت النمو في سلالات تحمل الطفرات. إذا تم استخدام المسوخ الحساسة لدرجة الحرارة ، فإن هذا سيؤثر أيضًا على النتائج إذا لم يتم مزامنةها مع سن الإنجاب. ولذلك، فمن المستحسن لقياس بعناية بداية وضع البيض لكل سلالة لتحديد متى يحدث الانهيار. نافذة الوقت بعد الزلت L4 وقبل بدء مرحلة النضج الإنجابية ضيقة؛ لذلك، يجب توخي الحذر بحيث لا يؤدي انهيار HSR عن غير قصد إلى حدوث تباين في النتائج.
بالإضافة إلى توقيت النمو، يمكن أن يكون للتغيرات الصغيرة بشكل مدهش في درجة الحرارة، أقل من 1 درجة مئوية، آثار كبيرة على HSR. على سبيل المثال، الخلايا العصبية الحرارية في C. elegans حساسة لتغيرات درجة الحرارة صغيرة مثل ± 0.05 درجة مئوية16. وبالتالي ، لا بد من استخدام ميزان الحرارة الذي يمكن قياس درجة الحرارة بدقة. لذلك، نقترح كأفضل ممارسة استخدام جهاز معاير لقياس درجة الحرارة دقيقة بما يكفي لقياس درجات الحرارة داخل ± 0.1 درجة مئوية. وعلاوة على ذلك، ينبغي استخدام ميزان حرارة مع وظيفة تسجيل البيانات لقياس التغيرات في درجة الحرارة عبر الزمن. يتم تحديد العديد من الحاضنات أن يكون لها اختلافات حرارية تزيد عن 1 درجة مئوية في أجزاء مختلفة من الحاضنة وعبر الزمن، والتي يمكن أن يكون لها آثار كبيرة على تجارب HSR. وكفضل الممارسات، نقترح استخدام حاضنات تحتوي على عزل ودورة كافية لتقليل تقلبات درجات الحرارة. لإجراء تجارب الصدمة الحرارية، نقترح أفضل ممارسة من حمام المياه المتداولة. الوقت الذي يستغرقه لطبقة أجار للوصول إلى درجة الحرارة المطلوبة هي ما يقرب من 6-7 دقيقة في حمام مائي ولكن لفترة أطول بكثير في حاضنة جافة15،17. ومع ذلك، إذا كان حمام المياه المتداولة غير متوفرة، فقد أظهرنا أن التوجيهية HSR قوية يحدث أيضا في حاضنة جافة باستخدام شروطنا. إذا تم استخدام حاضنة جافة ، يجب تقليل فتح الحاضنة طوال فترة الإجهاد.
ومن الثابت أن تحريض الجينات صدمة الحرارة يعتمد على المنظم الرئيسي للHSR، HSF-1. هنا، نقدم أدلة على أن اثنين من أكثر غير المباشرة المقايسة، المراسلين الفلورسنت وsrmorecovery، وتعتمد أيضا على HSF-1. بشكل ملحوظ، وجدنا أن يشيا الكائنات الحية البديلة المستخدمة عادة، thermotolerance، ليست HSF-1 تعتمد باستخدام HSF-1 RNAi(الشكل 4). وقد تم الإبلاغ عن نتائج مماثلة سابقا باستخدام متحولة hsf-1 أو متحولة ttx-3، الذي يمنع HSR18،19،20. معا، وهذه النتائج تشير إلى أن المقايسة الحرارية لا ينبغي أن تستخدم لأبحاث HSR. وعلاوة على ذلك، يشير هذا إلى أن أفضل الممارسات هي اختبار الاعتماد على HSF-1 لأي محك يستخدم لقياس HSR.
معا، ونحن نقدم سلسلة من البروتوكولات الموحدة وأفضل الممارسات لقياس قوية وقابلة للتكرار من التعريفي HSR في C. elegans. ونأمل أن تقلل هذه المنهجيات من التباين في تجارب HSR وتزيد من إمكانية التكاثر. إن تسهيل المقارنات المباشرة بين المختبرات سوف يساعد على تسريع البحوث في مجال HSR. وعلاوة على ذلك، فإن التوحيد القياسي سوف يفيد البحوث في الشيخوخة وأمراض التنكس العصبي التي ترتبط بها HSR ارتباطا وثيقا.
Disclosures
ليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
وقد دعم هذا العمل من قبل هبة من فرانك ليزلي. وقد تم توفير بعض السلالات من قبل CGC، التي يتم تمويلها من قبل مكتب المعاهد القومية للصحة لبرامج البنية التحتية للبحوث (P40 OD010440).
Materials
| Name | Company | Catalog Number | Comments |
| 18S-forward primer | TTGCGTCAACTGTGGTCGTG | ||
| 18S-reverse primer | CCAACAAAAAGAACCGAAGT CCTG | ||
| AM446 rmIs223[phsp70::gfp; pRF4(rol-6(su1006))] | Morimoto lab | http://groups.molbiosci.northwestern.edu/morimoto/ | |
| C12C8.1-forward primer | GTACTACGTACTCATGTGTCG GTATTT | ||
| C12C8.1-reverse primer | ACGGGCTTTCCTTGTTTTCC | ||
| CFX Connect Real-Time PCR Detection System | Bio Rad | 1855200 | |
| CL2070 dvIs70 [hsp-16.2p::GFP + rol-6(su1006)] | Caenorhabditis Genetics Center (CGC) | https://cgc.umn.edu/ | |
| EasyLog Thermistor Probe Data Logger with LCD | Lascar | EL-USB-TP-LCD | |
| Greenough Stereo Microscope S9i Series | Leica | ||
| Hard Shell 96 Well PCR Plates | Bio Rad | HSS9601 | |
| hsp-16.2-forward primer | ACTTTACCACTATTTCCGTCC AGC | ||
| hsp-16.2-reverse primer | CCTTGAACCGCTTCTTTCTTTG | ||
| iScript cDNA Synthesis Kit | Bio Rad | 1708891 | |
| iTaq Universal Sybr Green Super Mix | Bio Rad | 1725121 | |
| Laser Scanning Confocal Microscope | Nikon | Eclipse 90i | |
| MultiGene OptiMax Thermo Cycler | Labnet | TC9610 | |
| N2 (WT) | Caenorhabditis Genetics Center (CGC) | https://cgc.umn.edu/ | |
| Nanodrop Lite Spectrophotometer | Thermo Scientific | ND-LITE | |
| Parafilm M Roll | Bemis | 5259-04LC | |
| RapidOut DNA Removal Kit | Thermo Scientific | K2981 | |
| Recirculating Heated Water Bath | Lauda Brinkmann | RE-206 | |
| Traceable Platinum Ultra-Accurate Digital Thermometer | Fisher Scientific | 15-081-103 | |
| TRIzol Reagent | Invitrogen | 15596026 | RNA isolation reagent |
| TurboMix Attachment | Scientific Industries | SI-0564 | |
| Vortex-Genie 2 | Scientific Industries | SI-0236 |
References
- Guisbert, E., Morimoto, R. I. The regulation and function of the heat shock response. Protein Quality Control in Neurodegenerative Diseases. , 1-18 (2013).
- Li, J., Chauve, L., Phelps, G., Brielmann, R. M., Morimoto, R. I. E2F coregulates an essential HSF developmental program that is distinct from the heat-shock response. Genes and Development. 30 (18), 2062-2075 (2016).
- Hsu, A. L., Murphy, C. T., Kenyon, C. Regulation of aging and age-related disease by DAF-16 and heat-shock factor. Science. 300 (5622), 1142-1145 (2003).
- Morley, J. F., Morimoto, R. I. Regulation of longevity in Caenorhabditis elegans by heat shock factor and molecular chaperones. Molecular Biology of the Cell. 15 (2), 657-664 (2004).
- Labbadia, J., Morimoto, R. I. Repression of the Heat Shock Response Is a Programmed Event at the Onset of Reproduction. Molecular Cell. 59 (4), 639-650 (2015).
- Link, C. D., Cypser, J. R., Johnson, C. J., Johnson, T. E. Direct observation of stress response in Caenorhabditis elegans using a reporter transgene. Cell Stress & Chaperones. 4 (4), 235 (1999).
- Guisbert, E., Czyz, D. M., Richter, K., McMullen, P. D., Morimoto, R. I. Identification of a Tissue-Selective Heat Shock Response Regulatory Network. PLoS Genetics. 9 (4), 1-12 (2013).
- Ma, J., et al. Cellular Proteomes Drive Tissue-Specific Regulation of the Heat Shock Response. G3: Genes, Genomes, Genetics. 7 (3), 1011-1018 (2017).
- Mendenhall, A. R., et al. Expression of a single-copy hsp-16.2 reporter predicts life span. Journals of Gerontology - Series A Biological Sciences and Medical Sciences. 67 (7), 726-733 (2012).
- Stiernagle, T. Maintenance of C. elegans. WormBook. (1999), 1-11 (2006).
- Avery, L., You, Y. J. C. elegans feeding. WormBook: The Online Review of C. elegans Biology. , 1-23 (2012).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method. Methods. 25 (4), 402-408 (2001).
- Rea, S. L., Wu, D., Cypser, J. R., Vaupel, J. W., Johnson, T. E. A stress-sensitive reporter predicts longevity in isogenic populations of Caenorhabditis elegans. Nature Genetics. 37 (8), 894-898 (2005).
- Shiu, P. K., Hunter, C. P. Early Developmental Exposure to dsRNA Is Critical for Initiating Efficient Nuclear RNAi in C. elegans. Cell Reports. 18 (12), 2969-2978 (2017).
- Zevian, S. C., Yanowitz, J. L. Methodological considerations for heat shock of the nematode Caenorhabditis elegans. Methods. 68 (3), 450-457 (2014).
- Clark, D. A., Biron, D., Sengupta, P., Samuel, A. D. T. The AFD sensory neurons encode multiple functions underlying thermotactic behavior in Caenorhabditis elegans. Journal of Neuroscience. 26 (28), 7444-7451 (2006).
- Prahlad, V., Cornelius, T., Morimoto, R. I. Regulation of the cellular heat shock response in Caenorhabditis elegans by thermosensory neurons. Science. 320 (5877), 811-814 (2008).
- McColl, G., et al. Insulin-like signaling determines survival during stress via posttranscriptional mechanisms in C. elegans. Cell Metabolism. 12 (3), 260-272 (2010).
- Douglas, P. M., et al. Heterotypic Signals from Neural HSF-1 Separate Thermotolerance from Longevity. Cell Reports. 12 (7), 1196-1204 (2015).
- Kourtis, N., Nikoletopoulou, V., Tavernarakis, N. Small heat-shock proteins protect from heat-stroke-associated neurodegeneration. Nature. 490 (7419), 213-218 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved