Method Article
Caenorhabditis elegans Isı Şok Uyanımı İndüksiyon ölçme için Standart Yöntemler
Bu Makalede
Özet
Burada, moleküler düzeyde RT-qPCR kullanan Caenorhabditis elegans ısı şok tepkisi (HSR) indüksiyondeğerlendirmek için standart protokoller sunulmaktadır, hücresel düzeyde floresan muhabirler, ve organizma düzeyinde termokurtarma.
Özet
Isı şoku tepkisi (HSR), protein katlanır homeostaz veya proteostazi geri yüklemek için işlevleri sitosolik protein misfolding tarafından indüklenen bir hücresel stres yanıtıdır. Caenorhabditis elegans HSR araştırma için benzersiz ve güçlü bir niş kaplar çünkü HSR moleküler, hücresel ve organizma salalarınında değerlendirilebilir. Bu nedenle moleküler düzeydeki değişimler hücresel düzeyde görüntülenebilir ve bunların fizyoloji üzerindeki etkileri organizma düzeyinde ölçülebilir. HSR'yi ölçmek için yapılan tahliller basit olmakla birlikte, literatürde açıklanan zamanlama, sıcaklık ve metodolojideki farklılıklar, sonuçları çalışmalar arasında karşılaştırmayı zorlaştırmaktadır. Ayrıca, bu konular, hsr analizini araştırmalarına dahil etmek isteyen herkes için bir engel teşkil eder. Burada, RT-qPCR, floresan muhabirler ve organizmal termorecovery tetkisi ile HSR'nin sağlam ve tekrarlanabilir bir şekilde indüksiyonunun ölçülmesi için bir dizi protokol sunulmuştur. Ayrıca, yaygın olarak kullanılan bir termotolerans tacının HSR, HSF-1'in köklü ana regülatörüne bağlı olmadığını ve bu nedenle HSR araştırmaları için kullanılmaması gerektiğini gösteriyoruz. Son olarak, literatürde bulunan bu tahlillerde varyasyonlar tartışılır ve en iyi uygulamalar sonuçta nörodejeneratif hastalık, yaşlanma ve HSR araştırma kolaylaştırmak, alan genelinde sonuçları standartlaştırmak yardımcı olmak için önerilmektedir.
Giriş
Isı şoku tepkisi (HSR), sıcaklık artışları ve diğer proteotoksik gerilmelerin neden olduğu sitosolik protein indüklenen evrensel bir hücresel stres tepkisidir. Caenorhabditis elegans HSR aktivasyonu hsp-70 ve hsp-16.2 gibi ısı şokgenlerinin transkripsiyonel upregülasyonuna yol açar. Birçok ısı şok proteinleri (HSP) doğrudan yanlış katlanmış veya hasarlı proteinler ile etkileşim tarafından protein katlanır homeostaz, ya da proteostaz geri moleküler şaperon olarak işlev. HSR ana regülatör transkripsiyon faktörü Isı Şok Faktörü 1 (HSF-1), aktivasyonu zarif birden fazlamekanizma1 ile kontrol edilir.
HSF-1'in rolü stresle sınırlı değildir. HSF-1 normal büyüme ve gelişme için gereklidir, hsf-1 silinmesi larva arrest2yol açar. HSF-1, protein agregalarının birikmesi ve proteostazın sürdürülememesi ile karakterize yaşlanma ve yaşa bağlı nörodejeneratif hastalıklar da önemlidir. HSF-1'in yıkılması protein agregalarının birikmesi ve ömrün kısaltılmasına neden olurken, hsf-1'in aşırı ekspresyonu protein agregasyonunu azaltır ve ömrünü3,4olarak uzatır. Bu nedenle HSF-1'in moleküler düzeyde düzenlenmesinin organizma fizyolojisi ve hastalığı üzerinde geniş etkileri vardır.
C. elegans HSR araştırma için güçlü bir model organizmadır çünkü HSR moleküler ölçülebilir, hücresel, ve organizma düzeyleri4,5,6. Bu modelin gücünü vurgulayan, HSR yolu delineating önemli gelişmeler, HSR düzenleme doku ya da özel farklılıklar gibi, C. elegans7,8keşfedilmiştir . Ayrıca, C. elegans yaygın yaşlanma araştırma için kullanılan ve proteostaz bozulması ile bağlantılı hastalıkların modelleme için gelişmekte olan bir sistemdir.
C. elegans ile ısı şokdeneyleri hızlı ve tekrarlanabilir olabilir rağmen, başlamadan önce göz önünde bulundurulması gereken birkaç soru vardır. Örneğin, HSR indüksiyonu için hangi sıcaklık kullanılmalıdır ve solucanlar ne kadar süre maruz kalmalıdır? Kuru bir kuvöz veya su banyosu kullanmak daha mı iyi? Hangi gelişimsel evre kullanılmalıdır? Ne yazık ki, HSR'yi araştırmak için kullanılan metodolojiler laboratuvardan laboratuvara kadar büyük farklılıklar göstererek en iyi metodolojileri seçerken karışıklığa neden olur ve sonuçları alan genelinde karşılaştırmayı zorlaştırır.
HSR'yi ölçmek için RT-qPCR, floresan muhabirler ve termokurtarma kullanımı için sağlam ve standart protokoller salıyoruz. Bu üç yaklaşım birbirini tamamlasa da, her birinin benzersiz avantajları ve dezavantajları vardır. Örneğin, RT-qPCR HSR en doğrudan ve kantitatif ölçüm, ve bu tetkik kolayca birçok farklı ısı şokine indüklenebilir genler içerecek şekilde genişletilebilir. Ancak, RT-qPCR en pahalı, teknik olarak zor olabilir ve özel ekipman kullanımını gerektirir. Buna karşılık, floresan muhabirler HSR indüksiyondokuya özgü farklılıkları ölçme avantajına sahiptir. Ancak, doğru quantitate zordur, sadece belirli bir eşik üzerinde indüksiyon ölçmek ve bir floresan mikroskop kullanımını gerektirir. Ayrıca, burada açıklanan muhabir suşları standart N2 suşu ile karşılaştırıldığında gelişimsel olarak gecikir. Tek kopya transgenler içeren yeni muhabir suşları mevcut olmasına rağmen, burada test edilmemiştir9. Üçüncü bir tseleme, termokurtarma, organizma düzeyinde fizyolojik olarak ilgili bir okuma sağlama avantajıvardır. Ancak, bu titremuhtemelen en az hassas ve en dolaylı. Son olarak, bu tahlillerde bulunan bazı yaygın varyasyonları tartışıyor ve bu alanda araştırmayı kolaylaştırmak için bir dizi en iyi uygulama öneriyoruz.
Protokol
1. C. eleganların bakımı ve senkronizasyonu
- Op50 Escherichia coli bakterisi ile tohumlanmış Nematod Büyüme Ortamı (NGM) plakaları üzerinde 20 °C'de solucanları haftada yaklaşık 2x taze plakalara aktararakbakım10. Solucanların besinlerinin tükenmesini önlemeye özen izlenmelidir, çünkü bu onların fizyolojisini etkileyebilir11.
- NGM plakalarının hazırlanması.
- Mix 3 g NaCl, 2.5 g Bacto-peptone, 20 g agar ve deiyonize (DI) H2O kadar 1 L bir şişe.
- Sterilizasyon için karışımı otoklav.
- Karışımın ~50 °C'ye soğumasını bekleyin.
- 1 M KH2PO4 (pH = 6), 1 mL 1 M CaCl2,1 mL 1 MMGMgSO 4ve 1 mL kolesterol (5 mg/mL% 100 etanol) 25 mL ekleyin.
- Steril tekniği kullanarak, yaklaşık 100 tabak verim 6 cm plakalar içine karışımı dökün. Karışım ilk olarak 300 mL steril bir kabına aktarılırsa dökülen plakalar daha kolaydır.
- Bakteri ile tohumlamadan veya 4 °C'de depolamadan önce oda sıcaklığında (RT) katılaşmak için 1 gün bekleyin.
- OP50 bakterilerinin NGM plakalarına tohumlanması.
- 30 °C veya 37 °C'de LB'de doymuş bir gecede OP50 bakteri kültürünü büyütün.
- Kültürün yaklaşık 300 μL'sini 6 cm'lik bir NGM plakasının ortasına yerleştirin.
- Plakalar, bakteri çimlerin tabağa yapışması için gerektiği gibi 1-3 gün BOYUNCA RT'de kurutulun. Plakalar daha sonra kullanılabilir veya 4 °C'de saklanabilir.
- NGM plakalarının hazırlanması.
- Solucanları ya taze yumurtlanan yumurtaları izole ederek (burada açıklanan) ya da alternatif olarak solucanları çamaşır suyuyla erittikten sonra yumurta toplayarak senkronize olarak büyütün.
- Platin tel çekme kullanarak yaklaşık 10 gravid yetişkin solucanı yeni bir tabağa aktarın. Yetişkinler yetişkinliğin ilk gününde ise yumurta-lay senkronizasyon en iyi çalışır.
- Yaklaşık 1 saat sonra, plaka dan solucanlar çıkarın. Bu koşullar ve zorlanma bağlı olarak, plaka başına 40-60 yumurta neden olmalıdır.
2. HSR muhabirlerinin floresan görüntülemesi
- Solucanları senkronize edin (bölüm 1.2) ve istenilen gelişim aşamasına kadar 20 °C'de koruyun. AM446(hsp-70p::gfp)ve CL2070(hsp-16.2p::gfp)floresan muhabir suşları için, henüz üreme olgunluğa ulaşmamış genç yetişkin solucanlar, yumurta döşenmesi senkronizasyonundan sonra 64 saat sonra üretilir.
NOT: Gelişim selzamanlaması her zorlanmaya ve solucanların yetiştirildiği sıcaklığa göre değişir. Her iki HSR muhabiri suşları N2 göre hafif bir gelişimsel gecikme sergiler. Daha da önemlisi, HSR indüksiyonunun büyüklüğü üreme olgunluğunun başlangıcından sonra yaklaşık 2-4 kat azalır (bkz. Tartışma). - Solucanları parafin filmile sararak ve 33 °C'de 1 saat boyunca dolaşan bir su banyosuna daldırarak ısı şoku. Parafin film ince bir şerit kenarları mühürlemek için plaka etrafında 2x sarılmış olmalıdır. Plakanın alt kısmını kapatmayın veya ısı transferine engel olabilir. Bir test tüpü rafı ve kurşun ağırlığı kullanarak plakaları baş aşağı batırın. Gerekirse negatif kontrol numunesi (ısı şoku yok) eklemeyi unutmayın.
NOT: Parafin filmi güvenli değilse, su plakaya girer ve veri toplama için plaka kullanılmamalıdır. - Su banyosu tabakları kaldırarak ve bir kağıt havlu ile kurutma solucanlar kurtarmak. Parafin filmini çıkarın ve solucanları 20 °C'de 6-24 saat kuluçkaya yatırın. Bu iyileşme süresi görüntüleme den önce GFP sentezi ve katlanması için yeterli zaman sağlar.
- Görüntüleme için slaytlar hazırlayın. Slaytlar her kullanım için taze olarak hazırlanmalıdır.
- Agarose çözülene kadar bir mikrodalga kullanarak su ve ısı% 3 agarose çözeltisi olun.
- Agarose pad için bir spacer oluşturmak için üzerlerinde laboratuvar bandı şeridi olan diğer iki mikroskop slaytı arasında görüntüleme için bir mikroskop slaytı yerleştirin.
- 1.000 μL'lik bir pipet kullanarak, mikroskop kaydırağının ortasına ısıtmalı %3'lük agarose'un bir damlasını (~150 μL) yerleştirin.
- Mikroskop slaytını hemen ilk slayta dik boş bir mikroskop slaytı ile kaplayın, böylece üst slayt bitişik slaytlar üzerindeki laboratuvar bandına dayanacak. Bu tek tip genişlikte bir yastık oluşturmak için agarose damla dışarı yayılır.
- Üst teki slaydı dikkatlice çıkarın.
- Solucanları 200 μL'lik bir pipet kullanarak m9 tamponunda 1 mM levamisole'lık küçük bir damla (~5 μL) ekleyerek agarose pedin ortasına yerleştirin. Sonra platin tel almak kullanarak levamisole damla içine 10 solucan aktarın. Bir kapak slip ile kapak. Kapak sızdırmazlığı dik bir mikroskop için gerekli değildir. İsteğe bağlı olarak, solucanlar levamisole kapalı yayılarak felç olduğunda hizalanmış olabilir, agarose ped in dışına, ve platin tel almak ile solucanlar hizalama. Alternatif olarak, levamisole bir laboratuvar mendil kullanılarak ıslatılmış olabilir.
NOT: Levamisole uzun süreli kuluçka floresan değiştirebilir, çünkü görüntü, mümkün olan en kısa sürede. - Floresan mikroskobu kullanarak solucanları görüntüle. Görüntü yakalama nın ayrıntıları mikroskop ve yazılıma göre değişir.
NOT: Görüntü yoğunluklarını doğrudan karşılaştırmak için tek bir görüntüleme oturumunda aynı mikroskop ayarlarını kullanın. Görüntüyü aşırı doymaktan kaçının.
3. RT-qPCR kullanılarak HSR gen ekspresyonunun ölçülmesi
- Solucanları senkronize edin (bölüm 1.2) ve istenilen gelişim aşamasına kadar 20 °C'de koruyun. N2 solucanları için, henüz üreme olgunluğuna ulaşmamış genç erişkin solucanlar, yumurtlama senkronizasyonundan sonra 60 saat üretilir.
NOT: Gelişim selzamanlaması her zorlanmaya ve solucanların yetiştirildiği sıcaklığa göre değişir. Daha da önemlisi, HSR indüksiyonunun büyüklüğü üreme olgunluğunun başlangıcından sonra yaklaşık 2-4 kat azalır (bkz. Tartışma). - Isı şok solucanları adım 2.2 açıklandığı gibi.
- Su banyosu tabakları çıkarın, parafin filmi çıkarın ve hemen solucanlar toplamak. Solucanlar plakaları 1 mL M9 ile hafifçe yıkayarak, sıvıyı mikrosantrifüj tüpünde toplayarak ve 400 x g'de santrifüjden sonra 1 dk.'da m9'u çıkararak toplanabilir.
- Solucanları lyse ve organik ekstraksiyon kullanarak RNA arındırın.
- 250 μL RNA izolasyon reaktifi ekleyin (bkz. Malzeme Tablosu).
- Girdap tüpleri elle 30 s.
- Girdap tüpleri 20 dk 4 °C'de mikrosantrifüj tüp eki kullanılarak (Bkz. Malzeme Tablosu).
- 50 μL kloroform ekleyin.
- 30 s.'lik girdap.
- Örnekleri RT'de 3 dakika kuluçkaya yatırın.
- 4 °C'de 15 dakika için ≥14.000 x g'de santrifüj.
- Sulu katmanı (örn. üst katman, ~125 μL) yeni bir mikrosantrifüj tüpüne aktarın.
NOT: Organik katmandan ve arabirimdeki malzemeden kaçının. - 50 μL kloroform ekleyin.
- 30 s.'lik girdap.
- Örnekleri RT'de 3 dakika kuluçkaya yatırın.
- 4 °C'de 5 dk için ≥14.000 x g'de santrifüj.
- Sulu tabakayı (~100 μL) yeni bir mikrosantrifüj tüpüne aktarın.
NOT: Organik katmandan ve arabirimdeki malzemeden kaçının. - Eşit hacimli (yani 100°L) isopropanol ile RNA'yı çökeltin.
- En az 30 dakika -20 °C'de kuluçka, ama tercihen bir gecede.
NOT: Deney burada duraklatılabilir ve RNA -20 °C'de saklanabilir. - 4 °C'de ≥30 dk için ≥14.000 x g'de santrifüj ile RNA pelet.
- Pelet rahatsız etmeden mümkün olduğunca supernatant kadar çıkarın.
NOT: Pelet küçük olacak ve görünür olmayabilir. Pelet tüpün yan tarafına sıkıca yapışmayabilir, bu nedenle onu sislodging önlemek için dikkatli gereklidir. - Peleti RNase içermeyen H2O ile yapılan %70 buz gibi etanolle yıkayın.
- 4 °C'de ≥5 dk için ≥14.000 x g'de santrifüj.
- Pelet rahatsız etmeden mümkün olduğunca çok supernatant çıkarın.
- Kalan %70 etanolleri çıkarmak için RT'de hızlı bir dönüş yapın.
- Tüpleri rt'de gerektiği kadar açık bırakarak peletkurun; genellikle en az 20 dk. Tüpler kontaminasyonu önlemek için bir tiftik içermeyen doku veya alüminyum folyo ile kaplanabilir.
- 20 μL RNase içermeyen H2O peletrere resuspend.
- RNA konsantrasyonunu küçük hacimli bir spektrofotometre (2 μL) kullanarak belirleyin.
NOT: Deney burada duraklatılabilir ve RNA geçici olarak -20 °C'de veya altında saklanabilir.
- DNase I ile kuluçkaya yatarak artık DNA'yı çıkarın. Ticari olarak kullanılabilen bir kit (Bkz. Malzemeler Tablosu)kullanmak ve üreticinin talimatlarına uymak önerilir.
- Bu kit ile 30 dakika boyunca 37 °C'lik su banyosunda 500 ng RNA ve 1 μL DNase I ile 20 μL reaksiyon hazırlayın.
- Her numuneye 2,5 μL DNase inaktivasyon reaktifi (kisi dahil) ekleyin ve rt'de 5 dakika boyunca ara sıra titreme/girdap ile kuluçkaya yatırın.
- 2 dk için 14.000 x g aşağı spin.
- Beyaz peleti bozmadan, cDNA sentezi için 15 μL süpernatant'ı taze bir mikrotüpe aktarın.
- CDNA sentezi yap. Ticari olarak kullanılabilen bir kit (Bkz. Malzemeler Tablosu)kullanmak ve üreticinin talimatlarına uymak önerilir.
- Kit ile, bir önceki adımdan 15 μL DNase I-treated RNA ve 1 μL ters transkriptaz ile 20 μL reaksiyon hazırlayın.
- CDNA sentezi için aşağıdaki programı kullanın: 5 dk için 25 °C, 20 dk için 46 °C, 1 dk için 95 °C, 4 °C tutun.
- Numuneye doğrudan 80 μL RNase içermeyen H2O ekleyerek cDNA'yı seyreltin.
- Kısa bir süre girdap, sonra aşağı spin ve -20 °C'de gerekli kadar saklayın.
- QPCR gerçekleştirin. Ticari olarak kullanılabilen bir kit (Bkz. Malzemeler Tablosu)kullanmak ve üreticinin talimatlarına uymak önerilir.
- Kiti ile, 96 kuyulu bir plakanın bir kuyuda 2 μL cDNA ve 200 nM (her biri) ileri ve ters astar içeren 25 μL reaksiyon hazırlayın.
- Isı şoku genlerinin ölçümü için astar dizileri, hsp-70 ve hsp-16.2, ve 18S rRNA (normalleştirme kontrolü için) Malzemeler Tablosundalistelenmiştir. İstenildiği gibi birden çok normalleştirme denetimi kullanılabilir.
- Testin doğrusal aralıkta olduğundan emin olmak için 18S ölçümünden önce cDNA numunelerini 50 kat seyreltin. Uygun qPCR koşulları kullanılan kit ve astarlarla değişir (Bkz. Temsilci Sonuçları).
- 5 s denatürasyon için 95 °C'lik 40 döngülü qPCR için gerçek zamanlı PCR algılama sistemi (bkz.
NOT: Optimum tavlama sıcaklıkları astar ve koşullara göre değişebilir. - ΔΔCt veya standart eğri yöntemi12kullanarak ölçün.
4. HSR'nin organizma düzeyinde ölçülmesi için termokurtarma teşbi
- Solucanları senkronize edin (bölüm 1.2) ve istenilen gelişim aşamasına kadar 20 °C'de koruyun. N2 solucanları için, henüz üreme olgunluğuna ulaşmamış genç erişkin solucanlar, yumurtlama senkronizasyonundan sonra 60 saat üretilir.
NOT: Gelişim selzamanlaması her zorlanmaya ve solucanların yetiştirildiği sıcaklığa göre değişir. Daha da önemlisi, HSR indüksiyonunun büyüklüğü üreme olgunluğunun başlangıcından sonra yaklaşık 2-4 kat azalır (bkz. Tartışma). - Isı şok solucanları olarak adım 2.2 olarak açıklanan 6 saat.
- Su banyosundan tabakları çıkarın, parafin filmini çıkarın ve solucanların 20 °C'de 48 saat kuluçka yla iyileşmesini bekleyin.
- Sarsıntılı hareket veya felç olmadan mekanik stimülasyondan sonra hemen sürünebilen solucan ların sayısını sayın.
NOT: 6 saat kuluçka termokurtarma yı azaltan koşulları incelemek için en uygun uyruştur, ancak termokurtarmayı geliştiren koşulları aramak için daha uzun pozlama süreleri gerekebilir.
Sonuçlar
Bu el yazmasında açıklanan protokoller kullanılarak, HSR indüksiyonfloresan muhabirler, RT-qPCR ve termokurtarma tahlilleri kullanılarak ölçüldü. Her durumda, bölüm 1.2'deki prosedür, üreme olgunluğuna ulaşmamış senkronize, genç yetişkin solucanlar üretmek için kullanılmıştır.
Hücresel düzeyde HSR indüksiyonu görselleştirmek için, AM446 (hsp-70p::gfp) ve CL2070 (hsp-16.2p::gfp) floresan muhabir suşları protokolün 2. Isı şoku olmadan negatif kontrol örneklerinde, hsp-16.2 muhabiri sadece normal otofloresans gösterdi, ancak hsp-70 muhabiri daha önce bildirilen4 anal depresör kas kurucu floresan vardı (Şekil 1A). 33 °C'de 1 saat ısı şokundan sonra her iki muhabirde de sağlam floresan gözlendi; ancak ifade deseni hangi muhabirin kullanıldığına bağlı olarak farklıydı (Şekil 1B). HSP-70 muhabiri bağırsak ve spermatheca'da en parlak, hsp-16.2 muhabiri ise farinkste en parlak tı. Ayrıca, hsp-16.2 muhabiri daha önce açıklandığı gibi indüksiyon miktarında solucan-solucan değişkenliği yüksek derecede vardı, ama hsp-70 muhabiri13vermedi .
Bölüm 2 yaygın olarak kullanılan bir varyasyon bir kuru kuvöz yerine bir sirkülasyon su banyosu ısı şoku gerçekleştirmektir. Bu nedenle, iki metodoloji arasındaki fark da test edilmiştir. Her iki protokolün de bizim koşullarımızı kullanarak iki floresan muhabirin sağlam indüksiyonuna yol açtığı, ancak dolaşan bir su banyosunun en iyi uygulama olarak önerilmesine rağmen (bkz. Tartışma)(Bkz. Tartışma) (Şekil 1B).
Gazetecilerin transkripsiyon faktörü HSF-1'e olan bağımlılığını test etmek için, muhabir indüksiyonu ölçülmeden önce HSF-1'in yıkılması için RNAi beslenmesi kullanıldı. Her iki suşun floresansının HSF-1 nakavtı ile ciddi şekilde azaldığı, bu muhabirlerinliteratürde açıklandığı gibi HSF-1-bağımlı olduğu saptanmıştır(Şekil 2). Ancak, aynı zamanda faringeal floresan hsf-1 nakavt üzerine her iki muhabirde de devam gözlenmiştir, hangi faringeal kas14beslenerek RNAi dirençli olduğunu önceki raporlar ile tutarlıdır .
HSR'nin tüm solucan indüksiyonunu moleküler düzeyde ölçebilmek için protokolün 3. Örnekler üç erme ile ölçüldü, astarların her biri için standart bir eğri oluşturuldu ve kalite kontrolü için her örnek için bir erime eğrisi analiz edildi. Hsp-70 ve hsp-16.2 olmak üzere iki ısı şoku geni için göreceli hsp-70 ifadede 2000 x'ten fazla artışa neden olan 33 °C'lik bir ısı şoku bulunmuştur (Şekil 3). Bu sonuçlar, her iki endojen genin de HSR indüksiyonu ölçmek için uygun olduğunu ve 1 saat için 33 °C'lik ısı şoku için önemli bir tepki oluşturmak için yeterli olduğunu göstermektedir. Ancak, ısı şoku yokluğunda mRNA düzeyleri çok düşük olduğundan, ısı şoku indüksiyonmutlak derecesi yorumlanmasında dikkatli kullanılmalıdır.
Isı şokuna fizyolojik bir tepkiyi analiz etmek için, protokolün 4. Solucanların 33 °C'de 6 saat ısı çarpmasına maruz kalmanın, 48 saat iyileşmeden sonra normal hareket eden solucanlarda %20'lik bir azalmaya yol açtığı bulunmuştur(Şekil 4A). HSF-1 transkripsiyon faktörü bu test bağımlılığı strese solucanlar maruz kalmadan önce hsf-1 nakavt rnai besleme kullanılarak test edildi. HSF-1'in yıkılmasının normal harekette dramatik bir düşüşe neden olduğu, solucanların %95'inin platin tel kazma ile itişkin edildikten sonra sarsıntılı hareket veya felç gösterdiği saptandı.
Bu termokurtarma analizini yaygın olarak kullanılan alternatif organizma karşılaştırdık. Termotolerans analizinde solucanlar kuru bir kuluçka makinesi kullanılarak sürekli 35 °C sıcaklığa maruz kalır ve solucanların canlı yüzdesi çeşitli zaman noktalarında ölçülür. Bu titreyi kullanarak, sürekli olarak 35 °C'ye maruz kalan kontrol solucanlarının yaklaşık 8 saat maruz kaldıktan sonra öldüğü tespit edilmiştir(Şekil 4B). Ancak, HSF-1 bu test bağımlılığı RNAi knockdown kullanılarak test edildiğinde, hsf-1 inhibisyonu termotolerans bir azalmaya neden olmadığı bulundu. Benzer sonuçlar daha önce HSF-1 mutasyonları kullanılarak gösterilmiştir (bkz. Tartışma). Bu nedenle HSR'yi ölçmek için termotolerans telbettei sinin kullanılması önerilmez ve termokurtarma HSR'yi organizma düzeyinde incelemek için tercih edilen yöntemdir.

Şekil 1: Floresan muhabirlerle ölçülen HSR indüksiyonu. (A) HSP-70p::gfp ve hsp-16.2p::gfp muhabiri nin 33 °C'de bir su banyosunda veya kuluçka makinesinde 1 saat ısı şokundan sonra basal ve (B) ısıya dayanıklı ifadesi. Solucanlar OP50 bakterisi üzerinde 64 saat boyunca büyütüldü, ısı şokedildi ve görüntülemeden önce 20 °C'de 8 saat boyunca kurtarıldı. Referans olarak,(A)'deki ısı şoku solucanları (B)'deısı şoku solucanlarının menzili ve doygunluğu yla eşleşecek şekilde yeniden normalleştirildi. İki deneysel kopyanın temsili görüntüleri gösterilir. Ölçek çubuğu = 250 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
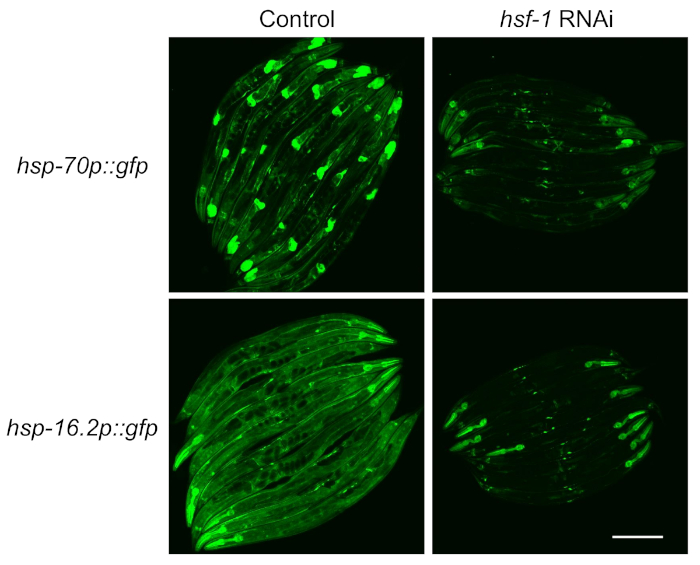
Şekil 2: Floresan muhabirlerle ölçülen HSR indüksiyonu HSF-1'e bağlıdır. HSP-70p::gfp ve hsp-16.2p::gfp muhabirleri kontrol (L4440 boş vektör) veya hsf-1 RNAi plakaları 64 saat, bir su banyosunda 33 °C'de 1 saat ısı şokuna maruz kalmıştır ve görüntülemeden önce 20 °C'de 8 saat boyunca kurtarıldı. İki deneysel kopyanın temsili görüntüleri gösterilir. Ölçek çubuğu = 250 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
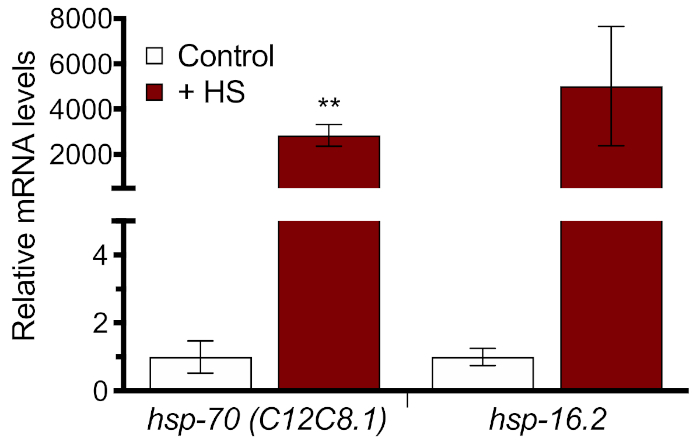
Şekil 3: RT-qPCR ile ölçülen HSR indüksiyonu. N2 solucanları HT115 bakterisi üzerinde 60 saat boyunca büyütüldü ve 33 °C'lik su banyosunda 1 saat ısı şokedildi. HSP-70 (C12C8.1) ve hsp-16.2'nin göreli mRNA düzeyleri ısı şoku kontrolü olmadan normalleştirilmiş olarak gösterilmiştir. Çizilen değerler dört biyolojik çoğaltmanın ortalamasıdır ve hata çubukları ± SEM'i temsil eder. İstatistiksel anlamlılık eşleşmeyen bir Öğrencinin t-testi kullanılarak hesaplanmıştır. **p < 0.01. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
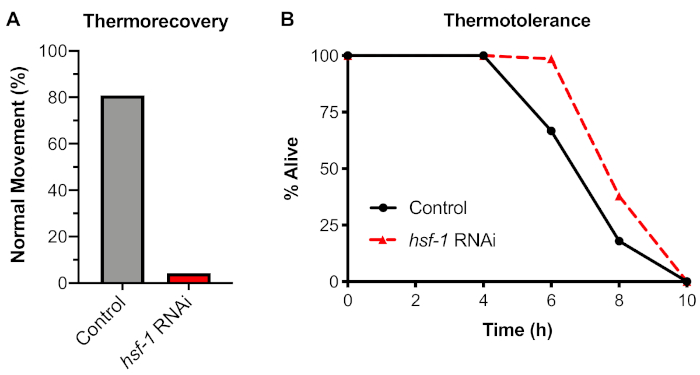
Şekil 4: Termotolerans değil, Termotolerans HSF-1'e bağlıdır. N2 solucanlar kontrol (L4440) veya hsf-1 RNAi plakaları üzerinde 60 saat boyunca yetiştirildi ve sonra ya kaydırıldı: (A) A 33 °C su banyosu 6 saat için ve 20 °C'de 48 h için normal hareket (termokurtarma) veya (B) A 35 °C kuru inkübatör için puanlama önce kurtarıldı ve ölü (termotolerans) kadar her 2 saat kaldırıldı. Her titre 2 bağımsız günde n ≥ 30 kişi ile yapıldı. Ortalama gösterilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Literatürde, gereksiz uyarılar getiren ve laboratuvarlar arasındaki sonuçları karşılaştırmada zorluk çeken HSR'yi tahsin etmek için çok çeşitli sıcaklıklar, zaman ve ekipmanlar kullanılmıştır. Örneğin, 32-37 °C arasında değişen sıcaklıklar ve 15 dakika ile birkaç saat arasında değişen sıcaklıklar HSR15'iindüklemek için kullanılmıştır. Ancak, öldürücülük gibi erken 3 h 37 °C tüm aşamaları için ve 1,5 saat gün 1 yetişkin15için meydana geldiği bildirilmiştir. Ayrıca, solucanların 35 °C'ye maruz kalmasının HSF-1'e bağlı olmayan ölümcüllüklere yol açtığını ve bu koşulların HSR analizi için uygun olmadığını gösteriyoruz. Buna karşılık, 33 °C'lik bir ısı şoku 1 saat için ısı şoku genlerinin güçlü indüksiyonu ortaya çıkaracak kadar sağlamdır, ancak solucanın canlılığını etkilemeyecek kadar hafiftir. Gerçekten de, 33 °C'ye 6 saat kadar uzun süre maruz kalmak solucanların sadece %20'sinin anormal hareket göstermesine neden olur. Bu nedenle, RT-qPCR ve floresan muhabir tahlilleri için standart bir koşul olarak 33 °C sıcaklık ve 1 saat bir zaman kullanmayı öneriyoruz.
Son deneyler, HSR deneyleri için solucanların gelişimsel evrelemesinin özellikle önemli olduğunu ortaya koymuştur. Son zamanlarda C. elegans hsr inducibility azalır (yani, çöker) tarafından >50% hermafroditler yumurtlama55 başladı . Solucanları doğru bir şekilde evrelemek çok önemlidir, çünkü mutasyon taşıyan suşlarda gelişimsel zamanlamada sık lıkla farklılıklar vardır. Isıya duyarlı mutantlar kullanılırsa, üreme yaşlarına göre senkronize edilmezlerse bu sonuçları da etkiler. Bu nedenle, çökmenin ne zaman oluştuğunu belirlemek için her zorlanma için yumurtlama başlangıcını dikkatle ölçmeleri önerilir. L4 molt sonra zaman penceresi ve üreme olgunluk başlangıcından önce dar; bu nedenle, HSR çöküşünün yanlışlıkla sonuçlarda değişkenliğe neden olmaması için dikkatli olunmalıdır.
Gelişimsel zamanlamaya ek olarak, 1 °C gibi kısa bir sıcaklık değişimi HSR üzerinde önemli etkilere yol açabilir. Örneğin, C. elegans termoduyuduyunöronlar ±0.05 °C16gibi küçük sıcaklık değişikliklerine duyarlıdır. Bu nedenle, doğru sıcaklık ölçebilen bir termometre kullanmak zorunludur. Bu nedenle, ±0.1 °C içindeki sıcaklıkları ölçecek kadar hassas sıcaklık ölçümü için kalibre edilmiş bir cihazın kullanılmasını en iyi yöntem olarak öneriyoruz. Ayrıca, zaman içinde sıcaklık değişimlerini ölçmek için veri kaydetme işlevine sahip bir termometre kullanılmalıdır. Birçok kuluçka makinesinin kuvözün farklı yerlerinde ve zaman içinde 1 °C'den fazla termal varyasyonları olduğu belirtilmiş olup, bu da HSR deneyleri üzerinde önemli etkilere yol açabilir. En iyi uygulama olarak, sıcaklık dalgalanmalarını en aza indirmek için yeterli yalıtım ve dolaşıma sahip kuvözleri kullanmanızı öneririz. Isı şoku deneyleri yapmak için, dolaşan bir su banyosu en iyi uygulama öneriyoruz. Bir agar plaka istenilen sıcaklığa ulaşmak için gereken süre yaklaşık 6-7 dk bir su banyosu ama çok daha uzun kuru bir kuluçka15,17. Ancak, dolaşan bir su banyosu mevcut değilse, biz sağlam HSR indüksiyon da bizim koşulları kullanarak kuru bir kuluçka meydana geldiğini göstermiştir. Kuru bir kuluçka makinesi kullanılırsa, stres süresince kuvözün açılması en aza indirilmelidir.
Isı şoku genlerinin indüksiyonunun HSR, HSF-1'in ana düzenleyicisi olan hsf-1'e bağlı olduğu iyi belirlenmiştir. Burada, iki dolaylı tahlil, floresan muhabirler ve termokurtarma, aynı zamanda HSF-1 bağlıdır kanıt salıyoruz. Önemli ölçüde, yaygın olarak kullanılan alternatif organizmasal bir sayılma, termotolerans, HSF-1 RNAi kullanılarak hsf-1 bağımlı değildir bulundu(Şekil 4). Benzer sonuçlar daha önce hsf-1 mutant veya bir ttx-3 mutant kullanılarak bildirilmiştir, hangi bloklar HSR18,19,20. Birlikte, bu sonuçlar termotolerans tahsinh HSR araştırma için kullanılmamalıdır göstermektedir. Ayrıca, bu en iyi uygulama HSR ölçmek için kullanılan herhangi bir test için HSF-1 bağımlılığı test etmek olduğunu göstermektedir.
Birlikte ele alındığında, C. elegansHSR indüksiyon sağlam ve tekrarlanabilir ölçümü için standart protokoller ve en iyi uygulamalar bir dizi salıyoruz. Bu metodolojilerin HSR deneylerinde değişkenliği azaltacağını ve tekrarlanabilirliği artıracağını umuyoruz. Laboratuvarlar arasında HSR araştırmalarının doğrudan karşılaştırılmasının kolaylaştırılması, HSR alanındaki araştırmaları n için hızlandıracaktır. Ayrıca, standardizasyon hsr yakından ilişkili olduğu yaşlanma ve nörodejeneratif hastalıklar içine araştırma yararlanacaktır.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma Frank Leslie'nin bağışı ile desteklendi. Bazı suşlar, NIH Araştırma Altyapı Programları Ofisi (P40 OD010440) tarafından finanse edilen CGC tarafından sağlanmıştır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 18S-forward primer | TTGCGTCAACTGTGGTCGTG | ||
| 18S-reverse primer | CCAACAAAAAGAACCGAAGT CCTG | ||
| AM446 rmIs223[phsp70::gfp; pRF4(rol-6(su1006))] | Morimoto lab | http://groups.molbiosci.northwestern.edu/morimoto/ | |
| C12C8.1-forward primer | GTACTACGTACTCATGTGTCG GTATTT | ||
| C12C8.1-reverse primer | ACGGGCTTTCCTTGTTTTCC | ||
| CFX Connect Real-Time PCR Detection System | Bio Rad | 1855200 | |
| CL2070 dvIs70 [hsp-16.2p::GFP + rol-6(su1006)] | Caenorhabditis Genetics Center (CGC) | https://cgc.umn.edu/ | |
| EasyLog Thermistor Probe Data Logger with LCD | Lascar | EL-USB-TP-LCD | |
| Greenough Stereo Microscope S9i Series | Leica | ||
| Hard Shell 96 Well PCR Plates | Bio Rad | HSS9601 | |
| hsp-16.2-forward primer | ACTTTACCACTATTTCCGTCC AGC | ||
| hsp-16.2-reverse primer | CCTTGAACCGCTTCTTTCTTTG | ||
| iScript cDNA Synthesis Kit | Bio Rad | 1708891 | |
| iTaq Universal Sybr Green Super Mix | Bio Rad | 1725121 | |
| Laser Scanning Confocal Microscope | Nikon | Eclipse 90i | |
| MultiGene OptiMax Thermo Cycler | Labnet | TC9610 | |
| N2 (WT) | Caenorhabditis Genetics Center (CGC) | https://cgc.umn.edu/ | |
| Nanodrop Lite Spectrophotometer | Thermo Scientific | ND-LITE | |
| Parafilm M Roll | Bemis | 5259-04LC | |
| RapidOut DNA Removal Kit | Thermo Scientific | K2981 | |
| Recirculating Heated Water Bath | Lauda Brinkmann | RE-206 | |
| Traceable Platinum Ultra-Accurate Digital Thermometer | Fisher Scientific | 15-081-103 | |
| TRIzol Reagent | Invitrogen | 15596026 | RNA isolation reagent |
| TurboMix Attachment | Scientific Industries | SI-0564 | |
| Vortex-Genie 2 | Scientific Industries | SI-0236 |
Referanslar
- Guisbert, E., Morimoto, R. I. The regulation and function of the heat shock response. Protein Quality Control in Neurodegenerative Diseases. , 1-18 (2013).
- Li, J., Chauve, L., Phelps, G., Brielmann, R. M., Morimoto, R. I. E2F coregulates an essential HSF developmental program that is distinct from the heat-shock response. Genes and Development. 30 (18), 2062-2075 (2016).
- Hsu, A. L., Murphy, C. T., Kenyon, C. Regulation of aging and age-related disease by DAF-16 and heat-shock factor. Science. 300 (5622), 1142-1145 (2003).
- Morley, J. F., Morimoto, R. I. Regulation of longevity in Caenorhabditis elegans by heat shock factor and molecular chaperones. Molecular Biology of the Cell. 15 (2), 657-664 (2004).
- Labbadia, J., Morimoto, R. I. Repression of the Heat Shock Response Is a Programmed Event at the Onset of Reproduction. Molecular Cell. 59 (4), 639-650 (2015).
- Link, C. D., Cypser, J. R., Johnson, C. J., Johnson, T. E. Direct observation of stress response in Caenorhabditis elegans using a reporter transgene. Cell Stress & Chaperones. 4 (4), 235 (1999).
- Guisbert, E., Czyz, D. M., Richter, K., McMullen, P. D., Morimoto, R. I. Identification of a Tissue-Selective Heat Shock Response Regulatory Network. PLoS Genetics. 9 (4), 1-12 (2013).
- Ma, J., et al. Cellular Proteomes Drive Tissue-Specific Regulation of the Heat Shock Response. G3: Genes, Genomes, Genetics. 7 (3), 1011-1018 (2017).
- Mendenhall, A. R., et al. Expression of a single-copy hsp-16.2 reporter predicts life span. Journals of Gerontology - Series A Biological Sciences and Medical Sciences. 67 (7), 726-733 (2012).
- Stiernagle, T. Maintenance of C. elegans. WormBook. (1999), 1-11 (2006).
- Avery, L., You, Y. J. C. elegans feeding. WormBook: The Online Review of C. elegans Biology. , 1-23 (2012).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method. Methods. 25 (4), 402-408 (2001).
- Rea, S. L., Wu, D., Cypser, J. R., Vaupel, J. W., Johnson, T. E. A stress-sensitive reporter predicts longevity in isogenic populations of Caenorhabditis elegans. Nature Genetics. 37 (8), 894-898 (2005).
- Shiu, P. K., Hunter, C. P. Early Developmental Exposure to dsRNA Is Critical for Initiating Efficient Nuclear RNAi in C. elegans. Cell Reports. 18 (12), 2969-2978 (2017).
- Zevian, S. C., Yanowitz, J. L. Methodological considerations for heat shock of the nematode Caenorhabditis elegans. Methods. 68 (3), 450-457 (2014).
- Clark, D. A., Biron, D., Sengupta, P., Samuel, A. D. T. The AFD sensory neurons encode multiple functions underlying thermotactic behavior in Caenorhabditis elegans. Journal of Neuroscience. 26 (28), 7444-7451 (2006).
- Prahlad, V., Cornelius, T., Morimoto, R. I. Regulation of the cellular heat shock response in Caenorhabditis elegans by thermosensory neurons. Science. 320 (5877), 811-814 (2008).
- McColl, G., et al. Insulin-like signaling determines survival during stress via posttranscriptional mechanisms in C. elegans. Cell Metabolism. 12 (3), 260-272 (2010).
- Douglas, P. M., et al. Heterotypic Signals from Neural HSF-1 Separate Thermotolerance from Longevity. Cell Reports. 12 (7), 1196-1204 (2015).
- Kourtis, N., Nikoletopoulou, V., Tavernarakis, N. Small heat-shock proteins protect from heat-stroke-associated neurodegeneration. Nature. 490 (7419), 213-218 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır