Method Article
カエノハブディティス・エレガンスにおける熱ショック応答の誘導を測定するための標準化された方法
要約
ここでは、分子レベルでRT-qPCRを使用したカエノハブディティス・エレガンスにおける熱ショック応答(HSR)の誘導、細胞レベルの蛍光レポーター、および生物レベルでの熱回収の誘導を評価するために標準化されたプロトコルが提示される。
要約
熱ショック応答(HSR)は、タンパク質折りたたみホメオスタシス、またはプロテオスタシスを回復させる機能する細胞質タンパク質ミスフォールディングによって誘発される細胞ストレス応答である。カエノハブディティスエレガンスは、HSRが分子、細胞、および生物レベルで評価できるため、HSR研究のためのユニークで強力なニッチを占めています。したがって、分子レベルでの変化は細胞レベルで可視化することができ、それらの生理学への影響は、生物レベルで定量することができる。HSRを測定するためのアッセイは簡単ですが、文献に記載されているタイミング、温度、方法論のばらつきは、研究全体で結果を比較することが困難です。さらに、これらの課題は、HSR分析を研究に組み込む人にとって障壁となる。ここでは、RT-qPCR、蛍光レポーター、および組織熱回収アッセイを用いて、堅牢で再現可能な方法でHSRの誘導を測定するための一連のプロトコルが提示されています。さらに、広く使用されている耐熱性アッセイは、HSR、HSF-1の確立されたマスターレギュレータに依存していないため、HSR研究に使用すべきではないことを示しています。最後に、文献に含まれるこれらのアッセイのバリエーションが議論され、ベストプラクティスが提案され、最終的には神経変性疾患、老化、HSR研究を促進し、現場全体で結果を標準化するのに役立ちます。
概要
熱ショック応答(HSR)は、温度上昇やその他のタンパク質毒性ストレスによって引き起こされる細胞質タンパク質ミスフォールディングによって引き起こされる普遍的な細胞ストレス応答である。ケノハブディティス・エレガンスにおけるHSRの活性化は、hsp-70およびhsp-16.2などの熱ショック遺伝子の転写アップレギュレーションにつながります。多くのヒートショックタンパク質(HSP)は、誤って折りたたまれたタンパク質や損傷したタンパク質と直接相互作用することによって、タンパク質の折りたたみホメオスタシス(プロテオスタシス)を回復させる分子シャペロンとして機能します。HSRのマスターレギュレータは転写因子熱ショック係数1(HSF-1)であり、その活性化は複数のメカニズム1を介してエレガントに制御される。
HSF-1の役割はストレスに限定されません。HSF-1は正常な成長と発達のために必要とされ、hsf-1の欠失は幼虫逮捕2に至る。HSF-1は、タンパク質凝集体の蓄積とプロテオスタシスを維持できないことを特徴とする老化および加齢に伴う神経変性疾患においても重要である。hsf-1のノックダウンはタンパク質凝集体の蓄積と寿命の短縮を引き起こし、hsf-1の過剰発現はタンパク質凝集を減少させ、寿命を3,44に延ばす。したがって、HSF-1の分子レベルでの調節は、組織生理学および疾患に広範な影響を及ぼす。
C. エレガンスは、HSRは分子、細胞、および生物レベル,4、5、65で測定することができるので、HSR研究4のための強力なモデル生物である。6このモデルの力を強調し、HSR調節における組織特異的な違いなどのHSR経路を引き出す際の主要な進歩がC.エレガンス77,88で発見された。さらに、C.エレガンスは老化研究に広く使用されており、プロテオスタシスの破壊に関連する疾患をモデル化するための新しいシステムです。
C.エレガンスによる熱ショック実験は迅速かつ再現可能ですが、開始する前に考慮すべきいくつかの質問があります。たとえば、HSR の誘導に使用する温度とワームをどのくらいの期間公開する必要がありますか。ドライインキュベーターや水浴を使用する方が良いですか?どの開発段階を使用する必要がありますか?残念ながら、HSRの調査に使用される方法論は、実験室によって大きく異なり、最良の方法論を選択する際に混乱を引き起こし、現場全体で結果を比較することが困難になります。
我々は、HSRを測定するためにRT-qPCR、蛍光レポーター、および熱回収を使用するための堅牢で標準化されたプロトコルを提示する。これら 3 つのアプローチは補完的ですが、それぞれに固有の長所と短所があります。例えば、RT-qPCRはHSRの最も直接的かつ定量的な測定であり、このアッセイは、多くの異なる熱ショック誘導性遺伝子を含むように容易に拡張することができる。しかし、RT-qPCRは最も高価であり、技術的に困難であり、特殊な機器の使用を必要とします。対照的に、蛍光レポーターはHSR誘導における組織特異的な違いを測定する利点を有する。しかし、正確に定量することは困難であり、一定の閾値を超える誘導しか測定できないので、蛍光顕微鏡の使用が必要です。さらに、ここで説明するレポーター株は、標準N2株と比較して発達的に遅延している。シングルコピートランス遺伝子を含む新しいレポーター株が利用可能であるが、彼らはここでテストされていない9.第3のアッセイは、熱回収、生物レベルで生理学的に関連する読み出しを提供するという利点を有する。しかし、このアッセイは間違いなく最も感度が低く、最も間接的です。最後に、これらのアッセイに見られるいくつかの一般的なバリエーションを議論し、この分野の研究を容易にするための一連のベストプラクティスを提案する。
プロトコル
1. C.エレガンスのメンテナンスと同期
- 週10に約2倍の新鮮なプレートに数人の成人を移すことによって、OP50大腸菌を播種した線虫成長培地(NGM)プレート上の20°Cでワームを維持する。これは彼らの生理学11に影響を与える可能性があるため、ワームが食物を使い果たさないように注意する必要があります。
- NGMプレートの調製。
- NaClの3g、バクトペプトン2.5g、寒天20g、および脱イオン化(DI)H2Oをフラスコ2中1Lまで混合する。
- 殺菌のための混合物をオートクレーブ。
- 混合物を~50°Cに冷却します。
- 1 M KH2PO4(pH =6)の25mL、1MCaCl2の1mL、1M MgSO4の1mL、および1mLのコレステロール(5mg/mLの100%エタノール)を加える。
- 滅菌技術を使用して、約100プレートを得るために6 cmプレートに混合物を注ぎます。混合液が最初に300 mLの滅菌ビーカーに移された場合、プレートを注ぎ込む方が容易です。
- 細菌で播種するか、4°Cで保存する前に、室温(RT)で固化するために1日を許可します。
- NGMプレートにOP50バクテリアを播種する。
- 飽和した一晩OP50細菌培養物をLBで30°Cまたは37°Cで増殖させる。
- 培養液の約300μLを6cmNGMプレートの中心に配置します。
- 細菌の芝生がプレートに付着するために必要に応じて1〜3日間RTでプレートを乾燥させます。その後、プレートを4°Cで使用または保存することができます。
- NGMプレートの調製。
- 産たばかりの卵(ここで説明)を単離するか、漂白剤でワームを溶解した後に卵を採取することによって、ワームを同期的に成長させます。
- プラチナワイヤーピックを使用して、約10グレイド成虫を新鮮なプレートに移します。卵子の同期は、成人が成人の初日である場合に最も効果的です。
- 約1時間後、プレートからワームを取り除きます。これは、条件と株に応じて、プレートあたり40〜60卵をもたらすはずです。
HSRレポーターの蛍光イメージング
- ワーム(セクション1.2)を同期し、望ましい発達段階まで20°Cで維持します。AM446(hsp-70p::gfp)およびCL2070(hsp-16.2p::gfp)蛍光レポーター株の場合、まだ生殖成熟度に達していない若年成虫は、産卵同期後64時間生成される。
注: 発生タイミングは、各菌株とワームが発生する温度によって異なります。両方のHSRレポーター株は、N2に対してわずかな発達遅延を示す。重要なのは、生殖成熟の発症後、HSR誘導の大きさは約2〜4倍低下することです(議論参照)。 - パラフィンフィルムでプレートを包み、33°Cの循環水浴に1時間浸水してワームに熱衝撃を与える。パラフィンフィルムの薄いストリップは、エッジを密封するためにプレートの周りに2倍を包む必要があります。プレートの底部を覆わないか、熱伝達を妨げる可能性があります。試験管ラックと鉛重量を使用してプレートを逆さまに沈下します。必要に応じて、負のコントロールサンプル(ヒートショックなし)を含めておいてください。
注:パラフィンフィルムが安全でない場合は、水がプレートに入り、プレートをデータ収集に使用しないでください。 - 水浴からプレートを取り出し、ペーパータオルで乾燥させることで、ワームを回復します。パラフィンフィルムを取り出し、20°Cで6〜24時間インキュベートします。この回復期間は、イメージングの前にGFPの合成と折り畳みのための十分な時間を可能にします。
- イメージング用のスライドを準備します。スライドは、使用するたびに新しい準備をする必要があります。
- 水中に3%のアガロース溶液を作り、アガロースが溶解するまで電子レンジを使用して加熱します。
- 他の2つの顕微鏡スライドの間に、ラボテープのストリップを持つ顕微鏡スライドを配置し、アガロースパッド用のスペーサーを作成します。
- 1,000 μL ピペットを使用して、加熱した 3%のアガロースの滴(約 150 μL)を顕微鏡スライドの中央に置きます。
- 顕微鏡スライドを最初のスライドに垂直なブランクの顕微鏡スライドで直ちに覆い、上部スライドが隣接するスライドの実験室テープの上に置くようにします。これはアガロースの滴を広げ、均一な幅のパッドを作り出す。
- 上のスライドを慎重に取り外します。
- 200 μL ピペットを使用して、M9 バッファに 1 mM レバミソールの小さなドロップ (約 5 μL) をアガロース パッドの中央に追加して、ワームを固定化します。その後、プラチナワイヤーピックを使用してレバミゾールのドロップに10ワームを転送します。カバースリップで覆います。カバースリップを密封することは、直立した顕微鏡のために必要ではない。必要に応じて、レバミゾールをアガロースパッドの外側に広げ、白金ワイヤーピックでワームを整列させることによって、ワームが麻痺したときに、ワームを整列させることができます。あるいは、レバミゾールは実験室のワイプを使用して浸すことができる。
注:レバミゾールの長時間のインキュベーションは蛍光を変える可能性があるため、できるだけ早く画像を作成します。 - 蛍光顕微鏡を使用してワームを画像化します。画像キャプチャの詳細は、顕微鏡とソフトウェアによって異なります。
注: 画像の強度を直接比較するには、1 回のイメージング セッションで同一の顕微鏡設定を使用します。画像の過剰な飽和は避けてください。
3. RT-qPCRを用いたHSR遺伝子発現の測定
- ワーム(セクション1.2)を同期し、必要な発達段階まで20°Cで維持します。N2ワームの場合、まだ生殖成熟に達していない若い成虫は、産卵同期後60時間で生成される。
注: 発生タイミングは、各菌株とワームが発生する温度によって異なります。重要なのは、生殖成熟の発症後、HSR誘導の大きさは約2〜4倍低下することです(議論参照)。 - ステップ2.2に記載されたヒートショックワーム。
- 水浴からプレートを取り出し、パラフィンフィルムを取り出し、すぐにワームを収集します。M9の1mLでプレートを穏やかに洗浄し、マイクロ遠心チューブに液体を集め、400xgでM9を1分間遠心して取り除くことで、ワームを採取することができます。 g
- ワームをライゼし、有機抽出を使用してRNAを精製します。
- RNA分離試薬を250μL追加します(材料表を参照)。
- 30 sのための手で渦管。
- マイクロ遠心分離管の取り付け具を用いて4°Cで20分間の渦管(材料表を参照)。
- クロロホルムを50μL加えます。
- 30 sのための渦。
- RTで3分間サンプルをインキュベートします。
- 4°Cで15分間≥14,000 x gで遠心分離機。
- 水性層(すなわち、最上層、~125μL)を新しいマイクロ遠心管に移します。
注: 有機層と、インターフェイス内のマテリアルは使用しないでください。 - クロロホルムを50μL加えます。
- 30 sのための渦。
- RTで3分間サンプルをインキュベートします。
- 4°Cで5分間≥14,000 x gで遠心分離機。
- 水性層(約100μL)を新しいマイクロ遠心チューブに移します。
注: 有機層と、インターフェイス内のマテリアルは使用しないでください。 - イソプロパノールの等しい体積(すなわち、100 μL)のRNAを沈殿させてください。
- -20°Cで30分以上インキュベートするが、好ましくは一晩。
注:実験はここで一時停止することができ、RNAは-20°Cで保存することができます。 - 4°Cで≥30分の≥14,000 x gで遠心分離によるRNAをペレット。
- ペレットを邪魔することなく、できるだけ多くの上清を取り除く。
注:ペレットは小さく表示されない場合があります。ペレットはチューブの側面にしっかりと付着しない可能性があるため、ペレットの外れを避けるため注意が必要です。 - ペレットをRNaseフリーH2Oで作った70%氷冷エタノール250μLで洗浄します2。
- 4°Cで≥5分の≥14,000 x gで遠心分離機。
- ペレットを邪魔することなく、できるだけ多くの上清を除去します。
- RTでクイックスピンを行い、残りの70%エタノールを除去します。
- 必要に応じて、チューブをRTで開いたままにしてペレットを乾燥させます。通常、少なくとも20分チューブは、汚染を防ぐために、糸くずのない組織またはアルミニウム箔で覆うことができます。
- ペレットをRNaseフリーH2Oの20 μLで再懸濁します。
- 小容量分光光度計(2μL)を用いてRNA濃度を測定します。
注:実験はここで一時停止することができ、RNAは-20°C以下で一時的に保存することができます。
- DNase Iでインキュベートすることにより残存DNAを除去する。市販のキット (資料一覧を参照) を使用し、製造元の指示に従うことをお勧めします。
- このキットでは、37°Cの水浴に500ngのRNAと1μLのDNase Iで30分間の20μL反応を準備します。
- 各サンプルに2.5 μLのDNase不活性化試薬(キットに含まれる)を加え、RTで5分間、時折フリック/渦を引き起こします。
- 14,000 x gで 2 分間スピンダウンします。
- 白いペレットを邪魔することなく、15 μLの上清を新鮮なマイクロチューブに移してcDNA合成を行います。
- cDNA合成を行う。市販のキット (資料一覧を参照) を使用し、製造元の指示に従うことをお勧めします。
- キットでは、前のステップのDNase I処理RNAを15μL、逆転写酵素を1μLで20μL反応させます。
- cDNA合成には、25°C、20分間46°C、1分間95°C、4°Cホールドのプログラムを使用してください。
- 80 μLのRNaseフリーH2Oをサンプルに直接加えてcDNAを希釈します。
- 短い渦を、スピンダウンし、必要になるまで-20°Cで保存します。
- qPCR を実行します。市販のキット (資料一覧を参照) を使用し、製造元の指示に従うことをお勧めします。
- キットでは、2 μL の cDNA と 200 nM (それぞれ) のフォワードおよびリバースプライマーを含む 25 μL の反応を 96 ウェル プレートの 1 つのウェルに用意します。
- ヒートショック遺伝子を測定するためのプライマー配列は、hsp-70およびhsp-16.2、および18S rRNA(正規化制御用)を材料表に列挙する。必要に応じて、複数の正規化コントロールを使用できます。
- 18Sの測定前に50倍のcDNAサンプルを希釈し、アッセイが線形範囲にあることを確認した。適切なqPCR条件は、使用するキットとプライマーによって異なります(代表結果を参照)。
- 5s変性の場合は95°Cの40サイクル、30 sアニーリングの場合は58°C、30 s延長の場合は72°CのqPCRにはリアルタイムPCR検出システム(材料表を参照)を使用します。
注: 最適なアニーリング温度はプライマーや条件によって異なる場合があります。 - ΔΔCt法または標準曲線法12を使用して定量化する。
4. 生物レベルでHSRを測定するための熱回収アッセイ
- ワーム(セクション1.2)を同期し、望ましい発達段階まで20°Cで維持します。N2ワームの場合、まだ生殖成熟に達していない若い成虫は、産卵同期後60時間で生成される。
注: 発生タイミングは、各菌株とワームが発生する温度によって異なります。重要なのは、生殖成熟の発症後、HSR誘導の大きさは約2〜4倍低下することです(議論参照)。 - ステップ2.2で説明したとおりにワームに熱衝撃を与える。
- 水浴からプレートを取り出し、パラフィンフィルムを取り除き、20°Cで48時間インキュベーションして回収させます。
- ぎくしゃくした動きや麻痺なしに機械的刺激の後すぐに這い去ることができるワームの数を数えます。
注:6時間のインキュベーションは熱回収を減らす条件を調べるのに最適ですが、熱回収を強化する条件を探すためにより長い暴露時間が必要な場合があります。
結果
本稿に記載されたプロトコルを用いて、HSR誘導を蛍光レポーター、RT-qPCR、および熱回収アッセイを用いて測定した。いずれの場合も、セクション1.2の手順は、生殖成熟に達していない同期化された若年成虫を生成するために使用された。
細胞レベルでHSR誘導を可視化するために、AM446(hsp-70p::gfp)およびCL2070(hsp-16.2p::gfp)蛍光レポーター株をプロトコルのセクション2に分析した。hsp-16.2p::gfp熱ショックのない陰性対照試料では、hsp-16.2レポーターは正常な自己蛍光しか示さなかったが、hsp-70レポーターは、前述の4(図1A)のように、肛門圧筋に構成的な蛍光を有していた。33°Cで1時間の熱ショックを受けた後、両方のレポーターに強い蛍光が観察されました。しかし、どのレポーターが使用されたかによって表現パターンが異なる(図1B)。hsp-70レポーターは腸と精子で最も明るかったのに対し、hsp-16.2レポーターは咽頭で最も明るかった。さらに、hsp-16.2レポーターは、前述のように誘導量に高いワーム対ワーム変動を有していたが、hsp-70レポーターは13ではなかった。
セクション2の一般的に使用されるバリエーションは、循環水浴の代わりに乾燥インキュベーターで熱ショックを行うことである。したがって、2つの方法論の違いもテストされた。両方のプロトコルが、我々の条件を使用して2つの蛍光レポーターの堅牢な誘導をもたらしたことが判明したが、循環水浴はベストプラクティスとして推奨される(図Figure 11B)。
転写因子HSF-1に対するレポーターの依存性を検定するために、レポーター誘導を測定する前にRNAiにノックダウンhsf-1を供給した。HSF-1ノックダウン時に両方の株の蛍光が著しく低下していることが分かったが、これらのレポーターは文献4に記載されているようにHSF-1依存性であることを示す(図2)。しかし、咽頭の蛍光がhsf-1ノックダウンの際に両方のレポーターに持続することが観察されたが、これは咽頭筋が14を供給することによってRNAiに耐性であるという以前の報告と一致している。
分子レベルでHSRのワーム誘導全体を定量化するために、プロトコルのセクション3を用いて2つの内因性HsPsをRT-qPCRで測定した。サンプルを三重で測定し、プライマーごとに標準曲線を生成し、各サンプルについて溶融曲線を分析して品質管理を行った。33°Cのヒートショックを1時間で行うと、2つのヒートショック遺伝子hsp-70およびhsp-16.2に対する相対発現が2,000倍以上増加することが分かった(図3)。これらの結果は、両方の内因性遺伝子がHSR誘導の測定に適しており、1時間の33°C熱ショックで実質的な応答を発生するのに十分であることを示している。ただし、熱ショックがない場合のmRNAレベルは非常に低いため、ヒートショック誘導の絶対度を解釈する際には注意が必要です。
熱ショックに対する生理学的応答を解析するために、プロトコルのセクション4を用いて組織熱回収アッセイを試験した。33°Cで6hの熱ショックにワームを曝露すると、48時間の回復後に正常な動きを伴うワームが20%減少することがわかりました(図4A)。HSF-1転写因子に対するこのアッセイの依存性は、ストレスにワームを暴露する前に、RNAiにノックダウンhsf-1を供給することを使用して試験した。hsf-1のノックダウンは正常な動きの劇的な減少を引き起こし、>95%のワームが白金ワイヤーピックで突き出された後にぎくしゃくした動きや麻痺を示すことがわかった。
我々は、この熱回収アッセイを、一般的に耐熱性と呼ばれる広く使用されている代替生物アッセイと比較した。耐熱性アッセイでは、ウォームは乾燥インキュベーターを用いて35°Cの連続温度に曝され、生きているワームの割合は様々なタイムポイントで測定されます。このアッセイを用いて、35°Cに継続的に曝露された制御ワームが、約8時間の曝露後に死んでしまったことが分かった(図4B)。しかし、このアッセイのHSF-1への依存性をRNAiノックダウンを用いて試験したところ、hsf-1の阻害は耐熱性の低下を引き起こさないことが判明した。同様の結果は、HSF-1突然変異を用いて以前に示されている(議論参照)。したがって、HSRを測定するための耐熱性アッセイの使用は推奨されず、また、熱回収は、生物レベルでHSRを調べるのに好ましい方法である。

図1:蛍光レポーターで測定したHSR誘導。(A) 水浴またはインキュベーター内の33°Cで1時間の熱ショックの後に、hsp-70p::gfpとhsp-16.2p::gfpレポーター株の基礎と(B)熱誘導発現。64時間OP50細菌にワームを飼育し、熱ショックを受け、イメージング前に8時間20°Cで回収した。参考までに、(A)の熱ショックワームは、ヒートショックワームの範囲と飽和度に合わせて(B)で再正規化されました。2つの実験反復の代表的な画像が示されている。スケールバー= 250 μm.この図の大きなバージョンを表示するには、ここをクリックしてください。
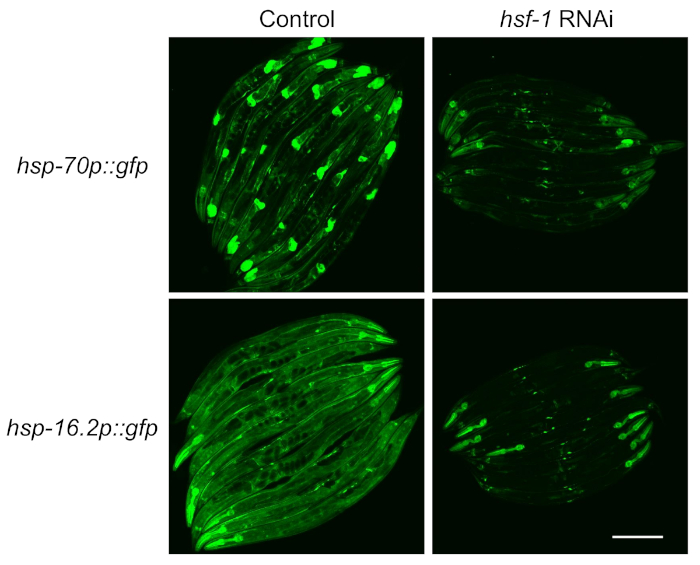
図2:蛍光レポーターで測定したHSR誘導はHSF−1に依存している。hsp-70p:::gfpおよびhsp-16.2pを含む株::gfpレポーターは、64時間の制御(L4440空ベクトル)またはhsf-1 RNAiプレートで64時間上昇し、水浴中で33°Cで1時間の熱ショックにさらされ、イメージング前に20°Cで20°Cで回収した。2つの実験反復の代表的な画像が示されている。スケールバー= 250 μm.この図の大きなバージョンを表示するには、ここをクリックしてください。
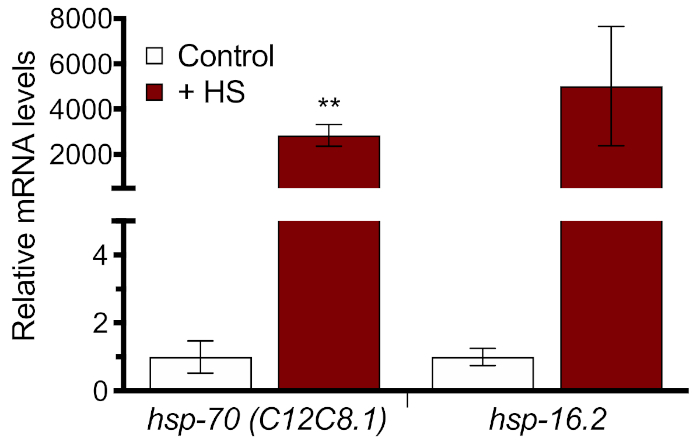
図3:RT-qPCRで測定したHSR誘導。N2ワームをHT115細菌に60時間飼育し、33°Cの水浴で1時間熱ショックを受けた。hsp-70(C12C8.1)およびhsp-16.2の相対mRNAレベルは、無熱衝撃制御に正規化して示されている。プロットされた値は、4つの生物学的複製の平均であり、誤差範囲は±SEMを表す。統計的有意性は、非対の学生のt検定を用いて計算された。**p < 0.01.この図の大きなバージョンを表示するには、ここをクリックしてください。
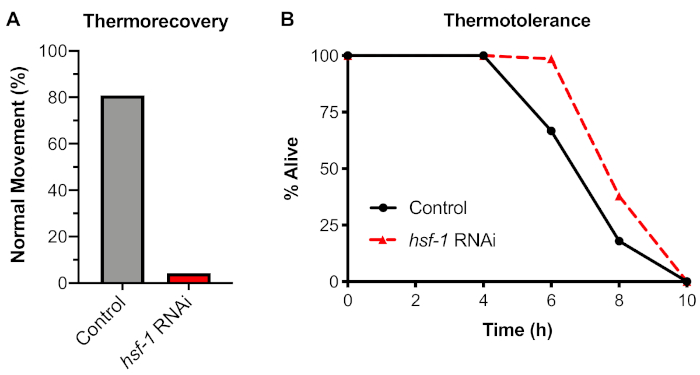
図4:熱耐性ではなく熱回収はHSF-1に依存している。N2ワームは、制御(L4440)またはhsf-1 RNAiプレートで60時間飼育され、(A)6時間の33°C水浴に移行し、通常の動き(熱回収)のために得点する前に48時間20°Cで回収 した。または(B)A35°Cドライインキュベーター(熱耐性)まで2時間ごとに除去した。各アッセイは、2つの独立した日にn ≥ 30個の個体で行われた。平均が表示されます。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
文献では、HSRのアッセイには多種多様な温度、時間、および装置が使用されており、不要な注意点が導入され、実験室間での結果の比較が困難となっています。例えば、32~37°Cの範囲の温度と15分から数時間の範囲の温度がHSR15を誘導するために使用されてきた。しかし、致死性は、すべての段階で37°Cで3時間、1日目の成人15日目に1.5時間で早くも3時間で起こると報告されている。さらに、35°Cにワームを曝露するとHSF-1依存性を持たない致死性が生じ、HSRの分析に適していない状態であることを示す。対照的に、33°Cの1時間のヒートショックは、熱ショック遺伝子の強力な誘導を引き出すのに十分な堅牢性であり、ワームの生存率に影響を与えないほど軽度である。実際、6時間の間33°Cに曝露すると、ワームの20%だけが異常な動きを示す。そこで、RT-qPCRや蛍光レポーターアッセイの標準化条件として、33°Cの温度と1時間の時間を用いることを提案する。
最近の実験では、HSR実験のためのワームの発生ステージングが特に重要であることを明らかにしました。最近、C.エレガンスでは、HSRの可分性が低下し(すなわち、崩壊)、雌雄同体が5を産み始めると50%減少することが示された。突然変異を運ぶ株の発達タイミングに違いが多いため、ワームを正しくステージングすることは非常に重要です。温度感受性変異体を使用する場合、生殖年齢によって同期されない場合、結果にも影響を与えます。したがって、崩壊が発生したときに決定するために、すべての株のための産卵の発症を慎重に測定することをお勧めします。L4モルト後と生殖成熟の開始前の時間のウィンドウは狭いです。したがって、HSR の崩壊によって誤って結果のばらつきが生じないように注意する必要があります。
発達タイミングに加えて、わずか1°Cの温度の驚くほど小さな変化は、HSRに大きな影響を与えることができます。例えば、C.エレガンスの熱感覚ニューロンは±0.05 °Cの16ほどの温度変化に敏感である。したがって、温度を正確に測定できる温度計を使用することが不可欠です。そこで、±0.1°C以内の温度を測定するのに十分な精度の高い温度測定用に較正された装置を使用することをベストプラクティスとして提案します。さらに、データロギング機能を備えた温度計を使用して、時間の変動を測定する必要があります。多くのインキュベーターは、インキュベーターの異なる部分および時間の経過に渡って1°C以上の熱変化を有するように指定されており、HSR実験に大きな影響を及ぼす可能性がある。ベストプラクティスとして、温度変動を最小限に抑えるために十分な断熱材と循環を有するインキュベーターを使用することをお勧めします。熱衝撃実験を行う場合は、循環水浴のベストプラクティスを提案する。寒天プレートが所望の温度に達するまでにかかる時間は、水浴で約6〜7分ですが、乾燥インキュベーター15、17,17でははるかに長いです。しかし、循環水浴が利用できない場合、我々は、我々の条件を使用して乾燥インキュベーターで堅牢なHSR誘導も起こることを示した。乾燥インキュベーターを使用する場合、ストレスの持続時間のためのインキュベーターの開口部を最小限に抑える必要があります。
熱ショック遺伝子の誘導はHSR、HSF-1のマスターレギュレータに依存することが確立されています。ここでは、蛍光レポーターと熱回収という2つの間接的なアッセイがHSF-1にも依存しているという証拠を提示する。有意に、我々は、一般的に使用される代替生物アッセイ、耐熱性、hsf-1 RNAiを用いたHSF-1依存性ではないことを発見した(図4)。同様の結果は,、HSR 18、19、20をブロックするhsf-1変異体またはttx-3変異体を使用して以前に報告されている。18,1920これらの結果は、恒熱性アッセイをHSR研究に使用すべきではないことを示している。さらに、これは、HSRを測定するために使用される任意のアッセイに対してHSF-1依存性をテストすることがベストプラクティスであることを示唆している。
まとめると、C.エレガンスにおけるHSR誘導の堅牢で再現可能な測定のための一連の標準化されたプロトコルとベストプラクティスを提示します。これらの方法論がHSR実験のばらつきを減少させ、再現性を高めればと期待しています。HSR研究の研究を研究室間で直接比較することが、HSR分野の研究を加速する役割を果たします。さらに、標準化は、HSRが密接に関連付けられている老化および神経変性疾患の研究に利益をもたらす。
開示事項
著者らは開示するものは何もない。
謝辞
この作品はフランク・レスリーからの寄付によって支えられた。いくつかの株は、研究インフラプログラムのNIHオフィス(P40 OD010440)によって資金提供されているCGCによって提供されました。
資料
| Name | Company | Catalog Number | Comments |
| 18S-forward primer | TTGCGTCAACTGTGGTCGTG | ||
| 18S-reverse primer | CCAACAAAAAGAACCGAAGT CCTG | ||
| AM446 rmIs223[phsp70::gfp; pRF4(rol-6(su1006))] | Morimoto lab | http://groups.molbiosci.northwestern.edu/morimoto/ | |
| C12C8.1-forward primer | GTACTACGTACTCATGTGTCG GTATTT | ||
| C12C8.1-reverse primer | ACGGGCTTTCCTTGTTTTCC | ||
| CFX Connect Real-Time PCR Detection System | Bio Rad | 1855200 | |
| CL2070 dvIs70 [hsp-16.2p::GFP + rol-6(su1006)] | Caenorhabditis Genetics Center (CGC) | https://cgc.umn.edu/ | |
| EasyLog Thermistor Probe Data Logger with LCD | Lascar | EL-USB-TP-LCD | |
| Greenough Stereo Microscope S9i Series | Leica | ||
| Hard Shell 96 Well PCR Plates | Bio Rad | HSS9601 | |
| hsp-16.2-forward primer | ACTTTACCACTATTTCCGTCC AGC | ||
| hsp-16.2-reverse primer | CCTTGAACCGCTTCTTTCTTTG | ||
| iScript cDNA Synthesis Kit | Bio Rad | 1708891 | |
| iTaq Universal Sybr Green Super Mix | Bio Rad | 1725121 | |
| Laser Scanning Confocal Microscope | Nikon | Eclipse 90i | |
| MultiGene OptiMax Thermo Cycler | Labnet | TC9610 | |
| N2 (WT) | Caenorhabditis Genetics Center (CGC) | https://cgc.umn.edu/ | |
| Nanodrop Lite Spectrophotometer | Thermo Scientific | ND-LITE | |
| Parafilm M Roll | Bemis | 5259-04LC | |
| RapidOut DNA Removal Kit | Thermo Scientific | K2981 | |
| Recirculating Heated Water Bath | Lauda Brinkmann | RE-206 | |
| Traceable Platinum Ultra-Accurate Digital Thermometer | Fisher Scientific | 15-081-103 | |
| TRIzol Reagent | Invitrogen | 15596026 | RNA isolation reagent |
| TurboMix Attachment | Scientific Industries | SI-0564 | |
| Vortex-Genie 2 | Scientific Industries | SI-0236 |
参考文献
- Guisbert, E., Morimoto, R. I. The regulation and function of the heat shock response. Protein Quality Control in Neurodegenerative Diseases. , 1-18 (2013).
- Li, J., Chauve, L., Phelps, G., Brielmann, R. M., Morimoto, R. I. E2F coregulates an essential HSF developmental program that is distinct from the heat-shock response. Genes and Development. 30 (18), 2062-2075 (2016).
- Hsu, A. L., Murphy, C. T., Kenyon, C. Regulation of aging and age-related disease by DAF-16 and heat-shock factor. Science. 300 (5622), 1142-1145 (2003).
- Morley, J. F., Morimoto, R. I. Regulation of longevity in Caenorhabditis elegans by heat shock factor and molecular chaperones. Molecular Biology of the Cell. 15 (2), 657-664 (2004).
- Labbadia, J., Morimoto, R. I. Repression of the Heat Shock Response Is a Programmed Event at the Onset of Reproduction. Molecular Cell. 59 (4), 639-650 (2015).
- Link, C. D., Cypser, J. R., Johnson, C. J., Johnson, T. E. Direct observation of stress response in Caenorhabditis elegans using a reporter transgene. Cell Stress & Chaperones. 4 (4), 235 (1999).
- Guisbert, E., Czyz, D. M., Richter, K., McMullen, P. D., Morimoto, R. I. Identification of a Tissue-Selective Heat Shock Response Regulatory Network. PLoS Genetics. 9 (4), 1-12 (2013).
- Ma, J., et al. Cellular Proteomes Drive Tissue-Specific Regulation of the Heat Shock Response. G3: Genes, Genomes, Genetics. 7 (3), 1011-1018 (2017).
- Mendenhall, A. R., et al. Expression of a single-copy hsp-16.2 reporter predicts life span. Journals of Gerontology - Series A Biological Sciences and Medical Sciences. 67 (7), 726-733 (2012).
- Stiernagle, T. Maintenance of C. elegans. WormBook. (1999), 1-11 (2006).
- Avery, L., You, Y. J. C. elegans feeding. WormBook: The Online Review of C. elegans Biology. , 1-23 (2012).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method. Methods. 25 (4), 402-408 (2001).
- Rea, S. L., Wu, D., Cypser, J. R., Vaupel, J. W., Johnson, T. E. A stress-sensitive reporter predicts longevity in isogenic populations of Caenorhabditis elegans. Nature Genetics. 37 (8), 894-898 (2005).
- Shiu, P. K., Hunter, C. P. Early Developmental Exposure to dsRNA Is Critical for Initiating Efficient Nuclear RNAi in C. elegans. Cell Reports. 18 (12), 2969-2978 (2017).
- Zevian, S. C., Yanowitz, J. L. Methodological considerations for heat shock of the nematode Caenorhabditis elegans. Methods. 68 (3), 450-457 (2014).
- Clark, D. A., Biron, D., Sengupta, P., Samuel, A. D. T. The AFD sensory neurons encode multiple functions underlying thermotactic behavior in Caenorhabditis elegans. Journal of Neuroscience. 26 (28), 7444-7451 (2006).
- Prahlad, V., Cornelius, T., Morimoto, R. I. Regulation of the cellular heat shock response in Caenorhabditis elegans by thermosensory neurons. Science. 320 (5877), 811-814 (2008).
- McColl, G., et al. Insulin-like signaling determines survival during stress via posttranscriptional mechanisms in C. elegans. Cell Metabolism. 12 (3), 260-272 (2010).
- Douglas, P. M., et al. Heterotypic Signals from Neural HSF-1 Separate Thermotolerance from Longevity. Cell Reports. 12 (7), 1196-1204 (2015).
- Kourtis, N., Nikoletopoulou, V., Tavernarakis, N. Small heat-shock proteins protect from heat-stroke-associated neurodegeneration. Nature. 490 (7419), 213-218 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved