Method Article
Méthodes normalisées pour mesurer l’induction de la réponse de choc thermique à Caenorhabditis elegans
Dans cet article
Résumé
Ici, des protocoles standardisés sont présentés pour évaluer l’induction de la réponse de choc thermique (HSR) à Caenorhabditis elegans en utilisant RT-qPCR au niveau moléculaire, les journalistes fluorescents au niveau cellulaire, et la thermorecovery au niveau de l’organisme.
Résumé
La réponse de choc thermique (HSR) est une réponse de stress cellulaire induite par la mauvaise pliage de protéines cytosoliques qui fonctionne pour restaurer l’homéostasie de pliage des protéines, ou protéostasie. Caenorhabditis elegans occupe une niche unique et puissante pour la recherche HSR parce que le HSR peut être évalué aux niveaux moléculaire, cellulaire et organisme. Par conséquent, les changements au niveau moléculaire peuvent être visualisés au niveau cellulaire et leurs impacts sur la physiologie peuvent être quantités au niveau de l’organisme. Bien que les essais de mesure du RSH soient simples, les variations dans le moment, la température et la méthodologie décrites dans la littérature rendent difficile la comparaison des résultats entre les études. De plus, ces questions constitueraient un obstacle pour quiconque cherche à intégrer l’analyse du RSS dans ses recherches. Ici, une série de protocoles est présenté pour mesurer l’induction du HSR d’une manière robuste et reproductible avec RT-qPCR, les journalistes fluorescents, et un essai thermorecovery organisme. En outre, nous montrons qu’un test de thermotélérance largement utilisé ne dépend pas du régulateur principal bien établi du HSR, HSF-1, et ne devrait donc pas être utilisé pour la recherche HSR. Enfin, les variations de ces essais trouvés dans la littérature sont discutées et les meilleures pratiques sont proposées pour aider à normaliser les résultats dans tout le domaine, en fin de compte faciliter la maladie neurodégénérative, le vieillissement, et la recherche HSR.
Introduction
La réponse de choc thermique (HSR) est une réponse universelle de stress cellulaire induite par l’erreur de protéine cytosolique causée par des augmentations de température et d’autres contraintes protéotoxiques. L’activation du HSR à Caenorhabditis elegans conduit à l’upregulation transcriptionnelle des gènes de choc thermique tels que hsp-70 et hsp-16.2. De nombreuses protéines de choc thermique (HSP) fonctionnent comme des chaperons moléculaires qui restaurent l’homéostasie pliable des protéines, ou protéostasie, en interagissant directement avec des protéines mal repliées ou endommagées. Le régulateur principal du HSR est le facteur de transcription Heat Shock Factor 1 (HSF-1), dont l’activation est élégamment contrôlée via plusieurs mécanismes1.
Le rôle de HSF-1 ne se limite pas au stress. HSF-1 est nécessaire pour une croissance et un développement normaux, car la suppression de hsf-1 conduit à l’arrestation larvaire2. HSF-1 est également important pendant le vieillissement et les maladies neurodégénératives liées à l’âge caractérisées par l’accumulation d’agrégats de protéines et une incapacité à maintenir la protéostase. Knockdown de hsf-1 provoque l’accumulation d’agrégats de protéines et une durée de vie raccourcie, tandis que la surexpression de hsf-1 réduit l’agrégation des protéines et prolonge la durée de vie3,4. Par conséquent, la régulation du HSF-1 au niveau moléculaire a de vastes implications pour la physiologie et la maladie de l’organisme.
C. elegans est un organisme modèle puissant pour la recherche HSR parce que le HSR peut être mesuré aux niveaux moléculaire, cellulaire et organisme4,5,6. Soulignant la puissance de ce modèle, des progrès clés dans la délimitation de la voie HSR, telles que les différences spécifiques aux tissus dans la régulation du RSH, ont été découverts dans C. elegans7,8. En outre, C. elegans est largement utilisé pour la recherche sur le vieillissement et est un système émergent pour la modélisation des maladies liées à la perturbation de la protéostase.
Bien que les expériences de choc thermique avec C. elegans puissent être rapides et reproductibles, il y a plusieurs questions à considérer avant de commencer. Par exemple, quelle température doit être utilisée pour l’induction du RSH et combien de temps les vers doivent-ils être exposés? Est-il préférable d’utiliser un incubateur sec ou un bain d’eau? Quel stade de développement doit être utilisé? Malheureusement, les méthodes utilisées pour étudier le RSH varient considérablement d’un laboratoire à l’autre, ce qui cause de la confusion lors de la sélection des meilleures méthodologies et rend difficile la comparaison des résultats sur le terrain.
Nous présentons des protocoles robustes et normalisés pour l’utilisation de RT-qPCR, de reporters fluorescents et de thermorecovery pour mesurer le HSR. Bien que ces trois approches soient complémentaires, elles présentent chacune des avantages et des inconvénients uniques. Par exemple, rt-qPCR est la mesure la plus directe et quantitative du RSH, et ce test peut être facilement étendu pour inclure de nombreux gènes différents de choc thermique inductible. Cependant, RT-qPCR est le plus cher, peut être techniquement difficile, et nécessite l’utilisation d’équipement spécialisé. En revanche, les journalistes fluorescents ont l’avantage de mesurer les différences spécifiques aux tissus dans l’induction du HSR. Cependant, ils sont difficiles à quantifier avec précision, ne peuvent mesurer l’induction au-dessus d’un certain seuil, et nécessitent l’utilisation d’un microscope à fluorescence. En outre, les souches de journaliste décrites ici sont en retard de développement par rapport à la souche standard N2. Bien que de nouvelles souches de reporter contenant des transgènes à copie unique soient disponibles, elles n’ont pas été testées ici9. Le troisième test, la thermorecovery, a l’avantage de fournir une lecture physiologiquement pertinente au niveau de l’organisme. Cependant, ce test est sans doute le moins sensible et le plus indirect. Enfin, nous discutons de quelques variations communes trouvées dans ces essais et proposons un ensemble de pratiques exemplaires pour faciliter la recherche dans ce domaine.
Protocole
1. Entretien et synchronisation de C. elegans
- Maintenir les vers à 20 °C sur les plaques de milieu de croissance de nématode (NGM) ensemencées avec la bactérie OP50 Escherichia coli en transférant plusieurs adultes dans des assiettes fraîches environ 2 fois par semaine10. Il faut faire attention à empêcher les vers de manquer de nourriture, car cela peut affecter leur physiologie11.
- Préparation des plaques NGM.
- Mélanger 3 g de NaCl, 2,5 g de Bacto-peptone, 20 g d’agar et déionisé (DI) H2O jusqu’à 1 L dans une fiole.
- Autoclaver le mélange pour la stérilisation.
- Laisser refroidir le mélange à ~50 °C.
- Ajouter 25 mL de 1 M KH2PO4 (pH = 6), 1 mL de 1 M CaCl2, 1 mL de 1 M MgSO4, et 1 mL de cholestérol (5 mg/mL dans 100% d’éthanol).
- À l’aide d’une technique stérile, verser le mélange dans des assiettes de 6 cm pour produire environ 100 assiettes. Verser des plaques est plus facile si le mélange est d’abord transféré dans un bécher stérile de 300 mL.
- Laisser 1 jour pour se solidifier à température ambiante (RT) avant d’ensemencer avec des bactéries ou de les stocker à 4 °C.
- Ensemencement des bactéries OP50 sur des plaques NGM.
- Cultiver une culture bactérienne OP50 saturée du jour au lendemain en LB à 30 °C ou 37 °C.
- Placer environ 300 μL de la culture sur le centre d’une plaque NGM de 6 cm.
- Laisser sécher les plaques à RT pendant 1-3 jours au besoin pour que la pelouse bactérienne adhère à la plaque. Les plaques peuvent ensuite être utilisées ou stockées à 4 °C.
- Préparation des plaques NGM.
- Cultiver les vers de façon synchrone soit en isolant les œufs fraîchement pondus (décrits ici) ou alternativement en ramassant des œufs après dissolution des vers avec de l’eau de Javel.
- Transférer environ 10 vers adultes gravids dans une assiette fraîche à l’aide d’un pic de fil de platine. La synchronisation des œufs fonctionne mieux si les adultes sont dans le premier jour de l’âge adulte.
- Après environ 1 h, retirer les vers de la plaque. Cela devrait se traduire par 40-60 œufs par assiette, selon les conditions et la souche.
2. Imagerie fluorescente des journalistes HSR
- Synchroniser les vers (section 1.2) et maintenir à 20 °C jusqu’au stade de développement souhaité. Pour les souches de reporters fluorescents AM446 (hsp-70p::gfp)et CL2070 (hsp-16.2p::gfp),les jeunes vers adultes qui n’ont pas encore atteint la maturité reproductive sont générés 64 h après la synchronisation de la ponte.
REMARQUE : Le moment du développement varie selon chaque souche et la température à laquelle les vers sont élevés. Les deux souches de journaliste hsr montrent un léger retard de développement par rapport à N2. Fait important, l’ampleur de l’induction du RSH diminue d’environ 2 à 4 fois après le début de la maturité reproductrice (voir Discussion). - La chaleur choque les vers en enveloppant les plaques avec du film de paraffine et en submergeant dans un bain d’eau circulant à 33 °C pendant 1 h. Une mince bande de film de paraffine doit être enveloppée 2x autour de la plaque pour sceller les bords. Ne couvrez pas le fond de la plaque ou il pourrait interférer avec le transfert de chaleur. Submergez les plaques à l’envers à l’aide d’un support à éprouvette et d’un poids de plomb. N’oubliez pas d’inclure un échantillon de contrôle négatif (pas de choc thermique) si nécessaire.
REMARQUE : Si le film de paraffine n’est pas sécurisé, l’eau entrera dans la plaque et la plaque ne doit pas être utilisée pour la collecte de données. - Récupérez les vers en enlevant les plaques du bain d’eau et en le séchant à l’aide d’une serviette en papier. Retirer le film de paraffine et incuber les vers à 20 °C pendant 6-24 h. Cette période de récupération laisse suffisamment de temps pour la synthèse et le pliage du GFP avant l’imagerie.
- Préparer des diapositives pour l’imagerie. Les diapositives doivent être préparées fraîchement pour chaque utilisation.
- Faire une solution agarose de 3% dans l’eau et chauffer à l’aide d’un four à micro-ondes jusqu’à ce que l’agarose soit dissoute.
- Placez une lame de microscope pour l’imagerie entre deux autres lames de microscope qui ont une bande de ruban de laboratoire sur eux pour créer un espaceur pour le tampon agarose.
- À l’aide d’une pipette de 1 000 μL, placez une goutte (~150 μL) de l’agarose chauffée de 3 % au centre de la lame du microscope.
- Couvrez immédiatement la lame du microscope à l’aide d’une lame de microscope vierge perpendiculaire à la première diapositive, de sorte que la diapositive supérieure repose sur le ruban de laboratoire sur les diapositives adjacentes. Cela étend la goutte d’agarose pour créer un tampon de largeur uniforme.
- Retirez soigneusement la diapositive supérieure.
- Immobiliser les vers à l’aide d’une pipette de 200 μL pour ajouter une petite goutte (~5 μL) de 1 mM de levamisole dans le tampon M9 au centre de la garniture d’agarose. Ensuite, transférer 10 vers dans la goutte de levamisole à l’aide d’un pic de fil de platine. Couvrir d’un couvercle. L’étanchéité du couvercle n’est pas nécessaire pour un microscope droit. En option, les vers peuvent être alignés lorsqu’ils deviennent paralysés en étalant la levamisole, à l’extérieur de la garniture d’agarose, et en alignant les vers avec un pic de fil de platine. Alternativement, le levamisole peut être absorbé à l’aide d’un lingettes de laboratoire.
REMARQUE : Image dès que possible, parce que l’incubation prolongée dans la levamisole pourrait altérer la fluorescence. - Imagez les vers à l’aide d’un microscope à fluorescence. Les détails de la capture d’image varient selon le microscope et le logiciel.
REMARQUE : Pour comparer directement les intensités d’image, utilisez des paramètres de microscope identiques dans une session d’imagerie. Évitez de sursaturer l’image.
3. Mesure de l’expression génique HSR à l’aide de RT-qPCR
- Synchroniser les vers (section 1.2) et les maintenir à 20 °C jusqu’au stade de développement souhaité. Pour les vers N2, les jeunes vers adultes qui n’ont pas encore atteint la maturité reproductrice sont générés 60 h après la synchronisation de la ponte.
REMARQUE : Le moment du développement varie selon chaque souche et la température à laquelle les vers sont élevés. Fait important, l’ampleur de l’induction du RSH diminue d’environ 2 à 4 fois après le début de la maturité reproductrice (voir Discussion). - Les vers de choc thermique décrits à l’étape 2.2.
- Sortez les plaques du bain d’eau, retirez le film de paraffine et collectez immédiatement les vers. Les vers peuvent être recueillis en lavant les plaques doucement avec 1 ml de M9, en recueillant le liquide dans un tube de microcentrifuge, puis en enlevant le M9 après centrifugation à 400 x g pendant 1 min.
- Lysez les vers et purifiez l’ARN à l’aide de l’extraction organique.
- Ajouter 250 μL de réactif d’isolement de l’ARN (voir tableau des matériaux).
- Tubes vortex à la main pendant 30 s.
- Tubes vortex pendant 20 min à 4 °C à l’aide d’une fixation de tube de microcentrifuge (voir tableau des matériaux).
- Ajouter 50 μL de chloroforme.
- Vortex pour 30 s.
- Incuber les échantillons à RT pendant 3 min.
- Centrifugeuse à ≥14 000 x g pendant 15 min à 4 °C.
- Transférer la couche aqueuse (c.-à-d. couche supérieure, ~125 μL) dans un nouveau tube de microcentrifuge.
REMARQUE : Évitez la couche organique et le matériau de l’interface. - Ajouter 50 μL de chloroforme.
- Vortex pour 30 s.
- Incuber les échantillons à RT pendant 3 min.
- Centrifugeuse à ≥14 000 x g pendant 5 min à 4 °C.
- Transférer la couche aqueuse (~100 μL) dans un nouveau tube de microcentrifuge.
REMARQUE : Évitez la couche organique et le matériau de l’interface. - Précipiter l’ARN avec un volume égal (c.-à-d. 100 μL) d’isopropanol.
- Incuber à -20 °C pendant au moins 30 min, mais de préférence pendant la nuit.
REMARQUE : L’expérience peut être interrompue ici et l’ARN peut être stocké à -20 °C. - Pelleter l’ARN par centrifugation à ≥14 000 x g pour ≥30 min à 4 °C.
- Retirez autant de supernatant que possible sans déranger la pastille.
REMARQUE : Le granulé sera petit et peut ne pas être visible. Le granulé peut ne pas adhérer étroitement au côté du tube, donc la prudence est nécessaire pour éviter de le déloger. - Laver la pastille avec 250 μL d’éthanol glacé à 70 % à base de H2O sans RNase.
- Centrifugeuse à ≥14 000 x g pour ≥5 min à 4 °C.
- Retirer autant de supernatant que possible sans déranger la pastille.
- Effectuez une rotation rapide à RT pour enlever tout éthanol restant de 70%.
- Sécher le granulé en laissant les tubes ouverts à RT aussi longtemps que nécessaire; généralement au moins 20 min. Les tubes peuvent être recouverts d’un tissu sans peluche ou d’une feuille d’aluminium pour prévenir la contamination.
- Resuspendez le granulé dans 20 μL de H2O sans RNase.
- Déterminer la concentration d’ARN à l’aide d’un spectrophotomètre à petit volume (2 μL).
REMARQUE : L’expérience peut être interrompue ici et l’ARN peut être stocké temporairement à -20 °C ou moins.
- Retirez l’ADN résiduel en couveant avec DNase I. Il est recommandé d’utiliser un kit disponible dans le commerce (voir tableau des matériaux)et de suivre les instructions du fabricant.
- Avec ce kit, préparer une réaction de 20 μL avec 500 ng d’ARN et 1 μL de DNase I dans un bain d’eau de 37 °C pendant 30 min.
- Ajouter 2,5 μL de réactif d’inactivation de DNase (inclus dans le kit) à chaque échantillon et incuber à RT pendant 5 min avec des effacements occasionnels/vortexing.
- Tourner vers le bas à 14.000 x g pendant 2 min.
- Sans perturber la pastille blanche, transférer 15 μL de supernatant sur un microtube frais pour la synthèse de l’ADC.
- Effectuer la synthèse de l’ADC. Il est recommandé d’utiliser un kit disponible dans le commerce (voir tableau des matériaux)et de suivre les instructions du fabricant.
- Avec le kit, préparez une réaction de 20 μL avec 15 μL d’ARN traité par DNase I de l’étape précédente et 1 μL de transcriptase inverse.
- Utilisez le programme suivant pour la synthèse de l’ADC : 25 °C pendant 5 min, 46 °C pendant 20 min, 95 °C pendant 1 min, 4 °C.
- Diluer l’ADNc en ajoutant 80 μL de H2O sans RNase directement à l’échantillon.
- Vortex brièvement, puis tourner vers le bas et stocker à -20 °C jusqu’à ce que nécessaire.
- Effectuez qPCR. Il est recommandé d’utiliser un kit disponible dans le commerce (voir tableau des matériaux)et de suivre les instructions du fabricant.
- Avec le kit, préparer une réaction de 25 μL contenant 2 μL d’ADN et 200 nM (chacun) d’amorces avant et inverses dans un puits d’une plaque de 96 puits.
- Les séquences d’amorce pour mesurer les gènes de choc thermique, hsp-70 et hsp-16.2, et rRNA 18S (pour un contrôle de normalisation) sont énumérées dans le tableau des matériaux. Plusieurs contrôles de normalisation peuvent être utilisés comme souhaité.
- Diluer les échantillons d’ADIC 50x avant la mesure de 18S pour s’assurer que l’essai se trouve dans la plage linéaire. Les conditions appropriées de qPCR varient selon le kit et les amorces utilisées (voir résultats représentatifs).
- Utiliser un système de détection PCR en temps réel (voir Tableau des matériaux)pour qPCR avec 40 cycles de 95 °C pour 5 s dentaturation, 58 °C pour 30 s annealing, et 72 °C pour l’extension de 30 s.
REMARQUE : Les températures optimales peuvent varier selon les amorces et les conditions. - Quantifier à l’aide de la méthode ΔΔCt ou de la méthode de courbe standard12.
4. Essai de thermorecovery pour mesurer le HSR au niveau de l’organisme
- Synchroniser les vers (section 1.2) et maintenir à 20 °C jusqu’au stade de développement souhaité. Pour les vers N2, les jeunes vers adultes qui n’ont pas encore atteint la maturité reproductrice sont générés 60 h après la synchronisation de la ponte.
REMARQUE : Le moment du développement varie selon chaque souche et la température à laquelle les vers sont élevés. Fait important, l’ampleur de l’induction du RSH diminue d’environ 2 à 4 fois après le début de la maturité reproductrice (voir Discussion). - La chaleur choque les vers comme décrit à l’étape 2.2 pour 6 h.
- Retirer les plaques du bain d’eau, enlever le film de paraffine et permettre aux vers de récupérer par incubation à 20 °C pendant 48 h.
- Comptez le nombre de vers qui peuvent immédiatement ramper après stimulation mécanique sans mouvement saccadé ou paralysie.
REMARQUE : L’incubation de 6 h est optimale pour examiner les conditions qui réduisent la thermorecovery, mais des temps d’exposition plus longs peuvent être nécessaires pour rechercher des conditions qui améliorent la thermorecovery.
Résultats
À l’aide des protocoles décrits dans ce manuscrit, l’induction du HSR a été mesurée à l’aide de reporters fluorescents, de RT-qPCR et d’essais de thermorecovery. Dans chaque cas, la procédure de la section 1.2 a été utilisée pour générer des vers synchronisés et jeunes adultes qui n’avaient pas atteint la maturité reproductive.
Pour visualiser l’induction HSR au niveau cellulaire, les souches de reporter fluorescents AM446 (hsp-70p::gfp) et CL2070 (hsp-16.2p::gfp) ont été analysées à la suite de la section 2 du protocole. Dans les échantillons de contrôle négatifs sans choc thermique, le journaliste hsp-16.2 n’a montré que l’autofluorescence normale, mais le journaliste hsp-70 a eu la fluorescence constitutive dans le muscle dépresseur anal comme précédemment rapporté4 (Figure 1A). Après 1 h de choc thermique à 33 °C, une fluorescence robuste a été observée chez les deux reporters; toutefois, le modèle d’expression était distinct selon le journaliste utilisé (figure 1B). Le journaliste hsp-70 était le plus brillant dans l’intestin et le spermatheca, tandis que le journaliste hsp-16.2 était le plus brillant dans le pharynx. En outre, le journaliste hsp-16.2 avait un degré élevé de variabilité de ver à ver dans la quantité d’induction comme précédemment décrit, mais le journaliste hsp-70 n’a pas13.
Une variante couramment utilisée de la section 2 est d’effectuer le choc thermique dans un incubateur sec au lieu d’un bain d’eau circulant. Par conséquent, la différence entre les deux méthodes a également été testée. Il a été constaté que les deux protocoles ont entraîné l’induction robuste des deux reporters fluorescents en utilisant nos conditions, bien qu’un bain d’eau circulant soit recommandé comme pratique exemplaire (voir Discussion) (figure 1B).
Pour tester la dépendance des journalistes sur le facteur de transcription HSF-1, l’alimentation RNAi a été utilisé pour knockdown hsf-1 avant l’induction du journaliste a été mesurée. Il a été constaté que la fluorescence des deux souches a été sévèrement réduite à la suite de l’élimination du HSF-1, ce qui indique que ces reporters dépendent du HSF-1, comme le décrit la littérature4 (Figure 2). Cependant, il a également été observé que la fluorescence pharyngée persistait dans les deux reporters sur hsf-1 knockdown, ce qui est compatible avec les rapports précédents que le muscle pharyngéal est résistant à l’ARNAi en nourrissant14.
Pour quantifier l’induction de ver entier du HSR au niveau moléculaire, deux HSP endogènes ont été mesurés avec RT-qPCR utilisant la section 3 du protocole. Les échantillons ont été mesurés en triple, une courbe standard a été générée pour chacun des amorces, et une courbe de fonte a été analysée pour chaque échantillon pour le contrôle de la qualité. Il a été constaté qu’un choc thermique de 33 °C pendant 1 h a entraîné une augmentation de plus de 2 000 x del’expressionrelative pour deux gènes de choc thermique, hsp-70 et hsp-16.2 ( figure 3 ). Ces résultats montrent que les deux gènes endogènes sont adaptés à la mesure de l’induction du HSR et qu’un choc thermique de 33 °C pendant 1 h est suffisant pour générer une réponse substantielle. Toutefois, il convient de faire preuve de prudence dans l’interprétation du degré absolu d’induction de choc thermique, car les niveaux d’ARNm en l’absence de choc thermique sont très faibles.
Pour analyser une réponse physiologique au choc thermique, un test de thermorecovery organisme a été testé à l’aide de la section 4 du protocole. Il a été constaté que l’exposition des vers à un choc thermique de 6 h à 33 °C a conduit à une diminution de 20 % des vers avec un mouvement normal après une récupération de 48 h (figure 4A). La dépendance de cet essai sur le facteur de transcription HSF-1 a été testée à l’aide de l’alimentation RNAi pour renverser hsf-1 avant d’exposer les vers au stress. Il a été constaté que knockdown de hsf-1 a causé une diminution spectaculaire du mouvement normal, avec >95% des vers montrant un mouvement saccadé ou la paralysie après avoir été poussé avec un pic de fil de platine.
Nous avons comparé cet essai de thermorecovery à un essai d’organisme alternatif largement utilisé communément appelé thermotolérance. Dans le test de thermotolérance, les vers sont exposés à une température continue de 35 °C à l’aide d’un incubateur sec, et le pourcentage de vers vivants est mesuré à différents moments. À l’aide de ce test, il a été constaté que les vers témoins continuellement exposés à 35 °C sont morts après environ 8 h d’exposition (figure 4B). Cependant, quand la dépendance de cet essai sur HSF-1 a été testée utilisant l’élimination d’ARNAi, il a été constaté que l’inhibition du hsf-1 n’a pas causé une diminution de la thermotolerance. Des résultats similaires ont été précédemment montrés utilisant des mutations de HSF-1 (voir discussion). Par conséquent, l’utilisation de l’essai de thermotolerance pour mesurer le HSR n’est pas recommandée, et la thermorecovery est la méthode préférée pour examiner le HSR au niveau de l’organisme.

Figure 1 : Induction HSR mesurée avec des reporters fluorescents. (A) L’expression basale et (B) à la chaleur de hsp-70p::gfp et hsp-16.2p::gfp reporter souches après 1 h de choc thermique à 33 °C dans un bain d’eau ou un incubateur. Les vers ont été élevés sur les bactéries OP50 pendant 64 h, la chaleur a choqué, puis récupéré à 20 °C pendant 8 h avant l’imagerie. À titre de référence, les vers sans choc thermique dans (A) ont été renormalisés dans (B) pour correspondre à la gamme et la saturation des vers de chaleur-choqué. Des images représentatives de deux répliques expérimentales sont montrées. Barre d’échelle = 250 μm. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
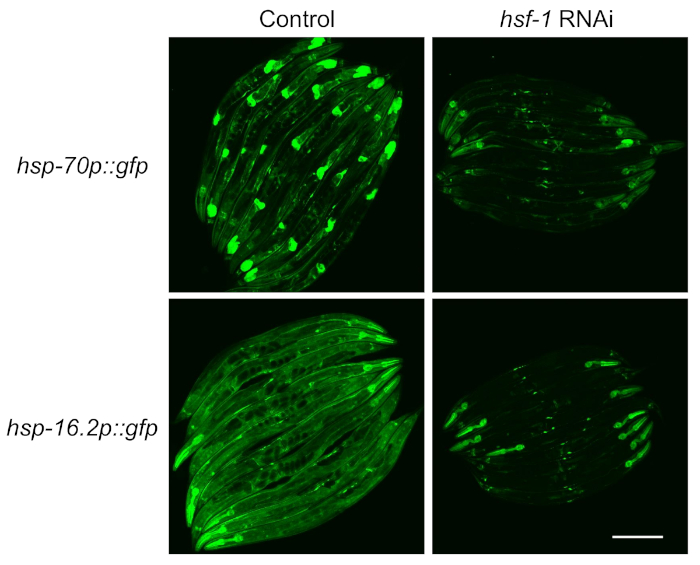
Figure 2 : L’induction du RSH mesurée à l’aide de reporters fluorescents dépend du HSF-1. Les souches contenant le hsp-70p::gfp et hsp-16.2p::gfp reporters ont été soulevées sur le contrôle (vecteur vide L4440) ou hsf-1 plaques RNAi pendant 64 h, exposés à un choc thermique de 1 h à 33 °C dans un bain d’eau, puis récupéré à 20 °C pendant 8 h avant l’imagerie. Des images représentatives de deux répliques expérimentales sont montrées. Barre d’échelle = 250 μm. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
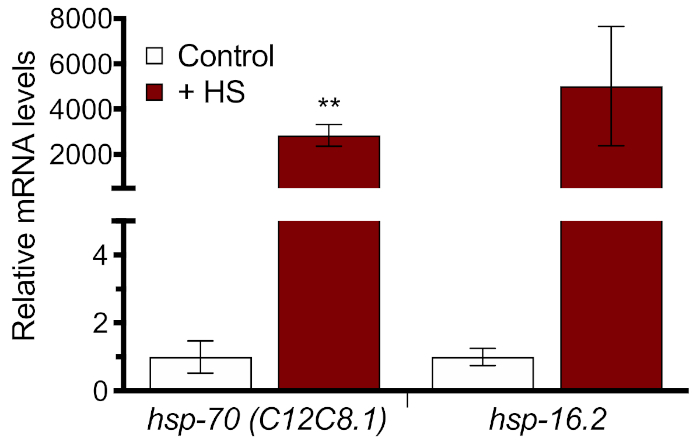
Figure 3 : Induction HSR mesurée avec RT-qPCR. Les vers N2 ont été élevés sur les bactéries HT115 pendant 60 h, puis la chaleur a choqué pendant 1 h dans un bain d’eau de 33 °C. Les niveaux relatifs d’ARNm de hsp-70 (C12C8.1) et hsp-16.2 sont montrés normalisés à la commande sans choc thermique. Les valeurs tracées sont la moyenne de quatre répliques biologiques et les barres d’erreur représentent ± SEM. La signification statistique a été calculée à l’aide du test t d’un élève non apparié. **p < 0,01. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
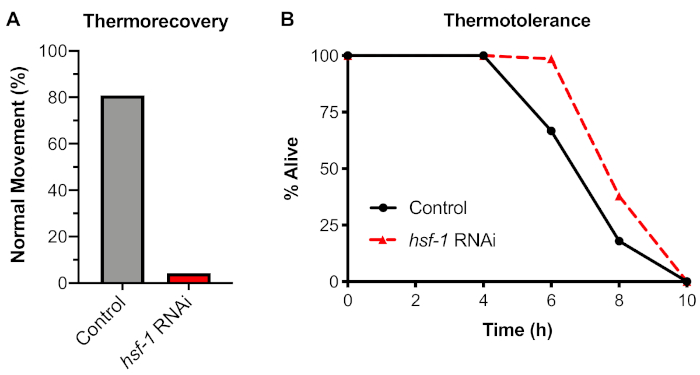
Figure 4 : La thermorecovery, mais pas la thermotolérance, dépend du HSF-1. Les vers N2 ont été soulevés sur des plaques de commande (L4440) ou hsf-1 RNAi pendant 60 h, puis déplacés vers soit : (A) Un bain d’eau de 33 °C pendant 6 h et récupérés à 20 °C pendant 48 h avant de marquer pour le mouvement normal (thermorecovery), ou (B) Un incubateur sec de 35 °C et enlevé tous les 2 h jusqu’à la mort (thermotoler). Chaque test a été fait avec n ≥ 30 individus sur 2 jours indépendants. La moyenne est indiquée. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Dans la littérature, une grande variété de températures, de temps et d’équipement ont été utilisés pour évaluer le RSH, qui a introduit des mises en garde inutiles et a eu des difficultés à comparer les résultats entre les laboratoires. Par exemple, des températures allant de 32 à 37 °C et des temps de 15 min à plusieurs heures ont été utilisées pour induire le HSR15. Cependant, il est signalé que la létalité se produit dès 3 h à 37 °C pour toutes les étapes et 1,5 h pour le jour 1 adultes15. En outre, nous montrons que l’exposition des vers à 35 °C provoque une létalité qui n’est pas dépendante du HSF-1, ce qui rend ces conditions mal adaptées à l’analyse du RSH. En revanche, un choc thermique de 33 °C pour 1 h est suffisamment robuste pour provoquer une forte induction des gènes de choc thermique, mais assez doux pour ne pas affecter la viabilité des vers. En effet, l’exposition à 33 °C aussi longtemps que 6 h ne provoque que 20% des vers à afficher un mouvement anormal. Par conséquent, nous proposons d’utiliser une température de 33 °C et un temps de 1 h comme condition normalisée pour les tests RT-qPCR et fluorescents.
Des expériences récentes ont révélé que la mise en scène développementale des vers pour les expériences HSR est particulièrement importante. Il a été récemment démontré que dans C. elegans l’inducibilité du RSH diminue (c.-à-d. s’effondre) de >50% lorsque les hermaphrodites commencent la ponte5. La mise en scène correcte des vers est essentielle parce qu’il y a souvent des différences dans le moment du développement dans les souches porteuses de mutations. Si des mutants sensibles à la température sont utilisés, cela aura également un impact sur les résultats s’ils ne sont pas synchronisés par leur âge de reproduction. Par conséquent, il est recommandé de mesurer soigneusement l’apparition de la ponte pour chaque souche afin de déterminer quand l’effondrement se produit. La fenêtre du temps après la mue L4 et avant l’initiation de la maturité reproductrice est étroite; par conséquent, il faut veiller à ce que l’effondrement du RSH ne provoque pas par inadvertance de variabilité des résultats.
En plus du moment de développement, des changements de température étonnamment faibles, aussi peu que 1 °C, peuvent avoir des effets substantiels sur le RSH. Par exemple, les neurones thermosensoriels de C. elegans sont sensibles aux changements de température aussi petits que ±0,05 °C16. Ainsi, il est impératif d’utiliser un thermomètre qui peut mesurer avec précision la température. Par conséquent, nous proposons, comme meilleures pratiques, l’utilisation d’un dispositif calibré pour la mesure de la température suffisamment précis pour mesurer les températures à ±0,1 °C. En outre, un thermomètre doté d’une fonctionnalité de journalisation des données doit être utilisé pour mesurer les variations de température dans le temps. De nombreux incubateurs sont spécifiés pour avoir des variations thermiques de plus de 1 °C dans différentes parties de l’incubateur et à travers le temps, ce qui peut avoir des effets significatifs sur les expériences HSR. Comme une pratique exemplaire, nous suggérons d’utiliser des incubateurs qui ont suffisamment d’isolation et de circulation pour minimiser les fluctuations de température. Pour mener des expériences de choc thermique, nous proposons une meilleure pratique d’un bain d’eau circulant. Le temps qu’il faut pour une plaque d’agar pour atteindre une température désirée est d’environ 6-7 min dans un bain d’eau, mais beaucoup plus longtemps dans un incubateur sec15,17. Toutefois, si un bain d’eau circulant n’est pas disponible, nous avons montré que l’induction robuste de HSR se produit également dans un incubateur sec utilisant nos conditions. Si un incubateur sec est utilisé, l’ouverture de l’incubateur pour la durée du stress doit être réduite au minimum.
Il est bien établi que l’induction des gènes de choc thermique dépend du régulateur principal du HSR, HSF-1. Ici, nous présentons des preuves que les deux tests plus indirects, les journalistes fluorescents et la thermorecovery, dépendent également de HSF-1. De manière significative, nous avons constaté qu’un test organisme de remplacement couramment utilisé, la thermotolérance, n’est pas dépendant de HSF-1 en utilisant hsf-1 RNAi (Figure 4). Des résultats similaires ont été précédemment rapportés à l’aide d’un mutant hsf-1 ou d’un mutant ttx-3, qui bloque le HSR18,19,20. Ensemble, ces résultats indiquent que le test de thermotélérance ne devrait pas être utilisé pour la recherche sur le RSH. En outre, cela suggère qu’une meilleure pratique consiste à tester la dépendance hsf-1 pour tout test utilisé pour mesurer le RSH.
Ensemble, nous présentons une série de protocoles normalisés et de pratiques exemplaires pour une mesure robuste et reproductible de l’induction du HSR dans C. elegans. Nous espérons que ces méthodologies diminueront la variabilité des expériences de RSH et augmenteront la reproductibilité. Faciliter les comparaisons directes de la recherche sur le RSH entre les laboratoires permettra d’accélérer la recherche dans le domaine du RSH. En outre, la normalisation bénéficiera à la recherche sur le vieillissement et les maladies neurodégénératives avec lesquelles le RSH est intimement associé.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par un don de Frank Leslie. Certaines souches ont été fournies par la CCG, qui est financée par le Bureau des programmes d’infrastructure de recherche des NIH (P40 OD010440).
matériels
| Name | Company | Catalog Number | Comments |
| 18S-forward primer | TTGCGTCAACTGTGGTCGTG | ||
| 18S-reverse primer | CCAACAAAAAGAACCGAAGT CCTG | ||
| AM446 rmIs223[phsp70::gfp; pRF4(rol-6(su1006))] | Morimoto lab | http://groups.molbiosci.northwestern.edu/morimoto/ | |
| C12C8.1-forward primer | GTACTACGTACTCATGTGTCG GTATTT | ||
| C12C8.1-reverse primer | ACGGGCTTTCCTTGTTTTCC | ||
| CFX Connect Real-Time PCR Detection System | Bio Rad | 1855200 | |
| CL2070 dvIs70 [hsp-16.2p::GFP + rol-6(su1006)] | Caenorhabditis Genetics Center (CGC) | https://cgc.umn.edu/ | |
| EasyLog Thermistor Probe Data Logger with LCD | Lascar | EL-USB-TP-LCD | |
| Greenough Stereo Microscope S9i Series | Leica | ||
| Hard Shell 96 Well PCR Plates | Bio Rad | HSS9601 | |
| hsp-16.2-forward primer | ACTTTACCACTATTTCCGTCC AGC | ||
| hsp-16.2-reverse primer | CCTTGAACCGCTTCTTTCTTTG | ||
| iScript cDNA Synthesis Kit | Bio Rad | 1708891 | |
| iTaq Universal Sybr Green Super Mix | Bio Rad | 1725121 | |
| Laser Scanning Confocal Microscope | Nikon | Eclipse 90i | |
| MultiGene OptiMax Thermo Cycler | Labnet | TC9610 | |
| N2 (WT) | Caenorhabditis Genetics Center (CGC) | https://cgc.umn.edu/ | |
| Nanodrop Lite Spectrophotometer | Thermo Scientific | ND-LITE | |
| Parafilm M Roll | Bemis | 5259-04LC | |
| RapidOut DNA Removal Kit | Thermo Scientific | K2981 | |
| Recirculating Heated Water Bath | Lauda Brinkmann | RE-206 | |
| Traceable Platinum Ultra-Accurate Digital Thermometer | Fisher Scientific | 15-081-103 | |
| TRIzol Reagent | Invitrogen | 15596026 | RNA isolation reagent |
| TurboMix Attachment | Scientific Industries | SI-0564 | |
| Vortex-Genie 2 | Scientific Industries | SI-0236 |
Références
- Guisbert, E., Morimoto, R. I. The regulation and function of the heat shock response. Protein Quality Control in Neurodegenerative Diseases. , 1-18 (2013).
- Li, J., Chauve, L., Phelps, G., Brielmann, R. M., Morimoto, R. I. E2F coregulates an essential HSF developmental program that is distinct from the heat-shock response. Genes and Development. 30 (18), 2062-2075 (2016).
- Hsu, A. L., Murphy, C. T., Kenyon, C. Regulation of aging and age-related disease by DAF-16 and heat-shock factor. Science. 300 (5622), 1142-1145 (2003).
- Morley, J. F., Morimoto, R. I. Regulation of longevity in Caenorhabditis elegans by heat shock factor and molecular chaperones. Molecular Biology of the Cell. 15 (2), 657-664 (2004).
- Labbadia, J., Morimoto, R. I. Repression of the Heat Shock Response Is a Programmed Event at the Onset of Reproduction. Molecular Cell. 59 (4), 639-650 (2015).
- Link, C. D., Cypser, J. R., Johnson, C. J., Johnson, T. E. Direct observation of stress response in Caenorhabditis elegans using a reporter transgene. Cell Stress & Chaperones. 4 (4), 235 (1999).
- Guisbert, E., Czyz, D. M., Richter, K., McMullen, P. D., Morimoto, R. I. Identification of a Tissue-Selective Heat Shock Response Regulatory Network. PLoS Genetics. 9 (4), 1-12 (2013).
- Ma, J., et al. Cellular Proteomes Drive Tissue-Specific Regulation of the Heat Shock Response. G3: Genes, Genomes, Genetics. 7 (3), 1011-1018 (2017).
- Mendenhall, A. R., et al. Expression of a single-copy hsp-16.2 reporter predicts life span. Journals of Gerontology - Series A Biological Sciences and Medical Sciences. 67 (7), 726-733 (2012).
- Stiernagle, T. Maintenance of C. elegans. WormBook. (1999), 1-11 (2006).
- Avery, L., You, Y. J. C. elegans feeding. WormBook: The Online Review of C. elegans Biology. , 1-23 (2012).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method. Methods. 25 (4), 402-408 (2001).
- Rea, S. L., Wu, D., Cypser, J. R., Vaupel, J. W., Johnson, T. E. A stress-sensitive reporter predicts longevity in isogenic populations of Caenorhabditis elegans. Nature Genetics. 37 (8), 894-898 (2005).
- Shiu, P. K., Hunter, C. P. Early Developmental Exposure to dsRNA Is Critical for Initiating Efficient Nuclear RNAi in C. elegans. Cell Reports. 18 (12), 2969-2978 (2017).
- Zevian, S. C., Yanowitz, J. L. Methodological considerations for heat shock of the nematode Caenorhabditis elegans. Methods. 68 (3), 450-457 (2014).
- Clark, D. A., Biron, D., Sengupta, P., Samuel, A. D. T. The AFD sensory neurons encode multiple functions underlying thermotactic behavior in Caenorhabditis elegans. Journal of Neuroscience. 26 (28), 7444-7451 (2006).
- Prahlad, V., Cornelius, T., Morimoto, R. I. Regulation of the cellular heat shock response in Caenorhabditis elegans by thermosensory neurons. Science. 320 (5877), 811-814 (2008).
- McColl, G., et al. Insulin-like signaling determines survival during stress via posttranscriptional mechanisms in C. elegans. Cell Metabolism. 12 (3), 260-272 (2010).
- Douglas, P. M., et al. Heterotypic Signals from Neural HSF-1 Separate Thermotolerance from Longevity. Cell Reports. 12 (7), 1196-1204 (2015).
- Kourtis, N., Nikoletopoulou, V., Tavernarakis, N. Small heat-shock proteins protect from heat-stroke-associated neurodegeneration. Nature. 490 (7419), 213-218 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon