Method Article
قياس حجم عفوية Ca2 + التدفقات وآثارها المصب في الخلايا العصبية الماوس الأولية Midbrain
In This Article
Summary
هنا نقدم بروتوكول لقياس في المختبر Ca2 + التدفقات في الخلايا العصبية في منتصف البران وآثارها على مجرى النهر caspase -3 باستخدام الثقافات الأولية منتصف الماوس. يمكن استخدام هذا النموذج لدراسة التغيرات الفيزيائية الباثولوجية المتعلقة بنشاط Ca2+ غير طبيعي في الخلايا العصبية في منتصف البران ، ولفحص العلاجات الجديدة للخصائص المضادة للاختصاص.
Abstract
مرض باركنسون (PD) هو اضطراب عصبي مدمر ناجم عن انحطاط الخلايا العصبية الدوبامينية (DA). الإفراط في Ca2+ تدفق بسبب تنشيط غير طبيعي من نتائج مستقبلات الغلوتامات في دا excitotoxicity وقد تم تحديدها كآلية هامة لفقدان الخلايا العصبية DA. في هذه الدراسة، نقوم بعزل الخلايا العصبية في منتصف القرنية، وننفصل عنها، ونتفثها عن التنفيس البطني للماوس (VM) من أجنة الماوس ED14. ثم نصيب الثقافات منتصف الماوس الأولية على المدى الطويل مع فيروس مرتبط أدينو (AAV) التعبير عن مؤشر الكالسيوم المشفرة وراثيا، GCaMP6f تحت سيطرة المروج العصبية البشرية محددة، hSyn. باستخدام التصوير confocal الحية، ونحن نظهر أن الخلايا العصبية منتصف منتصف الماوس مثقف عرض عفوية Ca2+ التدفقات التي تم الكشف عنها من قبل AAV-hSyn-GCaMP6f. حمام تطبيق الغلوتامات لثقافات منتصف البراري يسبب ارتفاعات غير طبيعية في داخل الخلايا كاليفورنيا2 + داخل الخلايا العصبية ويرافق هذا من قبل كاسباس-3 التنشيط في الخلايا العصبية DA, كما يتضح من الكبت المناعي. تقنيات لتحديد المبرمج الغلوتامية بوساطة في الخلايا العصبية DA الماوس الأولية لها تطبيقات هامة لفحص المحتوى العالي من الأدوية التي تحافظ على صحة الخلايا العصبية DA.
Introduction
مرض باركنسون (PD) هو ثاني أكثر الاضطرابات العصبية شيوعا في جميع أنحاء العالم، مع عدم وجود علاج معروف. وتشير التقديرات إلى أن انتشار داء الإيدز سوف يستمر في الزيادة ومن المتوقع أن يتجاوز مليون تشخيص بحلول عام 2030 في الولايات المتحدة وحدها1. مع عدد قليل من العلاجات الفعالة المتاحة حاليا لمكافحة PD، وهناك حاجة ملحة لتطوير علاجات أكثر فعالية. يتميز PD بالفقدان السريع والتقدمي للدوبامين في منتصف الفقر (DA) الخلايا العصبية2. الآليات التي تكمن وراء التنكس العصبي في PD غير مفهومة بشكل جيد. وتشير الأدلة إلى احتمال وجود تقارب بين آليات متعددة، مثل الإجهاد التأسدي والخلل الوظيفي الميتوكوندريا، وما إلى ذلك التي تسهم في بدء الشلالات الإشارات المبرمجة وموت الخلايا في نهاية المطاف3.
واحدة من هذه الآلية متقاربة، وقد تورط الغلوتامات بوساطة exciticicity في أمراض الأعصاب متعددة، بما في ذلك PD4. في حين يعتقد أن السمية الغلوتامية بوساطة الغلوتامات تعمل بشكل رئيسي من خلال تحفيز مستقبلات NMDA عبر زيادة مفرطة في تركيز Ca2+ داخل الخلايا وبدء المبرمج في نهاية المطاف ، Ca2 +- مستقبلات AMPA - نفاذية تورطت أيضًا في استجابة السامة5،6،7. ولذلك، فمن المهم تحديد مساهمة مستقبلات AMPA إلى المبرمج الغلوتامي بوساطة داخل نموذج PD. ويمكن تحقيق ذلك باستخدام NBQX، و أمبا وحاصرة القيات، والتي في تركيزات micromolar انتقائي لمستقبلات AMPA8. إن السمية الغلوتامية والإشارات التعاقبية اللوائية هي هدف مثالي في المصب لقياس مدى موت الخلايا، وهدف محتمل للتدخل العلاجي. لذلك، فإن تطوير طريقة عالية المحتوى لتقييم تعديل الغلوتامات بوساطة نشاط الكالسيوم وما يرتبط به من إشارات المصب في الخلايا العصبية المتوسطة البطنية الأولية (VM) سيكون ذا قيمة لفحص طرق العلاج الجديدة على قدرتها على الحفاظ على صحة الخلايا العصبية.
هنا، وضعنا بروتوكولاً نعبر فيه عن مؤشر الكالسيوم المشفر وراثياً (GECI)، GCaMP6f، باستخدام AAV2/5 مع نقطة الاشتباك العصبي البشرية (hSyn) لتعزيز قياس نشاط Ca2+ من الخلايا العصبية الأولية للماوس VM استجابة لتطبيق الغلوتامات الذي يمكن قياسه على المستوى الفسيولوجي والجزيئي. يمكن تكييف هذا الفحص عالي المحتوى لاكتشاف المستحضرات الصيدلانية أو العلاجات التي تعدل نشاط Ca2+ للحفاظ على صحة الخلايا العصبية VM. نقترح أن هذا النموذج الثقافة الأولية هو وسيلة فعالة لفحص تدخلات PD جديدة، على أساس قدرتها على الحفاظ على صحة الخلايا العصبية VM والتخفيف من تطور PD.
Protocol
وقد تمت الموافقة على جميع الإجراءات التي تنطوي على استخدام رعايا الحيوانات من قبل جامعة تكساس A & M لجنة الرعاية الحيوانية المؤسسية واستخدام (25نوفمبر 2019; AUP# 2019-0346).
ملاحظة: ينبغي أن يتم إعداد حلول زراعة الخلايا باستخدام إجراء معقمة في خزانة السلامة البيولوجية وتصفيتها عند 0.2 ميكرومتر لمنع التلوث.
1. إعداد الحلول و الوسط الثقافي
- إعداد محلول طلاء اللامينيين عن طريق تخفيف 20 ميكرولتر من 1 ملغ/مل مخزون اللامينين في 2 مل من المقطر العقيم H2O. إعداد في يوم تشريح.
- إعداد 10٪ equine (الحصان) مصل (ES) وقف الحل عن طريق إضافة 5 مل من ES إلى 45 مل من 1x هانك حل الملح المتوازن (HBSS). مرشّح معقم باستخدام نظام تصفية 0.2 ميكرومتر أو طرف مرشح الحقن. يُخزن عند 4 درجة مئوية.
- إعداد 4٪ البوفين المصل الألبومين (BSA) حل الأسهم عن طريق إضافة 2 غرام من مسحوق BSA إلى 1x الفوسفات المخزنة المالحة (PBS) وبذلك إلى حجم النهائي من 45 مل. مرشّح معقم باستخدام نظام تصفية 0.2 ميكرومتر أو طرف مرشح الحقن. يُخزن عند 4 درجة مئوية.
- تحضير محلول الأسهم papain عن طريق تخفيف papain إلى 3 ملغ / مل في 1x HBSS. مرشّح معقم باستخدام نظام تصفية 0.2 ميكرومتر أو طرف مرشح الحقن. يُخزن عند -20 درجة مئوية.
- إعداد deoxyribonuclease (DNase) حل بإضافة 20 ملغ من مسحوق DNase إلى العقيمة H2O وبذلك إلى حجم النهائي من 20 مل. مرشّح معقم باستخدام نظام تصفية 0.2 ميكرومتر أو طرف مرشح الحقن. يُخزن عند -20 درجة مئوية.
- إعداد حمض الاسكوربيك حل المخزون بإضافة 352 ملغ من حمض الاسكوربيك إلى معقم المقطر H2O وبذلك إلى حجم النهائي من 20 مل. الحرارة في 37 درجة مئوية حمام لتذوب إذا لزم الأمر. مرشّح معقم باستخدام نظام تصفية 0.2 ميكرومتر أو طرف مرشح الحقن. يُخزن عند -20 درجة مئوية.
- إعداد خلية ثقافة المتوسطة عن طريق إضافة ما يلي إلى 50 مل من المتوسط العصبي: 500 ميكرولتر من الجلوتاماكس (100x)، 500 ميكرولتر مصل الخيول، 1 مل من B-27، 100 ميكرولتر من حمض الاسكوربيك، 500 ميكرولتر من البنسلين-ستريبتوميسين، 50 ميكرولتر من الكاناميسين و50 ميكرولتر من الأمبيسيلين. مرشّح معقم باستخدام نظام تصفية 0.2 ميكرومتر. يُخزن عند 4 درجة مئوية.
- إعداد 0.01٪ تريتون X-100 الحل عن طريق إضافة 1 مل من تريتون X-100 في 9 مل من 1X PBS لجعل حل 10٪. كما تريتون X-100 هو لزج، ماصة ببطء للسماح تلميح لملء تماما. الحرارة في 37 درجة مئوية حمام لتذوب إذا لزم الأمر. يُخزن عند 4 درجة مئوية.
- لتخفيف 10٪ الأسهم تريتون X-100 إلى 0.01٪، أداء 3 3 تخفيفات المسلسل 1:10. تمييع 1 مل من 10% الأسهم في 9 مل من 1X PBS لجعل 1% حل. تمييع 1 مل من 1% حل في 9 مل من 1X PBS لجعل 0.1% حل. تمييع 1 مل من 0.1% حل في 9 مل من 1X PBS لجعل حل 0.01٪.
- إعداد 10٪ و 1٪ مصل الماعز العادي (NGS) حل عن طريق إضافة 1 مل من NGS إلى 9 مل من 1X PBS لمحلول 10٪. إضافة 100 μL من NGS إلى 9.9 مل من 1X برنامج تلفزيوني لجعل 1٪ حل.
- إعداد محلول الأسهم الغلوتامات (100 مل) عن طريق إضافة 735 ملغ من L (+)-حمض الجلوتاميك إلى معقم المقطر H2O وتقديم إلى حجم النهائي من 50 مل. الذوبان في هذا التركيز ستكون قضية. إن إضافة كميات صغيرة (100 ميكرولتر) من حمض الهيدروكلوريك 1 M كافية لزيادة القابلية للذوبان.
- إعداد NBQX حل الأسهم (10 مل م) عن طريق إضافة 50 ملغ من NBQX إلى معقم المقطر H2O وتقديم إلى حجم النهائي من 13 مل.
2. إعداد أطباق الثقافة وأغطية (القيام به في اليوم السابق للتشريح)
ملاحظة: لقد وجدنا أن الجمع بين ثلاثة وكلاء الطلاء، بولي-L-ليسين، بولي-L-ornithine، ولامينين يسمح للتصاق الخلية المثالي والقدرة على البقاء.
- ضع 10 أطباق بيتري مقاس 35 مم في خزانة السلامة البيولوجية. ضع اثنين من الأغطية الدائرية 12 مم في كل طبق وملء مع EtOH 70٪ لمدة 10 دقيقة. استخدم خط فراغ لتبخر EtOH المتبقية من كل طبق، مما يسمح لـ EtOH بالتبخر تمامًا.
- Pipette ~ 90-100 μL من 0.1٪ بولي-L-lysine الحل على كل غطاء، والتأكد من أن يغطي كامل مغطى من قبل حل بولي L-ليسين. غطي الأطباق بالأغطية ووضعها في حاضنة 37 درجة مئوية لمدة ساعة.
- التعرق المتبقية بولي-L-ليسين حل من كل غطاء وشطف مع عقيم H2O.
- كرر الخطوات 2.2 - 2.3 مع 0.1٪ بولي-L-أورنيثين الحل.
- مرة أخرى، كرر الخطوات 2.2 - 2.3 مع محلول لامينين 0.01٪. ضع في حاضنة CO2 37 درجة مئوية/5% حتى تصبح جاهزة لطلاء الخلايا في اليوم التالي.
3. تشريح الجنينية الماوس
ملاحظة: نستخدم ما بين 4 إلى 6 فئران حامل في الوقت المناسب لكل ثقافة. في حين أن الكثير من عملية التشريح تحدث خارج خزانة السلامة البيولوجية ، إلا أنه لا يزال من المهم الحفاظ على إجراء معقم. الاستخدام الوفير لـ EtOH 70% على الأسطح بالقرب من مجهر التشريح وعلى الأدوات الجراحية مثالي. كما يمكن ارتداء قناع أثناء التشريح لمنع التلوث. بالإضافة إلى ذلك، نستخدم 4 مضادات حيوية منفصلة في الوسط الثقافي، لذلك من غير المرجح أن يكون التلوث. ومع ذلك، إذا كان استخدام المضادات الحيوية هو إشكالية، يمكن نقل هذا الإعداد تشريح داخل غطاء معقمة. للحفاظ على صلاحية الخلية يجب أن تكون جميع حلول التشريح مبردة مسبقًا عند 4 درجات مئوية ، ويجب إكمال التشريح في أسرع وقت ممكن. نحن لا نقوم بالتشريح على الجليد. طريقة تشريح الخلايا العصبية منتصف منتصف الجنينية الماوس مطابق للأساليب الموصوفة سابقا9,10.
- إعداد مساحة على مقاعد البدلاء بالقرب من مجهر تشريح مع وسادة ماصة ورذاذ بتحرر مع ETOH 70٪.
- رش اثنين من 100 × 15 مم الزجاج الأطباق بيتري واحد 50 × 10 مم الزجاج طبق بيتري مع 70٪ EtOH والسماح EtOH لتتبخر. بمجرد تبخرها، ضع 50 مل من 1x HBSS معقمة في كل طبق بيتري 100 × 15 مم.
- غمر مقص الجراحية، ملقط، وشفرة microtome في EtOH 70٪ لمدة 10 دقيقة كحد أدنى لتعقيم. ضع أدوات على وسادة ماصة لتجف.
- باستخدام CO2 تليها خلع عنق الرحم، والقتل الرحيم 2-3 فئران الحمل من العمر 2-3 أشهر من العمر في اليوم الجنيني 14.
- رش البطن من الفئران القتل الرحيم مع EtOH 70٪ . باستخدام ملقط انتزاع أسفل البطن وفتح تجويف البطن باستخدام مقص الجراحية. ابدأ في القطع بالقرب من المكان الذي تمسك فيه ملقط البطن، مما يجعل الجروح الجانبية على كل جانب حتى يمكن طي جدار البطن مرة أخرى والرحم مرئيًا بوضوح.
- باستخدام مقص الجراحية، وقطع طرفي قرن الرحم. ثم إزالة الرحم ووضع في طبق بيتري مع 1x HBSS.
- باستخدام ملقط مستقيم الرأس إزالة بعناية الأجنة من الرحم. اترك الأجنة في HBSS طوال هذه العملية. باستخدام إما ملقط أو شفرة microtome، قطع الرأس الأجنة بسرعة عن طريق قطع بالقرب من الرقبة. جعل مستوى خفض ممكن.
- تحت مجهر تشريح، نقل رئيس الجنين إلى طبق بيتري الجاف 50 مم ووضع على الجانب البطني. تحقيق الاستقرار في الرأس مع ملقط عن طريق وضع واختراق بالقرب من العينين / خطم. يجب أن تكون الزوايا الزاوية إلى أسفل في ~ 45 درجة لتجنب اختراق الوسين.
- باستخدام ملقط في اليد الأخرى، وإزالة بعناية طبقة شفافة من الجلد والجمجمة قبل التلال البارزة من الوسين. تبدأ بالقرب من خط الوسط وإزالة الجلد والجمجمة caudally حتى يتم كشف الزيخة تماما.
- عقد ملقط عمودي على الزين تعرض مع طرف واحد بين القشرة والوسط والآخر بالقرب من المخيخ. اضغط لأسفل وقرص ملقط معا لإزالة منتصف كامل. يجب أن يكون الجزء المتوسط حوالي 0.5 مم سميكة. ضع الجزء المتوسط في طبق بيتري الثاني المليء بـ HBSS الطازج. كرر هذه العملية لكل جنين.
- باستخدام مجهر التشريح، ضع جزء الدماغ مع الجانب البطني الذي يواجهك. إذا كانت السحاية لا تزال تعلق، إزالته بعناية عن طريق الاستيلاء مع ملقط ورفع صعودا وبعيدا عن الجزء الدماغ.
- يجب أن يكون الجزء الدماغي 4 أرباع مرئية. ضع الجزء بطريقة يتم وضع الربعين الأصغرين فوق الربعين الأكبر. هناك سلسلة بارزة تفصل بين الربعين (الصغير) العلويين من الربعين السفليين (الكبيرين).
- باستخدام قرصة ملقط وفصل الأرباع متفوقة من الأرباع أدنى، ومن ثم تجاهل الأرباع متفوقة. سوف الأرباع السفلية المتبقية لديها الأنسجة الزائدة بشكل جانبي على الجانب الظهري، وهذا النسيج سوف تبدو أقل غموضا من الأنسجة البطنية المتبقية. إزالة الأنسجة الظهرية أقل كثافة والتخلص. يجب أن يحتوي الجزء المتبقي على كل من Substantia nigra pars compacta (SNc) ومنطقة التظن البطيني (VTA).
- باستخدام ملقط قطع الجزء المتبقية من الأنسجة البطنية إلى 4 قطع أصغر واستخدام 1mL واسعة الماصات تتحمل نقل هذه الأجزاء في أنبوب مخروطي 15 مل مع 1X HBSS. الحفاظ على أنبوب مخروطي مع أجزاء الدماغ على الجليد طوال العملية.
- كرر هذه العملية لجميع أجزاء الدماغ المتبقية.
4. تفكك الخلايا
- هضم انزيمي للخلايا
- اضمّر بعناية HBSS من أنبوب مخروطي 15 مل يحتوي على شرائح منتصف الفقرات، تاركاً الأجزاء في الجزء السفلي من الأنبوب.
- إضافة ~ 800 μL من محلول باباين إلى أنبوب ومكان في حاضنة 37 درجة مئوية لمدة 7 دقائق. خلايا إعادة الخفقان عن طريق نفض الغبار الأنبوب واستبدالها إلى حاضنة 37 درجة مئوية لمدة 7 دقائق إضافية.
- مع غيض من ماصة 1 مل واسعة تتحمل إزالة فقط شرائح منتصف في aliquot 1 مل من DNase. السماح للشرائح للوصول إلى الجزء السفلي من aliquot أو حوالي 1 دقيقة من التعرض.
- مع غيض من ماصة 1 مل واسعة تتحمل إزالة فقط شرائح منتصف في أنبوب مخروطي 15 مل تحتوي على 2 مل من وقف الحل. السماح للأجزاء لتسوية في الجزء السفلي من الأنبوب وتكرار شطف في أنبوب مخروطي إضافي مملوءة وقف الحل.
- التثاب الميكانيكي من تعليق الخلية
- في أنبوب شطف محلول التوقف الثاني ، باستخدام طرف ماصة 1 مل واسع ، الماصات الخلايا صعودا وهبوطا 10 مرات حتى لا تكون هناك أجزاء كبيرة من الأنسجة مرئية. من المهم تجنب التثاقل أكثر من لتحلل الخلية الحد الأدنى.
- ببطء ماصة 300 ميكرولتر من 4٪ BSA حل إلى الجزء السفلي من أنبوب مخروطي 15 مل تحتوي على أجزاء الدماغ. قم بإزالة طرف الماصات بعناية للحفاظ على طبقة تعليق. جهاز طرد مركزي عند 0.4 x ز لمدة 3 دقائق. ثم بعناية التعرق والخلايا resuspend في 400 μL من خلية ثقافة المتوسطة.
5. طلاء الخلايا
ملاحظة: بناءً على الخبرة، يتم جمع حوالي 100,000 خلية قابلة للحياة لكل جنين. 2-3 الشهر فئران الحمل القديمة عادة ما يكون حجم القمامة من 8-10 أجنة; لذلك، تقدير تقريبي لمجموع العائد من الخلايا لكل فأرة حامل موقوتة هو حوالي 1 مليون خلية.
- باستخدام مقياس الهيموسيتفورم العد خلية ومن ثم تخفيف التعليق إلى 2000 الخلايا / μL باستخدام خلية ثقافة المتوسطة. Triturate لفترة وجيزة لخلط.
- إزالة الأغطية مع حل اللامينيين من الخطوة 2 من الحاضنة وpirate محلول اللامينين المتبقية من الأغطية المغلفة باستخدام فراغ. لوحة بسرعة لتجنب الأغطية من التجفيف تماما. Pipette 100 μL (2.0 × 105 الخلايا / الأغطية) على كل غطاء ووضع أطباق بيتري في ح ح ح 37 درجة مئوية.
- إضافة بعناية 3 مل من خلية ثقافة المتوسطة لكل طبق ووضع مرة أخرى في حاضنة 37 درجة مئوية. يتغير نصف متوسطة الشكل نصف 2 مرات في الأسبوع لمدة 2 أسابيع.
6. عدوى من ثقافة الخلية في 14 DIV مع ناقلات الفيروسية المرتبطة أدينو (AAV)
- لكل طبق إعداد 1 مل من مصل الدم الحرة DMEM المتوسطة مع 1 ميكرولتر من hSyn-GCaMP6f AAV (1.0 × 1013 titer)
- التعرق متوسطة ثقافة الخلية من كل طبق واستبدالها ب 1 مل من دمه الحرة المصل التي تحتوي على hSyn-GCaMP6f. ضع الأطباق مرة أخرى في حاضنة 37 درجة مئوية لمدة ساعة.
- التعرق المصل المتوسطة الحرة التي تحتوي على AAVs واستبدالها مع 3 مل من خلية ثقافة المتوسطة. ضع الأطباق مرة أخرى في حاضنة 37 درجة مئوية. لقد وجدنا أن 5-7 أيام من عدوى AAV يسمح لمستويات مثالية من التعبير GCaMP. الاستمرار في تغيير المتوسطة كل 2-3 أيام طوال هذه الفترة من العدوى الفيروسية.
7. يعيش confocal Ca2 + التصوير بين 19-21 DIV
ملاحظة: كما هو مذكور في الخطوة 6.3، يمكن القيام التصوير بين 5-7 أيام بعد العدوى الفيروسية. هذا هو الإطار المثالي لتحقيق التعبير المرئي من الفلوروهور على المستويات التي تسمح للكشف عن النشاط التلقائي Ca2+ .
- إعداد مخازن التسجيل المؤقتة
- لجعل 1 L من العازلة تسجيل HEPES، إضافة: 9.009 غرام من NaCl، 0.3728 غرام من كليل، 0.901 غرام من د-جلوكوز، 2.381 غرام من HEPES، 2 مل من 1 M CaCl2 حل الأسهم، و 500 μL من 1 M MgCl2 حل الأسهم إلى 800 مل من التقطير العقيم H2O. جلب إلى 7.4 مع NAOH. إحضار إلى حجم النهائي من 1 L.
- لجعل 200 مل من 20 ميكرومتر الغلوتامات تسجيل العازلة، وتمييع 40 ميكرولتر من 100 mM الغلوتامات الغلوتامات حل في 200 مل من HEPES تسجيل العازلة المذكورة أعلاه.
- لجعل 200 مل من 10 μM NBQX العازلة تسجيل، وتمييع 200 ميكرولتر من 10 مل NBQX حل الأسهم في 200 مل من HEPES تسجيل العازلة.
- التصوير Confocal
- ملء طبق معقمة 35 ملم بيتري مع 3 مل من العازلة تسجيل.
- إزالة طبق بيتري 35 ملم مع الثقافات المصابة من حاضنة 37 درجة مئوية. باستخدام ملقط تلميح غرامة، والاستيلاء بعناية على حافة واحد coverslip ونقلها بسرعة إلى طبق بيتري مليئة المخزن المؤقت التسجيل. ضع الغطاء المتبقي في وسط الظهر في حاضنة 37 درجة مئوية. نقل الطبق مع العازلة تسجيل إلى المجهر confocal.
- بدء تشغيل برنامج التصوير. تابع إلى الخطوة التالية أثناء تهيئة.
- بدء المضخة ال peristaltic ووضع الخط في المخزن المؤقت للتسجيل. معايرة سرعة تدفق لتكون 2 مل / دقيقة.
- نقل الأغطية المصابة من طبق بيتري 35 مم إلى حمام التسجيل.
- باستخدام 10x المياه الغمر الهدف وBF الخفيفة، والعثور على الطائرة من التركيز والبحث عن منطقة ذات كثافة عالية من الخلايا العصبية الأجسام. التبديل إلى 40x هدف غمر المياه واستخدام ضوء BF إعادة التركيز على العينة.
- في إطار "قائمة الأصباغ" داخل FluoView حدد AlexaFluor 488 وتطبيقه.
- يمكن أن يكون تعبير AAV متغيرًا؛ يمكن أن يكون تعبير AAV متغيرًا؛ لذلك ، من أجل منع التعرض المفرط والضوء من الفلوروفوريس ، تبدأ مع إعدادات الطاقة HV والليزر منخفضة. بالنسبة لقناة AlexaFluor 488، قم بتعيين الجهد العالي (HV) إلى 500، والمكسب إلى 1x، وعوض إلى 0. لخط الليزر 488 تعيين السلطة إلى 5٪. من أجل زيادة حجم فعال في الصورة ض- الطائرة، وزيادة حجم الثقب إلى 300 μm. استخدم خيار المسح "التركيز x2" لضبط إشارات الانبعاثات على النحو الأمثل مع مستويات التشبع دون. من هنا، يمكن ضبط الإعدادات حتى يتم تحقيق رؤية مثالية لكل قناة.
ملاحظة: لالتقاط مجموعة كاملة من التدفقات2+ كاليفورنيا بدقة مع GCaMP، ضبط خط الأساس HV وإعدادات الطاقة بالليزر من أجل السماح لزيادة في كثافة الفلورسنت دون الإفراط في الإفراط في الكاشف. - بمجرد تحسين إعدادات المجهر، نقل المرحلة من أجل تحديد موقع منطقة مع خلايا متعددة عرض التغييرات التلقائية في الفلورس GCaMP6f والتركيز على الطائرة المطلوبة للتصوير.
- استخدم أداة "مُقَلّب" لقص إطار التصوير إلى حجم يمكنه تحقيق فاصل إطاري أقل من ثانية. هذا ضروري لتعيين الفاصل الزمني للتصوير على 1 إطار في الثانية.
- تعيين إطار "الفاصل الزمني" إلى قيمة 1.0 و إطار "Num" إلى 600.
ملاحظة: من أجل تقديم مخازن تسجيل مختلفة في الوقت المطلوب نقطة (300 s)، من المهم معايرة الكمون من مضخة لتقديم الحل الجديد إلى الحمام. هذا سوف يكون اعتمادا على معدل ضخ الحل (2 مل / دقيقة) وطول الخط المستخدم في ضخ الحل. - لالتقاط فيلم t-series حدد الخيار "الوقت" ثم استخدم خيار المسح الضوئي "XYt" لبدء التصوير.
- شاهد شريط تقدم التصوير وحرك الخط من مخزن تسجيل HEPES إلى مخزن تسجيل الغلوتامات 20 ميكرومتر في الوقت المناسب (على سبيل المثال، إذا تم معايرة الكمون من المضخة لتقديم محلول في 60 s، قم بتحريك الخط إلى مخزن الغلوتامات في 240 إطارًا من أجل تقديم الغلوتامات عند 300 s).
- عند اكتمال التصوير، حدد الزر سلسلة تم وحفظ الفيلم النهائي سلسلة t. الاستمرار في 20 μM الغلوتامات لمدة 5 دقائق إضافية, بحيث الخلايا العصبية المستزرعة قد تعرضت للغلوتامات لما مجموعه 10 دقيقة. كرر هذه العملية لكل غطاء إلى صورة.
- بعد التعرض الإضافي لمدة 5 دقائق إلى 20 ميكرومتر غلوتامات، قم بإزالة الغطاء من الحمام واعيد وضعه مرة أخرى إلى طبق Petri 35 مم الذي يحتوي على مخزن تسجيل مؤقت حتى يكتمل يوم التصوير. عند الانتهاء، انتقل إلى الخطوة 8.
- Ca2+ تحليل التتبع
- إجراء تحليل الصور في ImageJ. تثبيت البرنامج المساعد BIO-FORMATS لـ ImageJ، والتي سوف تسمح . OIB ملفات الصور لفتح.
- في شريط أدوات ImageJ، انقر على تحليل | قم بتعيين القياسات، وحدد المربع لقيمة متوسطة رمادية (MGV).
- في ImageJ، افتح فيلم t-series كـ كومة هايبرك.
- اسحب شريط التمرير للفيلم وتحديد الإطار مع أقصى استجابة الغلوتامات لتصور جميع الخلايا العصبية التي تستجيب للغلوتامات. استخدام أداة المضلع لتتبع جميع الخلايا العصبية مرئية الهيئات ، مضيفا ROIs الخاصة بهم إلى "مدير ROI" قائمة.
- عند الانتهاء من تتبع وإضافة ROIs، حدد كل ROIs داخل إطار مدير ROI واستخدم التحديد متعدد القياس في قائمة المزيد من الخيارات. نسخ هذه البيانات ولصقها في جدول بيانات. أكمل هذه العملية ليتم تحليل كافة الأفلام.
- لكل عائد استثمار، قم بتحويل بيانات MGV الخام من كل إطار إلى قيم ΔF/F0 باستخدام المعادلة: ΔF/F0 = [F(t) – F0]/ F0. حيث F(t) = MGV من أي إطار معين، و F0 = متوسط MGV خط الأساس من ~ 10 إطارات حيث لا يوجد تدفق Ca2+ .
- باستخدام برنامج إحصائي مثل OriginPro 2020، يمكن تحويل آثار ΔF/F0 إلى رسومات بيانية. يمكن استخدام وظيفة "ذروة محلل" (أو وظيفة مماثلة إذا كان استخدام برنامج مختلف) لقياس ذروة اتساع استجابة الغلوتامات، الكمون للاستجابة للغلوتامات، والمساحة تحت المنحنى.
8- الكبت المناعي للثقافات
ملاحظة: بعد التثبيت مع formalin، يمكن تخزين الأغطية في 1X PBS في 4 درجة مئوية حتى تصبح جاهزة للمعالجة للمناعة. تم حضانة الأجسام المضادة الأولية والثانوية بطريقة متسلسلة ، حيث أن مثل هذه الحضانة مع الأجسام المضادة مضادة لـ Caspase-3 والأجسام المضادة الثانوية التكميلية سبقت الحضانة بالجسم المضاد المضاد للثث TH والأجسام المضادة الثانوية التكميلية.
- مباشرة بعد التعرض للغلوتامات، ضع الغطاء مرة أخرى في طبقه بيتري 35 مم، وpirate المخزن المؤقت للتسجيل، وإضافة 3 مل من 10٪ formalin. اسمحوا الجلوس لمدة 40 دقيقة في درجة حرارة الغرفة (RT).
- شطف الطبق 3 مرات مع 1X PBS.
- التعرق في برنامج تلفزيوني والخلايا permeabilize في 1 مل من 0.01٪ تريتون X-100 في برنامج تلفزيوني لمدة 2 دقيقة.
- شطف الطبق 3 مرات مع 1X PBS.
- التعرق في برنامج تلفزيوني وكتلة الخلايا في 1 مل من 10٪ NGS في برنامج تلفزيوني لمدة 40 دقيقة.
- شطف الطبق 3 مرات مع 1X PBS.
- إضافة 1 ميكرولتر من الأرانب المضادة لكاسباس-3 الأجسام المضادة الأولية إلى 1 مل من 1٪ NGS في برنامج تلفزيوني (1:1000 تخفيف). سبيريت برنامج تلفزيوني من الطبق واستبدالها مع حل الأجسام المضادة الأولية. ضع على شاكر واحتضان لمدة 1.5 ساعة في RT.
- شطف الطبق 3 مرات مع 1X PBS.
- إضافة 1 ميكرولتر من الماعز المضادة للأرنب AlexaFluor 488 الأجسام المضادة الثانوية إلى 1 مل من 1٪ NGS في برنامج تلفزيوني (1:1000 تخفيف). سبيرت برنامج تلفزيوني من الطبق واستبدالها مع حل الأجسام المضادة الثانوية. ضع على شاكر واحتضان لمدة 1 ساعة في RT. المضي قدمًا حماية العينات من الضوء.
- شطف الطبق 3 مرات مع 1X PBS.
- كرر الخطوات 8.7 - 8.10، ولكن باستخدام الأجسام المضادة TH المضادة للدجاج (1:1000) في الخطوة 8.7 والماعز المضادة للدجاج AlexaFluor 594 الأجسام المضادة الثانوية (1:1000) في الخطوة 8.9.
- بعد شطف برنامج تلفزيوني النهائي، ضع 30 ميكرولتر من تركيب المتوسطة على شريحة المجهر. باستخدام ملقط انتزاع غطاء من طبق بيتري 35 مم ووضع غطاء مع الخلايا التي تواجه وصولا الى المتوسطة المتصاعدة. كلا الغطاءين سوف تناسب على شريحة مجهر واحد إذا وضعت بشكل صحيح. وضع في منطقة جافة، والظلام والسماح للتصاعد المتوسطة إلى الجافة بين عشية وضحاها.
9- التصوير الكونفوكالي للثقافات المثبطة للمناعة
- التصوير Confocal
- بدء تشغيل برنامج التصوير. ضع العينة على مرحلة المجهر.
- مع العدسة المجهر، وذلك باستخدام هدف التكبير 20x والضوء epifluorescent مع مرشح TRITC، والتركيز على العينة والبحث عن الجسم خلية TH + .
- بمجرد تحديد موقع جسم خلية TH + ، توسطه في مجال الرؤية ثم انتقل إلى هدف التكبير 60x.
- حدد صبغات AlexaFluor 488 و AlexaFluor 594 في نافذة "قائمة الصبغات".
- كما هو الحال مع التصوير المباشر، ابدأ بإعدادات طاقة الإضاءة المنخفضة HV، والمكاسب، والازاحة، والليزر لمنع التحسس الضوئي. استخدم خيار المسح الضوئي "focus x2" لتقييم شدة الفلورسنت لكل قناة وضبطها وفقًا لذلك. وبما أن هذه الصور سيتم تحديدها في وقت لاحق لكثافة الفلورسنت ، فمن الضروري الحفاظ على إعدادات التصوير متسقة عبر جميع مجالات الرؤية. لذلك، فمن الأفضل أن ننظر في أمثلة قليلة من كل شرط للحصول على فكرة عن مجموعة من كثافة الفلورسنت عبر العينات.
- بمجرد تحديد إعدادات التصوير المثالية، حدد خيار المسح الضوئي "التركيز x2" ونقل الخلية ذات الاهتمام إلى مركز مجال الرؤية. زيادة التكبير الرقمي إلى 3x باستخدام شريط التمرير "التكبير".
- باستخدام مقبض التركيز، العثور على مستوى التركيز مع ألمع التألق والتقاط صورة XY طائرة واحدة. حفظ الصورة إلى النهاية.
- الرجوع إلى هدف التكبير 20x للبحث عن خلية TH+ أخرى. كرر هذه العملية حتى يتم أخذ عينات من كل حالة من الخلايا المطلوبة.
- تحليل الصور
- في شريط أدوات ImageJ، انقر على تحليل | قم بتعيين القياسات، وحدد المربعات الخاصة بالمساحة والكثافة المتكاملة ويعني قيمة الرمادي.
- افتح صورة ككومة هايبركوم مع كل قناة مفصولة عن طريق السحب والإفلات في شريط أدوات ImageJ أو تحديد الصورة عبر قائمة الملفات.
- استخدام قناة TH (594 نانومتر) لرسم ROIs حول جسم الخلية. باستخدام أداة تتبع المضلع في ImageJ، تتبع عن كثب الحافة الخارجية للجسم الخلية. حيث المسافة بين غشاء الخلية ونواة الخلية هو أصغر، تتبع خط مستقيم من خلال السيتوسول إلى حافة النواة ومن ثم تتبع عن كثب مخطط النواة من أجل استبعاده. ثم تتبع خط مستقيم العودة إلى الغشاء الخارجي، على الحدود مع الخط الأولي بأكبر قدر ممكن، والاستمرار في اتباع الخطوط العريضة للجسم الخلية حتى اكتمال العائد على الاستثمار.
- استخدام اختصار لوحة المفاتيح "T" أو استخدام شريط الأدوات قائمة المسار تحليل | أدوات | مدير ROI، افتح مدير عائد الاستثمار وأضف عائد الاستثمار الذي تم سحبه للتو إلى القائمة.
- حدد نافذة قناة caspase-3 (488 نانومتر)، ثم حدد العائد على الاستثمار المضافة في قائمة "ROI Manager".
- في إطار مدير ROI، حدد الزر "قياس". ستظهر نافذة النتائج مع القياسات التي تم تعيينها مسبقًا. نسخ هذه إلى جدول بيانات وتكرار هذه العملية لكل خلية.
النتائج
بعد الزرع الأولي للخلايا، تعاملنا مع أطباق ثقافة VM في 14 DIV مع 1 ميكرولتر من AAV hSyn-GCaMP6f وسمح لمدة 5 أيام من التعبير الفيروسي. في يوم التصوير تم إعداد مخزن تسجيل HEPES حديثًا. استخدمنا شرطين; في شرط واحد تم تطبيق 20 μM الغلوتامات لمدة 10 دقيقة، بينما في حالة أخرى 5 دقيقة من 10 μM NBQX تطبيق يسبق 10 دقيقة تطبيق مشترك من 10 μM NBQX + 20 μM الغلوتامات. في كلتا الحالتين، لاحظنا تغييرات هيتيريوجينية وعفوية في الفلوريسنسي GCaMP6f، والتي تشير إلى تدفق Ca2+ عفوية، كما هو موضح في الآثار التمثيلية(الشكل 1A، B، فيلم تكميلية 1-2). تطبيق 20 μM الغلوتامات ولدت قوية ومستمرة Ca2 + استجابة في كل من الخلايا العصبية النشطة بشكل عفوي وsiescent(الشكل 1A, فيلم تكميلية 1). تطبيق 10 μM NBQX انخفاض النشاط التلقائي، وحجب جزئيا استجابة الغلوتامات(الشكل 1B، فيلم تكميلية 2). تم تحديد مدى تطبيق الغلوتامات التي حفزت استجابة Ca2+ في كل حالة كميا باستخدام المساحة تحت المنحنى، ذروة السعة، والكمون للاستجابة. وكانت كل من المنطقة تحت المنحنى والسعة الذروة مماثلة لكل من الغلوتامات و NBQX + الغلوتامات الظروف المعالجة (الشكل 1C) ، في حين زاد الكمون إلى الاستجابة بشكل كبير في NBQX + حالة الغلوتامات (الشكل 2A, B). بالإضافة إلى تحديد كمي استجابة Ca2+ لعلاج الغلوتامات ، قمنا بإصلاح عينات وملطخة مع جسم مضاد لـ caspase-3 كمقياس للتخثر المُوساطة بالغلوتامات. لاحظنا مجموعة من كاسباس-3 تفعيل عبر الظروف(الشكل 3A, B). تم تحديد كمية التنشيط Caspase-3 من خلال قياس المنطقة ويعني caspase-3 شدة. بالمقارنة مع خلايا التحكم غير المعالجة، فإن متوسط مساحة الخلايا مع تنشيط caspase-3 تحت الغلوتامات و NBQX + الغلوتامات تتجه نحو أهمية(الشكل 3B). وكان متوسط كثافة caspase-3 أعلى بكثير في الغلوتامات وNQX + الغلوتامات الظروف بالمقارنة مع الضوابط غير المعالجة(الشكل 3B). معا، هذه النتائج تظهر إطارا عالي المحتوى الذي يمكن قياس المبرمج الخلايا العصبية عن طريق قياس الردود على ca2+ العوامل السامة ومتابعتها مع تحليل الأحداث المبرمج المصبية المصبية المصبية مثل تنشيط caspase-3 في نفس المجموعة من الثقافات.
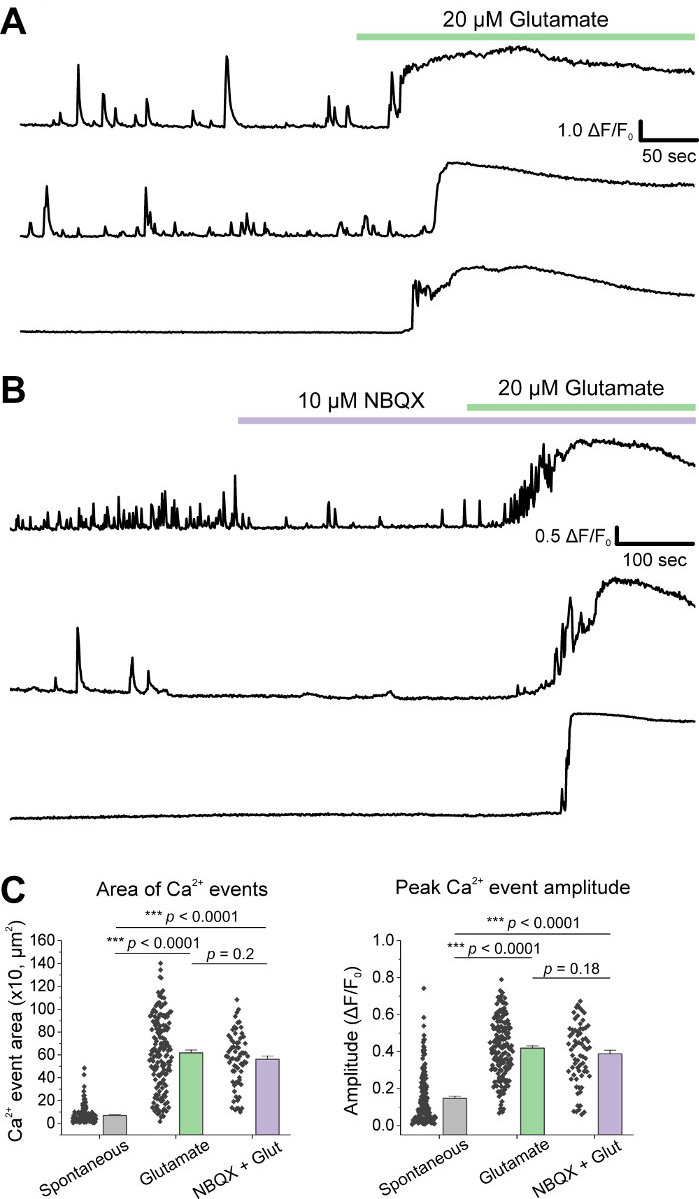
الشكل 1: الخلايا العصبية الزهنية فيترالي مثقف عرض عفوية Ca2 + النشاط وحفز بقوة من قبل تطبيق الغلوتامات. (A) آثار تمثيلية من النشاط التلقائي Ca2+ في الخلايا العصبية VM واستجابتها لتطبيق 20 μM الغلوتامات. (ب) آثار تمثيلية لنشاط Ca2+ العفوي في الخلايا العصبية VM واستجابتها لـ 10 μM NBQX + 20 μM الغلوتامات التطبيق. (ج)بيانات السكان التي تبين المنطقة تحت المنحنى وذروة السعة من آثار كاليفورنيا2+ . الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
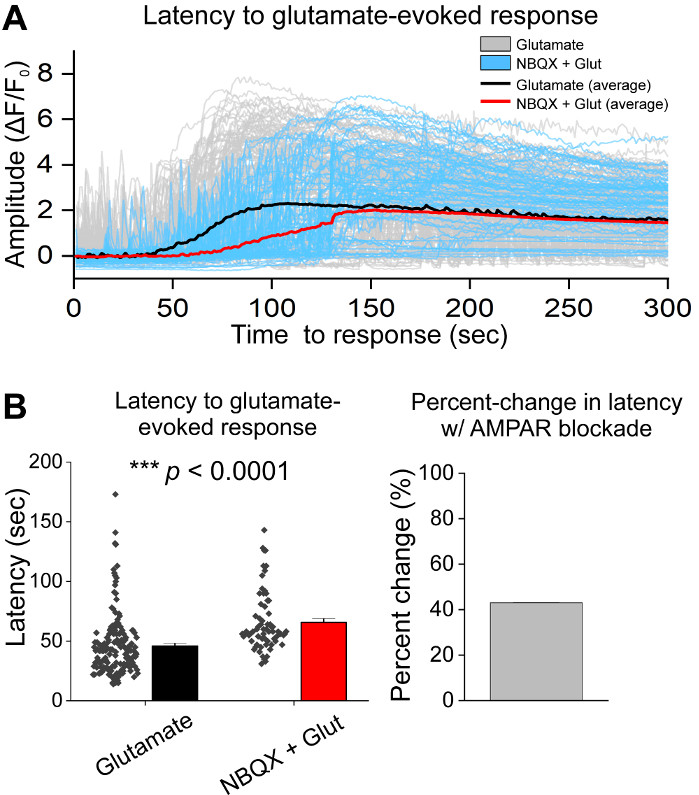
الشكل 2: AMPAR الحصار مع NBQX يؤخر الاستجابة لتطبيق الغلوتامات في الخلايا العصبية الزهن البطنية مثقف. (أ)ممثل Ca2+ آثار الغلوتامات (الرمادي) و NBQX + الغلوتامات (الأزرق) أثار الردود. متوسط كاليفورنيا2+ تظهر آثار الغلوتامات (أسود) و NBQX + الغلوتامات (الأحمر) مضاف. (ب) البيانات السكانية التي تظهر الكمون للاستجابة للغلوتامات و NBQX + الغلوتامات أثارت الاستجابات. يتم عرض نسبة التغير بين الغلوتامات و NBQX + الغلوتامات في اللوحة اليمنى. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
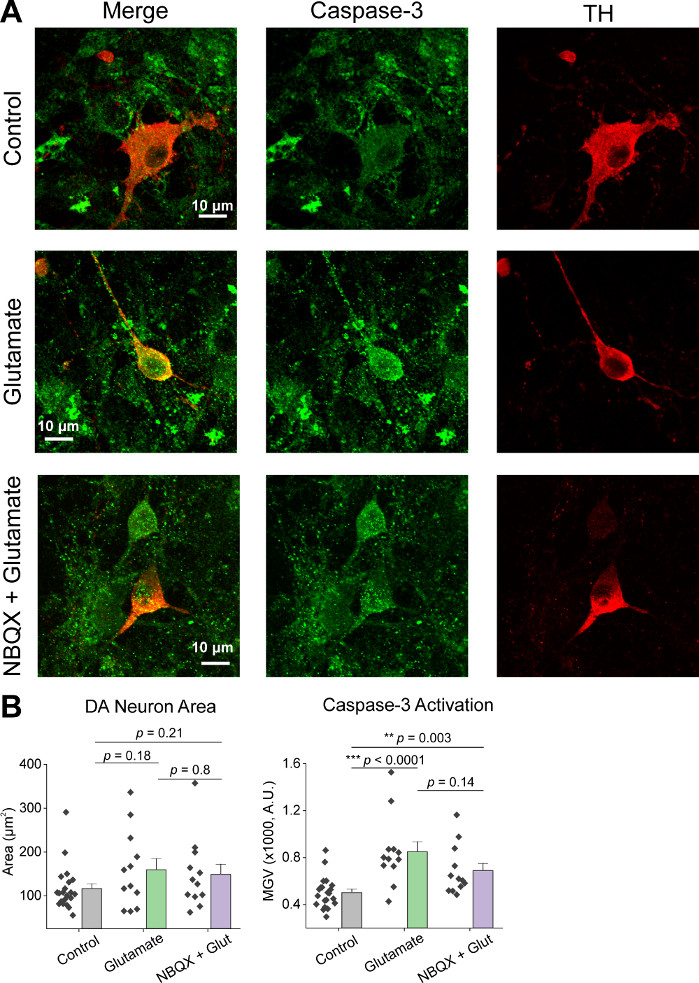
الشكل 3: تطبيق الغلوتامات يزيد من تعبير كاسباس-3 في التيروزين هيدروكسيلاس (TH) الخلايا العصبية المتوسطة البطنية الإيجابية. (أ)ممثل الصور confocal من الثقافات VM المثبطة لspase-3 (الأخضر) وTH (الأحمر)، شريط مقياس = 10 ميكرومتر. (ب) بيانات السكان تظهر منطقة الخلايا العصبية DA والقيمة الرمادية المتوسطة للتعبير كاسباس-3 في كل حالة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
فيلم تكميلي 1: عفوية Ca2+ النشاط والاستجابة لتطبيق الغلوتامات.
التلقائية Ca2+ التدفقات في وجود العازلة تسجيل HEPES (0-300 s) تليها تطبيق 20 μM الغلوتامات (301-600 s). شريط مقياس = 50 μm. الرجاء انقر هنا لتحميل هذا الفيديو.
فيلم تكميلي 2: عفوية Ca2 + النشاط والاستجابة لتطبيق NBQX + الغلوتامات.
التلقائي Ca2+ التدفقات في وجود العازلة تسجيل HEPES (0-300 s) تليها تطبيق 10 μM NBQX (301-600 s)، و 10 μM NBQX + 20 ميكرومتر الغلوتامات (601-900 s). شريط مقياس = 50 μm. الرجاء انقر هنا لتحميل هذا الفيديو.
Discussion
نحن نصف على المدى الطويل الأولية فيتسترال mesencephalic (VM) خلية نظام لثقافة لتحليل عالية المحتوى من المبرمج الغلوتامية بوساطة في الخلايا العصبية. وقد استخدمت الدراسات الثقافات الدوبامين منتصف الابتدائي لتوضيح آليات excitotoxic في سياق نماذج PD11,12. في هذه الدراسة، ونحن نستخدم نهج الجمع باستخدام مؤشرات الكالسيوم المشفرة وراثيا (GECIs) لقياس النشاط كاليفورنيا2 + وربط هذا النشاط مع التغيرات الجزيئية المصب، مثل بدء الشلالات إشارات المبرمج4. الأسلوب له مزايا متعددة لأنظمة أخرى مشابهة لثقافة الخلية. كما لدينا اهتمام خاص في excitotoxicity في سياق مرض باركنسون، وذلك باستخدام الثقافات الخلية VM الأولية مثالية. باستخدام تقنيات نقل الحقل المختلفة، مثل الأغطية الشبكية أو مرحلة مجهر XY الآلية جنبا إلى جنب مع TH مناعة، يمكننا دراسة مباشرة نوع الخلية آثار محددة من المبرمج الغلوتام بوساطة في الخلايا العصبية منتصف البطن. بالإضافة إلى ذلك, نموذج ثقافة الخلية 3 أسابيع يسمح للخلايا العصبية لتطوير كامل, ناضجة ملفها الجزيئي, تعكس الخلايا العصبية دا الكبار9. وقد ركزت الأساليب السابقة أساسا على التغيرات الجزيئية بعد الغلوتامات بوساطة excitotoxicity13,14. النموذج هو فريد من نوعه في قدرته على ربط التغيرات الحادة في فسيولوجيا الخلايا العصبية مع الأحداث الجزيئية المصب في أنواع الخلايا المحددة. أحد القيود على نموذج الثقافة الأولية هو أن تقنية التشريح تلتقط منتصف البطن بالكامل ، بما في ذلك DA والخلايا العصبية GABAergic وكذلك الخلايا العصبية من SNc و VTA. تشير الأدلة الآن إلى أن الخلايا العصبية DA من SNc لديها ضعف انتقائي للكالسيوم وموت الخلايا في نهاية المطاف مقارنة بالخلايا العصبية DA من VTAالمجاورة 15. لسوء الحظ، التمييز بين SNC والخلايا العصبية VTA في الثقافات الجنينية قد ثبت صعوبة مع عدد قليل من المعالم التشريحية لتحديد هذه الهياكل في الدماغ الجنيني.
ونحن نثبت أن تقنية الثقافة الأولية تسمح لك بالتكون الكمي لـ Ca2+ النشاط العفوي(الشكل 1). ولذلك، وهذا هو نموذج نظام ثقافة الخلية مثالية لدراسة الخلايا النشطة منشط، مثل الخلايا العصبية الدوبامين في ضربات القلب من منتصف القرن، الخلايا العصبية القشرية الجديدة، والخلايا العصبية GABAergic من نواة فوق شيازمية (SCN)16،17. في معظم التطبيقات، لا يحقق التصوير Ca2+ نفس الدقة الزمنية مثل علم الفيزيولوجيا الكهربائية. ولذلك، فمن المرجح أن واحد كاليفورنيا2 + الحدث مماثل لموجة من إمكانات العمل العصبي. ويمكن تفسير هذا على أن يعني أن كا2 + التصوير يسمح لمقاييس دقيقة نسبيا من نشاط الانفجار غير طبيعي في خلايا منظم ضربات القلب ، وبالتالي هو مناسب لشاشة عالية المحتوى من كاليفورنيا2 + -بوساطة موت الخلايا excitotoxic.
لتحقيق وصيانة النشاط التلقائي Ca2+ ، من المهم معالجة نقطتين رئيسيتين في البروتوكول. الأول هو كثافة الطلاء من الخلايا التالية تشريح. بالنسبة للخلايا العصبية VM الأولية، استخدمت الدراسات السابقة حوالي 100،000 الخلايا/سم29،10. لقد تكيفنا مع البروتوكول إلى لوحة كثافة 200،000 الخلايا / سم2، مما يخلق مجموعة heterogenous من النشاط العفوي ويزيد من عدد الخلايا العصبية VM الدوبامين الموجودة على كل coverlip. منذ مختلف الخلايا العصبية تنظيم ضربات القلب لها خصائص اطلاق النار متميزة16، وكثافة الطلاء يحتاج إلى تخصيص لنوع الخلية التي تدرس وتحسينها من أجل تحقيق مستويات مثالية من النشاط العفوي. والثاني هو وقت الحضانة بعد العدوى الفيروسية من AAVs. مثل كثافة الطلاء ، وهذا سوف يكون رهنا السياق المحدد للمسألة البحث ونوع AAV المستخدمة. لAV محددة المستخدمة هنا، 5 أيام من الحضانة بعد العدوى الفيروسية مثالية لتحقيق مستويات التعبير البروتين المطلوب، والذي يسمح للتغيرات الديناميكية في الفلوريس GCaMP من أجل تسجيل النشاط كاليفورنيا2+ . العديد من العوامل تحدد مدى سرعة وكفاءة AAV سوف تعبر عن حمولتها ، والكثير منها خارج نطاق هذه الطريقة ، ولكن بإيجاز ، من المهم النظر في نشاط المروج والمعدل الذي ينضج بروتين الشحن ويطوى.
ومن المزايا الأخرى لهذه الطريقة أنها تسمح بمرونة كبيرة في الشكل، ومتجهات التعبير، واستخدام معدات التصوير، ومجموعة الأسئلة العلمية التي يمكن معالجتها. بالإضافة إلى ذلك، تمكن هذه الطريقة من التحقيق في مجموعة واسعة من الأسئلة المحددة التي تحيط بالإثارة التي تتوسطها الغلوتامات في PD، ونماذج أخرى من الخلل في الجهاز العصبي. على سبيل المثال، الغلوتامات بوساطة excitotoxicity ينطوي على مستقبلات متعددة وشلالات إشارة5. باستخدام الأسلوب، وكما هو موضح مع مانع AMPAR، NBQX في الشكل 1، فمن الممكن تشريح مكونات محددة من استجابة الغلوتامات excitotox على المستوى الفسيولوجية والجزيئية. ويمكن تصور أن نهجا مماثلا يستخدم مثبطات نظم الرسل الثانية يمكن استخدامه لتحديد مساهمتها في السمية. بالإضافة إلى ذلك، يمكن تكييف AAVs المستخدمة هنا للتعبير عن GECIs مع المروجين الخلية الخاصة أو أجهزة الاستشعار optogenetic التي أعرب عنها AAV التي يمكن استخدامها لقياس المعلمات الأخرى مثل إطلاق الناقل العصبي.
وبصرف النظر عن التشريح الجنيني الأولي والتصوير confocal، يستخدم الكثير من البروتوكول المهارات المختبرية الأساسية التي لا تتطلب تدريبا متخصصا. لذلك ، فإن القيود على النموذج تشمل صعوبة تقنية التشريح الجنينية ، وطول الوقت الذي يجب أن تكون الخلايا مثقفة للوصول إلى مرحلة النضج ، والوصول إلى مجهر confocal ، أو جهاز تصوير مماثل. الفوائد والمرونة العديدة من الأسلوب تفوق هذه القيود، مما يجعل هذا النموذج المثالي لدراسة دور الغلوتامات بوساطة excitotoxicity في اضطرابات الجهاز العصبي. وأخيرا, هذا النموذج يمكن أن يكون أداة فعالة لفحص المركبات الجديدة للآثار المضادة لبروتيكة والقدرة على الحفاظ على صحة الخلايا العصبية DA.
Disclosures
ليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
بدعم من المنح المقدمة من جمعية مرض باركنسون الأمريكية (APDA) وNIH R01NS115809-01 إلى RS. نشكر معهد تكساس A&M للطب الجينومي (TIGM) على توفير الفئران الحامل في الوقت المناسب لتوليد الثقافات الدوبامينية الأولية.
Materials
| Name | Company | Catalog Number | Comments |
| 10% Formalin/PBS | VWR | 100496-506 | |
| 10X NA 0.3 water-immersion objective | Olympus | UMPLFLN10XW | |
| 12 mm circular cover glass No. 1 | Phenix Research Products | MS20-121 | |
| 20X NA 0.85 oil-immersion objective | Olympus | UPLSAPO20XO | |
| 35 mm uncoated plastic cell culture dishes | VWR | 25382-348 | |
| 40X NA 0.3 water-immersion objective | Olympus | LUMPLFLN40XW | |
| 60X NA 1.35 oil-immersion objective | Olympus | UPLSAPO60XO | |
| Ampicillin (sodium) | Gold Bio | A-301-25 | |
| B-27 supplement | ThermoFisher | 17504044 | 50x stock |
| Binolcular Microscope | Kent Scientific | KSCXTS-1121 | |
| Bovine serum albumin (BSA) | Sigma-Aldrich | A7030 | |
| Calcium Chloride (CaCl2), anhydrous | Sigma-Aldrich | 746495 | |
| Chicken polyclonal anti-Tyrosine Hydroxylase | Abcam | ab76442 | |
| Deoxyribonuclease I (DNase) | Sigma-Aldrich | DN25 | |
| D-glucose, andydrous | Sigma-Aldrich | RDD016 | |
| DMEM + GlutaMAX medium | ThermoFisher | 10569010 | 500 mL |
| Equine serum | ThermoFisher | 26050088 | heat-inactivated |
| Fiber Optic Illuminator, 100V | Kent Scientific | KSC5410 | |
| Filter System, PES 22UM 250ML | VWR | 28199-764 | |
| Fluoview 1000 confocal microscope | Olympus | ||
| Fluoview 1200 confocal microscope | Olympus | ||
| GlutaMAX supplement | ThermoFisher | 35050061 | |
| Goat polyclonal anti-chicken Alexa Fluor 594 | Abcam | ab150176 | |
| Goat polyclonal anti-rabbit Alexa Fluor 594 | Abcam | ab150077 | |
| Hanks-balanced Salt Solution (HBSS) 1x | ThermoFisher | 14175095 | 500 mL |
| HEPES | VWR | 101170-478 | |
| HeraCell 150 CO2 incubator | Heraeus (ThermoFisher) | ||
| ImageJ v1.52e | NIH | ||
| IRIS-Fine Scissors (Round Type)-S/S Str/31*8mm/13cm | RWD | S12014-13 | |
| Kanamycin monosulfate | Gold Bio | K-120-25 | |
| Laminin | Sigma-Aldrich | L2020 | |
| L-Ascorbic acid | Sigma-Aldrich | A7506 | |
| L-glutamic acid | VWR | 97061-634 | |
| Magnesium Chloride (MgCl2), andydrous | Sigma-Aldrich | M8266 | |
| MPII Mini-Peristaltic Pump, 115/230 VAC, 50/60 Hz | Harvard Apparatus | 70-2027 | |
| MULLER Micro Forceps-Str, 0.15mm Tips, 11cm | RWD | F11014-11 | |
| NBQX | Hello Bio | HB0443 | |
| Neurobasal medium | ThermoFisher | 21103049 | 500 mL |
| Normal goat serum (NGS) | Abcam | ab7481 | |
| Origin 2020 | OriginLab | ||
| pAAV.Syn.GCaMP6f.WPRE.SV40 | Addgene | 100837-AAV1 | Titer: 1.00E+13 gc/ml |
| Papain | Worthington Biomedical Corporation | LS003126 | |
| Penicillin streptomycin | ThermoFisher | 15140122 | 10,000 U/mL |
| Phosphate-buffered saline (PBS) 1x | ThermoFisher | 10010049 | 500 mL |
| Poly-L-lysine | Sigma-Aldrich | P4832 | |
| Poly-L-ornithine | Sigma-Aldrich | P4957 | |
| Potassium Chloride (KCl), anhydrous | Sigma-Aldrich | 746436 | |
| Pump Head Tubing Pieces For MPII | Harvard Apparatus | 55-4148 | |
| Rabbit monoclonal anti-caspase-3 | Abcam | ab32351 | |
| Sodium Chloride (NaCl), anhydrous | Sigma-Aldrich | 746398 | |
| Sucrose | Sigma-Aldrich | S7903 | BioXtra, ≥99.5% (GC) |
| Time-pregnant female C57BL/6 mice | Texas A&M Institue for Genomic Medicine | ||
| Triton X-100 | Sigma-Aldrich | X100 | 500 mL |
| Wide-bore blue pipette tips P1000 | VWR | 83007-380 |
References
- Marras, C., et al. Prevalence of Parkinson's disease across North America. NPJ Parkinson's Disease. 4, 21 (2018).
- Poewe, W., et al. Parkinson disease. Nature Reviews Disease Primers. 3, 17013 (2017).
- Mehta, A., Prabhakar, M., Kumar, P., Deshmukh, R., Sharma, P. L. Excitotoxicity: bridge to various triggers in neurodegenerative disorders. European Journal of Pharmacology. 698 (1-3), 6-18 (2013).
- Ambrosi, G., Cerri, S., Blandini, F. A further update on the role of excitotoxicity in the pathogenesis of Parkinson's disease. Journal of Neural Transmission (Vienna). 121 (8), 849-859 (2014).
- Dong, X. X., Wang, Y., Qin, Z. H. Molecular mechanisms of excitotoxicity and their relevance to pathogenesis of neurodegenerative diseases. Acta Pharmaceutica Sinica B. 30 (4), 379-387 (2009).
- Vieira, M., et al. Excitotoxicity through Ca2+-permeable AMPA receptors requires Ca2+-dependent JNK activation. Neurobiology of Disease. 40 (3), 645-655 (2010).
- Sebe, J. Y., et al. Ca(2+)-Permeable AMPARs Mediate Glutamatergic Transmission and Excitotoxic Damage at the Hair Cell Ribbon Synapse. Journal of Neuroscience. 37 (25), 6162-6175 (2017).
- Brickley, S. G., Farrant, M., Swanson, G. T., Cull-Candy, S. G. CNQX increases GABA-mediated synaptic transmission in the cerebellum by an AMPA/kainate receptor-independent mechanism. Neuropharmacology. 41 (6), 730-736 (2001).
- Srinivasan, R., et al. Smoking-Relevant Nicotine Concentration Attenuates the Unfolded Protein Response in Dopaminergic Neurons. Journal of Neuroscience. 36 (1), 65-79 (2016).
- Henley, B. M., et al. Reliable Identification of Living Dopaminergic Neurons in Midbrain Cultures Using RNA Sequencing and TH-promoter-driven eGFP Expression. Journal of Visualized Experiments. (120), e54981 (2017).
- Douhou, A., Troadec, J. D., Ruberg, M., Raisman-Vozari, R., Michel, P. P. Survival promotion of mesencephalic dopaminergic neurons by depolarizing concentrations of K+ requires concurrent inactivation of NMDA or AMPA/kainate receptors. Journal of Neurochemistry. 78 (1), 163-174 (2001).
- Lavaur, J., et al. The noble gas xenon provides protection and trophic stimulation to midbrain dopamine neurons. Journal of Neurochemistry. 142 (1), 14-28 (2017).
- Kritis, A. A., Stamoula, E. G., Paniskaki, K. A., Vavilis, T. D. Researching glutamate - induced cytotoxicity in different cell lines: a comparative/collective analysis/study. Frontiers in Cellular Neuroscience. 9, 91 (2015).
- Gupta, K., Hardingham, G. E., Chandran, S. NMDA receptor-dependent glutamate excitotoxicity in human embryonic stem cell-derived neurons. Neuroscience Letters. 543, 95-100 (2013).
- Surmeier, D. J., Obeso, J. A., Halliday, G. M. Selective neuronal vulnerability in Parkinson disease. Nature Reviews Neuroscience. 18 (2), 101-113 (2017).
- Ramirez, J. M., Tryba, A. K., Pena, F. Pacemaker neurons and neuronal networks: an integrative view. Current Opinion in Neurobiology. 14 (6), 665-674 (2004).
- Guzman, J. N., Sanchez-Padilla, J., Chan, C. S., Surmeier, D. J. Robust pacemaking in substantia nigra dopaminergic neurons. Journal of Neuroscience. 29 (35), 11011-11019 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved