Method Article
定量自发 Ca2+ 通量及其在原发性小鼠中脑神经元中的下游效应
摘要
在这里,我们提出了一个协议,测量体外Ca 2+ 通量在中脑神经元及其下游影响卡斯帕塞-3使用原发性小鼠中脑培养。该模型可用于研究与中脑神经元异常Ca2+ 活性相关的病理生理变化,并筛选抗凋亡特性的新疗法。
摘要
帕金森病 (PD) 是一种破坏性的神经退行性疾病,由多巴胺(DA)神经元退化引起。由于谷氨酸受体的异常激活导致过多的 Ca2+ 流入导致 DA 兴奋性,并被确定为 DA 神经元损失的重要机制。在这项研究中,我们从ED14小鼠胚胎的小鼠腹腔脑(VM)中分离和培养中脑神经元。然后,我们感染长期原发性小鼠中脑培养物与腺相关病毒(AAV),表达基因编码的钙指标,GCaMP6f在人类神经元特异性突触促进剂hSyn的控制之下。使用实时共体成像,我们显示培养小鼠中脑神经元显示AAV-hSyn-GCaMP6f检测到的自发的Ca2+ 通量。谷氨酸在中脑培养物的沐浴应用导致神经元内细胞Ca2+的异常 升高,并伴有DA神经元中的caspase-3活化,免疫污染就证明了这一点。识别原发性小鼠DA神经元中谷氨酸介质细胞凋亡的技术对于保持DA神经元健康的药物的高含量筛选具有重要的应用。
引言
帕金森病(PD)是全世界第二常见的神经退行性疾病,没有已知的治疗方法。据估计,PD患病率将继续上升,预计到2030年,仅美国就有100万例诊断。由于目前可用于对抗PD的有效治疗很少,因此迫切需要开发更有效的治疗方法。PD的特点是中脑多巴胺(DA)神经元2的快速和渐进损失。在PD中神经退化的成理理,人们对此知之甚少。有证据表明,多种机制(如氧化应激和线粒体功能障碍等)可能收敛,有助于启动凋亡信号级联和最终细胞死亡3。
其中一种这种收敛机制,谷氨酸的中质兴奋性已经牵连到多种神经退行性疾病,包括PD4。虽然谷氨酸调节的兴奋性被认为主要通过刺激NMDA受体通过细胞内Ca2+浓度的过度增加和最终启动凋亡,Ca2+渗透的AMPA受体也牵连在兴奋毒性反应5,6,7。,6,7因此,在PD模型中确定AMPA受体对谷氨酸受体的细胞凋亡的贡献是值得感兴趣的。这可以通过NBQX,一种AMPA和先天阻滞剂实现,在微摩尔浓度下,对AMPA受体8是选择性的。谷氨酸培养的兴奋和凋亡信号级联是测量细胞死亡程度的理想下游目标,也是治疗干预的潜在目标。因此,开发一种高含量的方法,评估谷氨酸调制的钙活性和相关下游信号在初级腹腔(VM)神经元将有价值的筛选新的治疗方法,其能力,以保持神经元健康。
在这里,我们开发了一个协议,其中我们表达基因编码的钙指标(GECI,GCaMP6f,使用AAV2/5与人类突触(hSyn)促进运动测量Ca2+活动小鼠VM 原生神经元的反应谷氨酸应用,可以在生理和分子水平测量。这种高含量的筛选可以适用于发现药物或治疗,调节Ca2+活性 ,以保持VM神经元的健康。我们提出,这种初级培养模型是基于其保护VM神经元健康并减轻PD进展的能力,对新型PD干预进行筛选的有效方法。
研究方案
所有涉及动物主体使用的程序都已获得德克萨斯A&M大学机构动物护理和使用委员会的批准(2019年 11月25日;AUP# 2019-0346)。
注:应使用生物安全柜中的无菌程序制备细胞培养溶液,并在0.2 μm时过滤,以防止污染。
1. 制定解决方案和文化媒介
- 通过将 20 μL 的 1 mg/mL 层压素库存稀释到 2 mL 的无菌蒸馏 H2O 中,准备层压层压涂层溶液。
- 通过将 5 mL 的 ES 添加到 45 mL 的 1x 汉克平衡盐溶液 (HBSS), 准备 10% 的马 (马) 血清 (ES) 停止溶液。使用 0.2 μm 过滤器系统或注射器滤片尖端进行无菌过滤器。储存在4°C。
- 通过将 2 克 BSA 粉加入 1x 磷酸盐缓冲盐水 (PBS) 中,并达到 45 mL 的最终体积,准备 4% 牛血清白蛋白 (BSA) 库存溶液。使用 0.2 μm 过滤器系统或注射器滤片尖端进行无菌过滤器。储存在4°C。
- 在 1x HBSS 中将木瓜素稀释至 3 mg/mL,以准备木瓜库存溶液。使用 0.2 μm 过滤器系统或注射器滤片尖端进行无菌过滤器。储存在-20°C。
- 准备脱氧核酸酶(DNase)溶液,将20毫克DNase粉加入无菌H2O,使最终体积达到20 mL。使用 0.2 μm 过滤器系统或注射器滤片尖端进行无菌过滤器。储存在-20°C。
- 通过将352毫克抗坏血酸加入无菌蒸馏H 2 O,使最终体积达到20mL,准备抗坏血酸库存溶液。在37°C浴中加热,如有必要溶解。使用 0.2 μm 过滤器系统或注射器滤片尖端进行无菌过滤器。储存在-20°C。
- 通过将以下神经基础培养基添加到 50 mL 中来制备细胞培养基:500 μL 的谷氨酸(100 倍)、500 μL 的马血清、 1 mL 的 B-27、100 μL 的抗坏血酸、500 μL 的青霉素-链霉素、50 μL 的卡那霉素和 50 μL 的氨基霉素。使用 0.2 μm 滤波器系统进行无菌过滤器。储存在4°C。
- 通过将 1 mL 的 Triton X-100 添加到 9 mL 的 1x PBS 中,准备 0.01% Triton X-100 解决方案,从而获得 10% 的解决方案。由于Triton X-100是粘性的,移液器缓慢,让尖端完全填充。在37°C浴中加热,如有必要溶解。储存在4°C。
- 要将 10% Triton X-100 库存稀释至 0.01%,请执行 3 次连续 1:10 稀释。将 1 mL 的 10% 库存稀释成 9 mL 的 1x PBS,使 1% 溶液。将 1 mL 的 1% 溶液稀释成 9 mL 的 1x PBS,使溶液达到 0.1%。将 1 mL 的 0.1% 溶液稀释成 9 mL 的 1x PBS,使溶液达到 0.01%。
- 通过将 1 mL 的 NGS 添加到 9 mL 的 1x PBS 中,为 10% 溶液添加 1mL,准备 10% 和 1% 的正常山羊血清 (NGS) 溶液。将 100 μL 的 NGS 添加到 9.9 mL 的 1x PBS 中,可制备 1% 溶液。
- 准备谷氨酸库存溶液(100 mM),将735毫克L(+)-谷氨酸加入无菌蒸馏H2O,并达到50 mL的最终体积。这种浓度的溶解性将是一个问题。加入小体积(100 μL)1 M盐酸足以提高溶解度。
- 准备NBQX库存溶液(10 mM),将50毫克NBQX加入无菌蒸馏H2O,最终达到13 mL。
2. 准备文化菜肴和盖玻片(解剖前一天完成)
注:我们发现,结合三种涂层剂,聚L-莱辛,聚L-奥尼辛和层氨基,允许理想的细胞粘附性和生存能力。
- 将 10 个 35 mm 培养皿放在生物安全柜中。在每个盘中放置两个圆形 12 mm 盖玻片,并填充 70% EtOH 10 分钟。使用真空管路从每道菜中吸出剩余的 EtOH,使 EtOH 完全蒸发。
- 将 0.1% 聚 L-晶硅氨酸溶液移液 90-100 μL 的每个盖玻片上,确保整个盖玻片由聚-L-lysine 溶液覆盖。用盖子盖住盘子,放在37°C的培养箱中1小时。
- 从每个盖玻片中吸出剩余的聚L-lysine溶液,并用无菌H2 O冲洗。
- 使用 0.1% 聚 L-二苯胺溶液重复步骤 2.2 = 2.3。
- 同样,使用 0.01% 层压溶液重复步骤 2.2 = 2.3。放在37°C/5%CO2 培养箱中,直到第二天准备好进行细胞电镀。
3. 小鼠胚胎解剖
注:我们每个培养使用4至6个时间期怀孕小鼠。虽然大部分解剖过程发生在生物安全柜之外,但维持无菌过程仍然很重要。在解剖显微镜附近的表面和手术工具上大量使用 70% EtOH 是理想的选择。在解剖过程中也可能戴口罩,以进一步防止污染。此外,我们在培养培养媒介中使用4种单独的抗生素,因此不太可能受到污染。然而,如果使用抗生素有问题,这种解剖装置可以移动到无菌罩内。为了保持细胞生存能力,所有解剖溶液应在4°C时预冷却,解剖应尽快完成。我们不在冰上进行解剖。小鼠胚胎中脑神经元解剖方法与先前描述的方法,9、10相同。9
- 在解剖显微镜附近的长凳上用吸水垫准备一个空间,并自由喷洒 70% EtOH。
- 喷两个 100 x 15 mm 玻璃培养皿和一个 50 x 10 mm 玻璃培养皿与 70% EtOH,并允许 EtOH 蒸发。蒸发后,将50 mL的无菌1x HBSS放入每100 x 15毫米培养皿中。
- 将手术剪刀、钳子和微切刀片在 70% EtOH 中下潜,至少消毒 10 分钟。将仪器放在吸水垫上晾干。
- 使用CO2, 然后是宫颈脱位,在胚胎第14天安乐死2-3个月大的时间妊娠小鼠。
- 用70%的EOH喷洒安乐死小鼠的腹部。用钳子抓住下腹部,用手术剪刀打开腹腔。开始切割附近的钳子举行腹部,使两侧的横向切割,直到腹部壁可以折叠回来,子宫清晰可见。
- 使用手术剪刀,切开子宫角的两端。然后取出子宫,放入培养皿中,用1xHSS。
- 使用直尖钳小心地从子宫中取出胚胎。在整个过程中将胚胎留在HBSS中。使用钳子或显微切刀,通过靠近颈部切割快速斩首胚胎。使尽可能平的切割。
- 在解剖显微镜下,将胚胎头移动到干燥的 50 mm 培养皿上,并放在腹侧。通过放置和穿透眼睛/鼻子附近,用钳子稳定头部。钳子应向下倾斜在 [45], 以避免穿透梅森脑。
- 使用另一只手的钳子,小心地去除半透明的皮肤和头骨层,就在脑积的突出脊之前。开始靠近中线,并去除皮肤和头骨,直到脑积水完全暴露。
- 握住垂直于暴露的脑膜的钳子,皮层和脑膜之间的一个尖端,另一个尖在小脑附近。向下按压并捏合钳子以拆下整个中脑。中脑段应大约 0.5 mm 厚。将中脑部分放入第二个装满新鲜 1x HBSS 的培养皿中。对每个胚胎重复此过程。
- 使用解剖显微镜,将大脑部分与心室朝上定位。如果脑筋仍然连接,小心地将其取出,用钳子抓住,提起和离开大脑部分。
- 大脑部分应有4个可见的象限。将段放置的方式是两个较小的象限位于优于两个较大的象限的位置。有一个突出的山脊,将上一个(小)象限与下级两个(大)象限隔开。
- 使用钳夹紧,将上限与下限分开,然后丢弃上级象限。剩余的劣质象限在后侧横向有多余的组织,这种组织看起来比剩余的腹体组织更不透明。取出较不密集的后体组织并丢弃。其余部分应同时包含 Substantia nigra pars Compacta (SNc) 和腹体区 (VTA)。
- 使用钳子将剩余的腹体组织部分切成 4 个较小的部分,并使用 1mL 宽的孔移液器在 15 mL 锥形管中传输这些段,带 1x HBSS。在整个过程中,将带大脑部分的圆锥管放在冰上。
- 对所有剩余大脑部分重复此过程。
4. 细胞分离
- 细胞酶消化
- 小心地从含有中脑段的 15 mL 锥形管中吸气 HBSS,将管底的段留在管子底部。
- 将 ±800 μL 的木瓜溶液加入管子,放在 37°C 培养箱中 7 分钟。通过轻拂管子将细胞重新暂停,并更换到 37°C 培养箱中,再增加 7 分钟。
- 使用宽孔 1 mL 移液器尖端,仅将中脑段移除为 1 mL 的 DNase 等分。允许段到达等分的底部或约 1 分钟的曝光。
- 使用宽孔 1 mL 移液器尖端,仅将中脑段拆下到包含 2 mL 止解的 15 mL 锥形管中。让段在管底沉淀,并在充满止损溶液的附加锥形管中重复冲洗。
- 细胞悬浮液的机械三化
- 在第二停止溶液冲洗管中,使用宽孔1 mL移液器尖端,移液器细胞上下10次,直到没有可见的大组织段。对于最小的细胞解解,避免过度三化是重要的。
- 缓慢移液器 300 μL 的 4% BSA 溶液到含有脑段的 15 mL 锥形管的底部。小心地拆下移液器尖端,以保持悬架层。在0.4 x g下 离心3分钟。然后在400μL细胞培养培养培养中小心吸进上一提和再增殖细胞。
5. 电镀细胞
注:根据经验,每个胚胎收集大约100,000个活细胞。2-3个月大的定时怀孕小鼠通常有8-10个胚胎的垃圾大小;因此,对每只正点怀孕小鼠细胞总产量的粗略估计约为100万个细胞。
- 使用血细胞计预形成细胞计数,然后使用细胞培养基将悬浮液稀释至2,000个细胞/μL。短暂三重奏混合。
- 从步骤 2 中取出带层压素溶液的盖玻片,并使用真空吸气从涂层盖玻片中吸走剩余的层压剂溶液。板快速,以避免盖玻片完全干燥。将 100 μL (2.0 x 105 细胞/盖玻片) 移液到每个盖玻片上,将培养皿放入 37°C 培养箱中 1 小时。
- 小心地将3 mL的细胞培养基添加到每道菜中,并放回37°C培养箱中。预制半介质每周更改 2 次,为期 2 周。
6. 14 DIV细胞培养感染腺相关病毒(AAV)载体
- 对于每道菜准备 1 mL 的血清免费 DMEM 介质与 1 μL 的 hSyn-GCaMP6f AAV (1.0 x 1013 滴度)
- 从每道菜中吸出细胞培养基,代之以含有 hSyn-GCaMP6f 的 1 mL 无血清 DMEM。将盘子放回 37 °C 培养箱中 1 小时。
- 吸气含有AAV的血清自由培养,代之以3mL的细胞培养培养。将菜肴放回 37 °C 培养箱中。我们发现,5-7天的AAV感染允许理想的GCAMP表达水平。在整个病毒感染期间,每2-3天继续更换一次介质。
7.19-21 DIV 之间的实时共声 Ca 2+ 成像
注:如步骤6.3所述,成像可以在病毒感染后5-7天内完成。这是实现荧光团在允许检测自发 Ca 2+ 活性的水平上可见表达的理想窗口 。
- 准备记录缓冲区
- 要制作 1 L 的 HEPES 记录缓冲区,请添加:9.009 g 的 NaCl, 0.3728 g KCl,0.901 g D-葡萄糖,2.381 g HEPES,2 mL 1 M CaCl2 库存溶液,500 μL 1 M MgCl2 库存溶液到 800 mL 无菌蒸馏 H2O.,使用 NaOH 将 pH 引入 7.4。将最终音量达到 1 L。
- 要使200 mL的20μM谷氨酸记录缓冲液,稀释40μL的100 mM谷氨酸库存溶液到200 mL的 HEPES 记录缓冲液上述。
- 要使 200 mL 的 10 μM NBQX 记录缓冲液,将 200 μL 的 10 mM NBQX 库存溶液稀释为 200 mL 的 HEPES 记录缓冲液。
- 共体成像
- 用 3 mL 的录音缓冲液填充无菌 35 mm 培养皿。
- 从 37 °C 培养箱中取出具有受感染培养物的 35 mm 培养皿。使用精细的尖端钳子,小心地抓住一个盖玻片的边缘,并快速将其转移到装满记录缓冲液的培养皿中。将剩余的盖玻片以中等水平放回 37°C 培养箱中。用记录缓冲器将盘子运送到共和显微镜。
- 启动映像软件。在初始化时继续执行下一步。
- 启动近位泵,将管路放入记录缓冲器中。将流量速度校准为 2 mL/min。
- 将受感染的盖玻片从 35 mm Petri 盘转移到录音浴中。
- 使用 10 倍水浸目标及 BF 光,找到焦点平面,并寻找神经元细胞体高密度区域。切换到 40 倍水浸目标,并使用 BF 光重新聚焦样品。
- 在 FluoView 中的"染料列表"窗口中,选择 AlexaFluor 488 并应用它。
- AAV表达式可以是可变的;因此,为了防止荧光团过度暴露和光漂白,请从低高压和激光功率设置开始。对于 AlexaFluor 488 通道,将高压 (HV) 设置为 500,增益设置为 1 倍,偏移设置为 0。对于 488 激光线,功率设置为 5%。为了增加 z 平面中成像的有效体积,将针孔尺寸增加至 300 μm。使用"对焦 x2"扫描选项以最佳方式将发射信号调整到低于饱和度水平。从这里,可以调整设置,直到实现每个通道的理想可见性。
注:要使用 GCaMP 准确捕获 Ca2+ 通量 的全范围,请调整基准 HV 和激光功率设置,以便在不使探测器过度饱和的情况下增加荧光强度。 - 一旦显微镜设置得到优化,移动舞台,以便定位一个区域,多个细胞显示 GCaMP6f 荧光中的自发变化,并聚焦到所需的平面进行成像。
- 使用"Clip rect"工具将成像帧剪辑到可达到不到 1 秒的帧间隔的大小。这是将成像间隔设置为 1 帧/秒所必需的。
- 将"间隔"窗口设置为值 1.0,将"Num"窗口设置为 600。
注:为了在所需的时间点(300 s)提供不同的记录缓冲器,必须校准泵的延迟,以便向浴缸提供新的解决方案。这取决于溶液灌注速率(2 mL/min)和泵溶液的管路长度。 - 要捕获 t 系列影片,请选择"时间"选项,然后使用"XYt"扫描选项开始成像。
- 观看成像进度条,并在适当的时间点将线从 HEPES 记录缓冲区移动到 20 μM 谷氨酸记录缓冲区(例如,如果泵的延迟被校准以在 60 s 时提供溶液,则将线路移动到谷氨酸缓冲器中,在 240 帧时,以便在 300 s 时提供谷氨酸)。
- 完成成像后,选择" 完成系列" 按钮并保存完成的 t 系列影片。继续使用20μM谷氨酸,额外5分钟,使培养的神经元已暴露在谷氨酸共10分钟。对要成像的每个盖玻片重复此过程。
- 在额外 5 分钟接触 20 μM 谷氨酸后,从浴池中取下盖玻片,放回包含记录缓冲液的 35mm Petri 盘中盘,直到成像完成。完成后,继续执行步骤 8。
- Ca2+ 跟踪分析
- 在 ImageJ 中执行图像分析。安装 ImageJ 的 BIO-FORMAT 插件,允许。要打开的 OIB 图像文件。
- 在 ImageJ 工具栏中,单击" 分析 | "设置"测量",并选择"平均灰色值"(MGV)的框。
- 在 ImageJ 中,打开一部 t 系列电影作为超堆栈。
- 拖动影片的滑块,用最大的谷氨酸响应识别帧,以可视化所有对谷氨酸有反应的神经元。使用多边形工具跟踪所有可见的神经元细胞实体,将它们的 ROI 添加到"ROI 管理器"列表中。
- 完成跟踪和添加 ROI 后,选择 ROI 管理器窗口中的所有 PI,并在更多选项列表中使用"多度量值"选项。复制这些数据并将其粘贴到电子表格中。完成此过程,用于分析所有影片。
- 对于每个 ROI,使用等式将每个帧的原始 MGV 数据转换为 +F/F0 值:\F/F0 = =F(t) = F0= / F0。其中 任何给定帧的 F(t) = MGV, 以及 F0 = 平均基线 MGV 为 ±10 帧,其中不存在 Ca2+ 通量。
- 使用诸如 OriginPro 2020 等统计软件,可将转换后的+F/F 0 跟踪转换为线图。可以使用"峰值分析仪"功能(如果使用其他软件,可以使用类似的功能)测量谷氨酸响应的峰值振幅、对谷氨酸的响应延迟以及曲线下的区域。
8. 文化的免疫
注:使用甲醛固定后,盖玻片可储存在 4 °C 的 1x PBS 中,直到准备好进行免疫处理。初级抗体和次生抗体的孵育以连续的方式进行,如与抗卡斯帕塞-3初级抗体进行孵育,其补充性二级抗体在与抗TH初级抗体及其互补的次级抗体的孵育之前进行。
- 紧接着谷氨酸暴露,将盖玻片放回其35毫米培养皿,吸气记录缓冲液,并添加3 mL的10%正式素。让我们在室温 (RT) 下坐 40 分钟。
- 用1x PBS冲洗盘子3次。
- 在PBS中吸入PBS和渗透细胞在1mL的0.01%Triton X-100中2分钟。
- 用1x PBS冲洗盘子3次。
- 在PBS中,将PBS和块细胞吸入1mL的10%NGS中40分钟。
- 用1x PBS冲洗盘子3次。
- 在PBS中加入1μL的兔抗卡斯帕塞-3原抗体至1mL的1%NGS(1:1000稀释)。从培养皿中吸出PBS,代之以原抗体溶液。放在摇床上,在RT处孵育1.5小时。
- 用1x PBS冲洗盘子3次。
- 在PBS中加入1μL的山羊抗兔Alexfluor 488二次抗体到1mL的1%NGS(1:1000稀释)。从培养皿中吸出PBS,代之以二次抗体溶液。放在摇床上,在RT处孵育1小时。
- 用1x PBS冲洗盘子3次。
- 重复步骤8.7~8.10,但在步骤8.7中使用鸡抗TH原抗体(1:1000)和步骤8.9中的山羊抗鸡亚历克萨弗594次抗体(1:1000)。
- 最后 PBS 冲洗后,将 30 μL 的安装介质放在显微镜幻灯片上。使用钳子从 35 mm Petri 盘上抓住盖玻片,将盖玻片与细胞朝下放置到安装介质中。如果放置正确,两个盖玻片将适合在单个显微镜幻灯片上。放在干燥、黑暗的区域,让安装介质在夜间干燥。
9. 免疫污染培养物的共振成像
- 共体成像
- 启动映像软件。将样品放在显微镜舞台上。
- 使用显微镜目镜,使用 20 倍放大镜和荧光光与 TRITC 过滤器,聚焦样品并搜索 TH+ 细胞体。
- 找到 TH+ 单元格主体后,在视场中居中,然后移动到 60 倍放大目标。
- 在"染料列表"窗口中选择 AlexaFluor 488 和 AlexaFluor 594 染料。
- 与实时成像一样,从低 HV、增益、偏移和激光功率设置开始,以防止光漂白。使用"焦点 x2"扫描选项来评估每个通道的荧光强度并相应地进行调整。由于这些图像稍后将量化为荧光强度,因此有必要在所有视点保持成像设置的一致性。因此,最好查看每个条件的几个示例,了解样本中的荧光强度范围。
- 确定理想的成像设置后,选择"对焦 x2"扫描选项,然后将感兴趣的单元格移动到视场的中心。使用"缩放"滑块将数字变焦缩放倍增加至 3 倍。
- 使用对焦旋钮,找到具有最亮荧光的对焦平面,并捕获单个平面 XY 图像。保存要完成的图像。
- 切换回 20 倍放大目标以搜索另一个 TH+ 单元格。重复此过程,直到从每个条件采样所需的单元格数。
- 图像分析
- 在 ImageJ 工具栏中,单击" 分析 | "设置"测量",并选择"面积"、"集成密度"和"平均灰色"值的框。
- 通过拖放到 ImageJ 工具栏或通过文件菜单选择图像,将每个通道分隔成一个超级堆栈打开图像。
- 使用 TH 通道 (594 nm) 在细胞体周围绘制 PI。使用 ImageJ 中的多边形跟踪工具,密切跟踪单元格主体的外边缘。当细胞膜和细胞核之间的距离最小时,通过细胞胶追踪一条直线到细胞核的边缘,然后密切跟随细胞核的轮廓以排除细胞核。然后将一条直线追溯到外部膜,尽可能紧密地与初始线保持边界,并继续遵循细胞主体的轮廓,直到 ROI 完成。
- 使用键盘快捷键"T"或使用工具栏菜单路径 分析 |工具 |ROI 管理器,打开 ROI 管理器并将刚刚绘制到列表中的 ROI 添加。
- 选择 caspase-3 通道 (488 nm) 的窗口,然后在"ROI 管理器"列表中选择添加的 ROI。
- 在 ROI 管理器窗口中 ,选择"测量 " 按钮。结果窗口将显示与之前设置的测量值一起。将它们复制到电子表格中,然后对每个单元格重复此过程。
结果
在细胞的初始培养后,我们用1 μL的AAV hSyn-GCaMP6f在14 DIV处理VM培养皿,并允许5天的病毒表达。在成像当天,HEPES记录缓冲液准备新鲜。我们使用了两个条件;在一个条件 20 μM 谷氨酸应用 10 分钟, 而在另一个条件 5 分钟 10 μM NBQX 应用之前 10 分钟共同应用 10 μM NBQX = 20 μM 谷氨酸.在这两个条件下,我们观察到GCaMP6f荧光的异质和自发变化,这些荧光表示自发的Ca2+通量,如代表性的轨迹所示(图1A,B,补充电影1-2)。20 μM谷氨酸的应用在自发活性神经元和静止神经元中产生了强健和持续的Ca2+反应(图1A,补充电影1)。应用10μM NBQX减少自发活性,并部分阻断谷氨酸反应(图1B,补充电影2)。谷氨酸应用在每个条件下刺激 Ca2+响应的程度使用曲线下的区域、峰值振幅和响应延迟进行量化。曲线下的区域和峰值振幅都相似,谷氨酸和NBQX + 谷氨酸处理条件(图1C),而响应延迟在NBQX = 谷氨酸条件(图2A,B)显著增加。 Figure 2除了量化Ca2+对谷氨酸治疗的反应外,我们还用抗卡斯帕塞-3抗体固定和染色样品,作为谷氨酸介质细胞凋亡的测量。我们观察到一系列在条件中的卡斯帕塞-3激活(图3A,B)。Caspase-3活化通过测量面积和平均卡斯帕塞-3强度进行量化。与未经治疗的对照细胞相比,谷氨酸和NBQX+谷氨酸条件下具有卡斯帕塞-3活化的细胞的平均面积呈显著趋势(图3B)。与未经治疗的对控相比,谷氨酸和NBQX + 谷氨酸条件均值的caspase-3强度明显高于(图3B)。这些结果共同展示了一个高含量的框架,在这个框架中,可以通过量化Ca2+对兴奋毒性剂的反应来测量神经元的凋亡,并随后分析下游凋亡事件,如在同一组培养物中的 caspase-3 激活。
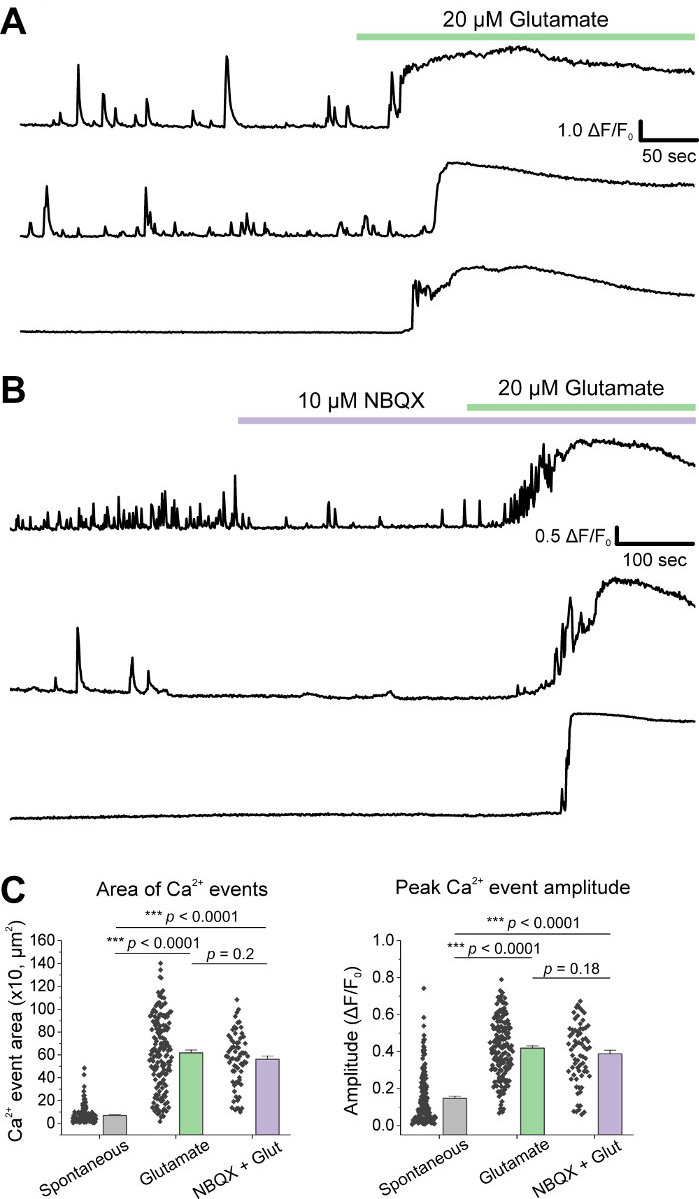
图1:培养的腹腔神经元表现出自发的Ca2+ 活性,并由谷氨酸应用有力地刺激。(A) VM神经元中自发的Ca2+ 活性的代表性痕迹及其对20μM谷氨酸应用的反应。(B) VM神经元中自发 Ca2+ 活性 的代表性痕迹及其对 10 μM NBQX = 20 μM 谷氨酸应用的反应。(C) 显示Ca2+ 曲线下面积和峰值振幅的群体数据。 请单击此处查看此图的较大版本。
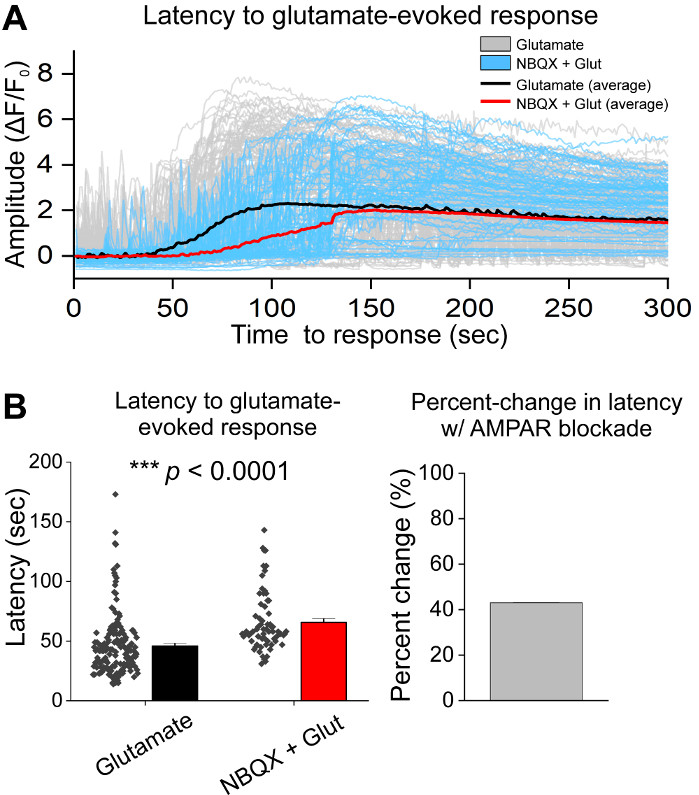
图2:AMPAR封锁与NBQX延迟对谷氨酸应用在培养的腹腔脑神经元的反应。(A) 代表 Ca2+ 谷氨酸(灰色)和 NBQX + 谷氨酸(蓝色)的痕迹引起反应。平均 Ca2+ 谷氨酸(黑色)和 NBQX + 谷氨酸(红色)的痕迹显示叠加。(B) 显示谷氨酸和 NBQX + 谷氨酸响应延迟的人口数据引起响应。谷氨酸和 NBQX = 谷氨酸条件之间的百分比变化显示在右侧面板中。 请单击此处查看此图的较大版本。
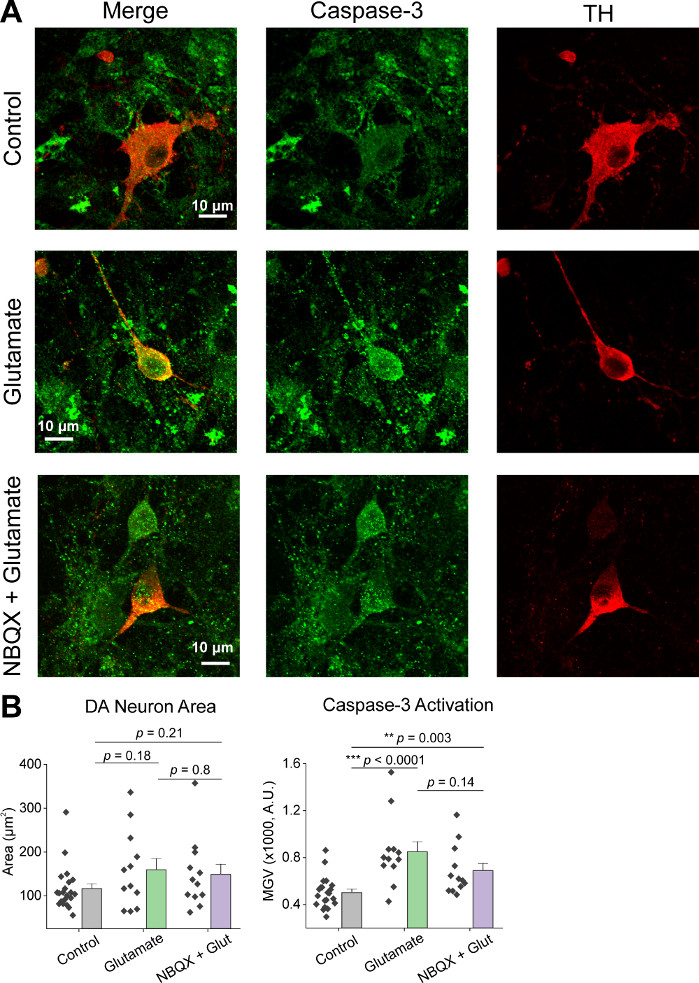
图3:谷氨酸应用增加酪氨酸羟基酶(TH)阳性腹腔神经元中的卡斯帕塞-3表达。(A) 代表 VM 培养物的共生图像免疫,用于 caspase-3(绿色)和 TH(红色),比例杆 = 10 μm. ( B )显示DA 神经元面积和 caspase-3 表达式在每个条件下的均值。 请单击此处查看此图的较大版本。
补充电影1:自发的Ca 2+ 活动和对谷氨酸应用的反应。
在存在 HEPES 记录缓冲液 (0-300 s) 的情况下,自发的 Ca2+ 通量,然后应用 20 μM 谷氨酸 (301-600 s)。缩放栏 = 50 μm. 请点击这里下载此视频。
补充电影2:自发的Ca2+ 活动和响应NBQX+谷氨酸应用程序。
在存在 HEPES 记录缓冲液 (0-300 s) 时,自发 Ca2+ 通量,然后应用 10 μM NBQX (301-600 s), 10 μM NBQX = 20 μM 谷氨酸 (601-900 s)。缩放栏 = 50 μm. 请点击这里下载此视频。
讨论
我们描述了一个长期的原发性腹腔(VM)细胞培养系统,用于对神经元中谷氨酸培养的凋亡进行高含量分析。研究已经采用了初级中脑多巴胺培养物,以阐明在PD模型11,12的背景下兴奋毒性机制。在这项研究中,我们使用一种组合方法,使用基因编码钙指标(GECIs)来测量Ca2+ 活性,并将进一步将此活性与下游分子变化关联,例如启动凋亡信号级联4。该方法与其他类似的细胞培养系统具有多种优点。由于我们对帕金森病环境中的兴奋毒性特别感兴趣,因此使用原发性VM细胞培养是理想的。通过使用不同的场位定位技术,如网格覆盖唇或电动XY显微镜阶段结合TH免疫覆盖,我们可以直接研究谷氨酸培养的凋亡在腹中脑神经元中的细胞类型特异性效应。此外,3周的细胞培养模型允许神经元发展其完整的,成熟的分子轮廓,反映成人DA神经元9。以前的方法主要侧重于谷氨酸介质的兴奋性13,14之后分子的变化。该模型在将神经元生理学的急性变化与已识别细胞类型的下游分子事件关联的能力方面独树一帜。初级培养模型的一个限制是解剖技术捕获整个腹中脑,包括DA和GABAergic神经元以及来自SNc和VTA的神经元。现在有证据表明,与邻近的VTA15的DA神经元相比,SNc的DA神经元对钙和最终细胞死亡有选择性的脆弱性。不幸的是,在胚胎培养中区分SNc和VTA神经元已被证明是困难的,很少有解剖地标来定义胚胎大脑中的这些结构。
我们证明,初级培养技术允许定量异源自发Ca2+活性(图1)。因此,这是一个理想的细胞培养系统模型,用于研究吨位活性细胞,如中脑、新皮质神经元和超血核(SCN)16、17,的GABAergic神经元的起搏多巴胺神经元。在大多数应用中,Ca2+成像无法达到与电生理学相同的时间分辨率。因此,单个 Ca2+事件很可能类似于神经元作用电位的爆发。这可解释为 Ca2+成像允许相对精确测量起搏细胞中的异常爆发活动,因此适用于 Ca2+ 中培养兴奋细胞死亡的高含量屏幕。
为了实现和维护自发的 Ca2+活动,必须解决协议中的两个关键点。首先是解剖后细胞的电镀密度。对于原发性VM神经元,先前的研究已经使用了大约100,000个细胞/厘米29,10。9,10我们已经调整了协议,将200,000个细胞/cm2的密度进行板,从而产生一个自发活动的异质范围,并增加了每个盖玻片上存在的多巴胺VM神经元的数量。由于不同的起搏神经元具有不同的发射特性16,电镀密度需要根据所研究的细胞类型进行定制和优化,以达到理想的自发活性水平。第二是AAV病毒感染后孵育时间。与电镀密度一样,这将取决于研究问题的具体背景和使用的 AAV 类型。对于此处使用的特定 AAV,病毒感染后 5 天的孵育是达到所需蛋白质表达水平的理想值,这允许 GCaMP 荧光的动态变化,以记录 Ca2+活性。许多因素决定了 AAV 能够快速高效地表达其货物,其中很多都超出了这种方法的范围,但简言之,考虑促进剂活性和货物蛋白成熟和折叠的速度非常重要。
该方法的另一个优点是,它允许在格式、表达载体、成像设备的使用以及可以解决的一系列科学问题方面具有相当大的灵活性。此外,该方法还能够调查围绕PD中谷氨酸的兴奋性和其他神经系统功能障碍模型的广泛具体问题。例如,谷氨酸中质兴奋性涉及多个受体和信号级联5。通过使用该方法,如图1所示,与APAR阻滞器 NBQX一起,有可能在生理和分子水平上解剖出兴奋性谷氨酸反应的特定成分。可以想象,使用第二信使系统抑制剂的类似方法可以用来确定它们对兴奋毒性的贡献。此外,此处使用的 AAV 可用于使用细胞特异性启动子或 AAV 表示的光遗传学传感器来表示 GEC,这些传感器可用于测量其他参数,如神经递质释放。
除了初级胚胎解剖和共生成像外,大部分协议都使用不需要专门培训的基本实验室技能。因此,该模型的局限性包括胚胎解剖技术的难度、细胞培养时间长或需要获得共生显微镜或类似成像设备。该方法的许多优点和灵活性超过了这些限制,使其成为研究谷氨酸促进兴奋在神经系统疾病中的作用的理想模型。最后,该模型可以有效地筛选新的化合物,防止抗凋亡效果,并保护DA神经元健康的能力。
披露声明
作者没有什么可透露的。
致谢
支持美国帕金森病协会(APDA)和NIH R01NS115809-01到RS的资助。我们感谢德克萨斯A&M基因组医学研究所(TIGM)提供及时怀孕的小鼠,以产生原发性多巴胺培养物。
材料
| Name | Company | Catalog Number | Comments |
| 10% Formalin/PBS | VWR | 100496-506 | |
| 10X NA 0.3 water-immersion objective | Olympus | UMPLFLN10XW | |
| 12 mm circular cover glass No. 1 | Phenix Research Products | MS20-121 | |
| 20X NA 0.85 oil-immersion objective | Olympus | UPLSAPO20XO | |
| 35 mm uncoated plastic cell culture dishes | VWR | 25382-348 | |
| 40X NA 0.3 water-immersion objective | Olympus | LUMPLFLN40XW | |
| 60X NA 1.35 oil-immersion objective | Olympus | UPLSAPO60XO | |
| Ampicillin (sodium) | Gold Bio | A-301-25 | |
| B-27 supplement | ThermoFisher | 17504044 | 50x stock |
| Binolcular Microscope | Kent Scientific | KSCXTS-1121 | |
| Bovine serum albumin (BSA) | Sigma-Aldrich | A7030 | |
| Calcium Chloride (CaCl2), anhydrous | Sigma-Aldrich | 746495 | |
| Chicken polyclonal anti-Tyrosine Hydroxylase | Abcam | ab76442 | |
| Deoxyribonuclease I (DNase) | Sigma-Aldrich | DN25 | |
| D-glucose, andydrous | Sigma-Aldrich | RDD016 | |
| DMEM + GlutaMAX medium | ThermoFisher | 10569010 | 500 mL |
| Equine serum | ThermoFisher | 26050088 | heat-inactivated |
| Fiber Optic Illuminator, 100V | Kent Scientific | KSC5410 | |
| Filter System, PES 22UM 250ML | VWR | 28199-764 | |
| Fluoview 1000 confocal microscope | Olympus | ||
| Fluoview 1200 confocal microscope | Olympus | ||
| GlutaMAX supplement | ThermoFisher | 35050061 | |
| Goat polyclonal anti-chicken Alexa Fluor 594 | Abcam | ab150176 | |
| Goat polyclonal anti-rabbit Alexa Fluor 594 | Abcam | ab150077 | |
| Hanks-balanced Salt Solution (HBSS) 1x | ThermoFisher | 14175095 | 500 mL |
| HEPES | VWR | 101170-478 | |
| HeraCell 150 CO2 incubator | Heraeus (ThermoFisher) | ||
| ImageJ v1.52e | NIH | ||
| IRIS-Fine Scissors (Round Type)-S/S Str/31*8mm/13cm | RWD | S12014-13 | |
| Kanamycin monosulfate | Gold Bio | K-120-25 | |
| Laminin | Sigma-Aldrich | L2020 | |
| L-Ascorbic acid | Sigma-Aldrich | A7506 | |
| L-glutamic acid | VWR | 97061-634 | |
| Magnesium Chloride (MgCl2), andydrous | Sigma-Aldrich | M8266 | |
| MPII Mini-Peristaltic Pump, 115/230 VAC, 50/60 Hz | Harvard Apparatus | 70-2027 | |
| MULLER Micro Forceps-Str, 0.15mm Tips, 11cm | RWD | F11014-11 | |
| NBQX | Hello Bio | HB0443 | |
| Neurobasal medium | ThermoFisher | 21103049 | 500 mL |
| Normal goat serum (NGS) | Abcam | ab7481 | |
| Origin 2020 | OriginLab | ||
| pAAV.Syn.GCaMP6f.WPRE.SV40 | Addgene | 100837-AAV1 | Titer: 1.00E+13 gc/ml |
| Papain | Worthington Biomedical Corporation | LS003126 | |
| Penicillin streptomycin | ThermoFisher | 15140122 | 10,000 U/mL |
| Phosphate-buffered saline (PBS) 1x | ThermoFisher | 10010049 | 500 mL |
| Poly-L-lysine | Sigma-Aldrich | P4832 | |
| Poly-L-ornithine | Sigma-Aldrich | P4957 | |
| Potassium Chloride (KCl), anhydrous | Sigma-Aldrich | 746436 | |
| Pump Head Tubing Pieces For MPII | Harvard Apparatus | 55-4148 | |
| Rabbit monoclonal anti-caspase-3 | Abcam | ab32351 | |
| Sodium Chloride (NaCl), anhydrous | Sigma-Aldrich | 746398 | |
| Sucrose | Sigma-Aldrich | S7903 | BioXtra, ≥99.5% (GC) |
| Time-pregnant female C57BL/6 mice | Texas A&M Institue for Genomic Medicine | ||
| Triton X-100 | Sigma-Aldrich | X100 | 500 mL |
| Wide-bore blue pipette tips P1000 | VWR | 83007-380 |
参考文献
- Marras, C., et al. Prevalence of Parkinson's disease across North America. NPJ Parkinson's Disease. 4, 21(2018).
- Poewe, W., et al. Parkinson disease. Nature Reviews Disease Primers. 3, 17013(2017).
- Mehta, A., Prabhakar, M., Kumar, P., Deshmukh, R., Sharma, P. L. Excitotoxicity: bridge to various triggers in neurodegenerative disorders. European Journal of Pharmacology. 698 (1-3), 6-18 (2013).
- Ambrosi, G., Cerri, S., Blandini, F. A further update on the role of excitotoxicity in the pathogenesis of Parkinson's disease. Journal of Neural Transmission (Vienna). 121 (8), 849-859 (2014).
- Dong, X. X., Wang, Y., Qin, Z. H. Molecular mechanisms of excitotoxicity and their relevance to pathogenesis of neurodegenerative diseases. Acta Pharmaceutica Sinica B. 30 (4), 379-387 (2009).
- Vieira, M., et al. Excitotoxicity through Ca2+-permeable AMPA receptors requires Ca2+-dependent JNK activation. Neurobiology of Disease. 40 (3), 645-655 (2010).
- Sebe, J. Y., et al. Ca(2+)-Permeable AMPARs Mediate Glutamatergic Transmission and Excitotoxic Damage at the Hair Cell Ribbon Synapse. Journal of Neuroscience. 37 (25), 6162-6175 (2017).
- Brickley, S. G., Farrant, M., Swanson, G. T., Cull-Candy, S. G. CNQX increases GABA-mediated synaptic transmission in the cerebellum by an AMPA/kainate receptor-independent mechanism. Neuropharmacology. 41 (6), 730-736 (2001).
- Srinivasan, R., et al. Smoking-Relevant Nicotine Concentration Attenuates the Unfolded Protein Response in Dopaminergic Neurons. Journal of Neuroscience. 36 (1), 65-79 (2016).
- Henley, B. M., et al. Reliable Identification of Living Dopaminergic Neurons in Midbrain Cultures Using RNA Sequencing and TH-promoter-driven eGFP Expression. Journal of Visualized Experiments. (120), e54981(2017).
- Douhou, A., Troadec, J. D., Ruberg, M., Raisman-Vozari, R., Michel, P. P. Survival promotion of mesencephalic dopaminergic neurons by depolarizing concentrations of K+ requires concurrent inactivation of NMDA or AMPA/kainate receptors. Journal of Neurochemistry. 78 (1), 163-174 (2001).
- Lavaur, J., et al. The noble gas xenon provides protection and trophic stimulation to midbrain dopamine neurons. Journal of Neurochemistry. 142 (1), 14-28 (2017).
- Kritis, A. A., Stamoula, E. G., Paniskaki, K. A., Vavilis, T. D. Researching glutamate - induced cytotoxicity in different cell lines: a comparative/collective analysis/study. Frontiers in Cellular Neuroscience. 9, 91(2015).
- Gupta, K., Hardingham, G. E., Chandran, S. NMDA receptor-dependent glutamate excitotoxicity in human embryonic stem cell-derived neurons. Neuroscience Letters. 543, 95-100 (2013).
- Surmeier, D. J., Obeso, J. A., Halliday, G. M. Selective neuronal vulnerability in Parkinson disease. Nature Reviews Neuroscience. 18 (2), 101-113 (2017).
- Ramirez, J. M., Tryba, A. K., Pena, F. Pacemaker neurons and neuronal networks: an integrative view. Current Opinion in Neurobiology. 14 (6), 665-674 (2004).
- Guzman, J. N., Sanchez-Padilla, J., Chan, C. S., Surmeier, D. J. Robust pacemaking in substantia nigra dopaminergic neurons. Journal of Neuroscience. 29 (35), 11011-11019 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。