Method Article
主マウス中脳ニューロンにおける自発的Ca2+ フラックスとその下流効果の定量化
要約
ここでは、中脳ニューロンのin vitro Ca2+ フラックスを測定するプロトコルと、プライマリマウス中脳培養を用いたカスパーゼ-3に対するその下流の影響を提示する。このモデルは、中脳ニューロンにおける異常なCa2+ 活性に関連する病態生理学的変化を研究し、抗アポトーシス特性の新しい治療法をスクリーニングするために使用することができる。
要約
パーキンソン病(PD)は、ドーパミン作動性(DA)ニューロンの変性によって引き起こされる壊滅的な神経変性疾患である。グルタミン酸受容体の異常な活性化による過剰なCa2+ 流入は、DA興奮毒性をもたらし、DAニューロン喪失の重要なメカニズムとして同定されている。本研究では、ED14マウス胚のマウス腹側中頭症(VM)から中脳ニューロンを単離、解離、培養する。その後、ヒトニューロン特異的シナプシンプロモーターhSynの制御下で、遺伝的にコードされたカルシウム指標であるGCaMP6fを発現するアデノ関連ウイルス(AAV)を用いて、長期の一次マウス中脳培養物に感染する。ライブ共焦点イメージングを用いて、培養マウス中脳ニューロンがAAV-hSyn-GCaMP6fによって検出された自発的なCa2+ フラックスを表示することを示す。グルタミン酸を中脳培養に浴用に適用すると、ニューロン内の細胞内Ca2+ の異常な上昇を引き起こし、これは免疫染色によって示されるように、DAニューロンにおけるカスパーゼ3活性化を伴う。一次マウスDAニューロンにおけるグルタミン酸媒介アポトーシスを同定する技術は、DAニューロンの健康を維持する薬物の高含有スクリーニングに重要な用途を有する。
概要
パーキンソン病(PD)は、世界的に2番目に一般的な神経変性疾患であり、治療法は知られていない。推定によると、PDの有病率は増加し続け、米国だけで2030年までに100万件を超えると予測されている。PDと戦うために現在利用可能な効果的な治療法はほとんどないので、より効果的な治療法を開発する必要があります。PDは、中脳ドーパミン(DA)ニューロン2の急速かつ進行性の損失によって特徴付けられる。PDの神経変性の根本となるメカニズムは十分に理解されていない。証拠は、アポトーシスシグナル伝達カスケードおよび最終的な細胞死の開始に寄与する酸化ストレスやミトコンドリア機能不全などの複数のメカニズムの収束の可能性を示唆している3。
このような収束機構の1つは、グルタミン酸媒介性興奮毒性がPD4を含む複数の神経変性疾患に関与している。グルタミン酸媒介性興奮毒性は、主に細胞内Ca2+濃度の過剰増加および最終的なアポトーシスの開始を介したNMDA受容体の刺激によって働くことと考えられているが、Ca2+-透過性AMPA受容体もまた、興奮性反応55、6、76,7に関与している。したがって、PDモデル内のグルタミン酸媒介アポトーシスに対するAMPA受容体の寄与を決定することが目的である。これは、NBQX、AMPAおよびカイネートブロッカーを用いて達成することができ、これはマイクロモル濃度でAMPA受容体8に対して選択的である。グルタミン酸媒介性興奮性およびアポトーシスシグナル伝達カスケードは、細胞死の程度を測定する理想的な下流標的であり、治療介入の潜在的な標的である。したがって、グルタミン酸媒介性カルシウム活性の調節および第一次腹側中脳症(VM)ニューロンにおける関連する下流シグナル伝達を評価するための高含有法を開発することは、ニューロンの健康を維持する能力に関する新しい治療法をスクリーニングする上で有益であろう。
ここでは、遺伝的にコード化されたカルシウム指標(GECI)、GCaMP6fを、AAV2/5とヒトシナプシン(hSyn)プロモートを用いて、生理学的および分子レベルで測定できるグルタミン酸アプリケーションに応答してマウスVM一次ニューロンのCa2+ 活性を測定するプロトコルを開発しました。この高含有スクリーニングは、VMニューロンの健康を維持するためにCa2+ 活性を調節する医薬品または治療法を発見するために適応することができる。我々は、この主要な培養モデルが、VMニューロンの健康を維持し、PDの進行を緩和する能力に基づいて、新しいPD介入をスクリーニングする効果的な方法であることを提案する。
プロトコル
動物の被験者の使用に関するすべての手順は、テキサスA&M大学の施設動物のケアと使用委員会によって承認されています(2019年11月25日 ;AUP# 2019-0346)。
注:細胞培養液の調製は、生物学的安全キャビネットで無菌手順を使用して行い、汚染を防ぐために0.2 μmで濾過する必要があります。
1. 溶液・培養培地の調製
- ラミニンコーティング液を調製し、20 μLの1 mg/mLラミニンストックを2 mLの滅菌蒸留H2O.解剖日に準備します。
- 1xハンクスバランスソルト溶液(HBSS)の45 mLにESの5 mLを加えることによって、10%馬(馬)血清(ES)停止液を調製します。0.2 μmのフィルターシステムかシリンジフィルターの先端を使用した無菌フィルター。4 °Cで保管。
- 1xリン酸緩衝生理食塩水(PBS)に2gのBSA粉末を加え、最終容積45mLに持ち込み、4%のウシ血清アルブミン(BSA)ストック液を調製します。0.2 μmのフィルターシステムかシリンジフィルターの先端を使用した無菌フィルター。4 °Cで保管。
- パパインを1x HBSSで3mg/mLに希釈してパパインストック液を調製します。0.2 μmのフィルターシステムかシリンジフィルターの先端を使用した無菌フィルター。-20°Cで保管してください。
- DNase粉末20mgを滅菌H2Oに加え、最終容積20mLに持ち込み、デオキシリボヌクレアーゼ(DNase)溶液を調製します。0.2 μmのフィルターシステムかシリンジフィルターの先端を使用した無菌フィルター。-20°Cで保管してください。
- 352mgのアスコルビン酸を無菌蒸留H2Oに加え、最終容積20mLに持ち込んで、アスコルビン酸ストック液を調製します。37°C浴中で熱を入し、必要に応じて溶解する。0.2 μmのフィルターシステムかシリンジフィルターの先端を使用した無菌フィルター。-20°Cで保管してください。
- グルタマックス500μL(100x)、500μLの馬血清、B-27の1mL、アスコルビン酸100μL、500μLのペニシリンストレプマイシン、50μLのカナマイシンおよび50μLの神経基底培地に次の50 mLを加えて細胞培地を調製する。0.2 μmのフィルターシステムを使用した滅菌フィルター。4 °Cで保管。
- 10%の溶液を作るために1x PBSの9 mLにトリトンX-100の1 mLを加えることによって0.01%トリトンX-100の解決を準備する。トリトンX-100は粘性であるため、ピペットはゆっくりと先端が完全に充填されるようにします。37°C浴中で熱を入し、必要に応じて溶解する。4 °Cで保管。
- 10%トリトンX-100ストックを0.01%に希釈するには、3シリアル1:10希釈を行います。10%ストックの1mLを1x PBSの9 mLに希釈して1%溶液にします。1%溶液1mLを9mLの1x PBSに希釈し、0.1%溶液を作ります。0.1%溶液の1 mLを9 mLの1x PBSに希釈し、0.01%溶液を作ります。
- 10%の溶液のために1x PBSの9 mLにNGSの1 mLを加えることによって10%および1%の正常なヤギ血清(NGS)溶液を準備する。1%の溶液を作るために1x PBSの9.9 mLにNGSの100 μLを加える。
- 735 mgのL(+)-グルタミン酸を滅菌蒸留H2Oに加え、50 mLの最終容積に持ち込むことにより、グルタミン酸ストック液(100mM)を調製します。この濃度での溶解性が問題となる。1M塩酸の少量(100μL)を添加すると、溶解性を高めるのに十分です。
- NBQXのストック溶液(10mM)を50mgのNBQXを無菌蒸留H2Oに加え、最終容積13mLに持ち込みます。
2. 文化料理・カバーリップの作製(解剖前日に行う)
注:ポリL-リジン、ポリ-L-オルニチン、ラミニンの3つのコーティング剤を組み合わせることで、理想的な細胞接着性と生存率を可能にすることがわかりました。
- 生物学的安全キャビネットに10 35 mmペトリ皿を置きます。各皿に2つの円形12 mmのカバーリップを入れ、70%のEtOHで10分間充填します。真空ラインを使用して各ディッシュから残りのEtOHを吸引し、EtOHを完全に蒸発させます。
- ピペット~90~100μLの0.1%ポリL-リジン溶液を各カバースリップに取り付け、カバースリップ全体がポリL-リジン溶液で覆われていることを確認します。蓋で皿を覆い、37°Cのインキュベーターに1時間置きます。
- 各カバースリップからポリL-リジン溶液を吸引し、滅菌H2Oですすいする。
- 0.1%ポリL-オルニチン溶液でステップ2.2~2.3を繰り返します。
- ここでも、0.01%ラミニン溶液でステップ2.2~2.3を繰り返します。37 °C/5%CO2 インキュベーターに入れ、翌日に細胞めっきの準備ができるまで入れてください。
3. マウス胚性切離
注:私たちは、培養ごとに4〜6回のタイミングの妊娠中のマウスを使用しています。解剖プロセスの多くは生物学的安全キャビネットの外で起こるが、それはまだ無菌手順を維持することが重要である。解剖顕微鏡の近くの表面および外科用具の70%EtOHの豊富な使用は理想的である。さらに汚染を防ぐために、解剖中にマスクを着用することもできる。さらに、培地に4つの別々の抗生物質を使用するため、汚染はありそうにありません。しかし、抗生物質の使用が問題である場合、この解剖セットアップは無菌フードの中に移動する可能性があります。細胞の生存率を維持するために、解剖液はすべて4°Cで予冷し、解剖はできるだけ早く完了する必要があります。氷上での切り出しは行いません。マウス胚性中脳神経の解剖方法は、前に述べた方法99,1010と同一である。
- 吸収パッドで解剖顕微鏡の近くのベンチにスペースを用意し、70%のEtOHで自由にスプレーします。
- 100 x 15 mmガラスのペトリ皿2個と50 x 10mmガラスペトリ皿を70%EtOHでスプレーし、EtOHを蒸発させます。蒸発したら、無菌1x HBSSの50 mLを各100 x 15 mmのペトリ皿に入れます。
- 手術用ハサミ、鉗子、ミクロトームブレードを70%EtOHに最低10分間沈み、滅菌します。吸水パッドの上に器具を置いて乾燥させます。
- CO22に続いて子宮頸部脱臼を使用し、胚性14日目に生後2〜3ヶ月の時限妊娠マウスを安楽死させる。
- 安楽死マウスの腹部を70%のEtOHでスプレーする。鉗子を使用して下腹部をつかみ、外科用はさみを使用して腹腔を開く。鉗子が腹部を保持している場所の近くで切断を開始し、腹壁を折り返し、子宮がはっきりと見えるまで、両側に横切りを行います。
- 手術用ハサミを使用して、子宮ホーンの両端を切断します。その後、子宮を取り除き、1x HBSSでペトリ皿に入れます。
- ストレートチップ鉗子を使用して慎重に子宮から胚を除去します。このプロセスを通して、胚をHBSSに残します。鉗子かミクロトームの刃を使用して、首の近くで切断することによってすぐに胚を切断する。可能な限りレベルのカットを行います。
- 解剖顕微鏡の下で、胚の頭部を乾燥した50mmペトリ皿に移し、腹側に置きます。目/スアウトの近くに配置し、貫通することにより、鉗子で頭を安定させます。鉗子は、メセンセファロンを貫通しないように〜45°で下向きにする必要があります。
- 一方、鉗子を使用して、メセンセファロンの顕著な尾根の直前に皮膚と頭蓋骨の半透明層を慎重に取り除きます。中線の近くで開始し、メセンセファロンが完全に露出するまで皮膚と頭蓋骨を取り除きます。
- 露出した中皮に垂直な鉗子を、皮質と中頭症の間の先端と小脳の近くで持つ。鉗子を押し下げてつまんで中脳全体を取り除きます。中脳セグメントは、約0.5mmの厚さでなければなりません。新鮮な1x HBSSで満たされた第二のペトリ皿に中脳セグメントを置きます。胚ごとにこのプロセスを繰り返します。
- 解剖顕微鏡を使用して、腹側を上に向けて脳セグメントを配置します。髄液がまだ取り付けられている場合は、鉗子でつかんで脳セグメントから持ち上げて離すことによって慎重に取り除きます。
- 脳セグメントは、4つの可視象限を持っている必要があります。2 つの小さな象限が 2 つの大きな象限よりも上位になるようにセグメントを配置します。上位2つの(小さな)象限と劣った2つの(大きな)象限を分離する顕著な尾根があります。
- 鉗子を使用して、優れた象限を下の象限からピンチして分離し、その後、上位象限を破棄します。残りの下側象限は、側側に過剰な組織を有し、この組織は残りの腹側組織よりも不透明に見える。密度の低い後ろ組織を取り除き、捨てます。残りのセグメントには、Substantia ニグラ パルスコンパ (SNc) と腹側テグメンタル領域 (VTA) の両方が含まれている必要があります。
- 鉗子を使用して残りの腹側組織のセグメントを4つの小さい部分に切り取り、1mL幅のボアピペットを使用して、1x HBSSを有する15 mL円錐状の管でこれらのセグメントを移す。手順を通して氷の上に脳セグメントを持つ円錐管を保ちます。
- 残りのすべての脳セグメントに対してこのプロセスを繰り返します。
4. 細胞の解離
- 細胞の酵素消化
- HBSSを中脳セグメントを含む15 mL円錐管から慎重に吸引し、チューブの下部にセグメントを残します。
- チューブに約800μLのパパイン溶液を加え、37°Cインキュベーターに7分間入れる。チューブをフリックして細胞を再懸濁し、さらに7分間37°Cインキュベーターに交換します。
- 広ボア1 mLピペットチップを使用すると、中脳セグメントのみをDNaseの1mLアリコートに取り除きます。セグメントがアリコートの底部または約1分の露出に到達するようにします。
- 広ボア1 mLピペットチップを使用して、2 mLの停止溶液を含む15 mL円錐管に中脳セグメントのみを取り外します。セグメントがチューブの下部に落ち着き、ストップ溶液で満たされた追加の円錐管でリンスを繰り返します。
- 細胞懸濁液の機械的トリアーレーション
- 第2のストップ溶液リンスチューブでは、広ボア1mLピペットチップを使用し、大きな組織セグメントが見えないまで細胞を上下に10回ピペット化する。最小限の細胞のリシスのためのトリアーレーションを避けるために重要です。
- 脳セグメントを含む15 mL円錐管の底部に4%BSA溶液のピペット300 μLをゆっくりと。慎重に懸濁液層を維持するために、ピペットの先端を取り外します。遠心分離機 0.4 x g で 3 分間その後、上清を慎重に吸引し、細胞培養培地の400μLで細胞を再懸濁します。
5. 細胞をめっきする
注:経験に基づいて、胚あたり約100,000個の生存可能な細胞が収集されます。2-3ヶ月のタイミングを使った妊娠マウスは、典型的には8-10胚のごみサイズを有する。したがって、時を取った妊娠マウスあたりの細胞の総収量の概算は約100万個の細胞である。
- ヘモサイトートメーターを用いて細胞数をプリフォームし、細胞培養培地を用いて懸濁液を2,000個/μLに希釈した。混ぜるために簡単にトリチュレートします。
- インキュベーターからステップ2からラミニン溶液でカバースリップを取り出し、残りのラミニン溶液を真空を使用してコーティングされたカバースリップから吸引します。カバーリップが完全に乾燥するのを避けるためにすぐに皿。ピペット100 μL(2.0 x 105 セル/カバースリップ)を各カバースリップに入れ、ペトリ皿を37°Cインキュベーターに1時間置きます。
- 各皿に3mLの細胞培養培地を慎重に加え、37°Cインキュベーターに戻します。プリフォームハーフミディアムは週に2回、2週間変更します。
6. アデノ関連ウイルス(AAV)ベクターによる14 DIVでの細胞培養の感染
- 各皿のためにhSyn-GCaMP6f AAVの1 μLと血清フリーDMEM培地の1 mLを準備する(1.0 x 1013 のチター)
- 各皿から細胞培養培地を吸引し、hSyn-GCaMP6fを含む1mLの血清フリーDMEMに交換する。37°Cインキュベーターに1時間戻します。
- AAVを含む無血清培地を吸引し、3mLの細胞培養培地に交換する。37°Cインキュベーターに皿を戻します。我々は、AAV感染の5-7日がGCaMP発現の理想的なレベルを可能にすることを発見した。ウイルス感染のこの期間を通じて2〜3日ごとに培地を変更し続けます.
7. 19-21 DIV間のライブ共焦点Ca2+ イメージング
注:ステップ6.3で述べたように、イメージングは、ウイルス感染後5〜7日の間に行うことができます。これは、自発的なCa2+ 活性の検出を可能にするレベルで蛍光体の目に見える表現を達成するための理想的なウィンドウです。
- 記録バッファの準備
- HEPES記録バッファの1 Lを作るために、 追加: NaCl の 9.009 g, KCl の 0.3728 g, D-グルコースの 0.901 g, HEPES の 2.381 g, 2 mL2の 1 M CaCl2ストック溶液, 800 mL の無菌蒸留 H2O.最終容積は1 Lに持ち込む。
- 20 μM グルタミン酸記録バッファーの 200 mL を作るために、上述した HEPES 記録バッファーの 200 mL に 100 mM グルタミン酸ストック溶液の 40 μL を希釈します。
- 10 μM NBQX記録バッファの200 mLを作るために、10 mM NBQXストック溶液の200 μLをHEPES記録バッファの200 mLに希釈します。
- 共焦点イメージング
- 3 mLの記録バッファで滅菌35mmペトリ皿を充填します。
- 37°Cインキュベーターから感染培養物を含む35mmペトリ皿を取り除きます。細かい先端鉗子を使用して、慎重に1つのカバースリップの端をつかみ、記録バッファで満たされたペトリ皿に素早くそれを移します。残りのカバースリップを培地に入れて、37°Cインキュベーターに戻します。録音バッファーを備えた皿を共焦点顕微鏡に運ぶ。
- イメージング ソフトウェアを起動します。初期化中に次のステップに進みます。
- 蠕動ポンプを起動し、記録バッファにラインを入れます。流れの速度を2 mL/minに調整します。
- 感染したカバースリップを35mmペトリ皿から記録浴に移します。
- 10x水浸しの目的とBF光を使用して、焦点の平面を見つけ、ニューロン細胞体の高密度の領域を探します。40倍の水浸し目的に切り替え、BF光を使用してサンプルを再焦点を合わせます。
- FluoViewの「染料リスト」ウィンドウで、AlexaFluor 488を選択して適用します。
- AAV 式は変数にできます。したがって、蛍光色素の露出過多や光の切開を防ぐために、低HVとレーザーパワー設定から始めます。AlexaFluor 488チャンネルの場合は、高電圧(HV)を500に、ゲインを1xに設定し、オフセットを0に設定します。488レーザーラインの場合は、電源を5%に設定します。z平面での有効なボリュームを増やすには、ピンホールサイズを300 μmに大きくします。「focus x2」スキャンオプションを使用して、発光信号をサブサチュレーションレベルに最適に調整します。ここから、各チャンネルの理想的な可視性が達成されるまで設定を調整することができます。
注:GCaMPでCa2+ フラックスの全範囲を正確にキャプチャするには、検出器を過飽和にすることなく蛍光強度の増加を可能にするためにベースラインHVとレーザーパワー設定を調整してください。 - 顕微鏡の設定が最適化されたら、GCaMP6f蛍光の自発的な変化を示す複数の細胞を有する領域を見つけるためにステージを移動し、イメージングのために目的の平面に焦点を合わせます。
- 「クリップ rect」ツールを使用して、1 秒弱のフレーム間隔を達成できるサイズにイメージングフレームをクリップします。これは、1 秒あたり 1 フレームにイメージング間隔を設定する必要があります。
- 「間隔」ウィンドウを1.0の値に設定し、「Num」ウィンドウを600に設定します。
注:所望の時点(300秒)で異なる記録バッファを提供するためには、新しいソリューションを浴槽に届けるためにポンプの待ち時間を調整することが重要です。これは、溶液の灌流速度(2 mL/min)と、溶液のポンプに使用されるラインの長さに依存します。 - t シリーズ ムービーをキャプチャするには、[Time] オプションを選択し、"XYt" スキャン オプションを使用してイメージングを開始します。
- イメージング進捗バーを見て、適切な時点でHEPES記録バッファから20 μMグルタミン酸記録バッファにラインを移動します(例えば、ポンプの遅延が60秒で溶液を送達するように較正されている場合は、300 sでグルタミン酸を送達するために240フレームでグルタミン酸バッファーにラインを移動します)。
- イメージングが完了したら、[ シリーズ完了 ]ボタンを選択し、完成したtシリーズムービーを保存します。20 μM グルタミン酸を 5 分間パーフューズし続け、培養ニューロンが合計 10 分間グルタミン酸にさらされるようにします。画像を作成するカバースリップごとにこの手順を繰り返します。
- さらに5分の20μMグルタミン酸への露出に続いて、蓋を浴から取り出し、撮影が完了するまで記録バッファを含む35mmペトリ皿に戻します。完了したら、ステップ 8 に進みます。
- Ca2+ トレース分析
- ImageJ で画像解析を実行します。を許可する ImageJ の BIO フォーマット プラグインをインストールします。開く OIB イメージ ファイル。
- [ImageJ] ツールバーで、[ 分析] をクリックします。[測定値] を設定し、[平均グレー値 (MGV)] のボックスを選択します。
- ImageJ で、t シリーズムービーをハイパースタックとして開きます。
- ムービーのスライダーをドラッグし、グルタミン酸応答を最大のフレームを識別し、グルタミン酸に応答するすべてのニューロンを視覚化します。ポリゴン ツールを使用して、可視ニューロンセルの全体をトレースし、ROI を ROI マネージャ リストに追加します。
- ROI のトレースと追加が完了したら、[ROI マネージャ]ウィンドウ内のすべての ROI を選択し、オプションの一覧で[複数メジャー ] の選択を使用します。これらのデータをコピーしてスプレッドシートに貼り付けます。すべての映画を分析するには、このプロセスを完了します。
- ROI ごとに、各フレームの生の MGV データをΔF/F000値に変換します。0F(t) =任意のフレームの MGV、およびF0 = Ca2+フラックスが存在しない~10 フレームの平均ベースライン MGV を示します。
- OriginPro 2020などの統計ソフトウェアを使用して、変換されたΔF/F0 トレースを折れ線グラフにすることができます。「ピークアナライザ」機能は、グルタミン酸応答のピーク振幅、グルタミン酸に応答する待ち時間、および曲線下の面積を測定するために使用することができます(または別のソフトウェアを使用する場合は同様の機能)。
8. 培養物の免疫染色
注:ホルマリンによる固定後、カバーリップは、免疫染色のために処理される準備ができるまで、4°Cで1x PBSに保存することができます。一次抗体および二次抗体インキュベーションは、抗CASpase-3一次抗体とその相補的二次抗体とのインキュベーションを、抗TH一次抗体およびその相補的二次抗体と共にインキュベーションする前に、連続的に行われました。
- グルタミン酸暴露の直後に、カバースリップを35mmのペトリ皿に戻し、記録バッファを吸引し、3 mLのホルマリンを加えます。室温(RT)で40分間座らせます。
- 1x PBSで皿を3回洗いすます。
- PBSを吸引し、2分間PBSで0.01%トリトンX-100の1mLで細胞を透過させる。
- 1x PBSで皿を3回洗いすます。
- PBSを1mLで1mLで吸引し、40分間PBSで細胞をブロックします。
- 1x PBSで皿を3回洗いすます。
- PBSで1%NGSの1mLにウサギ抗カスパーゼ-3一次抗体の1 μLを加える(1:1000希釈)。皿からPBSを吸引し、一次抗体溶液と交換する。シェーカーの上に置き、RTで1.5時間インキュベートします。
- 1x PBSで皿を3回洗いすます。
- 1 μLのヤギ抗ウサギアレクサフルオール 488 2次抗体をPBSで1%NGSの1 mLに加えます(1:1000希釈)。皿からPBSを吸引し、二次抗体溶液と交換する。シェーカーの上に置き、RTで1時間インキュベートします。
- 1x PBSで皿を3回洗いすます。
- ステップ 8.7 ~ 8.10 を繰り返しますが、ステップ 8.7 の鶏抗 TH 一次抗体 (1:1000) とステップ 8.9 のヤギ抗鶏アレクサフルオール 594 二次抗体 (1:1000) を使用します。
- 最後のPBSリンスに続いて、30 μLの取り付け媒体を顕微鏡スライドに置きます。鉗子を使用して35 mmのペトリ皿からカバースリップをつかみ、取り付け媒体に下向きの細胞とカバースリップを置く。両方のカバーリップは、正しく配置された場合、単一の顕微鏡スライドに収まります。乾燥した暗い領域に置き、取り付け媒体を一晩乾燥させます。
免疫染色培養の共焦点イメージング
- 共焦点イメージング
- イメージング ソフトウェアを起動します。サンプルを顕微鏡のステージに置きます。
- 顕微鏡接眼レンズを用いて、TRITCフィルターを用いた20倍の倍率の目的と蛍光灯を用いて、試料を焦点を合わせ、TH+細胞体を探します。
- TH+ セルのボディを見つけたら、それを視野の中央に配置し、60 倍の拡大目標に移動します。
- 「染料リスト」ウィンドウでAlexaFluor 488とAlexaFluor 594染料を選択します。
- ライブイメージングと同様に、低HV、ゲイン、オフセット、レーザー電源設定から開始して、光の切り落としを防ぎます。「focus x2」スキャンオプションを使用して、各チャンネルの蛍光強度を評価し、それに応じて調整します。これらの画像は後で蛍光強度を定量化するため、画像の設定を全ての視野で一貫して保つ必要があります。したがって、各条件のいくつかの例を見て、サンプル全体の蛍光強度の範囲のアイデアを得ることをお勧めします。
- 理想的なイメージング設定が決定されたら、「フォーカスx2」スキャンオプションを選択し、対象セルを視野の中央に移動します。「ズーム」スライダを使用して、デジタルズームを3倍に増やします。
- フォーカスノブを使用して、最も明るい蛍光で焦点面を見つけ、単一の平面XY画像をキャプチャします。画像を保存して終了します。
- 別のTH +セルを検索するには、20倍の倍率の目的に戻ります。各条件から目的の数のセルがサンプリングされるまで、この手順を繰り返します。
- 画像解析
- [ImageJ] ツールバーで、[ 分析] をクリックします。[測定値]を設定し、[面積]、[統合密度]、[平均グレーの値] の各ボックスを選択します。
- ImageJ ツールバーにドラッグ アンド ドロップするか、ファイル メニューからイメージを選択して、各チャンネルを分離したハイパースタックとしてイメージを開きます。
- TH チャネル(594 nm)を使用して、セル本体の周囲に ROI を描画します。ImageJ のポリゴン トレース ツールを使用して、セルボディの外側のエッジを密接にトレースします。細胞膜と細胞核の距離が最も小さい場合は、細胞質ゾルを通って核の縁まで直線をたどり、それを排除するために核の輪郭に密接に従う。次に、直線を外部膜に戻し、初期線をできるだけ近づけて、ROIが完了するまで細胞体の輪郭に従い続けます。
- キーボードショートカット"T"を使用するか、ツールバーメニューパスを 使用して分析 |ツール |ROI マネージャを開き、ROI マネージャを開き、リストに引き出された ROI を追加します。
- カスパーゼ-3チャネル(488 nm)のウィンドウを選択し、「ROIマネージャ」リストから追加されたROIを選択します。
- [ROI マネージャ]ウィンドウで、[測定]ボタンを選択します。結果ウィンドウは、以前に設定された測定値と共に表示されます。これらをスプレッドシートにコピーし、各セルに対してこの手順を繰り返します。
結果
細胞の初期培養後、14 DIVで1μLのAAV hSyn-GCaMP6fでVM培養皿を処理し、5日間のウイルス発現を許可した。撮像HEPES記録バッファの当日に、フレッシュに調製した。我々は2つの条件を使用した。1つの条件では20 μMグルタミン酸を10分間塗布し、もう一方の条件では10 μM NBQXの塗布は10 μM NBQX + 20 μMグルタミン酸の10分共同塗布に先行した。両方の条件で、代表的な痕跡に示すように、自発的なCa2+フラックスを示すGCaMP6f蛍光の異種および自発的な変化を観察した(図1A、B、補足ムービー1-2)。20 μMグルタミン酸の適用は、自発的に活性および静止したニューロンの両方に強く持続したCa2+応答を生成した(図1A、補足ムービー1)。10 μM NBQXの適用は、自発的な活動を減少させ、グルタミン酸応答を部分的に遮断した(図1B、補足ムービー2)。グルタミン酸アプリケーションが各条件でCa2+応答を刺激した程度を、曲線下の面積、ピーク振幅、および遅延を使用して定量化した。曲線下及びピーク振幅の両方がグルタミン酸及びNBQX+グルタミン酸処理条件(図1C)の両方で類似していたが、一方、応答に対する遅延は、NBQX+グルタミン酸状態(.図2A,B)において有意に増加した。グルタミン酸処理に対するCa2+応答を定量化することに加えて、グルタミン酸媒介アポトーシスの尺度として、抗カスパーゼ-3抗体で試料を固定・染色した。我々は、条件にわたってカスパーゼ-3活性化の範囲を観察した(図3A,B)。カスパーゼ-3活性化は、測定領域および平均カスパーゼ-3強度によって定量した。未処理の対照細胞と比較すると、グルタミン酸およびNBQX+グルタミン酸状態下でカスパーゼ-3活性化を有する細胞の平均面積は有意性に向かう傾向にある(図3B)。平均カスパーゼ-3強度は、未治療のコントロールと比較してグルタミン酸およびNBQX+グルタミン酸状態において有意に高かった(図3B)。これらの結果は、ニューロンのアポトーシスを、興奮性物質に対するCa2+応答を定量化し、同じ培養物群におけるカスパーゼ-3活性化などの下流アポトーシス事象の分析を追跡することによって測定できる高含有フレームワークを示す。
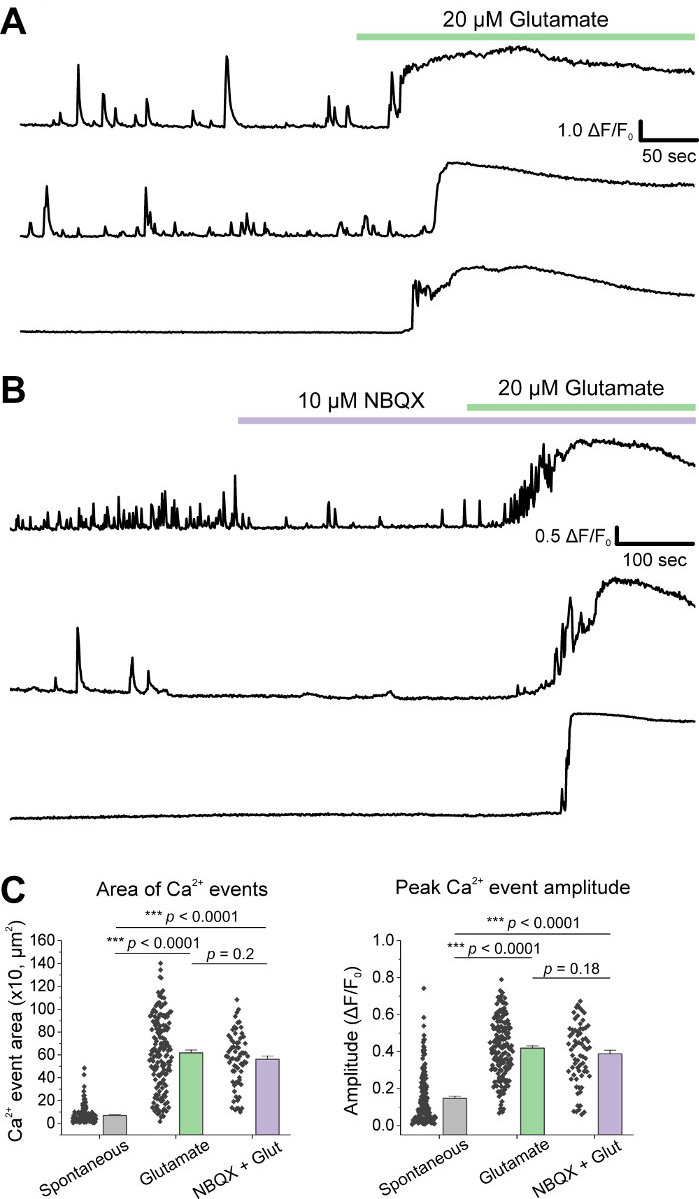
図1:培養腹側の脳包系ニューロンは、自発的なCa2+活性を示し、グルタミン酸アプリケーションによって強く刺激される。(A)VMニューロンにおける自発的Ca2+活性の代表的な痕跡と20μMグルタミン酸アプリケーションに対するそれらの反応。(B) VMニューロンにおける自発的Ca2+活性の代表的な痕跡と、10 μM NBQX + 20 μMグルタミン酸アプリケーションに対するそれらの反応。(C)Ca2+トレースの曲線下の面積とピーク振幅を示す人口データ。この図の大きなバージョンを表示するには、ここをクリックしてください。
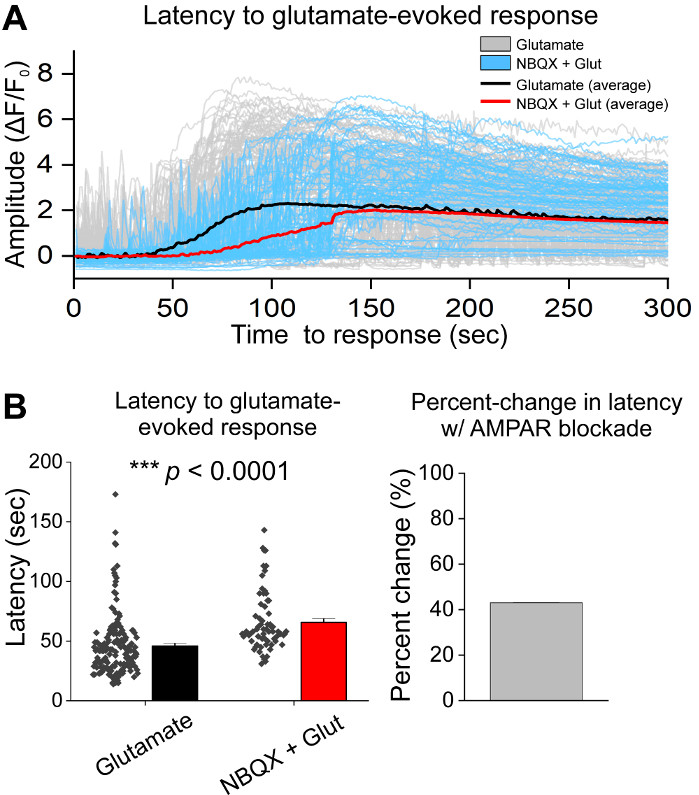
図2:NBQXによるAMPAR遮断は、培養された腹側中脳症ニューロンにおけるグルタミン酸アプリケーションへの応答を遅らせる。(A)代表Ca2+グルタミン酸(灰色)およびNBQX+グルタミン酸(青色)誘発応答の痕跡。平均Ca2+グルタミン酸(黒)およびNBQX+グルタミン酸(赤色)の痕跡が重ね合せて示されている。(B) グルタミン酸およびNBQX + グルタミン酸誘発応答に対する応答までの遅延を示す母集団データ。グルタミン酸とNBQX+グルタミン酸条件の間のパーセント変化は、右側のパネルに表示されます。この図の大きなバージョンを表示するには、ここをクリックしてください。
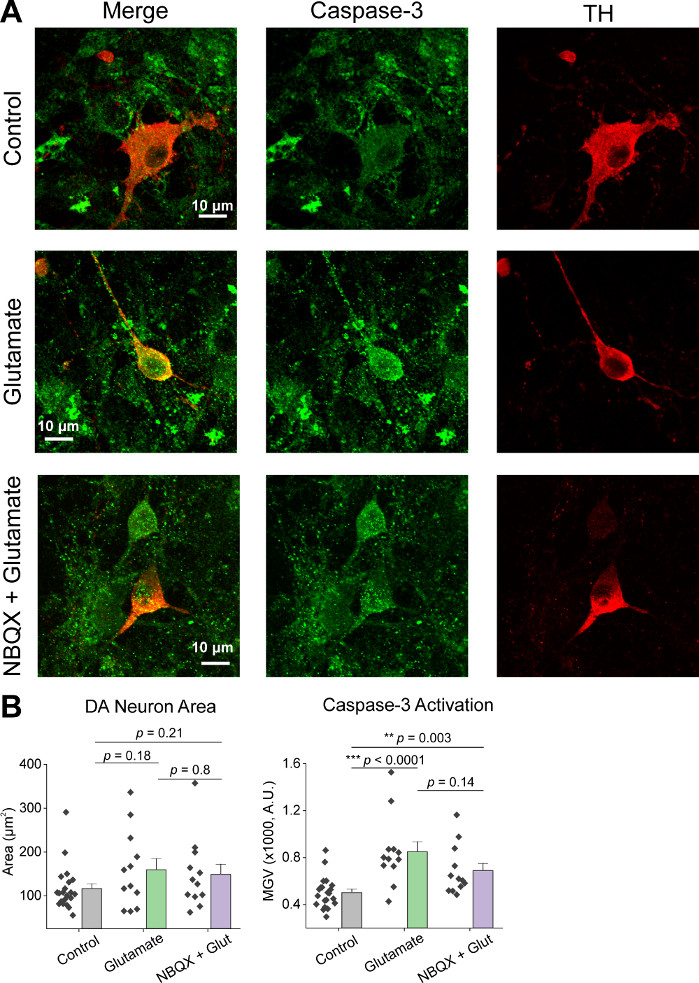
図3:グルタミン酸剤の適用はチロシンヒドロキシラーゼ(TH)陽性腹側中脳症ニューロンにおけるカスパーゼ-3発現を増加させる。(A)カスパーゼ-3(緑色)およびTH(赤色)に対して免疫染色されたVM培養物の代表的な共焦点像、スケールバー=10μm(B)各条件におけるDAニューロン領域および平均カスパーゼ-3発現のグレー値を示す集団データ。Bこの図の大きなバージョンを表示するには、ここをクリックしてください。
補足ムービー 1: 自発的な Ca2+ 活動とグルタミン酸アプリケーションへの応答.
HEPES記録バッファ(0-300 s)の存在下での自発的なCa2+ フラックスは、20 μMグルタミン酸(301-600 s)の適用に続く。スケールバー= 50 μm. こちらをクリックして、このビデオをダウンロードしてください。
補足ムービー2:NBQX +グルタミン酸アプリケーションへの自発的なCa2+ 活性と応答。
HEPES記録バッファ(0-300 s)の存在下での自発的なCa2+ フラックスは、10 μM NBQX(301-600 s)、10 μM NBQX + 20 μMグルタミン酸(601-900 s)の適用に続きます。スケールバー= 50 μm. こちらをクリックして、このビデオをダウンロードしてください。
ディスカッション
ニューロンにおけるグルタミン酸媒介アポトーシスの高含有解析のための長期一次腹側中脳症(VM)細胞培養システムについて述べた。研究は、PDモデル11、12,の文脈で興奮性メカニズムを解明するために主要な中脳ドーパミン作動性培養を採用している。本研究では、遺伝的にコード化されたカルシウム指標(GECI)を用いた組み合わせアプローチを用いてCa2+活性を測定し、さらにこの活性をアポトーシスシグナル伝達カスケードの開始などの下流分子変化と関連付ける。この方法は、他の類似した細胞培養系に対して複数の利点を有する。パーキンソン病の文脈における興奮毒性に特に関心を持っているため、一次VM細胞培養を使用することが理想的である。グリッド付きカバースリップやTH免疫染色と組み合わせた電動XY顕微鏡ステージなど、異なるフィールド再配置技術を用いることで、腹側中脳ニューロンにおけるグルタミン酸媒介アポトーシスの細胞型特異的効果を直接研究することができます。さらに、3週間の細胞培養モデルは、ニューロンが成人DAニューロン9を反映して、完全で成熟した分子プロファイルを開発することを可能にする。以前の方法は、主にグルタミン酸媒介性興奮毒性13,14,14に続く分子変化に焦点を当ててきた。このモデルは、神経生理学の急性変化と同定された細胞タイプの下流の分子事象を関連付ける能力においてユニークである。一次培養モデルの1つの制限は、解剖技術が、DAおよびGABAergicニューロンならびにSNcおよびVTAのニューロンを含む腹側中脳全体を捕捉することです。SNcのDAニューロンは、隣接するVTA15のDAニューロンと比較して、カルシウムおよび最終的な細胞死に対する選択的脆弱性を有することを示唆する証拠がある。残念ながら、胚培養中のVTAニューロンからSNcを分化することは、胚性脳内でこれらの構造を定義する解剖学的ランドマークがほとんどないことが証明されています。
我々は、一次培養技術が異種自発的なCa2+活性の定量化を可能にすることを実証する(図1)。したがって、これは、中脳のペース形成ドーパミン作動性ニューロン、新皮質ニューロン、および、二重化核(SCN)16,17のGABAergicニューロンなどの、細胞間でのペース形成などの細胞を調べるための17理想的な細胞培養系モデルである。ほとんどのアプリケーションでは、Ca2+イメージングは電気生理学と同じ時間的分解能を達成しません。したがって、単一のCa2+イベントは、ニューロン作用電位のバーストに類似している可能性が高い。これは、Ca2+イメージングがペースメイキング細胞における異常な破裂活性の比較的正確な尺度を可能にし、したがってCa2+-媒介した興奮性細胞死の高い含有量スクリーンに適していることを意味すると解釈することができる。
自発的なCa2+ 活性を達成し維持するためには、プロトコルの2つの重要なポイントに対処することが重要です。第1は、解剖後の細胞のめっき密度である。プライマリ VM ニューロンの場合、これまでの研究では、約 100,000 個のセル/cm29,10を使用しています。我々は、自発的な活動の異種の範囲を作成し、各カバースリップに存在するドーパミン作動性VMニューロンの数を増加させる200,000細胞/cm2の密度をプレートするプロトコルを適応させました。異なるペースメイキングニューロンは、異なる発火特性16を有するので、メッキ密度は、自発的な活動の理想的なレベルを達成するために研究され、最適化されている細胞の種類に合わせてカスタマイズする必要があります。第二は、AAVのウイルス感染後の潜伏時間である。めっき密度と同様に、これは使用されているAAVの研究問題とタイプの特定の文脈に依存する。ここで用いられる特定のAAVについては、ウイルス感染後の5日間のインキュベーションが所望のタンパク質発現レベルを達成するのに理想的であり、これはCa2+ 活性を記録するためにGCaMP蛍光の動的変化を可能にする。多くの要因は、AAVがその貨物をどれだけ迅速かつ効率的に表現するかを決定しますが、その多くは、この方法の範囲外ですが、簡単に言えば、プロモーター活性と貨物タンパク質が成熟し、折り畳む速度を考慮することが重要です。
この方法のもう1つの利点は、フォーマット、発現ベクター、イメージング機器の使用、および対処可能な科学的な質問の範囲においてかなりの柔軟性を可能にすることです。さらに、この方法は、PDにおけるグルタミン酸媒介性興奮毒性、および神経系機能不全の他のモデルを取り巻く広範な特定の質問に関する調査を可能にする。例えば、グルタミン酸媒介性興奮毒性は、複数の受容体およびシグナル伝達カスケード5を伴う。この方法を用いることによって、 図1のAMPARブロッカー、NBQXと共に示したように、興奮性グルタミン酸反応の特定の成分を生理学的および分子レベルで解剖することができる。おそらく、第二のメッセンジャーシステムの阻害剤を使用して同様のアプローチを使用して、興奮毒性へのそれらの寄与を決定することができる。さらに、ここで使用されるAAVは、細胞特異的プロモーターまたは神経伝達物質放出などの他のパラメータを測定するために使用できるAAV発現光遺伝学的センサーを備えたGECIを発現するように適応することができる。
一次胚分節と共焦点イメージングとは別に、プロトコルの多くは専門的な訓練を必要としない基本的な実験室のスキルを使用しています。したがって、モデルの限界は、胚解離技術の難しさ、成熟に達するまで細胞を培養しなければならない時間の長さ、および共焦点顕微鏡、または同様の画像化装置へのアクセスを含む。この方法の多くの利点と柔軟性がこれらの制限を上回り、神経系障害におけるグルタミン酸媒介性興奮毒性の役割を研究するための理想的なモデルとなる。最後に、このモデルは、抗アポトーシス効果とDAニューロンの健康を維持する能力のための新しい化合物をスクリーニングするための効果的なツールとなり得る。
開示事項
著者らは開示するものは何もない。
謝辞
米国パーキンソン病協会(APDA)とNIH R01NS115809-01からRSへの助成金によってサポートされています。テキサスA&Mゲノム医学研究所(TIGM)は、原発性ドーパミン作動性培養を生み出すタイミングの高い妊娠中のマウスを提供してくれたことに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 10% Formalin/PBS | VWR | 100496-506 | |
| 10X NA 0.3 water-immersion objective | Olympus | UMPLFLN10XW | |
| 12 mm circular cover glass No. 1 | Phenix Research Products | MS20-121 | |
| 20X NA 0.85 oil-immersion objective | Olympus | UPLSAPO20XO | |
| 35 mm uncoated plastic cell culture dishes | VWR | 25382-348 | |
| 40X NA 0.3 water-immersion objective | Olympus | LUMPLFLN40XW | |
| 60X NA 1.35 oil-immersion objective | Olympus | UPLSAPO60XO | |
| Ampicillin (sodium) | Gold Bio | A-301-25 | |
| B-27 supplement | ThermoFisher | 17504044 | 50x stock |
| Binolcular Microscope | Kent Scientific | KSCXTS-1121 | |
| Bovine serum albumin (BSA) | Sigma-Aldrich | A7030 | |
| Calcium Chloride (CaCl2), anhydrous | Sigma-Aldrich | 746495 | |
| Chicken polyclonal anti-Tyrosine Hydroxylase | Abcam | ab76442 | |
| Deoxyribonuclease I (DNase) | Sigma-Aldrich | DN25 | |
| D-glucose, andydrous | Sigma-Aldrich | RDD016 | |
| DMEM + GlutaMAX medium | ThermoFisher | 10569010 | 500 mL |
| Equine serum | ThermoFisher | 26050088 | heat-inactivated |
| Fiber Optic Illuminator, 100V | Kent Scientific | KSC5410 | |
| Filter System, PES 22UM 250ML | VWR | 28199-764 | |
| Fluoview 1000 confocal microscope | Olympus | ||
| Fluoview 1200 confocal microscope | Olympus | ||
| GlutaMAX supplement | ThermoFisher | 35050061 | |
| Goat polyclonal anti-chicken Alexa Fluor 594 | Abcam | ab150176 | |
| Goat polyclonal anti-rabbit Alexa Fluor 594 | Abcam | ab150077 | |
| Hanks-balanced Salt Solution (HBSS) 1x | ThermoFisher | 14175095 | 500 mL |
| HEPES | VWR | 101170-478 | |
| HeraCell 150 CO2 incubator | Heraeus (ThermoFisher) | ||
| ImageJ v1.52e | NIH | ||
| IRIS-Fine Scissors (Round Type)-S/S Str/31*8mm/13cm | RWD | S12014-13 | |
| Kanamycin monosulfate | Gold Bio | K-120-25 | |
| Laminin | Sigma-Aldrich | L2020 | |
| L-Ascorbic acid | Sigma-Aldrich | A7506 | |
| L-glutamic acid | VWR | 97061-634 | |
| Magnesium Chloride (MgCl2), andydrous | Sigma-Aldrich | M8266 | |
| MPII Mini-Peristaltic Pump, 115/230 VAC, 50/60 Hz | Harvard Apparatus | 70-2027 | |
| MULLER Micro Forceps-Str, 0.15mm Tips, 11cm | RWD | F11014-11 | |
| NBQX | Hello Bio | HB0443 | |
| Neurobasal medium | ThermoFisher | 21103049 | 500 mL |
| Normal goat serum (NGS) | Abcam | ab7481 | |
| Origin 2020 | OriginLab | ||
| pAAV.Syn.GCaMP6f.WPRE.SV40 | Addgene | 100837-AAV1 | Titer: 1.00E+13 gc/ml |
| Papain | Worthington Biomedical Corporation | LS003126 | |
| Penicillin streptomycin | ThermoFisher | 15140122 | 10,000 U/mL |
| Phosphate-buffered saline (PBS) 1x | ThermoFisher | 10010049 | 500 mL |
| Poly-L-lysine | Sigma-Aldrich | P4832 | |
| Poly-L-ornithine | Sigma-Aldrich | P4957 | |
| Potassium Chloride (KCl), anhydrous | Sigma-Aldrich | 746436 | |
| Pump Head Tubing Pieces For MPII | Harvard Apparatus | 55-4148 | |
| Rabbit monoclonal anti-caspase-3 | Abcam | ab32351 | |
| Sodium Chloride (NaCl), anhydrous | Sigma-Aldrich | 746398 | |
| Sucrose | Sigma-Aldrich | S7903 | BioXtra, ≥99.5% (GC) |
| Time-pregnant female C57BL/6 mice | Texas A&M Institue for Genomic Medicine | ||
| Triton X-100 | Sigma-Aldrich | X100 | 500 mL |
| Wide-bore blue pipette tips P1000 | VWR | 83007-380 |
参考文献
- Marras, C., et al. Prevalence of Parkinson's disease across North America. NPJ Parkinson's Disease. 4, 21 (2018).
- Poewe, W., et al. Parkinson disease. Nature Reviews Disease Primers. 3, 17013 (2017).
- Mehta, A., Prabhakar, M., Kumar, P., Deshmukh, R., Sharma, P. L. Excitotoxicity: bridge to various triggers in neurodegenerative disorders. European Journal of Pharmacology. 698 (1-3), 6-18 (2013).
- Ambrosi, G., Cerri, S., Blandini, F. A further update on the role of excitotoxicity in the pathogenesis of Parkinson's disease. Journal of Neural Transmission (Vienna). 121 (8), 849-859 (2014).
- Dong, X. X., Wang, Y., Qin, Z. H. Molecular mechanisms of excitotoxicity and their relevance to pathogenesis of neurodegenerative diseases. Acta Pharmaceutica Sinica B. 30 (4), 379-387 (2009).
- Vieira, M., et al. Excitotoxicity through Ca2+-permeable AMPA receptors requires Ca2+-dependent JNK activation. Neurobiology of Disease. 40 (3), 645-655 (2010).
- Sebe, J. Y., et al. Ca(2+)-Permeable AMPARs Mediate Glutamatergic Transmission and Excitotoxic Damage at the Hair Cell Ribbon Synapse. Journal of Neuroscience. 37 (25), 6162-6175 (2017).
- Brickley, S. G., Farrant, M., Swanson, G. T., Cull-Candy, S. G. CNQX increases GABA-mediated synaptic transmission in the cerebellum by an AMPA/kainate receptor-independent mechanism. Neuropharmacology. 41 (6), 730-736 (2001).
- Srinivasan, R., et al. Smoking-Relevant Nicotine Concentration Attenuates the Unfolded Protein Response in Dopaminergic Neurons. Journal of Neuroscience. 36 (1), 65-79 (2016).
- Henley, B. M., et al. Reliable Identification of Living Dopaminergic Neurons in Midbrain Cultures Using RNA Sequencing and TH-promoter-driven eGFP Expression. Journal of Visualized Experiments. (120), e54981 (2017).
- Douhou, A., Troadec, J. D., Ruberg, M., Raisman-Vozari, R., Michel, P. P. Survival promotion of mesencephalic dopaminergic neurons by depolarizing concentrations of K+ requires concurrent inactivation of NMDA or AMPA/kainate receptors. Journal of Neurochemistry. 78 (1), 163-174 (2001).
- Lavaur, J., et al. The noble gas xenon provides protection and trophic stimulation to midbrain dopamine neurons. Journal of Neurochemistry. 142 (1), 14-28 (2017).
- Kritis, A. A., Stamoula, E. G., Paniskaki, K. A., Vavilis, T. D. Researching glutamate - induced cytotoxicity in different cell lines: a comparative/collective analysis/study. Frontiers in Cellular Neuroscience. 9, 91 (2015).
- Gupta, K., Hardingham, G. E., Chandran, S. NMDA receptor-dependent glutamate excitotoxicity in human embryonic stem cell-derived neurons. Neuroscience Letters. 543, 95-100 (2013).
- Surmeier, D. J., Obeso, J. A., Halliday, G. M. Selective neuronal vulnerability in Parkinson disease. Nature Reviews Neuroscience. 18 (2), 101-113 (2017).
- Ramirez, J. M., Tryba, A. K., Pena, F. Pacemaker neurons and neuronal networks: an integrative view. Current Opinion in Neurobiology. 14 (6), 665-674 (2004).
- Guzman, J. N., Sanchez-Padilla, J., Chan, C. S., Surmeier, D. J. Robust pacemaking in substantia nigra dopaminergic neurons. Journal of Neuroscience. 29 (35), 11011-11019 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved