Method Article
Quantification spontanée Ca2+ Fluxes et leurs effets en aval dans les neurones midbrains de souris primaires
Dans cet article
Résumé
Ici, nous présentons un protocole pour mesurer in vitro Ca2 + flux dans les neurones midbrain et leurs effets en aval sur caspase-3 en utilisant les cultures primaires de la souris midbrain. Ce modèle peut être employé pour étudier les changements pathophysiologiques liés à l’activité anormale de Ca2+ dans les neurones midbrain, et pour dépister de nouvelles thérapies pour des propriétés anti-apoptotiques.
Résumé
La maladie de Parkinson (MP) est une maladie neurodégénérative dévastatrice causée par la dégénérescence des neurones dopaminergiques (DA). L’afflux excessif de Ca2+ dû à l’activation anormale des récepteurs de glutamate a des résultats dans l’excitotoxicité de DA et a été identifié comme un mécanisme important pour la perte de neurone de DA. Dans cette étude, nous isolons, dissocions, et culture neurones midbrain du mésencéphalon ventral de souris (VM) des embryons de souris ED14. Nous infectons ensuite les cultures primaires à long terme de la souris midbrain avec un virus adéno-associé (AAV) exprimant un indicateur génétiquement codé de calcium, GCaMP6f sous le contrôle du promoteur humain de synapsine neurone-spécifique, hSyn. En utilisant l’imagerie confocale vivante, nous montrons que les neurones de midbrain de souris cultivées affichent des flux spontanés de Ca2+ détectés par AAV-hSyn-GCaMP6f. L’application de bain des cultures de glutamate à midbrain cause des élévations anormales dans le Ca2+ intracellulaire dans les neurones et ceci est accompagné de l’activation de caspase-3 dans les neurones de DA, comme démontré par immunostaining. Les techniques pour identifier l’apoptose médiée par le glutamate dans les neurones DA de souris primaires ont des applications importantes pour le dépistage à haute teneur des médicaments qui préservent la santé des neurones DA.
Introduction
La maladie de Parkinson (MP) est la deuxième maladie neurodégénérative la plus courante dans le monde, sans traitement connu. Les estimations suggèrent que la prévalence de la MP continuera d’augmenter et devrait dépasser le million de diagnostics d’ici 2030 rien qu’aux États-Unis1. Avec peu de traitements efficaces actuellement disponibles pour lutter contre la MP, il est urgent de développer des thérapies plus efficaces. La MP se caractérise par une perte rapide et progressive des neurones de dopamine de midbrain (DA)2. Les mécanismes qui sous-tendent la neurodégénérescence dans la MP sont mal compris. Les preuves suggèrent une convergence probable de mécanismes multiples, tels que le stress oxydatif et le dysfonctionnement mitochondrial, etc. qui contribuent à l’initiation des cascades de signalisation apoptotique et la mort cellulaire éventuelle3.
Un tel mécanisme convergent, l’excitotoxicité glutamate-médiée a été impliqué dans de multiples maladies neurodégénératives, y compris4. Alors que l’exctotoxicité médiée par le glutamate est pensé pour fonctionner principalement par la stimulation des récepteurs NMDA via une augmentation excessive de la concentration intracellulaire Ca2 + et l’initiation éventuelle de l’apoptose, Ca2 +-perméables récepteurs AMPA ont également été impliqués dans la réponse excitototoxique5,6,7. Par conséquent, il est intéressant de déterminer la contribution des récepteurs AMPA à l’apoptose médiée par le glutamate dans un modèle de. Ceci peut être réalisé à l’aide de NBQX, un bloqueur AMPA et kainate, qui à des concentrations micromolaires est sélectif pour les récepteurs AMPA8. L’excitotoxicité médiée par le glutamate et les cascades de signalisation apoptotique sont une cible idéale en aval pour mesurer l’étendue de la mort cellulaire, et une cible potentielle pour l’intervention thérapeutique. Par conséquent, le développement d’une méthode à forte teneur pour évaluer la modulation médiée par le glutamate de l’activité du calcium et la signalisation en aval associée dans les neurones mésencéphaliques ventrals primaires (VM) serait utile pour le dépistage de nouvelles méthodes de traitement sur leur capacité à préserver la santé neuronale.
Ici, nous avons développé un protocole dans lequel nous exprimons l’indicateur de calcium génétiquement codé (GECI), GCaMP6f, en utilisant AAV2/5 avec le promoteur de synapsine humaine (hSyn) pour mesurer l’activité Ca2+ des neurones primaires VM de souris en réponse à l’application de glutamate qui peut être mesurée au niveau physiologique et moléculaire. Ce dépistage à haute teneur peut être adapté pour la découverte de produits pharmaceutiques ou de traitements qui modulent l’activité de Ca2+ afin de préserver la santé des neurones VM. Nous proposons que ce modèle de culture primaire soit un moyen efficace de dépister de nouvelles interventions de, basée sur leur capacité à préserver la santé des neurones VM et à atténuer la progression de la MP.
Protocole
Toutes les procédures impliquant l’utilisation de sujets animaux ont été approuvées par le Texas A&M University Institutional Animal Care and Use Committee (25e Nov 2019; AUP# 2019-0346).
REMARQUE : La préparation de solutions de culture cellulaire doit être effectuée à l’aide d’une procédure stérile dans un cabinet de sécurité biologique et filtrée à 0,2 μm pour prévenir la contamination.
1. Préparation de solutions et de culture
- Préparer la solution de revêtement de laminine en diluant 20 μL de 1 mg/mL de laminine en 2 mL de H2O. distillé stérile le jour de la dissection.
- Préparez une solution d’arrêt de sérum équin (cheval) (ES) à 10 % en ajoutant 5 mL d’ES à 45 mL de 1x Hank’s Balanced Salt Solution (HBSS). Filtre stérile à l’aide d’un système de filtre de 0,2 μm ou d’une pointe de filtre à seringues. Conserver à 4 °C.
- Préparer une solution de stock d’albumine de sérum bovin (BSA) de 4 % en ajoutant 2 g de poudre BSA à 1 x saline tamponnée de phosphate (PBS) et en portant à un volume final de 45 mL. Filtre stérile à l’aide d’un système de filtre de 0,2 μm ou d’une pointe de filtre à seringues. Conserver à 4 °C.
- Préparer la solution de stock de papain en diluant la papaine à 3 mg/mL dans 1x HBSS. Filtre stérile à l’aide d’un système de filtre de 0,2 μm ou d’une pointe de filtre à seringues. Conserver à -20 °C.
- Préparer la solution de désoxyribonucléase (DNase) en ajoutant 20 mg de poudre de DNase à H2O stérile et en portant à un volume final de 20 mL. Filtre stérile à l’aide d’un système de filtre de 0,2 μm ou d’une pointe de filtre à seringues. Conserver à -20 °C.
- Préparer la solution de stock d’acide ascorbique en ajoutant 352 mg d’acide ascorbique à H2O distillé stérile et en portant à un volume final de 20 mL. Chauffer dans un bain de 37 °C pour dissoudre si nécessaire. Filtre stérile à l’aide d’un système de filtre de 0,2 μm ou d’une pointe de filtre à seringues. Conserver à -20 °C.
- Préparer la culture cellulaire moyenne en ajoutant ce qui suit à 50 mL de milieu neurobasal: 500 μL de Glutamax (100x), sérum équin 500 μL, 1 mL de B-27, 100 μL d’acide ascorbique, 500 μL de pénicilline-streptomycine, 50 μL de kanamycine et 50 μL d’ampicilline. Filtre stérile à l’aide d’un système de filtre de 0,2 μm. Conserver à 4 °C.
- Préparez 0,01% Triton X-100 Solution en ajoutant 1 mL de Triton X-100 en 9 mL de 1x PBS pour faire une solution de 10%. Comme Triton X-100 est visqueux, pipette lentement pour permettre à la pointe de remplir complètement. Chauffer dans un bain de 37 °C pour dissoudre si nécessaire. Conserver à 4 °C.
- Pour diluer 10% Triton X-100 stock à 0,01%, effectuer 3 série 1:10 dilutions. Diluer 1 mL de 10% de stock en 9 mL de 1x PBS pour faire 1% de solution. Diluer 1 mL de 1% de solution en 9 mL de 1x PBS pour faire 0,1% de solution. Diluer 1 mL de 0,1% solution en 9 mL de 1x PBS pour faire une solution de 0,01%.
- Préparer une solution normale de sérum de chèvre (NGS) de 10 % et 1 % en ajoutant 1 mL de NGS à 9 mL de 1 x PBS pour une solution de 10 %. Ajouter 100 μL de NGS à 9,9 mL de 1x PBS pour faire une solution de 1%.
- Préparer la solution de bouillon de glutamate (100 mM) en ajoutant 735 mg d’acide L(+)-Glutamique à H2O o distillé stérile et porter à un volume final de 50 mL. La solubilité à cette concentration sera un problème. L’ajout de petits volumes (100 μL) d’acide chlorhydrique de 1 M est suffisant pour augmenter la solubilité.
- Préparer la solution de stock NBQX (10 mM) en ajoutant 50 mg de NBQX à H2O distillé stérile et porter à un volume final de 13 mL.
2. Préparation de plats de culture et de couvertures (Fait la veille de la dissection)
NOTE : Nous avons constaté que la combinaison de trois agents de revêtement, la poly-L-lysine, la poly-L-ornithine et la laminine permet l’adhérence et la viabilité cellulaires idéales.
- Placer 10 boîtes de Pétri de 35 mm dans une armoire de sécurité biologique. Placer deux couvercles circulaires de 12 mm dans chaque plat et remplir de 70% d’EtOH pendant 10 min. Utilisez une ligne sous vide pour aspirer le reste de l’EtOH de chaque plat, permettant à l’EtOH de s’évaporer complètement.
- Pipette ~90-100 μL de 0,1% solution poly-L-lysine sur chaque couvercle, en s’assurant que l’ensemble du couvercle est couvert par la solution poly-L-lysine. Couvrir les plats de couvercles et placer dans un incubateur de 37 °C pendant 1 h.
- Aspirate restant la solution poly-L-lysine de chaque couvercle et rincer avec H2O stérile.
- Répétez les étapes 2.2 – 2.3 avec la solution poly-L-ornithine de 0,1%.
- Encore une fois, répétez les étapes 2.2 – 2.3 avec la solution laminine de 0.01%. Placer dans un incubateur de CO2 à 37 °C/5 % jusqu’à ce qu’il soit prêt pour le placage cellulaire le lendemain.
3. Dissections embryonnaires de souris
REMARQUE : Nous utilisons entre 4 et 6 souris enceintes chronométrées par culture. Bien qu’une grande partie du processus de dissection se produise à l’extérieur d’un cabinet de sécurité biologique, il est toujours important de maintenir la procédure stérile. L’utilisation abondante de 70% d’EtOH sur les surfaces près du microscope de dissection et sur les outils chirurgicaux est idéale. Un masque peut également être porté pendant la dissection pour prévenir davantage la contamination. En outre, nous utilisons 4 antibiotiques distincts dans le milieu de la culture, de sorte que la contamination est peu probable. Cependant, si l’utilisation des antibiotiques est problématique, cette configuration de dissection pourrait être déplacée à l’intérieur d’un capot stérile. Pour préserver la viabilité cellulaire, toutes les solutions de dissection doivent être pré-réfrigérées à 4 °C, et les dissections doivent être effectuées le plus rapidement possible. Nous n’effectuons pas les dissections sur la glace. La méthode de dissection des neurones embryonnaires de la souris midbrain est identique aux méthodes précédemment décrites9,10.
- Préparez un espace sur un banc près d’un microscope à dissection avec un tampon absorbant et pulvérisez généreusement avec 70% d’EtOH.
- Vaporiser deux boîtes petri en verre de 100 x 15 mm et une boîte petri en verre de 50 x 10 mm avec 70 % d’EtOH et permettre à EtOH de s’évaporer. Une fois évaporé, placer 50 mL de 1x HBSS stérile dans chaque plat petri de 100 x 15 mm.
- Submerger les ciseaux chirurgicaux, les forceps et la lame microtome dans 70% EtOH pendant 10 min minimum à stériliser. Déposer les instruments sur le tampon absorbant pour sécher.
- En utilisant le CO2 suivi d’une dislocation cervicale, euthanasier les souris de grossesse chronométrées de 2 à 3 mois le jour embryonnaire 14.
- Vaporiser l’abdomen des souris euthanasiées avec 70% d’EtOH. À l’aide de forceps saisir le bas-ventre et d’ouvrir la cavité abdominale à l’aide de ciseaux chirurgicaux. Commencez à couper près de l’endroit où les forceps tiennent l’abdomen, faisant des coupures latérales de chaque côté jusqu’à ce que la paroi abdominale peut être repliée en arrière et l’utérus est clairement visible.
- À l’aide de ciseaux chirurgicaux, couper les deux extrémités de la corne utérine. Ensuite, retirer l’utérus et placer dans la boîte de Pétri avec 1x HBSS.
- En utilisant des forceps à pointe droite, retirez soigneusement les embryons de l’utérus. Laissez les embryons dans le HBSS tout au long de ce processus. À l’aide de forceps ou d’une lame de microtome, décapitez rapidement les embryons en coupant près du cou. Faire une coupe aussi de niveau que possible.
- Sous un microscope de dissection, déplacez une tête d’embryon vers une boîte de Pétri sèche de 50 mm et placez-la sur le côté ventral. Stabiliser la tête au forceps en plaçant et en pénétrant près des yeux/museau. Les forceps doivent être inclinés vers le bas à ~45° pour éviter de pénétrer le mésencéphale.
- En utilisant les forceps dans l’autre main, enlever soigneusement la couche translucide de la peau et du crâne juste avant la crête proéminente du mésencéphalon. Commencez près de la ligne médiane et retirez la peau et le crâne de façon caudalement jusqu’à ce que le mésencéphale soit entièrement exposé.
- Maintenez les forceps perpendiculaires au mésencéphale exposé avec une pointe entre le cortex et le mésencéphale et l’autre près du cervelet. Appuyez sur vers le bas et pincez les forceps ensemble pour enlever l’ensemble du cerveau moyen. Le segment midbrain doit être d’environ 0,5 mm d’épaisseur. Placez le segment midbrain dans la deuxième boîte de Pétri remplie de 1x HBSS frais. Répétez ce processus pour chaque embryon.
- À l’aide du microscope de dissection, positionnez le segment du cerveau avec le côté ventral orienté vers le haut. Si les méninges sont encore attachées, retirez-le soigneusement en saisissant avec les forceps et en soulevant et en s’éloignant du segment du cerveau.
- Le segment du cerveau devrait avoir 4 quadrants visibles. Placez le segment de telle manière que les deux quadrants plus petits sont positionnés supérieurs aux deux plus grands quadrants. Il y a une crête proéminente séparant les deux (petits) quadrants supérieurs des deux (grands) quadrants inférieurs.
- En utilisant les forceps pincer et séparer les quadrants supérieurs des quadrants inférieurs, puis jeter les quadrants supérieurs. Les quadrants inférieurs restants auront l’excès de tissu latéralement sur le côté dorsal, ce tissu semblera moins opaque que le tissu ventral restant. Retirer le tissu dorsal moins dense et jeter. Le segment restant doit contenir à la fois le Substantia nigra pars compacta (SNc) et la zone ventrale tegmental (VTA).
- L’utilisation des forceps a coupé le segment de tissu ventral restant en 4 petits morceaux et à l’aide d’une pipette de forage de 1mL de large transférer ces segments dans un tube conique de 15 mL avec 1x HBSS. Gardez le tube conique avec des segments de cerveau sur la glace tout au long de la procédure.
- Répétez ce processus pour tous les segments du cerveau restants.
4. Dissociation des cellules
- Digestion enzymatique des cellules
- Aspirate soigneusement le HBSS du tube conique de 15 mL contenant des segments de cerveau milieu, laissant les segments au fond du tube.
- Ajouter ~800 μL de solution de papain au tube et placer dans un incubateur de 37 °C pendant 7 min. Resuspender les cellules en faisant glisser le tube et remplacer à l’incubateur de 37 °C pour un supplément de 7 min.
- Avec une pointe de pipette de 1 mL à large alésage, n’enlevez que les segments de cerveau milieu dans un aliquot de 1 mL de DNase. Laisser les segments atteindre le bas de l’aliquot ou environ 1 min d’exposition.
- À l’aide d’une pointe de pipette de 1 mL, retirez seulement les segments de cerveau milieu dans un tube conique de 15 mL contenant 2 ml de solution d’arrêt. Laisser les segments s’installer au fond du tube et répéter le rinçage dans un tube conique supplémentaire rempli de solution d’arrêt.
- Trituration mécanique de la suspension cellulaire
- Dans le deuxième tube de rinçage de solution d’arrêt, à l’aide d’une pointe de pipette de 1 mL, pipette les cellules de haut en bas 10 fois jusqu’à ce qu’il n’y ait pas de grands segments de tissu visibles. Il est important d’éviter la trituration pour une lyse cellulaire minimale.
- Lentement pipette 300 μL de 4% BSA solution au fond du tube conique de 15 mL contenant des segments du cerveau. Retirez soigneusement la pointe de la pipette pour maintenir une couche de suspension. Centrifugeuse à 0,4 x g pendant 3 min. Puis aspirate soigneusement les cellules supernatantes et resuspend dans 400 μL de milieu de culture cellulaire.
5. Placage des cellules
REMARQUE : D’après l’expérience, environ 100 000 cellules viables par embryon sont collectées. Les souris enceintes chronométrées de 2 à 3 mois ont généralement des portées de 8 à 10 embryons; par conséquent, une estimation approximative du rendement total des cellules par souris enceinte chronométrée est d’environ 1 million de cellules.
- À l’aide d’un hémocytomètre préforment un nombre de cellules, puis diluez la suspension à 2 000 cellules/μL à l’aide d’un milieu de culture cellulaire. Triturate brièvement à mélanger.
- Retirez les couvercles avec la solution laminine de l’étape 2 de l’incubateur et aspirez la solution de laminine restante des couvercles enduits à l’aide d’un vide. Plaquez rapidement pour éviter que les couvercles ne sèchent complètement. Pipette 100 μL (2,0 x 105 cellules/coverslip) sur chaque couvercle et placer les plats Petri dans un incubateur de 37 °C pendant 1 h.
- Ajouter soigneusement 3 mL de milieu de culture cellulaire à chaque plat et remettre dans l’incubateur à 37 °C. Préformer les changements mi-moyens 2 fois par semaine pendant 2 semaines.
6. Infection de la culture cellulaire à 14 DIV avec des vecteurs viraux adéno-associés (AAV)
- Pour chaque plat préparer 1 mL de sérum sans DMEM moyen avec 1 μL de hSyn-GCaMP6f AAV (1,0 x 1013 titer)
- Remplacer le milieu de culture cellulaire de chaque plat et remplacer par 1 mL de DMEM sans sérum contenant hSyn-GCaMP6f. Remettre les plats dans l’incubateur de 37 °C pendant 1 h.
- Remplacer le milieu sans sérum contenant des AAV et remplacer par 3 mL de milieu de culture cellulaire. Remettre les plats dans l’incubateur à 37 °C. Nous avons constaté que 5-7 jours d’infection à AAV permet des niveaux idéaux d’expression GCaMP. Continuer à changer de milieu tous les 2-3 jours tout au long de cette période d’infection virale.
7. Live confocal Ca2+ imagerie entre 19-21 DIV
REMARQUE : Comme mentionné à l’étape 6.3, l’imagerie peut se faire entre 5 et 7 jours après l’infection virale. C’est la fenêtre idéale pour obtenir l’expression visible du fluorophore aux niveaux qui permettent la détection de l’activité spontanée de Ca2+.
- Préparation des tampons d’enregistrement
- Pour faire 1 L de tampon d’enregistrement HEPES, ajouter: 9.009 g de NaCl, 0,3728 g de KCl, 0,901 g de D-glucose, 2,381 g de HEPES, 2 mL de 1 M CaCl2 solution de stock, et 500 μL de 1 M MgCl2 solution de stock à 800 mL de H2O stérile distillé. Porter le pH à 7,4 avec NaOH. Porter à un volume final de 1 L.
- Pour faire 200 mL de tampon d’enregistrement de glutamate de 20 μM, diluer 40 μL de 100 mM solution de stock de glutamate dans 200 mL de tampon d’enregistrement HEPES décrit ci-dessus.
- Pour faire 200 mL de 10 μM NBQX tampon d’enregistrement, diluer 200 μL de 10 mM NBQX solution de stock dans 200 mL de tampon d’enregistrement HEPES.
- Imagerie confocale
- Remplir une boîte de Pétri stérile de 35 mm avec 3 mL de tampon d’enregistrement.
- Retirer une boîte de Pétri de 35 mm avec des cultures infectées de l’incubateur de 37 °C. À l’aide de fines pointes, saisissez soigneusement le bord d’un couvercle et transférez-le rapidement dans la boîte de Pétri remplie de tampon d’enregistrement. Remettre le couvercle restant en milieu dans l’incubateur à 37 °C. Transporter le plat avec tampon d’enregistrement au microscope confocal.
- Démarrez le logiciel d’imagerie. Passez à l’étape suivante pendant qu’il initialise.
- Démarrez la pompe péristaltique et placez la ligne dans la mémoire tampon d’enregistrement. Calibrer la vitesse de débit à 2 mL/min.
- Transférer le couvercle infecté de la boîte de Pétri de 35 mm dans le bain d’enregistrement.
- En utilisant l’objectif d’immersion 10x d’eau et la lumière BF, trouver le plan de mise au point et chercher une région avec une forte densité de corps cellulaires neuronaux. Passez à l’objectif d’immersion 40x et en utilisant la lumière BF recentrer l’échantillon.
- Dans la fenêtre « Liste des colorants » de FluoView, sélectionnez AlexaFluor 488 et appliquez-la.
- L’expression AAV peut être variable; par conséquent, afin d’éviter la surexposition et le photobleaching des fluorophores, commencez par des réglages de puissance de HV et laser bas. Pour le canal AlexaFluor 488, réglez la haute tension (HV) à 500, le gain à 1x, et compensez à 0. Pour la ligne laser 488 réglé la puissance à 5%. Afin d’augmenter le volume effectif de l’image dans le plan z, augmenter la taille du trou d’épingle à 300 μm. Utilisez l’option de numérisation « Focus x2 » pour ajuster de façon optimale les signaux d’émission aux niveaux de sous-saturation. À partir de là, les réglages peuvent être ajustés jusqu’à ce qu’une visibilité idéale de chaque canal soit atteinte.
REMARQUE : Pour capturer avec précision la gamme complète des flux Ca2+ avec GCaMP, réglez les paramètres de base HV et de puissance laser afin de permettre une augmentation de l’intensité fluorescente sans sursaturation du détecteur. - Une fois que les réglages du microscope sont optimisés, déplacez l’étape afin de localiser une région avec plusieurs cellules affichant des changements spontanés dans la fluorescence GCaMP6f et de se concentrer sur le plan souhaité pour l’imagerie.
- Utilisez l’outil « Clip rect » pour couper le cadre d’imagerie à une taille qui peut atteindre un intervalle de cadre d’un peu moins d’une seconde. Ceci est nécessaire pour régler l’intervalle d’imagerie à 1 image par seconde.
- Définissez la fenêtre « Intervalle » sur une valeur de 1,0 et la fenêtre « Num » sur 600.
REMARQUE : Afin de fournir différents tampons d’enregistrement au point de temps souhaité (300 s), il est important de calibrer la latence de la pompe pour fournir la nouvelle solution au bain. Cela dépendra du taux de perfusion de la solution (2 mL/min) et de la longueur de la ligne utilisée pour pomper la solution. - Pour capturer un film de série t, sélectionnez l’option « Heure », puis utilisez l’option de numérisation « XYt » pour commencer l’imagerie.
- Regardez la barre de progression de l’imagerie et déplacez la ligne de la mémoire tampon d’enregistrement HEPES dans la mémoire tampon d’enregistrement du glutamate de 20 μM au point de travail approprié (p. ex., si la latence de la pompe est calibrée pour fournir la solution à 60 s, déplacez la ligne dans la mémoire tampon de glutamate à 240 images afin de délivrer du glutamate à 300 s).
- Lorsque l’imagerie est terminée, sélectionnez le bouton Série terminée et enregistrez le film de la série t terminée. Continuer à perfuse 20 μM Glutamate pour un supplément de 5 min, de sorte que les neurones cultivés ont été exposés au glutamate pour un total de 10 min. Répétez ce processus pour chaque couverture à imager.
- Après l’exposition supplémentaire de 5 minutes au glutamate de 20 μM, retirez le couvercle du bain et placez-le dans la boîte de Pétri de 35 mm contenant un tampon d’enregistrement jusqu’à ce que le jour de l’imagerie soit terminé. Une fois terminé, passez à l’étape 8.
- Analyse des traces ca2+
- Effectuez l’analyse d’image dans ImageJ. Installez le plugin BIO-FORMATS pour ImageJ, ce qui vous permettra . Fichiers d’image OIB à ouvrir.
- Dans la barre d’outils ImageJ, cliquez sur Analyser | Définissez les mesureset sélectionnez la zone pour la valeur grise moyenne (MGV).
- Dans ImageJ, ouvrez un film de série T comme une hyperstack.
- Faites glisser le curseur pour le film et identifiez le cadre avec une réponse maximale au glutamate pour visualiser tous les neurones qui répondent au glutamate. Utilisez l’outil polygone pour retracer tous les corps de cellules neuronales visibles, en ajoutant leurs TORI à la liste « Gestionnaire de roi ».
- Lorsque vous avez terminé le traçage et l’ajout d’TORI, sélectionnez tous les TORI de la fenêtre Gestionnaire de retour sur investissement et utilisez la sélection multi-mesures dans la liste plus d’options. Copiez et collez ces données dans une feuille de calcul. Terminez ce processus pour que tous les films soient analysés.
- Pour chaque retour sur investissement, convertir les données MGV brutes de chaque image en valeurs ΔF/F0 à l’aide de l’équation : ΔF/F0 = [F(t) – F0] / F0. Où F(t) = MGV d’un cadre donné, et F0 = MGV de base moyen d’environ 10 images où aucun ca2+ flux sont présents.
- À l’aide d’un logiciel statistique tel qu’OriginPro 2020, les traces ΔF/F0 converties peuvent être transformées en graphiques en ligne. La fonction « Analyseur de pointe » peut être utilisée (ou fonction similaire si vous utilisez un logiciel différent) pour mesurer l’amplitude maximale de la réponse au glutamate, la latence pour répondre au glutamate et la zone sous la courbe.
8. Immunostaining des cultures
REMARQUE : Après fixation avec la formaline, les couvercles peuvent être stockés dans 1x PBS à 4 °C jusqu’à ce qu’ils soient prêts à être traités pour l’immunostaining. L’incubation primaire et secondaire d’anticorps a été faite en série, en tant que telle incubation avec l’anticorps primaire anti-Caspase-3 et son anticorps secondaire complémentaire a précédé l’incubation avec l’anticorps primaire anti-TH et son anticorps secondaire complémentaire.
- Immédiatement après l’exposition au glutamate, remettre le couvercle dans sa boîte de Pétri de 35 mm, apirate le tampon d’enregistrement et ajouter 3 mL de formaline à 10 %. Laisser reposer 40 min à température ambiante (RT).
- Rincer le plat 3 fois avec 1x PBS.
- Apirate le PBS et les cellules perméabilisées dans 1 mL de 0,01% Triton X-100 en PBS pendant 2 min.
- Rincer le plat 3 fois avec 1x PBS.
- Apirate les cellules PBS et bloquer dans 1 mL de 10% NGS dans PBS pendant 40 min.
- Rincer le plat 3 fois avec 1x PBS.
- Ajouter 1 μL d’anticorps primaire anti-Caspase-3 de lapin à 1 mL de 1% de NGS dans PBS (dilution de 1:1000). Remplacer pbs du plat et remplacer par la solution d’anticorps primaire. Déposer sur un shaker et incuber pendant 1,5 h à RT.
- Rincer le plat 3 fois avec 1x PBS.
- Ajouter 1 μL d’anticorps secondaire AlexaFluor 488 de chèvre à 1 mL de 1% NGS dans PBS (dilution de 1:1000). Remplacer pbs du plat et remplacer par la solution d’anticorps secondaire. Placer sur un shaker et incuber pendant 1 h à RT. Aller de l’avant protéger les échantillons de la lumière.
- Rincer le plat 3 fois avec 1x PBS.
- Répétez les étapes 8.7 – 8.10, mais en utilisant l’anticorps primaire anti-TH de poulet (1:1000) dans l’étape 8.7 et l’anticorps secondaire AlexaFluor 594 de chèvre (1:1000) dans l’étape 8.9.
- Après le rinçage final du PBS, placez 30 μL de milieu de montage sur une lame de microscope. À l’aide de forceps, prenez un couvercle de la boîte de Pétri de 35 mm et placez le couvercle avec les cellules orientées vers le bas dans le milieu de montage. Les deux couvercles s’adapteront sur une seule lame de microscope si elles sont placées correctement. Placer dans une zone sèche et sombre et laisser sécher le milieu de montage pendant la nuit.
9. Imagerie confocale des cultures immunostained
- Imagerie confocale
- Démarrez le logiciel d’imagerie. Placez l’échantillon sur le microscope.
- Avec les oculaires au microscope, à l’aide d’un objectif de grossissement de 20x et d’une lumière épifluorère avec un filtre TRITC, concentrez l’échantillon et recherchez un corps cellulaire TH+.
- Une fois qu’il a localisé un corps cellulaire TH+, centrez-le dans le champ de vision, puis passez à l’objectif de grossissement 60x.
- Sélectionnez les colorants AlexaFluor 488 et AlexaFluor 594 dans la fenêtre « liste de teintures ».
- Comme avec l’imagerie en direct, commencez par un faible HV, gain, décalage, et les paramètres de puissance laser pour empêcher le photobleaching. Utilisez l’option d’analyse « focus x2 » pour évaluer l’intensité fluorescente de chaque canal et ajuster en conséquence. Comme ces images seront quantifiées ultérieurement pour l’intensité fluorescente, il est nécessaire de garder les paramètres d’imagerie cohérents dans tous les champs de vision. Par conséquent, il est préférable de regarder quelques exemples de chaque condition pour avoir une idée de la gamme de l’intensité fluorescente à travers les échantillons.
- Une fois que les paramètres d’imagerie idéaux sont déterminés, sélectionnez l’option d’analyse « Focus x2 » et déplacez la cellule d’intérêt au centre du champ de vision. Augmentez le zoom numérique à 3x à l’aide du curseur « oo ».
- À l’aide du bouton de mise au point, trouvez le plan de mise au point avec la fluorescence la plus brillante et capturez une seule image XY plan. Enregistrez l’image pour terminer.
- Revenez à l’objectif de grossissement 20x pour rechercher une autre cellule TH+. Répétez ce processus jusqu’à ce que le nombre souhaité de cellules ait été échantillonné à partir de chaque condition.
- Analyse d’image
- Dans la barre d’outils ImageJ, cliquez sur Analyser | Définissez les mesureset sélectionnez les cases pour la valeur grise de zone, densité intégrée et valeur grise moyenne.
- Ouvrez une image sous forme d’hyperstack avec chaque canal séparé en faisant glisser et tomber dans la barre d’outils ImageJ ou en sélectionnant l’image via le menu fichier.
- Utilisez le canal TH (594 nm) pour dessiner des ROV autour du corps cellulaire. À l’aide de l’outil de traçage polygone de l’ImageJ, tracez de près le bord externe du corps cellulaire. Lorsque la distance entre la membrane cellulaire et le noyau cellulaire est la plus petite, tracer une ligne droite à travers le cytosol jusqu’au bord du noyau, puis suivre de près le contour du noyau afin de l’exclure. Puis tracez une ligne droite jusqu’à la membrane externe, en bordure de la ligne initiale aussi étroitement que possible, et continuez à suivre le contour du corps cellulaire jusqu’à ce que le retour sur investissement soit terminé.
- Utilisation du raccourci clavier « » ou à l’aide du chemin d’accès du menu de la barre d’outils Analyser | Outils | Roi Manager, ouvrez le gestionnaire de roi et ajoutez le roi qui vient d’être tiré sur la liste.
- Sélectionnez la fenêtre du canal caspase-3 (488 nm), puis sélectionnez le roi ajouté dans la liste « Gestionnaire de retour sur investissement ».
- Dans la fenêtre Gestionnaire de retour sur investissement, sélectionnez le bouton Mesurer. La fenêtre de résultats s’affiche avec les mesures définies précédemment. Copiez-les dans une feuille de calcul et répétez ce processus pour chaque cellule.
Résultats
Après la culture initiale des cellules, nous avons traité des plats de culture VM à 14 DIV avec 1 μL d’AAV hSyn-GCaMP6f et a permis pendant 5 jours d’expression virale. Le jour de l’imagerie HEPES tampon d’enregistrement a été préparé frais. Nous avons utilisé deux conditions; dans une condition, 20 μM glutamate a été appliqué pendant 10 min, tandis que dans l’autre état 5 min de 10 μM NBQX application a précédé une co-application de 10 min de 10 μM NBQX + 20 μM glutamate. Dans les deux conditions, nous avons observé des changements hétérogènes et spontanés dans la fluorescence GCaMP6f, qui indiquent des flux spontanés de Ca2+, comme le montrent les traces représentatives (Figure 1A,B, Film supplémentaire 1-2). L’application du glutamate de 20 μM a généré une réponse robuste et soutenue de Ca2+ dans les neurones spontanément actifs et quiescents (Figure 1A, Film supplémentaire 1). L’application de 10 μM NBQX a réduit l’activité spontanée et a partiellement bloqué la réponse au glutamate (Figure 1B, Film supplémentaire 2). La mesure dans laquelle l’application de glutamate a stimulé une réponse de Ca2+ dans chaque état a été quantifiée en utilisant la zone sous la courbe, l’amplitude de pointe, et la latence pour répondre. Les deux zones sous la courbe et l’amplitude de pointe étaient semblables pour le glutamate et les conditions traitées au glutamate NBQX + glutamate (figure 1C),tandis que la latence à la réponse a été significativement augmentée dans l’état NBQX + glutamate (Figure 2A,B). En plus de quantifier la réponse de Ca2+ au traitement du glutamate, nous avons fixé et taché des échantillons avec un anticorps anti-caspase-3 comme mesure de l’apoptose médiée par le glutamate. Nous avons observé une gamme d’activation en caspase-3 dans toutes les conditions (Figure 3A,B). L’activation de Caspase-3 a été quantifiée par la zone de mesure et l’intensité moyenne de caspase-3. Par rapport aux cellules témoins non traitées, la superficie moyenne des cellules présentant une activation en caspase-3 sous le glutamate et les conditions de glutamate NBQX + tendait vers l’importance (figure 3B). L’intensité moyenne du caspase-3 était significativement plus élevée dans les conditions de glutamate et de NBQX + glutamate par rapport aux témoins non traités (figure 3B). Ensemble, ces résultats démontrent un cadre à forte teneur dans lequel l’apoptose des neurones peut être mesurée en quantifiant les réponses ca2+ aux agents excitotoxiques et suivie d’une analyse des événements apoptotiques en aval tels que l’activation caspase-3 dans le même ensemble de cultures.
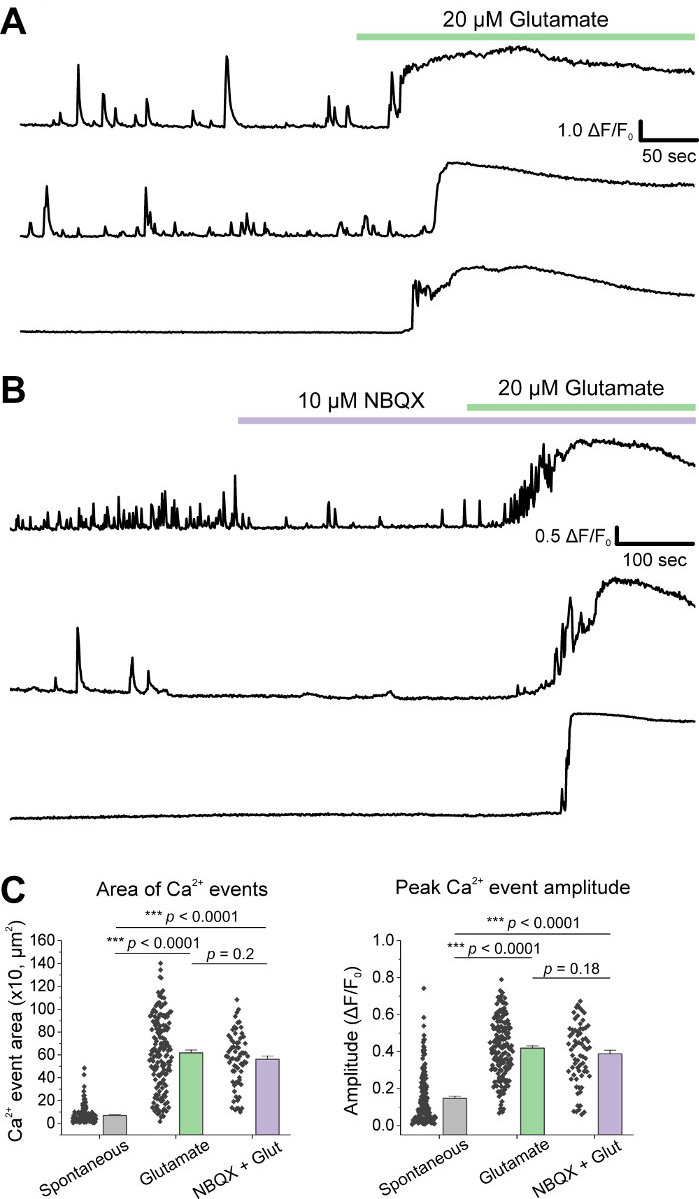
Figure 1 : Les neurones mésencéphaliques ventrals cultivés affichent l’activité spontanée de Ca2+ et sont vigoureusement stimulés par l’application de glutamate. (A) Traces représentatives de l’activité spontanée de Ca2+ dans les neurones VM et leur réponse à l’application de glutamate de 20 μM. (B) Traces représentatives de l’activité spontanée de Ca2+ dans les neurones VM et leur réponse à l’application de glutamate de 10 μM NBQX + 20 μM. (C) Données de population montrant la zone sous la courbe et l’amplitude de pointe des traces de Ca2+. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
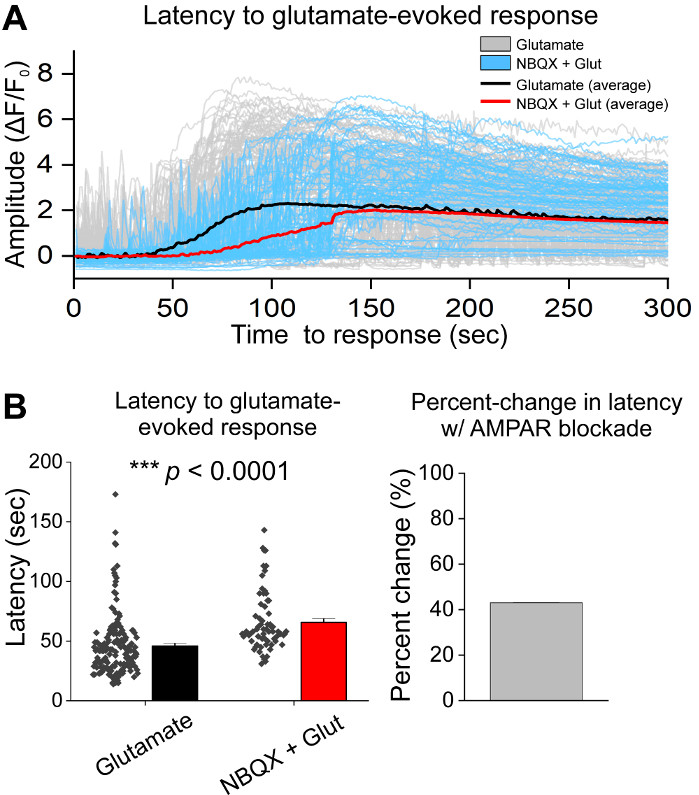
Figure 2 : Le blocus de l’AMPAR avec NBQX retarde la réponse à l’application du glutamate dans les neurones mésencéphales ventrals cultivés. (A) Représentant Ca2+ traces de glutamate (gris) et NBQX + glutamate (bleu) a évoqué des réponses. Des traces moyennes de Ca2+ de glutamate (noir) et de NBQX + glutamate (rouge) sont représentées superposées. (B) Les données de population montrant la latence à la réponse pour le glutamate et NBQX + glutamate ont évoqué des réponses. Le pourcentage de variation entre le glutamate et les conditions de glutamate NBQX + est affiché dans le panneau droit. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
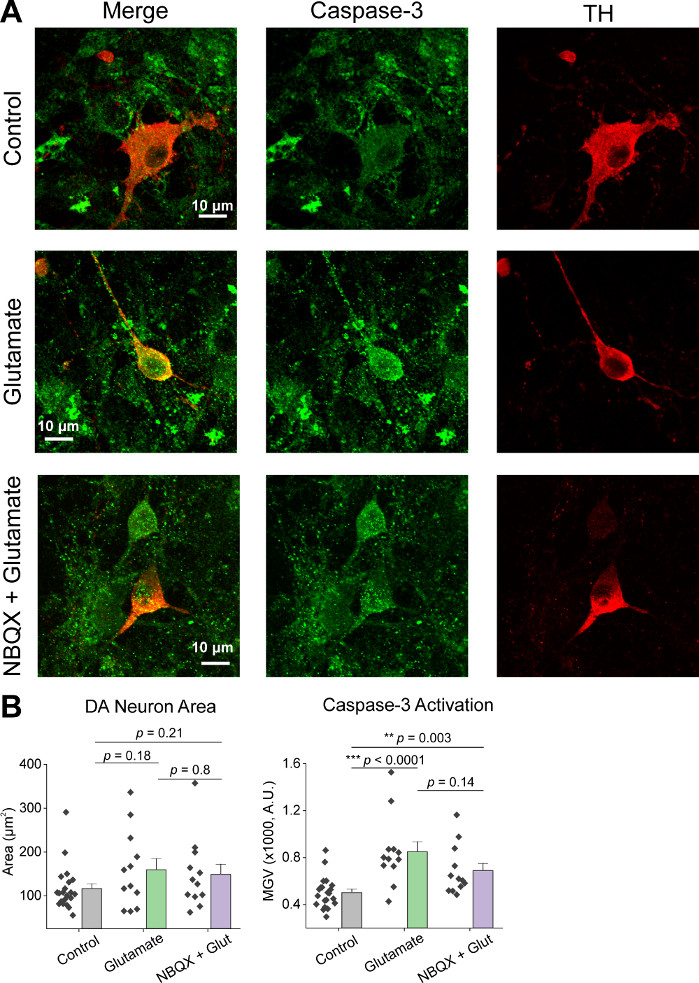
Figure 3 : L’application de glutamate augmente l’expression de caspase-3 dans les neurones mésencéphaliques ventrals positifs de tyrosine (TH). (A) Images confocales représentatives des cultures VM immunostained pour caspase-3 (vert) et TH (rouge), barre d’échelle = 10 μm. (B) Données démographiques montrant la zone des neurones DA et la valeur grise moyenne de caspase-3 expression dans chaque condition. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Film supplémentaire 1 : Activité spontanée de Ca2+ et réponse à l’application de glutamate.
Flux spontanés de Ca2+ en présence de tampon d’enregistrement HEPES (0-300 s) suivi d’une application de 20 μM de glutamate (301-600 s). Barre d’échelle = 50 μm. Veuillez cliquer ici pour télécharger cette vidéo.
Film supplémentaire 2 : Activité spontanée ca2+ et réponse à l’application NBQX + glutamate.
Flux spontanés de Ca2+ en présence de tampon d’enregistrement HEPES (0-300 s) suivi de l’application de 10 μM NBQX (301-600 s) et de 10 μM NBQX + 20 μM glutamate (601-900 s). Barre d’échelle = 50 μm. Veuillez cliquer ici pour télécharger cette vidéo.
Discussion
Nous décrivons un système de culture cellulaire mésencéphale ventral (VM) à long terme pour l’analyse à haute teneur de l’apoptose à médiation glutamate dans les neurones. Des études ont employé les cultures dopaminergiques primaires de midbrain pour élucider les mécanismes excitotoxiques dans le contexte des modèles de11,12. Dans cette étude, nous utilisons une approche combinatoire utilisant des indicateurs de calcium génétiquement codés (GECI) pour mesurer l’activité de Ca2+ et associer davantage cette activité aux changements moléculaires en aval, tels que l’initiation des cascades de signalisation apoptotique4. La méthode présente de multiples avantages par rapport à d’autres systèmes de culture cellulaire similaires. Comme nous avons un intérêt particulier pour l’excitotoxicité dans le contexte de la maladie de Parkinson, l’utilisation des cultures primaires de cellules VM est idéal. En utilisant différentes techniques de relocalisation sur le terrain, telles que des couvercles quadrrés ou un stade de microscope XY motorisé combiné à l’immunostaining TH, nous pouvons étudier directement les effets spécifiques du type cellulaire de l’apoptose pédiée par le glutamate dans les neurones ventrals de la midbraine. En outre, le modèle de culture cellulaire de 3 semaines permet aux neurones de développer leur profil moléculaire complet et mature, reflétant les neurones DA adultes9. Les méthodes précédentes se sont principalement concentrées sur les changements moléculaires suite à l’excitotoxicité médiée par le glutamate13,14. Le modèle est unique dans sa capacité à corréler les changements aigus dans la physiologie neuronale avec les événements moléculaires en aval dans les types de cellules identifiés. Une limitation du modèle de culture primaire est que la technique de dissection capture l’ensemble du midbrain ventral, y compris les neurones DA et GABAergic ainsi que les neurones de la SNC et VTA. Les preuves suggèrent maintenant que les neurones DA de la SNC ont une vulnérabilité sélective au calcium et à la mort cellulaire éventuelle par rapport aux neurones DA du VTA15voisin . Malheureusement, différencier le Snc des neurones VTA dans les cultures embryonnaires s’est avéré difficile avec peu de repères anatomiques pour définir ces structures dans le cerveau embryonnaire.
Nous démontrons que la technique de culture primaire permet la quantification de l’activité hétérogène spontanée ca2+ (Figure 1). Par conséquent, il s’agit d’un modèle idéal de système de culture cellulaire pour étudier les cellules toniques actives, telles que les neurones dopaminergiques de la midbrain, les neurones néocortiques et les neurones GABAergic du noyau suprachiasmatique (SCN)16,17. Dans la plupart des applications, l’imagerie Ca2+ n’atteint pas la même résolution temporelle que l’électrophysiologie. Par conséquent, il est probable qu’un seul événement Ca2+ est analogue à une explosion de potentiels d’action neuronale. Cela peut être interprété comme signifiant que l’imagerie Ca2+ permet des mesures relativement précises de l’activité anormale d’éclatement dans les cellules de pacemaking et est donc appropriée pour un écran à contenu élevé de la mort des cellules excitotoxiques à médiation Ca2+.
Pour atteindre et maintenir l’activité spontanée ca2+, il est important d’aborder deux points clés du protocole. La première est la densité de placage des cellules suivant la dissection. Pour les neurones VM primaires, des études antérieures ont utilisé environ 100.000 cellules/cm29,10. Nous avons adapté le protocole pour plaquer une densité de 200.000 cellules/cm2, ce qui crée une gamme hétérogène d’activité spontanée et augmente le nombre de neurones dopaminergiques VM présents sur chaque couvercle. Puisque les différents neurones de pacemaking ont des propriétés de cuisson distinctes16, la densité de placage doit être personnalisée au type de cellule étudié et optimisé afin d’atteindre des niveaux idéaux d’activité spontanée. Deuxièmement, le temps d’incubation suivant l’infection virale des AAV. Comme la densité de placage, cela dépendra du contexte spécifique de la question de recherche et du type d’AAV utilisé. Pour l’AAV spécifique utilisé ici, 5 jours d’incubation suivant l’infection virale est idéal pour atteindre les niveaux d’expression des protéines souhaités, ce qui permet des changements dynamiques dans la fluorescence GCaMP afin d’enregistrer l’activité de Ca2+ . De nombreux facteurs déterminent la rapidité et l’efficacité avec laquelle un AAV exprimera sa cargaison, dont une grande partie n’est pas du champ d’application de cette méthode, mais brièvement, il est important de tenir compte de l’activité du promoteur et de la vitesse à laquelle la protéine cargo mûrit et se plie.
Un autre avantage de la méthode est qu’elle permet une flexibilité considérable dans le format, les vecteurs d’expression, l’utilisation de l’équipement d’imagerie, et la gamme de questions scientifiques qui peuvent être abordées. En outre, la méthode permet l’enquête sur un large éventail de questions spécifiques qui entourent l’exctotoxicité de glutamate-médiée dans, et d’autres modèles de dysfonctionnement du système nerveux. Par exemple, l’excitotoxicité médiée par le glutamate implique de multiples récepteurs et des cascades de signalisation5. En utilisant la méthode, et comme démontré avec le bloqueur AMPAR, NBQX dans la figure 1, il est possible de disséquer des composants spécifiques de la réponse excitototoxique glutamate à un niveau physiologique et moléculaire. Il est concevable qu’une approche similaire utilisant des inhibiteurs des systèmes de second messager puisse être utilisée pour déterminer leur contribution à l’excitotoxicité. En outre, les AAV utilisés ici pourraient être adaptés pour exprimer les GECIs avec des promoteurs spécifiques aux cellules ou des capteurs optogénétiques exprimés par AAV qui pourraient être utilisés pour mesurer d’autres paramètres tels que la libération de neurotransmetteurs.
Outre les dissections embryonnaires primaires et l’imagerie confocale, une grande partie du protocole utilise des compétences de laboratoire de base qui ne nécessitent pas de formation spécialisée. Par conséquent, les limites du modèle comprennent la difficulté de la technique de dissection embryonnaire, la durée pendant la culture des cellules pour atteindre la maturité, et l’accès à un microscope confocal, ou un appareil d’imagerie similaire. Les nombreux avantages et la flexibilité de la méthode l’emportent sur ces limitations, ce qui en fait un modèle idéal pour étudier le rôle de l’excitotoxicité médiée par le glutamate dans les troubles du système nerveux. Enfin, ce modèle pourrait être un outil efficace pour dépister de nouveaux composés pour les effets anti-apoptotiques et leur capacité à préserver la santé des neurones DA.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Soutenu par des subventions de l’American Parkinson Disease Association (APDA) et nih R01NS115809-01 à RS. Nous remercions le Texas A & M Institute for Genomic Medicine (TIGM) pour fournir des souris enceintes chronométrées pour générer des cultures dopaminergiques primaires.
matériels
| Name | Company | Catalog Number | Comments |
| 10% Formalin/PBS | VWR | 100496-506 | |
| 10X NA 0.3 water-immersion objective | Olympus | UMPLFLN10XW | |
| 12 mm circular cover glass No. 1 | Phenix Research Products | MS20-121 | |
| 20X NA 0.85 oil-immersion objective | Olympus | UPLSAPO20XO | |
| 35 mm uncoated plastic cell culture dishes | VWR | 25382-348 | |
| 40X NA 0.3 water-immersion objective | Olympus | LUMPLFLN40XW | |
| 60X NA 1.35 oil-immersion objective | Olympus | UPLSAPO60XO | |
| Ampicillin (sodium) | Gold Bio | A-301-25 | |
| B-27 supplement | ThermoFisher | 17504044 | 50x stock |
| Binolcular Microscope | Kent Scientific | KSCXTS-1121 | |
| Bovine serum albumin (BSA) | Sigma-Aldrich | A7030 | |
| Calcium Chloride (CaCl2), anhydrous | Sigma-Aldrich | 746495 | |
| Chicken polyclonal anti-Tyrosine Hydroxylase | Abcam | ab76442 | |
| Deoxyribonuclease I (DNase) | Sigma-Aldrich | DN25 | |
| D-glucose, andydrous | Sigma-Aldrich | RDD016 | |
| DMEM + GlutaMAX medium | ThermoFisher | 10569010 | 500 mL |
| Equine serum | ThermoFisher | 26050088 | heat-inactivated |
| Fiber Optic Illuminator, 100V | Kent Scientific | KSC5410 | |
| Filter System, PES 22UM 250ML | VWR | 28199-764 | |
| Fluoview 1000 confocal microscope | Olympus | ||
| Fluoview 1200 confocal microscope | Olympus | ||
| GlutaMAX supplement | ThermoFisher | 35050061 | |
| Goat polyclonal anti-chicken Alexa Fluor 594 | Abcam | ab150176 | |
| Goat polyclonal anti-rabbit Alexa Fluor 594 | Abcam | ab150077 | |
| Hanks-balanced Salt Solution (HBSS) 1x | ThermoFisher | 14175095 | 500 mL |
| HEPES | VWR | 101170-478 | |
| HeraCell 150 CO2 incubator | Heraeus (ThermoFisher) | ||
| ImageJ v1.52e | NIH | ||
| IRIS-Fine Scissors (Round Type)-S/S Str/31*8mm/13cm | RWD | S12014-13 | |
| Kanamycin monosulfate | Gold Bio | K-120-25 | |
| Laminin | Sigma-Aldrich | L2020 | |
| L-Ascorbic acid | Sigma-Aldrich | A7506 | |
| L-glutamic acid | VWR | 97061-634 | |
| Magnesium Chloride (MgCl2), andydrous | Sigma-Aldrich | M8266 | |
| MPII Mini-Peristaltic Pump, 115/230 VAC, 50/60 Hz | Harvard Apparatus | 70-2027 | |
| MULLER Micro Forceps-Str, 0.15mm Tips, 11cm | RWD | F11014-11 | |
| NBQX | Hello Bio | HB0443 | |
| Neurobasal medium | ThermoFisher | 21103049 | 500 mL |
| Normal goat serum (NGS) | Abcam | ab7481 | |
| Origin 2020 | OriginLab | ||
| pAAV.Syn.GCaMP6f.WPRE.SV40 | Addgene | 100837-AAV1 | Titer: 1.00E+13 gc/ml |
| Papain | Worthington Biomedical Corporation | LS003126 | |
| Penicillin streptomycin | ThermoFisher | 15140122 | 10,000 U/mL |
| Phosphate-buffered saline (PBS) 1x | ThermoFisher | 10010049 | 500 mL |
| Poly-L-lysine | Sigma-Aldrich | P4832 | |
| Poly-L-ornithine | Sigma-Aldrich | P4957 | |
| Potassium Chloride (KCl), anhydrous | Sigma-Aldrich | 746436 | |
| Pump Head Tubing Pieces For MPII | Harvard Apparatus | 55-4148 | |
| Rabbit monoclonal anti-caspase-3 | Abcam | ab32351 | |
| Sodium Chloride (NaCl), anhydrous | Sigma-Aldrich | 746398 | |
| Sucrose | Sigma-Aldrich | S7903 | BioXtra, ≥99.5% (GC) |
| Time-pregnant female C57BL/6 mice | Texas A&M Institue for Genomic Medicine | ||
| Triton X-100 | Sigma-Aldrich | X100 | 500 mL |
| Wide-bore blue pipette tips P1000 | VWR | 83007-380 |
Références
- Marras, C., et al. Prevalence of Parkinson's disease across North America. NPJ Parkinson's Disease. 4, 21 (2018).
- Poewe, W., et al. Parkinson disease. Nature Reviews Disease Primers. 3, 17013 (2017).
- Mehta, A., Prabhakar, M., Kumar, P., Deshmukh, R., Sharma, P. L. Excitotoxicity: bridge to various triggers in neurodegenerative disorders. European Journal of Pharmacology. 698 (1-3), 6-18 (2013).
- Ambrosi, G., Cerri, S., Blandini, F. A further update on the role of excitotoxicity in the pathogenesis of Parkinson's disease. Journal of Neural Transmission (Vienna). 121 (8), 849-859 (2014).
- Dong, X. X., Wang, Y., Qin, Z. H. Molecular mechanisms of excitotoxicity and their relevance to pathogenesis of neurodegenerative diseases. Acta Pharmaceutica Sinica B. 30 (4), 379-387 (2009).
- Vieira, M., et al. Excitotoxicity through Ca2+-permeable AMPA receptors requires Ca2+-dependent JNK activation. Neurobiology of Disease. 40 (3), 645-655 (2010).
- Sebe, J. Y., et al. Ca(2+)-Permeable AMPARs Mediate Glutamatergic Transmission and Excitotoxic Damage at the Hair Cell Ribbon Synapse. Journal of Neuroscience. 37 (25), 6162-6175 (2017).
- Brickley, S. G., Farrant, M., Swanson, G. T., Cull-Candy, S. G. CNQX increases GABA-mediated synaptic transmission in the cerebellum by an AMPA/kainate receptor-independent mechanism. Neuropharmacology. 41 (6), 730-736 (2001).
- Srinivasan, R., et al. Smoking-Relevant Nicotine Concentration Attenuates the Unfolded Protein Response in Dopaminergic Neurons. Journal of Neuroscience. 36 (1), 65-79 (2016).
- Henley, B. M., et al. Reliable Identification of Living Dopaminergic Neurons in Midbrain Cultures Using RNA Sequencing and TH-promoter-driven eGFP Expression. Journal of Visualized Experiments. (120), e54981 (2017).
- Douhou, A., Troadec, J. D., Ruberg, M., Raisman-Vozari, R., Michel, P. P. Survival promotion of mesencephalic dopaminergic neurons by depolarizing concentrations of K+ requires concurrent inactivation of NMDA or AMPA/kainate receptors. Journal of Neurochemistry. 78 (1), 163-174 (2001).
- Lavaur, J., et al. The noble gas xenon provides protection and trophic stimulation to midbrain dopamine neurons. Journal of Neurochemistry. 142 (1), 14-28 (2017).
- Kritis, A. A., Stamoula, E. G., Paniskaki, K. A., Vavilis, T. D. Researching glutamate - induced cytotoxicity in different cell lines: a comparative/collective analysis/study. Frontiers in Cellular Neuroscience. 9, 91 (2015).
- Gupta, K., Hardingham, G. E., Chandran, S. NMDA receptor-dependent glutamate excitotoxicity in human embryonic stem cell-derived neurons. Neuroscience Letters. 543, 95-100 (2013).
- Surmeier, D. J., Obeso, J. A., Halliday, G. M. Selective neuronal vulnerability in Parkinson disease. Nature Reviews Neuroscience. 18 (2), 101-113 (2017).
- Ramirez, J. M., Tryba, A. K., Pena, F. Pacemaker neurons and neuronal networks: an integrative view. Current Opinion in Neurobiology. 14 (6), 665-674 (2004).
- Guzman, J. N., Sanchez-Padilla, J., Chan, C. S., Surmeier, D. J. Robust pacemaking in substantia nigra dopaminergic neurons. Journal of Neuroscience. 29 (35), 11011-11019 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon