Method Article
Cuantificación de los flujos espontáneos de Ca2+ y sus efectos aguas abajo en las neuronas primarias de cerebro medio de ratón
En este artículo
Resumen
Aquí presentamos un protocolo para medir los flujos in vitro ca2+ en las neuronas de cerebro medio y sus efectos aguas abajo en la caspasa-3 utilizando cultivos primarios de cerebro medio ratón. Este modelo se puede emplear para estudiar los cambios fisiopatológicos relacionados con la actividad anormal de Ca2+ en las neuronas de cerebro medio, y para detectar nuevas terapias en busca de propiedades anti-apoptóticas.
Resumen
La enfermedad de Parkinson es un trastorno neurodegenerativo devastador causado por la degeneración de las neuronas dopaminérgicas (DA). La afluencia excesiva de Ca2+ debido a la activación anormal de los receptores de glutamato da lugar a la excitotoxicidad da y se ha identificado como un mecanismo importante para la pérdida de neuronas DA. En este estudio, aislamos, disociamos y cultivamos neuronas de cerebro medio del mesencéfalo ventral (VM) del ED14 embriones de ratón. Luego infectamos los cultivos primarios de cerebro medio del ratón primario a largo plazo con un virus asociado a la adeno (AAV) que expresa un indicador de calcio genéticamente codificado, GCaMP6f bajo el control del promotor de sinapsina específico de la neurona humana, hSyn. Usando imágenes confocales en vivo, mostramos que las neuronas cultivadas de ratón de cerebro medio muestran flujos espontáneos de Ca2+ detectados por AAV-hSyn-GCaMP6f. La aplicación de baño de glutamato a cultivos de cerebro medio causa elevaciones anormales en Ca2+ intracelulares dentro de las neuronas y esto se acompaña de la activación de la caspasa-3 en las neuronas DA, como lo demuestra la inmunostaining. Las técnicas para identificar la apoptosis mediada por glutamato en las neuronas primarias de DA de ratón tienen aplicaciones importantes para el cribado de alto contenido de fármacos que preservan la salud de las neuronas DA.
Introducción
La enfermedad de Parkinson es el segundo trastorno neurodegenerativo más común en todo el mundo, sin cura conocida. Las estimaciones sugieren que la prevalencia de los datos sobre el rendimiento seguirá aumentando y se prevé que supere los 1 millón de diagnósticos para el año 2030 solo en los Estados Unidos1. Con pocos tratamientos eficaces disponibles actualmente para combatir la DP, existe una necesidad apremiante de desarrollar terapias más eficaces. La DP se caracteriza por una pérdida rápida y progresiva de las neuronas de dopamina de cerebro medio (DA)2. Los mecanismos que subyacen a la neurodegeneración en la DP no se entienden bien. La evidencia sugiere una convergencia probable de múltiples mecanismos, tales como estrés oxidativo y disfunción mitocondrial, etc. que contribuyen al inicio de cascadas de señalización apoptótica y eventual muerte celular3.
Uno de estos mecanismos convergentes, la excitotoxicidad mediada por glutamato ha estado implicada en múltiples enfermedades neurodegenerativas, incluyendo PD4. Mientras que la excitotoxicidad mediada por glutamato se piensa para trabajar principalmente a través de la estimulación de los receptores NMDA a través de un aumento excesivo en la concentración intracelular Ca2 + y el inicio eventual de la apoptosis, Ca2 +receptores AMPA permeables también han estado implicados en la respuesta excitotóxica5,6,7. Por lo tanto, es de interés determinar la contribución de los receptores AMPA a la apoptosis mediada por glutamato dentro de un modelo de DP. Esto se puede lograr utilizando NBQX, un bloqueador ampañedor y kainato, que a concentraciones micromolares es selectivo para los receptores AMPA8. La excitotoxicidad mediada por glutamato y las cascadas de señalización apoptótica son un objetivo descendente ideal para medir el alcance de la muerte celular y un posible objetivo de intervención terapéutica. Por lo tanto, el desarrollo de un método de alto contenido para evaluar la modulación mediada por glutamato de la actividad de calcio y la señalización posterior asociada en las neuronas mesencéfalas (VM) ventrales primarias sería valioso para la detección de nuevos métodos de tratamiento sobre su capacidad para preservar la salud neuronal.
Aquí, hemos desarrollado un protocolo en el que expresamos el indicador de calcio genéticamente codificado (GECI), GCaMP6f, utilizando AAV2/5 con la sinapsis humana (hSyn) promotor para medir la actividad Ca2+ de las neuronas primarias VM de ratón en respuesta a la aplicación de glutamato que se puede medir a nivel fisiológico y molecular. Este cribado de alto contenido se puede adaptar para descubrir productos farmacéuticos o tratamientos que modulan la actividad de Ca2+ para preservar la salud de las neuronas VM. Proponemos que este modelo de cultivo primario es una manera eficaz de detectar nuevas intervenciones de DP, basada en su capacidad para preservar la salud de las neuronas vm y mitigar la progresión de la DP.
Protocolo
Todos los procedimientos relacionados con el uso de sujetos animales han sido aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Texas A&M (25 de noviembrede 2019; AUP 2019-0346).
NOTA: La preparación de las soluciones de cultivo celular debe realizarse mediante un procedimiento estéril en un armario de seguridad biológica y filtrarse a 0,2 m para evitar la contaminación.
1. Preparación de soluciones y medio de cultivo
- Preparar la solución de recubrimiento de laminina diluyendo 20 ml de 1 mg/ml de stock de laminina en 2 ml de H2O estéril destilado.
- Preparar una solución de parada de 10% de suero equino (caballo) (ES) añadiendo 5 ml de ES a 45 ml de solución de sal equilibrada de Hank (HBSS) de 1x. Filtro estéril con un sistema de filtro de 0,2 m o punta de filtro de jeringa. Conservar a 4oC.
- Preparar una solución de albúmina sérica bovina (BSA) al 4% añadiendo 2 g de polvo de BSA a 1 solución salina tamponada con fosfato (PBS) y llevando a un volumen final de 45 ml. Filtro estéril con un sistema de filtro de 0,2 m o punta de filtro de jeringa. Conservar a 4oC.
- Preparar la solución de papaína diluyendo la papaína a 3 mg/ml en 1x HBSS. Filtro estéril con un sistema de filtro de 0,2 m o punta de filtro de jeringa. Conservar a -20oC.
- Preparar la solución de desoxirribonucleasa (DNase) añadiendo 20 mg de polvo de DNase a H2O estéril y llevando a un volumen final de 20 ml. Filtro estéril con un sistema de filtro de 0,2 m o punta de filtro de jeringa. Conservar a -20oC.
- Preparar la solución de acido ascórbico añadiendo 352 mg de ácido ascórbico al destilado estéril H2O y llevando a un volumen final de 20 ml. Calentar en un baño de 37oC para disolver si es necesario. Filtro estéril con un sistema de filtro de 0,2 m o punta de filtro de jeringa. Conservar a -20oC.
- Preparar el medio de cultivo celular añadiendo lo siguiente a 50 ml de medio neurobasal: 500 l de Glutamax (100x), suero equino de 500 l, 1 ml de B-27, 100 ml de ácido ascórbico, 500 ml de penicilina-estreptomicina, 50 ml de kanamicina y 50 ml de ampicilina. Filtro estéril con un sistema de filtro de 0,2 m. Conservar a 4oC.
- Prepare la solución Triton X-100 del 0,01% añadiendo 1 ml de Tritón X-100 en 9 ml de 1x PBS para hacer una solución del 10%. Como Triton X-100 es viscoso, pipeta lentamente para permitir que la punta se llene por completo. Calentar en un baño de 37oC para disolver si es necesario. Conservar a 4oC.
- Para diluir 10% Triton X-100 stock a 0.01%, realice 3 diluciones en serie 1:10. Diluir 1 ml de 10% de stock en 9 ml de 1x PBS para hacer 1% de solución. Diluir 1 ml de solución al 1% en 9 ml de 1x PBS para hacer una solución del 0,1%. Diluir 1 ml de 0,1% de solución en 9 ml de 1x PBS para hacer una solución de 0,01%.
- Preparar una solución de suero de cabra normal (NGS) del 10% y 1% añadiendo 1 ml de NGS a 9 ml de 1x PBS para una solución del 10%. Añadir 100 l de NGS a 9,9 ml de 1x PBS para hacer una solución del 1%.
- Preparar la solución de material de glutamato (100 mM) añadiendo 735 mg de L(+)-glutámico a H2O destilado estéril y llevar a un volumen final de 50 ml. La solubilidad en esta concentración será un problema. La adición de pequeños volúmenes (100 l) de ácido clorhídrico de 1 M es suficiente para aumentar la solubilidad.
- Preparar la solución de stock NBQX (10 mM) añadiendo 50 mg de NBQX a H2O destilado estéril y llevar a un volumen final de 13 ml.
2. Preparación de platos de cultura y cubreobjetos (Hecho el día antes de la disección)
NOTA: Hemos descubierto que la combinación de tres agentes de recubrimiento, poli-L-lisina, poli-L-ornitina y laminina permite una adherencia y viabilidad celular ideales.
- Coloque 10 platos Petri de 35 mm en un armario de seguridad biológica. Colocar dos cubreobjetos circulares de 12 mm en cada plato y rellenar con 70% EtOH durante 10 min. Utilice una línea de vacío para aspirar el EtOH restante de cada plato, permitiendo que el EtOH se evapore por completo.
- Pipetear 90-100 l de 0,1% de solución de poli-l-lisina en cada tapapción, asegurándose de que toda la cubierta esté cubierta por la solución de poli-L-lisina. Cubra los platos con tapas y colóquelos en una incubadora de 37oC durante 1 h.
- Aspirar la solución restante de poli-L-lisina de cada cubrelip y enjuagar con H2O estéril.
- Repita los pasos 2.2 – 2.3 con 0.1% de solución de poli-L-ornitina.
- Una vez más, repita los pasos 2.2 – 2.3 con 0.01% solución de laminin. Colocar en una incubadora de CO2 de 37oC/5% hasta que esté lista para el enchapado celular al día siguiente.
3. Disecciones embrionarias de ratón
NOTA: Utilizamos entre 4 y 6 ratones embarazadas cronobazes por cultivo. Si bien gran parte del proceso de disección ocurre fuera de un gabinete de seguridad biológica, sigue siendo importante mantener un procedimiento estéril. El uso abundante de 70% EtOH en superficies cercanas al microscopio de disección y en herramientas quirúrgicas es ideal. También se puede usar una máscara durante la disección para evitar aún más la contaminación. Además, utilizamos 4 antibióticos separados en el medio de cultivo, por lo que la contaminación es poco probable. Sin embargo, si el uso de antibióticos es problemático, esta configuración de disección podría moverse dentro de una capucha estéril. Para preservar la viabilidad celular, todas las soluciones de disección deben enfriarse previamente a 4 oC, y las disecciones deben completarse lo antes posible. No realizamos las disecciones sobre hielo. El método para la disección de las neuronas embrionarias de ratón es idéntico a los métodos descritos anteriormente9,10.
- Prepare un espacio en un banco cerca de un microscopio de disección con una almohadilla absorbente y rocíe liberalmente con 70% EtOH.
- Rocíe dos platos Petri de vidrio de 100 x 15 mm y un plato Petri de cristal de 50 x 10 mm con 70% EtOH y permita que EtOH se evapore. Una vez evaporado, coloque 50 ml de 1x HBSS estéril en cada plato petri de 100 x 15 mm.
- Sumerja las tijeras quirúrgicas, los fórceps y la cuchilla de microtoma en 70% EtOH durante 10 minutos como mínimo para esterilizar. Coloque los instrumentos en la almohadilla absorbente para secar.
- Usando CO2 seguido de dislocación cervical, eutanasia ratones de embarazo cronosizado de 2-3 meses de edad en el día embrionario 14.
- Rocíe el abdomen de los ratones eutanizados con 70% EtOH. Usando fórceps agarrar la parte inferior del abdomen y abrir la cavidad abdominal usando tijeras quirúrgicas. Comience a cortar cerca de donde los fórceps están sosteniendo el abdomen, haciendo cortes laterales en cada lado hasta que la pared abdominal se puede doblar hacia atrás y el útero es claramente visible.
- Usando tijeras quirúrgicas, corte ambos extremos del cuerno uterino. A continuación, retire el útero y colóquelo en la placa de Petri con 1x HBSS.
- El uso de fórceps de punta recta elimina cuidadosamente los embriones del útero. Deje embriones en HBSS durante todo este proceso. Usando los fórceps o una cuchilla de microtoma, decapitar rápidamente los embriones cortando cerca del cuello. Haciendo un corte lo más nivelado posible.
- Bajo un microscopio diseccionado, mueva la cabeza de un embrión a una placa petri seca de 50 mm y colóquela en el lado ventral. Estabilice la cabeza con fórceps colocando y penetrando cerca de los ojos/snout. Los fórceps deben inclinarse hacia abajo a 45o para evitar penetrar el mesencéfalo.
- Usando los fórceps en la otra mano, retire cuidadosamente la capa translúcida de la piel y el cráneo justo antes de la cresta prominente del mesencéfalo. Comience cerca de la línea media y retire la piel y el cráneo caudalmente hasta que el mesencéfalo esté completamente expuesto.
- Sostenga los fórceps perpendiculares al mesencéfalo expuesto con una punta entre la corteza y el mesencéfalo y la otra cerca del cerebelo. Presione hacia abajo y pellizca los fórceps para quitar todo el cerebro medio. El segmento de cerebro medio debe tener aproximadamente 0,5 mm de espesor. Coloque el segmento de cerebro medio en el segundo plato Petri lleno de 1x HBSS fresco. Repita este proceso para cada embrión.
- Usando el microscopio de disección, coloque el segmento cerebral con el lado ventral hacia arriba. Si las meninges todavía están unidas, retírela cuidadosamente agarrando con los fórceps y levantando y alejando el segmento cerebral.
- El segmento cerebral debe tener 4 cuadrantes visibles. Coloque el segmento de tal manera que los dos cuadrantes más pequeños se posicionen superior a los dos cuadrantes más grandes. Hay una cresta prominente que separa los dos (pequeños) cuadrantes superiores de los dos cuadrantes inferiores (grandes).
- Usando los fórceps pellizcar y separar los cuadrantes superiores de los cuadrantes inferiores, y luego descartar los cuadrantes superiores. Los cuadrantes inferiores restantes tendrán exceso de tejido lateralmente en el lado dorsal, este tejido se verá menos opaco que el tejido ventral restante. Retire el tejido dorsal menos denso y deseche. El segmento restante debe contener tanto la Sustancia nigra pars compacta (SNc) como la zona tegmental ventral (VTA).
- Usando los fórceps cortar el segmento de tejido ventral restante en 4 piezas más pequeñas y usando una pipeta de diámetro de 1 ml de ancho transfiera estos segmentos en un tubo cónico de 15 ml con 1x HBSS. Mantenga el tubo cónico con segmentos cerebrales sobre hielo durante todo el procedimiento.
- Repita este proceso para todos los segmentos cerebrales restantes.
4. Disociación de células
- Digestión enzimática de las células
- Aspirar cuidadosamente el HBSS del tubo cónico de 15 ml que contiene segmentos de cerebro medio, dejando los segmentos en la parte inferior del tubo.
- Añadir a la tubo a 800 l de solución de papaína y colocarla en una incubadora de 37oC durante 7 min. Resuspender las células moviendo el tubo y reemplazarlo a la incubadora de 37 oC durante 7 minutos adicionales.
- Con una punta de pipeta de 1 ml de diámetro ancho, retire sólo los segmentos de cerebro medio en una alícuota de 1 ml de DNase. Permita que los segmentos lleguen a la parte inferior de la alícuota o aproximadamente 1 min de exposición.
- Con una punta de pipeta de 1 ml de diámetro ancho, retire sólo los segmentos de cerebro medio en un tubo cónico de 15 ml que contenga 2 ml de solución de parada. Deje que los segmentos se asienten en la parte inferior del tubo y repita el enjuague en un tubo cónico adicional lleno de solución de parada.
- Trituración mecánica de la suspensión celular
- En el tubo de enjuague de la segunda solución de parada, utilizando una punta de pipeta de 1 ml de diámetro ancho, pipetee las células hacia arriba y hacia abajo 10 veces hasta que no haya segmentos de tejido grandes visibles. Es importante evitar la trituración excesiva para una mínima lelisis celular.
- Pipetear lentamente 300 l de 4% de solución de BSA a la parte inferior del tubo cónico de 15 ml que contiene segmentos cerebrales. Retire cuidadosamente la punta de la pipeta para mantener una capa de suspensión. Centrífuga a 0,4 x g durante 3 min. A continuación, aspirar cuidadosamente las células sobrenadantes y resuspendidas en 400 l del medio de cultivo celular.
5. Encote de las células
NOTA: Según la experiencia, se recogen alrededor de 100.000 células viables por embrión. 2-3 meses de edad ratones embarazadas con tiempo por lo general tienen tamaños de camada de 8-10 embriones; por lo tanto, una estimación aproximada para el rendimiento total de las células por ratón embarazada cronodado es de aproximadamente 1 millón de células.
- Usando un hemocicómetro preformar un recuento de células y luego diluir la suspensión a 2.000 células/L utilizando un medio de cultivo celular. Triturar brevemente para mezclar.
- Retire los cubreobjetos con solución de laminina del paso 2 de la incubadora y aspire la solución de laminina restante de los cubreobjetos recubiertos utilizando un vacío. Placa rápidamente para evitar que los cubreobjetos se sequen por completo. Pipetear 100 l (2,0 x 105 células/cubierta) sobre cada cubreobjetos y colocar los platos de Petri en una incubadora de 37oC durante 1 h.
- Añadir cuidadosamente 3 ml de medio de cultivo celular a cada plato y colocar de nuevo en la incubadora de 37oC. Preformar medio cambia 2 veces por semana durante 2 semanas.
6. Infección del cultivo celular a 14 DIV con vectores virales adeno asociados (AAV)
- Para cada plato preparar 1 mL de medio DMEM libre de suero con 1 l de HSyn-GCaMP6f AAV (1,0 x 1013 títulos)
- Aspirar el medio de cultivo celular de cada plato y reemplazarlo con 1 ml de DMEM libre de suero que contenga hSyn-GCaMP6f. Coloque los platos de nuevo en la incubadora de 37oC durante 1 h.
- Aspirar el medio libre de suero que contiene AAV y reemplazarlo con 3 ml de medio de cultivo celular. Coloque los platos de nuevo en la incubadora de 37oC. Hemos encontrado que 5-7 días de infección de AAV permite niveles ideales de expresión GCaMP. Continúe cambiando de medio cada 2-3 días durante este período de infección viral.
7. Imágenes en vivo confocal Ca2+ entre 19-21 DIV
NOTA: Como se menciona en el paso 6.3, las imágenes se pueden hacer entre 5-7 días después de la infección viral. Esta es la ventana ideal para lograr la expresión visible del fluoróforo a niveles que permiten la detección de actividad espontánea de Ca2+.
- Preparación de búferes de grabación
- Para hacer 1 L del búfer de grabación HEPES, agregue: 9.009 g de NaCl, 0,3728 g de KCl, 0,901 g de D-glucosa, 2,381 g de HEPES, 2 ml de solución de stock de 1 M CaCl2 y 500 ml de solución de 1 M MgCl2 a 800 ml de H2O estéril destilado. Llevar a un volumen final de 1 L.
- Para hacer 200 ml de tampón de grabación de glutamato de 20 m, diluir 40 ml de solución de material de glutamato de 100 ml en 200 ml del búfer de grabación HEPES descrito anteriormente.
- Para hacer 200 ml de tampón de grabación NBQX de 10 mL, diluir 200 ml de solución de stock NBQX de 10 mM en 200 ml del búfer de grabación HEPES.
- Imágenes confocales
- Llene una placa estéril de 35 mm Petri con 3 ml de tampón de grabación.
- Retire un plato de Petri de 35 mm con cultivos infectados de la incubadora de 37 oC. Usando fórceps de punta fina, agarre cuidadosamente el borde de un cubreobjetos y transfiéralo rápidamente a la placa Petri llena de tampón de grabación. Coloque el cubreobjeto restante en medio de nuevo en la incubadora de 37oC. Transporte el plato con tampón de grabación al microscopio confocal.
- Inicie el software de imágenes. Continúe con el paso siguiente mientras se inicializa.
- Inicie la bomba peristáltica y coloque la línea en el búfer de grabación. Calibre la velocidad de flujo a 2 mL/min.
- Transfiera el cubreobjetos infectado de la placa Petri de 35 mm al baño de grabación.
- Usando el objetivo de inmersión de agua 10x y la luz BF, busque el plano de enfoque y busque una región con una alta densidad de cuerpos celulares de neuronas. Cambie al objetivo de inmersión en agua de 40x y utilice la luz BF para reenfocar la muestra.
- En la ventana "Lista de tintes" dentro de FluoView seleccione AlexaFluor 488 y aplíquelo.
- La expresión AAV puede ser variable; por lo tanto, con el fin de evitar la sobreexposición y fotoblancada de los fluoróforos, comience con los ajustes de baja potencia HV y láser. Para el canal AlexaFluor 488, establezca el alto voltaje (HV) en 500, la ganancia en 1x y el desplazamiento en 0. Para la línea láser 488, ajuste la potencia al 5%. Con el fin de aumentar el volumen efectivo que se muestra en el plano z, aumente el tamaño del agujero a 300 m. Utilice la opción de escaneo "focus x2" para ajustar de forma óptima las señales de emisión a los niveles de subsaturada. Desde aquí, los ajustes se pueden ajustar hasta que se alcance la visibilidad ideal de cada canal.
NOTA: Para capturar con precisión toda la gama de flujos de Ca2+ con GCaMP, ajuste los ajustes de potencia de alta y alta velocidad de referencia para permitir un aumento de la intensidad fluorescente sin sobresaturar el detector. - Una vez optimizados los ajustes del microscopio, mueva el escenario para localizar una región con varias células que muestren cambios espontáneos en la fluorescencia GCaMP6f y enfoque al plano deseado para la toma de imágenes.
- Utilice la herramienta "Clip rect" para recortar el fotograma de imagen a un tamaño que pueda lograr un intervalo de fotogramas de poco menos de 1 segundo. Esto es necesario para establecer el intervalo de imágenes en 1 fotograma por segundo.
- Establezca la ventana "Intervalo" en un valor de 1,0 y la ventana "Num" en 600.
NOTA: Con el fin de entregar diferentes búferes de grabación en el punto de tiempo deseado (300 s), es importante calibrar la latencia de la bomba para entregar la nueva solución al baño. Esto dependerá de la tasa de perfusión de la solución (2 ml/min) y de la longitud de la línea utilizada para bombear la solución. - Para capturar una película de la serie t, seleccione la opción "Tiempo" y, a continuación, utilice la opción de escaneo "XYt" para comenzar la creación de imágenes.
- Observe la barra de progreso de la imagen y mueva la línea desde el búfer de grabación HEPES al búfer de grabación de glutamato de 20 m en el punto de tiempo adecuado (por ejemplo, si la latencia de la bomba está calibrada para entregar la solución a 60 s, mueva la línea al búfer de glutamato a 240 fotogramas para entregar glutamato a 300 s).
- Cuando finalice la creación de imágenes, seleccione el botón Series Done y guarde la película de la serie t terminada. Continúe perfundiendo 20 M de glutamato durante 5 minutos adicionales, de modo que las neuronas cultivadas hayan estado expuestas al glutamato durante un total de 10 min. Repita este proceso para cada portada que se va a poner en forma.
- Después de la exposición adicional de 5 minutos al glutamato de 20 m, retire el cubreobjetos del baño y vuelva a colocarlo en la placa Petri de 35 mm que contiene el tampón de grabación hasta que se complete el día de la toma de imágenes. Cuando haya terminado, proceda al paso 8.
- Análisis de trazas de Ca2+
- Realice análisis de imágenes en ImageJ. Instale el plugin BIO-FORMATS para ImageJ, que permitirá . Archivos de imagen OIB para abrir.
- En la barra de herramientas de ImageJ, haga clic en Analizar . Establezca Medicionesy seleccione el cuadro Valor gris medio (MGV).
- En ImageJ, abra una película de la serie t como una hiperapila.
- Arrastre el control deslizante de la película e identifique el fotograma con la máxima respuesta de glutamato para visualizar todas las neuronas que responden al glutamato. Utilice la herramienta poligonal para rastrear todos los cuerpos de células de neuronas visibles, agregando sus ROI a la lista "Administrador de ROI".
- Cuando haya terminado de trazar y agregar ROI, seleccione todos los ROI dentro de la ventana ADMINISTRADOR de ROI y utilice la selección Multi medida en la lista más de opciones. Copie y pegue estos datos en una hoja de cálculo. Complete este proceso para que se analicen todas las películas.
- Para cada ROI, convierta los datos MGV sin procesar de cada fotograma a valores de F/F0 utilizando la ecuación: .F/F0 - [F(t) – F0] / F0. Donde F(t) - MGV de cualquier trama dada, y F0 - MGV de línea de base promedio de 10 fotogramas donde no hay flujos de Ca2+.
- Utilizando un software estadístico como OriginPro 2020, las trazas convertidas de la serie de datos F/F0 se pueden convertir en gráficos de líneas. La función "Analizador de picos" se puede utilizar (o una función similar si se utiliza un software diferente) para medir la amplitud máxima de la respuesta glutamato, la latencia para responder al glutamato y el área debajo de la curva.
8. Inmunostaining of cultures
NOTA: Después de la fijación con formalina, los cubreobjetos se pueden almacenar en 1x PBS a 4 oC hasta que estén listos para ser procesados para inmunosuqueo. La incubación de anticuerpos primarios y secundarios se realizó en serie, ya que dicha incubación con anticuerpos primarios anti-Caspase-3 y su anticuerpo secundario complementario precedió a la incubación con el anticuerpo primario anti-TH y su anticuerpo secundario complementario.
- Inmediatamente después de la exposición al glutamato, vuelva a colocar el cubreobjetos en su plato Petri de 35 mm, aspire el tampón de grabación y agregue 3 ml de 10% de formalina. Dejar reposar durante 40 minutos a temperatura ambiente (RT).
- Enjuague el plato 3 veces con 1x PBS.
- Aspirar el PBS y permeabilizar las células en 1 ml de 0.01% Tritón X-100 en PBS durante 2 min.
- Enjuague el plato 3 veces con 1x PBS.
- Aspirar el PBS y bloquear las células en 1 ml de 10% NGS en PBS durante 40 min.
- Enjuague el plato 3 veces con 1x PBS.
- Añadir 1 l de anticuerpo primario anti-Caspasa-3 de conejo a 1 ml de 1% NGS en PBS (1:1000 dilución). Aspirar PBS del plato y reemplazarlo con la solución primaria de anticuerpos. Colocar en una coctelera e incubar durante 1,5 h en RT.
- Enjuague el plato 3 veces con 1x PBS.
- Añadir 1 l de anticuerpo secundario de cabra anti-conejo AlexaFluor 488 a 1 mL de 1% NGS en PBS (1:1000 dilución). Aspirar PBS del plato y reemplazarlo con la solución de anticuerpos secundaria. Colocar en una coctelera e incubar durante 1 h en RT. En movimiento hacia adelante proteger las muestras de la luz.
- Enjuague el plato 3 veces con 1x PBS.
- Repita los pasos 8.7 – 8.10, pero utilizando el anticuerpo primario anti-TH de pollo (1:1000) en el paso 8.7 y el anticuerpo secundario anti-pollo de cabra AlexaFluor 594 (1:1000) en el paso 8.9.
- Después del enjuague final de PBS, coloque 30 ml de medio de montaje en una diapositiva del microscopio. Usando fórceps agarra un cubreobjetos de la placa Petri de 35 mm y coloca el cubreobjetos con las celdas hacia abajo en el medio de montaje. Ambos cubreobjetos caben en una sola diapositiva de microscopio si se colocan correctamente. Colocar en un área seca y oscura y dejar que el medio de montaje se seque durante la noche.
9. Imágenes confocales de cultivos inmunosutenidos
- Imágenes confocales
- Inicie el software de imágenes. Coloque la muestra en la etapa del microscopio.
- Con los oculares del microscopio, utilizando un objetivo de aumento de 20x y una luz epifluorescente con un filtro TRITC, enfoque la muestra y busque un cuerpo celular TH+.
- Una vez localizado un cuerpo de celda TH+, centralo en el campo de visión y, a continuación, muévete al objetivo de ampliación de 60x.
- Seleccione los tintes AlexaFluor 488 y AlexaFluor 594 en la ventana "lista de tintes".
- Al igual que con las imágenes en vivo, comience con ajustes de baja potencia hv, ganancia, desplazamiento y potencia láser para evitar el fotoblancada. Utilice la opción de escaneo "focus x2" para evaluar la intensidad fluorescente de cada canal y ajustar en consecuencia. Como estas imágenes se cuantificarán más adelante para la intensidad fluorescente, es necesario mantener la configuración de imágenes coherente en todos los campos de visión. Por lo tanto, es mejor mirar algunos ejemplos de cada condición para hacerse una idea de la gama de intensidad fluorescente entre las muestras.
- Una vez que se determinen los ajustes de imagen ideales, seleccione la opción de escaneo "focus x2" y mueva la celda de interés al centro del campo de visión. Aumente el zoom digital a 3x usando el control deslizante "zoom".
- Usando la perilla de enfoque, busque el plano de enfoque con la fluorescencia más brillante y capture una sola imagen XY de plano. Guarde la imagen para finalizar.
- Vuelva al objetivo de ampliación de 20x para buscar otra celda TH+. Repita este proceso hasta que se haya muestreado el número deseado de celdas de cada condición.
- Análisis de imágenes
- En la barra de herramientas de ImageJ, haga clic en Analizar . Establezca Medidasy seleccione los cuadros Para El valor de Área, Densidad integrada y Gris medio.
- Abra una imagen como una hiperapila con cada canal separado arrastrando y soltando en la barra de herramientas de ImageJ o seleccionando la imagen a través del menú de archivos.
- Utilice el canal TH (594 nm) para dibujar ROI alrededor del cuerpo de la célula. Con la herramienta de trazado de polígonos en ImageJ, trace de cerca el borde exterior del cuerpo de la celda. Cuando la distancia entre la membrana celular y el núcleo celular es la más pequeña, traza una línea recta a través del citosol hasta el borde del núcleo y luego sigue de cerca el contorno del núcleo para excluirlo. A continuación, trace una línea recta de vuelta a la membrana externa, bordeando la línea inicial lo más cerca posible, y continúe siguiendo el contorno del cuerpo celular hasta que el ROI esté completo.
- Usando el atajo de teclado "T" o usando la ruta del menú de la barra de herramientas Analizar . Herramientas ? ROI Manager, abra el gestor de ROI y agregue el ROI que se acaba de dibujar a la lista.
- Seleccione la ventana del canal caspase-3 (488 nm) y, a continuación, seleccione el ROI agregado en la lista "ADMINISTRADOR DE ROI".
- En la ventana Administrador de ROI, seleccione el botón Medir. La ventana de resultados aparecerá con las medidas establecidas anteriormente. Copie estos en una hoja de cálculo y repita este proceso para cada celda.
Resultados
Después del cultivo inicial de las células, tratamos los platos de cultivo de VM a 14 DIV con 1 l de AAV hSyn-GCaMP6f y se permitió para 5 días de expresión viral. El día de la toma de imágenes, el búfer de grabación HEPES se preparó fresco. Usamos dos condiciones; en una condición se aplicó un glutamato de 20 m durante 10 min, mientras que en la otra condición se aplicaron 5 min de 10 m de aplicación NBQX precedió a una coaparación de 10 min de GLutamato NBQX + 20 m. En ambas condiciones, observamos cambios heterogéneos y espontáneos en la fluorescencia GCaMP6f, que indican flujos espontáneos de Ca2+, como se muestra en los rastros representativos(Figura 1A,B, Película Suplementaria 1-2). La aplicación de glutamato de 20 m generó una respuesta robusta y sostenida de Ca2+ tanto en neuronas espontáneamente activas como en reposo(Figura 1A, Película Suplementaria 1). La aplicación de 10 m NBQX redujo la actividad espontánea, y bloqueó parcialmente la respuesta del glutamato(Figura 1B, Película Suplementaria 2). La medida en que la aplicación de glutamato estimuló una respuesta de Ca2+ en cada condición se cuantificó utilizando el área bajo la curva, la amplitud máxima y la latencia para responder. Ambas áreas bajo la curva y la amplitud máxima fueron similares tanto para las condiciones tratadas con glutamato como para NBQX + glutamato(Figura 1C),mientras que la latencia a la respuesta se incrementó significativamente en la condición NBQX + glutamato (Figura 2A,B). Además de cuantificar la respuesta de Ca2+ al tratamiento con glutamato, fijamos y manchamos muestras con un anticuerpo anti-caspasa-3 como medida de apoptosis mediada por glutamato. Hemos observado una gama de activación de caspase-3 en todas las condiciones(Figura 3A,B). La activación de Caspase-3 se cuantificó midiendo el área y la intensidad media de la caspasa-3. En comparación con las células de control no tratadas, el área media de las células con activación de la caspasa-3 bajo glutamato y NBQX + condiciones de glutamato tendencia hacia la importancia (Figura 3B). La intensidad media de la caspasa-3 fue significativamente mayor en las condiciones de glutamato y NBQX + glutamato en comparación con los controles no tratados(Figura 3B). Juntos, estos resultados demuestran un marco de alto contenido en el que la apoptosis de las neuronas se puede medir cuantificando las respuestas de Ca2+ a los agentes excitotóxicos y se realiza un seguimiento con un análisis de eventos apoptóticos posteriores como la activación de la caspasa-3 en el mismo conjunto de cultivos.
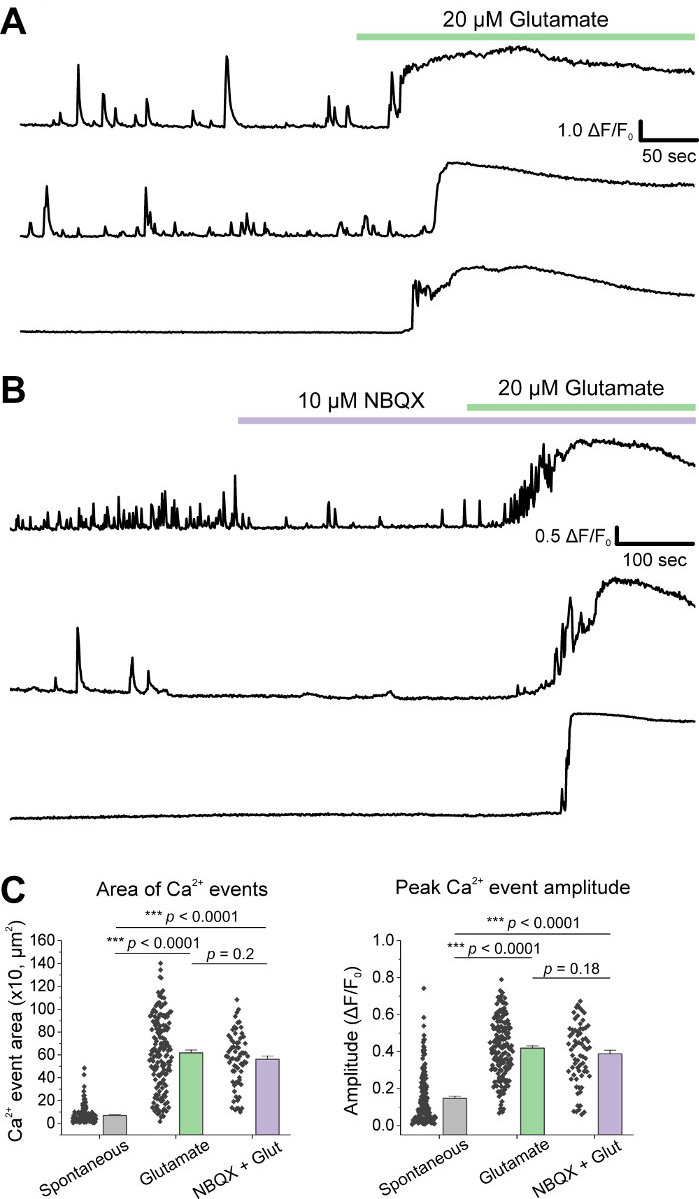
Figura 1: Las neuronas mesencéfalas ventrales cultivadas muestran actividad espontánea de Ca2+ y son fuertemente estimuladas por la aplicación de glutamato. (A) Rastros representativos de la actividad espontánea de Ca2+ en las neuronas VM y su respuesta a la aplicación de glutamato de 20 M. (B) Rastros representativos de la actividad espontánea de Ca2+ en las neuronas VM y su respuesta a la aplicación de glutamato NBQX + 20 m de 10 M. (C) Datos de población que muestran el área bajo la curva y la amplitud de pico de las trazas de Ca2+. Haga clic aquí para ver una versión más grande de esta figura.
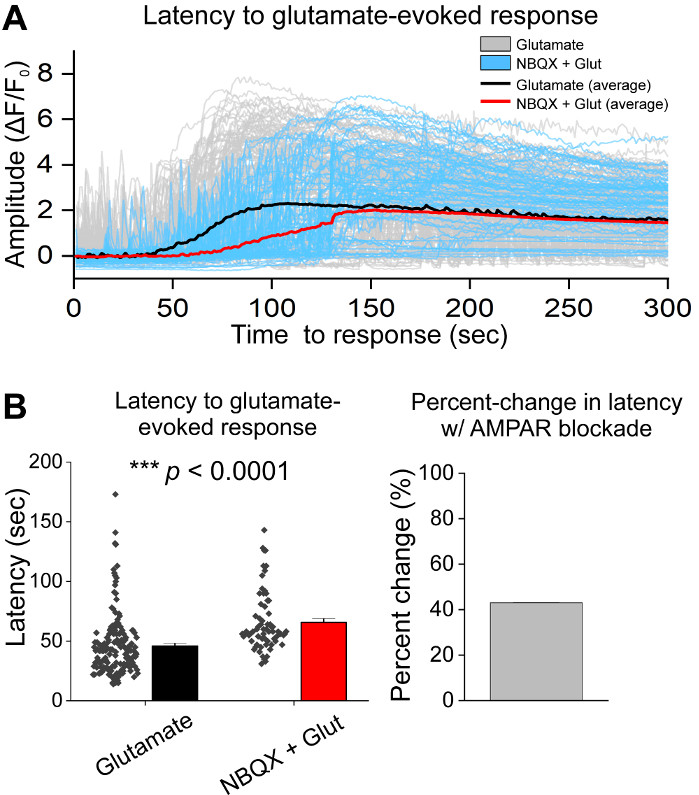
Figura 2: Bloqueo AMPAR con NBQX retrasa la respuesta a la aplicación de glutamato en neuronas mesencéfalas ventrales cultivadas. (A) El Representante Ca2+ trazas de glutamato (gris) y NBQX + glutamato (azul) evocaron respuestas. Promedio Ca2+ trazas de glutamato (negro) y NBQX + glutamato (rojo) se muestran superpuestas. (B) Datos de población que muestran latencia a la respuesta para glutamato y NBQX + glutamato evocado respuestas. El porcentaje de cambio entre las condiciones de glutamato y NBQX + glutamato se muestra en el panel derecho. Haga clic aquí para ver una versión más grande de esta figura.
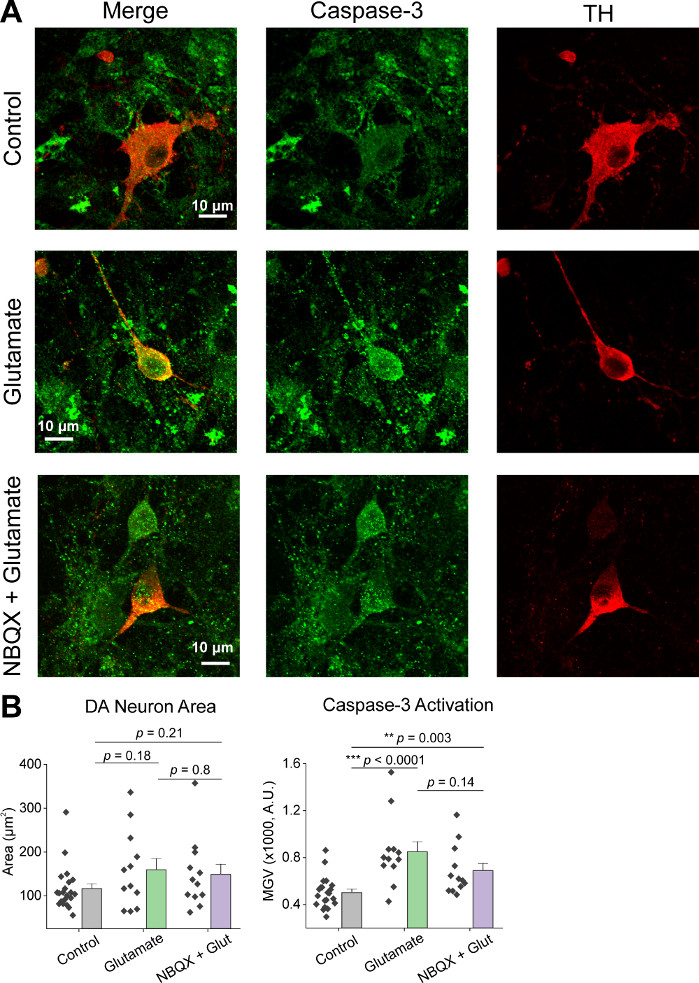
Figura 3: Aplicación de glutamato aumenta la expresión de caspasa-3 en las neuronas mesencéfalas ventrales positivas de tirosina (TH). (A) Imágenes confocales representativas de cultivos de VM inmunotenidos para caspasa-3 (verde) y TH (rojo), barra de escala a 10 m. (B) Datos de población que muestran el área de la neurona DA y el valor gris medio de la expresión de caspasa-3 en cada condición. Haga clic aquí para ver una versión más grande de esta figura.
Película Suplementaria 1: Actividad espontánea de Ca2+ y respuesta a la aplicación de glutamato.
Flujos espontáneos de Ca2+ en presencia de tampón de grabación HEPES (0-300 s) seguido de la aplicación de glutamato de 20 m (301-600 s). Barra de escala de 50 m. Haga clic aquí para descargar este vídeo.
Película Suplementaria 2: Actividad espontánea de Ca2+ y respuesta a la aplicación NBQX + glutamato.
Flujos espontáneos de Ca2+ en presencia de búfer de grabación HEPES (0-300 s) seguido de la aplicación de 10 m NBQX (301-600 s), y 10 m de GLutamato NBQX + 20 m (601-900 s). Barra de escala de 50 m. Haga clic aquí para descargar este vídeo.
Discusión
Describimos un sistema de cultivo celular mesencéfalo (VM) primario a largo plazo para el análisis de alto contenido de apoptosis mediada por glutamato en las neuronas. Los estudios han empleado cultivos dopaminérgicos primarios de cerebro medio para dilucidar los mecanismos excitotóxicos en el contexto de los modelos de DP11,12. En este estudio, empleamos un enfoque combinatorio utilizando Indicadores de Calcio Genéticamente Codificados (GECI) para medir la actividad de Ca2+ y asociar aún más esta actividad con cambios moleculares posteriores, como el inicio de cascadas de señalización apoptótica4. El método tiene múltiples ventajas para otros sistemas de cultivo celular similares. Como tenemos especial interés en la excitotoxicidad en el contexto de la enfermedad de Parkinson, el uso de cultivos celulares de VM primarias es ideal. Mediante el uso de diferentes técnicas de reubicación de campo, como cubreobjetos cuadriculados o una etapa motorizada del microscopio XY combinada con inmunosutención TH, podemos estudiar directamente los efectos específicos del tipo de célula de la apoptosis mediado con glutamato en las neuronas ventrales de cerebro medio. Además, el modelo de cultivo celular de 3 semanas permite que las neuronas desarrollen su perfil molecular completo y maduro, reflejando las neuronas adultas del DA9. Los métodos anteriores se han centrado principalmente en los cambios moleculares tras la excitotoxicidad mediada por glutamato13,14. El modelo es único en su capacidad para correlacionar cambios agudos en la fisiología neuronal con eventos moleculares posteriores en tipos celulares identificados. Una limitación del modelo de cultivo primario es que la técnica de disección captura todo el cerebro medio ventral, incluyendo DA y las neuronas GABAérgicas, así como las neuronas de la CS y VTA. La evidencia ahora sugiere que las neuronas DA de la SC tienen vulnerabilidad selectiva al calcio y eventual muerte celular en comparación con las neuronas DA de la vecina VTA15. Desafortunadamente, la diferenciación de SNc de las neuronas VTA en cultivos embrionarios ha resultado difícil con pocos puntos de referencia anatómicos para definir estas estructuras en el cerebro embrionario.
Demostramos que la técnica de cultivo primario permite cuantificar la actividad espontánea heterogénea de Ca2+ (Figura 1). Por lo tanto, este es un modelo de sistema de cultivo celular ideal para estudiar las células activas tonónicamente, como las neuronas dopaminérgicas de marca de ritmo del cerebro medio, las neuronas neocorticales, y las neuronas GABAérgicas del núcleo supraquiasmático (SCN)16,,17. En la mayoría de las aplicaciones, las imágenes Ca2+ no logran la misma resolución temporal que la electrofisiología. Por lo tanto, es probable que un solo evento de Ca2+ sea análogo a una ráfaga de potenciales de acción neuronal. Esto puede interpretarse en el punto de cual significa que las imágenes de Ca2+ permiten medidas relativamente precisas de la actividad de estallido anormal en las células de marca de ritmo y, por lo tanto, es apropiada para una pantalla de alto contenido de muerte celular excitotóxica mediada de Ca2+.
Para lograr y mantener la actividad espontánea de Ca2+, es importante abordar dos puntos clave en el protocolo. En primer lugar es la densidad de chapado de las células después de la disección. Para las neuronas VM primarias, estudios previos han utilizado alrededor de 100.000 células/cm29,10. Hemos adaptado el protocolo para placar una densidad de 200.000 células/cm2,lo que crea un rango heterogéneo de actividad espontánea y aumenta el número de neuronas VM dopaminérgicas presentes en cada cubierta. Dado que las diferentes neuronas de marcapasos tienen propiedades de disparo distintas16, la densidad de chapado debe ser personalizada al tipo de célula que se está estudiando y optimizando con el fin de lograr niveles ideales de actividad espontánea. En segundo lugar, el tiempo de incubación después de la infección viral de los AAV. Al igual que la densidad de chapado, esto dependerá del contexto específico de la pregunta de investigación y el tipo de AAV que se utiliza. Para el AAV específico utilizado aquí, 5 días de incubación después de la infección viral es ideal para lograr los niveles deseados de expresión de proteínas, lo que permite cambios dinámicos en la fluorescencia GCaMP con el fin de registrar la actividad de Ca2+. Muchos factores determinan la rapidez y eficiencia con la que un AAV expresará su carga, gran parte de la cual está fuera del alcance de este método, pero brevemente, es importante considerar la actividad promotora y la velocidad a la que la proteína de carga madura y se pliega.
Otra ventaja del método es que permite una flexibilidad considerable en el formato, los vectores de expresión, el uso de equipos de imágenes y la gama de cuestiones científicas que se pueden abordar. Además, el método permite la investigación de una amplia gama de preguntas específicas que rodean la excitotoxicidad mediada por glutamato en la DP, y otros modelos de disfunción del sistema nervioso. Por ejemplo, la excitotoxicidad mediada por glutamato implica múltiples receptores y cascadas de señalización5. Mediante el uso del método, y como se demuestra con el bloqueador AMPAR, NBQX en la Figura 1, es posible diseccionar componentes específicos de la respuesta glutamato excitotóxica a nivel fisiológico y molecular. Concebiblemente, un enfoque similar utilizando inhibidores de los segundos sistemas de mensajería podría utilizarse para determinar su contribución a la excitotoxicidad. Además, los AAV utilizados aquí podrían adaptarse para expresar los GECI con promotores específicos de la célula o sensores optogenéticos expresados por AAV que podrían utilizarse para medir otros parámetros como la liberación de neurotransmisores.
Aparte de las disecciones embrionarias primarias y las imágenes confocales, gran parte del protocolo utiliza habilidades básicas de laboratorio que no requieren entrenamiento especializado. Por lo tanto, las limitaciones al modelo incluyen la dificultad de la técnica de disección embrionaria, el tiempo que las células deben ser cultivadas para alcanzar la madurez, y el acceso a un microscopio confocal, o un aparato de imagen similar. Los muchos beneficios y flexibilidad del método superan estas limitaciones, lo que hace de este un modelo ideal para estudiar el papel de excitotoxicidad mediada por glutamato en trastornos del sistema nervioso. Por último, este modelo podría ser una herramienta eficaz para la pantalla de compuestos nuevos para efectos anti-apoptóticos y su capacidad para preservar la salud de las neuronas DA.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Apoyado por subvenciones de la Asociación Americana de Enfermedad de Parkinson (APDA) y NIH R01NS115809-01 a RS. Agradecemos al Instituto texas A&M de Medicina Genómica (TIGM) por proporcionar ratones embarazadas cronomeptados para generar cultivos dopaminérgicos primarios.
Materiales
| Name | Company | Catalog Number | Comments |
| 10% Formalin/PBS | VWR | 100496-506 | |
| 10X NA 0.3 water-immersion objective | Olympus | UMPLFLN10XW | |
| 12 mm circular cover glass No. 1 | Phenix Research Products | MS20-121 | |
| 20X NA 0.85 oil-immersion objective | Olympus | UPLSAPO20XO | |
| 35 mm uncoated plastic cell culture dishes | VWR | 25382-348 | |
| 40X NA 0.3 water-immersion objective | Olympus | LUMPLFLN40XW | |
| 60X NA 1.35 oil-immersion objective | Olympus | UPLSAPO60XO | |
| Ampicillin (sodium) | Gold Bio | A-301-25 | |
| B-27 supplement | ThermoFisher | 17504044 | 50x stock |
| Binolcular Microscope | Kent Scientific | KSCXTS-1121 | |
| Bovine serum albumin (BSA) | Sigma-Aldrich | A7030 | |
| Calcium Chloride (CaCl2), anhydrous | Sigma-Aldrich | 746495 | |
| Chicken polyclonal anti-Tyrosine Hydroxylase | Abcam | ab76442 | |
| Deoxyribonuclease I (DNase) | Sigma-Aldrich | DN25 | |
| D-glucose, andydrous | Sigma-Aldrich | RDD016 | |
| DMEM + GlutaMAX medium | ThermoFisher | 10569010 | 500 mL |
| Equine serum | ThermoFisher | 26050088 | heat-inactivated |
| Fiber Optic Illuminator, 100V | Kent Scientific | KSC5410 | |
| Filter System, PES 22UM 250ML | VWR | 28199-764 | |
| Fluoview 1000 confocal microscope | Olympus | ||
| Fluoview 1200 confocal microscope | Olympus | ||
| GlutaMAX supplement | ThermoFisher | 35050061 | |
| Goat polyclonal anti-chicken Alexa Fluor 594 | Abcam | ab150176 | |
| Goat polyclonal anti-rabbit Alexa Fluor 594 | Abcam | ab150077 | |
| Hanks-balanced Salt Solution (HBSS) 1x | ThermoFisher | 14175095 | 500 mL |
| HEPES | VWR | 101170-478 | |
| HeraCell 150 CO2 incubator | Heraeus (ThermoFisher) | ||
| ImageJ v1.52e | NIH | ||
| IRIS-Fine Scissors (Round Type)-S/S Str/31*8mm/13cm | RWD | S12014-13 | |
| Kanamycin monosulfate | Gold Bio | K-120-25 | |
| Laminin | Sigma-Aldrich | L2020 | |
| L-Ascorbic acid | Sigma-Aldrich | A7506 | |
| L-glutamic acid | VWR | 97061-634 | |
| Magnesium Chloride (MgCl2), andydrous | Sigma-Aldrich | M8266 | |
| MPII Mini-Peristaltic Pump, 115/230 VAC, 50/60 Hz | Harvard Apparatus | 70-2027 | |
| MULLER Micro Forceps-Str, 0.15mm Tips, 11cm | RWD | F11014-11 | |
| NBQX | Hello Bio | HB0443 | |
| Neurobasal medium | ThermoFisher | 21103049 | 500 mL |
| Normal goat serum (NGS) | Abcam | ab7481 | |
| Origin 2020 | OriginLab | ||
| pAAV.Syn.GCaMP6f.WPRE.SV40 | Addgene | 100837-AAV1 | Titer: 1.00E+13 gc/ml |
| Papain | Worthington Biomedical Corporation | LS003126 | |
| Penicillin streptomycin | ThermoFisher | 15140122 | 10,000 U/mL |
| Phosphate-buffered saline (PBS) 1x | ThermoFisher | 10010049 | 500 mL |
| Poly-L-lysine | Sigma-Aldrich | P4832 | |
| Poly-L-ornithine | Sigma-Aldrich | P4957 | |
| Potassium Chloride (KCl), anhydrous | Sigma-Aldrich | 746436 | |
| Pump Head Tubing Pieces For MPII | Harvard Apparatus | 55-4148 | |
| Rabbit monoclonal anti-caspase-3 | Abcam | ab32351 | |
| Sodium Chloride (NaCl), anhydrous | Sigma-Aldrich | 746398 | |
| Sucrose | Sigma-Aldrich | S7903 | BioXtra, ≥99.5% (GC) |
| Time-pregnant female C57BL/6 mice | Texas A&M Institue for Genomic Medicine | ||
| Triton X-100 | Sigma-Aldrich | X100 | 500 mL |
| Wide-bore blue pipette tips P1000 | VWR | 83007-380 |
Referencias
- Marras, C., et al. Prevalence of Parkinson's disease across North America. NPJ Parkinson's Disease. 4, 21 (2018).
- Poewe, W., et al. Parkinson disease. Nature Reviews Disease Primers. 3, 17013 (2017).
- Mehta, A., Prabhakar, M., Kumar, P., Deshmukh, R., Sharma, P. L. Excitotoxicity: bridge to various triggers in neurodegenerative disorders. European Journal of Pharmacology. 698 (1-3), 6-18 (2013).
- Ambrosi, G., Cerri, S., Blandini, F. A further update on the role of excitotoxicity in the pathogenesis of Parkinson's disease. Journal of Neural Transmission (Vienna). 121 (8), 849-859 (2014).
- Dong, X. X., Wang, Y., Qin, Z. H. Molecular mechanisms of excitotoxicity and their relevance to pathogenesis of neurodegenerative diseases. Acta Pharmaceutica Sinica B. 30 (4), 379-387 (2009).
- Vieira, M., et al. Excitotoxicity through Ca2+-permeable AMPA receptors requires Ca2+-dependent JNK activation. Neurobiology of Disease. 40 (3), 645-655 (2010).
- Sebe, J. Y., et al. Ca(2+)-Permeable AMPARs Mediate Glutamatergic Transmission and Excitotoxic Damage at the Hair Cell Ribbon Synapse. Journal of Neuroscience. 37 (25), 6162-6175 (2017).
- Brickley, S. G., Farrant, M., Swanson, G. T., Cull-Candy, S. G. CNQX increases GABA-mediated synaptic transmission in the cerebellum by an AMPA/kainate receptor-independent mechanism. Neuropharmacology. 41 (6), 730-736 (2001).
- Srinivasan, R., et al. Smoking-Relevant Nicotine Concentration Attenuates the Unfolded Protein Response in Dopaminergic Neurons. Journal of Neuroscience. 36 (1), 65-79 (2016).
- Henley, B. M., et al. Reliable Identification of Living Dopaminergic Neurons in Midbrain Cultures Using RNA Sequencing and TH-promoter-driven eGFP Expression. Journal of Visualized Experiments. (120), e54981 (2017).
- Douhou, A., Troadec, J. D., Ruberg, M., Raisman-Vozari, R., Michel, P. P. Survival promotion of mesencephalic dopaminergic neurons by depolarizing concentrations of K+ requires concurrent inactivation of NMDA or AMPA/kainate receptors. Journal of Neurochemistry. 78 (1), 163-174 (2001).
- Lavaur, J., et al. The noble gas xenon provides protection and trophic stimulation to midbrain dopamine neurons. Journal of Neurochemistry. 142 (1), 14-28 (2017).
- Kritis, A. A., Stamoula, E. G., Paniskaki, K. A., Vavilis, T. D. Researching glutamate - induced cytotoxicity in different cell lines: a comparative/collective analysis/study. Frontiers in Cellular Neuroscience. 9, 91 (2015).
- Gupta, K., Hardingham, G. E., Chandran, S. NMDA receptor-dependent glutamate excitotoxicity in human embryonic stem cell-derived neurons. Neuroscience Letters. 543, 95-100 (2013).
- Surmeier, D. J., Obeso, J. A., Halliday, G. M. Selective neuronal vulnerability in Parkinson disease. Nature Reviews Neuroscience. 18 (2), 101-113 (2017).
- Ramirez, J. M., Tryba, A. K., Pena, F. Pacemaker neurons and neuronal networks: an integrative view. Current Opinion in Neurobiology. 14 (6), 665-674 (2004).
- Guzman, J. N., Sanchez-Padilla, J., Chan, C. S., Surmeier, D. J. Robust pacemaking in substantia nigra dopaminergic neurons. Journal of Neuroscience. 29 (35), 11011-11019 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados