Method Article
기본 마우스 중뇌 뉴런에서 자발적인 Ca2+ 플럭스와 다운스트림 효과를 정량화
요약
여기에서 우리는 시험관 외 Ca에서 측정 하는 프로토콜을 제시2+ 중간 뇌 뉴런에서 플럭스와 1 차 마우스 중간 두뇌 문화를 사용 하 여 caspase-3에 그들의 다운 스트림 효과. 이 모델은 중뇌 뉴런에서 비정상적인 Ca2+ 활동과 관련된 병리학적 변화를 연구하고, 세포세포 항세포 특성에 대한 새로운 치료법을 선별하기 위해 사용될 수 있다.
초록
파킨슨 병 (PD)은 도파민 (DA) 뉴런의 퇴행성으로 인한 치명적인 신경 퇴행성 질환입니다. 글루타민산 수용체의 비정상적인 활성화로 인한 과도한 Ca2+ 유입은 DA 절제독성을 초래하고 DA 뉴런 손실을 위한 중요한 메커니즘으로 확인되었습니다. 이 연구에서는, 우리는 ED14 마우스 배아의 마우스 복부 심뇌 mesencephalon (VM)에서 격리, 해리, 및 배양 중뇌 뉴런. 그런 다음 유전적으로 인코딩된 칼슘 지표를 발현하는 아데노 관련 바이러스(AAV)로 장기 1차 마우스 중뇌 배양을 감염시키고, GCaMP6f는 인간 뉴런 특이적 시냅신 프로모터, hSyn의 통제 하에 있다. 라이브 공초점 이미징을 사용하여, 우리는 배양 마우스 중뇌 뉴런이 AAV-hSyn-GCaMP6f에 의해 검출된 자발적인 Ca2+ 플럭스를 표시한다는 것을 보여줍니다. 중뇌 배양에 조미료의 목욕 응용 프로그램은 뉴런 내에서 세포 내 Ca2 + 비정상적인 고도를 일으키는 원인이되며, 이것은 면역 염색에 의해 입증 된 바와 같이, DA 뉴런에서 caspase-3 활성화를 동반한다. 1 차 마우스 DA 뉴런에서 글루타민산 매개 세포사멸을 식별하는 기술은 DA 뉴런 건강을 보존하는 약물의 높은 함량 선별에 대한 중요한 응용 프로그램이 있습니다.
서문
파킨슨 병 (PD)은 알려진 치료법이없는 전 세계적으로 두 번째로 흔한 신경 퇴행성 질환입니다. 추정에 따르면 PD 보급은 계속 증가할 것이며 2030년까지미국에서만100만 개의 진단을 능가할 것으로 예상됩니다. 현재 PD를 퇴치하기 위해 사용할 수있는 몇 가지 효과적인 치료와 함께, 더 효과적인 치료를 개발하는 절박한 필요가있다. PD는 중뇌 도파민 (DA) 뉴런2의신속하고 점진적 인 손실을 특징으로한다. PD에서 신경 변성의 기초가 되는 기계장치는 제대로 이해되지 않습니다. 증거는 산화 스트레스 및 미토콘드리아 기능 장애 등과 같은 여러 메커니즘의 가능성이 수렴을 시사하며, 이는 세포 사멸 신호 캐스케이드 및 최종 세포 사멸 의 개시에 기여한다3.
이러한 수렴 메커니즘 중 하나, 글루타민산 매개 발췌 독성은 PD4를포함한 여러 신경 퇴행성 질환에 연루되었다. 글루타메이트 매개 흥분독성은 세포내 Ca2+ 농도 및 종말 개시의 과도한 증가를 통해 NMDA 수용체의 자극을 통해 주로 작동하도록 생각되지만, Ca2+투과성 AMPA 수용체도 발독 반응5,,6,,7에연루되어 있다. 따라서, PD 모델 내에서 글루타민산염 매개 세포사멸에 AMPA 수용체의 기여를 결정하는 것이 흥미로하다. 이는 AMPA 및 kainate 차단제인 NBQX를 사용하여 달성될 수 있으며, 이는 마이크로몰라 농도에서 AMPA 수용체8에대해 선택적이다. 글루타민산매개 엑시토토독성 및 세포사멸 신호 캐스케이드는 세포 사멸의 정도를 측정하는 이상적인 다운스트림 표적이며 치료 개입을 위한 잠재적인 표적이다. 따라서, 1차 복부 심폐(VM) 뉴런에서 글루타메이트 매개 변조 및 관련 다운스트림 신호 조절을 평가하기 위한 고함량 방법을 개발하는 것은 뉴런 건강을 보존하는 능력에 대한 새로운 치료 방법을 선별하는 데 유용할 것이다.
여기서, 우리는 인간 시냅신(hSyn) 프로모터와 AAV2/5를 사용하여 생리학적 및 분자 수준에서 측정할 수 있는 글루타민트 애플리케이션에 대응하여 마우스 VM 1차 뉴런의Ca2+ 활성을 측정하는 유전자 코딩된 칼슘 표시기(GECI), GCaMP6f를 발현하는 프로토콜을 개발했습니다. 이 고함량 스크리닝은 VM 뉴런의 건강을 보존하기 위해 Ca2+ 활동을 조절하는 제약 또는 치료법을 발견하기 위해 조정할 수 있습니다. 우리는이 기본 문화 모델은 VM 뉴런의 건강을 보존하고 PD의 진행을 완화하는 능력에 따라 새로운 PD 개입을 선별하는 효과적인 방법이라고 제안합니다.
프로토콜
동물 과목의 사용과 관련된 모든 절차는 텍사스 A&M 대학 기관 동물 관리 및 사용위원회에 의해 승인되었습니다 (25th 11 월 2019; AUP # 2019-0346).
참고: 세포 배양 솔루션의 준비는 생물학적 안전 캐비닛에서 멸균 절차를 사용하여 수행하고 오염을 방지하기 위해 0.2 μm에서 필터링해야합니다.
1. 솔루션 및 배양 매체의 준비
- 해부 당일 에 준비한 멸균 증류H2O의2mL에 1 mg/mL 라미닌 재고의 20 μL을 희석하여 라미닌 코팅 솔루션을 준비합니다.
- 1x 행크의 균형 잡힌 소금 용액(HBSS)의 45mL에 5mL의 ES를 추가하여 10% 말(말) 혈청(ES) 스톱 솔루션을 준비합니다. 0.2 μm 필터 시스템 또는 주사기 필터 팁을 사용하여 멸균 필터. 4 °C에 보관하십시오.
- 1x 인산염 완충식식염(PBS)에 BSA 파우더 2g을 첨가하고 최종 45mL의 최종 부피를 가져와 4% 소세럼 알부민(BSA) 스톡 용액을 준비한다. 0.2 μm 필터 시스템 또는 주사기 필터 팁을 사용하여 멸균 필터. 4 °C에 보관하십시오.
- 1x HBSS에서 3 mg/mL로 파고통을 희석하여 파팡 스톡 솔루션을 준비하십시오. 0.2 μm 필터 시스템 또는 주사기 필터 팁을 사용하여 멸균 필터. -20 °C에 보관하십시오.
- DNase 분말 20 mg을 첨가하여 H2O를멸균하고 최종 부피 인 20 mL를 가져와 deoxyribonuclease (DNase) 용액을 준비하십시오. 0.2 μm 필터 시스템 또는 주사기 필터 팁을 사용하여 멸균 필터. -20 °C에 보관하십시오.
- 멸균 된 H2O에 352 mg의 아스코르브 산을 첨가하고 20 mL의 최종 부피를 가져와 아스코르브 산 스톡 용액을 준비하십시오. 필요한 경우 37 °C 목욕에 가열하여 용해합니다. 0.2 μm 필터 시스템 또는 주사기 필터 팁을 사용하여 멸균 필터. -20 °C에 보관하십시오.
- 신경물질 배지 50mL에 다음을 추가하여 세포 배양 배지를 준비: 글루타맥스 500 μL (100x), 500 μL 말 혈청, B-27의 1mL, 아스코르브 산 100 μL, 500 μL 의 페니실린 연쇄 상피 및 50 μL 의 50 μL. 0.2 μm 필터 시스템을 사용하여 멸균 필터. 4 °C에 보관하십시오.
- 트리톤 X-100 1mL을 1x PBS의 9mL에 추가하여 0.01% 트리톤 X-100 솔루션을 준비하여 10% 솔루션을 만듭니다. 트리톤 X-100은 점성이 있기 때문에 파이펫을 천천히 채워 팁이 완전히 채워지도록 합니다. 필요한 경우 37 °C 목욕에 가열하여 용해합니다. 4 °C에 보관하십시오.
- 트리톤 X-100 주식을 0.01%로 희석하려면 3직 1:10 희석을 수행합니다. 10% 스톡의 1mL를 1x PBS9mL로 희석하여 1% 용액을 만듭니다. 1% 용액 1mL을 1x PBS 9mL로 희석하여 0.1% 용액을 만듭니다. 0.01% 용액 1mL을 1x PBS 9mL로 희석하여 0.01% 솔루션을 만듭니다.
- 10% 용액을 위해 10% PBS의 9mL에 NGS 1mL을 추가하여 10% 및 1% 일반 염소 세럼(NGS) 솔루션을 준비합니다. 1x PBS의 9.9mL에 NGS 100 μL을 추가하여 1% 용액을 만듭니다.
- 글루타메이트 스톡 솔루션(100mMM)을 첨가하여 735 mg의 L(+)-글루타믹산을 첨가하여 증류된 H2O를 멸균하고 50mL의 최종 부피를 가져옵니다. 이 농도에 용해도 문제가 될 것입니다. 1M 염산의 소량(100 μL)을 첨가하면 용해도를 높이기에 충분합니다.
- NBQX 스톡 솔루션(10mM)을 첨가하여 50mg의 NBQX를 첨가하여 증류H2O를멸균하고 최종 부피인 13mL을 준비합니다.
2. 문화 요리 및 커버립 준비 (해부 전날 완료)
참고: 우리는 3개의 코팅 제, 폴리 L-리신, 폴리 L-ornithine 및 라미닌을 결합하면 이상적인 세포 접착및 생존성을 허용한다는 것을 것을을 발견했습니다.
- 생물학적 안전 캐비닛에 10 35mm 페트리 접시를 놓습니다. 각 접시에 원형 12mm 커버립 2개를 놓고 10분 동안 70% EtOH로 채웁니다. 진공 선을 사용하여 각 접시에서 나머지 EtOH를 흡인하여 EtOH가 완전히 증발할 수 있습니다.
- 파이펫 ~90-100 μL000 0.1% 폴리-L-리신 용액을 각 커버슬립에 적용하여 전체 커버슬립이 폴리 L-리신 용액으로 덮여 있는지 확인합니다. 뚜껑으로 접시를 덮고 37°C 인큐베이터에 1시간 동안 배치합니다.
- 각 커버슬립에서 남은 폴리 L-리신 용액을 흡인시키고 멸균 H2O로 헹구세요.
- 0.1% 폴리 L-오르니틴 용액으로 2.2 – 2.3 단계를 반복합니다.
- 다시, 0.01% 라미닌 솔루션으로 2.2 – 2.3 단계를 반복합니다. 다음 날 세포 도금에 대비할 때까지 37°C/5% CO2 인큐베이터에 놓습니다.
3. 마우스 배아 해부
참고: 우리는 문화당 4~6시간 임신한 마우스를 사용합니다. 해부 과정의 대부분은 생물학적 안전 캐비닛 외부에서 발생하지만 여전히 멸균 절차를 유지하는 것이 중요합니다. 해부 현미경 근처의 표면과 수술 도구에 70 % EtOH를 풍부히 사용하는 것이 이상적입니다. 또한 해부 중에 마스크를 착용하여 오염을 더욱 방지할 수 있습니다. 또한, 우리는 배양 배지에 4 개의 별도 항생제를 사용하므로 오염이 거의 없습니다. 그러나 항생제 사용이 문제가있는 경우이 해부 설정이 멸균 후드 내부로 이동할 수 있습니다. 세포 생존가능성을 보존하려면 모든 해부 용액을 4°C에서 미리 냉각해야 하며, 해부를 가능한 한 빨리 완료해야 한다. 우리는 얼음에 해부를 수행하지 않습니다. 마우스 배아 중뇌 뉴런의 해부 방법은 이전에 설명된 방법9,,10과동일하다.
- 흡수 패드와 해부 현미경 근처 벤치에 공간을 준비하고 70 % EtOH와 자유롭게 스프레이.
- 100 x 15mm 유리 페트리 접시 2개와 50 x 10mm 유리 페트리 접시 1개를 70% EtOH로 스프레이하고 EtOH가 증발할 수 있도록 합니다. 증발하면 멸균 1x HBSS 50mL을 각 100 x 15mm 페트리 접시에 넣습니다.
- 수술 용 가위, 집게 및 마이크로 톤 블레이드를 70 % EtOH에 70 분 동안 최소 10 분 동안 침수하여 멸균하십시오. 흡수 패드에 기기를 놓아 건조시다.
- CO2를 사용한 다음 자궁 경부 탈구를 통해 배아 일째인 14일에 2-3개월 된 시간 초과 임신 마우스를 안락사시합니다.
- 안락사 마우스의 복부를 70% EtOH로 분무하십시오. 집게를 사용하여 하복부를 잡고 외과 가위를 사용하여 복강을 엽니다. 집게가 복부를 들고있는 곳 근처에서 절단을 시작하여 복벽을 다시 접을 수 있고 자궁이 명확하게 보일 때까지 양쪽에 측면 상처를 줍니다.
- 외과 가위를 사용하여 자궁 뿔의 양쪽 끝을 잘라냅니다. 그런 다음 자궁을 제거하고 1x HBSS로 페트리 접시에 넣습니다.
- 스트레이트 팁 집게를 사용하여 자궁에서 배아를 조심스럽게 제거합니다. 이 과정을 통해 HBSS에 배아를 둡니다. 집게 나 마이크로 톤 블레이드를 사용하여 목 근처에서 절단하여 배아를 신속하게 참수합니다. 가능한 한 레벨 컷을 만들기.
- 해부 현미경으로 배아 머리를 마른 50mm 페트리 접시로 옮기고 복부 쪽에 놓습니다. 눈/주미 근처에 배치하고 관통하여 집게로 머리를 안정시다. 집게는 메세스팔론을 관통하지 않도록 ~ 45°에서 아래로 기울어져야 합니다.
- 다른 한편으로는 집게를 사용하여, 조심스럽게 메스페스팔론의 눈에 띄는 능선 직전에 피부와 두개골의 반투명 층을 제거합니다. 중간 선 근처에서 시작하여 메스페스팔론이 완전히 노출 될 때까지 피부와 두개골을 caudally 제거합니다.
- 피질과 메스피살론 사이의 한 쪽 끝과 소뇌 부근의 한 쪽 끝으로 노출된 메스페실론에 수직으로 집게를 잡습니다. 아래로 누르고 전체 중간 뇌를 제거하기 위해 함께 집게를 꼬집습니다. 중간 뇌 세그먼트는 약 0.5 mm 두께여야합니다. 중간 뇌 세그먼트를 신선한 1x HBSS로 채워진 두 번째 페트리 접시에 넣습니다. 각 배아에 대해 이 과정을 반복한다.
- 해부 현미경을 사용하여 뇌 세그먼트를 복부 측이 위로 향하여 배치합니다. 수막이 여전히 부착되어 있는 경우, 조심스럽게 집게를 잡고 뇌 세그먼트에서 들어 올려서 제거하십시오.
- 뇌 세그먼트는 4 눈에 보이는 사분면이 있어야합니다. 세그먼트를 두 개의 더 작은 사분면이 두 개의 큰 사분면보다 우수하게 배치되는 방식으로 배치합니다. 우수한 2개(작은) 사분면과 열등한 2개(대형) 사분면과 분리하는 눈에 띄는 능선이 있습니다.
- 집게를 사용하여 우수한 사분면과 열등한 사분면을 분리한 다음 우수한 사분면을 폐기합니다. 나머지 열등한 사분면은 등쪽 측에 과분 조직을 나중에 가질 것이고, 이 조직은 나머지 복부 조직보다 불투명해 보일 것이다. 덜 조밀 한 등대 조직을 제거하고 폐기. 나머지 세그먼트에는 실질 니그라 파스 콤팩트카(SNc)와 복부 테지멘트 영역(VTA)이 모두 포함되어야 합니다.
- 집게를 사용하여 나머지 복부 조직 세그먼트를 4 개의 작은 조각으로 자르고 1mL 넓은 보어 파이펫을 사용하여 1x HBSS가있는 15 mL 원추형 튜브에서 이러한 세그먼트를 전달합니다. 절차 전반에 걸쳐 얼음에 뇌 세그먼트와 원적 튜브를 유지합니다.
- 남아있는 모든 뇌 세그먼트에 대한이 과정을 반복합니다.
4. 세포의 해리
- 세포의 효소 소화
- 중뇌 세그먼트를 포함하는 15 mL 원추형 튜브에서 HBSS를 조심스럽게 흡인하여 세그먼트를 튜브 의 바닥에 둡시합니다.
- 튜브에 ~800 μL의 파아틀 용액을 넣고 37°C 인큐베이터에 7분 간 배치합니다. 튜브를 가볍게 하여 세포를 다시 중단하고 추가 7 분 동안 37 °C 인큐베이터로 대체하십시오.
- 와이드 보어 1 mL 파이펫 팁으로 미드브레인 세그먼트만 DNase의 1mL 알리쿼트로 제거합니다. 세그먼트가 알리쿼트의 하단 또는 노출 의 약 1 분에 도달 할 수 있습니다.
- 와이드 보어 1 mL 파이펫 팁으로 중간 뇌 세그먼트만 정지 용액 2mL를 포함하는 15 mL 원추형 튜브로 제거합니다. 세그먼트가 튜브 의 바닥에 정착하고 정지 솔루션으로 채워진 추가 원문 튜브에서 헹구기를 반복 할 수 있습니다.
- 셀 서스펜션의 기계적 트리튜레이션
- 두 번째 정지 용액에서 헹구는 튜브를 헹구고, 와이드 보어 1 mL 파이펫 팁을 사용하여, 큰 조직 세그먼트가 보이지 않을 때까지 세포를 위아래로 10 번 피펫. 최소한의 셀 용해를 위해 과다 한 트리튜레이션을 피하는 것이 중요합니다.
- 천천히 파이펫 300 μL 의 4% BSA 용액은 뇌 세그먼트를 포함하는 15 mL 원전 튜브의 바닥에. 서스펜션 레이어를 유지하기 위해 파이펫 팁을 조심스럽게 제거합니다. 원심 분리기0.4 x g에서 3 분 동안. 그런 다음 셀 배양 배지의 400 μL에서 슈퍼네티를 조심스럽게 흡인하고 세포를 재중단합니다.
5. 세포 도금
참고: 경험에 기초하여, 태아 당 대략 100,000의 실행 가능한 세포가 집합됩니다. 2-3 개월 된 시간 초과 임신 마우스는 전형적으로 8-10 배아의 쓰레기 크기를 가지고; 따라서, 시간제 임신 마우스당 세포의 총 수율에 대한 대략적인 추정치는 약 1백만 개의 세포이다.
- 혈류계를 사용하여 세포 수를 제거한 다음 세포 배양 배지를 사용하여 2,000세포/μL로 현탁액을 희석시 한다. 짧게 삼중하여 섞어보도록 합니다.
- 인큐베이터에서 2단계에서 라미닌 용액으로 커버립을 제거하고 진공을 사용하여 코팅된 커버립에서 나머지 라미닌 용액을 흡인합니다. 커버립이 완전히 건조되는 것을 방지하기 위해 신속하게 접시를 매는다. 파이펫 100 μL(2.0 x 105 셀/커버슬립)을 각 커버슬립에 넣고 페트리 접시를 37°C 인큐베이터에 1시간 동안 배치합니다.
- 각 접시에 세포 배양 배지 3mL을 조심스럽게 추가하고 37°C 인큐베이터에 다시 넣습니다. Preform 반 중간 변경 2 주 동안 주 당 시간.
6. 아데노 관련 바이러스 (AAV) 벡터를 가진 14 DIV에서 세포 배양의 감염
- 각 접시에 대해 hSyn-GCaMP6f AAV (1.0 x 1013 티터)의 1 μL과 함께 1 mL의 세럼 무료 DMEM 배지를 준비합니다.
- 각 접시에서 세포 배양 배지를 흡인시키고 hSyn-GCaMP6f를 함유한 무혈무DMEM 1mL로 대체한다. 요리를 37°C 인큐베이터에 1시간 동안 다시 넣습니다.
- AAV를 함유한 혈청 프리 배지를 흡인하고 세포 배양 배지의 3mL로 대체한다. 37°C 인큐베이터에 요리를 다시 넣습니다. 우리는 AAV 감염의 5-7 일이 GCaMP 발현의 이상적인 수준을 허용한다는 것을 것을을 발견했습니다. 바이러스 감염의이 기간 동안 매 2-3 일마다 매체를 변경 합니다.
7. 19-21 DIV 사이의 라이브 공초점 Ca2+ 이미징
참고: 6.3 단계에서 언급했듯이, 화상 진찰은 바이러스 감염 후에 5-7 일 사이에서 행해질 수 있습니다. 이것은 자발적인 Ca2+ 활동의 검출을 허용하는 수준에서 형광소의 눈에 보이는 표현을 달성하기위한 이상적인 창입니다.
- 레코딩 버퍼 준비
- HEPES 레코딩 버퍼 1L을 만들기 위해 NaCl 9.009 g, KCl 0.3728 g, D-포도당 0.901 g, HEPES 2.381 g, 1 M CaCl 2 스톡 솔루션 2m, 500 μL 1M2MgCl2 재고 용액 을 800 m로 O. O. O.2 1 L의 최종 볼륨에 가져.
- 20 μM 글루타민트 레코딩 버퍼의 200mL를 만들기 위해, 위에서 설명한 HEPES 기록 버퍼의 200mL로 100mMM의 글루타민트 스톡 용액의 40 μL을 희석한다.
- 10 μM NBQX 레코딩 버퍼의 200mL를 만들기 위해 10mM NBQX 스톡 솔루션의 200 μL을 HEPES 레코딩 버퍼 200mL로 희석하십시오.
- 공초점 이미징
- 멸균 35mm 페트리 접시에 3mL의 레코딩 버퍼를 채웁니다.
- 37°C 인큐베이터에서 감염된 배양으로 35mm 페트리 접시를 제거합니다. 미세 팁 집게를 사용하여 한 커버 슬립의 가장자리를 조심스럽게 잡고 녹음 버퍼로 채워진 페트리 접시로 빠르게 옮습니다. 나머지 커버슬립을 37°C 인큐베이터에 다시 중간 크기로 놓습니다. 녹음 버퍼와 함께 접시를 공초점 현미경으로 운반합니다.
- 이미징 소프트웨어를 시작합니다. 초기화하는 동안 다음 단계로 진행합니다.
- 연동 펌프를 시작하고 레코딩 버퍼에 라인을 배치합니다. 흐름 속도를 2mL/분으로 보정합니다.
- 감염된 커버슬립을 35mm 페트리 접시에서 녹음 욕조로 옮킨다.
- 10배 물 침수 목표와 BF 빛을 사용하여 초점 의 평면을 찾아 뉴런 세포 체의 고밀도를 가진 영역을 찾습니다. 40배 물 침수 목표로 전환하고 BF 라이트를 사용하여 시료에 다시 초점을 맞춥니다.
- 플루오뷰 내의 "염료 목록" 창에서 AlexaFluor 488을 선택하고 적용합니다.
- AAV 식은 변수일 수 있습니다. 따라서 형광의 과다 노출 및 광표백을 방지하기 위해 낮은 HV 및 레이저 전원 설정으로 시작합니다. AlexaFluor 488 채널의 경우 고전압(HV)을 500으로 설정하고 게인을 1x로 설정하고 0으로 오프셋합니다. 488 레이저 라인의 경우 전력을 5%로 설정합니다. z-평면에서 이미지된 유효 볼륨을 증가시키기 위해 핀홀 크기를 300 μm로 늘립니다. "초점 x2" 스캐닝 옵션을 사용하여 배기가스 신호를 하위 채도 수준으로 최적으로 조정합니다. 여기에서 각 채널의 이상적인 가시성이 달성될 때까지 설정을 조정할 수 있습니다.
참고: GCaMP로 Ca2+ 플럭스의 전체 범위를 정확하게 캡처하려면 검출기를 과도하게 처리하지 않고 형광 강도의 증가를 허용하기 위해 기준선 HV 및 레이저 전원 설정을 조정합니다. - 현미경 설정이 최적화되면, GCaMP6f 형광에서 자발적인 변화를 표시하는 여러 세포가있는 영역을 찾아 이미징을 위해 원하는 평면에 초점을 맞추기 위해 단계를 이동합니다.
- "클립 정류" 도구를 사용하여 이미징 프레임을 1초 미만의 프레임 간격으로 달성할 수 있는 크기로 잘라냅니다. 이것은 초당 1 프레임에서 이미징 간격을 설정하는 데 필요합니다.
- "간격" 창을 값1.0과 "Num" 창을 600으로 설정합니다.
참고: 원하는 시점(300s)에서 다른 레코딩 버퍼를 전달하려면 펌프의 대기 시간을 보정하여 새로운 솔루션을 목욕에 전달하는 것이 중요합니다. 이는 용액 관류 속도(2mL/min)와 펌프 용액에 사용되는 라인의 길이에 따라 달라집니다. - t 시리즈 동영상을 캡처하려면 "시간" 옵션을 선택한 다음 "XYt" 검색 옵션을 사용하여 이미징을 시작합니다.
- 이미징 진행률 막대를 보고 HEPES 레코딩 버퍼에서 적절한 시점에서 20 μM 글루타메이트 레코딩 버퍼로 라인을 이동합니다(예: 펌프의 대기 시간이 60초에서 솔루션을 제공하도록 보정되는 경우, 300s에서 글루타메이트를 전달하기 위해 240프레임에서 조미료 버퍼로 라인을 이동).
- 이미징이 완료되면 시리즈 완료 버튼을 선택하고 완성된 t 시리즈 동영상을 저장합니다. 배양 된 뉴런이 총 10 분 동안 글루타민에 노출되도록 20 μM 글루타민산염을 추가로 5 분 동안 계속 perfuse. 각 커버슬립을 이미지화할 때마다 이 프로세스를 반복합니다.
- 20 μM 글루타민에 추가로 5분 동안 노출된 후, 욕조에서 커버슬립을 제거하고 영상 촬영 일이 완료될 때까지 레코딩 버퍼를 함유한 35mm 페트리 접시에 다시 넣습니다. 완료되면 8단계로 진행합니다.
- Ca2+ 추적 분석
- ImageJ에서 이미지 분석을 수행합니다. ImageJ용 BIO-FORMATS 플러그인을 설치하여 이를 허용합니다. OIB 이미지 파일을 엽니다.
- ImageJ 도구 모음에서 분석하려면 클릭 | 측정값을 설정하고평균 회색 값(MGV)에 대한 상자를 선택합니다.
- ImageJ에서 하이퍼 스택으로 t 시리즈 영화를 엽니다.
- 동영상의 슬라이더를 드래그하고 최대 글루타민반응으로 프레임을 식별하여 글루타민에 반응하는 모든 뉴런을 시각화합니다. 다각형 도구를 사용하여 눈에 보이는 모든 뉴런 세포 체를 추적하여 ROI를 "ROI 관리자" 목록에 추가합니다.
- 추적 및 ROI 추가가 완료되면 ROI 관리자 창 내의 모든 ROI를 선택하고 더 많은 옵션 목록에서 다중 측정값 선택을 사용합니다. 이러한 데이터를 복사하여 스프레드시트에 붙여넣습니다. 모든 영화를 분석할 이 프로세스를 완료합니다.
- 각 ROI에 대해, 방정식을 사용하여 각 프레임에서 ΔF/F0 값으로 원시 MGV 데이터를 변환합니다: ΔF/F0 = [F(t) – F0]/ F0. 여기서 F(t) = 주어진 프레임의 MGV,F0 = 평균 기준선 MGV ~10 프레임의 경우 Ca2+ 플럭스가 존재하지 않습니다.
- OriginPro 2020과 같은 통계 소프트웨어를 사용하여 변환된 ΔF/F0 추적을 라인 그래프로 만들 수 있습니다. "피크 분석기" 함수는 글루타민반응의 피크 진폭, 조미료에 반응하는 대기 시간 및 곡선 아래 영역을 측정하기 위해 (또는 다른 소프트웨어를 사용하는 경우 이와 유사한 기능)을 사용할 수 있습니다.
8. 배양의 면역 염색
참고: 포르말린으로 고정후, 커버립은 면역염색을 위해 처리될 준비가 될 때까지 4°C에서 1x PBS에 저장할 수 있습니다. 1차 및 이차 항체 인큐베이션은 항-Caspase-3 1차 항체를 가진 배양과 같은 연쇄적인 방식으로 수행되었으며, 그 보완적인 이차 항체는 항체 1차 항체 및 보완적인 이차 항체를 사용하여 배양에 선행되었다.
- 글루타민트 노출 직후 커버슬립을 35mm 페트리 접시에 다시 넣고 레코딩 버퍼를 흡인하고 10% 포르말린 3mL를 추가합니다. 실온(RT)에서 40분 동안 앉습니다.
- 1x PBS로 3회 헹구는 요리.
- PBS를 흡습하고 PBS에서 0.01% 트리톤 X-100의 1mL에서 2분 동안 세포를 흡혈구한다.
- 1x PBS로 3회 헹구는 요리.
- PBS에서 PBS 및 블록 셀을 1mL에서 10% NGS의 10% NGS에서 40분 동안 흡인시합니다.
- 1x PBS로 3회 헹구는 요리.
- PBS(1:1000 희석)에서 1mL의 1mL에 토끼 항 카스파스-3 1차 항체1μL을 첨가한다. 접시에서 PBS를 흡인하고 1 차 적인 항체 용액으로 대체하십시오. 셰이커에 놓고 RT에서 1.5 시간 동안 인큐베이션하십시오.
- 1x PBS로 3회 헹구는 요리.
- 염소 안티 토끼 알렉사플루어 488 이차 항체의 1 μL을 PBS (1:1000 희석)에서 1 % NGS의 1 mL에 추가합니다. 접시에서 PBS를 흡인하고 이차 항체 용액으로 대체하십시오. 셰이커에 놓고 RT에서 1h에 대한 인큐베이션을 진행하십시오.
- 1x PBS로 3회 헹구는 요리.
- 반복 단계 8.7 – 8.10, 하지만 닭 안티 TH 1 차성 항체를 사용 하 여 (1:1000) 단계에서 단계 8.7 및 염소 항 닭 알렉사플루어 594 이차 항체 (1:1000) 단계에서 8.9.
- 최종 PBS 헹구기 에 따라, 현미경 슬라이드에 장착 매체의 30 μL을 배치합니다. 집게를 사용하여 35mm 페트리 접시에서 커버슬립을 잡고 커버슬립을 장착 매체로 아래로 향하도록 하는 셀을 놓습니다. 두 커버립모두 올바르게 배치하면 단일 현미경 슬라이드에 맞습니다. 건조하고 어두운 곳에 놓고 마운팅 매체가 밤새 건조하도록 합니다.
9. 면역 염색 된 문화의 공초점 이미징
- 공초점 이미징
- 이미징 소프트웨어를 시작합니다. 샘플을 현미경 단계에 놓습니다.
- 현미경 안구를 사용하면 TRITC 필터를 사용하여 20배배율 목표및 상피 광을 사용하여 샘플을 집중하고 TH+ 세포 본체를 검색합니다.
- TH+ 셀 본문을 찾은 후 시야에서 중앙을 중심으로 60배율 배율 목표로 이동합니다.
- "염료 목록" 창에서 AlexaFluor 488 및 AlexaFluor 594 염료를 선택합니다.
- 라이브 이미징과 마찬가지로 낮은 HV, 게인, 오프셋 및 레이저 전원 설정으로 시작하여 광표백을 방지합니다. "초점 x2" 스캔 옵션을 사용하여 각 채널의 형광 강도를 평가하고 그에 따라 조정합니다. 이러한 이미지는 나중에 형광 강도에 대해 정량화될 것이기 때문에 모든 시야에서 이미징 설정을 일관되게 유지해야 합니다. 따라서 각 조건의 몇 가지 예를 살펴보면 샘플 전반에 걸쳐 형광 강도 범위에 대한 아이디어를 얻는 것이 가장 좋습니다.
- 이상적인 이미징 설정이 결정되면 "포커스 x2" 스캔 옵션을 선택하고 관심 있는 셀을 시야 중앙으로 이동합니다. "줌" 슬라이더를 사용하여 디지털 줌을 3배로 늘립니다.
- 포커스 노브를 사용하여 가장 밝은 형광으로 초점 의 평면을 찾아 하나의 평면 XY 이미지를 캡처합니다. 이미지를 저장하여 완료합니다.
- 다른 TH+ 셀을 검색하려면 20배 배율 목표로 다시 전환합니다. 원하는 수의 세포가 각 조건에서 샘플링될 때까지 이 과정을 반복합니다.
- 이미지 분석
- ImageJ 도구 모음에서 분석하려면 클릭 | 측정값을 설정하고영역, 통합 밀도 및 평균 회색 값에 대한 상자를 선택합니다.
- ImageJ 도구 모음을 드래그하고 삭제하거나 파일 메뉴를 통해 이미지를 선택하여 각 채널이 분리된 하이퍼스택으로 이미지를 엽니다.
- TH 채널(594 nm)을 사용하여 세포 체주위에 ROI를 그립니다. ImageJ에서 다각형 추적 도구를 사용하여 셀 본체의 바깥쪽 가장자리를 밀접하게 추적합니다. 세포막과 세포 핵 사이의 거리가 가장 작은 경우, 사이토솔을 통해 핵의 가장자리까지 직선을 추적한 다음 핵의 윤곽을 밀접하게 따라 이를 배제한다. 그런 다음 외부 멤브레인으로 다시 직선을 추적하여 초기 라인을 가능한 한 가깝게 접하고 ROI가 완료될 때까지 세포 체의 윤곽을 계속 따릅니다.
- 키보드 단축자 "T"를 사용하거나 도구 모음 메뉴 경로를 사용하여 분석 | 도구 | ROI 매니저,ROI 관리자를 열고 목록에 그려진 ROI를 추가합니다.
- caspase-3 채널(488 nm)의 창을 선택한 다음 "ROI 관리자" 목록에서 추가된 ROI를 선택합니다.
- ROI 관리자 창에서 측정 단추를 선택합니다. 결과 창은 이전에 설정된 측정값과 함께 나타납니다. 스프레드시트에 복사하고 각 셀에 대해 이 프로세스를 반복합니다.
결과
세포의 초기 배양에 따라, 우리는 AAV hSyn-GCaMP6f의 1 μL로 14 DIV에서 VM 배양 접시를 처리하고 바이러스 성 발현5 일 동안 허용했습니다. 영상 촬영 당일 HEPES 레코딩 버퍼는 신선하게 준비하였다. 우리는 두 가지 조건을 사용했습니다. 한 조건에서 20 μM 글루타메이트는 10분 동안 적용되었고, 다른 조건에서는 10μM NBQX 의 5분 이면에 10μM NBQX + 20 μM 글루타메이트의 10분 공동 적용이 선행되었다. 두 조건 모두에서, 우리는 GCaMP6f 형광의 이종및 자발적인 변화를 관찰, 이는 자발적인 Ca2 + 플럭스를 나타내는, 대표 흔적에 도시된 바와 같이(그림 1A, B, 보충 영화 1-2). 20 μM 글루타메이트의 적용은 자발적으로 활성 및 정지 성 뉴런 모두에서 견고하고 지속적인 Ca2+ 반응을 생성(그림 1A, 보충 영화 1). 10 μM NBQX의 응용 프로그램은 자발적인 활성을 감소시키고 글루타민반응(도 1B, 보충 동영상 2)을부분적으로 차단하였다. 각 조건에서 조미료 응용 프로그램이 Ca2+ 응답을 자극하는 정도는 곡선 아래 영역, 피크 진폭 및 반응할 대기 시간을 사용하여 정량화되었습니다. 곡선 및 피크 진폭 아래의 두 영역모두 글루타민산염 및 NBQX + 글루타민처리조건(도 1C)과유사했으며, 응답에 대한 대기 시간은 NBQX + 글루타민트 상태(도2A,B)에서크게 증가하였다.. 글루타민처리에 대한 Ca2+ 반응을 정량화하는 것 외에도 글루타민트 매개 석립증의 척도로서 항 카스파스-3 항체로 샘플을 고정하고 염색했습니다. 조건에 걸쳐 카스파제-3 활성화의 범위를관찰하였다(그림 3A, B). Caspase-3 활성화는 측정 영역 및 평균 caspase-3 강도에 의해 정량화되었다. 처리되지 않은 대조군 세포와 비교했을 때, 글루타민산염 및 NBQX + 글루타민트 조건 하에서 caspase-3 활성화를 갖는 세포의 평균 영역은 유의성(도3B)으로경향하였다. 평균 caspase-3 강도는 처리되지 않은 대조군(도 3B)에비해 글루타민트 및 NBQX + 글루타민트 조건에서 상당히 높았다. 이러한 결과는 함께 엑시토독성 제제에 대한 Ca2+ 반응을 정량화하여 뉴런의 세포멸을 측정하고 동일한 배양 집합에서 caspase-3 활성화와 같은 다운스트림 세포 분석의 분석을 통해 측정할 수 있는 고함량 프레임워크를 보여 줍니다.
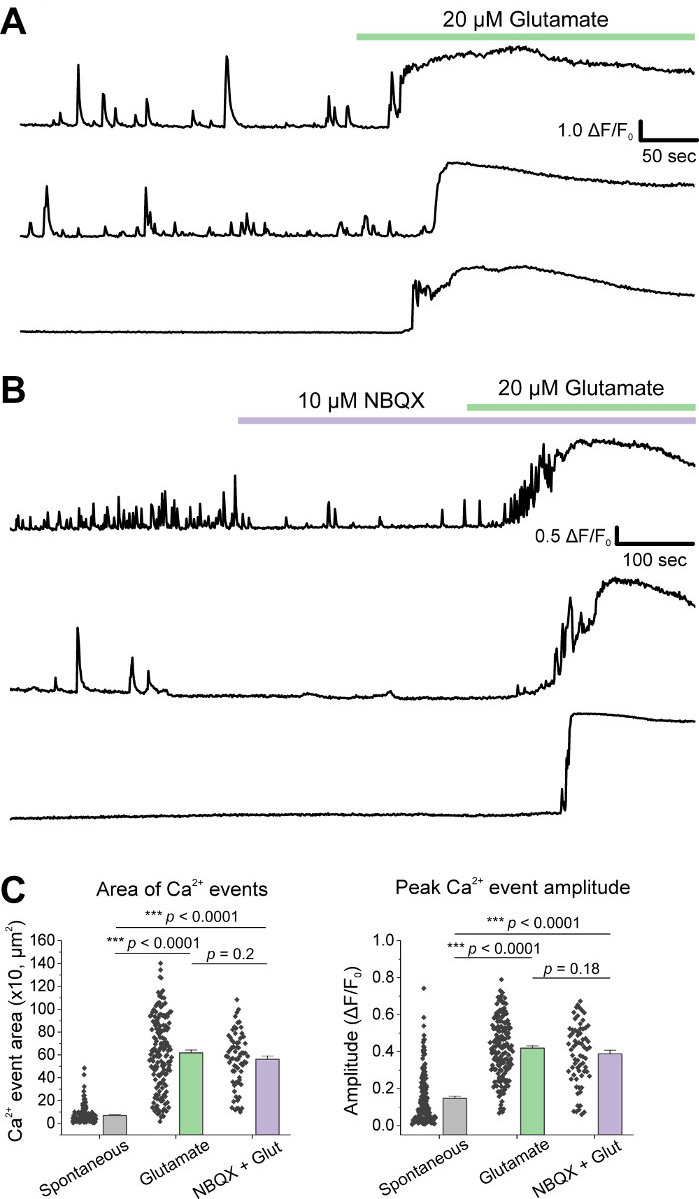
그림 1: 배양 된 복부 심연 성 뉴런은 자발적인 Ca2+ 활동을 표시하고 글루타민트 응용 프로그램에 의해 강력하게 자극됩니다. (A)VM 뉴런에서 자발적인 Ca2+ 활성의 대표적인 흔적과 20 μM 글루타메이트 응용 프로그램에 대한 반응. (B)VM 뉴런에서 자발적인 Ca2+ 활성의 대표적인 흔적과 10 μM NBQX + 20 μM 글루타메이트 애플리케이션에 대한 반응. (C)Ca2+ 추적의 곡선 및 피크 진폭 아래 영역을 나타내는 인구 데이터. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
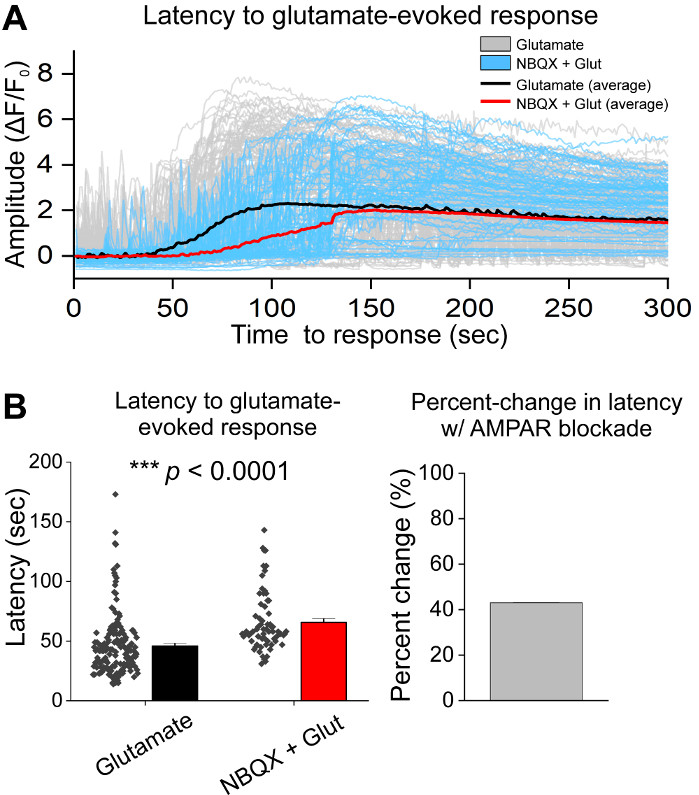
그림 2: NBQX를 가진 AMPAR 봉쇄는 배양된 복부 심전도 뉴런에서 글루타민제 응용에 대한 반응을 지연시다. (A)대표 Ca2+ 글루타민산염(회색) 및 NBQX + 글루타민트(파란색)의 흔적이 응답을 불러 일으켰습니다. 글루타민트(블랙)와 NBQX + 글루타메이트(빨간색)의 평균 Ca2+ 흔적이 오버레이된 것으로 나타났다. (B)글루타민산염 및 NBQX + 글루타메이트에 대한 응답에 대한 대기 시간을 나타내는 인구 데이터가 응답을 불러 일으켰습니다. 글루타민트와 NBQX + 글루타민트 조건 사이의 백분율 변화가 오른쪽 패널에 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
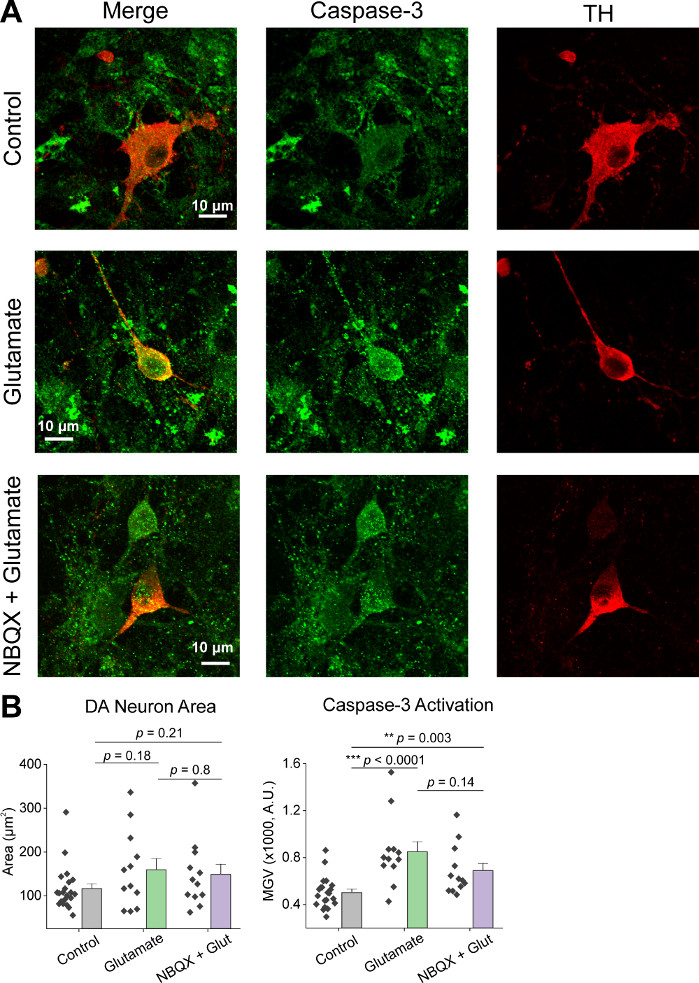
그림 3: 글루타민트 응용 프로그램은 티로신 하이드록실라제(TH) 양성 복부 심폐성 뉴런에서 caspase-3 발현을 증가시킨다. (A)VM 배양물의 대표적인 공초점 이미지는 카스파제-3(녹색) 및 TH(빨간색), 스케일 바 = 10 μm.(B)각 조건에서 caspase-3 발현의 평균 회색 값을 나타내는 인구 데이터를 갖는다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보조 영화 1: 자발적인 Ca2+ 활동 및 글루타민트 응용 프로그램에 대한 응답.
HEPES 레코딩 버퍼(0-300s)가 있는 경우 자발적인 Ca2+ 플럭스가 20μM 글루타메이트(301-600s)를 적용합니다. 스케일 바 = 50 μm. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
보조 영화 2: 자발적인 Ca2+ 활동 및 NBQX + 글루타민트 응용 프로그램에 대한 응답.
HEPES 레코딩 버퍼(0-300s)가 있는 경우 자발적인 Ca2+ 플럭스 10 μM NBQX(301-600s) 및 10 μM NBQX + 20 μM 글루타메이트(601-900s)를 적용한다. 스케일 바 = 50 μm. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
토론
우리는 뉴런에서 글루타민산 매개 세포석증의 고함량 분석을 위한 장기 1 차적인 1차 복부 심폐(VM) 세포 배양 시스템을 기술합니다. 연구는 PD 모델 의 맥락에서 엑시토 독성 메커니즘을 해명하기 위해 기본 중뇌 도파민 문화를사용하였다 11,,12. 이 연구에서는, 우리는 Ca2+ 활동을 측정하고 더 apoptotic 신호 캐스케이드4의개시와 같은 다운스트림 분자 변화와 이 활동을 연관시키기 위하여 유전으로 인코딩된 칼슘 표시기(GECIs)를 사용하여 조합접근을 채택합니다. 이 방법은 다른 유사한 세포 배양 시스템에 여러 가지 장점이 있습니다. 우리는 파킨슨 병의 맥락 내에서 흥분 독성에 특히 관심이 있기 때문에, 1 차적인 VM 세포 배양을 사용하는 것이 이상적입니다. TH 면역염색과 결합된 격자 표지또는 전동 XY 현미경 단계와 같은 다른 필드 재배치 기술을 사용하여, 우리는 복부 중뇌 뉴런에서 글루타민산 매개 세포 세포 세포의 특정 효과를 직접 연구할 수 있습니다. 또한, 3 주 세포 배양 모델은 뉴런이 성인 DA 뉴런9을반영하여 전체, 성숙한 분자 프로파일을 개발할 수 있게 합니다. 이전 방법은 주로 글루타민산 매개 흥분 독성13,,14에따른 분자 변화에 초점을 맞추고 있다. 이 모델은 뉴런 생리학의 급성 변화와 확인된 세포 유형의 다운스트림 분자 사건과 상관 관계를 맺는 능력이 독특합니다. 1 차 배양 모델의 한 가지 제한은 해부 기술이 전체 복부 중뇌를 캡처한다는 것입니다, DA와 GABAergic 뉴런뿐만 아니라 SNc와 VTA에서 뉴런을 포함. 증거는 지금 SNc의 DA 뉴런이 이웃 VTA15의DA 뉴런에 비해 칼슘과 최종 세포 사멸에 선택적 취약점이 있음을 시사한다. 불행히도, 배아 배양 배양에서 VTA 뉴런에서 SNc를 차별화하는 것은 배아 뇌에서 이러한 구조를 정의하는 몇 가지 해부학 적 랜드 마크와 어려운 입증했다.
우리는 기본 배양 기술이 이종 자발적인 Ca2+ 활동의 정량화를 허용한다는 것을 보여줍니다(도 1). 따라서, 이것은 중뇌의 페이스메이킹 도파민간 뉴런, 신코르티컬 뉴런, 및 수막핵(SCN)16,,17의GABAergic 뉴런과 같은 톤활성 세포를 연구하는 이상적인 세포 배양 시스템 모델이다. 대부분의 응용 프로그램에서 Ca2+ 이미징은 전기 생리학과 동일한 시간적 해결을 달성하지 못합니다. 따라서 단일 Ca2+ 이벤트는 신경 작용 잠재력의 파열과 유사할 수 있습니다. 이는 Ca2+ 이미징이 페이스메이킹 세포에서 비정상적인 파열 활성을 비교적 정확하게 측정할 수 있으며 따라서 Ca2+-매개엑시토독성 세포 사멸의 고함량 스크린에 적합하다는 것을 의미하기 위해 해석될 수 있다.
자발적인 Ca2+ 활동을 달성하고 유지 관리하려면 프로토콜의 두 가지 핵심 사항을 해결하는 것이 중요합니다. 첫 번째는 해부 다음 세포의 도금 밀도입니다. 1 차적인 VM 뉴런을 위해, 이전 연구 결과는 약 100,000 세포/cm29,,10을사용했습니다. 우리는 200,000 세포 /cm2의밀도를 플레이트 프로토콜을 조정하여 이종성 범위의 자발적 인 활성을 생성하고 각 커버 슬립에 존재하는 도파민 성 VM 뉴런의 수를 증가시킵니다. 다른 페이스 메이킹 뉴런은 뚜렷한 발사 특성을 가지고 있기 때문에16,도금 밀도는 연구되고 자발적 인 활동의 이상적인 수준을 달성하기 위해 최적화되는 세포 유형에 사용자 정의 할 필요가있다. 두 번째는 AAV의 바이러스 감염 에 따른 잠복기입니다. 도금 밀도처럼, 이것은 연구 질문의 특정 컨텍스트와 사용되는 AAV의 유형에 따라 달라집니다. 여기서 사용되는 특정 AAV의 경우, 바이러스 감염 에 따른 5일 간의 배양은 원하는 단백질 발현 수준을 달성하는 데 이상적이며, 이는 Ca2+ 활성을 기록하기 위해 GCaMP 형광의 동적 변화를 허용한다. 많은 요인이 AAV가화물을 얼마나 빠르고 효율적으로 표현할 것인지를 결정하며, 그 중 상당수는 이 방법의 범위를 벗어났지만, 간단히 말해서, 프로모터 활동과 화물 단백질이 성숙하고 접는 속도를 고려하는 것이 중요합니다.
이 방법의 또 다른 장점은 형식, 발현 벡터, 이미징 장비 사용 및 해결할 수 있는 과학적 질문의 범위에서 상당한 유연성을 허용한다는 것입니다. 또한, 이 방법은 PD의 글루타메이트 매개 흥분 독성및 신경계 기능 장애의 다른 모델을 둘러싸는 광범위한 특정 질문에 대한 문의를 가능하게 합니다. 예를 들어, 글루타민산 매개 흥분독성은 다중 수용체와 신호 캐스케이드5를포함한다. 상기 방법을 이용하여, AMPAR 차단제, NBQX를 도 1에서,생리학적 및 분자 수준에서 엑시토독성 글루타민반응의 특정 성분을 해부할 수 있다. 생각할 수 있는, 두 번째 메신저 시스템의 억제제를 사용 하 여 비슷한 접근 흥분 독성에 그들의 기여를 결정 하는 데 사용할 수 있습니다. 또한, 여기에 사용되는 AAV는 신경 전달 물질 방출과 같은 다른 매개 변수를 측정하는 데 사용할 수있는 세포 특정 프로모터 또는 AAV 발현 광유전학 센서로 GECI를 발현하도록 적응 될 수 있습니다.
1 차적인 배아 해부 및 공초점 화상 진찰을 제외하고, 프로토콜의 대부분은 특수 교육을 필요로 하지 않는 기본적인 실험실 기술을 이용합니다. 따라서, 모델에 대한 제한은 배아 해부 기술의 난이도, 세포가 성숙에 도달하기 위해 배양되어야 하는 시간의 길이, 및 공초점 현미경, 또는 유사한 이미징 장치에 대한 접근을 포함한다. 이 방법의 많은 이점과 유연성은 이러한 한계보다 더 중요하므로 신경계 장애에서 글루타메이트 매개 흥분 독성을 연구하기에 이상적인 모델입니다. 마지막으로,이 모델은 안티 세포 효과 와 DA 뉴런 건강을 보존 하는 그들의 능력에 대 한 새로운 화합물을 스크린 하는 효과적인 도구가 될 수 있습니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
미국 파킨슨 병 협회 (APDA)와 NIH R01NS15809-01RS의 보조금에 의해 지원됩니다. 텍사스 유전체 의학 연구소 (TIGM)는 1 차적인 도파민 문화를 생성하기 위하여 시간 조정된 임신 마우스를 제공한 것을 감사합니다.
자료
| Name | Company | Catalog Number | Comments |
| 10% Formalin/PBS | VWR | 100496-506 | |
| 10X NA 0.3 water-immersion objective | Olympus | UMPLFLN10XW | |
| 12 mm circular cover glass No. 1 | Phenix Research Products | MS20-121 | |
| 20X NA 0.85 oil-immersion objective | Olympus | UPLSAPO20XO | |
| 35 mm uncoated plastic cell culture dishes | VWR | 25382-348 | |
| 40X NA 0.3 water-immersion objective | Olympus | LUMPLFLN40XW | |
| 60X NA 1.35 oil-immersion objective | Olympus | UPLSAPO60XO | |
| Ampicillin (sodium) | Gold Bio | A-301-25 | |
| B-27 supplement | ThermoFisher | 17504044 | 50x stock |
| Binolcular Microscope | Kent Scientific | KSCXTS-1121 | |
| Bovine serum albumin (BSA) | Sigma-Aldrich | A7030 | |
| Calcium Chloride (CaCl2), anhydrous | Sigma-Aldrich | 746495 | |
| Chicken polyclonal anti-Tyrosine Hydroxylase | Abcam | ab76442 | |
| Deoxyribonuclease I (DNase) | Sigma-Aldrich | DN25 | |
| D-glucose, andydrous | Sigma-Aldrich | RDD016 | |
| DMEM + GlutaMAX medium | ThermoFisher | 10569010 | 500 mL |
| Equine serum | ThermoFisher | 26050088 | heat-inactivated |
| Fiber Optic Illuminator, 100V | Kent Scientific | KSC5410 | |
| Filter System, PES 22UM 250ML | VWR | 28199-764 | |
| Fluoview 1000 confocal microscope | Olympus | ||
| Fluoview 1200 confocal microscope | Olympus | ||
| GlutaMAX supplement | ThermoFisher | 35050061 | |
| Goat polyclonal anti-chicken Alexa Fluor 594 | Abcam | ab150176 | |
| Goat polyclonal anti-rabbit Alexa Fluor 594 | Abcam | ab150077 | |
| Hanks-balanced Salt Solution (HBSS) 1x | ThermoFisher | 14175095 | 500 mL |
| HEPES | VWR | 101170-478 | |
| HeraCell 150 CO2 incubator | Heraeus (ThermoFisher) | ||
| ImageJ v1.52e | NIH | ||
| IRIS-Fine Scissors (Round Type)-S/S Str/31*8mm/13cm | RWD | S12014-13 | |
| Kanamycin monosulfate | Gold Bio | K-120-25 | |
| Laminin | Sigma-Aldrich | L2020 | |
| L-Ascorbic acid | Sigma-Aldrich | A7506 | |
| L-glutamic acid | VWR | 97061-634 | |
| Magnesium Chloride (MgCl2), andydrous | Sigma-Aldrich | M8266 | |
| MPII Mini-Peristaltic Pump, 115/230 VAC, 50/60 Hz | Harvard Apparatus | 70-2027 | |
| MULLER Micro Forceps-Str, 0.15mm Tips, 11cm | RWD | F11014-11 | |
| NBQX | Hello Bio | HB0443 | |
| Neurobasal medium | ThermoFisher | 21103049 | 500 mL |
| Normal goat serum (NGS) | Abcam | ab7481 | |
| Origin 2020 | OriginLab | ||
| pAAV.Syn.GCaMP6f.WPRE.SV40 | Addgene | 100837-AAV1 | Titer: 1.00E+13 gc/ml |
| Papain | Worthington Biomedical Corporation | LS003126 | |
| Penicillin streptomycin | ThermoFisher | 15140122 | 10,000 U/mL |
| Phosphate-buffered saline (PBS) 1x | ThermoFisher | 10010049 | 500 mL |
| Poly-L-lysine | Sigma-Aldrich | P4832 | |
| Poly-L-ornithine | Sigma-Aldrich | P4957 | |
| Potassium Chloride (KCl), anhydrous | Sigma-Aldrich | 746436 | |
| Pump Head Tubing Pieces For MPII | Harvard Apparatus | 55-4148 | |
| Rabbit monoclonal anti-caspase-3 | Abcam | ab32351 | |
| Sodium Chloride (NaCl), anhydrous | Sigma-Aldrich | 746398 | |
| Sucrose | Sigma-Aldrich | S7903 | BioXtra, ≥99.5% (GC) |
| Time-pregnant female C57BL/6 mice | Texas A&M Institue for Genomic Medicine | ||
| Triton X-100 | Sigma-Aldrich | X100 | 500 mL |
| Wide-bore blue pipette tips P1000 | VWR | 83007-380 |
참고문헌
- Marras, C., et al. Prevalence of Parkinson's disease across North America. NPJ Parkinson's Disease. 4, 21 (2018).
- Poewe, W., et al. Parkinson disease. Nature Reviews Disease Primers. 3, 17013 (2017).
- Mehta, A., Prabhakar, M., Kumar, P., Deshmukh, R., Sharma, P. L. Excitotoxicity: bridge to various triggers in neurodegenerative disorders. European Journal of Pharmacology. 698 (1-3), 6-18 (2013).
- Ambrosi, G., Cerri, S., Blandini, F. A further update on the role of excitotoxicity in the pathogenesis of Parkinson's disease. Journal of Neural Transmission (Vienna). 121 (8), 849-859 (2014).
- Dong, X. X., Wang, Y., Qin, Z. H. Molecular mechanisms of excitotoxicity and their relevance to pathogenesis of neurodegenerative diseases. Acta Pharmaceutica Sinica B. 30 (4), 379-387 (2009).
- Vieira, M., et al. Excitotoxicity through Ca2+-permeable AMPA receptors requires Ca2+-dependent JNK activation. Neurobiology of Disease. 40 (3), 645-655 (2010).
- Sebe, J. Y., et al. Ca(2+)-Permeable AMPARs Mediate Glutamatergic Transmission and Excitotoxic Damage at the Hair Cell Ribbon Synapse. Journal of Neuroscience. 37 (25), 6162-6175 (2017).
- Brickley, S. G., Farrant, M., Swanson, G. T., Cull-Candy, S. G. CNQX increases GABA-mediated synaptic transmission in the cerebellum by an AMPA/kainate receptor-independent mechanism. Neuropharmacology. 41 (6), 730-736 (2001).
- Srinivasan, R., et al. Smoking-Relevant Nicotine Concentration Attenuates the Unfolded Protein Response in Dopaminergic Neurons. Journal of Neuroscience. 36 (1), 65-79 (2016).
- Henley, B. M., et al. Reliable Identification of Living Dopaminergic Neurons in Midbrain Cultures Using RNA Sequencing and TH-promoter-driven eGFP Expression. Journal of Visualized Experiments. (120), e54981 (2017).
- Douhou, A., Troadec, J. D., Ruberg, M., Raisman-Vozari, R., Michel, P. P. Survival promotion of mesencephalic dopaminergic neurons by depolarizing concentrations of K+ requires concurrent inactivation of NMDA or AMPA/kainate receptors. Journal of Neurochemistry. 78 (1), 163-174 (2001).
- Lavaur, J., et al. The noble gas xenon provides protection and trophic stimulation to midbrain dopamine neurons. Journal of Neurochemistry. 142 (1), 14-28 (2017).
- Kritis, A. A., Stamoula, E. G., Paniskaki, K. A., Vavilis, T. D. Researching glutamate - induced cytotoxicity in different cell lines: a comparative/collective analysis/study. Frontiers in Cellular Neuroscience. 9, 91 (2015).
- Gupta, K., Hardingham, G. E., Chandran, S. NMDA receptor-dependent glutamate excitotoxicity in human embryonic stem cell-derived neurons. Neuroscience Letters. 543, 95-100 (2013).
- Surmeier, D. J., Obeso, J. A., Halliday, G. M. Selective neuronal vulnerability in Parkinson disease. Nature Reviews Neuroscience. 18 (2), 101-113 (2017).
- Ramirez, J. M., Tryba, A. K., Pena, F. Pacemaker neurons and neuronal networks: an integrative view. Current Opinion in Neurobiology. 14 (6), 665-674 (2004).
- Guzman, J. N., Sanchez-Padilla, J., Chan, C. S., Surmeier, D. J. Robust pacemaking in substantia nigra dopaminergic neurons. Journal of Neuroscience. 29 (35), 11011-11019 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유