Method Article
Primer Fare Orta Beyin Nöronlarında Spontan Ca2+ Akılarının ve Downstream Etkilerinin Ölçülmesi
Bu Makalede
Özet
Burada in vitro Ca 2+ akıları orta beyin nöronlar ve caspase-3 üzerinde downstream etkilerini birincil fare orta beyin kültürleri kullanarak ölçmek için bir protokol sokuldu. Bu model, orta beyin nöronlarında anormal Ca2+ aktivitesi ile ilgili patofizyolojik değişiklikleri incelemek ve anti-apoptotik özellikler için yeni terapötikleri taramak için kullanılabilir.
Özet
Parkinson hastalığı (PH) dopaminerjik dejenerasyonu neden yıkıcı bir nörodejeneratif hastalıktır (DA) nöronlar. Glutamat reseptörlerinin anormal aktivasyonuna bağlı aşırı Ca2+ akını DA eksitotoksisite ile sonuçlanır ve DA nöron kaybı için önemli bir mekanizma olarak tanımlanmışlardır. Bu çalışmada, ED14 fare embriyolarının fare ventral mesensefalonundan (VM) orta beyin nöronlarını izole ediyoruz, ayrıştırıyoruz ve kültürümüz var. Daha sonra bir adeno-ilişkili virüs ile uzun vadeli birincil fare orta beyin kültürleri enfekte (AAV) genetik olarak kodlanmış kalsiyum göstergesi ifade, GCaMP6f insan nöron özgü sinapsin organizatörü kontrolü altında, hSyn. Canlı konfokal görüntüleme kullanarak, kültürlü fare orta beyin nöronların AAV-hSyn-GCaMP6f tarafından saptanır spontan Ca2+ akıları gösterdiğini gösteriyoruz. Orta beyin kültürleri glutamat Banyo uygulaması nöronlar içinde hücre içi Ca2 + anormal yükselmelere neden olur ve bu DA nöronlarda kaspas-3 aktivasyonu eşlik eder, immünboyama ile gösterildiği gibi. Primer fare DA nöronlarında glutamat aracılı apoptozu belirleme teknikleri, DA nöron sağlığını koruyan ilaçların yüksek içerikli taraması için önemli uygulamalara sahiptir.
Giriş
Parkinson Hastalığı (PH) bilinen bir tedavisi ile, dünya çapında ikinci en yaygın nörodejeneratif bozukluktur. Tahminler, PD yaygınlığının artmaya devam edeceğini ve sadece AMERIKA BirleşikDevletleri'nde2030 yılına kadar 1 milyon tanıyı aşacağını göstermektedir 1. Ph ile mücadele için şu anda mevcut birkaç etkili tedaviler ile, daha etkili tedaviler geliştirmek için acil bir ihtiyaç vardır. PH orta beyin dopamin hızlı ve ilerleyici kaybı ile karakterizedir (DA) nöronlar2. PH'de nörodejenerasyonun altında yatan mekanizmalar tam olarak anlaşılamamıştır. Kanıtlar oksidatif stres ve mitokondriyal disfonksiyon, vb apoptotic sinyal basamaklar ve nihai hücre ölümü başlatılmasına katkıda gibi birden fazla mekanizma, olası bir yakınsama göstermektedir3.
Böyle bir yakınsak mekanizma, glutamat aracılı eksitotoksisite pd4dahil olmak üzere birden fazla nörodejeneratif hastalıklar, karıştığı olmuştur. Glutamat aracılı eksitotoksisite hücre içi Ca2 + konsantrasyonu ve apoptoz nihai inisiyasyon aşırı bir artış yoluyla NMDA reseptörlerinin uyarılması yoluyla esas olarak çalışmak için düşünülse de, Ca2 +-geçirgen AMPA reseptörleri de eksitotoksik yanıt karıştığı olmuştur5,6,7. Bu nedenle, bir PD modeli içinde glutamat aracılı apoptosis AMPA reseptörlerinin katkısını belirlemek için ilgi çekicidir. Bu NBQX kullanılarak elde edilebilir, Bir AMPA ve kainate bloker, hangi mikromolar konsantrasyonlarda AMPAreseptörleriiçin seçici 8 . Glutamat aracılı eksitotoksisite ve apoptotik sinyal basamakları hücre ölümünün derecesini ölçmek için ideal bir aşağı akım hedef ve terapötik müdahale için potansiyel bir hedeftir. Bu nedenle, kalsiyum aktivitesi nin glutamat aracılı modülasyonunun değerlendirilmesi için yüksek içerikli bir yöntem geliştirmek ve primer ventral mesensefalik (VM) nöronlarda ilişkili downstream sinyalizasyonu nöronal sağlığı koruma yetenekleri ne kadar yeni tedavi yöntemlerinin taranması açısından değerli olacaktır.
Burada, fizyolojik ve moleküler düzeyde ölçülebilen glutamat uygulamasına yanıt olarak fare VM primer nöronların Ca2+ aktivitesini ölçmek için insan sinapsin (hSyn) promotörü ile AAV2/5 kullanarak genetik olarak kodlanmış kalsiyum indikatörü (GECI), GCaMP6f'ı ifade ettiğimiz bir protokol geliştirdik. Bu yüksek içerikli tarama, VM nöronların sağlığını korumak için Ca2+ aktivitesini modüle eden ilaç veya tedavileri keşfetmek için uyarlanabilir. Bu birincil kültür modelinin, VM nöronların sağlığını koruma ve PH'nin ilerlemesini azaltma yeteneklerine dayalı yeni PD müdahaleleri için etkili bir yol olduğunu öneriyoruz.
Protokol
Hayvan deneklerinin kullanımına ilişkin tüm prosedürler Texas A&M Üniversitesi Kurumsal Hayvan Bakımth ve Kullanım Komitesi tarafından onaylanmıştır (25 Kasım 2019; AUP# 2019-0346).
NOT: Hücre kültürü çözeltilerinin hazırlanması biyolojik bir güvenlik kabininde steril prosedür kullanılarak yapılmalı ve kontaminasyonu önlemek için 0,2 μm'de filtrelenmelidir.
1. Çözüm ve kültür ortamının hazırlanması
- 20 μL 1 mg/mL laminin stoğunu 2 mL steril distile H2O. Diseksiyon gününde hazırlayarak laminin kaplama çözeltisini hazırlayın.
- 1x Hank'in Dengeli Tuz Çözeltisi'nin (HBSS) 45 mL'sine 5 mL ES ekleyerek %10 at (at) serum (ES) durdurma çözeltisi hazırlayın. 0,2 μm filtre sistemi veya şırınga filtre ucu kullanılarak steril filtre. 4 °C'de saklayın.
- 1x fosfat tamponlu saline (PBS) 2 g BSA tozu ekleyerek ve 45 mL'lik son bir hacim getirerek %4 büyükbaş serum albumin (BSA) stok çözeltisini hazırlayın. 0,2 μm filtre sistemi veya şırınga filtre ucu kullanılarak steril filtre. 4 °C'de saklayın.
- Papaini 1x HBSS'de 3 mg/mL'ye seyrelterek papain stok çözeltisini hazırlayın. 0,2 μm filtre sistemi veya şırınga filtre ucu kullanılarak steril filtre. -20 °C'de saklayın.
- Steril H2O'ya 20 mg DNase tozu ekleyerek ve 20 mL'lik son bir hacme getirerek deoksiribonükleaz (DNase) çözeltisini hazırlayın. 0,2 μm filtre sistemi veya şırınga filtre ucu kullanılarak steril filtre. -20 °C'de saklayın.
- Steril distile H2O'ya 352 mg askorbik asit ekleyerek ve 20 mL'lik son bir hacme getirerek askorbik asit çözeltisini hazırlayın. Gerekirse eritmek için 37 °C banyoda ısı. 0,2 μm filtre sistemi veya şırınga filtre ucu kullanılarak steril filtre. -20 °C'de saklayın.
- 50 mL Nörobazal ortama aşağıdakileri ekleyerek Hücre Kültürü Ortamını hazırlayın: 500 μL Glutamax (100x), 500 μL at serumu, 1 mL B-27, 100 0L askorbik asit, 500 μL penisilin-streptomisin, 50 μL kanamisin ve 50 μL ampicisilin. 0,2 μm filtre sistemi kullanılarak steril filtre. 4 °C'de saklayın.
- %10 çözüm yapmak için 9 mL 1x PBS içine 1 mL Triton X-100 ekleyerek %0,01 Triton X-100 Çözümü hazırlayın. Triton X-100 viskoz olduğu için, pipet yavaş yavaş ucu tamamen doldurmak için izin verir. Gerekirse eritmek için 37 °C banyoda ısı. 4 °C'de saklayın.
- %10 Triton X-100 stoğunu %0,01'e seyreltmek için 3 seri 1:10 seyreltme gerçekleştirin. %1 çözelti yapmak için %1'lik 1x PBS'nin 9 mL içine %10'luk stok seyreltin. %0,1 çözelti yapmak için 9 mL 1x PBS içine %1 mL çözeltiyi seyreltin. % 0.01 çözelti yapmak için 1x PBS 9 mL içine% 0.1 çözelti 1 mL seyreltmek.
- %10 çözüm için 9 mL 1x PBS'ye 1 mL NGS ekleyerek %10 ve %1 normal keçi serumu (NGS) çözeltisini hazırlayın. %1 çözüm yapmak için 9,9 mL 1x PBS'ye 100 μL NGS ekleyin.
- Steril distile H2O'ya 735 mg L(+)-Glutamik asit ekleyerek glutamat stok çözeltisini (100 mM) hazırlayın ve 50 mL'lik son bir hacme getirin. Bu konsantrasyonda çözünürlük bir sorun olacaktır. 1 M hidroklorik asit küçük hacimler (100 μL) ekleyerek çözünürlüğü artırmak için yeterlidir.
- Steril distile H2O'ya 50 mg NBQX ekleyerek NBQX stok çözeltisini (10 mM) hazırlayın ve 13 mL'lik son bir hacme getirin.
2. Kültür yemekleri ve kapak kapaklarının hazırlanması (Diseksiyondan bir gün önce yapılır)
NOT: Üç kaplama aracı, poli-L-lizin, poli-L-ornitin ve laminin birleştirilmesinin ideal hücre yapışması ve canlılığını sağladığını bulduk.
- Biyolojik bir güvenlik dolabına 10 35 mm Petri kabı yerleştirin. Her tabağa iki dairesel 12 mm kapak yerleştirin ve 10 dk için %70 EtOH ile doldurun. EtOH tamamen buharlaşmasını sağlayan, her çanak kalan EtOH aspire etmek için bir vakum hattı kullanın.
- Pipet ~90-100 μL %0.1 poli-L-lizin çözeltisi her coverslip üzerine, tüm coverslip poli-L-lizin çözeltisi ile kaplı olduğundan emin olun. Bulaşıkları kapaklarla kapatın ve 37 °C'lik bir kuluçka makinesine 1 saat süreyle yerleştirin.
- Her coverslip'ten kalan poli-L-lizin çözeltisine aspirat ve steril H2O ile durulayın.
- %0,1 poli-L-ornitin çözeltisi ile 2,2 – 2,3 adımlarını tekrarlayın.
- Yine, %0,01 laminin çözeltisi ile 2,2 – 2,3 adımlarını tekrarlayın. Bir gün hücre kaplaması için hazır olana kadar %37 °C/5% CO2 kuluçka makinesine yerleştirin.
3. Fare embriyonik diseksiyonları
NOT: Biz kültür başına 4 ila 6 zamanlı hamile fareler kullanın. Diseksiyon sürecinin büyük bir kısmı biyolojik bir güvenlik kabininin dışında gerçekleşirken steril prosedürün sürdürülmesi hala önemlidir. Diseksiyonu mikroskobun yakınındaki yüzeylerde ve cerrahi aletlerde %70 EtOH bolca kullanımı idealdir. Kontaminasyonu daha fazla önlemek için diseksiyon sırasında bir maske takılabilir. Ayrıca, kültür ortamında 4 ayrı antibiyotik kullanıyoruz, bu nedenle kontaminasyon olasılığı düşük. Ancak, antibiyotik kullanımı sorunlu ise, Bu diseksiyon kurulum steril bir başlık içinde taşınmış olabilir. Hücre canlılığını korumak için tüm diseksiyon solüsyonları 4 °C'de önceden soğutulmalı ve diseksiyonlar mümkün olan en kısa sürede tamamlanmalıdır. Buz üzerinde diseksiyonları yapmayız. Fare embriyonik orta beyin nöronların diseksiyon yöntemi daha önce açıklananyöntemler9,,10aynıdır.
- Emici pedli bir diseksiyon mikroskobunun yanındaki bankta bir yer hazırlayın ve %70 EtOH ile serbestçe püskürtün.
- Sprey iki 100 x 15 mm cam Petri kapları ve bir 50 x 10 mm cam Petri çanak% 70 EtOH ile ve EtOH buharlaşmasını sağlar. Buharlaştıktan sonra, her 100 x 15 mm Petri kabına 50 mL steril 1x HBSS yerleştirin.
- Sterilize etmek için en az 10 dakika boyunca %70 EtOH'da cerrahi makas, forseps ve mikrotome bıçağı batırın. Kurutmak için emici ped üzerine aletleri yerleştirin.
- CO2 kullanarak servikal dislokasyon, embriyonik gün 2-3 aylık zamanlanmış gebelik fareler ötanazi 14.
- Sprey ötanazi farelerin karın% 70 EtOH ile. Forceps kullanarak alt karın kapmak ve cerrahi makas kullanarak karın boşluğu açın. Forceps karın tutan yakın kesme başlayın, karın duvarı geri katlanabilir ve rahim açıkça görülebilir kadar her iki tarafta lateral kesikler yapma.
- Cerrahi makas kullanarak, rahim boynuzu her iki ucunu kesti. Sonra 1x HBSS ile Petri kabına rahim ve yer çıkarın.
- Düz uçlu forceps kullanarak dikkatle rahim embriyoları kaldırın. Bu süreç boyunca embriyoları HBSS'de bırakın. Ya forceps veya mikrotome bıçak kullanarak, hızlı bir şekilde boyun yakın keserek embriyoların kafasını kesmek. Mümkün olduğunca seviye bir kesim yapma.
- Bir diseksiyon mikroskobu altında, kuru bir 50 mm Petri kabına bir embriyo kafası hareket ettirin ve ventral tarafında yerleştirin. Göz/prout'a yakın bir yere yerleştirerek ve delerek başı forceps ile stabilize edin. Forceps mezensefalon nüfuz önlemek için ~ 45 ° aşağı doğru açılı olmalıdır.
- Diğer taraftan forseps kullanarak, dikkatle mezensefalon belirgin sırt hemen önce deri ve kafatası yarı saydam tabakası kaldırın. Orta hatta yakın başlayın ve mezensefalon tamamen maruz kalana kadar caudally deri ve kafatası kaldırın.
- Korteks ve mezensefalon ve beyincik yakın diğer arasında bir ucu ile maruz mezensefalon dik forceps tutun. Tüm orta beyni çıkarmak için forcepleri bastırın ve sıkıştırın. Orta beyin segmenti yaklaşık 0,5 mm kalınlığında olmalıdır. Orta beyin segmentini taze 1x HBSS ile dolu ikinci Petri kabına yerleştirin. Her embriyo için bu işlemi tekrarlayın.
- Diseksiyonu mikroskobu kullanarak, ventral tarafı yukarı bakacak şekilde beyin segmentini konumlandırın. Menenjler hala bağlıise, forseps ile kapma ve yukarı ve uzak beyin segmentinden kaldırarak dikkatlice kaldırın.
- Beyin segmentinde 4 görünür quadrant olmalıdır. İki küçük çeyreğin iki büyük çeyreğinden daha üstün konumlandırılmış olacak şekilde segment yerleştirin. Superior iki (küçük) çeyreği alt iki (büyük) kadrandan ayıran belirgin bir sırt vardır.
- Forceps çimdik kullanarak ve alt quadrants üstün quadrants ayırmak ve sonra üstün quadrants atın. Kalan inferior quadrants yanal dorsal tarafında aşırı doku olacak, Bu doku kalan ventral doku daha az opak bakacağız. Daha az yoğun sırt dokusu çıkarın ve atın. Kalan segment hem Substantia nigra pars compacta (SNc) ve ventral tegmental alan (VTA) içermelidir.
- Forceps kullanarak 4 küçük parçalar halinde kalan ventral doku segmenti kesilmiş ve 1mL geniş delikli pipet kullanarak 1x HBSS ile 15 mL konik tüp bu segmentleri transfer. Prosedür boyunca buz üzerinde beyin segmentleri ile konik tüp tutun.
- Kalan tüm beyin segmentleri için bu işlemi tekrarlayın.
4. Hücrelerin dissosiyası
- Hücrelerin enzimatik sindirimi
- HBSS'yi orta beyin segmentleri içeren 15 mL konik tüpten dikkatlice aspire edin ve segmentleri tüpün alt kısmında bırakarak.
- Tüpe ~800 μL papain çözeltisi ekleyin ve 7 dakika boyunca 37 °C'lik bir kuluçka makinesine yerleştirin. Tüpü hareket ettirerek hücreleri yeniden askıya alın ve 37 °C'lik kuvözyerine 7 dakika daha yerleştirin.
- Geniş delikli 1 mL pipet ucu ile sadece orta beyin parçalarını 1 mL dNase aliquot içine kaldırın. Segmentlerin aliquot'un dibine veya yaklaşık 1 dakika pozlamaya ulaşmasına izin verin.
- Geniş delikli 1 mL pipet ucu ile sadece orta beyin parçalarını 2 mL stop çözeltisi içeren 15 mL konik bir tüpe çıkarın. Segmentlerin tüpün altına yerleşmesine izin verin ve durulayın durdurma çözeltisi ile dolu ek bir konik tüpte tekrarlayın.
- Hücre süspansiyonunun mekanik triturasyonu
- İkinci stop çözeltisinde, geniş delikli 1 mL pipet ucu kullanılarak, büyük doku segmentleri görünmeyene kadar hücreleri 10 kez yukarı ve aşağı inceletin. Bu minimal hücre lisis için tritürasyon üzerinde önlemek için önemlidir.
- Yavaş pipet 300 μL 4% BSA çözeltisi beyin segmentleri içeren 15 mL konik tüp altına. Süspansiyon tabakasını korumak için pipet ucunu dikkatlice çıkarın. Santrifüj 0.4 x g 3 dk. Daha sonra 400 μL hücre kültürü ortamında süpernatant ve resuspend hücreleri dikkatlice aspire edin.
5. Hücreleri kaplamak
NOT: Deneyime dayanarak, embriyo başına yaklaşık 100.000 canlı hücre toplanır. 2-3 aylık zamanlanmış hamile fareler genellikle 8-10 embriyo çöp boyutları var; bu nedenle, zamanlanmış gebe fare başına hücrelerin toplam verimi için kaba bir tahmin yaklaşık 1 milyon hücredir.
- Bir hemositometre preform kullanarak bir hücre sayısı ve daha sonra hücre kültürü ortamı kullanarak 2.000 hücre / μL süspansiyon seyreltmek. Karıştırmak için kısaca triturate.
- 2. adımdan laminin solüsyonu olan kapakları çıkarın ve kalan laminin çözeltisini vakum kullanarak kaplamalı kapaklardan aspire edin. Kapakkapaklarının tamamen kurumasını önlemek için hızlı bir şekilde plakalayın. Pipet 100°L (2,0 x 105 hücre/coverslip) her bir kapak kayması üzerine ve Petri kaplarını 1 saat boyunca 37 °C'lik bir kuluçka makinesine yerleştirin.
- Her çanağa 3 mL hücre kültürü ortamını dikkatlice ekleyin ve 37 °C'lik kuluçka makinesine geri yerleştirin. Preform yarım orta değişiklikler 2 hafta boyunca haftada 2 kez.
6. Adeno-ilişkili viral (AAV) vektörleri ile 14 DIV hücre kültürünün enfeksiyonu
- Her yemek için 1 μL hSyn-GCaMP6f AAV (1,0 x 1013 titre) ile 1 mL serumsuz DMEM ortamı hazırlayın
- Her yemekten hücre kültürü ortamını aspire edin ve hSyn-GCaMP6f içeren 1 mL serumsuz DMEM ile değiştirin. Yemekleri 37 °C'lik kuluçka makinesine 1 saat süreyle yerleştirin.
- ATV içeren serum içermeyen ortamı aspire edin ve 3 mL hücre kültürü ortamı ile değiştirin. Yemekleri 37 °C'lik kuluçka makinesine geri yerleştirin. Biz AAV enfeksiyonu 5-7 gün GCaMP ifade ideal düzeyde sağlar bulduk. Viral enfeksiyon bu dönemde her 2-3 günde bir orta değiştirmeye devam edin.
7. Canlı konfokal Ca2+ görüntüleme 19-21 DIV arasında
NOT: 6.3. adımda da belirtildiği gibi viral enfeksiyonu takip eden 5-7 gün arasında görüntüleme yapılabilir. Bu, spontan Ca2+ aktivitesinin saptanmasına olanak sağlayan seviyelerde floroforun görünür bir şekilde ifade sini elde etmek için ideal bir penceredir.
- Kayıt arabelleklerinin hazırlanması
- 1 L HEPES kayıt arabelleği yapmak için, eklemek: 9.009 g NaCl, 0.3728 g KCl, 0.901 g D-glikoz, 2.381 g HEPES, 2 mL 1 M CaCl2 stok çözeltisi ve 500 μL 1 M MgCl2 stok çözeltisi 800 mL steril distile H2O. NaOH ile pH'ı 7,4'e getirin. 1 L'lik son bir sese getirin.
- 200 mL 200 mL 20μM glutamat kayıt tamponu yapmak için, seyreltik 40 μL 100 mM glutamat stok çözeltisi içine 200 mL HEPES kayıt tampon yukarıda açıklanan.
- 10 μM NBQX kayıt tamponunun 200 mL'sini yapmak için 200 mL 10 mM NBQX stok çözeltisini 200 mL HEPES kayıt tamponuna seyreltin.
- Konfokal görüntüleme
- Steril 35 mm Petri kabını 3 mL kayıt tamponuyla doldurun.
- 37 °C'lik kuvözden enfekte kültürleriçeren 35 mm'lik petri kabını çıkarın. İnce uçlu forceps kullanarak, dikkatle bir coverslip kenarına kapmak ve kayıt tampon dolu Petri kabına hızlı bir şekilde aktarın. Kalan kapak kaymasını orta kısımda 37 °C'lik kuluçka makinesine yerleştirin. Kayıt tamponu ile kabı konfokal mikroskoba taşıyın.
- Görüntüleme yazılımını başlatın. Bir sonraki adıma geçin ve baş harfe doğru ilerleyin.
- Peristaltik pompayı çalıştırın ve hattı kayıt tamponuna yerleştirin. Akış hızını 2 mL/dk olarak kalibre edin.
- 35 mm Petri kabından enfekte kapak fişini kayıt banyosuna aktarın.
- 10x su daldırma hedefi ve BF ışık kullanarak, odak düzlemi bulmak ve nöron hücre organlarının yüksek yoğunluklu bir bölge arayın. 40x su daldırma hedefine geçin ve BF ışığını kullanarak numuneyi yeniden odaklayın.
- FluoView içindeki "Boyalar listesi" penceresinde AlexaFluor 488'i seçin ve uygulayın.
- AAV ifadesi değişken olabilir; bu nedenle, floroforların aşırı maruz kalmasını ve fotobeyazlmasını önlemek için düşük HV ve lazer güç ayarları ile başlayın. AlexaFluor 488 kanalı için, yüksek gerilimi (HV) 500'e, kazancı 1x'e ve 0'a mahsup edin. 488 lazer hattı için% 5 güç ayarlayın. Z düzleminde görüntülenebilen etkin hacmi artırmak için iğne deliği boyutunu 300 μm'ye yükseltin. Emisyon sinyallerini alt doygunluk düzeylerine en iyi şekilde ayarlamak için "focus x2" tarama seçeneğini kullanın. Buradan, ayarlar her kanalın ideal görünürlüğü elde edilene kadar ayarlanabilir.
NOT: GCaMP ile Ca2+ akılarının tamamını doğru bir şekilde yakalamak için, dedektörü aşırı dozatmadan floresan yoğunluğunda artışa izin vermek için temel HV ve lazer güç ayarlarını ayarlayın. - Mikroskop ayarları optimize edildikten sonra, GCaMP6f floresansında spontan değişiklikler gösteren birden fazla hücreye sahip bir bölgeyi bulmak için sahneyi hareket ettirin ve görüntüleme için istenilen düzleme odaklanın.
- Görüntüleme çerçevesini 1 saniyenin altında bir kare aralığına ulaşabilecek bir boyuta çekmek için "Küçük rekt" aracını kullanın. Bu, görüntüleme aralığını saniyede 1 kare olarak ayarlamak için gereklidir.
- "Aralık" penceresini 1,0, "Num" penceresini 600 değerine ayarlayın.
NOT: İstenilen zaman noktasında (300 s) farklı kayıt tamponları sağlamak için, banyoya yeni bir çözüm sunmak için pompanın gecikme süresini kalibre etmek önemlidir. Bu çözelti perfüzyon hızına (2 mL/dk) ve çözelti pompalamak için kullanılan hattın uzunluğuna bağlı olacaktır. - Bir t-serisi filmi yakalamak için "Zaman" seçeneğini seçin ve ardından görüntülemeye başlamak için "XYt" tarama seçeneğini kullanın.
- Görüntüleme ilerleme çubuğunu izleyin ve hattı HEPES kayıt tamponundan uygun zaman noktasında20 μM glutamat kayıt tamponuna taşıyın (örneğin, pompanın gecikme süresi 60's'da çözüm sağlamak üzere kalibre edilmişse, 300 s'de glutamat sağlamak için hattı 240 karede glutamat arabellene doğru hareket ettirin).
- Görüntüleme tamamlandığında, Seri Bitti düğmesini seçin ve bitmiş t-serisi filmi kaydedin. Ek bir 5 dakika için 20 μM Glutamat perfuse devam, böylece kültürlü nöronlar toplam 10 dakika glutamata maruz kalmıştır. Görüntülenecek her kapak için bu işlemi tekrarlayın.
- 20 μM Glutamate ilave 5 dk maruz kaldıktan sonra, kapak kaymasını banyodan çıkarın ve görüntüleme günü tamamlanana kadar kayıt tamponu içeren 35mm Petri kabına geri yerleştirin. Bittiğinde, adım 8'e geçin.
- Ca2+ iz analizi
- ImageJ'de görüntü çözümlemesi gerçekleştirin. ImageJ için BIO-FORMATS eklentisini yükleyin, hangi izin verir. OIB resim dosyaları açılacak.
- ImageJ araç çubuğunda, Analiz Et | Ölçümleri ayarlayınve Ortalama gri değeri (MGV) için kutuyu seçin.
- ImageJ'de, bir t-serisi filmi hyperstack olarak açın.
- Film için kaydırıcıyı sürükleyin ve glutamata yanıt veren tüm nöronları görselleştirmek için çerçeveyi maksimal glutamat yanıtı ile tanımlayın. Tüm görünür nöron hücre vücutlarını izlemek için çokgen aracını kullanın, "ROI yöneticisi" listesine roi'lerini ekleyerek.
- İzleme ve roi ekleme tamamlandığında, YG Yöneticisi penceresindeki tüm ROI'ları seçin ve daha fazla seçenek listesinde Çoklu ölçü seçimini kullanın. Bu verileri bir elektronik tabloya kopyalayıp yapıştırın. Tüm filmlerin analiz edilmesi için bu işlemi tamamlayın.
- Her Yatırım Getirisi için, her bir çerçevedeki ham MGV verilerini δf/f0 değerlerine dönüştürün denklemi: ΔF/F0 = [F(t) – F0] / F0. Herhangi bir çerçevenin F(t) = MGV ve ~100 karelerin ortalama taban çizgisi MGV'sinin bulunduğu yerde Ca2+ akıları yoktur.
- OriginPro 2020 gibi istatistiksel bir yazılım kullanılarak, dönüştürülmüş ΔF/F0 izleri çizgi grafiklere dönüştürülebilir. "Peak analyzer" işlevi glutamat yanıtının tepe genliğini ölçmek için (veya farklı bir yazılım kullanıyorsa benzer bir işlev) kullanılabilir, glutamata yanıt vermek için gecikme ve eğrinin altındaki alan.
8. Kültürlerin İmmünostaining
NOT: Formalin fiksasyonundan sonra, kapaklar 4 °C'de 1x PBS'de saklanabilir ve immünboyama için işleme hazır olunabilir. Primer ve sekonder antikor inkübasyonu seri bir şekilde yapıldı, anti-Caspase-3 primer antikor ve tamamlayıcı sekonder antikor anti-TH primer antikor ve tamamlayıcı sekonder antikor ile birlikte inkübasyondan önce gelen ler gibi.
- Glutamat maruziyetinden hemen sonra, coverslip'i 35 mm Petri kabına geri yerleştirin, kayıt tamponunu aspire edin ve %10 formalin 3 mL ekleyin. Oda sıcaklığında 40 dakika (RT) oturalım.
- 1x PBS ile yemeği 3 kez durulayın.
- PBS aspire ve permeabilize hücreleri 1 mL 0.01% Triton X-100 PBS için 2 dakika.
- 1x PBS ile yemeği 3 kez durulayın.
- PBS'de %10 NGS'nin 1 mL'sinde PBS ve blok hücrelerini 40 dakika aspire edin.
- 1x PBS ile yemeği 3 kez durulayın.
- PBS'de %1 NGS'nin 1 mL'sine 1 μL tavşan anti-Caspase-3 primer antikor ekleyin (1:1000 seyreltme). Çanak tan PBS aspire ve birincil antikor çözeltisi ile değiştirin. Rt'de 1,5 saat çalkalayıcı ve kuluçka ya tıkıştın.
- 1x PBS ile yemeği 3 kez durulayın.
- 1 μL keçi anti-tavşan AlexaFluor 488 ikincil antikor pbs (1:1000 seyreltme) % 1 NGS 1 mL ekleyin. Çanaktan PBS aspire edin ve ikincil antikor solüsyonu ile değiştirin. Bir shaker üzerine yerleştirin ve RT 1 saat için kuluçka.
- 1x PBS ile yemeği 3 kez durulayın.
- Tekrar adımlar 8.7 - 8.10, ama tavuk anti-TH birincil antikor kullanarak (1:1000) adım 8.7 ve keçi anti-tavuk AlexaFluor 594 ikincil antikor (1:1000) adım 8.9.
- Son PBS durulamadan sonra, 30 μL'lik montaj ortamını mikroskop slaytına yerleştirin. Forceps kullanarak 35 mm Petri çanak bir coverslip kapmak ve montaj orta içine aşağı bakan hücreleri ile coverslip yerleştirin. Doğru yerleştirilirse her iki kapak kapağı da tek bir mikroskop slaytına sığar. Kuru, karanlık bir alana yerleştirin ve montaj ortamının bir gecede kurumasını bekleyin.
9. İmmünosif kültürlerin konfokal görüntülemesi
- Konfokal görüntüleme
- Görüntüleme yazılımını başlatın. Örneği mikroskop aşamasına yerleştirin.
- Mikroskop parçaları ile, tritc filtre ile 20x büyütme hedefi ve epifloresan ışık kullanarak, örnek odaklanmak ve bir TH + hücre gövdesi için arama.
- Bir TH+ hücre gövdesini bir kez bularak, görüş alanına ortalayın ve ardından 60x büyütme hedefine geçin.
- "Boya listesi" penceresinde AlexaFluor 488 ve AlexaFluor 594 boyalarını seçin.
- Canlı görüntülemede olduğu gibi, fotobeyaztlamayı önlemek için düşük HV, kazanç, ofset ve lazer güç ayarlarıyla başlayın. Her kanalın floresan yoğunluğunu değerlendirmek ve buna göre ayarlamak için "focus x2" tarama seçeneğini kullanın. Bu görüntüler daha sonra floresan yoğunluğu için ölçüleceği için görüntüleme ayarlarını tüm görüş alanlarında tutarlı tutmak gerekir. Bu nedenle, örnekler arasında floresan yoğunluğu aralığı hakkında bir fikir elde etmek için her durumun birkaç örnek bakmak en iyisidir.
- İdeal görüntüleme ayarları belirlendikten sonra "focus x2" taraması seçeneğini seçin ve ilgi hücresini görüş alanının merkezine taşıyın. "Yakınlaştırma" kaydırıcısını kullanarak dijital yakınlaştırmayı 3 katartırın.
- Odak tonuzunu kullanarak, en parlak floresan ile odak düzlemini bulun ve tek bir düzlemxy görüntü yakalayın. Görüntüyü bitirmek için kaydedin.
- Başka bir TH+ hücresi aramak için 20x büyütme hedefine geri dön. İstenilen sayıda hücre her koşuldan örneklenene kadar bu işlemi tekrarlayın.
- Görüntü analizi
- ImageJ araç çubuğunda, Analiz Et | Ölçümleri ayarlayınve Alan, Tümleşik yoğunluk ve Ortalama gri değeri için kutuları seçin.
- Görüntüyü, ImageJ araç çubuğuna sürükleyip bırakarak veya dosya menüsünden görüntüyü seçerek her kanal ayrılmış bir hiperyığın olarak açın.
- Hücre gövdesi nin etrafına ROI çizmek için TH kanalını (594 nm) kullanın. ImageJ'deki çokgen izleme aracını kullanarak hücre gövdesinin dış kenarını yakından takip edin. Hücre zarı ile hücre çekirdeği arasındaki mesafenin en küçük olduğu yerde, sitosol dan çekirdeğin kenarına doğru düz bir çizgi izleyin ve sonra onu dışlamak için çekirdeğin anahatlarını yakından takip edin. Daha sonra dış zara kadar düz bir çizgi izleyin, mümkün olduğunca yakın olarak ilk satırı sınırlayan, ve YG tamamlanana kadar hücre gövdesinin anahat izlemeye devam.
- Klavye kısayolunu "T" veya araç çubuğu menü yolunu kullanarak Çözümle | Araçlar | YG Yöneticisi,YG yöneticisini açın ve listeye yeni çekilen Yatırım Getirisi'ni ekleyin.
- Caspase-3 kanalının penceresini (488 nm) seçin ve ardından "YG Yöneticisi" listesinde eklenen YG'yi seçin.
- YG Yöneticisi penceresinde Ölçüle düğmesini seçin. Sonuçlar penceresi daha önce ayarlanan ölçümlerle görünür. Bunları bir elektronik tabloya kopyalayın ve her hücre için bu işlemi yineleyin.
Sonuçlar
Hücrelerin ilk birliş sonra, 14 DIV de VM kültür yemekleri tedavi 1 μL AAV hSyn-GCaMP6f ve viral ifade 5 gün için izin. Görüntüleme gününde HEPES kayıt tamponu taze olarak hazırlandı. İki şart kullandık; bir koşulda 10 dakika boyunca 20 μM glutamat uygulanırken, diğer durumda 10 μM NBQX uygulaması5 dk 10 min co-uygulama dan önce 10 μM NBQX + 20 μM glutamat uygulandı. Her iki durumda da GCaMP6f floresansında, temsili izlerde gösterildiği gibi spontan Ca2+ akılarını gösteren heterojen ve spontan değişiklikler gözlendik (Şekil 1A,B, Ek Film 1-2). Uygulama 20 μM glutamat spontan aktif ve quiescent nöronlarda sağlam ve sürekli Ca2 + yanıt üretti(Şekil 1A, Ek Film 1). 10 μM NBQX uygulaması spontan aktiviteyi azalttı ve glutamat yanıtını kısmen engelledi (Şekil 1B, Ek Film 2). Glutamat uygulamasının her koşulda Ca2+ yanıtını uyardığı ölçüde eğrinin altındaki alan, tepe genliği ve yanıt gecikmesi kullanılarak ölçüldü. Eğri nin altındaki her iki alan ve pik genlik hem glutamat hem de NBQX + glutamat tedavi edilen durumlar için benzerdi (Şekil 1C),Yanıt gecikmesi Ise NBQX + glutamat durumunda(Şekil 2A,B). Ca2+ yanıtını glutamat tedavisine ölçmenin yanı sıra, glutamat aracılı apoptozun bir ölçüsü olarak bir anti-caspase-3 antikor ile numuneleri sabitledik ve boyadı. Koşullar arasında bir dizi kaspas-3 aktivasyonu gözlemledik(Şekil 3A,B). Caspase-3 aktivasyonu ölçüm alanı ve ortalama caspase-3 yoğunluğu ile ölçüldü. İşlenmemiş kontrol hücreleri ile karşılaştırıldığında, glutamat ve NBQX + glutamat koşulları altında kaspaz-3 aktivasyonu olan hücrelerin ortalama alan önemi ne doğru eğilimli(Şekil 3B). İşlenmemiş kontrollere göre glutamat ve NBQX + glutamat koşullarında ortalama kaspas-3 şiddeti anlamlı olarak yüksekti (Şekil 3B). Bu sonuçlar birlikte, eksitotoksik ajanlara Göre Ca2+ yanıtlarının ölçülebileceği ve aynı kültür kümesinde caspase-3 aktivasyonu gibi aşağı akım apoptotik olayların analizi ile takip edilebilen yüksek içerikli bir çerçeve göstermektedir.
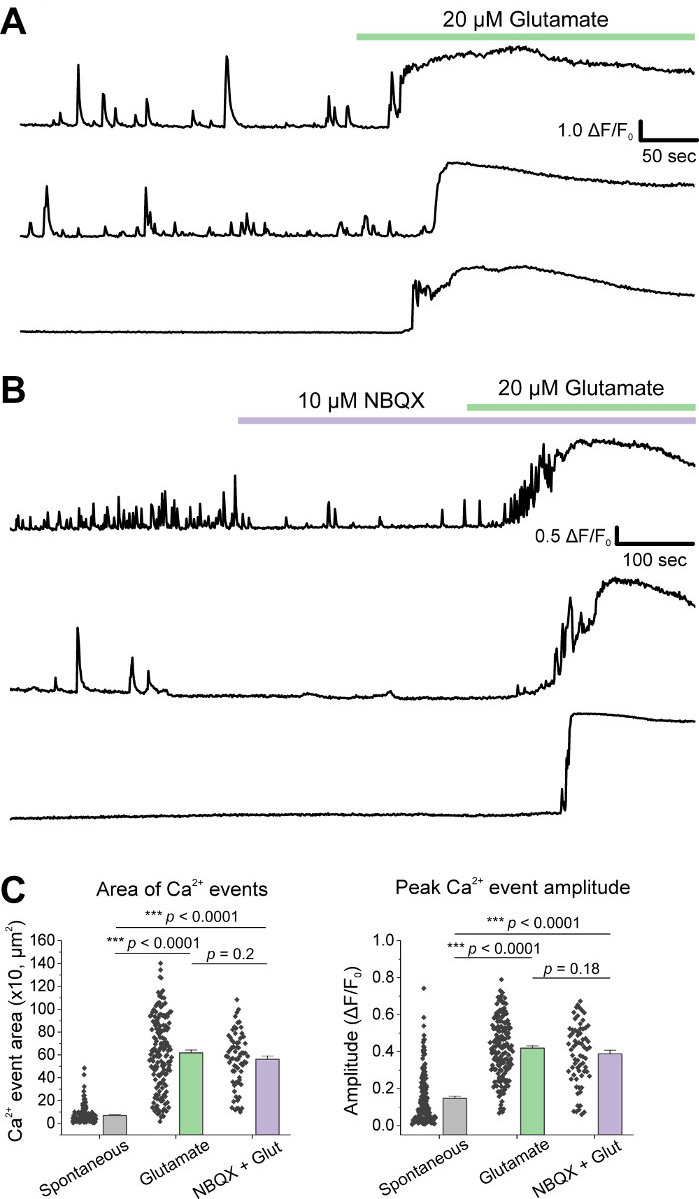
Şekil 1: Kültürlü ventral mesensefalik nöronlar spontan Ca2+ aktivitesini gösterir ler ve glutamat uygulaması ile sağlam bir şekilde uyarılırlar. (A) VM nöronlarında spontan Ca2+ aktivitesinin ve 20 μM Glutamat uygulamasına yanıtlarının temsilcisi izleri. (B) VM nöronlarında spontan Ca2+ aktivitesinin ve bunların 10 μM NBQX + 20 μM Glutamat uygulamasına yanıtının temsilcisi izleri. (C) Ca2+ izlerinin eğri ve tepe genliğini altındaki alanı gösteren nüfus verileri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
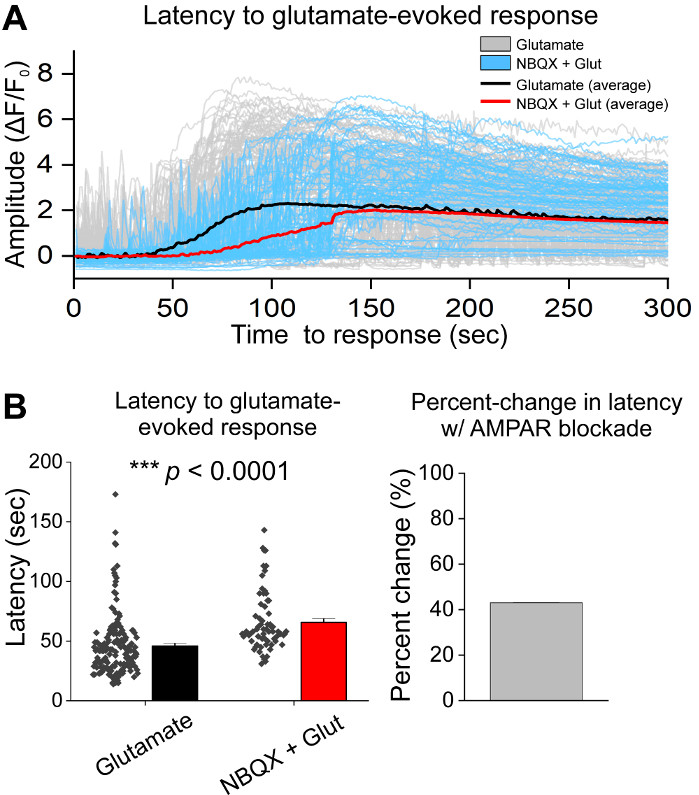
Şekil 2: NBQX ile AMPAR bloku kültürlü ventral mesensefalik nöronlarda glutamat uygulamasına yanıtı geciktirir. (A) Temsilci Ca2+ glutamat (gri) ve NBQX + glutamat (mavi) uyarılmış yanıtlar izleri. Ortalama Ca2+ glutamat (siyah) ve NBQX + glutamat (kırmızı) izleri overlaid gösterilir. (B) Glutamat ve NBQX + glutamat için yanıt gecikmesi gösteren nüfus verileri uyarılmış yanıtları. Sağ panelde glutamat ve NBQX + glutamat koşulları arasındaki yüzde değişim görüntülenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
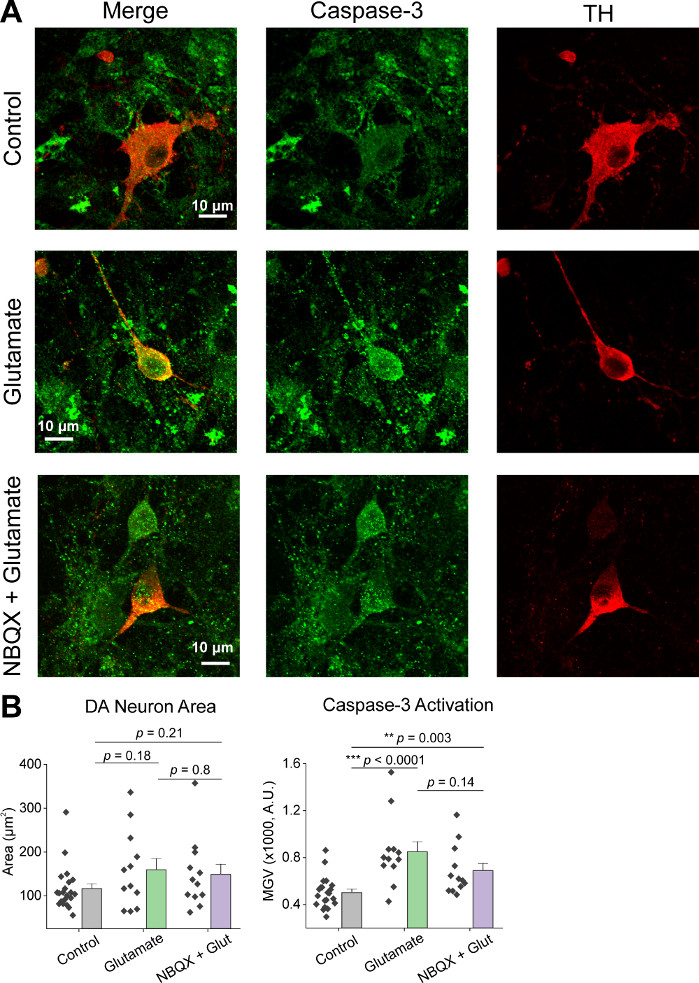
Şekil 3: Glutamat uygulaması tirozin hidroksilaz (TH) pozitif ventral mesensefalik nöronlarda caspase-3 ekspresyonunu arttırır. (A) VM kültürlerinin temsili konfokal görüntüleri kaspaz-3 (yeşil) ve TH (kırmızı), ölçek çubuğu = 10 μm. (B) Da nöron alanını gösteren nüfus verileri ve her durumda kaspaz-3 ifadesinin ortalama gri değeri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Film 1: Spontan Ca2+ aktivitesi ve glutamat uygulamasına yanıt.
HEPES kayıt tamponu (0-300 s) varlığında spontan Ca2+ akıları ve ardından 20 μM glutamat (301-600 s) uygulaması. Ölçek çubuğu = 50 μm. Bu videoyu indirmek için lütfen buraya tıklayınız.
Ek Film 2: Spontan Ca2+ aktivitesi ve NBQX + glutamat uygulamasına yanıt.
HEPES kayıt tamponu (0-300 s) varlığında spontan Ca2+ akıları ve ardından 10 μM NBQX (301-600 s) ve 10 μM NBQX + 20 μM glutamat (601-900 s) uygulama. Ölçek çubuğu = 50 μm. Bu videoyu indirmek için lütfen buraya tıklayınız.
Tartışmalar
Biz nöronlarda glutamat aracılı apoptoz un yüksek içerikli analizi için uzun vadeli primer ventral mesensefalik (VM) hücre kültür sistemi açıklar. Çalışmalar PD modelleri bağlamında eksitotoksik mekanizmaları açıklamak için birincil orta beyin dopaminerjik kültürler istihdam var11,12. Bu çalışmada, Ca2+ aktivitesini ölçmek ve bu aktiviteyi apoptotik sinyal basamaklarının başlatılması gibi aşağı moleküler değişikliklerle ilişkilendirmek için Genetik Olarak Kodlanmış Kalsiyum Göstergeleri (GECIs) kullanarak kombinatoryal bir yaklaşım kullanıyoruz4. Yöntemin diğer benzer hücre kültür sistemlerine birden çok avantajı vardır. Parkinson hastalığı bağlamında eksitotoksisiteye özel bir ilgi miz olduğu için primer VM hücre kültürlerini kullanmak idealdir. Gridded coverslips veya th immünboyama ile birlikte motorlu XY mikroskop aşaması gibi farklı alan tehcir teknikleri kullanarak, doğrudan ventral orta beyin nöronlarda glutamat aracılı apoptoz hücre tipi özel etkileri inceleyebilirsiniz. Ayrıca, 3 haftalık hücre kültürü modeli nöronların tam geliştirmek için izin verir, olgun moleküler profil, yetişkin DA nöronlar yansıtan9. Önceki yöntemler ağırlıklı olarak glutamat aracılı eksitotoksisite13,,14aşağıdaki moleküler değişiklikler üzerinde duruldu. Model tanımlanan hücre tiplerinde downstream moleküler olaylar ile nöronal fizyolojisi akut değişiklikler ilişkilendirmek için yeteneği benzersizdir. Birincil kültür modelinin bir sınırlama diseksiyon tekniği tüm ventral orta beyin yakalar olduğunu, DA ve GABAerjik nöronlar yanı sıra SNc ve VTA gelen nöronlar da dahil olmak üzere. Kanıtlar şimdi SNc DA nöronlar komşu VTA DA nöronlar ile karşılaştırıldığında kalsiyum ve nihai hücre ölümüne seçici güvenlik açığı olduğunu göstermektedir15. Ne yazık ki, embriyonik kültürlerde VTA nöronlar SNc ayırt embriyonik beyinde bu yapıları tanımlamak için birkaç anatomik işaretleri ile zor kanıtlamıştır.
Birincil kültür tekniğinin heterojen spontan Ca2+ aktivitesinin sayısallaştırılmasına olanak sağladığını göstermişiz (Şekil 1). Bu nedenle, bu tonik aktif hücreleri incelemek için ideal bir hücre kültürü sistemi modeli, orta beyin pacemaking dopaminerjik nöronlar gibi, neokortikal nöronlar, ve suprachiasmatic çekirdek GABAerjik nöronlar (SCN)16,17. Çoğu uygulamada, Ca2+ görüntüleme elektrofizyoloji ile aynı zamansal çözünürlüğe ulaşmaz. Bu nedenle, tek bir Ca2 + olay nöronal eylem potansiyelleri bir patlama benzer olması muhtemeldir. Bu, Ca2+ görüntülemenin hız yapma hücrelerinde anormal patlama aktivitesinin nispeten doğru ölçütlerine izin verdiği ve bu nedenle Ca2+aracılıeksitotoksik hücre ölümünün yüksek içerikli ekranı için uygun olduğu şeklinde yorumlanabilir.
Spontan Ca2+ etkinliğini elde etmek ve sürdürmek için protokoldeki iki önemli noktayı ele almak önemlidir. Birincisi, diseksiyondan sonra hücrelerin kaplama yoğunluğudur. Primer VM nöronlar için, önceki çalışmalarda yaklaşık 100.000 hücre/ cm29,,10kullandık. Protokolü 200.000 hücre/cm2yoğunluklu bir yoğunluk tabakasına uyarladık, bu da heterojen bir spontan aktivite aralığı oluşturur ve her kapak kaymasında bulunan dopaminerjik VM nöronların sayısını artırır. Farklı pacemaking nöronlar farklı ateşleme özellikleri olduğundan16, kaplama yoğunluğu çalışılan hücre tipine özelleştirilmiş ve spontan aktivite ideal düzeyde elde etmek için optimize edilmesi gerekir. İkinci atv viral enfeksiyon aşağıdaki kuluçka süresi. Kaplama yoğunluğu gibi, bu araştırma sorusu ve kullanılan AAV türü belirli bağlamına bağlı olacaktır. Burada kullanılan özel AAV için, viral enfeksiyon sonrası 5 günlük kuluçka, Ca2+ aktivitesini kaydetmek için GCaMP floresansında dinamik değişikliklere olanak tanıyan istenilen protein ekspresyonu seviyelerini elde etmek için idealdir. Birçok faktör ne kadar hızlı ve verimli bir AAV kargo ifade edeceğini belirlemek, çok bu yöntemin kapsamı dışında, ama kısaca, bu organizatör aktivitesi ve kargo proteinolgunve kıvrımlar oranı dikkate almak önemlidir.
Yöntemin bir diğer avantajı da formatta, ifade vektörlerinde, görüntüleme ekipmanlarının kullanımına ve ele alınabilecek bilimsel soruların çeşitliliğine önemli ölçüde esneklik sağlamasıdır. Buna ek olarak, yöntem PH glutamat aracılı eksitotoksisite çevreleyen özel soruların geniş bir yelpazede içine soruşturma sağlar, ve sinir sistemi disfonksiyon diğer modeller. Örneğin, glutamat aracılı eksitotoksisite birden fazla reseptör ve sinyal basamaklariçerir 5. Yöntemi kullanarak ve ŞEKIL 1'dekiNBQX AMPAR blokeri ile gösterildiği gibi, eksitotoksik glutamat yanıtının spesifik bileşenlerini fizyolojik ve moleküler düzeyde incelemek mümkündür. İkinci haberci sistemlerinin inhibitörlerini kullanan benzer bir yaklaşım, eksitotoksisiteye olan katkılarını belirlemek için kullanılabilir. Ayrıca, burada kullanılan AAVs hücre özel organizatörleri veya nörotransmitter salınımı gibi diğer parametreleri ölçmek için kullanılabilecek AAV ifade optogenetik sensörler ile GECIs ifade adapte edilebilir.
Birincil embriyonik diseksiyonlar ve konfokal görüntüleme dışında, protokolün büyük bir kısmı özel eğitim gerektirmeyen temel laboratuvar becerilerini kullanır. Bu nedenle, modeliçin sınırlamalar embriyonik diseksiyon tekniğinin zorluk içerir, hücrelerin olgunluğa ulaşmak için kültürlü zaman uzunluğu, ve bir konfokal mikroskop erişim, ya da benzer görüntüleme cihazları. Yöntemin birçok faydası ve esnekliği bu sınırlamalara ağır basar, bu da sinir sistemi bozukluklarında glutamat aracılı eksitotoksisite rolünü incelemek için ideal bir modeldir. Son olarak, Bu model anti-apoptotik etkileri ve DA nöron sağlığını korumak için yeteneklerini yeni bileşikler ekraniçin etkili bir araç olabilir.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Amerikan Parkinson Hastalığı Derneği (APDA) ve NIH R01NS115809-01 RS hibe tarafından desteklenir. Texas A&M Genomik Tıp Enstitüsü'ne (TIGM) birincil dopaminerjik kültürler oluşturmak için zamanlanmış hamile fareler sağladığı için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10% Formalin/PBS | VWR | 100496-506 | |
| 10X NA 0.3 water-immersion objective | Olympus | UMPLFLN10XW | |
| 12 mm circular cover glass No. 1 | Phenix Research Products | MS20-121 | |
| 20X NA 0.85 oil-immersion objective | Olympus | UPLSAPO20XO | |
| 35 mm uncoated plastic cell culture dishes | VWR | 25382-348 | |
| 40X NA 0.3 water-immersion objective | Olympus | LUMPLFLN40XW | |
| 60X NA 1.35 oil-immersion objective | Olympus | UPLSAPO60XO | |
| Ampicillin (sodium) | Gold Bio | A-301-25 | |
| B-27 supplement | ThermoFisher | 17504044 | 50x stock |
| Binolcular Microscope | Kent Scientific | KSCXTS-1121 | |
| Bovine serum albumin (BSA) | Sigma-Aldrich | A7030 | |
| Calcium Chloride (CaCl2), anhydrous | Sigma-Aldrich | 746495 | |
| Chicken polyclonal anti-Tyrosine Hydroxylase | Abcam | ab76442 | |
| Deoxyribonuclease I (DNase) | Sigma-Aldrich | DN25 | |
| D-glucose, andydrous | Sigma-Aldrich | RDD016 | |
| DMEM + GlutaMAX medium | ThermoFisher | 10569010 | 500 mL |
| Equine serum | ThermoFisher | 26050088 | heat-inactivated |
| Fiber Optic Illuminator, 100V | Kent Scientific | KSC5410 | |
| Filter System, PES 22UM 250ML | VWR | 28199-764 | |
| Fluoview 1000 confocal microscope | Olympus | ||
| Fluoview 1200 confocal microscope | Olympus | ||
| GlutaMAX supplement | ThermoFisher | 35050061 | |
| Goat polyclonal anti-chicken Alexa Fluor 594 | Abcam | ab150176 | |
| Goat polyclonal anti-rabbit Alexa Fluor 594 | Abcam | ab150077 | |
| Hanks-balanced Salt Solution (HBSS) 1x | ThermoFisher | 14175095 | 500 mL |
| HEPES | VWR | 101170-478 | |
| HeraCell 150 CO2 incubator | Heraeus (ThermoFisher) | ||
| ImageJ v1.52e | NIH | ||
| IRIS-Fine Scissors (Round Type)-S/S Str/31*8mm/13cm | RWD | S12014-13 | |
| Kanamycin monosulfate | Gold Bio | K-120-25 | |
| Laminin | Sigma-Aldrich | L2020 | |
| L-Ascorbic acid | Sigma-Aldrich | A7506 | |
| L-glutamic acid | VWR | 97061-634 | |
| Magnesium Chloride (MgCl2), andydrous | Sigma-Aldrich | M8266 | |
| MPII Mini-Peristaltic Pump, 115/230 VAC, 50/60 Hz | Harvard Apparatus | 70-2027 | |
| MULLER Micro Forceps-Str, 0.15mm Tips, 11cm | RWD | F11014-11 | |
| NBQX | Hello Bio | HB0443 | |
| Neurobasal medium | ThermoFisher | 21103049 | 500 mL |
| Normal goat serum (NGS) | Abcam | ab7481 | |
| Origin 2020 | OriginLab | ||
| pAAV.Syn.GCaMP6f.WPRE.SV40 | Addgene | 100837-AAV1 | Titer: 1.00E+13 gc/ml |
| Papain | Worthington Biomedical Corporation | LS003126 | |
| Penicillin streptomycin | ThermoFisher | 15140122 | 10,000 U/mL |
| Phosphate-buffered saline (PBS) 1x | ThermoFisher | 10010049 | 500 mL |
| Poly-L-lysine | Sigma-Aldrich | P4832 | |
| Poly-L-ornithine | Sigma-Aldrich | P4957 | |
| Potassium Chloride (KCl), anhydrous | Sigma-Aldrich | 746436 | |
| Pump Head Tubing Pieces For MPII | Harvard Apparatus | 55-4148 | |
| Rabbit monoclonal anti-caspase-3 | Abcam | ab32351 | |
| Sodium Chloride (NaCl), anhydrous | Sigma-Aldrich | 746398 | |
| Sucrose | Sigma-Aldrich | S7903 | BioXtra, ≥99.5% (GC) |
| Time-pregnant female C57BL/6 mice | Texas A&M Institue for Genomic Medicine | ||
| Triton X-100 | Sigma-Aldrich | X100 | 500 mL |
| Wide-bore blue pipette tips P1000 | VWR | 83007-380 |
Referanslar
- Marras, C., et al. Prevalence of Parkinson's disease across North America. NPJ Parkinson's Disease. 4, 21 (2018).
- Poewe, W., et al. Parkinson disease. Nature Reviews Disease Primers. 3, 17013 (2017).
- Mehta, A., Prabhakar, M., Kumar, P., Deshmukh, R., Sharma, P. L. Excitotoxicity: bridge to various triggers in neurodegenerative disorders. European Journal of Pharmacology. 698 (1-3), 6-18 (2013).
- Ambrosi, G., Cerri, S., Blandini, F. A further update on the role of excitotoxicity in the pathogenesis of Parkinson's disease. Journal of Neural Transmission (Vienna). 121 (8), 849-859 (2014).
- Dong, X. X., Wang, Y., Qin, Z. H. Molecular mechanisms of excitotoxicity and their relevance to pathogenesis of neurodegenerative diseases. Acta Pharmaceutica Sinica B. 30 (4), 379-387 (2009).
- Vieira, M., et al. Excitotoxicity through Ca2+-permeable AMPA receptors requires Ca2+-dependent JNK activation. Neurobiology of Disease. 40 (3), 645-655 (2010).
- Sebe, J. Y., et al. Ca(2+)-Permeable AMPARs Mediate Glutamatergic Transmission and Excitotoxic Damage at the Hair Cell Ribbon Synapse. Journal of Neuroscience. 37 (25), 6162-6175 (2017).
- Brickley, S. G., Farrant, M., Swanson, G. T., Cull-Candy, S. G. CNQX increases GABA-mediated synaptic transmission in the cerebellum by an AMPA/kainate receptor-independent mechanism. Neuropharmacology. 41 (6), 730-736 (2001).
- Srinivasan, R., et al. Smoking-Relevant Nicotine Concentration Attenuates the Unfolded Protein Response in Dopaminergic Neurons. Journal of Neuroscience. 36 (1), 65-79 (2016).
- Henley, B. M., et al. Reliable Identification of Living Dopaminergic Neurons in Midbrain Cultures Using RNA Sequencing and TH-promoter-driven eGFP Expression. Journal of Visualized Experiments. (120), e54981 (2017).
- Douhou, A., Troadec, J. D., Ruberg, M., Raisman-Vozari, R., Michel, P. P. Survival promotion of mesencephalic dopaminergic neurons by depolarizing concentrations of K+ requires concurrent inactivation of NMDA or AMPA/kainate receptors. Journal of Neurochemistry. 78 (1), 163-174 (2001).
- Lavaur, J., et al. The noble gas xenon provides protection and trophic stimulation to midbrain dopamine neurons. Journal of Neurochemistry. 142 (1), 14-28 (2017).
- Kritis, A. A., Stamoula, E. G., Paniskaki, K. A., Vavilis, T. D. Researching glutamate - induced cytotoxicity in different cell lines: a comparative/collective analysis/study. Frontiers in Cellular Neuroscience. 9, 91 (2015).
- Gupta, K., Hardingham, G. E., Chandran, S. NMDA receptor-dependent glutamate excitotoxicity in human embryonic stem cell-derived neurons. Neuroscience Letters. 543, 95-100 (2013).
- Surmeier, D. J., Obeso, J. A., Halliday, G. M. Selective neuronal vulnerability in Parkinson disease. Nature Reviews Neuroscience. 18 (2), 101-113 (2017).
- Ramirez, J. M., Tryba, A. K., Pena, F. Pacemaker neurons and neuronal networks: an integrative view. Current Opinion in Neurobiology. 14 (6), 665-674 (2004).
- Guzman, J. N., Sanchez-Padilla, J., Chan, C. S., Surmeier, D. J. Robust pacemaking in substantia nigra dopaminergic neurons. Journal of Neuroscience. 29 (35), 11011-11019 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır