Method Article
Quantificare i flussispontanei di Ca 2 e i loro effetti a valle nei neuroni Midbrain del topo primario
In questo articolo
Riepilogo
Qui presentiamo un protocollo per misurare i flussi in vitro di Ca2 nei neuroni midbrain e i loro effetti a valle sulla caspase-3 utilizzando colture midbrain topo primario. Questo modello può essere utilizzato per studiare i cambiamenti patofsiologici legati all'attività anormale di Ca2 nei neuroni midbrain e per lo screening di nuove terapie per le proprietà anti-apoptotiche.
Abstract
Il morbo di Parkinson (PD) è un disturbo neurodegenerativo devastante causato dalla degenerazione dei neuroni dopaminergici (DA). L'eccessivo afflusso di Ca2 a causa dell'attivazione anomala dei recettori del glutammato si traduce in accitotossicità DA ed è stato identificato come un importante meccanismo per la perdita di neurone DA. In questo studio, isoliamo, dissociamo e coltura i neuroni midbrain dal mesencephalon ventrale del topo (VM) degli embrioni di topo ED14. Infettamo quindi le colture midbrain del topo primario a lungo termine con un virus associato all'adeno (AAV) che esprime un indicatore di calcio geneticamente codificato, GCaMP6f sotto il controllo del promotore di sinapsin specifico del neurone umano, hSyn. Utilizzando l'imaging confocale dal vivo, mostriamo che i neuroni midbrain murini di topo se nerici colturati mostrano iflussimenti spontanei di Ca 2 e rilevati da AAV-hSyn-GCaMP6f. L'applicazione del bagno di glutammato a colture midbrain provoca elevazioni anomale nella Ca2 all'interno dei neuroni e questo è accompagnato dall'attivazione del caspase-3 nei neuroni DA, come dimostrato dall'immunosostenimento. Le tecniche per identificare l'apoptosi mediata dal glutammato nei neuroni DA del topo primario hanno importanti applicazioni per lo screening ad alto contenuto di farmaci che preservano la salute dei neuroni DA.
Introduzione
Il morbo di Parkinson (PD) è il secondo disturbo neurodegenerativo più comune al mondo, senza una cura nota. Le stime suggeriscono che la prevalenza della PD continuerà ad aumentare e si prevede che supererà 1 milione di diagnosi entro il 2030 solo negli Stati Uniti1. Con pochi trattamenti efficaci attualmente disponibili per combattere la PD, c'è una pressante necessità di sviluppare terapie più efficaci. PD è caratterizzato da una rapida e progressiva perdita di neuroni dopamina midbrain (DA)2. I meccanismi che sono alla base della neurodegenerazione nella PD sono poco compresi. Le prove suggeriscono una probabile convergenza di più meccanismi, come lo stress ossidativo e la disfunzione mitocondriale, ecc. che contribuiscono all'avvio di cascate di segnalazione apoptotica e alla morte finaledelle cellule 3.
Uno di questi meccanismi convergenti, l'ecitotossicità mediata dal glutammato è stato implicato in molteplici malattie neurodegenerative, tra cui PD4. Mentre si pensa che l'ecitotossicità mediata dal glutammato funzioni principalmente attraverso la stimolazione dei recettori NMDA attraverso un aumento eccessivo della concentrazione intracellulare di Ca2 e l'eventuale inizio dell'apoptosi, anche i recettori AMPA permeabili ca2sono stati implicati nella risposta excitotossica5,6,7. Pertanto, è interessante determinare il contributo dei recettori AMPA all'apoptosi mediata dal glutammato all'interno di un modello PD. Questo può essere ottenuto utilizzando NBQX, un AMPA e kainate blocker, che a concentrazioni di micromolari è selettivo per i recettori AMPA8. L'ecitotossicità mediata dal glutammato e le cascate di segnalazione apoptotica sono un bersaglio a valle ideale per misurare l'entità della morte cellulare e un potenziale obiettivo per l'intervento terapeutico. Pertanto, lo sviluppo di un metodo ad alto contenuto per valutare la modulazione mediata dal glutammato dell'attività del calcio e la segnalazione a valle associata nei neuroni mesencephalici ventrali (VM) primari sarebbe utile per lo screening di nuovi metodi di trattamento sulla loro capacità di preservare la salute neuronale.
Qui, abbiamo sviluppato un protocollo in cui esprimiamo l'indicatore di calcio geneticamente codificato (GECI), GCaMP6f, utilizzando AAV2/5 con la promotore della sinasi umana (hSyn) per misurarel'attività Ca 2 dei neuroni primari della VM del topo in risposta all'applicazione del glutammato che può essere misurata a livello fisiologico e molecolare. Questo screening ad alto contenuto può essere adattato per scoprire prodotti farmaceutici o trattamenti che modulano l'attività di Ca2 per preservare la salute dei neuroni vm. Proponiamo che questo modello di coltura primaria sia un modo efficace per controllare nuovi interventi pd, in base alla loro capacità di preservare la salute dei neuroni VM e mitigare la progressione della PD.
Protocollo
Tutte le procedure relative all'uso di soggetti animali sono state approvate dal Texas A&M University Institutional Animal Care and Use Committee (25novembre 2019; AUP 2019-0346).
NOTA: La preparazione delle soluzioni di coltura cellulare deve essere effettuata mediante procedura sterile in un armadietto di sicurezza biologica e filtrata a 0,2 m per prevenire la contaminazione.
1. Preparazione delle soluzioni e dei mezzi di coltura
- Preparare la soluzione di rivestimento di laminina diluindo 20 L di 1 mg/mL di brodo di laminina in 2 mL di distillato sterile H2O. Preparare il giorno della dissezione.
- Preparare la soluzione di arresto del siero equino (cavallo) (ES) al 10% aggiungendo 5 mL di ES a 45 mL della soluzione di sale bilanciata di 1x Hank (HBSS). Filtro sterile con un sistema di filtro di 0,2 m o una punta del filtro della siringa. Conservare a 4 gradi centigradi.
- Preparare la soluzione di stock di albumina del siero bovino (BSA) aggiungendo 2 g di polvere di BSA a 1x di salina tamponata di fosfato (PBS) e portando ad un volume finale di 45 mL. Filtro sterile con un sistema di filtro di 0,2 m o una punta del filtro della siringa. Conservare a 4 gradi centigradi.
- Preparare la soluzione di brodo papain diluendo papaina a 3 mg/mL in 1x HBSS. Filtro sterile con un sistema di filtro di 0,2 m o una punta del filtro della siringa. Conservare a -20 gradi centigradi.
- Preparare la soluzione deossiribonuclease (DNase) aggiungendo 20 mg di polvere DNase a sterile H2O e portando ad un volume finale di 20 mL. Filtro sterile con un sistema di filtro di 0,2 m o una punta del filtro della siringa. Conservare a -20 gradi centigradi.
- Preparare la soluzione di stock di acido ascorbico aggiungendo 352 mg di acido ascorbico alla distillata sterile H2O e portando ad un volume finale di 20 mL. Riscaldare in bagno da 37 gradi per sciogliere se necessario. Filtro sterile con un sistema di filtro di 0,2 m o una punta del filtro della siringa. Conservare a -20 gradi centigradi.
- Preparare Cell Culture Medium aggiungendo quanto segue a 50 mL di mezzo Neurobasal: 500 L di Glutamax (100x), 500 SL siero equino, 1 mL di B-27, 100 L di acido ascorbico, 500 lL di penicillina-streptomicina, 50 L di kanamycin e 50 l di ampicillina. Filtro sterile con un sistema di filtro da 0,2 m. Conservare a 4 gradi centigradi.
- Preparare la soluzione Triton X-100 da 0,01% aggiungendo 1 mL di Triton X-100 in 9 mL di 1x PBS per creare una soluzione del 10%. Poiché Triton X-100 è viscoso, pipetta lentamente per consentire la punta di riempire completamente. Riscaldare in bagno da 37 gradi per sciogliere se necessario. Conservare a 4 gradi centigradi.
- Per diluire il 10% del triton X-100 a 0,01%, eseguire 3 diluizioni seriali 1:10. Diluire 1 mL del 10% di stock in 9 mL di 1x PBS per fare la soluzione dell'1%. Diluire 1 mL della soluzione 1% in 9 mL di 1x PBS per fare la soluzione 0,1%. Diluire 1 mL della soluzione dello 0,1% in 9 mL di 1x PBS per creare una soluzione dello 0,01%.
- Preparare la soluzione del siero di capra normale (NGS) al 10% e all'1% aggiungendo 1 mL di NGS a 9 mL di 1x PBS per una soluzione del 10%. Aggiungere 100 L di NGS a 9,9 mL di 1x PBS per creare una soluzione dell'1%.
- Preparare la soluzione di stock di glutammato (100 mM) aggiungendo 735 mg di acido L(-Glutamic) alla distillata sterile H2O e portare ad un volume finale di 50 mL. La solubilità a questa concentrazione sarà un problema. L'aggiunta di piccoli volumi (100 L) di 1 M di acido cloridrico è sufficiente per aumentare la solubilità.
- Preparare la soluzione di stock NBQX (10 mM) aggiungendo 50 mg di NBQX a H2O distillato sterile e portare ad un volume finale di 13 mL.
2. Preparazione di piatti di cultura e coverlips (Fatto il giorno prima della dissezione)
NOTA: Abbiamo scoperto che la combinazione di tre agenti di rivestimento, poli-L-lisina, poli-L-ornithine e laminina consente l'adesione e la vitalità delle cellule ideali.
- Mettere 10 piatti Petri da 35 mm in un armadietto di sicurezza biologica. Mettere due coperture circolari da 12 mm in ogni piatto e riempire con 70% EtOH per 10 min. Utilizzare una linea di vuoto per aspirare il rimanente EtOH da ogni piatto, permettendo all'ETOH di evaporare completamente.
- Pipette 90-100 L di soluzione poli-llysina da 0,1% su ciascun coperchio, assicurandosi che l'intero coperchio sia coperto dalla soluzione poli-llysina. Coprire i piatti con i coperchi e mettere in un'incubatrice di 37 gradi centigradi per 1 h.
- Aspirare la soluzione di poli-llysina rimanente da ogni cosepi e risciacquare con H2O sterile.
- Ripetere i passaggi da 2.2 a 2.3 con la soluzione poli-ornithine 0.1%.
- Ripetere nuovamente i passaggi da 2.2 a 2.3 con la soluzione laminin 0.01%. Mettere in un'incubatrice di CO 2 a 37 gradicentigradi fino a quando non è pronta per la placcatura cellulare il giorno successivo.
3. dissezioni embrionali del topo
NOTA: Usiamo tra 4 e 6 topi in gravidanza a tempo per coltura. Mentre gran parte del processo di dissezione si verifica al di fuori di un armadio di sicurezza biologica è ancora importante mantenere la procedura sterile. L'uso abbondante del 70% di EtOH su superfici vicine al microscopio di dissezione e su strumenti chirurgici è l'ideale. Una maschera può anche essere indossata durante la dissezione per prevenire ulteriormente la contaminazione. Inoltre, usiamo 4 antibiotici separati nel mezzo di coltura, quindi la contaminazione è improbabile. Tuttavia, se l'uso di antibiotici è problematico, questa impostazione di dissezione potrebbe essere spostata all'interno di un cappuccio sterile. Per preservare la vitalità cellulare, tutte le soluzioni di dissezione devono essere pre-raffreddate a 4 gradi centigradi e le dissezioni devono essere completate il più rapidamente possibile. Non eseguiamo le dissezioni sul ghiaccio. Il metodo per la dissezione dei neuroni midbrain embrionali del topo è identico ai metodi descritti inprecedenza 9,10.
- Preparare uno spazio su una panca vicino a un microscopio di dissezione con un pad assorbente e spruzzare liberamente con 70% EtOH.
- Spruzzare due piatti Petri in vetro da 100 x 15 mm e uno piatto Petri in vetro da 50 x 10 mm con 70% EtOH e consentire all'ETOH di evaporare. Una volta evaporato, mettere 50 mL di HBSS sterile 1x in ogni piatto Petri da 100 x 15 mm.
- Immergere forbici chirurgiche, forbici e lama microtoma in 70% EtOH per 10 min minimo per sterilizzare. Posizionare gli strumenti sul pad assorbente per asciugare.
- Utilizzando CO2 seguita da lussazione cervicale, eutanasia topi di gravidanza a tempo di 2-3 mesi il giorno embrionale 14.
- Spruzzare l'addome dei topi eutanasia con 70% EtOH. Utilizzando le forcepi afferrare l'addome inferiore e aprire la cavità addominale utilizzando forbici chirurgiche. Iniziare a tagliare vicino a dove le forcepie stanno tenendo l'addome, facendo tagli laterali su ogni lato fino a quando la parete addominale può essere piegata all'indietro e l'utero è chiaramente visibile.
- Utilizzando le forbici chirurgiche, tagliare entrambe le estremità del corno uterino. Quindi rimuovere l'utero e mettere nel piatto Petri con 1x HBSS.
- Utilizzando le forcette a punta dritta rimuovere con attenzione gli embrioni dall'utero. Lasciare gli embrioni in HBSS durante tutto questo processo. Utilizzando le forme o una lama microtoma, decapitare rapidamente gli embrioni tagliando vicino al collo. Rendere il più livellato possibile un taglio.
- Sotto un microscopio sezionante, spostare la testa di un embrione su un piatto Petri secco da 50 mm e posizionarsi sul lato ventrale. Stabilizzare la testa con le forcezze posizionando e penetrando vicino agli occhi / muso. Le forceps devono essere inclinate verso il basso a 45 gradi per evitare di penetrare il mesencephalon.
- Utilizzando le forcerse nell'altra mano, rimuovere con attenzione lo strato traslucido della pelle e del cranio appena prima della cresta prominente del mesencephalon. Iniziare vicino alla linea mediana e rimuovere la pelle e il cranio caudally fino a quando il mesencephalon è completamente esposto.
- Tenere le forcepi perpendicolari al mesencephalon esposto con una punta tra la corteccia e il mesencephalon e l'altra vicino al cervelletto. Premere verso il basso e pizzicare le forcepi insieme per rimuovere l'intero midbrain. Il segmento midbrain deve avere uno spessore di circa 0,5 mm. Posizionare il segmento midbrain nel secondo piatto Petri riempito con HBSS fresco 1x. Ripetere questo processo per ogni embrione.
- Utilizzando il microscopio di dissezione, posizionare il segmento cerebrale con il lato ventrale rivolto verso l'alto. Se le meningi sono ancora attaccate, rimuoverle con attenzione afferrando con le forceppa e sollevandosi e allontanandosi dal segmento cerebrale.
- Il segmento cerebrale dovrebbe avere 4 quadranti visibili. Posizionare il segmento in modo tale che i due quadranti più piccoli siano posizionati in modo superiore ai due quadranti più grandi. C'è una cresta prominente che separa i due quadranti superiori (piccoli) dai due quadranti inferiori (grandi).
- Utilizzando le forcepi pizzicare e separare i quadranti superiori dai quadranti inferiori, quindi scartare i quadranti superiori. I restanti quadranti inferiori avranno tessuto in eccesso lateralmente sul lato dorsale, questo tessuto avrà un aspetto meno opaco rispetto al tessuto ventrale rimanente. Rimuovere il tessuto dorsale meno denso e scartare. Il segmento rimanente deve contenere sia la Substantia nigra pars compacta (SNc) che l'area tegmentale ventrale (VTA).
- Utilizzando le forcelle tagliare il segmento di tessuto ventrale rimanente in 4 pezzi più piccoli e utilizzando una pipetta foro largo 1mL trasferire questi segmenti in un tubo conico 15 mL con 1x HBSS. Mantenere il tubo conico con segmenti cerebrali sul ghiaccio per tutta la procedura.
- Ripetere questo processo per tutti i segmenti cerebrali rimanenti.
4. Dissociazione delle cellule
- Digestione ezimatica delle cellule
- Aspirare con cura l'HBSS dal tubo conico da 15 mL contenente segmenti midbrain, lasciando i segmenti nella parte inferiore del tubo.
- Aggiungere 800 dollari di soluzione di papaina al tubo e mettere in un'incubatrice di 37 gradi centigradi per 7 minuti. Riesping delle cellule facendo scorrere il tubo e sostituirlo con l'incubatrice di 37 gradi centigradi per altri 7 minuti.
- Con una punta di pipetta a foro largo da 1 mL, rimuovere solo i segmenti midbrain in un aliquot di 1 mL di DNase. Lasciare che i segmenti raggiungano la parte inferiore dell'aliquot o circa 1 min di esposizione.
- Con una punta di pipetta a foro largo da 1 mL, rimuovere solo i segmenti midbrain in un tubo conico da 15 mL contenente 2 mL di soluzione di arresto. Lasciare che i segmenti si stabiliscano nella parte inferiore del tubo e ripetere il risciacquo in un tubo conico aggiuntivo riempito con soluzione di arresto.
- Triturazione meccanica delle sospensioni cellulari
- Nella seconda soluzione di arresto risciacquare tubo, utilizzando una punta di pipetta a foro largo 1 mL, pipetta le cellule su e giù 10 volte fino a quando non ci sono grandi segmenti di tessuto visibili. È importante evitare la triturazione per la linesi cellulare minima.
- Pipetta lenta 300 L della soluzione BSA del 4% sul fondo del tubo conico da 15 mL contenente segmenti cerebrali. Rimuovere con attenzione la punta della pipetta per mantenere uno strato di sospensione. Centrifuga a 0,4 x g per 3 min. Quindi aspirare con attenzione le cellule supernante e riespettere in 400 L del mezzo di coltura cellulare.
5. Placcare le cellule
NOTA: Sulla base dell'esperienza, vengono raccolte circa 100.000 cellule vitali per embrione. I topi in gravidanza a tempo di 2-3 mesi hanno in genere una dimensione della lettiera di 8-10 embrioni; pertanto, una stima approssimativa per la resa totale delle cellule per topo in gravidanza a tempo è di circa 1 milione di cellule.
- Utilizzando un emocitometro preforma un conteggio delle cellule e quindi diluire la sospensione a 2.000 cellule / L utilizzando il supporto di coltura cellulare. Triturate brevemente per mescolare.
- Rimuovere le coperture con soluzione di laminina dal passo 2 dall'incubatrice e aspirare la soluzione di laminina rimanente dalle coperture rivestite utilizzando un vuoto. Piastra veloce per evitare che i coperture si asciughino completamente. Pipette 100 L (2,0 x 105 celle/coverslip) su ogni coperture e mettere i piatti Petri in un'incubatrice da 37 gradi centigradi per 1 h.
- Aggiungere con cura 3 mL di mezzo di coltura cellulare per ogni piatto e ri-ri-intasa nell'incubatrice a 37 gradi centigradi. Preforma metà media cambia 2 volte a settimana per 2 settimane.
6. Infezione della coltura cellulare a 14 DIV con vettori virali associati all'adeno (AAV)
- Per ogni piatto preparate 1 mL di siero senza supporto DMEM con 1 L di hSyn-GCaMP6f AAV (1,0 x 1013 titer)
- Aspirare il mezzo di coltura cellulare da ogni piatto e sostituire con 1 mL di siero libero DMEM contenente hSyn-GCaMP6f. Ri-schiena i piatti nell'incubatrice da 37 gradi centigradi per 1 h.
- Aspirare il mezzo senza siero contenente AAV e sostituire con 3 mL di mezzo di coltura cellulare. Ri-schiena i piatti nell'incubatrice a 37 gradi centigradi. Abbiamo scoperto che 5-7 giorni di infezione da AAV consentono livelli ideali di espressione GCaMP. Continuare a cambiare mezzo ogni 2-3 giorni durante questo periodo di infezione virale.
7. Immagini confocali in tempo reale Ca2 o tra 19-21 DIV
NOTA: Come accennato nel punto 6.3, l'imaging può essere fatto tra 5-7 giorni dopo l'infezione virale. Questa è la finestra ideale per ottenere un'espressione visibile del fluoroforo a livelli che consentono il rilevamento dell'attività spontanea di Ca2.
- Preparazione dei buffer di registrazione
- Per creare 1 L del buffer di registrazione HEPES, aggiungere: 9.009 g di NaCl, 0,3728 g di KCl, 0,901 g di D-glucosio, 2,381 g di HEPES, 2 mL di 1 M CaCl2 soluzione di stock e 500 L di 1 M MgCl2 soluzione di stock a 800 mL di H2O. Portare il pH a 7,4 con NaOH. Portare ad un volume finale di 1 L.
- Per realizzare una soluzione di registrazione di 20 mL di 20 ML, diluire 40 SL di 100 mM di soluzione di stock di glutammato in 200 mL di buffer di registrazione HEPES descritto in precedenza.
- Per realizzare un buffer di registrazione di 200 mL di 10 M NBQX, diluire 200 L di 10 mM NBQX in 200 mL di buffer di registrazione HEPES.
- Imaging confocale
- Riempire un piatto Petri sterile da 35 mm con 3 mL di buffer di registrazione.
- Rimuovere dall'incubatrice di 37 gradi centigradi un piatto Petri da 35 mm con colture infette. Utilizzando le forcepi di punta fine, afferrare con attenzione il bordo di un coperture e trasferirlo rapidamente nel piatto Petri riempito con buffer di registrazione. Mettere il coperture rimanente in media nell'incubatrice di 37 gradi centigradi. Trasportare il piatto con buffer di registrazione al microscopio confocale.
- Avviare il software di imaging. Procedere al passaggio successivo durante l'inizializzazione.
- Avviare la pompa peristaltica e posizionare la linea nel buffer di registrazione. Calibrare la velocità del flusso a 2 mL/min.
- Trasferire le coperture infette dal piatto Petri da 35 mm nel bagno di registrazione.
- Utilizzando l'obiettivo di immersione dell'acqua 10x e la luce BF, trovare il piano di messa a fuoco e cercare una regione con un'alta densità di corpi cellulari neuronali. Passare all'obiettivo di immersione dell'acqua 40x e utilizzare la luce BF rifocalizzare il campione.
- Nella finestra "Dyes list" all'interno di FluoView selezionare AlexaFluor 488 e applicarlo.
- L'espressione AAV può essere variabile; pertanto, al fine di prevenire la sovraesposizione e la fotosesposizione dei fluorofori, iniziare con impostazioni di potenza A basso ESmorne e laser. Per il canale AlexaFluor 488, impostare l'HV ad alta tensione (HV) su 500, il guadagno su 1x e l'offset su 0. Per la linea laser 488 impostare la potenza al 5%. Al fine di aumentare il volume effettivo immagine nel piano z, aumentare la dimensione del foro stenopeico a 300 m. Utilizzare l'opzione di scansione "focus x2" per regolare in modo ottimale i segnali di emissione ai livelli di sub-saturazione. Da qui, le impostazioni possono essere regolate fino a raggiungere la visibilità ideale di ogni canale.
NOTA: per catturare con precisione l'intera gamma diflasceggi Ca 2 con GCaMP, regolare le impostazioni di potenza HV e laser della linea di base per consentire un aumento dell'intensità fluorescente senza sovrasaturare il rilevatore. - Una volta ottimizzate le impostazioni del microscopio, spostare lo stage per individuare una regione con più celle che mostrano cambiamenti spontanei nella fluorescenza GCaMP6f e concentrarsi sul piano desiderato per l'imaging.
- Utilizzare lo strumento "Clip rect" per ritagliare il fotogramma di imaging a una dimensione che può ottenere un intervallo di fotogrammi di poco meno di 1 secondo. Ciò è necessario per impostare l'intervallo di imaging a 1 fotogramma al secondo.
- Impostare la finestra "Intervallo" su un valore di 1.0 e la finestra "Num" su 600.
NOTA: Al fine di fornire diversi buffer di registrazione al punto di tempo desiderato (300 s), è importante calibrare la latenza della pompa per fornire la nuova soluzione al bagno. Questo dipenderà dalla velocità di perfusione della soluzione (2 mL/min) e dalla lunghezza della linea utilizzata per pompare la soluzione. - Per acquisire un filmato della serie t, selezionare l'opzione "Time" e quindi utilizzare l'opzione di scansione "XYt" per avviare l'imaging.
- Osservare la barra di avanzamento dell'imaging e spostare la linea dal buffer di registrazione HEPES nel buffer di registrazione del glutammato da 20 M al momento appropriato (ad esempio, se la latenza della pompa è calibrata per fornire la soluzione a 60 s, spostare la linea nel buffer del glutammato a 240 fotogrammi per consegnare il glutammato a 300 s).
- Al termine dell'imaging, selezionate il pulsante Fatto serie (Series Done) e salvate il filmato della serie t finito. Continuare a perfuse 20 20 -M Glutamate per un ulteriore 5 min, in modo che i neuroni colturati sono stati esposti al glutammato per un totale di 10 min. Ripetere questa procedura per ogni coverlip da immagini.
- A seguito dell'ulteriore esposizione di 5 minuti a 20 M Glutamate, rimuovere il coperto dal bagno e rirenirlo nel piatto Petri da 35 mm contenente il buffer di registrazione fino al completamento del giorno dell'imaging. Al termine, procedere al passaggio 8.
- Analisidelle tracce Ca 2
- Eseguire l'analisi delle immagini in ImageJ. Installare il plugin BIO-FORMATS per ImageJ, che consentirà . file di immagine OIB da aprire.
- Nella barra degli strumenti di ImageJ, fare clic su Analizza. Impostare Misure eselezionare la casella valore di grigio medio (MGV).
- In ImageJ, apri un filmato della serie t come hyperstack.
- Trascinate il cursore per il filmato e identificate il fotogramma con la risposta massima del glutammato per visualizzare tutti i neuroni che rispondono al glutammato. Utilizzare lo strumento poligono per tracciare tutti i corpi cellulari dei neuroni visibili, aggiungendo i loro ROI all'elenco "Gestione ROI".
- Al termine dell'analisi e dell'aggiunta di ROI, selezionare tutti i ROI all'interno della finestra Gestione ROI e utilizzare la selezione di misure multi nell'elenco delle altre opzioni. Copiare e incollare questi dati in un foglio di calcolo. Completare questo processo per tutti i film da analizzare.
- Per ogni ROI, convertire i dati MGV non elaborati da ogni fotogramma in valori di F/F0 utilizzando l'equazione: F/F0 : [F(t) – F0] / F0. Dove F(t) - MGV di qualsiasi fotogramma, e F0 - MGV medio di base di 10 fotogrammi in cui non sono presenti flussi Ca2.
- Utilizzando un software statistico come OriginPro 2020, le tracce convertite di F/F0 possono essere trasformate in grafici a linee. La funzione "Analizzatore di picco" può essere utilizzata (o funzione simile se si utilizza un software diverso) per misurare l'ampiezza di picco della risposta del glutammato, la latenza per rispondere al glutammato e l'area sotto la curva.
8. Immunostaining delle culture
NOTA: Dopo la fissazione con formalina, le coperture possono essere conservate in 1x PBS a 4 gradi centigradi fino a quando non sono pronte per essere elaborate per l'immunosostenimento. L'incubazione degli anticorpi primari e secondari è stata effettuata in modo seriale, in quanto tale incubazione con anticorpo primario anti-Caspase-3 e il suo anticorpo secondario complementare ha preceduto l'incubazione con l'anticorpo primario anti-TH e il suo anticorpo secondario complementare.
- Immediatamente dopo l'esposizione al glutammato, rilinare il cosopia nel suo piatto Petri da 35 mm, aspirare il buffer di registrazione e aggiungere 3 mL del 10% di formalina. Lasciare riposare per 40 min a temperatura ambiente (RT).
- Sciacquare il piatto 3 volte con 1x PBS.
- Aspirare il PBS e permeare le cellule in 1 mL di 0.01% Triton X-100 in PBS per 2 min.
- Sciacquare il piatto 3 volte con 1x PBS.
- Aspirare il PBS e bloccare le cellule in 1 mL del 10% NGS in PBS per 40 min.
- Sciacquare il piatto 3 volte con 1x PBS.
- Aggiungere 1 GN di anticorpo primario anti-Caspase-3 del coniglio a 1 mL di NGS dell'1% in PBS (diluizione 1:1000). Aspirare PBS dal piatto e sostituire con la soluzione anticorpo primaria. Mettere su uno shaker e incubare per 1,5 h a RT.
- Sciacquare il piatto 3 volte con 1x PBS.
- Aggiungere 1 GN di capra anti-coniglio AlexaFluor 488 anticorpo secondario a 1 mL di 1% NGS in PBS (1:1000 diluizione). Aspirare PBS dal piatto e sostituire con la soluzione di anticorpo secondario. Posizionare su uno shaker e incubare per 1 h a RT.
- Sciacquare il piatto 3 volte con 1x PBS.
- Ripetere i passaggi da 8.7 a 8.10, ma utilizzando l'anticorpo primario anti-TH (1:1000) al punto 8.7 e l'anticorpo secondario AlexaFluor 594 (1:1000) di capra al punto 8.9.
- Dopo il risciacquo finale del PBS, posizionare 30 L del supporto di montaggio su un faro al microscopio. Utilizzando le forcepi afferrare un costope dal piatto Petri 35 mm e posizionare il coperture con le cellule rivolte verso il basso nel mezzo di montaggio. Entrambe le copertine si adattano a un singolo scivolo al microscopio se posizionato correttamente. Mettere in una zona asciutta e scura e lasciare che il mezzo di montaggio si asciughi durante la notte.
9. Imaging confocale di colture immunosostenibili
- Imaging confocale
- Avviare il software di imaging. Posizionare il campione sullo stadio del microscopio.
- Con gli occhi al microscopio, utilizzando un obiettivo di ingrandimento 20x e una luce epifluorescente con un filtro TRITC, mettere a fuoco il campione e cercare un corpo cellulare TH.
- Una volta individuato il corpo di una cella TH, centrarlo nel campo di vista e quindi passare all'obiettivo di ingrandimento 60x.
- Selezionare i coloranti AlexaFluor 488 e AlexaFluor 594 nella finestra "Dye list".
- Come per l'imaging dal vivo, iniziare con impostazioni di HV basso, guadagno, offset e potenza laser per prevenire il fotobleaching. Utilizzare l'opzione di scansione "focus x2" per valutare l'intensità fluorescente di ogni canale e regolare di conseguenza. Poiché queste immagini verranno successivamente quantificate per l'intensità fluorescente, è necessario mantenere coerenti le impostazioni di imaging in tutti i campi di visualizzazione. Pertanto, è meglio esaminare alcuni esempi di ogni condizione per avere un'idea della gamma di intensità fluorescente tra i campioni.
- Una volta determinate le impostazioni di imaging ideali, selezionare l'opzione di scansione "focus x2" e spostare la cella di interesse al centro del campo di visualizzazione. Aumentare lo zoom digitale a 3x utilizzando il cursore "zoom".
- Utilizzando la manopola di messa a fuoco, trovare il piano di messa a fuoco con la fluorescenza più luminosa e catturare un singolo piano immagine XY. Salvare l'immagine per completare l'operazione.
- Tornare all'obiettivo di ingrandimento 20x per cercare un'altra cella TH. Ripetere questo processo fino a quando non è stato campionato il numero desiderato di celle da ogni condizione.
- Analisi delle immagini
- Nella barra degli strumenti di ImageJ, fare clic su Analizza. Impostare Misure eselezionare le caselle Per Area, Densità integrata e Valore grigio medio.
- Aprire un'immagine come hyperstack con ogni canale separato trascinandolo nella barra degli strumenti ImageJ o selezionando l'immagine tramite il menu del file.
- Utilizzare il canale TH (594 nm) per disegnare ROI intorno al corpo della cella. Utilizzando lo strumento di tracciamento del poligono in ImageJ, tracciare attentamente il bordo esterno del corpo della cella. Dove la distanza tra la membrana cellulare e il nucleo cellulare è la più piccola, tracciare una linea retta attraverso il citosol fino al bordo del nucleo e quindi seguire da vicino il contorno del nucleo per escluderlo. Quindi tracciare una linea retta fino alla membrana esterna, confinante con la linea iniziale il più vicino possibile, e continuare a seguire il contorno del corpo cellulare fino al completamento del ROI.
- Utilizzando la scorciatoia da tastiera "T" o utilizzando il percorso del menu della barra degli strumenti Analizza Strumenti - Strumenti RoI Manager, aprire il ROI manager e aggiungere il ROI appena disegnato alla lista.
- Selezionare la finestra del canale caspase-3 (488 nm), quindi selezionare il ROI aggiunto nell'elenco "Gestione ROI".
- Nella finestra Gestione ROI, selezionare il pulsante Misura. La finestra dei risultati verrà visualizzata con le misure impostate in precedenza. Copiarli in un foglio di calcolo e ripetere questo processo per ogni cella.
Risultati
Dopo la coltura iniziale delle cellule, abbiamo trattato i piatti di coltura VM a 14 DIV con 1 L di AAV hSyn-GCaMP6f e abbiamo permesso 5 giorni di espressione virale. Il giorno dell'imaging hePES buffer di registrazione è stato preparato fresco. Abbiamo usato due condizioni; in una condizione 20 glutammato M è stato applicato per 10 min, mentre nell'altra condizione 5 min di 10 NBQX applicazione ha preceduto una co-applicazione di 10 min di 10 M NBQX . In entrambe le condizioni, abbiamo osservato cambiamenti eterogenei e spontanei nella fluorescenza GCaMP6f, che indicano i fluxs spontanei di Ca2, come mostrato nelle tracce rappresentative (Figura 1A,B, Supplemental Movie 1-2). L'applicazione di un glutammato da 20 M ha generato una risposta Ca2 e robusta sia nei neuroni spontaneamente attivi che in quiescenti (Figura 1A, Supplemental Movie 1). L'applicazione di 10 NBQX ha ridotto l'attività spontanea e ha parzialmente bloccato la risposta del glutammato (Figura 1B, Supplemental Movie 2). La misura in cui l'applicazione del glutammato ha stimolato una risposta Ca2 in ogni condizione è stata quantificata utilizzando l'area sotto la curva, l'ampiezza di picco e la latenza per rispondere. Entrambe le area sotto la curva e l'ampiezza di picco erano simili sia per il glutammato che per NBQX , le condizioni trattate con glutammato (Figura 1C), mentre la latenza di risposta è stata notevolmente aumentata nella condizione NBQX - glutammato (Figura 2A,B). Oltre a quantificare la risposta ca2 al trattamento del glutammato, abbiamo fissato e macchiato campioni con un anticorpo anti-caspase-3 come misura dell'apoptosi mediata dal glutammato. È stata osservata una serie di attivazione di caspase-3 nelle condizioni (Figura 3A,B). L'attivazione di Caspase-3 è stata quantificata dall'area di misurazione e dall'intensità media della caspase-3. Rispetto alle celle di controllo non trattate, l'area media delle cellule con attivazione caspase-3 in condizioni di glutammato e NBQX - glutammato tendeva verso la significatività (Figura 3B). L'intensità media del caspase-3 è stata significativamente più elevata nelle condizioni di glutammato e NBQX - glutammato rispetto ai controlli non trattati (Figura 3B). Insieme, questi risultati dimostrano un quadro ad alto contenuto in cui l'apoptosi dei neuroni può essere misurata quantificando le risposte di Ca2 o più agli agenti eccitati e seguita da un'analisi degli eventi apoptotici a valle come l'attivazione della caspase-3 nello stesso insieme di culture.
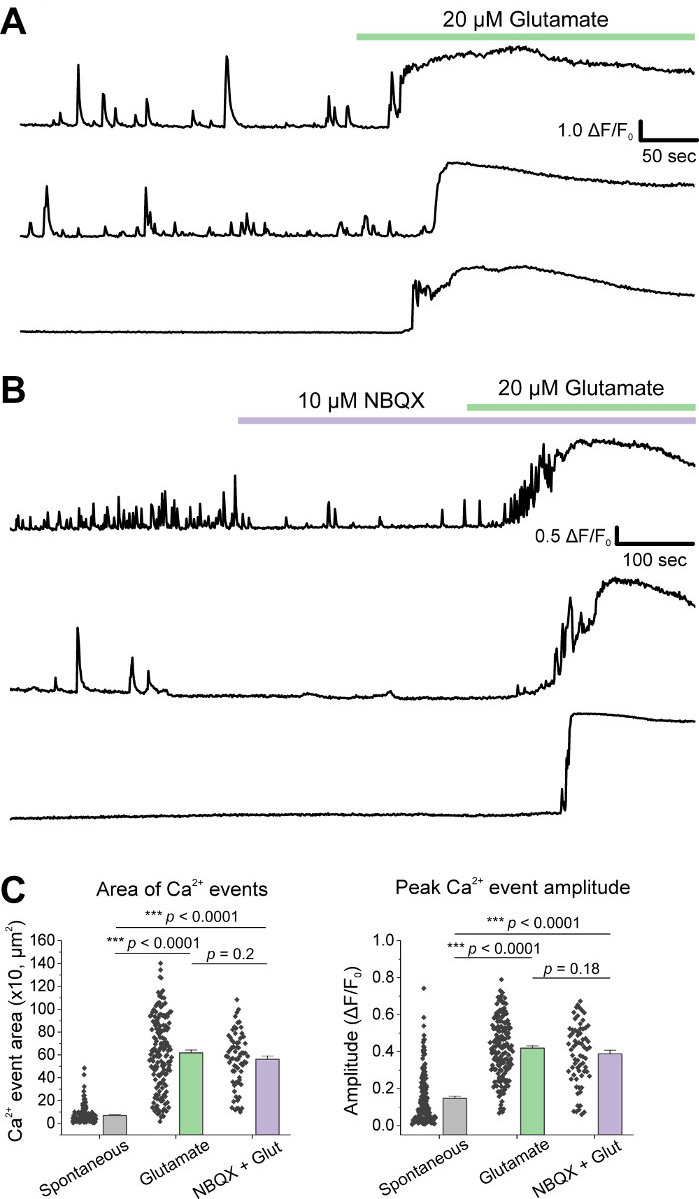
Figura 1: I neuroni mesencephalici ventrali serenigraficicoltura mostrano un'attività spontanea di Ca 2 e sono stimolati in modo robusto dall'applicazione del glutammato. (A) Tracce rappresentative dell'attività spontanea di Ca2 e della loro risposta all'applicazione di 20 M Glutamate. (B) Tracce rappresentative dell'attività spontanea di Ca2 nei neuroni VM e la loro risposta all'applicazione 10 NBQX da 20 M. (C) Dati della popolazione che mostrano l'area sotto la curva e l'ampiezza di picco delle tracce di Ca2. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
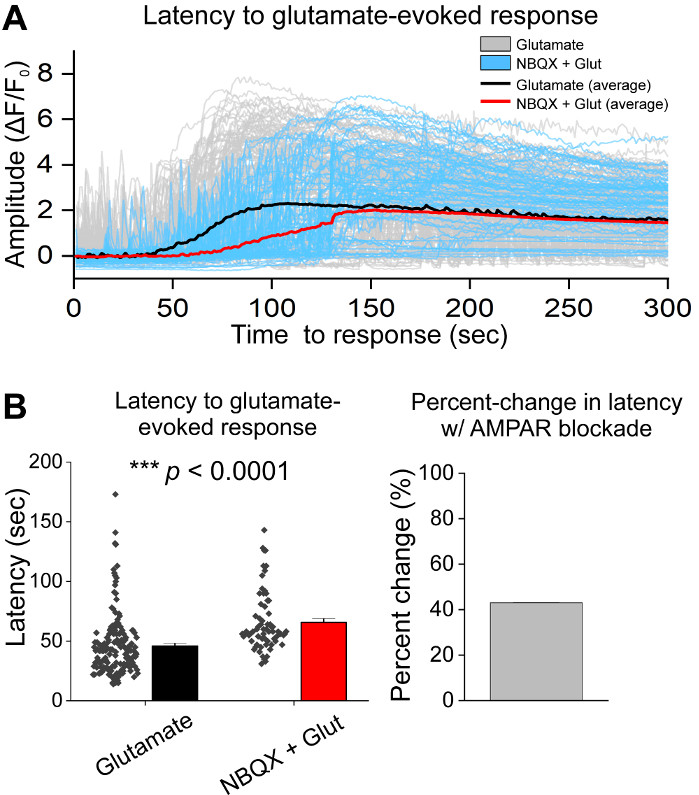
Figura 2: Blocco AMPAR con NBQX ritarda la risposta all'applicazione glutammato nei neuroni mesencephalici ventrali colturati. (A) Le tracce del rappresentante Ca2 e dei glutammato (grigio) e NBQX - glutammato (blu) evocavano le risposte. Le tracce medie di Ca2 di glutammato (nero) e NBQX - glutammato (rosso) sono mostrate sovrapposte. (B) I dati sulla popolazione che mostrano la latenza di risposta per il glutammato e NBQX - glutammato evocavano risposte. Nel pannello di destra viene visualizzata la variazione percentuale tra glutammato e NBQX e condizioni di glutammato. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
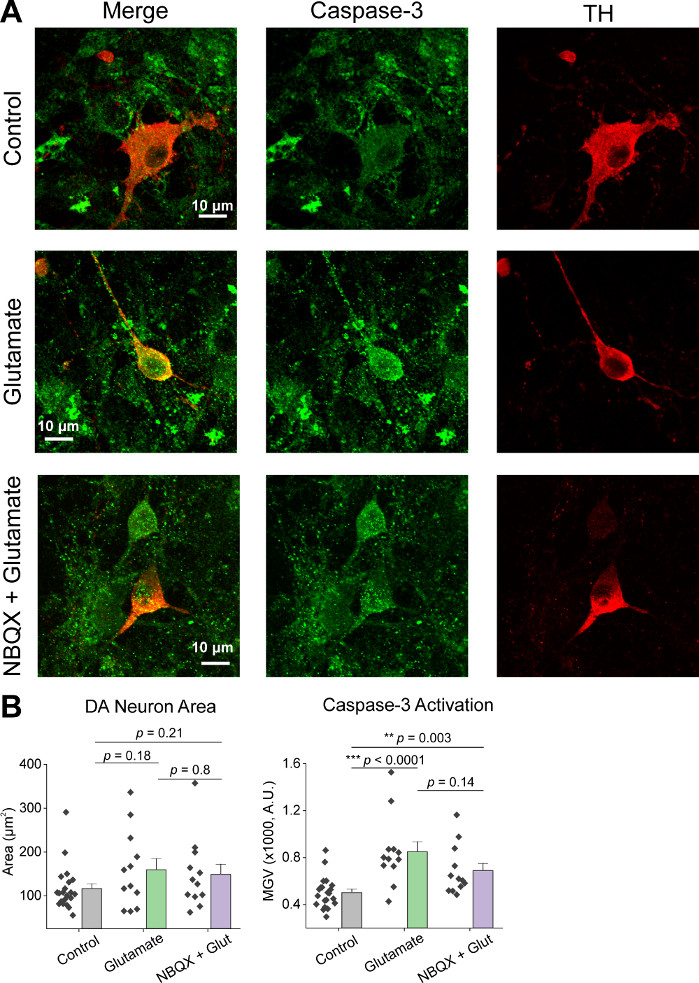
Figura 3: L'applicazione glutammato aumenta l'espressione di caspase-3 nei neuroni mesencephalici ventrali positivi della tirosina (TH). (A) Immagini confocali rappresentative delle culture VM immunostained per caspase-3 (verde) e TH (rosso), barra della scala - 10 m. ( B ) Datidi popolazioneche mostrano l'area del neurone DA e il valore di grigio medio dell'espressione caspase-3 in ogni condizione. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
Filmato supplementare 1: Attività spontanea di Ca2 e risposta all'applicazione del glutammato.
Flussispontanei di ca 2 in presenza di buffer di registrazione HEPES (0-300 s) seguiti dall'applicazione di 20 glutammato di M (301-600 s). Barra della scala di 50 m. Fare clic qui per scaricare questo video.
Filmato supplementare 2: Attività spontanea di Ca2 e risposta all'applicazione NBQX - glutammato.
Flussispontanei di ca 2 in presenza di buffer di registrazione HEPES (0-300 s) seguiti dall'applicazione di 10 SM NBQX (301-600 s) e 10 NBQX (20 s) (601-900 s). Barra della scala di 50 m. Fare clic qui per scaricare questo video.
Discussione
Descriviamo un sistema di coltura cellulare ventrale primaria a lungo termine (VM) per l'analisi ad alto contenuto dell'apoptosi mediata dal glutammato nei neuroni. Gli studi hanno impiegato colture dopaminergiche midbrain primarie per chiarire i meccanismi eccitatotossici nel contesto dei modelli PD11,12. In questo studio, impieghiamo un approccio combinatorio utilizzando indicatori di calcio codificati geneticamente (GECI) per misurarel'attività di Ca 2 e associare ulteriormente questa attività ai cambiamenti molecolari a valle, come l'avvio di cascate di segnalazione apoptotica4. Il metodo presenta molteplici vantaggi rispetto ad altri sistemi di coltura cellulare simili. Poiché abbiamo un particolare interesse per l'eccitatotossicità nel contesto del morbo di Parkinson, l'uso di colture cellulari VM primarie è l'ideale. Utilizzando diverse tecniche di rilocazione del campo, come i puntini di copertura grigliati o uno stadio di microscopio XY motorizzato combinato con l'immunostaining TH, possiamo studiare direttamente gli effetti specifici del tipo di cellula dell'apoptosi mediata dal glutammato nei neuroni midbrain ventrali. Inoltre, il modello di coltura cellulare di 3 settimane consente ai neuroni di sviluppare il loro profilo molecolare completo e maturo, riflettendo i neuroni DAadulti 9. I metodi precedenti si sono concentrati principalmente sui cambiamenti molecolari a seguito dell'ecitototossicità mediata dal glutammato13,14. Il modello è unico nella sua capacità di correlare i cambiamenti acuti nella fisiologia neuronale con gli eventi molecolari a valle nei tipi di cellule identificati. Una limitazione del modello di coltura primaria è che la tecnica di dissezione cattura l'intero midbrain ventrale, compresi i neuroni DA e GABAergic così come i neuroni dalla SNc e VTA. Le prove suggeriscono ora che i neuroni DA della SNc hanno vulnerabilità selettiva al calcio e alla morte delle cellule rispetto ai neuroni DA della vicina VTA15. Sfortunatamente, differenziare la SNc dai neuroni VTA nelle colture embrionali si è dimostrata difficile con pochi punti di riferimento anatomici per definire queste strutture nel cervello embrionale.
Dimostriamo che la tecnica di coltura primaria consente la quantificazione dell'attività spontanea eterogenea di Ca2 (Figura 1). Pertanto, questo è un modello di sistema di coltura cellulare ideale per studiare le cellule tonicamente attive, come i neuroni dopaminergici che making del midbrain, neuroni neocorticali, e neuroni GABaergic del nucleo soprachiasmatico (SCN)16,17. Nella maggior parte delle applicazioni,l'imaging Ca 2 non raggiunge la stessa risoluzione temporale dell'elettrofisiologia. Pertanto, è probabile che un singolo evento Ca2 è analogo a una raffica di potenziali di azione neuronale. Questo può essere interpretato nel modo in cuil'imaging Ca 2 consente misure relativamente accurate dell'attività di scoppio anormale nelle cellule di pace ed è quindi appropriato per uno schermo ad alto contenuto della morte delle cellule eccitate mediate ca2.
Per realizzare e mantenerel'attività spontanea di Ca 2, è importante affrontare due punti chiave del protocollo. Il primo è la densità di placcatura delle cellule dopo la dissezione. Per i neuroni primari della macchina virtuale, studi precedenti hanno utilizzato circa 100.000cellule/cm 29,10. Abbiamo adattato il protocollo per placcare una densità di 200.000 cellule/cm2, che crea una gamma eterogenea di attività spontanea e aumenta il numero di neuroni VM dopaminergici presenti su ogni coperture. Poiché diversi neuroni del pacemaking hanno proprietà di cotturadistinte 16, la densità di placcatura deve essere personalizzata in base al tipo di cellula studiata e ottimizzata al fine di raggiungere livelli ideali di attività spontanea. Il secondo è il tempo di incubazione dopo l'infezione virale degli AAV. Come la densità di placcatura, questo dipenderà dal contesto specifico della domanda di ricerca e dal tipo di AAV in uso. Per l'AAV specifico utilizzato qui, 5 giorni di incubazione a seguito di infezione virale è ideale per raggiungere i livelli di espressione proteica desiderati, che consente cambiamenti dinamici nella fluorescenza GCaMP al fine di registrare l'attività di Ca2. Molti fattori determinano quanto rapidamente ed efficientemente un AAV esprimerà il suo carico, gran parte dei quali è al di fuori dell'ambito di questo metodo, ma brevemente, è importante considerare l'attività del promotore e la velocità con cui la proteina del carico matura e si piega.
Un altro vantaggio del metodo è che consente una notevole flessibilità nel formato, nei vettori di espressione, nell'uso di apparecchiature di imaging e nella gamma di domande scientifiche che possono essere affrontate. Inoltre, il metodo consente di indagare su una vasta gamma di domande specifiche che circondano l'eccitactotossicità mediata dal glutammato nella PD e altri modelli di disfunzione del sistema nervoso. Ad esempio, l'ecitotossicità mediata dal glutammato coinvolge più recettori e cascate di segnalazione5. Utilizzando il metodo, e come dimostrato con il blocco AMPAR, NBQX in Figura 1, è possibile sezionare componenti specifici della risposta del glutammato excitotossico a livello fisiologico e molecolare. In teoria, un approccio simile utilizzando inibitori dei sistemi di secondo messaggero potrebbe essere utilizzato per determinare il loro contributo all'eccitatossicità. Inoltre, gli AV utilizzati qui potrebbero essere adattati per esprimere i GECI con promotori specifici delle cellule o sensori optogenetici espressi da AAV che potrebbero essere utilizzati per misurare altri parametri come il rilascio di neurotrasmettitori.
Oltre alle dissezioni embrionali primarie e all'imaging confocale, gran parte del protocollo utilizza competenze di laboratorio di base che non richiedono una formazione specializzata. Pertanto, i limiti al modello includono la difficoltà della tecnica di dissezione embrionale, il periodo di tempo in cui le cellule devono essere colturate per raggiungere la maturità e l'accesso a un microscopio confocale, o a un apparato di imaging simile. I numerosi vantaggi e la flessibilità del metodo superano queste limitazioni, rendendo questo un modello ideale per studiare il ruolo di evitotossicità mediata dal glutammato nei disturbi del sistema nervoso. Infine, questo modello potrebbe essere uno strumento efficace per lo screening di nuovi composti per gli effetti anti-apoptotici e la loro capacità di preservare la salute dei neuroni DA.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Supportato da sovvenzioni dell'American Parkinson Disease Association (APDA) e del NIH R01NS115809-01 alla RS. Ringraziamo il Texas A&M Institute for Genomic Medicine (TIGM) per aver fornito topi in gravidanza a tempo per generare colture dopaminergiche primarie.
Materiali
| Name | Company | Catalog Number | Comments |
| 10% Formalin/PBS | VWR | 100496-506 | |
| 10X NA 0.3 water-immersion objective | Olympus | UMPLFLN10XW | |
| 12 mm circular cover glass No. 1 | Phenix Research Products | MS20-121 | |
| 20X NA 0.85 oil-immersion objective | Olympus | UPLSAPO20XO | |
| 35 mm uncoated plastic cell culture dishes | VWR | 25382-348 | |
| 40X NA 0.3 water-immersion objective | Olympus | LUMPLFLN40XW | |
| 60X NA 1.35 oil-immersion objective | Olympus | UPLSAPO60XO | |
| Ampicillin (sodium) | Gold Bio | A-301-25 | |
| B-27 supplement | ThermoFisher | 17504044 | 50x stock |
| Binolcular Microscope | Kent Scientific | KSCXTS-1121 | |
| Bovine serum albumin (BSA) | Sigma-Aldrich | A7030 | |
| Calcium Chloride (CaCl2), anhydrous | Sigma-Aldrich | 746495 | |
| Chicken polyclonal anti-Tyrosine Hydroxylase | Abcam | ab76442 | |
| Deoxyribonuclease I (DNase) | Sigma-Aldrich | DN25 | |
| D-glucose, andydrous | Sigma-Aldrich | RDD016 | |
| DMEM + GlutaMAX medium | ThermoFisher | 10569010 | 500 mL |
| Equine serum | ThermoFisher | 26050088 | heat-inactivated |
| Fiber Optic Illuminator, 100V | Kent Scientific | KSC5410 | |
| Filter System, PES 22UM 250ML | VWR | 28199-764 | |
| Fluoview 1000 confocal microscope | Olympus | ||
| Fluoview 1200 confocal microscope | Olympus | ||
| GlutaMAX supplement | ThermoFisher | 35050061 | |
| Goat polyclonal anti-chicken Alexa Fluor 594 | Abcam | ab150176 | |
| Goat polyclonal anti-rabbit Alexa Fluor 594 | Abcam | ab150077 | |
| Hanks-balanced Salt Solution (HBSS) 1x | ThermoFisher | 14175095 | 500 mL |
| HEPES | VWR | 101170-478 | |
| HeraCell 150 CO2 incubator | Heraeus (ThermoFisher) | ||
| ImageJ v1.52e | NIH | ||
| IRIS-Fine Scissors (Round Type)-S/S Str/31*8mm/13cm | RWD | S12014-13 | |
| Kanamycin monosulfate | Gold Bio | K-120-25 | |
| Laminin | Sigma-Aldrich | L2020 | |
| L-Ascorbic acid | Sigma-Aldrich | A7506 | |
| L-glutamic acid | VWR | 97061-634 | |
| Magnesium Chloride (MgCl2), andydrous | Sigma-Aldrich | M8266 | |
| MPII Mini-Peristaltic Pump, 115/230 VAC, 50/60 Hz | Harvard Apparatus | 70-2027 | |
| MULLER Micro Forceps-Str, 0.15mm Tips, 11cm | RWD | F11014-11 | |
| NBQX | Hello Bio | HB0443 | |
| Neurobasal medium | ThermoFisher | 21103049 | 500 mL |
| Normal goat serum (NGS) | Abcam | ab7481 | |
| Origin 2020 | OriginLab | ||
| pAAV.Syn.GCaMP6f.WPRE.SV40 | Addgene | 100837-AAV1 | Titer: 1.00E+13 gc/ml |
| Papain | Worthington Biomedical Corporation | LS003126 | |
| Penicillin streptomycin | ThermoFisher | 15140122 | 10,000 U/mL |
| Phosphate-buffered saline (PBS) 1x | ThermoFisher | 10010049 | 500 mL |
| Poly-L-lysine | Sigma-Aldrich | P4832 | |
| Poly-L-ornithine | Sigma-Aldrich | P4957 | |
| Potassium Chloride (KCl), anhydrous | Sigma-Aldrich | 746436 | |
| Pump Head Tubing Pieces For MPII | Harvard Apparatus | 55-4148 | |
| Rabbit monoclonal anti-caspase-3 | Abcam | ab32351 | |
| Sodium Chloride (NaCl), anhydrous | Sigma-Aldrich | 746398 | |
| Sucrose | Sigma-Aldrich | S7903 | BioXtra, ≥99.5% (GC) |
| Time-pregnant female C57BL/6 mice | Texas A&M Institue for Genomic Medicine | ||
| Triton X-100 | Sigma-Aldrich | X100 | 500 mL |
| Wide-bore blue pipette tips P1000 | VWR | 83007-380 |
Riferimenti
- Marras, C., et al. Prevalence of Parkinson's disease across North America. NPJ Parkinson's Disease. 4, 21 (2018).
- Poewe, W., et al. Parkinson disease. Nature Reviews Disease Primers. 3, 17013 (2017).
- Mehta, A., Prabhakar, M., Kumar, P., Deshmukh, R., Sharma, P. L. Excitotoxicity: bridge to various triggers in neurodegenerative disorders. European Journal of Pharmacology. 698 (1-3), 6-18 (2013).
- Ambrosi, G., Cerri, S., Blandini, F. A further update on the role of excitotoxicity in the pathogenesis of Parkinson's disease. Journal of Neural Transmission (Vienna). 121 (8), 849-859 (2014).
- Dong, X. X., Wang, Y., Qin, Z. H. Molecular mechanisms of excitotoxicity and their relevance to pathogenesis of neurodegenerative diseases. Acta Pharmaceutica Sinica B. 30 (4), 379-387 (2009).
- Vieira, M., et al. Excitotoxicity through Ca2+-permeable AMPA receptors requires Ca2+-dependent JNK activation. Neurobiology of Disease. 40 (3), 645-655 (2010).
- Sebe, J. Y., et al. Ca(2+)-Permeable AMPARs Mediate Glutamatergic Transmission and Excitotoxic Damage at the Hair Cell Ribbon Synapse. Journal of Neuroscience. 37 (25), 6162-6175 (2017).
- Brickley, S. G., Farrant, M., Swanson, G. T., Cull-Candy, S. G. CNQX increases GABA-mediated synaptic transmission in the cerebellum by an AMPA/kainate receptor-independent mechanism. Neuropharmacology. 41 (6), 730-736 (2001).
- Srinivasan, R., et al. Smoking-Relevant Nicotine Concentration Attenuates the Unfolded Protein Response in Dopaminergic Neurons. Journal of Neuroscience. 36 (1), 65-79 (2016).
- Henley, B. M., et al. Reliable Identification of Living Dopaminergic Neurons in Midbrain Cultures Using RNA Sequencing and TH-promoter-driven eGFP Expression. Journal of Visualized Experiments. (120), e54981 (2017).
- Douhou, A., Troadec, J. D., Ruberg, M., Raisman-Vozari, R., Michel, P. P. Survival promotion of mesencephalic dopaminergic neurons by depolarizing concentrations of K+ requires concurrent inactivation of NMDA or AMPA/kainate receptors. Journal of Neurochemistry. 78 (1), 163-174 (2001).
- Lavaur, J., et al. The noble gas xenon provides protection and trophic stimulation to midbrain dopamine neurons. Journal of Neurochemistry. 142 (1), 14-28 (2017).
- Kritis, A. A., Stamoula, E. G., Paniskaki, K. A., Vavilis, T. D. Researching glutamate - induced cytotoxicity in different cell lines: a comparative/collective analysis/study. Frontiers in Cellular Neuroscience. 9, 91 (2015).
- Gupta, K., Hardingham, G. E., Chandran, S. NMDA receptor-dependent glutamate excitotoxicity in human embryonic stem cell-derived neurons. Neuroscience Letters. 543, 95-100 (2013).
- Surmeier, D. J., Obeso, J. A., Halliday, G. M. Selective neuronal vulnerability in Parkinson disease. Nature Reviews Neuroscience. 18 (2), 101-113 (2017).
- Ramirez, J. M., Tryba, A. K., Pena, F. Pacemaker neurons and neuronal networks: an integrative view. Current Opinion in Neurobiology. 14 (6), 665-674 (2004).
- Guzman, J. N., Sanchez-Padilla, J., Chan, C. S., Surmeier, D. J. Robust pacemaking in substantia nigra dopaminergic neurons. Journal of Neuroscience. 29 (35), 11011-11019 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon