A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
بلانكوري Scrunching كما قراءات سلوكية كمية لتحسس المحفزات الضارة
In This Article
Summary
يحمل المُعَلِّقون في المياه العذبة ثلاث مشيات (مزلق، و peristalsis، وscrunching) يمكن تمييزها من خلال التحليل السلوكي الكمي. نحن وصف طريقة للحث على scrunching باستخدام مختلف المحفزات الضارة، وتحديد كم من ذلك، والتمييز من ال peristalsis وتزلق. باستخدام ضرب الجينات ، ونحن نبين خصوصية scrunching كمي phenotypic القراءة.
Abstract
تنزلق عادة ً ألواح المياه العذبة بسلاسة من خلال الدفع الإستهوي على جانبها البطني. ومع ذلك، يمكن أن تحفز بعض الظروف البيئية أشكال الحركة التي يحركها العضلات: التملق أو التحلل. بينما ينتج ال peristalsis عن عيب ciliary، scrunching مستقل عن وظيفة أهداب وهو استجابة محددة لبعض المحفزات، بما في ذلك بتر، درجة الحرارة الضارة، درجة الحرارة القصوى، والإيثانول. وهكذا، فإن هاتين المشيتين اللتين يحركهما الالعضلات متميزة بشكل ميكانيكي. ومع ذلك، قد يكون من الصعب التمييز بين نوعي. هنا، ونحن نقدم بروتوكولا لتحفيز scrunching باستخدام مختلف المحفزات الفيزيائية والكيميائية. نحن تفاصيل التوصيف الكمي من scrunching، والتي يمكن استخدامها لتمييزه عن ال peristalsis وتزلق، وذلك باستخدام البرمجيات المتاحة بحرية. منذ scrunching هو مشية شاملة بلاناية، وإن كان مع اختلافات مميزة الأنواع محددة، يمكن تطبيق هذا البروتوكول على نطاق واسع لجميع أنواع من planarians، عند استخدام الاعتبارات المناسبة. لإثبات ذلك، قارنا استجابة النوعين الأكثر شعبية في البحوث السلوكية، دوديسيا جابونيكا وميتميديرانيا، إلى نفس المجموعة من المحفزات الفيزيائية والكيميائية. وعلاوة على ذلك، فإن خصوصية scrunching يسمح هذا البروتوكول لاستخدامها جنبا إلى جنب مع تدخل الحمض النووي الريبي و / أو التعرض الدوائية لتشريح الأهداف الجزيئية والدوائر العصبية المعنية، مما يحتمل أن يوفر رؤية ميكانيكية في الجوانب الهامة من nociception والاتصالات العصبية العضلية.
Introduction
بالإضافة إلى شعبيتها لابحاث الخلايا الجذعية وتجديد1,2,3, وقد استخدمت منذ فترة طويلة في الدراسات السلوكية4,5,الاستفادة من حجمها الكبير نسبيا (بضعة ملليمترات في الطول), سهولة وانخفاض تكلفة صيانة المختبر, وطيف واسع من السلوكيات الملاحظة. وقد مكنت مقدمة من رؤية الكمبيوتر وتتبع الآلي لدراسات السلوك6،7،8،9،10،11 التمايز الكمي من الأنماط الظاهرية السلوكية. سلوك الحيوان هو قراءات مباشرة من وظيفة الخلايا العصبية. لأن الجهاز العصبي غير المتوسط الحجم والتعقيد، ولكن أسهم العناصر الأساسية المحفوظة مع الدماغ الفقارية12،13،14، يمكن لدراسة السلوك بلانيوار توفير نظرة ثاقبة آليات الحفاظ على العمل العصبي الذي قد يكون من الصعب التحقيق مباشرة في الكائنات الحية أكثر تعقيدا. وهكذا، فإن البوليين نموذج قيم للدراسات البيولوجية العصبية المقارنة8،12،15،16،17،18،19،20،21. بالإضافة إلى ذلك، تسمح البيئة المائية بالتعرض السريع والواه للمواد الكيميائية لدراسة تأثيرها على وظيفة المخ في التجديد و 26 من الكائنات الخبيثة في مجال تجديد الخلايا السنية، مما يجعلها نظامًا شائعًا في علم السموم العصبية22،23،24،25،26.
يمتلك المواحنون ثلاث مشيات متميزة ، يشار إليها باسم الانزلاق ، وال peristalsis ، وscrunching. كل مشية يتم عرضها في ظروف محددة: مزلق هو مشية الافتراضي, peristalsis يحدث عندما يتم اختراق وظيفة ciliary7,27, وscrunching هو مشية الهروب – مستقلة عن وظيفة أهداب – ردا على بعض المحفزات الضارة7. لقد أظهرنا أن scrunching هو استجابة محددة ، التي أثارها الإحساس ببعض الإشارات الكيميائية أو الفيزيائية ، بما في ذلك درجات الحرارة القصوى أو درجة الحرارة ، والإصابة الميكانيكية ، أو محرضات كيميائية محددة ، وبالتالي ليست استجابة عامة للإجهاد7،28،29.
بسبب خصوصيته والمعلمات النمطية، والتي يمكن بسهولة كميا باستخدام هذا البروتوكول، scrunching هو نمط ظاهري السلوكية القوية التي تمكن الباحثين من إجراء دراسات ميكانيكية تشريح المسارات الحسية والسيطرة العصبية من السلوك25،28. بالإضافة إلى ذلك ، وقد تبين أن scrunching نقطة نهاية حساسة لمجرا الآثار الكيميائية الضارة على تطوير الجهاز العصبي وظيفة في دراسات السمومالعصبية 22،24،25،30. كما يبدو عدة مسارات حسية مختلفة للالتقاء للحث على scrunching من خلال آليات مختلفة28, scrunching يختلف عن السلوكيات الأخرى االحلاني لأن مختلف, ولكن محددة, يمكن استخدام المحفزات لتشريح الدوائر العصبية متميزة ودراسة كيفية دمج إشارات مختلفة لإنتاج النمط الظاهري scrunching.
والأهم من ذلك، توجد اختلافات في الأنواع، حيث قد تثير مادة كيميائية واحدة التشوّر في نوع واحد من الأنواع القارّة، ولكن استجابة سلوكية مختلفة في نوع آخر. على سبيل المثال، وجدنا أن anandamide يحفز scrunching في الأنواع بلانكاري Dugesia japonica ولكن يدفع peristalsis في شميدتيا mediterranea28. يسلط هذا المثال الضوء على أهمية القدرة على التمييز بشكل موثوق بين المشي المختلفة ، لأنها هي المظاهر الظاهرية للآليات الجزيئية المتميزة. ومع ذلك ، فإن التمييز بين الزخرف من ال peristalsis صعب استخدام بيانات الرصد النوعي ، لأن كلا المشية يحركها العضلات وتشترك في أوجه التشابه النوعي7،28. وهكذا، للتمييز بين المشي فمن الضروري إجراء التصوير أهداب أو دراسة سلوكية كمية، والتي تسمح التمييز على أساس المعلمات المميزة7،,28. لأن التصوير أهداب تحديا تجريبيا ويتطلب معدات متخصصة مثل المجهر المركب عالية التكبير وكاميرا عالية السرعة7,28, فإنه ليس في متناول الباحثين على نطاق واسع كما التحليل السلوكي الكمي.
هنا، نقدم بروتوكول لـ (1) تحريض scrunching باستخدام مختلف المادية (درجة الحرارة الضارة، بتر، الأشعة فوق البنفسجية الخفيفة) والكيميائية (الأليل isothiocyanate (AITC)، cinnamaldehyde) المحفزات و (2) التحليل الكمي للسلوك البلاناري باستخدام البرمجيات المتاحة بحرية. من خلال قياس أربعة معلمات (تردد تذبذبات طول الجسم ، والسرعة النسبية ، والحد الأقصى للسعة ، وعدم التماثل في اطالة الجسم والانكماش)7، يمكن تمييز scrunching عن الانزلاق ، وال peristalsis ، والدول السلوكية الأخرى المبلغ عنها في الأدب ، مثل التزحلق الشبيه بالثعبان15 أو الصرع15. وعلاوة على ذلك، في حين يتم حفظ scrunching بين الأنواع المختلفة7،كل نوع له ترددها وسرعتها المميزة الخاصة بها. لذلك، مرة واحدة تم تحديد السرعات مزلق وscrunching من الأنواع، يمكن استخدام السرعة وحدها كوسيلة للتمييز scrunching من الانزلاق وsing29. لا يفترض البروتوكول أي تدريب مسبق على تحليل الصور الحسابية أو الدراسات السلوكية وبالتالي يمكن تطبيقها أيضًا على التجارب السلوكية التخطيطية في سياق مختبري تعليمي على مستوى البكالوريوس. وتقدم بيانات المثال لتيسير تكييف البروتوكول في المادة التكميلية.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. كمية تحليل السلوك ا
- الإعداد التجريبي
- ضع لوحة LED قابلة للتهياء على سطح مستو. تخدم لوحة LED غرضين: (1) لتوفير خلفية بيضاء موحدة و (2) لاستخدامها كمصدر للضوء قابل للتعديل للحصول على التباين المناسب. ضع ساحة طبق بيتري مقاس 100 مم على لوحة LED.
ملاحظة: لزيادة الإنتاجية، يمكن استخدام لوحة متعددة جيدا كساحة23،24، ولكن أكبر الساحات تسهيل تحليل الصور الآلي. - جبل كاميرا على موقف حلقة فوق الساحة (الشكل 1A). ضبط موقف الكاميرا، وارتفاع، والتركيز حسب الضرورة بحيث يتم تمركز الساحة بأكملها داخل مجال الرؤية وفي التركيز(الشكل 1B).
ملاحظة: يجب أن تكون دقة الكاميرا عالية بما يكفي لتمييز بين بين الـ planarian بوضوح والخلفية المتجانسة التي توفرها لوحة LED. - ملء الساحة مع وسائل الإعلام التعرض المناسبة (مياه غير مُنطّة أو محلول كيميائي) إلى نصف الحد الأقصى لحجم (وسوف يشار إلى هذا باسم حمام). وهذا يتوافق مع ما يقرب من 25 مل لطبق بيتري 100 ملم. قم بتشغيل لوحة LED وإيقاف أي مصادر ضوئية أخرى قد تؤثر سلبًا على جودة التسجيل (أي مصادر الضوء القريبة التي تنتج وهجًا على الساحة).
تنبيه: إدارة الحلول الكيميائية الخطرة بشكل مناسب من خلال ارتداء معدات الحماية الشخصية الكاملة (PPE) ونقل الإعداد التجريبي إلى غطاء أبخرة إذا لزم الأمر. اتباع اللوائح الاتحادية ولوائح الولايات بشأن التخلص من النفايات. - إسقاط بلاناريان نحو وسط الساحة باستخدام ماصة نقل. ابدأ التسجيل. تسجيل البيانات كتسلسلات صور بتنسيق Fiji31 الأصلي (TIFF، GIF، JPEG، PNG، DICOM، BMP، PGM، أو FITSات؛ راجع قسم تحليل الصور 1.2).
ملاحظة: لأن السلوكيات والحساسية للمحفزات الخارجية تختلف بين البهلامينيين الفردية، من المهم جمع البيانات حول عدد كبير بما فيه الكفاية من النسخ المتماثلة البيولوجية، بالإضافة إلى إجراء النسخ المتماثلة التقنية. لقد عملنا مع ما يصل إلى 10 متوسطة الحجم (4-7 مم) في طبق بيتري 100 ملم في وقت واحد. في حين أن الوقت الفعال ، فإن تعدد الارياريين في طبق بيتري في وقت واحد يجعل تحليل البيانات أكثر صعوبة لأن الـ planarians قد يعبر المسارات.- بالنسبة لتجارب الانزلاق، سجل باستخدام إطار على الأقل في الثانية (FPS). بالنسبة للتجارب الزخرف/ال peristalsis، سجل باستخدام FPS التي لا تقل عن ضعف تردد scrunching/peristalsis من الأنواع البينارية. إذا كان النوع من الأجناس غير معروف تردد scrunching /peristalsis، استخدم 10 FPS كنقطة انطلاق وزيادة / نقصان حسب الاقتضاء.
- عند استخدام محلول كيميائي، نقل الـ planarian باستخدام أقل عدد ممكن من قطرات الماء الياكيميائي بحيث لا يتغير تركيز المحلل الكيميائي بشكل كبير.
- بالنسبة لتجارب الانزلاق، سجل 1-2 دقيقة من سلوك الانزلاق. للتجارب scrunching /peristalsis، سجل فترة طويلة بما يكفي لالتقاط ما لا يقل عن 3 تذبذبات متتالية تحدث في خط مستقيم. بمجرد الانتهاء من التجربة، قم بإنهاء التسجيل.
ملاحظة: للتجارب scrunching/peristalsis، إذا لم يف planarian معيار الإنهاء خلال فترة زمنية ثابتة التي يجب أن تكون متناسقة عبر replicates ويتم تحديد تجريبياً استناداً إلى التحفيز، إنهاء التسجيل واختبار غير ذلك.- إذا وصل الم planarian إلى حدود الساحة دون تلبية معيار الإنهاء ، فإن الماصة تعود إلى مركز الساحة.
ملاحظة: تجنب القذف المتكرر لفرد ما للتسجيل، لأن هذا قد يغير سلوكه.
- إذا وصل الم planarian إلى حدود الساحة دون تلبية معيار الإنهاء ، فإن الماصة تعود إلى مركز الساحة.
- إزالة (ق) من الألواح النووية والتخلص من المياه أو محلول كيميائي في حاويات النفايات المناسبة. يمكن إعادة الـ"بلاناريوس" الذين كانوا في المياه الـ"بلاناريوس" إلى حاوية منازلهم.
ملاحظة: تجنب التلوث عبر استخدام ساحات مختلفة لوسائل الإعلام المختلفة (أي، لا ينبغي أن يتم تشغيل الانزلاق في تجارب المياه غير المرتبطة في ساحة تستخدم سابقا للتجارب scrunching /peristalsis مع التعرض للمواد الكيميائية).- شطف المسلسل planarians يتعرض لمحلول كيميائي في 3 نظيفة 100 ملم أطباق بيتري مليئة 25 مل من المياه بلاناري لتخفيف تماما من أي مواد كيميائية. إذا تم حث الزخرف أو ال peristalsis، ضع هذه الـ planarians في حاوية منفصلة. يمكن أن تعاد إلى الحاويات ا لابلاطن بعد شهر واحد منذ معظم الخلايا قد تحولت بحلول ذلك الوقت1.
ملاحظة: إذا كانت هناك حاجة إلى تجارب مختلفة متعددة لنفس السكان من المُقبلين، على سبيل المثال، بالنسبة للسكان من الـ RNAi، فسمحوا للـ 24 ساعة بالتعافي قبل إجراء التجربة التالية. ترتيب التجارب بحيث التجربة الأقل توغلا هو الأول والتجربة الأكثر الغازية (على سبيل المثال، بتر) يتم تشغيل الماضي. - إذا كان تشغيل تجارب متعددة في نفس الساحة، والتخلص بشكل صحيح من حل الحمام وإزالة أي مسارات المخاط عن طريق مسح أسفل الساحة مع منشفة ورقية بين أشواط.
ملاحظة: يمكن أن يكون مؤقتاً البروتوكول هنا.
- شطف المسلسل planarians يتعرض لمحلول كيميائي في 3 نظيفة 100 ملم أطباق بيتري مليئة 25 مل من المياه بلاناري لتخفيف تماما من أي مواد كيميائية. إذا تم حث الزخرف أو ال peristalsis، ضع هذه الـ planarians في حاوية منفصلة. يمكن أن تعاد إلى الحاويات ا لابلاطن بعد شهر واحد منذ معظم الخلايا قد تحولت بحلول ذلك الوقت1.
- ضع لوحة LED قابلة للتهياء على سطح مستو. تخدم لوحة LED غرضين: (1) لتوفير خلفية بيضاء موحدة و (2) لاستخدامها كمصدر للضوء قابل للتعديل للحصول على التباين المناسب. ضع ساحة طبق بيتري مقاس 100 مم على لوحة LED.
- التحليل الكمي للسلوك اليافع
- تنفيذ عمليات الفحص السلوكية كما هو موضح في القسم 1.1.
- افتح تسلسل الصورة الأولية لتجربة في فيجي (ملف > استيراد > تسلسل الصورة) وحدد الصورة الأولى في تسلسل الصورة. في إطار خيارات التسلسل، حدد المربع لـ "فرز الأسماء رقمياً" وانقر فوق "موافق". بمجرد تحميل تسلسل الصورة في، تحويل تسلسل الصورة إلى 8 بت(صورة > اكتب> 8 بت)واستخدام أداة السهم أو المنزلق في الجزء السفلي من كومة الصورة لمشاهدة أو تحريك من خلال تسلسل الصورة.
ملاحظة: بالنسبة لتجارب الانزلاق، يمكن استخدام كافة البيانات طالما يمكن رؤية الـ planarian بوضوح خلال التسجيل. ومع ذلك، فإنه عادة ما يكفي لتحليل الحركة الحرة في وسط الساحة عن طريق استخراج الجزء (ق) ذات الصلة على النحو المبين أدناه. - لاستخراج فترة زمنية ومنطقة ذات أهمية، رسم منطقة ذات فائدة تشمل المسار الكامل لبلاناري باستخدام أداة المستطيل(الشكل 2A, 2B). انقر بزر الماوس الأيمن على كومة الصور وحدد تكرار...، حدد مربع المكدس المكررة،أدخل الإطارات الأولى والأخيرة من تسلسل الاهتمام، وانقر فوق موافق. إذا تم تصوير العديد من الـ planarians في وقت واحد ، كرر هذه الخطوة من اختيار المنطقة والازدواجية لكل بلانتاري في الساحة بحيث يكون هناك العديد من أكوام الصور المفتوحة كما هناك من الاريانيين في الساحة. يجب تنفيذ الخطوات التالية (الخطوات 1.2.4-1.2.10) على كل مكدس الصور، كل مرة.
- لتجارب مزلق، استخراج فترة من مزلق حيث يتحرك بلاناني على الأقل ضعف طول الجسم.
ملاحظة: كلما تم استخراج بيانات مزلقة أكثر لكل من غير مُنَقَدٍ، كلما كانت البيانات أكثر موثوقية. لا يحتاج المُنطَرِي أن يتحرك في خط مستقيم لتحليل الانزلاق. - للتجارب scrunching / peristalsis، استخراج مثيل عندما يخضع لا يقل عن ثلاثة تذبذبات الجسم متتالية (أكثر) متتالية (من الناحية المثالية) في خط مستقيم، والتأكد من كل تذبذب هو دورة كاملة استطالة انكماش، كما التذبذبات الكاملة ضرورية لتحديد بدقة التردد.
ملاحظة: كلما كان هناك المزيد من التذبذبات التي يمكن استخراجها، كلما كانت البيانات أكثر موثوقية. لا تستخدم تسلسل حيث يتم تشغيل االنطانين كما سيؤدي إلى هذه القياسات طول غير دقيقة.
- لتجارب مزلق، استخراج فترة من مزلق حيث يتحرك بلاناني على الأقل ضعف طول الجسم.
- تطبيق عتبة على كومة الصور المكررة(صورة > ضبط > عتبة) لbinarize الصورة واستخراج من الخلفية. ضبط أشرطة انزلاق حسب الضرورة بحيث يتم تسليط الضوء على بلاناريان بأكمله باللون الأحمر. تعتمد القيم الدقيقة على جودة التصوير. اترك المربعات للخلفية الداكنة، والمكوّن التكراري المكدس، ولا تقم بإعادة تعيين النطاق دون تحديد. قم بالتمرير عبر مكدس الصور لضمان نطاق عتبة جيد (أي أن الـ planarian منفصل تمامًا عن الخلفية خلال المكدس) ، ثم انقر فوق تطبيق.
- في إطار تحويل المكدس إلى ثنائي تعيين الأسلوب إلى الافتراضي والخلفية إلى الضوء. قم بإلغاء تحديد كافة المربعات في هذا الإطار ثم انقر فوق موافق. ستظهر صورة مُنَطَبة تُظهر بلانايان أسود على خلفية بيضاء (الشكل 2C). تأكد من أن planarian كامل مرئيا في جميع إطارات تسلسل الصورة.
ملاحظة: يمكن تصفية الكائنات غير المرغوب فيها في تسلسل الصور binarized أصغر أو أكبر من اا لايناري في التحليل اللاحق باستخدام عامل تصفية الحجم(الشكل 2Ciii). - تعيين القياسات بالنقر فوق تحليل > تعيين القياسات. حدد المربعات الخاصة بمساحة، مركز كتلة، موضع المكدس، وتناسب القطع الناقص ثم انقر فوق موافق.
ملاحظة: هذه المعلمات تحتاج فقط إلى تعيين مرة واحدة لكل جلسة عمل فيجي. - حدد كومة الصور المفتوحة وحدد تحليل > تحليل الجسيمات.
- في نافذة تحليل الجسيمات، حدد إظهار > أقنعة لفتح رصة جديدة تعرض كافة الكائنات التي تم اكتشافها باستخدام المعلمات المختارة. ويمكن استخدام هذا للتحقق بصريا من أن يتم اتخاذ قياسات فقط من ا. بلانكاري. قد يتم تعيين عامل تصفية حجم في هذه الخطوة لإزالة الضوضاء غير المرغوب فيها عن طريق إدخال المساحة التقريبية من 2-2 بكسل في المساحة المتوفرة. حدد المربعات لعرض النتائج ومسح النتائج ثم انقر فوق موافق.
ملاحظة: في الإطار نتائج إذا الفهرس (العمود الأول) لا يساوي رقم شريحة لكافة الصفوف، هذا يعني أن كائنات كثيرة جداً أو عدد قليل جداً تم تعقب. أحد الاحتمالات لهذا التناقض هو وجود كائنات أخرى إلى جانب الـ planarian أو أن الـ planarian لم يتم تعقبه في إطارات محددة. - حرك خلال كومة صورة القناع باستخدام شريط التمرير الموجود في الجزء السفلي من اللوحة. إذا كان هناك أي ضجيج أو هناك إطارات تفتقر إلى قنينة، أغلق إطار النتائج و كومة صورة القناع. كرر الخطوات 1.2.7-1.2.8 بواسطة ضبط عامل تصفية المنطقة لإزالة الكائنات الأخرى غير الـ planarian فقط.
ملاحظة: إذا كان planarian مفقود من الإطار في القناع، هذا يشير إلى أن الحد الأدنى من عامل تصفية المنطقة تم تعيين عالية جداً. - في نافذة النتائج، احفظ البيانات باستخدام ملف>حفظ باسم. إضافة ملحق .csv إلى اسم الملف لحفظ البيانات كقيم مفصولة بفواصل. بمجرد حفظ البيانات الخاصة بكدسة الصور، أغلق مكدس الصور المعني، والنوافذ النتائج والقناع.
- استيراد البيانات وتحليل مزيد من استخدام أي برنامج جداول البيانات أو البرامج المجانية. لحساب سرعة مزلق، راجع المقطع 1.3. لحساب مجموعة المعلمة الكاملة scrunching/peristalsis، راجع المقطع 1.4.
ملاحظة: يمكن أن يكون مؤقتاً البروتوكول هنا. - لتحديد تحويل البكسل إلى طول فعلي، افتح صورة في فيجي مع طول مرجعي (على سبيل المثال، قطر الحلبة). حدد أداة السطر وارسم خطًا فوق الطول المعروف.
- قم بتحويل وحدات البكسل إلى وحدة قياسية من الطول بالنقر فوق تحليل > تعيين مقياس. أدخل الطول المطابق للخط المرسوم على الصورة في مربع المسافة المعروفة ثم قم بتغيير وحدة الطول من البكسل إلى الوحدة القياسية المختارة للطول. تتم كتابة عامل التحويل بجوار مقياس.
ملاحظة: قيمة تحويل بكسل غير مطلوبة من أجل مزلق أو تحليل scrunching/peristalsis في المقاطع 1.3 و 1.4.
- حساب سرعة مزلق
- باستخدام ملف البيانات المحفوظة في المقطع 1.2 تحميل مركز إحداثيات x و ص الكتلة و البيانات المحور الرئيسي. إذا تم حفظ البيانات كملف قيم مفصولة بفواصل، تتوافق هذه القوائم مع الأعمدة "XM" و "YM" و "الرئيسية" على التوالي.
- حساب إزاحة (د) من مركز كتلة في البكسل لكل إطار فيما يتعلق الإطار التالي باستخدام أعمدة البيانات "XM" و "YM". 10- التشريد (د) يُعطى من خلال:
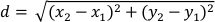
حيث x1 و y1 تشير إلى إحداثيات COM (XM، YM) من إطار واحد و X2 و y2 الرجوع إلى إحداثيات COM (XM، YM) من الإطار اللاحقة. - تعيين طول الجسم االشاطئي كما95 th th في العمود "الرئيسية". منذ planarians يحمل سلوك تفضيل الجدار32، وهذا يضمن أن طول الجسم االنطان محسوب هو ممثل عندما يتم ممدود24.
- تطبيع النزوح بطول الجسم من خلال تقسيم التشريد بكسل في الإطار من قبل طول الجسم االبلانية (ل). يتم إعطاء النزوح تطبيع (دن) من قبل:
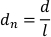
- إنشاء قائمة بالسرعات المُطَوَّلة عن طريق قسمة عمليات الترحيل التي تم تسويتها على الوقت المنقضي لكل إطار (عكس FPS المسجل). يتم إعطاء سرعة مزلق تطبيع (قن) من قبل:
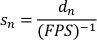
- حساب سرعة مزلق تطبيع من اصطناع من خلال اتخاذ متوسط من قائمة السرعات تطبيع (قن). ويمكن استخدام الانحراف المعياري كمقياس لعدم اليقين بالنسبة للمخطّط.
- كرر الخطوات 1.3.1-1.3.6 لكل بلاناري لتحليلها. متوسط واتخاذ الانحراف المعياري للسرعات مزلق لجميع planarians للحصول على سرعة مزلق وما يرتبط بها من عدم اليقين ، على التوالي ، للسكان بلانايين.
- تمييز من scrunching وs peristalsis مشيا باستخدام مجموعة المعلمة الكاملة
- تحميل قائمة بيانات المحور الرئيسي من ملف البيانات المحفوظة من 2.1 المقطع. إذا تم حفظ البيانات كملف قيم مفصولة بفاصلة، فإن هذا يتوافق مع العمود الرئيسي.
- إنشاء قائمة تقوم بـرد كل نقطة بيانات في العمود الرئيسي، بدءاً من 0. تحويل هذه القائمة إلى الوقت المنقضي في إطار عن طريق قسمة على FPS المسجلة.
- رسم بيانات العمود الرئيسي فيما يتعلق بالوقت المنقضي لتوليد مؤامرة التذبذب scrunching / peristalsis (الشكل 3A). باستخدام مؤامرة التذبذب، تقليم البيانات إلى ما لا يقل عن ثلاثة متتالية، والتذبذبات خط مستقيم (الشكل 3Bi). تقليم البيانات لبدء وتنتهي عند قمم المحلية (الحد الأقصى للارطالة من التذبذب) أو أحواض (الحد الأدنى من الاستطالة من التذبذب).
ملاحظة: إذا لم تكن extrema المحلية متساوية تقريبا (القمم / أحواض تختلف بشكل كبير في الارتفاعات)، وهذا يشير إلى أن التذبذبات ليست خط مستقيم(الشكل 3Bii). استخراج تسلسل آخر من ثلاثة على الأقل متتالية، التذبذبات خط مستقيم. راجع القسم 1.2. - تأكد من أن تسلسل التذبذب من الفائدة قد تم استخراجها وتقليمها بشكل صحيح عن طريق إعادة تجميع البيانات الرئيسية المقصوصة فيما يتعلق بالوقت. استخدم قائمة البيانات المقتطعة هذه لكافة الحسابات اللاحقة.
- لحساب تردد التذبذب (νm)، قسمة عدد التذبذبات (On) على العدد الإجمالي لنقاط البيانات في قائمة بيانات المحور الرئيسي المشذبة (N). ضرب FPS بهذه القيمة للحصول على التردد في التذبذبات في الثانية الواحدة.
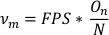
- لحساب أقصى اطالة (|Δε| الحد الأقصى)، وطرح الحد الأدنى المطلق طول الجسم (لدقيقة) من أقصى طول الجسم المطلق (لالحد الأقصى). تطبيع لطول الجسم ممدود من قبل قسمة على طول الجسم الأقصى المطلق.
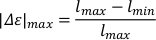
- لحساب السرعة لكل طول الجسم (v*m) ، ضرب الحد الأقصى المُحسَن من الاستطالة بتردد التذبذب.
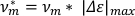
ملاحظة: يمكن استخدام السرعة وحدها للتمييز بين الهرولة وsalsissgaits 7. - لحساب جزء من الوقت المستغرق في ممدود (fألونغ)، خذ مشتقة قائمة بيانات المحور الرئيسي المشذبة فيما يتعلق بالوقت. تقسيم عدد نقاط البيانات الموجبة (أي عندما تكون المشتقة >0 (np)، على العدد الإجمالي لنقاط البيانات في قائمة بيانات المحور الرئيسي (nt)).
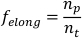
ملاحظة: السكانشنج planarians المعرض جزء غير متماثل من الوقت الذي يقضيه ممدود في حين أن الـ planarians أداء peristalsis تنفق كميات متساوية من الوقت الممدود والتعاقد7. - كرر الخطوات 1.4.1-1.4.8 لكل بلاناريان ليتم تحليلها. حساب معلمة سكانية اُعدّت بأخذ الانحراف المعياري والمتوسط لكل معلمة.
ملاحظة: يمكن استخدام مجموعة المعلمة لتحديد ما إذا كان سلوك التذبذب هو scrunching أو peristalsis أو بعض أشكال أخرى من الحركة مع تغييرات شكل الجسم الدوري. كل من scrunching و peristalsis لها معلمات ثابتة لأنواع معينة7، مع المعلمات scrunching عموما أكبر من المعلمات7. في حين أنه من الممكن أن واحدة من المعلمات قد تقع خارج نطاق الأنواع المحددة، كما لاحظنا سابقا مع التعريفي الكيميائي28،يجب أن يتفق السلوك الملاحظ مع ما لا يقل عن 3 من 4 المعلمات المنشورة ليتم تصنيفها إما الصدف أو scrunching.
2. Scrunching التعريفي
- المحفزات الفيزيائية (درجة الحرارة الضارة، ضوء الأشعة فوق البنفسجية، البتر)
- بالنسبة لجميع تجارب المحفزات الفيزيائية، راجع القسم 1.1 للإعداد التجريبي.
ملاحظة: من الأفضل استخدام ساحة كبيرة، مثل طبق بيتري 100 مم، لإجراء تجارب تحفيزية مادية للسماح بمساحة أكثر مفتوحة للمناورة على ماصة و/أو شفرة حلاقة. - للحث على scrunching عبر درجة الحرارة الضارة، والحرارة المياه البلاونية في كوب زجاجي (ما لا يقل عن 100 ميكرولتر لكل بلانكاري ليتم اختبارها) إلى 65 درجة مئوية على لوحة ساخنة.
- وضع بلانكاري في وسط الساحة. انتظر حتى يوجه الموالتر نفسه منتصبا ويبدأ مزلق. ابدأ التسجيل.
- باستخدام ماصة P-200، ماصة ببطء 100 ميكرولتر من 65 درجة مئوية مياه األبلارية بعد البلعوم على نهاية ذيل البلاناري للحث على scrunching.
ملاحظة: تأكد من أن الماء المُدفأ يبقى عند درجة حرارة 65 درجة مئوية. إذا لزم الأمر، قم بإعادة تسخين الماء إلى 65 درجة مئوية قبل بدء تجربة أخرى. منذ الضغط يمكن أن تحفز أيضا scrunching، pipetting بطيئة أمر ضروري. يمكن أن تكون مياه درجة حرارة الغرفة الأنابيب بنفس الطريقة كما في التجربة بمثابة خيار التحكم والممارسة. - إيقاف التسجيل بمجرد توقف scrunching. وضع planarian في وعاء الانتعاش وتبادل وسائل الإعلام في طبق بتري مع الطازجة، ودرجة حرارة الغرفة المياه بلاناري إذا تشغيل المزيد من التجارب.
- للحث على scrunching عن طريق البتر، ونقل بلاناريان إلى وسط الساحة والانتظار حتى يوجه نفسه منتصبا ويبدأ مزلق. ابدأ التسجيل.
- بتري الـ(بلانار) باستخدام شفرة حلاقة نظيفة ويمكن أن تتم عمليات البتر في أي مكان على طول planarian طالما أن موقع قطع متناسقة عبر التجارب.
ملاحظة: يتم استخراج معلمات Scrunching من القطعة الأمامية. وهكذا ، تجنب عرقلة عرض الكاميرا لهذا الجزء من البلاناري عند تطبيق خفض من خلال الاقتراب من النهاية الخلفية. كما تعمل زلات الغطاء البلاستيكي بشكل جيد للقطع وهي خيار أكثر أمانًا ، خاصة في بيئة التدريس. - وقف التسجيل مرة واحدة في الجزء الأمامي قد توقفت scrunching. إزالة كل قطعة، ووضعها في حاوية منفصلة والسماح لهم لتجديد لمدة 7 أيام. يمكن إعادة دمج المبترتين في حاوية المنزل بمجرد تجديدها.
- بتري الـ(بلانار) باستخدام شفرة حلاقة نظيفة ويمكن أن تتم عمليات البتر في أي مكان على طول planarian طالما أن موقع قطع متناسقة عبر التجارب.
- للحث على scrunching باستخدام الأشعة فوق البنفسجية القريبة، إرفاق مرشحات مناسبة (على سبيل المثال، مرشحات روسكولوكس) لعدسة الكاميرا للحد من كمية الضوء القريب من الأشعة فوق البنفسجية المنعكة التي يتم جمعها بواسطة الكاميرا، وقد تتداخل مع تصوير استجابة بلاناريان. بدلا من استخدام لوحة LED لإلقاء الضوء على الساحة من الأسفل، واستخدام الإضاءة الحمراء المحيطة التي لا تحسس33.
- ملء ساحة طبق بيتري 100 ملم مع المياه بلاناري ووضع planarian واحد (5-9 ملم) في وسط الساحة. ابدأ التسجيل عند 10 FPS.
- عقد مؤشر ليزر الأشعة فوق البنفسجية من الدرجة الثانية (405 ± 10 نانومتر, انتاج الطاقة <5 ميغاواط) ما يقرب من 30 سم من الساحة. ضع مؤشر الليزر في زاوية 45 درجة من البلاناري المزلق ثم يلمع مؤشر الليزر لمدة 5-10 ثوان في منتصف الطريق بين الطرف الخلفي من البلعوم وطرف الذيل للحث على scrunching.
ملاحظة: يمكن قياس قوة مؤشر الليزر باستخدام مقياس طاقة حساس للأشعة فوق البنفسجية. - انتظر لالبليان لبدء الانزلاق مرة أخرى قبل محاولة اثنين من أكثر التحفيز على نفس الفرد لاختبار لإعادة إنتاج رد الفعل. إذا استمر المُنطَرِي في إظهار نفس السلوك، فتوقف عن التسجيل ووضع المُنطَرّي في حاويته. إذا تغير السلوك بين التحفيزات، ستظهر اختبارات إضافية الاستجابة الأكثر بروزًا.
ملاحظة: يمكن أن تصبح غير متحسسة من الحساسية إلى ضوء الأشعة فوق البنفسجية القريبة، وسوف تتوقف عن التفاعل. تتطلب التحفيزات المتتالية فترة راحة من 8-10 ثوانٍ.
- بالنسبة لجميع تجارب المحفزات الفيزيائية، راجع القسم 1.1 للإعداد التجريبي.
- التحفيز الكيميائي (AITC)
- للحث على scrunching باستخدام مادة كيميائية، على سبيل المثال، وSNPA1 ناهض AITC28، هي من الناحية المثالية منغمسين في حمام المادة الكيميائية. ويمكن، إذا لزم الأمر، تطبيق القذف على النحو المبين في الفرع 2-1-2-3.
تنبيه: إنّ الـ AITC قابلة للاشتعال، وهي سامة بشكل حاد، ويمكن أن تسبب تهيج الجلد والعين، وحساسية الجهاز التنفسي والجلد، وهي خطرة على الحياة المائية. وينبغي التعامل مع النفط AITC في غطاء الدخان. قبل صنع حلول المخزون من AITC، وضعت على معدات الحماية الشخصية المناسبة (قفازات نيتريل ومعطف مختبر) وإعداد حاويات التخلص من النفايات الخطرة الصلبة والسائلة المناسبة. - في غطاء الدخان، وجعل 10 mM حل المخزون من AITC في المياه في 50 مل جهاز طرد مركزي أنبوب. هذا الحل المخزون هو قابل للاستخدام لمدة تصل إلى شهر واحد عند تخزينها في 4 درجة مئوية.
- من هذا المخزون، وإعداد حل عمل 25 مل من 100 μM AITC في المياه غير المائية في أنبوب الطرد المركزي 50 مل. سيتم استخدام هذا الحل 100 μM AITC للحث على scrunching في الـ planarians.
ملاحظة: 100 μM AITC يدفع scrunching متسقة في D. japonica وS. mediterranea planarians28. وبالنسبة لغيرها من الارياني المائية، يمكن أن تكون 100 ميكرومتر بمثابة تركيز يبدأ ويمكن تعديلها وفقاً لذلك. - إعداد الإعداد التجريبي (راجع القسم 1.1). ملء الساحة مع حل العمل AITC ووضعها في حاوية ثانوية. وينبغي أن تعقد الحاوية الثانوية على الأقل ضعف حجم الساحة.
ملاحظة: يمكن إجراء التجارب داخل غطاء أبخرة لمزيد من السلامة. - نقل ما يصل إلى 10 من المُعَلَّين إلى مركز الساحة وابدأ التسجيل.
- مرة واحدة في planarians تصبح غير متحسسة والتوقف عن scrunching ، ووقف التسجيل. إزالة planarians من حل AITC وشطف (الرجوع إلى القسم 1.1). التخلص من النفايات الصلبة والسائلة AITC في حاويات النفايات المناسبة.
- تحقق من خصوصية الاستجابة إلى AITC باستخدام RNAi إلى TRPA128 التالية البروتوكولات القياسية.
- من هذا المخزون، وإعداد حل عمل 25 مل من 100 μM AITC في المياه غير المائية في أنبوب الطرد المركزي 50 مل. سيتم استخدام هذا الحل 100 μM AITC للحث على scrunching في الـ planarians.
- للحث على scrunching باستخدام مادة كيميائية، على سبيل المثال، وSNPA1 ناهض AITC28، هي من الناحية المثالية منغمسين في حمام المادة الكيميائية. ويمكن، إذا لزم الأمر، تطبيق القذف على النحو المبين في الفرع 2-1-2-3.
Access restricted. Please log in or start a trial to view this content.
النتائج
خارج أشعة فوق البنفسجية التصور في S. mediterranea planarians TRPA1 تعتمد وقد اقترح أن تكون مرتبطة H2O2 الافراج17. لأن التعرض H2O2 يحفز TRPA1 تعتمد على scrunching في S. mediterranea وD. japonica planarians28، يمكن استخدام الخطوات في القسم 2.1.4 لاختبار ما إذا كان التعرض للض...
Access restricted. Please log in or start a trial to view this content.
Discussion
باستخدام هذا البروتوكول، يمكن للمرء أن دراسة كمية آثار المحفزات الفيزيائية والكيميائية7،,28،,29 أو التلاعب الجيني (RNAi)28،29 على الحركة بلاناري. لتحقيق أقصى قدر من الدقة المكانية، فمن الأفضل لنقل الكاميرا أقرب...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
يشكر المؤلفون السيد تابان غول على تعليقاته على المخطوطة. تم تمويل هذا العمل من قبل NSF منحة الوظيفي 1555109.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Allyl isothiocyanate, 95% (AITC) | Sigma-Aldrich | 377430-5G | CAUTION: Flammable and acutely toxic; handle in a fume hood with appropriate PPE. |
| Camera lens, 2/3 25mm F/1.4 | Tamron | 23FM25SP | |
| Cell culture plates, 6 well, tissue culture treated | Genesee Scientific | 25-105 | |
| Centrifuge tubes, 50 mL polypropylene, sterile | MedSupply Partners | 62-1019-2 | |
| Cinnamaldehyde, >95% | Sigma-Aldrich | W228613-100G-K | |
| Dimmable A4 LED Tracer Light Box | Amazon | B07HD631RP | |
| Flea3 USB3 camera | FLIR | FL3-U3-13E4M | |
| Heat resistant gloves | Fisher Scientific | 11-394-298 | |
| Hot plate | Fisher Scientific | HP88854200 | |
| Instant Ocean Sea Salt, prepared in deionized water | Instant Ocean | SS15-10 | Prepare in deionized water at 0.5 g/L. |
| Montjüic salts, prepared in Milli-Q water | Sigma-Aldrich | various | Prepare in milli-Q water at 1.6 mM NaCl, 1.0 mM CaCl2, 1.0 mM MgSO4, 0.1 mM MgCl2, 0.1 mM KCl, 1.2 mM NaHCO3; adjust pH to 7.0 with HCl. |
| Petri dishes, 100 mm x 20 mm, sterile polystyrene | Simport | D210-7 | |
| Pipette, 20-200 μL range | Rainin | 17008652 | |
| PYREX 150 mL beaker | Sigma-Aldrich | CLS1000150 | |
| Razor blade, 0.22 mm | VWR | 55411-050 | |
| Roscolux color filter: Golden Amber | Rosco | R21 | Alternatively purchase the Roscolux Designer Color Selector (Musson Theatrical product #SBLUX0306) which includes all 3 color filters together. |
| Roscolux color filter: Medium Red | Rosco | R27 | |
| Roscolux color filter: Storaro Red | Rosco | R2001 | |
| Samco transfer pipette, 62 µL large aperture | Thermo Fisher | 691TS | |
| Support stand | Fisher Scientific | 12-947-976 | |
| Thermometer | VWR | 89095-600 | |
| UV laser pointer | Amazon | B082DGS86R | This is a Class II laser (405nm ±10nm) with output power <5 mW. |
References
- Rink, J. C. Stem cell systems and regeneration in planaria. Development Genes and Evolution. 223, 67-84 (2013).
- Reddien, P. W., Alvarado, A. S. Fundamentals of Planarian Regeneration. Annual Review of Cell and Developmental Biology. 20, 725-757 (2004).
- Cebrià, F. Regenerating the central nervous system: how easy for planarians. Development Genes and Evolution. 217, 733-748 (2007).
- Pearl, R. Memoirs: The Movements and Reactions of Fresh-Water Planarians: A Study in Animal Behaviour. Journal of Cell Science. , 2-46 (1903).
- Mc Connell, J. A Manual of Psychological Experimentation on Planarians. , Planarian Press. (1967).
- Talbot, J., Schötz, E. M. Quantitative characterization of planarian wild-type behavior as a platform for screening locomotion phenotypes. Journal of Experimental Biology. 214, 1063-1067 (2011).
- Cochet-Escartin, O., Mickolajczk, K. J., Collins, E. M. S. Scrunching: a novel escape gait in planarians. Physical Biology. 12, 055001(2015).
- Inoue, T., et al. Planarian shows decision-making behavior in response to multiple stimuli by integrative brain function. Zoological Letters. 1, 1-15 (2015).
- Arenas, O. M., et al. Activation of planarian TRPA1 by reactive oxygen species reveals a conserved mechanism for animal nociception. Nature Neuroscience. 20, 1686-1693 (2017).
- Shomrat, T., Levin, M. An automated training paradigm reveals long-term memory in planarians and its persistence through head regeneration. Journal of Experimental Biology. 216, 3799-3810 (2013).
- Blackiston, D., Shomrat, T., Nicolas, C. L., Granata, C., Levin, M. A Second-Generation device for automated training and quantitative behavior analyses of Molecularly-Tractable model organisms. PLoS One. 5, 1-20 (2010).
- Ross, K. G., Currie, K. W., Pearson, B. J., Zayas, R. M. Nervous system development and regeneration in freshwater planarians. Wiley Interdisciplinary Reviews-Developmental Biology. 6, 266(2017).
- Cebrià, F., et al. The expression of neural-specific genes reveals the structural and molecular complexity of the planarian central nervous system. Mechanisms of Development. , 116-204 (2002).
- Mineta, K., et al. Origin and evolutionary process of the CNS elucidated by comparative genomics analysis of planarian ESTs. Proceedings of the National Academy of Sciences of the United States of America. 100, 7666-7671 (2003).
- Ross, K. G., et al. SoxB1 Activity Regulates Sensory Neuron Regeneration, Maintenance, and Function in Planarians. Developmental Cell. 47, 331-347 (2018).
- Nishimura, K., et al. Reconstruction of Dopaminergic Neural Network and Locomotion Function in Planarian Regenerates. Developmental Neurobiology. 67, 1059-1078 (2007).
- Birkholz, T. R., Beane, W. S. The planarian TRPA1 homolog mediates extraocular behavioral responses to near-ultraviolet light. Journal of Experimental Biology. 220, 2616-2625 (2017).
- Currie, K. W., Molinaro, A. M., Pearson, B. J. Neuronal sources of hedgehog modulate neurogenesis in the adult planarian brain. Elife. 5, (2016).
- Talbot, J. A., Currie, K. W., Pearson, B. J., Collins, E. M. S. Smed-dynA-1 is a planarian nervous system specific dynamin 1 homolog required for normal locomotion. Biology Open. , 1-8 (2014).
- Currie, K. W., Pearson, B. J. Transcription factors lhx1/5-1 and pitx are required for the maintenance and regeneration of serotonergic neurons in planarians. Development. 140, 3577-3588 (2013).
- Hagstrom, D., et al. Planarian cholinesterase: molecular and functional characterization of an evolutionarily ancient enzyme to study organophosphorus pesticide toxicity. Archives of Toxicology. 92, 1161-1176 (2018).
- Hagstrom, D., Cochet-Escartin, O., Collins, E. M. S. Planarian brain regeneration as a model system for developmental neurotoxicology. Regeneration. 3, 65-77 (2016).
- Hagstrom, D., Cochet-Escartin, O., Zhang, S., Khuu, C., Collins, E. M. S. Freshwater planarians as an alternative animal model for neurotoxicology. Toxicological Sciences. 147, 270-285 (2015).
- Zhang, S., Hagstrom, D., Hayes, P., Graham, A., Collins, E. M. S. Multi-behavioral endpoint testing of an 87-chemical compound library in freshwater planarians. Toxicological Sciences. , 26-44 (2019).
- Zhang, S., Hagstrom, D., Siper, N., Behl, M., Collins, E. M. S. Screening for neurotoxic potential of 15 flame retardants using freshwater planarians. Neurotoxicology and Teratology. 73, 54-66 (2019).
- Wu, J. P., Li, M. H. The use of freshwater planarians in environmental toxicology studies: Advantages and potential. Ecotoxicology and Environmental Safety. 161, 45-56 (2018).
- Rompolas, P., Azimzadeh, J., Marshall, W. F., King, S. M. Analysis of ciliary assembly and function in planaria. Methods in Enzymology. 525, 245-264 (2013).
- Sabry, Z., et al. Pharmacological or genetic targeting of Transient Receptor Potential (TRP) channels can disrupt the planarian escape response. PLoS One. , 753244(2019).
- Cochet-Escartin, O., Carter, J. A., Chakraverti-Wuerthwein, M., Sinha, J., Collins, E. M. S. Slo1 regulates ethanol-induced scrunching in freshwater planarians. Physical Biology. 13, 1-12 (2016).
- Hagstrom, D., Truong, L., Zhang, S., Tanguay, R. L., Collins, E. M. S., et al. Comparative analysis of zebrafish and planarian model systems for developmental neurotoxicity screens using an 87-compound library. Toxicological Sciences. , (2019).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Akiyama, Y., Agata, K., Inoue, T. Spontaneous Behaviors and Wall-Curvature Lead to Apparent Wall Preference in Planarian. PLoS One. 10, 0142214(2015).
- Paskin, T. R., Jellies, J., Bacher, J., Beane, W. S. Planarian Phototactic Assay Reveals Differential Behavioral Responses Based on Wavelength. PLoS One. 9, 114708(2014).
- Petrus, M., et al. A role of TRPA1 in mechanical hyperalgesia is revealed by pharmacological inhibition. Molecular Pain. 3, 40(2007).
- Takano, T., et al. Regeneration-dependent conditional gene knockdown (Readyknock) in planarian: Demonstration of requirement for Djsnap-25 expression in the brain for negative phototactic behavior. Development, Growth & Differentiation. 49, 383-394 (2007).
- Nishimura, K., et al. Identification of glutamic acid decarboxylase gene and distribution of GABAergic nervous system in the planarian Dugesia japonica. Neuroscience. 153, 1103-1114 (2008).
- Inoue, T., Yamashita, T., Agata, K. Thermosensory signaling by TRPM is processed by brain serotonergic neurons to produce planarian thermotaxis. Journal of Neuroscience. 34, 15701-15714 (2014).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved