Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Planarian Scrunching как количественный поведенческий считывание для вредных стимулов зондирования
В этой статье
Резюме
Пресноводные планарианцы демонстрируют три походки (скольжение, перистализ и сморщение), которые различимы количественным поведенческим анализом. Мы описываем метод, чтобы вызвать scrunching с помощью различных вредных стимулов, количественной оценки из них, и различие от перистализа и скольжения. Используя генный нокдаун, мы демонстрируем специфику хруста в качестве количественного фенотипического считывания.
Аннотация
Пресноводные планарианцы обычно плавно скользят через цилиарную двигательную установку на их брюшной стороне. Некоторые экологические условия, однако, может вызвать мускулатуры инициативе формы передвижения: перистализ или scrunching. В то время как перистализ является результатом цилиарного дефекта, scrunching не зависит от функции ресничок и является специфическим ответом на определенные стимулы, включая ампутацию, вредные температуры, экстремальный рН и этанол. Таким образом, эти две мускулатурно-управляемые походки механистически отличаются. Тем не менее, они могут быть трудно отличить качественно. Здесь мы предоставляем протокол для индуцирования scrunching с использованием различных физических и химических стимулов. Мы подробно количественные характеристики scrunching, которые могут быть использованы, чтобы отличить его от перистализа и скольжения, используя свободно доступное программное обеспечение. Поскольку сморщение является универсальной планарной походкой, хотя и с характерными характерными видами специфических различий, этот протокол может быть широко применен ко всем видам планариев, при использовании соответствующих соображений. Чтобы продемонстрировать это, мы сравниваем реакцию двух самых популярных планарных видов, используемых в поведенческих исследованиях, Dugesia japonica и Schmidtea mediterranea, с тем же набором физических и химических стимулов. Кроме того, специфика scrunching позволяет этот протокол, который будет использоваться в сочетании с РНК-интерференции и / или фармакологического воздействия вскрыть молекулярных целей и нейронных цепей участие, потенциально обеспечивая механистическое понимание важных аспектов ноцицепции и нервно-мышечной связи.
Введение
В дополнение к своей популярности для исследованиястволовых клеток и регенерации 1,2,3, пресноводных planarians уже давноиспользуются в поведенческих исследованиях 4,5, воспользовавшись их сравнительно большой размер (несколько миллиметров в длину), легкость и низкая стоимость лабораторного обслуживания, а также широкий спектр наблюдаемых поведения. Внедрение компьютерного зрения и автоматизированного отслеживания планарныхисследований поведения 6,,7,,8,,9,,10,,11 позволило количественной дифференциации поведенческих фенотипов. Поведение животных является прямым считыванием нейронной функции. Потому что планарианская нервная система среднего размера и сложности, но разделяет сохраненные ключевые элементыс позвоночным мозгом 12,13,14, изучение планарного поведения может дать представление о сохраненных механизмов нейронального действия, которые могут быть трудно непосредственно зонд в более сложных организмов. Таким образом, планарианцы являются ценной моделью для сравнительных нейробиологическихисследований 8,,12,,15,,16,,17,,18,,19,,20,,21. Кроме того, водная среда позволяет быстрое и легкое воздействие химических веществ для изучения их влияния на функции мозга в регенерации и взрослых planarians, что делает их популярной системой нейротоксикологии22,23,24,25,26.
Планарианцы обладают тремя различными походки, называют скольжения, перистрализа, и scrunching. Каждая походка выставлена при определенных обстоятельствах: скольжение походка по умолчанию, перистализ возникает, когда цилиарная функцияскомпрометирована 7,27, и scrunching является побег походка - независимо от функции ресничок - в ответ на определенные вредныестимулы 7. Мы показали, что scrunching является специфическим ответом, вызвано ощущением определенных химических или физических сигналов, в том числе экстремальных температур или рН, механические повреждения, или конкретные химические индукторы, и, таким образом, не является общейреакции стресса 7,28,29.
Из-за своей специфичности и стереотипных параметров, которые можно легко количественно с помощью этого протокола, scrunching является мощным поведенческим фенотипом, который позволяет исследователям выполнять механистические исследования, рассекая сенсорные пути и нейрональный контроль поведения25,28. Кроме того, scrunching было показано, что чувствительные конечной точкой для анализа неблагоприятного химического воздействия на развитие нервной системы и функциив нейротоксикологии исследований 22,24,25,30. Как несколько различных сенсорных путей, кажется, сходятся, чтобы вызвать scrunchingчерез различные механизмы 28, scrunching отличается от других планарных поведения, потому что различные, но конкретные, стимулы могут быть использованы для вскрытия различных нейронных цепей и изучить, как различные сигналы интегрированы для производства scrunching фенотипа.
Важно отметить, что существуют различия видов, в которых одно химическое вещество может вызвать сморщение в одном планерианских видах, но другая поведенческая реакция в другом. Например, мы обнаружили, что анандамид вызывает scrunching в планарных видов Dugesia japonica, но вызывает перистализ в Schmidtea mediterranea28. Этот пример подчеркивает важность того, чтобы быть в состоянии надежно различать различные походки, потому что они являются фенотипическими проявлениями различных молекулярных механизмов. Тем не менее, различие scrunching от перистализа трудно использовать качественные данные наблюдения, потому что обе походки мускулатуры инициативе идоля качественного сходства 7,28. Таким образом, для различения походок необходимо выполнить визуализацию ресничок или количественное поведенческое исследование, которое позволяет проводить различие на основехарактерных параметров 7,,28. Потому что реснички изображений является экспериментально сложной задачей и требует специализированного оборудования, таких как высокое увеличение соединениямикроскопа и высокоскоростной камеры 7,28, это не так широко доступны для исследователей, как количественный поведенческий анализ.
Здесь мы представляем протокол для (1) индукции scrunching с использованием различных физических (вредные температуры, ампутации, почти УФ-излучения) и химических (allyl isothiocyanate (AITC), cinnamaldehyde) стимулы и (2) количественный анализ планарного поведения с использованием свободно доступных программ. Путем количественной оценки четырех параметров (частота колебаний длины тела, относительная скорость, максимальная амплитуда, и асимметрия удлинения тела и сокращения)7, scrunching может быть дифференцирована от скольжения, перистализа и других поведенческих состояний, о которых сообщается в литературе, таких как змеи, как движение15 или эпилепсии 15. Кроме того, в то время как scrunching сохраняется среди различных планарныхвидов 7, каждый вид имеет свою собственную характерную частоту и скорость; поэтому, как только скорость скольжения и сморщения вида были определены, скорость сама по себе может быть использована в качестве средства, чтобы отличить scrunching от скольжения иперистализа 29. Протокол не предполагает предварительного обучения в вычислительном анализе изображений или поведенческих исследованиях и, таким образом, также может быть применен для планарных поведенческих экспериментов в контексте учебной лаборатории на уровне бакалавриата. Примерные данные для облегчения адаптации протокола приведены в дополнительном материале.
протокол
1. Количественные прогнозные анализы поведения
- Экспериментальная установка
- Поместите тусклую светодиодную панель на плоскую поверхность. Светодиодная панель служит двум целям: (1) обеспечить единый белый фон и (2), которые будут использоваться в качестве регулируемого источника света для получения соответствующего контраста. Поместите 100-мм арену чашки Петри на светодиодную панель.
ПРИМЕЧАНИЕ: Для увеличения пропускной способности, несколько хорошо пластины могут быть использованыв качестве арены 23,24, но большие арены облегчить автоматизированный анализ изображения. - Установить камеру на кольцо стоять над ареной (Рисунок 1A). Отрегулируйте положение камеры, высоту и фокус по мере необходимости, чтобы вся арена была сосредоточена в поле зрения и была в фокусе(рисунок 1B).
ПРИМЕЧАНИЕ: Разрешение камеры должно быть достаточно высоким, чтобы четко отличить планарианец от однородного фона, предоставляемого светодиодной панелью. - Заполните арену соответствующими средствами воздействия (планарная вода или химический раствор) до половины максимального объема (это будет называться баней). Это соответствует примерно 25 мл для 100 мм чашки Петри. Включите светодиодную панель и выключите любые другие источники света, которые могут негативно повлиять на качество записи (т.е. близлежащие источники света, которые производят блики на арене).
ВНИМАНИЕ: Управление опасными химическими растворами надлежащим образом, нося полное индивидуальное защитное оборудование (СИЗ) и перемещение экспериментальной установки в дым капот, если это необходимо. Следуйте федеральным и государственным правилам по утилизации отходов. - Бросьте planarian к центру арены с помощью передачи пипетки. Начните запись. Запись данных в виде последовательностей изображений в родном формате Fiji31 (TIFF, GIF, JPEG, PNG, DICOM, BMP, PGM или FITS; см. раздел анализа изображений 1.2).
ПРИМЕЧАНИЕ: Поскольку поведение и чувствительность к внешним раздражителям различаются между отдельными планариями, важно собирать данные о достаточно большом количестве биологических репликаций, в дополнение к выполнению технических репликаций. Мы работали с до 10 средних (4-7 мм) planarians в 100 мм Петри блюдо сразу. В то время как время эффективно, несколько planarians в чашке Петри сразу сделать анализ данных более трудным, поскольку planarians могут пересекать пути.- Для планерных экспериментов замыкайте по крайней мере 1 кадр в секунду (FPS). Для экспериментов scrunching/peristalsis, запись с использованием FPS, что, по крайней мере в два раза scrunching /peristalsis частоты планарных видов. Если планарианский вид имеет неизвестную частоту сморщения/перистализа, используйте 10 FPS в качестве отправной точки и при необходимости увеличьте/уменьшите.
- При использовании химического раствора, передать planarian использованием как несколько капель планарной воды, как это возможно, так что концентрация химического раствора не сильно изменилась.
- Для планерных экспериментов завемить 1-2 минуты скользящего поведения. Для экспериментов scrunching/peristalsis, запись достаточно долго, чтобы захватить по крайней мере 3 последовательных колебаний, происходящих в прямой линии. Как только эксперимент завершен, прекратите запись.
ПРИМЕЧАНИЕ: Для экспериментов scrunching/peristalsis, если planarian не удовлетворяет критерию прекращения в пределах определенного периода времени, который должен быть последовательным через репликации и эмпирически определяется на основе стимула, прекратить запись и проверить другой planarian.- Если планарианец достигает границы арены, не удовлетворяя критерию расторжения, пипетка планарного обратно в центр арены.
ПРИМЕЧАНИЕ: Избегайте повторения пипетки человека для записи, так как это может изменить его поведение.
- Если планарианец достигает границы арены, не удовлетворяя критерию расторжения, пипетка планарного обратно в центр арены.
- Удалите планарий (ы) с арены и утилизировать планарную воду или химический раствор в соответствующих контейнерах для отходов. Планарианцы, навеявные воды, могут быть возвращены в свой домашний контейнер.
ПРИМЕЧАНИЕ: Избегайте перекрестного загрязнения с помощью различных арен для различных средств массовой информации (т.е. скольжение в планарных водных экспериментов не должны быть запущены в арене, ранее используемой для scrunching/peristalsis экспериментов с химическим воздействием).- Серийно промыть planarians подвергаются химическому раствору в 3 чистых 100 мм Петри блюда заполнены 25 мл планарной воды, чтобы тщательно разбавить любые химические вещества. Если scrunching или peristalsis было наведено, то поместите эти planarians в отдельно контейнер. Planarians могут быть возвращены в свой домашний контейнер через месяц, так как большинство клеток были бы перевернулся к томувремени 1.
ПРИМЕЧАНИЕ: Если для одной и той же популяции планариев, например, для популяции РНК, требуется несколько различных экспериментов, то планарианцы могут восстановиться в течение 24 часов перед началом следующего эксперимента. Закажите эксперименты таким образом, что наименее инвазивный эксперимент является первым и наиболее инвазивный эксперимент (например, ампутация) проводится последним. - Если работает несколько экспериментов в той же арене, правильно распоряжаться раствором ванны и удалить любые следы слизи, вытирая арену с бумажным полотенцем между работает.
ПРИМЕЧАНИЕ: Протокол можно приостановить здесь.
- Серийно промыть planarians подвергаются химическому раствору в 3 чистых 100 мм Петри блюда заполнены 25 мл планарной воды, чтобы тщательно разбавить любые химические вещества. Если scrunching или peristalsis было наведено, то поместите эти planarians в отдельно контейнер. Planarians могут быть возвращены в свой домашний контейнер через месяц, так как большинство клеток были бы перевернулся к томувремени 1.
- Поместите тусклую светодиодную панель на плоскую поверхность. Светодиодная панель служит двум целям: (1) обеспечить единый белый фон и (2), которые будут использоваться в качестве регулируемого источника света для получения соответствующего контраста. Поместите 100-мм арену чашки Петри на светодиодную панель.
- Количественный анализ планарного поведения
- Выполните анализы планарного поведения, описанные в разделе 1.1.
- Откройте необработанную последовательность изображений для эксперимента на Фиджи (Файл и импорти последовательность изображений)и выберите первое изображение в последовательности изображений. В окне Параметры последовательности проверьте поле на наличие "Сортировать имена численно" и нажмите кнопку "Хорошо". После загрузки последовательности изображений, конвертировать последовательность изображений в 8-битный (Изображение , Тип йgt; 8-битный) и использовать инструмент стрелки или ползунок в нижней части стека изображения, чтобы посмотреть или панорамировать через последовательность изображений.
ПРИМЕЧАНИЕ: Для планерных экспериментов все данные могут быть использованы до тех пор, пока планарианец может быть четко виден на протяжении всей записи. Тем не менее, как правило, достаточно проанализировать свободное движение в центре арены путем извлечения соответствующей части (ы), как описано ниже. - Чтобы извлечь период времени и область интереса, нарисуйте область интереса, охватывающая полный путь планария с помощью прямоугольника инструмента(рисунок 2A, 2B). Нажмите правой кнопкой мыши на стек изображения и выберите Duplicate..., проверьте поле для двойного стека,введите первый и последний кадры последовательности интересов, и нажмите OK. Если несколько planarians были изображены одновременно, повторите этот шаг выбора региона и дублирования для каждого planarian на арене, так что Есть так много открытых стеков изображения, как Есть planarians на арене. Следующие шаги (Шаги 1.2.4-1.2.10) должны выполняться на каждом стеке изображения, по одному.
- Для планерных экспериментов извлекайте период скольжения, когда планарианец перемещается по крайней мере в два раза по длине тела.
ПРИМЕЧАНИЕ: Чем больше скользящих данных будет извлечено на одного планариана, тем надежнее будут данные. Планарианец не должен двигаться по прямой для анализа скольжения. - Для экспериментов scrunching/peristalsis извлекайте случай когда planarian проходит минимум 3 последовательных (идеально больше) колебаний тела в прямой линии, убеждаясь что каждое колебание полный цикл удлинения-сокращения, по мере того как полные колебания необходимы точно обусловить частоту.
ПРИМЕЧАНИЕ: Чем больше колебаний можно извлечь, тем надежнее будут данные. Не используйте последовательности, где planarian поворачивается, поскольку они приведут к неточным измерениям длины.
- Для планерных экспериментов извлекайте период скольжения, когда планарианец перемещается по крайней мере в два раза по длине тела.
- Примените порог к дублируемому стеку изображений(Изображение иотрегулируйте ) для бинаризации изображения и извлечения плана с фона. Отрегулируйте раздвижные полосы по мере необходимости так, чтобы весь планарианец был выделен красным цветом. Точные значения зависят от качества изображения. Оставьте коробки для темного фона, стек гистограммы , и не сбросить диапазон беспрепятственно. Прокрутите стек изображений, чтобы обеспечить хороший пороговый диапазон (т.е. планарианец хорошо отделен от фона по всему стеку), а затем нажмите Применить.
- В стеке преобразования в двоичное окно установите метод по умолчанию и фон для света. Снимите все коробки в этом окне, а затем нажмите OK. Появится бинаризованное изображение, показывающее черного планарианка на белом фоне(рисунок 2C). Убедитесь, что весь planarian виден во всех кадрах последовательности изображения.
ПРИМЕЧАНИЕ: Нежелательные объекты в последовательности бинаризованных изображений, которые меньше или больше, чем планарий, могут быть отфильтрованы в последующем анализе с помощью фильтраразмера (рисунок 2Ciii). - Установите измерения, нажав На анализ и установить измерения. Проверьте коробки для области, Центр массы ,Стек позиции, и Fit эллипс и нажмите OK.
ПРИМЕЧАНИЕ: Эти параметры необходимо устанавливать только один раз за сессию Фиджи. - Выберите открытый стек изображений и выберите Анализ и анализ частиц.
- В окне Analyze Particles выберите Шоу и Маски, чтобы открыть новый стек, показывающий все объекты, которые были обнаружены с выбранными параметрами. Это может быть использовано для визуальной проверки того, что проводятся только измерения плана. На этом этапе может быть установлен фильтр размера для удаления нежелательного шума, введя примерную область плана (впикселе 2 единицы) в предоставленном пространстве. Проверьте коробки для отображения результатов и четкие результаты и нажмите OK.
ПРИМЕЧАНИЕ: В окне Результатов, если индекс (первый столбец) не равен числу срезов для всех строк, это означает, что отслеживалось слишком много или слишком мало объектов. Одной из возможностей для этого расхождения является наличие других объектов, кроме планарных или что планарианец не отслеживается в конкретных кадрах. - Панорамирование через стек изображения маски с помощью ползунка в нижней части панели. Если есть какой-либо шум или есть кадры, которые не имеют planarian, закройте окно результаты и стек изображения маски. Повторите шаги 1.2.7-1.2.8, отрегулив фильтр области только для удаления объектов, не отбирающих планарных.
ПРИМЕЧАНИЕ: Если планарианец отсутствует в кадре в маске, это говорит о том, что нижняя граница фильтра области была установлена слишком высоко. - В окне Результатов сохраните данные с помощью File'gt;Save As. Добавьте расширение .csv к имени файла, чтобы сохранить данные в качестве запятых разделенных значений. После того, как данные для стека изображений сохраняются, закройте соответствующий стек изображений, а также окна «Результаты и маска».
- Импорт данных и дальнейший анализ с использованием любого программного обеспечения электронной таблицы или бесплатных программ. Для расчета скорости скольжения обратитесь к разделу 1.3. Для расчета полного набора параметров scrunching/peristalsis обратитесь к разделу 1.4.
ПРИМЕЧАНИЕ: Протокол можно приостановить здесь. - Чтобы определить пиксель до фактического преобразования длины, откройте изображение на Фиджи со справочной длиной (например, диаметр арены). Выберите линейный инструмент и нарисуйте линию над известной длиной.
- Преобразование пиксельных единиц в стандартную единицу длины, нажав На анализ . Введите длину, соответствующую линии, нарисованной на изображении в поле Известного расстояния, и измените единицу длины от пикселя к выбранной стандартной единице длины. Коэффициент конверсии написан рядом с шкалой.
ПРИМЕЧАНИЕ: Значение преобразования пикселей не требуется для анализа скольжения или сморщения/перистализа в разделах 1.3 и 1.4.
- Расчет скорости скольжения
- Используя файл данных, сохраненный в разделе 1.2, загрузите центр массы (COM) x и y координаты и основные данные оси. Если данные сохраняются в файле разделенных запятой значений, эти списки соответствуют столбцам "XM", "YM" и "Major" соответственно.
- Рассчитайте смещение (d) планарного центра массы в пикселях для каждого кадра по отношению к следующему кадру с помощью столбцов данных "XM" и "YM". Перемещение (d) дается:
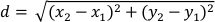
где x1 и y1 относятся к координатам COM (XM, YM) одного кадра и x2 иy 2 относятся к координатам COM (XM, YM) последующего кадра. - Установите длину тела планарного как95-й процентиль столбца "Майор". В виду того что planarians exhibit поведениепредпочтения стены 32,это гарантирует что высчитанная длинка тела planarian представительна когда planarian удлиненное24.
- Нормализация смещения по длине планарного тела путем деления смещений пикселей на кадр на длину планарного тела (l). Нормализованное перемещение (dn) дается:
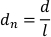
- Создание списка нормализованных скоростей путем деления нормализованных перемещений на время, прошедшее за кадр (обратно записанных FPS). Нормализованная скорость скольжения(s n) дается:
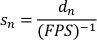
- Рассчитайте нормализованную скорость скольжения планарианского, взяв средний список нормализованных скоростей (sn). Стандартное отклонение может быть использовано в качестве измерения неопределенности для планарного.
- Повторите шаги 1.3.1-1.3.6 для каждого плана, который будет проанализирован. Средний и принять стандартное отклонение скорости скольжения для всех planarians, чтобы получить скорость скольжения и связанные с этим неопределенности, соответственно, для планарного населения.
- Различие походки scrunching и peristalsis используя полный набор параметров
- Загрузите основной список данных оси из файла данных, сохраненных из раздела 1.2. Если данные сохраняются в файле разделенных запятых значений, это соответствует столбецу Major.
- Создайте список, который читит каждую точку данных в столбце Major, начиная с 0. Преобразование этого списка в время, прошедшее за кадр, путем деления на записанный FPS.
- Участок Основные данные столбца по отношению к времени, прошедшее для создания scrunching/peristalsis колебания участка (рисунок 3A). Используя участок колебаний, обрежьте данные, по крайней мере, до трех последовательных колебаний прямой линии(рисунок 3Bi). Обрезать данные для запуска и окончания на локальных пиках (максимальное удлинение колебаний) или желобах (минимальное удлинение колебаний).
ПРИМЕЧАНИЕ: Если локальные конечности не примерно равны (пики/впадины резко различаются по высотам), это говорит о том, что колебания не являются прямыми(рисунок 3Bii). Извлекайте другую последовательность, по крайней мере, три последовательных, прямых колебаний. Обратитесь к разделу 1.2. - Подтвердите, что последовательность колебаний, представляющих интерес, была извлечена и обрезалась должным образом путем повторного анализа обрезанных основных данных по отношению к времени. Используйте этот обрезанный список данных для всех последующих вычислений.
- Для расчета частоты колебаний (Noм)разделите количество колебаний (On)на общее количество точек данных в обрезанном списке данных основной оси (N). Умножьте FPS на это значение, чтобы получить частоту колебаний в секунду.
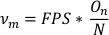
- Для расчета максимального удлинения (я) max),вычесть абсолютную минимальную длину тела (lmin) из абсолютной максимальной длины тела (lmax). Нормализация до удлиненной длины тела путем деления на абсолютную максимальную длину тела.
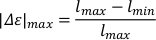
- Для расчета скорости на длину тела(v'm),mумножьте рассчитанное максимальное удлинение на частоту колебаний.
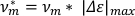
ПРИМЕЧАНИЕ: Скорость сама по себе может быть использована, чтобы различать scrunching и перистализ походки7. - Чтобы рассчитать долю времени, затраченного на удлинение (felong),возьмите производную от обрезанного списка основных данных оси по отношению к времени. Разделите количество положительных точек данных (т.е. когда производная составляет 0 (np)на общее количество точек данных в списке данных основной оси(nt)).
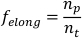
ПРИМЕЧАНИЕ: Scrunching planarians exhibit асимметричная доля времени потраченного удлинять тогда как planarians выполняя peristalsis тратят равное количество времени удлиняяя иконтракты 7. - Повторите шаги 1.4.1-1.4.8 для каждого плана, который будет проанализирован. Рассчитайте параметр планарного населения, установленный путем принятия среднего и стандартного отклонения каждого параметра.
ПРИМЕЧАНИЕ: Набор параметров может быть использован для определения того, если поведение колебаний scrunching, перистализ или какой-либо другой форме передвижения с периодическими изменениями формы тела. Оба scrunching и peristalsis имеют фиксированные параметры дляданного вида 7, с scrunching параметры, как правило, больше, чем параметры перистализа7. Хотя вполне возможно, что один из параметров может выпасть за пределы видового диапазона, как мы уже наблюдали с химической индукции28, наблюдаемое поведение должно согласиться с по крайней мере 3 из 4 опубликованных параметров, которые будут классифицированы как либо перистализ или scrunching.
2. Индукция scrunching
- Физические стимулы (неясная температура, УФ-излучение, ампутация)
- Для всех экспериментов с физическими стимулами обратитесь к разделу 1.1 для экспериментальной установки.
ПРИМЕЧАНИЕ: Лучше всего использовать большую арену, такую как 100-мм чашка Петри, для физических экспериментов стимулов, чтобы обеспечить более открытое пространство для маневрирования пипетки и / или лезвие бритвы. - Чтобы вызвать scrunching через вредные температуры, тепла planarian воды в стакане (по крайней мере 100 йл на планарианец, которые будут проверены) до 65 градусов по Цельсию на горячей пластине.
- Поместите планарного в центре арены. Подождите, пока планарианец сориентироваться в вертикальном положении и начинает скользить. Начните запись.
- Используя пипетку P-200, медленно пипетка 100 йл из 65 Q C planarian воды пост-pharyngeally на хвосте planarian, чтобы вызвать scrunching.
ПРИМЕЧАНИЕ: Убедитесь, что нагретая планарная вода остается на уровне 65 градусов по Цельсию. При необходимости разогрейте воду до 65 градусов по Цельсию до начала другого эксперимента. Так как давление может также вызвать scrunching, медленно pipetting необходимо. Трубопроводная вода комнатной температуры так же, как и в эксперименте, может служить в качестве опции контроля и практики. - Остановите запись после того, как сморщение прекратилось. Поместите planarian в контейнер для восстановления и обмена средствами массовой информации в чашке Петри со свежей, комнатной температуры planarian воды, если работает больше экспериментов.
- Чтобы вызвать scrunching через ампутацию, передать planarian в центре арены и ждать, пока planarian ориентируется в вертикальном положении и начинает скользить. Начните запись.
- Ампутируйте планарианку, используя чистое лезвие бритвы. Ампутации могут быть сделаны в любом месте вдоль planarian до тех пор, как сократить место последовательно в ходе экспериментов.
ПРИМЕЧАНИЕ: Параметры scrunching извлекаются из передней части. Таким образом, избегайте препятствования камере зрения этой части planarian при применении разреза, приближаясь с задней части. Пластиковые крышки скользит также хорошо работать для резки и являются более безопасным вариантом, особенно в условиях обучения. - Остановите запись, как только передняя часть перестанет scrunching. Удалите оба куска, поместите их в отдельный контейнер и дайте им регенерировать в течение 7 дней. Ампутированный planarians можно reincorporated в домашний контейнер раз регенерировал.
- Ампутируйте планарианку, используя чистое лезвие бритвы. Ампутации могут быть сделаны в любом месте вдоль planarian до тех пор, как сократить место последовательно в ходе экспериментов.
- Чтобы вызвать сморщение с помощью почти УФ-излучения, приложите соответствующие фильтры (например, фильтры Roscolux) к объективу камеры, чтобы уменьшить количество отраженного почти УФ-излучения, которое собирается камерой и может помешать визуализации реакции плана. Вместо того, чтобы использовать светодиодную панель для освещения арены снизу, используйте окружающее красное освещение, к которому planarians являютсябесчувственными 33.
- Заполните 100-мм чашу Петри арены с планарной водой и поместите один планарий (5-9 мм) в центре арены. Начало записи на 10 FPS.
- Держите УФ-лазерную указку II класса (405 ± 10 нм, выходную мощность 1 л;5 мВт) примерно в 30 см от арены. Позиция лазерной указкой под углом 45 "от скольжения planarian, а затем сиять лазерной указкой в течение 5-10 секунд на полпути между задней части глотки и кончик хвоста, чтобы вызвать scrunching.
ПРИМЕЧАНИЕ: Мощность лазерной указки может быть измерена с помощью почти УФ-чувствительных счетчик мощности. - Подождите, пока планарианец начнет скользить снова, прежде чем пытаться еще две стимуляции на том же человеке, чтобы проверить на воспроизводимость реакции. Если планарианец продолжает показывать такое же поведение, прекратите запись и поместите планарного обратно в контейнер. Если поведение меняется между стимуляциями, дополнительные тесты покажут, какой ответ является наиболее заметным.
ПРИМЕЧАНИЕ: Планарианцы могут стать десенсибилизированными к почти УФ-свету и перестанут реагировать. Последовательные стимуляции требуют периода отдыха 8-10 секунд.
- Для всех экспериментов с физическими стимулами обратитесь к разделу 1.1 для экспериментальной установки.
- Химический стимул (AITC)
- Чтобы вызвать scrunching с помощью химического вещества, например, TRPA1 агонист AITC28, planarians идеально погружены в ванну химического вещества. При необходимости пипетка может быть применена, как описано в разделе 2.1.2.3.
ВНИМАНИЕ: AITC является легковоспламеняющимся, остро токсичным, может вызвать раздражение кожи и глаз, респираторной и сенсибилизации кожи, и является опасным для водной жизни. Масло AITC должно обрабатываться в дымовой капоте. Перед изготовлением фондовых растворов AITC на надеть соответствующие СИЗ (нитрил-перчатки и лабораторный слой) и установить соответствующие контейнеры для удаления твердых и жидких опасных отходов. - В дымовой капоте сделайте 10-метровый стоковое раствор AITC в планарной воде в трубе центрифуги 50 мл. Это решение для акций можно использовать в течение одного месяца при хранимом при 4 градусах Цельсия.
- Из этого запаса подготовьте рабочий раствор из 25 мл 100 МКМ AITC в планарной воде в центрифуге 50 мл. Это решение AITC 100 МК будет использоваться для индуцирования scrunching в planarians.
ПРИМЕЧАНИЕ: 100 МКМ AITC вызывает последовательное scrunching в D. japonica и S. mediterranea planarians28. Для других водных planarians, 100 МКМ может служить в качестве стартовой концентрации и могут быть скорректированы соответствующим образом. - Настройка экспериментальной установки (ссылка на раздел 1.1). Заполните арену рабочим решением AITC и поместите ее во вторичный контейнер. Вторичный контейнер должен в два раза больше арены.
ПРИМЕЧАНИЕ: Эксперименты могут быть проведены внутри капота дыма для дополнительной безопасности. - Перенесите до 10 планариев в центр арены и начните запись.
- После того, как планарианцы становятся десенсибилизированными и перестают сжать, прекратите запись. Удалите планариев из раствора AITC и промойте (обратитесь к разделу 1.1). Утилизация твердых и жидких отходов AITC в соответствующих контейнерах для отходов.
- Проверить специфику ответа на AITC с помощью РНК на TRPA128 следующие стандартные протоколы.
- Из этого запаса подготовьте рабочий раствор из 25 мл 100 МКМ AITC в планарной воде в центрифуге 50 мл. Это решение AITC 100 МК будет использоваться для индуцирования scrunching в planarians.
- Чтобы вызвать scrunching с помощью химического вещества, например, TRPA1 агонист AITC28, planarians идеально погружены в ванну химического вещества. При необходимости пипетка может быть применена, как описано в разделе 2.1.2.3.
Результаты
Экстраокулярное почти УФ-восприятие в S. mediterranea planarians зависит от TRPA1 и было предложено быть связано с H2O2 релиз17. Потому что H2O2 воздействия вызывает TRPA1-зависимых scrunching в S. mediterranea и D. japonica planarians28, шаги в разделе 2.1.4 могут быть и...
Обсуждение
Используя этот протокол, можно количественно изучить влияние физическихи химических стимулов 7,,28,,29 или генетических манипуляций(РНК) 28,29 на планарных передвижения. Чтобы максимизировать пространствен?...
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Авторы благодарят г-на Тапана Гоэля за комментарии к рукописи. Эта работа была профинансирована NSF CAREER Грант 1555109.
Материалы
| Name | Company | Catalog Number | Comments |
| Allyl isothiocyanate, 95% (AITC) | Sigma-Aldrich | 377430-5G | CAUTION: Flammable and acutely toxic; handle in a fume hood with appropriate PPE. |
| Camera lens, 2/3 25mm F/1.4 | Tamron | 23FM25SP | |
| Cell culture plates, 6 well, tissue culture treated | Genesee Scientific | 25-105 | |
| Centrifuge tubes, 50 mL polypropylene, sterile | MedSupply Partners | 62-1019-2 | |
| Cinnamaldehyde, >95% | Sigma-Aldrich | W228613-100G-K | |
| Dimmable A4 LED Tracer Light Box | Amazon | B07HD631RP | |
| Flea3 USB3 camera | FLIR | FL3-U3-13E4M | |
| Heat resistant gloves | Fisher Scientific | 11-394-298 | |
| Hot plate | Fisher Scientific | HP88854200 | |
| Instant Ocean Sea Salt, prepared in deionized water | Instant Ocean | SS15-10 | Prepare in deionized water at 0.5 g/L. |
| Montjüic salts, prepared in Milli-Q water | Sigma-Aldrich | various | Prepare in milli-Q water at 1.6 mM NaCl, 1.0 mM CaCl2, 1.0 mM MgSO4, 0.1 mM MgCl2, 0.1 mM KCl, 1.2 mM NaHCO3; adjust pH to 7.0 with HCl. |
| Petri dishes, 100 mm x 20 mm, sterile polystyrene | Simport | D210-7 | |
| Pipette, 20-200 μL range | Rainin | 17008652 | |
| PYREX 150 mL beaker | Sigma-Aldrich | CLS1000150 | |
| Razor blade, 0.22 mm | VWR | 55411-050 | |
| Roscolux color filter: Golden Amber | Rosco | R21 | Alternatively purchase the Roscolux Designer Color Selector (Musson Theatrical product #SBLUX0306) which includes all 3 color filters together. |
| Roscolux color filter: Medium Red | Rosco | R27 | |
| Roscolux color filter: Storaro Red | Rosco | R2001 | |
| Samco transfer pipette, 62 µL large aperture | Thermo Fisher | 691TS | |
| Support stand | Fisher Scientific | 12-947-976 | |
| Thermometer | VWR | 89095-600 | |
| UV laser pointer | Amazon | B082DGS86R | This is a Class II laser (405nm ±10nm) with output power <5 mW. |
Ссылки
- Rink, J. C. Stem cell systems and regeneration in planaria. Development Genes and Evolution. 223, 67-84 (2013).
- Reddien, P. W., Alvarado, A. S. Fundamentals of Planarian Regeneration. Annual Review of Cell and Developmental Biology. 20, 725-757 (2004).
- Cebrià, F. Regenerating the central nervous system: how easy for planarians. Development Genes and Evolution. 217, 733-748 (2007).
- Pearl, R. Memoirs: The Movements and Reactions of Fresh-Water Planarians: A Study in Animal Behaviour. Journal of Cell Science. , 2-46 (1903).
- Mc Connell, J. . A Manual of Psychological Experimentation on Planarians. , (1967).
- Talbot, J., Schötz, E. M. Quantitative characterization of planarian wild-type behavior as a platform for screening locomotion phenotypes. Journal of Experimental Biology. 214, 1063-1067 (2011).
- Cochet-Escartin, O., Mickolajczk, K. J., Collins, E. M. S. Scrunching: a novel escape gait in planarians. Physical Biology. 12, 055001 (2015).
- Inoue, T., et al. Planarian shows decision-making behavior in response to multiple stimuli by integrative brain function. Zoological Letters. 1, 1-15 (2015).
- Arenas, O. M., et al. Activation of planarian TRPA1 by reactive oxygen species reveals a conserved mechanism for animal nociception. Nature Neuroscience. 20, 1686-1693 (2017).
- Shomrat, T., Levin, M. An automated training paradigm reveals long-term memory in planarians and its persistence through head regeneration. Journal of Experimental Biology. 216, 3799-3810 (2013).
- Blackiston, D., Shomrat, T., Nicolas, C. L., Granata, C., Levin, M. A Second-Generation device for automated training and quantitative behavior analyses of Molecularly-Tractable model organisms. PLoS One. 5, 1-20 (2010).
- Ross, K. G., Currie, K. W., Pearson, B. J., Zayas, R. M. Nervous system development and regeneration in freshwater planarians. Wiley Interdisciplinary Reviews-Developmental Biology. 6, 266 (2017).
- Cebrià, F., et al. The expression of neural-specific genes reveals the structural and molecular complexity of the planarian central nervous system. Mechanisms of Development. , 116-204 (2002).
- Mineta, K., et al. Origin and evolutionary process of the CNS elucidated by comparative genomics analysis of planarian ESTs. Proceedings of the National Academy of Sciences of the United States of America. 100, 7666-7671 (2003).
- Ross, K. G., et al. SoxB1 Activity Regulates Sensory Neuron Regeneration, Maintenance, and Function in Planarians. Developmental Cell. 47, 331-347 (2018).
- Nishimura, K., et al. Reconstruction of Dopaminergic Neural Network and Locomotion Function in Planarian Regenerates. Developmental Neurobiology. 67, 1059-1078 (2007).
- Birkholz, T. R., Beane, W. S. The planarian TRPA1 homolog mediates extraocular behavioral responses to near-ultraviolet light. Journal of Experimental Biology. 220, 2616-2625 (2017).
- Currie, K. W., Molinaro, A. M., Pearson, B. J. Neuronal sources of hedgehog modulate neurogenesis in the adult planarian brain. Elife. 5, (2016).
- Talbot, J. A., Currie, K. W., Pearson, B. J., Collins, E. M. S. Smed-dynA-1 is a planarian nervous system specific dynamin 1 homolog required for normal locomotion. Biology Open. , 1-8 (2014).
- Currie, K. W., Pearson, B. J. Transcription factors lhx1/5-1 and pitx are required for the maintenance and regeneration of serotonergic neurons in planarians. Development. 140, 3577-3588 (2013).
- Hagstrom, D., et al. Planarian cholinesterase: molecular and functional characterization of an evolutionarily ancient enzyme to study organophosphorus pesticide toxicity. Archives of Toxicology. 92, 1161-1176 (2018).
- Hagstrom, D., Cochet-Escartin, O., Collins, E. M. S. Planarian brain regeneration as a model system for developmental neurotoxicology. Regeneration. 3, 65-77 (2016).
- Hagstrom, D., Cochet-Escartin, O., Zhang, S., Khuu, C., Collins, E. M. S. Freshwater planarians as an alternative animal model for neurotoxicology. Toxicological Sciences. 147, 270-285 (2015).
- Zhang, S., Hagstrom, D., Hayes, P., Graham, A., Collins, E. M. S. Multi-behavioral endpoint testing of an 87-chemical compound library in freshwater planarians. Toxicological Sciences. , 26-44 (2019).
- Zhang, S., Hagstrom, D., Siper, N., Behl, M., Collins, E. M. S. Screening for neurotoxic potential of 15 flame retardants using freshwater planarians. Neurotoxicology and Teratology. 73, 54-66 (2019).
- Wu, J. P., Li, M. H. The use of freshwater planarians in environmental toxicology studies: Advantages and potential. Ecotoxicology and Environmental Safety. 161, 45-56 (2018).
- Rompolas, P., Azimzadeh, J., Marshall, W. F., King, S. M. Analysis of ciliary assembly and function in planaria. Methods in Enzymology. 525, 245-264 (2013).
- Sabry, Z., et al. Pharmacological or genetic targeting of Transient Receptor Potential (TRP) channels can disrupt the planarian escape response. PLoS One. , 753244 (2019).
- Cochet-Escartin, O., Carter, J. A., Chakraverti-Wuerthwein, M., Sinha, J., Collins, E. M. S. Slo1 regulates ethanol-induced scrunching in freshwater planarians. Physical Biology. 13, 1-12 (2016).
- Hagstrom, D., Truong, L., Zhang, S., Tanguay, R. L., Collins, E. M. S., et al. Comparative analysis of zebrafish and planarian model systems for developmental neurotoxicity screens using an 87-compound library. Toxicological Sciences. , (2019).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Akiyama, Y., Agata, K., Inoue, T. Spontaneous Behaviors and Wall-Curvature Lead to Apparent Wall Preference in Planarian. PLoS One. 10, 0142214 (2015).
- Paskin, T. R., Jellies, J., Bacher, J., Beane, W. S. Planarian Phototactic Assay Reveals Differential Behavioral Responses Based on Wavelength. PLoS One. 9, 114708 (2014).
- Petrus, M., et al. A role of TRPA1 in mechanical hyperalgesia is revealed by pharmacological inhibition. Molecular Pain. 3, 40 (2007).
- Takano, T., et al. Regeneration-dependent conditional gene knockdown (Readyknock) in planarian: Demonstration of requirement for Djsnap-25 expression in the brain for negative phototactic behavior. Development, Growth & Differentiation. 49, 383-394 (2007).
- Nishimura, K., et al. Identification of glutamic acid decarboxylase gene and distribution of GABAergic nervous system in the planarian Dugesia japonica. Neuroscience. 153, 1103-1114 (2008).
- Inoue, T., Yamashita, T., Agata, K. Thermosensory signaling by TRPM is processed by brain serotonergic neurons to produce planarian thermotaxis. Journal of Neuroscience. 34, 15701-15714 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены