È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Planarian Scrunching come una lettura comportamentale quantitativa per il rilevamento di stimoli nocivi
In questo articolo
Riepilogo
I planari di acqua dolce presentano tre andatri (gli aliante, peristalsi e scrunching) che sono distinguibili dall'analisi comportamentale quantitativa. Descriviamo un metodo per indurre scrunching utilizzando vari stimoli nocivi, quantificazione della stessa, e distinzione da peristalsis e planata. Usando l'abbattimento genico, dimostriamo la specificità dello scrunching come lettura fenotipico quantitativa.
Abstract
I planari d'acqua dolce normalmente scivolano senza problemi attraverso la propulsione ciliaria sul loro lato ventrale. Alcune condizioni ambientali, tuttavia, possono indurre forme di locomozione guidate dalla muscolatura: peristalsis o scrunching. Mentre la peristalsis deriva da un difetto ciliare, lo scrunching è indipendente dalla funzione delle ciglia ed è una risposta specifica a determinati stimoli, tra cui amputazione, temperatura nociva, pH estremo ed etanolo. Così, queste due andature moscentivamente guidate sono meccanicisticamente distinte. Tuttavia, possono essere difficili da distinguere qualitativamente. Qui, forniamo un protocollo per indurre scrunching utilizzando vari stimoli fisici e chimici. Dettagliamo la caratterizzazione quantitativa dello scrunching, che può essere utilizzata per distinguerlo dalla peristalsi e dal planata, utilizzando un software liberamente disponibile. Poiché lo scrunching è un'andatura planaria universale, anche se con differenze caratteristiche specifiche delle specie, questo protocollo può essere ampiamente applicato a tutte le specie di planari, quando si utilizzano considerazioni appropriate. Per dimostrarlo, confrontiamo la risposta delle due specie planariari più popolari utilizzate nella ricerca comportamentale, Dugesia japonica e Schmidtea mediterraneo,con lo stesso insieme di stimoli fisici e chimici. Inoltre, la specificità dello scrunching consente di utilizzare questo protocollo in combinazione con l'interferenza dell'RNA e/o l'esposizione farmacologica per sezionare gli obiettivi molecolari e i circuiti neuronali coinvolti, fornendo potenzialmente informazioni meccanicistiche su importanti aspetti della nocicezione e della comunicazione neuromuscolare.
Introduzione
Oltre alla loro popolarità per le cellule staminali e la ricerca dirigenerazione 1,2,3, planarini d'acqua dolce sono stati a lungo utilizzati negli studi comportamentali4,5, sfruttando le loro dimensioni relativamente grandi (pochi millimetri di lunghezza), facilità e basso costo di manutenzione di laboratorio, e ampio spettro di comportamenti osservabili. L'introduzione della visione artificiale e il monitoraggio automatizzato agli studi sul comportamento planaria6,7,8,9,10,11 hanno permesso la differenziazione quantitativa dei fenotipi comportamentali. Il comportamento animale è una lettura diretta della funzione neuronale. Poiché il sistema nervoso planaria è di medie dimensioni e complessità, ma condivide elementi chiave conservati con il cervello vertebrato12,13,14, studiare il comportamento planaria può fornire informazioni sui meccanismi conservati di azione neuronale che possono essere difficili da sondare direttamente in organismi più complessi. Così, i planari sono un modello prezioso per gli studi comparativi di neurobiologia8,12,15,16,17,18,19,20,21. Inoltre, l'ambiente acquatico consente una rapida e facile esposizione alle sostanze chimiche per studiare il loro effetto sulla funzione cerebrale nella rigenerazione e planari adulti, rendendoli un sistema popolare per la neurotossicologia22,23,24,25,26.
I planariani possiedono tre andatte distinte, denominate planata, peristalsis e scrunching. Ogni andatura è esposta in circostanze specifiche: il volo a volo è l'andatura di default, la peristalsi si verifica quando la funzione ciliaria ècompromessa 7,27, e lo scrunching è un'andatura di fuga – indipendente dalla funzione delle ciglia – in risposta a determinati stimoli nocivi7. Abbiamo dimostrato che lo scrunching è una risposta specifica, suscitata dalla sensazione di alcuni segnali chimici o fisici, tra cui temperature estreme o pH, lesioni meccaniche o induttori chimici specifici, e quindi non è una risposta di stressgenerale 7,28,29.
A causa della sua specificità e dei parametri stereotipati, che possono essere facilmente quantificati utilizzando questo protocollo, lo scrunching è un potente fenotipo comportamentale che consente ai ricercatori di eseguire studi meccanicistici che sezionano le vie sensoriali e il controllo neuronale del comportamento25,28. Inoltre, lo scrunching ha dimostrato di essere un endpoint sensibile al saggio effetti chimici negativi sullo sviluppo del sistema nervoso e la funzione negli studi di neurotossicologia22,24,25,30. Come diversi percorsi sensoriali diversi sembrano convergere per indurre scrunching attraverso vari meccanismi28, scrunching differisce da altri comportamenti planarili perché vari, ma specifici, stimoli possono essere utilizzati per sezionare circuiti neuronali distinti e studiare come diversi segnali sono integrati per produrre il fenotipo scrunching.
È importante sottolineare che esistono differenze di specie, in cui una sostanza chimica può suscitare scrunching in una specie planaria, ma una risposta comportamentale diversa in un'altra. Per esempio, abbiamo scoperto che l'anandamide induce scrunching nella specie planaria Dugesia japonica ma induce peristalsis in Schmidtea mediterraneo28. Questo esempio evidenzia l'importanza di essere in grado di distinguere in modo affidabile tra le diverse andatte, perché sono le manifestazioni fenotipiche di meccanismi molecolari distinti. Tuttavia, la distinzione di scrunching da peristalsis è difficile utilizzando dati osservazionali qualitativi, perché entrambe le andature sono muscolatura-driven e condividono somiglianze qualitative7,28. Così, per distinguere le andatte è necessario eseguire l'imaging delle ciglia o uno studio comportamentale quantitativo, che consente la distinzione in base ai parametricaratteriali 7,28. Poiché l'imaging delle ciglia è sperimentalemente impegnativo e richiede attrezzature specializzate come un microscopio composto ad alto ingrandimento e una telecamera ad altavelocità 7,28, non è così ampiamente accessibile ai ricercatori come l'analisi comportamentale quantitativa.
Qui, presentiamo un protocollo per (1) l'induzione di scrunching utilizzando vari stimoli fisici (temperatura nocica, amputazione, luce quasi UV) e chimici (isothiocyanate allyl (AITC), cinnamaldeidede) e (2) l'analisi quantitativa del comportamento planaria utilizzando software liberamente disponibile. Quantificando quattro parametri (frequenza delle oscillazioni della lunghezza del corpo, velocità relativa, ampiezza massima e asimmetria dell'allungamento e della contrazione del corpo)7, lo scrunching può essere differenziato da planare, peristalsis e altri stati comportamentali riportati nella letteratura, come la locomozione simile a unserpente 15 o le epilessie15. Inoltre, mentre lo scrunching è conservato tra le diverse specie planariari7, ogni specie ha la sua frequenza e velocità caratteristica; pertanto, una volta determinate le velocità di planata e di tascafo di una specie, la velocità da sola può essere utilizzata come mezzo per distinguere lo scarsobo passare dal planilo e dalla peristaalsis29. Il protocollo non presuppone alcuna formazione preventiva nell'analisi computazionale delle immagini o negli studi comportamentali e quindi può essere applicato anche per esperimenti comportamentali planariari in un contesto di laboratorio didattico a livello universitario. I dati di esempio per facilitare l'adattamento del protocollo sono forniti nel materiale supplementare.
Protocollo
1. Analisi quantitative del comportamento planaria
- Configurazione sperimentale
- Posizionare un pannello LED dimmable su una superficie piana. Il pannello LED ha due scopi: (1) fornire uno sfondo bianco uniforme e (2) da utilizzare come sorgente luminosa regolabile per ottenere un contrasto appropriato. Posizionare un'arena di piatto Petri da 100 mm sul pannello LED.
NOTA: per aumentare la velocità effettiva, una piastra multi-pozzo può essere utilizzata come arena23,24, ma arene più grandi facilitano l'analisi automatizzata delle immagini. - Montare una telecamera su un supporto ad anello sopra l'arena (Figura 1A). Regolare la posizione, l'altezza e la messa a fuoco della fotocamera in base alle esigenze in modo che l'intera arena sia centrata all'interno del campo di visualizzazione e sia a fuoco (Figura 1B).
NOTA: La risoluzione della fotocamera deve essere sufficientemente alta da distinguere chiaramente un planariano dallo sfondo omogeneo fornito dal pannello LED. - Riempire l'arena con i mezzi di esposizione appropriati (acqua planaria o soluzione chimica) al volume mezzo massimo (questo sarà indicato come un bagno). Questo corrisponde a circa 25 mL per un piatto Petri da 100 mm. Accendere il pannello LED e spegnere eventuali altre sorgenti di luce che possono influire negativamente sulla qualità di registrazione (ad esempio, sorgenti di luce vicine che producono un bagliore sull'arena).
CAUTION: Gestire le soluzioni chimiche pericolose in modo appropriato indossando attrezzature di protezione personale complete (PPE) e spostando l'installazione sperimentale in un cofano di fumi, se necessario. Seguire le normative federali e statali sullo smaltimento dei rifiuti. - Lascia cadere un planariano verso il centro dell'arena usando una pipetta di trasferimento. Iniziare la registrazione. Registrare i dati come sequenze di immagini in un formato nativo di Fiji31 (TIFF, GIF, JPEG, PNG, DICOM, BMP, PGM o FITS; vedere la sezione 1.2 dell'analisi delle immagini).
NOTA: Poiché i comportamenti e la sensibilità agli stimoli esterni variano tra i singoli planari, è importante raccogliere dati su un numero sufficientemente elevato di repliche biologiche, oltre a eseguire repliche tecniche. Abbiamo lavorato con fino a 10 planari di medie dimensioni (4-7 mm) in un piatto Petri da 100 mm in una sola volta. Anche se efficiente in termini di tempo, più planari nel piatto Petri allo stesso tempo rendono l'analisi dei dati più difficile dal momento che i planariani possono incrociarsi.- Per gli esperimenti di planata, registrare utilizzando almeno 1 fotogramma al secondo (FPS). Per gli esperimenti di scrunching/peristalsis, registrare utilizzando un FPS che è almeno il doppio della frequenza scrunching/peristalsis della specie planaria. Se la specie planaria ha una frequenza di scrunching/peristalsis sconosciuta, utilizzare 10 FPS come punto di partenza e aumentare/diminuire a seconda dei casi.
- Quando si utilizza una soluzione chimica, trasferire il planaria utilizzando il minor numero possibile di gocce di acqua planaria in modo che la concentrazione della soluzione chimica non sia significativamente modificata.
- Per gli esperimenti di volo a volo, registrare 1-2 minuti di comportamento di planata. Per gli esperimenti di scrunching/peristalsis, registrare abbastanza a lungo da catturare almeno 3 oscillazioni consecutive che si verificano in linea retta. Una volta completato l'esperimento, terminare la registrazione.
NOTA: Per gli esperimenti di scrunching/peristalsis, se un planaria non soddisfa il criterio di terminazione entro un periodo di tempo fisso che deve essere coerente tra le repliche ed è determinato empiricamente in base allo stimolo, terminare la registrazione e testare un altro planaria.- Se il planaria raggiunge il confine dell'arena senza soddisfare il criterio di terminazione, pipette il planaria torna al centro dell'arena.
NOTA: Evitare il pipettamento ripetuto di un individuo per la registrazione, in quanto ciò potrebbe modificarne il comportamento.
- Se il planaria raggiunge il confine dell'arena senza soddisfare il criterio di terminazione, pipette il planaria torna al centro dell'arena.
- Rimuovere i planari dall'arena e smaltire l'acqua planaria o la soluzione chimica in apposti contenitori di rifiuti. I planari che erano in acqua planaria possono essere restituiti al loro contenitore di casa.
NOTA: Evitare la contaminazione incrociata utilizzando arene diverse per diversi media (ad esempio, il volo a volo d'acqua planaria non dovrebbe essere eseguito in un'arena precedentemente utilizzata per esperimenti di scrunching/peristalsis con esposizione chimica).- Risciacquare in seriemente i planari esposti a una soluzione chimica in 3 piatti Petri puliti da 100 mm riempiti con 25 mL di acqua planaria per diluire completamente eventuali sostanze chimiche. Se è stata indotta scrunching o peristalsis, posizionare questi planari in un contenitore separato. I planariani possono essere restituiti al loro contenitore di casa dopo un mese poiché la maggior parte delle cellule si sarebbe ribaltata entro quel momento1.
NOTA: se sono necessari più esperimenti diversi per la stessa popolazione di planari, ad esempio per una popolazione RNAi, consentire ai planari di riprendersi per 24 ore prima di eseguire l'esperimento successivo. Ordinare gli esperimenti in modo tale che l'esperimento meno invasivo sia il primo e l'esperimento più invasivo (ad esempio, l'amputazione) sia eseguito per ultimo. - Se si eseguono più esperimenti nella stessa arena, smaltire correttamente la soluzione del bagno e rimuovere eventuali tracce di muco asciugando l'arena con un tovagliolo di carta tra una corsa e l'altra.
NOTA: il protocollo può essere messo in pausa qui.
- Risciacquare in seriemente i planari esposti a una soluzione chimica in 3 piatti Petri puliti da 100 mm riempiti con 25 mL di acqua planaria per diluire completamente eventuali sostanze chimiche. Se è stata indotta scrunching o peristalsis, posizionare questi planari in un contenitore separato. I planariani possono essere restituiti al loro contenitore di casa dopo un mese poiché la maggior parte delle cellule si sarebbe ribaltata entro quel momento1.
- Posizionare un pannello LED dimmable su una superficie piana. Il pannello LED ha due scopi: (1) fornire uno sfondo bianco uniforme e (2) da utilizzare come sorgente luminosa regolabile per ottenere un contrasto appropriato. Posizionare un'arena di piatto Petri da 100 mm sul pannello LED.
- Analisi quantitativa del comportamento planaria
- Eseguire i test di comportamento planaria come descritto nella Sezione 1.1.
- Aprite la sequenza di immagini non elaborata per un esperimento in Figi (File > Importa > Sequenza immagini) e selezionate la prima immagine nella sequenza di immagini. Nella finestra Opzioni sequenza, selezionare la casella "Ordina i nomi numericamente" e fare clic su "OK". Una volta caricata la sequenza di immagini, convertite la sequenza di immagini in 8 bit (Immagine > Testo > 8 bit) e utilizzate lo strumento freccia o cursore nella parte inferiore della pila di immagini per guardare o scorrere la sequenza di immagini.
NOTA: Per gli esperimenti di planata, tutti i dati possono essere utilizzati fino a quando il planariano può essere chiaramente visto in tutta la registrazione. Tuttavia, di solito è sufficiente analizzare il movimento libero al centro dell'arena estraendo le parti pertinenti come descritto di seguito. - Per estrarre un periodo di tempo e una regione di interesse, disegnare un'area di interesse che comprenda il percorso completo di un planaria utilizzando lo strumento rettangolo (Figura 2A, 2B). Fare clic con il pulsante destro del mouse sulla pila di immagini e selezionare Duplica..., selezionare la casella di controllo Duplica pila, immettere il primo e l'ultimo fotogramma della sequenza di interesse e fare clic su OK. Se più planari sono stati immagine contemporaneamente, ripetere questa fase di selezione e duplicazione regione per ogni planaria nell'arena in modo che ci siano tante pile di immagini aperte come ci sono planari nell'arena. I passaggi seguenti (passaggi 1.2.4-1.2.10) devono essere eseguiti su ogni pila di immagini, una alla volta.
- Per gli esperimenti di volo a volo d'aria, estrarre un periodo di planata in cui il planariano si muove almeno due volte la sua lunghezza corporea.
NOTA: più dati di planata estratti per planariano, più affidabili saranno i dati. Il planariano non ha bisogno di muoversi in linea retta per l'analisi del volo a volo. - Per gli esperimenti di scrunching/peristalsis, estrarre un esempio quando il planaria subisce un minimo di tre oscillazioni corporee consecutive (idealmente più) in linea retta, assicurandosi che ogni oscillazione sia un ciclo completo di allungamento-contrazione, poiché sono necessarie oscillazioni complete per determinare con precisione la frequenza.
NOTA: più oscillazioni possono essere estratte, più affidabili saranno i dati. Non utilizzare sequenze in cui il planaria sta girando in quanto questi si tradurrà in misurazioni di lunghezza imprecise.
- Per gli esperimenti di volo a volo d'aria, estrarre un periodo di planata in cui il planariano si muove almeno due volte la sua lunghezza corporea.
- Applicare una soglia alla pila di immagini duplicate (Immagine > Regola > Soglia) per eseguire il file binario dell'immagine ed estrarre il planariano dallo sfondo. Regolare le barre scorrevoli in base alle esigenze in modo che l'intera planaria sia evidenziata in rosso. I valori esatti dipendono dalla qualità dell'imaging. Lasciare deselezionate le caselle Sfondo scuro, Istogramma impilamento e Non reimpostare l'intervallo. Scorrere la pila di immagini per garantire un buon intervallo di soglia (ad esempio, il planariano è ben separato dallo sfondo in tutta la pila) e quindi fare clic su Applica.
- Nella finestra Converti stack in binario, impostare il metodo su default e lo sfondo su Light. Deselezionare tutte le caselle in questa finestra e quindi fare clic su OK. Apparirà un'immagine binaria che mostra un planariano nero su uno sfondo bianco (Figura 2C). Assicuratevi che l'intero planariano sia visibile in tutti i fotogrammi della sequenza di immagini.
NOTA: gli oggetti indesiderati nella sequenza di immagini binarie più piccoli o più grandi del planariano possono essere filtrati nell'analisi successiva utilizzando un filtro di dimensione (Figura 2Ciii). - Impostare le misurazioni facendo clic su Analizza > Imposta misurazioni. Selezionare le caselle Area , Centro di massa , Posizionepila e Adattaellissi e fare clic su OK.
NOTA: questi parametri devono essere impostati una sola volta per ogni sessione Fiji. - Selezionate la pila di immagini aperta e selezionate Analizza > Analizza particelle.
- Nella finestra Analizza particelle, selezionate Mostra > Maschere per aprire una nuova pila che mostra tutti gli oggetti rilevati con i parametri scelti. Questo può essere utilizzato per controllare visivamente che solo le misurazioni del planariano sono state prese. In questo passaggio è possibile impostare un filtro di dimensione per rimuovere il rumore indesiderato immettendo l'area approssimativa del planariano (in unità pixel2) nello spazio fornito. Selezionare le caselle Visualizza risultati e Cancella risultati e fare clic su OK.
NOTA: nella finestra Risultati, se l'indice (prima colonna) non è uguale al numero di sezione per tutte le righe, significa che sono stati rilevati troppi o troppi oggetti. Una possibilità per questa discrepanza è la presenza di altri oggetti oltre al planariano o che il planariano non è stato tracciato in fotogrammi specifici. - Eseguire una panoramica della pila di immagini della maschera utilizzando il cursore nella parte inferiore del pannello. Se c'è qualche disturbo o sono fotogrammi privi di planariano, chiudete la finestra Risultati e la pila di immagini della maschera. Ripetere i passaggi 1.2.7-1.2.8 regolando il filtro area in modo da rimuovere solo oggetti diversi dal planariano.
NOTA: se il planariano non è presente nella cornice della maschera, significa che il limite inferiore del filtro area è stato impostato su un valore troppo alto. - Nella finestra Risultati salvare i dati utilizzando File>Salva con nome. Aggiungere l'estensione .csv al nome del file per salvare i dati come valori delimitati da virgole. Una volta salvati i dati per la pila di immagini, chiudere la rispettiva pila di immagini e le finestre Risultati e Maschera.
- Importa i dati e analizza ulteriormente utilizzando qualsiasi software per fogli di calcolo o freeware. Per calcolare la velocità di planata, fare riferimento alla sezione 1.3. Per calcolare il set di parametri completo, fare riferimento alla sezione 1.4.
NOTA: il protocollo può essere messo in pausa qui. - Per determinare la conversione da pixel a lunghezza effettiva, aprire un'immagine in Figi con una lunghezza di riferimento (ad esempio, il diametro dell'arena). Selezionare lo strumento linea e disegnare una linea sulla lunghezza nota.
- Convertire le unità pixel in un'unità di lunghezza standard facendo clic su Analizza > Imposta scala. Immettere la lunghezza corrispondente alla linea disegnata sull'immagine nella casella Distanza nota e modificare l'unità di lunghezza da pixel all'unità di lunghezza standard scelta. Il fattore di conversione viene scritto accanto a Scala.
NOTA: non è necessario un valore di conversione dei pixel per le analisi di planata o scrunching/peristalsis nelle sezioni 1.3 e 1.4.
- Calcolo della velocità di planata
- Utilizzando il file di dati salvato nella sezione 1.2, caricare le coordinate x e y del centro di massa (COM) e i dati dell'asse principale. Se i dati vengono salvati come file di valori delimitati da virgole, questi elenchi corrispondono rispettivamente alle colonne "XM", "YM" e "Major".
- Calcolare lo spostamento (d) del centro planaria di massa in pixel per ogni fotogramma rispetto al fotogramma successivo utilizzando le colonne di dati "XM" e "YM". Lo spostamento (d) è dato da:
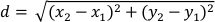
dove x1 e y1 si riferiscono alle coordinate COM (XM, YM) di un fotogramma e x2 e y2 si riferiscono alle coordinate COM (XM, YM) del fotogramma successivo. - Impostare la lunghezza del corpo planaria come 95esimo percentile della colonna "Major". Poiché i planari presentano un comportamento di preferenza delmuro 32, questo assicura che la lunghezza del corpo planaria calcolata sia rappresentativa di quando il planariario èallungato 24.
- Normalizzare lo spostamento per lunghezza del corpo planaria dividendo gli spostamenti dei pixel per fotogramma per la lunghezza del corpo planaria (l). Lo spostamento normalizzato (dn) è dato da:
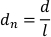
- Generare un elenco di velocità normalizzate dividendo gli spostamenti normalizzati per il tempo trascorso per fotogramma (inverso dell'FPS registrato). La velocità di planata normalizzata (sn) è data da:
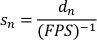
- Calcolare la velocità di planata normalizzata del planaria prendendo la media dell'elenco delle velocità normalizzate (sn). La deviazione standard può essere utilizzata come misura dell'incertezza per il planariano.
- Ripetere i passaggi 1.3.1-1.3.6 per ogni planariano da analizzare. Media e prendere la deviazione standard delle velocità di volo a volo per tutti i planari per ottenere la velocità di planata e l'incertezza associata, rispettivamente, per una popolazione planaria.
- Distinzione di etere scrunching e peristalsis utilizzando il set di parametri completo
- Caricare l'elenco dei dati dell'asse principale dal file di dati salvato dalla sezione 1.2. Se i dati vengono salvati come file di valori delimitati da virgole, corrisponde alla colonna Principale.
- Creare un elenco che numeri ogni punto dati nella colonna Principale, a partire da 0. Converti questo elenco in tempo trascorso per fotogramma dividendo per l'FPS registrato.
- Tracciare i dati della colonna Major rispetto al tempo trascorso per generare un grafico di oscillazione scrunching/peristalsis (Figura 3A). Utilizzando il grafico di oscillazione, tagliare i dati ad almeno tre oscillazioni consecutive in linea retta (Figura 3Bi). Tagliare i dati per iniziare e terminare ai picchi locali (allungamento massimo dell'oscillazione) o avvallamenti (allungamento minimo dell'oscillazione).
NOTA: Se l'estremità locale non è approssimativamente uguale (picchi/troughs differiscono drammaticamente in altezze), ciò suggerisce che le oscillazioni non sono in linea retta (Figura 3Bii). Estrarre un'altra sequenza di almeno tre oscillazioni consecutive in linea retta. Fare riferimento alla Sezione 1.2. - Verificare che la sequenza di oscillazione di interesse sia stata estratta e tagliata correttamente ricoplottando i dati principali tagliati rispetto al tempo. Utilizzare questo elenco di dati tagliati per tutti i calcoli successivi.
- Per calcolare la frequenza di oscillazione (νm), dividere il numero di oscillazioni (On) per il numero totale di punti dati nell'elenco di dati dell'asse principale tagliato (N). Moltiplicare FPS per questo valore per ottenere la frequenza in oscillazioni al secondo.
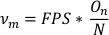
- Per calcolare l'allungamento massimo max), sottrarre la lunghezza minima assoluta del corpo (lmin) dalla lunghezza massima assoluta del corpo (lmax). Normalizzare alla lunghezza del corpo allungata dividendo per la lunghezza massima assoluta del corpo.
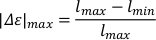
- Per calcolare la velocità per lunghezza del corpo (v,moltiplicarel'allungamento massimo calcolato per la frequenza di oscillazione.
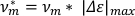
NOTA: La velocità da sola può essere utilizzata per distinguere tra andatte scrunching e peristalsis7. - Per calcolare la frazione di tempo impiegato per allungare (felong),prendere la derivata dell'elenco di dati dell'asse principale tagliato rispetto al tempo. Dividere il numero di punti dati positivi (ad esempio, quando la derivata è >0 (np), per il numero totale di punti dati nell'elenco di dati dell'asse principale (nt)).
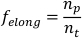
NOTA: i planarini scrunching presentano una frazione asimmetrica del tempo impiegato allungando, mentre i planari che eseguono la peristaalsi trascorrono la stessa quantità di tempo allungando econtraendo 7. - Ripetere i passaggi 1.4.1-1.4.8 per ogni planariano da analizzare. Calcolare un parametro di popolazione planaria impostato prendendo la deviazione media e standard di ogni parametro.
NOTA: Il set di parametri può essere utilizzato per determinare se il comportamento dell'oscillazione è scrunching, peristalsis o qualche altra forma di locomozione con modifiche periodiche della forma del corpo. Sia scrunching che peristalsis hanno parametri fissi per una determinata specie7, con parametri di tascollante generalmente maggiori dei parametri peristalsis7. Sebbene sia possibile che uno dei parametri non riemessi dall'intervallo specifico della specie, come abbiamo osservato in precedenza con l'induzione chimica28, il comportamento osservato deve essere d'accordo con almeno 3 dei 4 parametri pubblicati da classificare come peristalsis o scrunching.
2. Induzione scrunching
- Stimoli fisici (temperatura nociva, luce UV, amputazione)
- Per tutti gli esperimenti di stimoli fisici, fare riferimento alla Sezione 1.1 per l'installazione sperimentale.
NOTA: È meglio usare una grande arena, come un piatto Petri da 100 mm, per esperimenti di stimoli fisici per consentire più spazio aperto per manovrare una pipetta e/o una lama di rasoio. - Per indurre lo scrunching a temperatura nociva, l'acqua planaria termica in un bicchiere di vetro (almeno 100 L per planariano da testare) a 65 gradi centigradi su una piastra calda.
- Posizionare un planariano al centro dell'arena. Attendere che il planaria si orienti in posizione verticale e inizia a scivolare. Iniziare la registrazione.
- Utilizzando una pipetta P-200, la pipetta lenta 100 lL dell'acqua planaria da 65 gradi centigradi post-pharyngeally sulla coda del planaria per indurre lo scrunching.
NOTA: Assicurarsi che l'acqua planaria riscaldata rimanga a 65 gradi centigradi. Se necessario, riscaldare l'acqua a 65 gradi centigradi prima di iniziare un altro esperimento. Poiché la pressione può anche indurre scrunching, è necessario pipettare lentamente. Pipettare l'acqua a temperatura ambiente nello stesso modo in cui nell'esperimento può servire come opzione di controllo e pratica. - Interrompere la registrazione una volta che lo scrunching è cessato. Mettere il planariano in un contenitore di recupero e scambiare i supporti nella piastra di Petri con acqua planaria a temperatura ambiente fresca se si eseguono più esperimenti.
- Per indurre lo scrunching tramite amputazione, trasferire un planariano al centro dell'arena e attendere che il planaria si orienti in posizione verticale e inizia a scivolare. Iniziare la registrazione.
- Amputate il planariano usando una lama pulita. Le amputazioni possono essere eseguite ovunque lungo il planariano, purché la posizione di taglio sia coerente tra gli esperimenti.
NOTA: i parametri di scrunching vengono estratti dal pezzo anteriore. Quindi, evitare di ostacolare la vista della telecamera di questa parte del planariano quando si applica il taglio avvicinandosi dall'estremità posteriore. Le traligli di copertura in plastica funzionano bene anche per il taglio e sono un'opzione più sicura, soprattutto in un ambiente di insegnamento. - Interrompere la registrazione una volta che il pezzo anteriore ha cessato di scrunching. Rimuovere entrambi i pezzi, metterli in un contenitore separato e consentire loro di rigenerare per 7 giorni. I planari amputati possono essere reincorporati nel contenitore di casa una volta rigenerati.
- Amputate il planariano usando una lama pulita. Le amputazioni possono essere eseguite ovunque lungo il planariano, purché la posizione di taglio sia coerente tra gli esperimenti.
- Per indurre lo scrunching utilizzando la luce quasi UV, collegare filtri appropriati (ad esempio, filtri Roscolux) all'obiettivo della fotocamera per ridurre la quantità di luce quasi UV riflessa che viene raccolta dalla fotocamera e può interferire con l'imaging della risposta del planariano. Invece di utilizzare il pannello LED per illuminare l'arena dal basso, utilizzare l'illuminazione rossa ambientale a cui i planari sono insensibili33.
- Riempire un'arena di piatto Petri da 100 mm con acqua planaria e posizionare un singolo planaria (5-9 mm) al centro dell'arena. Iniziare la registrazione a 10 FPS.
- Tenere un puntatore laser UV di classe II (405 ± 10 nm, potenza di uscita <5 mW) a circa 30 cm dall'arena. Posizionare il puntatore laser ad un angolo di 45 gradi dal planario di volo a planario e quindi far brillare il puntatore laser per 5-10 secondi a metà strada tra l'estremità posteriore del pharynx e la punta della coda per indurre lo scrunching.
NOTA: la potenza del puntatore laser può essere misurata utilizzando un misuratore di potenza sensibile all'UV. - Attendere che il planaria inizi a scivolare di nuovo prima di tentare altre due stimolazioni sullo stesso individuo per verificare la riproducibilità della reazione. Se il planaria continua a mostrare lo stesso comportamento, interrompere la registrazione e rimettere il planaria nel suo contenitore. Se il comportamento cambia tra le stimolazioni, test aggiuntivi mostreranno quale risposta è la più importante.
NOTA: I planariani possono diventare insensibili alla luce quasi UV e smetterà di reagire. Le stimolazioni consecutive richiedono un periodo di riposo di 8-10 secondi.
- Per tutti gli esperimenti di stimoli fisici, fare riferimento alla Sezione 1.1 per l'installazione sperimentale.
- Stimolo chimico (AITC)
- Per indurre lo scrunching utilizzando una sostanza chimica, ad esempio, il TRPA1 agonista AITC28, i planari sono idealmente immersi in un bagno della sostanza chimica. Se necessario, il pipettamento può essere applicato come descritto nella sezione 2.1.2.3.
CAUTION: AITC è infiammabile, acutamente tossico, può causare irritazione della pelle e degli occhi, sensibilizzazione respiratoria e cutanea ed è pericolosa per la vita acquatica. L'olio AITC deve essere maneggiato in un cappuccio di fumi. Prima di realizzare soluzioni stock di AITC, mettere su PPE appropriati (guanti di nitrile e un camice da laboratorio) e impostare adeguati contenitori per lo smaltimento dei rifiuti pericolosi solidi e liquidi. - In un cappuccio di fumi, fare una soluzione stock di 10 mM di AITC in acqua planaria in un tubo di centrifuga da 50 mL. Questa soluzione stock è utilizzabile per un massimo di un mese quando viene immagazzinata a 4 gradi centigradi.
- Da questo stock, preparate una soluzione di lavoro di 25 mL di 100 AITC in acqua planaria in un tubo di centrifuga da 50 mL. Questa soluzione AITC da 100 M sarà utilizzata per indurre lo scrunching nei planari.
NOTA: 100 AITC di M induce scrunching coerente in D. japonica e S. mediterraneo planarians28. Per gli altri planarini acquatici, 100 M possono servire come concentrazione iniziale e possono essere regolati di conseguenza. - Impostare l'installazione sperimentale (fare riferimento alla Sezione 1.1). Riempire l'arena con la soluzione di lavoro AITC e posizionarla in un contenitore secondario. Il contenitore secondario deve contenere almeno il doppio del volume dell'arena.
NOTA: Gli esperimenti possono essere effettuati all'interno di un cofano di fumi per una maggiore sicurezza. - Trasferisci fino a 10 planari al centro dell'arena e inizia a registrare.
- Una volta che i planari diventano insensibili e cessano di scrunching, smettere di registrare. Rimuovere i planari dalla soluzione AITC e risciacquare (fare riferimento alla Sezione 1.1). Smaltire i rifiuti AITC solidi e liquidi in contenitori di rifiuti appropriati.
- Verificare la specificità della risposta ad AITC utilizzando RNAi a TRPA128 seguendo i protocolli standard.
- Da questo stock, preparate una soluzione di lavoro di 25 mL di 100 AITC in acqua planaria in un tubo di centrifuga da 50 mL. Questa soluzione AITC da 100 M sarà utilizzata per indurre lo scrunching nei planari.
- Per indurre lo scrunching utilizzando una sostanza chimica, ad esempio, il TRPA1 agonista AITC28, i planari sono idealmente immersi in un bagno della sostanza chimica. Se necessario, il pipettamento può essere applicato come descritto nella sezione 2.1.2.3.
Risultati
La percezione extraoculare quasi UV in S. mediterraneo planarins è TRPA1-dipendente ed è stato proposto di essere collegato a H2O2 release17. Poichél'esposizioneH 2 O2 induce lo scrunching dipendente da TRPA1 in S. mediterraneo e D. japonica planarians28, le fasi della sezione 2.1.4 possono essere utilizzate per verificare se l'esposizione alla luce quasi UV induce scrunching in entrambe le specie. Me...
Discussione
Utilizzando questo protocollo, si possono studiare quantitativamente gli effetti degli stimoli fisici e chimici7,28,29 o manipolazione genetica (RNAi)28,29 sulla locomozione planaria. Per massimizzare la risoluzione spaziale, è meglio spostare la fotocamera il più vicino possibile all'arena, assicurandosi che l'intera arena sia nel campo di vista. Per aumentare la velo...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori ringraziano il signor Tapan Goel per i commenti sul manoscritto. Questo lavoro è stato finanziato da NSF CAREER Grant 1555109.
Materiali
| Name | Company | Catalog Number | Comments |
| Allyl isothiocyanate, 95% (AITC) | Sigma-Aldrich | 377430-5G | CAUTION: Flammable and acutely toxic; handle in a fume hood with appropriate PPE. |
| Camera lens, 2/3 25mm F/1.4 | Tamron | 23FM25SP | |
| Cell culture plates, 6 well, tissue culture treated | Genesee Scientific | 25-105 | |
| Centrifuge tubes, 50 mL polypropylene, sterile | MedSupply Partners | 62-1019-2 | |
| Cinnamaldehyde, >95% | Sigma-Aldrich | W228613-100G-K | |
| Dimmable A4 LED Tracer Light Box | Amazon | B07HD631RP | |
| Flea3 USB3 camera | FLIR | FL3-U3-13E4M | |
| Heat resistant gloves | Fisher Scientific | 11-394-298 | |
| Hot plate | Fisher Scientific | HP88854200 | |
| Instant Ocean Sea Salt, prepared in deionized water | Instant Ocean | SS15-10 | Prepare in deionized water at 0.5 g/L. |
| Montjüic salts, prepared in Milli-Q water | Sigma-Aldrich | various | Prepare in milli-Q water at 1.6 mM NaCl, 1.0 mM CaCl2, 1.0 mM MgSO4, 0.1 mM MgCl2, 0.1 mM KCl, 1.2 mM NaHCO3; adjust pH to 7.0 with HCl. |
| Petri dishes, 100 mm x 20 mm, sterile polystyrene | Simport | D210-7 | |
| Pipette, 20-200 μL range | Rainin | 17008652 | |
| PYREX 150 mL beaker | Sigma-Aldrich | CLS1000150 | |
| Razor blade, 0.22 mm | VWR | 55411-050 | |
| Roscolux color filter: Golden Amber | Rosco | R21 | Alternatively purchase the Roscolux Designer Color Selector (Musson Theatrical product #SBLUX0306) which includes all 3 color filters together. |
| Roscolux color filter: Medium Red | Rosco | R27 | |
| Roscolux color filter: Storaro Red | Rosco | R2001 | |
| Samco transfer pipette, 62 µL large aperture | Thermo Fisher | 691TS | |
| Support stand | Fisher Scientific | 12-947-976 | |
| Thermometer | VWR | 89095-600 | |
| UV laser pointer | Amazon | B082DGS86R | This is a Class II laser (405nm ±10nm) with output power <5 mW. |
Riferimenti
- Rink, J. C. Stem cell systems and regeneration in planaria. Development Genes and Evolution. 223, 67-84 (2013).
- Reddien, P. W., Alvarado, A. S. Fundamentals of Planarian Regeneration. Annual Review of Cell and Developmental Biology. 20, 725-757 (2004).
- Cebrià, F. Regenerating the central nervous system: how easy for planarians. Development Genes and Evolution. 217, 733-748 (2007).
- Pearl, R. Memoirs: The Movements and Reactions of Fresh-Water Planarians: A Study in Animal Behaviour. Journal of Cell Science. , 2-46 (1903).
- Mc Connell, J. . A Manual of Psychological Experimentation on Planarians. , (1967).
- Talbot, J., Schötz, E. M. Quantitative characterization of planarian wild-type behavior as a platform for screening locomotion phenotypes. Journal of Experimental Biology. 214, 1063-1067 (2011).
- Cochet-Escartin, O., Mickolajczk, K. J., Collins, E. M. S. Scrunching: a novel escape gait in planarians. Physical Biology. 12, 055001 (2015).
- Inoue, T., et al. Planarian shows decision-making behavior in response to multiple stimuli by integrative brain function. Zoological Letters. 1, 1-15 (2015).
- Arenas, O. M., et al. Activation of planarian TRPA1 by reactive oxygen species reveals a conserved mechanism for animal nociception. Nature Neuroscience. 20, 1686-1693 (2017).
- Shomrat, T., Levin, M. An automated training paradigm reveals long-term memory in planarians and its persistence through head regeneration. Journal of Experimental Biology. 216, 3799-3810 (2013).
- Blackiston, D., Shomrat, T., Nicolas, C. L., Granata, C., Levin, M. A Second-Generation device for automated training and quantitative behavior analyses of Molecularly-Tractable model organisms. PLoS One. 5, 1-20 (2010).
- Ross, K. G., Currie, K. W., Pearson, B. J., Zayas, R. M. Nervous system development and regeneration in freshwater planarians. Wiley Interdisciplinary Reviews-Developmental Biology. 6, 266 (2017).
- Cebrià, F., et al. The expression of neural-specific genes reveals the structural and molecular complexity of the planarian central nervous system. Mechanisms of Development. , 116-204 (2002).
- Mineta, K., et al. Origin and evolutionary process of the CNS elucidated by comparative genomics analysis of planarian ESTs. Proceedings of the National Academy of Sciences of the United States of America. 100, 7666-7671 (2003).
- Ross, K. G., et al. SoxB1 Activity Regulates Sensory Neuron Regeneration, Maintenance, and Function in Planarians. Developmental Cell. 47, 331-347 (2018).
- Nishimura, K., et al. Reconstruction of Dopaminergic Neural Network and Locomotion Function in Planarian Regenerates. Developmental Neurobiology. 67, 1059-1078 (2007).
- Birkholz, T. R., Beane, W. S. The planarian TRPA1 homolog mediates extraocular behavioral responses to near-ultraviolet light. Journal of Experimental Biology. 220, 2616-2625 (2017).
- Currie, K. W., Molinaro, A. M., Pearson, B. J. Neuronal sources of hedgehog modulate neurogenesis in the adult planarian brain. Elife. 5, (2016).
- Talbot, J. A., Currie, K. W., Pearson, B. J., Collins, E. M. S. Smed-dynA-1 is a planarian nervous system specific dynamin 1 homolog required for normal locomotion. Biology Open. , 1-8 (2014).
- Currie, K. W., Pearson, B. J. Transcription factors lhx1/5-1 and pitx are required for the maintenance and regeneration of serotonergic neurons in planarians. Development. 140, 3577-3588 (2013).
- Hagstrom, D., et al. Planarian cholinesterase: molecular and functional characterization of an evolutionarily ancient enzyme to study organophosphorus pesticide toxicity. Archives of Toxicology. 92, 1161-1176 (2018).
- Hagstrom, D., Cochet-Escartin, O., Collins, E. M. S. Planarian brain regeneration as a model system for developmental neurotoxicology. Regeneration. 3, 65-77 (2016).
- Hagstrom, D., Cochet-Escartin, O., Zhang, S., Khuu, C., Collins, E. M. S. Freshwater planarians as an alternative animal model for neurotoxicology. Toxicological Sciences. 147, 270-285 (2015).
- Zhang, S., Hagstrom, D., Hayes, P., Graham, A., Collins, E. M. S. Multi-behavioral endpoint testing of an 87-chemical compound library in freshwater planarians. Toxicological Sciences. , 26-44 (2019).
- Zhang, S., Hagstrom, D., Siper, N., Behl, M., Collins, E. M. S. Screening for neurotoxic potential of 15 flame retardants using freshwater planarians. Neurotoxicology and Teratology. 73, 54-66 (2019).
- Wu, J. P., Li, M. H. The use of freshwater planarians in environmental toxicology studies: Advantages and potential. Ecotoxicology and Environmental Safety. 161, 45-56 (2018).
- Rompolas, P., Azimzadeh, J., Marshall, W. F., King, S. M. Analysis of ciliary assembly and function in planaria. Methods in Enzymology. 525, 245-264 (2013).
- Sabry, Z., et al. Pharmacological or genetic targeting of Transient Receptor Potential (TRP) channels can disrupt the planarian escape response. PLoS One. , 753244 (2019).
- Cochet-Escartin, O., Carter, J. A., Chakraverti-Wuerthwein, M., Sinha, J., Collins, E. M. S. Slo1 regulates ethanol-induced scrunching in freshwater planarians. Physical Biology. 13, 1-12 (2016).
- Hagstrom, D., Truong, L., Zhang, S., Tanguay, R. L., Collins, E. M. S., et al. Comparative analysis of zebrafish and planarian model systems for developmental neurotoxicity screens using an 87-compound library. Toxicological Sciences. , (2019).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Akiyama, Y., Agata, K., Inoue, T. Spontaneous Behaviors and Wall-Curvature Lead to Apparent Wall Preference in Planarian. PLoS One. 10, 0142214 (2015).
- Paskin, T. R., Jellies, J., Bacher, J., Beane, W. S. Planarian Phototactic Assay Reveals Differential Behavioral Responses Based on Wavelength. PLoS One. 9, 114708 (2014).
- Petrus, M., et al. A role of TRPA1 in mechanical hyperalgesia is revealed by pharmacological inhibition. Molecular Pain. 3, 40 (2007).
- Takano, T., et al. Regeneration-dependent conditional gene knockdown (Readyknock) in planarian: Demonstration of requirement for Djsnap-25 expression in the brain for negative phototactic behavior. Development, Growth & Differentiation. 49, 383-394 (2007).
- Nishimura, K., et al. Identification of glutamic acid decarboxylase gene and distribution of GABAergic nervous system in the planarian Dugesia japonica. Neuroscience. 153, 1103-1114 (2008).
- Inoue, T., Yamashita, T., Agata, K. Thermosensory signaling by TRPM is processed by brain serotonergic neurons to produce planarian thermotaxis. Journal of Neuroscience. 34, 15701-15714 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon