A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
התכתוב תכנון כקריאה התנהגותית כמותית עבור חישת גירויים מזיקים
In This Article
Summary
תכנון מים מתוקים מציגים שלוש חבטות (גלישה, פריסלזיס, ו כיווץ) הניתנים להבחנה על ידי ניתוח התנהגותי כמותי. אנו מתארים שיטה לגרום לכיסה באמצעות גירויים מזיקים שונים, כימות שלהם, והבחנה בין פריסלזיס וגלישה. באמצעות נוק-דאון גנטי, אנו מדגימים את הספנות של התכתשות כקריאה פנוטיפית כמותית.
Abstract
תכנון מים מתוקים בדרך כלל לדאות בצורה חלקה דרך הנעה ciliary בצד הפתח שלהם. תנאים סביבתיים מסוימים, עם זאת, יכול לגרום צורות מונעות על ידי התנועה: פריסלזיס או כיווץ. בעוד פריסלזיס נובע פגם ciliary, כיווץ אינו תלוי בתפקוד cilia והוא תגובה ספציפית לגירויים מסוימים, כולל קטיעה, טמפרטורה מזיקה, חומציות קיצונית, ואתנול. לפיכך, שני ההליכות המונעות על ידי בשרים הם שונים מבחינה מכנית. עם זאת, הם יכולים להיות קשים להבחין איכותית. כאן, אנו מספקים פרוטוקול לגירויים שונים באמצעות גירויים פיזיים וכימיים שונים. אנו מפרטים את האפיון הכמותי של התכתוש, אשר ניתן להשתמש בו כדי להבחין בו פריסלזיס וגלישה, באמצעות תוכנה זמינה בחופשיות. מאז כיווץ הוא הליכה פלנרית אוניברסלית, אם כי עם הבדלים ספציפיים למינים אופייניים, פרוטוקול זה יכול להיות מיושם באופן נרחב על כל מיני התכנון, בעת שימוש בשיקולים המתאימים. כדי להדגים זאת, אנו משווים את התגובה של שני המינים הפלנריים הפופולריים ביותר המשמשים במחקר התנהגותי, Dugesia japonica ו Schmidtea mediterranea, לאותה קבוצה של גירויים פיזיקליים וכימיים. יתר על כן, הייחודיות של כיווץ מאפשר פרוטוקול זה לשמש בשילוב עם הפרעות RNA ו / או חשיפה תרופתית לנתח את המטרות המולקולריות ואת המעגלים העצביים המעורבים, פוטנציאל מתן תובנה מכנית להיבטים חשובים של nociception ותקשורת עצבית-שרירית.
Introduction
בנוסף לפופולריות שלהם עבור תאי גזעומחקר התחדשות 1,2,3,פלנריים מים מתוקים שימשו זמן רב במחקריםהתנהגותיים 4, 5,ניצול גודלם הגדול יחסית (כמהמילימטריםבאורך), קלות ועלות נמוכה של תחזוקת מעבדה, וספקטרום רחב שלהתנהגויותנצפות. המבוא של ראייה ממוחשבת ומעקב אוטומטי ללימודיהתנהגות פלנריים 6,7,8,9,10,11 אפשרו בידול כמותי של פנוטיפים התנהגותיים. התנהגות בעלי חיים היא קריאה ישירה של תפקוד עצבי. בגלל מערכת העצבים המישנית היא בגודל בינוני ומורכבות, אבל מניות שפרו אלמנטים מרכזיים עם המוחבעל החוליות 12,13,14,לימוד התנהגות פלנרית יכול לספק תובנה לתוך מנגנונים שוחזים של פעולה עצבית אשר עשוי להיות קשה לבדיקה ישירה אורגניזמים מורכבים יותר. לפיכך, תכנון הוא מודל בעל ערך עבור מחקרי נוירוביולוגיההשוואתית 8,12,15,16,17,18,19,20,21. בנוסף, הסביבה הימית מאפשרת חשיפה מהירה ונוחה לכימיקלים כדי ללמוד את השפעתם על תפקוד המוח בהתחדשות ופלנריים בוגרים, מה שהופך אותם למערכת פופולריתלנוירו-רעלים 22,,23,,24,,25,,26.
לפלנריים יש שלוש תלינים נפרדים, המכונים גלישה, פריסלזיס, ולכיווץ. כל הליכה מוצגת בנסיבות ספציפיות: גלישה היא ההליכה המוגדרת כברירת מחדל, פריסלזיס מתרחשת כאשרפונקציית הקליארית נפרץ 7,27, ו כיווץ הוא הליכה בריחה – ללא תלות בתפקוד cilia – בתגובה לגירויים מזיקים מסוימים7. הוכנו כי כיווץ היא תגובה ספציפית, הנוזרת על ידי התחושה של רמזים כימיים או פיזיים מסוימים, כולל טמפרטורות קיצוניות או pH, פגיעה מכנית, או גורם כימי ספציפי, ולכן אינו תגובתמתח כללית 7,28,29.
בשל ספציפיותו הפרמטרים הסטריאוטיפיים שלה, אשר ניתן לכמת בקלות באמצעות פרוטוקול זה, כיווץ הוא פנוטיפ התנהגותי רב עוצמה המאפשר לחוקרים לבצע מחקרים מכניים לנתח מסלולים חושיים ושליטה עצבית שלהתנהגות 25,28. בנוסף, כיווץ כבר הראה להיות נקודת קצה רגישה כדי לומר תופעות כימיות שליליות על התפתחות מערכת העצבים ותפקוד במחקרים neurotoxicology22,24,25,30. כמו מספר מסלולים חושיים שונים נראה להתכנס כדי לגרום כיווץבאמצעות מנגנונים שונים 28, כיווץ שונה מהתנהגויות פלנריות אחרות כי שונים, אבל ספציפיים, גירויים יכולים לשמש כדי לנתח מעגלים עצביים ברורים וללמוד כיצד אותות שונים משולבים כדי לייצר את פנוטיפ מכווץ.
חשוב לציין, קיימים הבדלי מינים, כאשר כימיקל אחד עלול לעורר כיווץ במין פלנרי אחד, אך תגובה התנהגותית שונה במין אחר. לדוגמה, מצאנו כי anandamide גורם מכווץ בזן התכנון Dugesia japonica אבל גורם פריסלזיס ב Schmidtea מדיטרנה28. דוגמה זו מדגישה את החשיבות של היכולת להבחין באופן אמין בין ההליכות השונות, משום שהן ביטויים פנוטיפיים של מנגנונים מולקולריים ברורים. עם זאת, קשה להבחין בין התכתשות מהפריסטלזיס באמצעות נתונים תצפיתיים איכותיים, משום ששני הגייטים מונעים על ידי שרירים וחותקיםקווי דמיון איכותיים 7,28. לפיכך, כדי להבחין בין ההליכות יש צורך לבצע הדמיה cilia או מחקר התנהגותי כמותי, המאפשר הבחנה בהתבסס על פרמטריםאופייניים 7,28. מכיוון שהדמיית cilia היא מאתגרת מבחינה ניסיונית ודורשת ציוד מיוחד כגון מיקרוסקופ מורכב הגדלה גבוההומצלמהבמהירות גבוהה 7,28, היא אינה נגישה באופן נרחב לחוקרים כמו ניתוח התנהגותי כמותי.
כאן, אנו מציגים פרוטוקול עבור (1) אינדוקציה של כיווץ באמצעות גירויים פיזיים (רעילים, קטיעה, אור UV קרוב) וכימי (allyl isothiocyanate (AITC), cinnamaldehyde) גירויים ו (2) ניתוח כמותי של התנהגות פלנרית באמצעות תוכנה זמינה בחופשיות. על ידי כימות ארבעה פרמטרים (תדירות תנודות אורך הגוף, מהירות יחסית, משרעת מקסימלית, ואמימטריה של הארכת הגוףוהתכווצות) 7, כיווץ ניתן להבדיל מגלישה, פריסלזיס, ו מצבים התנהגותיים אחרים שדווחו בספרות, כגון קטר כמו נחש15 או אפילפסיות15. יתר על כן, בעוד כיווץ הוא שוחמר בין מיניםפלנריים שונים 7, כל מין יש תדירות אופיינית משלו ומהירות; לכן, לאחר שנקבעו מהירויות הגלישה והכווץ של מין, ניתן להשתמש במהירות לבדה כאמצעי להבחין בין התכתוכות לביןגלישה ונזיד 29. הפרוטוקול אינו מניח הכשרה מוקדמת בניתוח תמונה חישובית או מחקרים התנהגותיים ולכן ניתן ליישם גם עבור ניסויים התנהגותיים תכנון בהקשר מעבדה הוראה ברמת התואר הראשון. נתונים לדוגמה כדי להקל על התאמת פרוטוקול מסופקים בחומר משלים.
Protocol
1. התנהגות פלנרית כמותית
- התקנה ניסיונית
- מניחים לוח LED מעומעם על משטח שטוח. לוח ה-LED משרת שתי מטרות: (1) לספק רקע לבן אחיד ו- (2) שישמש כמקור אור מתכוונן להשגת ניגודיות מתאימה. מניחים זירת צלחת פטרי 100 מ"מ על לוח LED.
הערה: כדי להגדיל את התפוקה, ניתן להשתמש בצלחתמרובת בארות כזירה 23,24, אך זירות גדולות יותר מאפשרות ניתוח תמונה אוטומטי. - הר מצלמה על טבעת לעמוד מעל הזירה(איור 1A). כוונון מיקום המצלמה, גובה ומיקוד במידת הצורך כך שהזירה כולה תתמקד בשדה התצוגה ותתמקד(איור 1B).
הערה: רזולוציית המצלמה צריכה להיות גבוהה מספיק כדי להבחין בבירור בין פלנרי לרקע ההומוגני המסופק על-ידי לוח ה-LED. - מלא את הזירה עם אמצעי החשיפה המתאימים (מים פלנריים או פתרון כימי) לנפח חצי מרבי (זה ייקרא אמבטיה). זה מתאים כ 25 מ"ל עבור צלחת פטרי 100 מ"מ. הפעל את לוח ה-LED וכבה מקורות אור אחרים שעשויים להשפיע לרעה על איכות ההקלטה (כלומר, מקורות אור סמוכים המייצרים בוהק בזירה).
התראה: נהל פתרונות כימיים מסוכנים כראוי על-ידי לבישת ציוד מגן אישי מלא (PPE) והעברת ההתקנה הניסיונית למכסה אדים במידת הצורך. בצע תקנות פדרליות ומדינה על סילוק פסולת. - זרוק פלנרי לכיוון מרכז הזירה באמצעות פיפטת העברה. התחל להקליט. רמת נתונים כקטעי תמונה בתבנית מקורית שלפיג'י 31 (TIFF, GIF, JPEG, PNG, DICOM, BMP, PGM או FITS; ראה סעיף ניתוח תמונה 1.2).
הערה: מכיוון שהתנהגויות ורגישות לגירויים חיצוניים משתנים בין תכנון יחיד, חשוב לאסוף נתונים על מספר גדול מספיק של משכפלים ביולוגיים, בנוסף לביצוע משכפלים טכניים. עבדנו עם עד 10 planarians בגודל בינוני (4-7 מ"מ) בצלחת פטרי 100 מ"מ בבת אחת. בעוד הזמן יעיל, כננים מרובים בצלחת פטרי בבת אחת להפוך ניתוח נתונים קשה יותר מאז planarians עשוי לחצות נתיבים.- לניסווני גלישה, הקלט באמצעות מסגרת אחת לשנייה לפחות (FPS). לניסויים מכווץ /פריסלזיס, להקליט באמצעות FPS כי הוא לפחות פעמיים את תדירות כיווץ / פריסלזיס של המין פלנרי. אם למין התכנון יש תדירות לא ידועה של כיווץ/פריסלזיס, השתמשו ב- 10 FPS כנקודת התחלה והגדלו/הקטן בהתאם לצורך.
- בעת שימוש בתמיסה כימית, להעביר את planarian באמצעות כמה שפחות טיפות של מים פלנריים ככל האפשר, כך הריכוז של הפתרון הכימי לא השתנה באופן משמעותי.
- לניסווני גלישה, להקליט 1-2 דקות של התנהגות גלישה. לניסויים מכווץ /פריסלזיס, להקליט מספיק זמן כדי ללכוד לפחות 3 תנודות רצופות המתרחשות בקו ישר. לאחר השלמת הניסוי, סיים את ההקלטה.
הערה: עבור ניסויי כיווץ/פריסלזיס, אם תכנון אינו עומד בקריטריון הסיום בתוך פרק זמן קבוע שצריך להיות עקבי על-פני שכפולים ונקבע באופן אמפירי בהתבסס על הגירוי, סיים את ההקלטה ובדוק תוכנית אחרת.- אם התכנון מגיע לגבול הזירה מבלי לספק את קריטריון הפיטורים, פיפטה התכנון בחזרה למרכז הזירה.
הערה: הימנע מצינורות חוזרים ונשנים של אדם להקלטה, מכיוון שפעולה זו עשויה לשנות את התנהגותו.
- אם התכנון מגיע לגבול הזירה מבלי לספק את קריטריון הפיטורים, פיפטה התכנון בחזרה למרכז הזירה.
- הסר את התכנון מהזירה והיפטר מהמים התכנון או התמיסה הכימית במכולות פסולת מתאימות. ניתן להחזיר את התכנון שהיו במים פלנריים למכולה הביתית שלהם.
הערה: הימנע מזיהום צולב באמצעות זירות שונות עבור מדיה שונה (כלומר, אין להפעיל גלישה בניסויי מים פלנריים בזירה ששימשה בעבר לניסויים בעיסוך/פריסלזיס עם חשיפה כימית).- לשטוף באופן סדרתי planarians חשופים לפתרון כימי 3 נקי 100 מ"מ פטרי מנות מלאות 25 מ"ל של מים פלנריים כדי לדלל ביסודיות את כל הכימיקלים. אם כיווץ או פריסלזיס היה מושרה, למקם את planarians אלה במיכל נפרד. Planarians ניתן להחזיר למכולה הביתית שלהם לאחר חודש מאז רוב התאים היו מתהפך עד אז1.
הערה: אם יש צורך בניסויים שונים מרובים עבור אותה אוכלוסייה של תכנון, למשל, עבור אוכלוסיית RNAi, לאפשר planarians להתאושש במשך 24 שעות לפני הפעלת הניסוי הבא. להזמין את הניסויים כך הניסוי הפחות פולשני הוא הראשון ואת הניסוי הפולשני ביותר (למשל, קטיעה) הוא לרוץ אחרון. - אם עורכים ניסויים מרובים באותה זירה, השלך כראוי את תמיסת האמבטיה והסר את כל שבילי הריר על-ידי ניגוב הזירה עם מגבת נייר בין הריצות.
הערה: ניתן להשהות את הפרוטוקול כאן.
- לשטוף באופן סדרתי planarians חשופים לפתרון כימי 3 נקי 100 מ"מ פטרי מנות מלאות 25 מ"ל של מים פלנריים כדי לדלל ביסודיות את כל הכימיקלים. אם כיווץ או פריסלזיס היה מושרה, למקם את planarians אלה במיכל נפרד. Planarians ניתן להחזיר למכולה הביתית שלהם לאחר חודש מאז רוב התאים היו מתהפך עד אז1.
- מניחים לוח LED מעומעם על משטח שטוח. לוח ה-LED משרת שתי מטרות: (1) לספק רקע לבן אחיד ו- (2) שישמש כמקור אור מתכוונן להשגת ניגודיות מתאימה. מניחים זירת צלחת פטרי 100 מ"מ על לוח LED.
- ניתוח כמותי של התנהגות פלנרית
- בצע את ההתנהגויות התכנון כמתואר בסעיף 1.1.
- פתח את רצף התמונה הגולמית לניסוי בפיג'י (קובץ > ייבוא > רצף תמונות) ובחר את התמונה הראשונה ברצף התמונה. בחלון אפשרויות רצף, סמן את התיבה עבור "מיין שמות באופן מספרי" ולחץ על "אישור". לאחר טעינת רצף התמונה, המר את רצף התמונה ל- 8 סיביות(תמונה > כתב > 8 סיביות) והשתמשבכלי החץ או במחוון בתחתית ערימת התמונות כדי לצפות או לגלוש ברצף התמונה.
הערה: עבור ניסויי גלישה, ניתן להשתמש בכל הנתונים כל עוד ניתן לראות בבירור את התכנון לאורך כל ההקלטה. עם זאת, בדרך כלל די בכך כדי לנתח את התנועה החופשית במרכז הזירה על ידי חילוץ החלקים הרלוונטיים כמתואר להלן. - כדי לחלץ פרק זמן ואזור עניין, צייר אזור עניין המקיף את הנתיב המלא של תכנון באמצעות הכלי מלבן(איור 2א', 2B). לחץ לחיצה ימנית על מחסנית התמונהובחר שכפל..., סמן את התיבה עבור מחסניתכפולה , הזן את המסגרות הראשונה והאחרונות של רצף העניין ולחץ על אישור . אם תכנון מרובים היו תמונה בו זמנית, לחזור על זה בחירת אזור וצעד שכפול עבור כל planarian בזירה, כך שיש ערימות תמונה פתוחות רבות כמו שיש planarians בזירה. יש לבצע את השלבים הבאים (שלבים 1.2.4-1.2.10) בכל מחסנית תמונה, אחת בכל פעם.
- לניסווני גלישה, לחלץ תקופה של גלישה שבו planarian נע לפחות כפול אורך גופו.
הערה: כך הנתונים יהיו אמינים יותר לגלישה לכל פלנרי, כך הנתונים יהיו אמינים יותר. התכנון לא צריך לנוע בקו ישר לניתוח הגלישה. - לניסויים מכווץ /פריסלזיס, לחלץ מופע כאשר planarian עובר לפחות שלוש תנודות גוף רצופות (אידיאלי יותר) בקו ישר, לוודא שכל תנודה היא מחזור התכווצות-הארכה מלאה, כמו תנודות מלאות נחוצות כדי לקבוע במדויק את התדירות.
הערה: יותר תנודות שניתן לחלץ, כך הנתונים יהיו אמינים יותר. אין להשתמש רצפים שבהם התכנון פונה כמו אלה יביאו מדידות אורך לא מדויקות.
- לניסווני גלישה, לחלץ תקופה של גלישה שבו planarian נע לפחות כפול אורך גופו.
- החל סף על מחסנית התמונה המשוכפלת (תמונה > כוונן > סף) כדי לבארר את התמונה ולחלץ את התכנון מהרקע. התאם את פסי ההזזה כנדרש כך שכל התכנון מסומן באדום. הערכים המדויקים תלויים באיכות ההדמיה. השאר את התיבות עבור רקע כהה , מחסנית היסטוגרמה ואל תאפס טווח ללא סימון. גלול בערימת התמונה כדי להבטיח טווח סף טוב (כלומר, התכנון מופרד היטב מהרקע לאורך הערימה) ולאחר מכן לחץ על החל.
- בחלון המרת מחסנית לקובץ בינארי, הגדר את פעולת השירות כברירת מחדל ואת הרקע לאור. בטל את סימון כל התיבות בחלון זה ולאחר מכן לחץ על אישור. תמונה בינארית המציגה פלנרי שחור על רקע לבן תופיע(איור 2C). ודא שכל התכנון גלוי בכל המסגרות של רצף התמונה.
הערה: ניתן לסנן עצמים לא רצויים ברצף התמונה הבינארי קטן או גדול יותר מהתכנון בניתוח הבא באמצעות מסנן גודל (איור 2Ciii). - הגדר מידות על-ידי לחיצה על נתח > הגדר מידות. סמן את התיבות עבור אזור, מרכז מסה, מיקום מחסנית ותאום אליפסה ולחץ על אישור.
הערה: פרמטרים אלה צריכים להיות מוגדרים רק פעם אחת לכל הפעלה של פיג'י. - בחר את מחסנית התמונה הפתוחה ובחר נתח > נתח חלקיקים.
- בחלון נתח חלקיקים, בחר הצג > מסיכות כדי לפתוח מחסנית חדשה המציגה את כל האובייקטים שזוהו עם הפרמטרים שנבחרו. ניתן להשתמש באפשרות זו כדי לבדוק באופן חזותי כי רק מדידות של planarian נלקחים. ניתן להגדיר מסנן גודל בשלב זה כדי להסיר רעש לא רצוי על-ידי הזנת האזור המשוער של התכנון(בפיקסל 2 יחידות) בחלל שסופק. סמן את התיבות לקבלת תוצאות תצוגה ונקה תוצאות ולחץ על אישור.
הערה: בחלון תוצאות, אם האינדקס (העמודה הראשונה) אינו שווה למספר הפרוסה עבור כל השורות, משמעות הדבר היא שאותן מעקב אחר אובייקטים רבים מדי או מעטים מדי. אפשרות אחת לחוסר התאמה זו היא נוכחות של אובייקטים אחרים מלבד הפלנרי או שהפלנרי לא אותר במסגרות ספציפיות. - תעברו בין מחסנית תמונת המסיכה בעזרת המחוון בתחתית החלונית. אם יש רעש או שיש מסגרות שחסרות בהן תוכנית, סגור את חלון התוצאות ואת מחסנית תמונת המסיכה. חזור על שלבים 1.2.7-1.2.8 על-ידי התאמת מסנן האזור כדי להסיר אובייקטים אחרים בלבד מלבד התכנון.
הערה: אם התכנון חסר מהמסגרת במסיכה, הדבר מצביע על כך שהאוגד התחתון של מסנן האזור הוגדר גבוה מדי. - בחלון תוצאות, שמור את הנתונים באמצעות קובץ>שמירה בשם. הוסף את הסיומת .csv בשם הקובץ כדי לשמור נתונים כערכים המופרדים באמצעות פסיקים. לאחר שנתונים עבור מחסנית התמונות נשמרים, סגור את מחסנית התמונות המתאימה ואת חלונות התוצאות והמסיכה.
- יבא נתונים ונתח עוד יותר באמצעות כל תוכנת גיליון אלקטרוני או תוכנה חופשית. כדי לחשב את מהירות הגלישה, עיין בסעיף 1.3. כדי לחשב את ערכת הפרמטרים המלאה של כיווץ/פריסלסיס, עיין בסעיף 1.4.
הערה: ניתן להשהות את הפרוטוקול כאן. - כדי לקבוע את הפיקסל להמרת אורך בפועל, פתח תמונה בפיג'י עם אורך הפניה (לדוגמה, קוטר הזירה). בחרו בכלי הקו וצרו קו מעל האורך המוכר.
- המר יחידות פיקסלים ליחידת אורך רגילה על-ידי לחיצה על נתח > קבע קנה מידה. הזן את האורך המתאים לקו שצויר בתמונה בתיבה מרחק מוכר ושנה את יחידת האורך מפיקסל ליחידת האורך הסטנדרטית שנבחרה. גורם ההמרה נכתב לצד קנה מידה.
הערה: ערך המרת פיקסלים אינו נדרש לניתוחי גלישה או כיווץ/פריסלזיס בסעיפים 1.3 ו- 1.4.
- חישוב מהירות הגלישה
- באמצעות קובץ הנתונים שנשמר בסעיף 1.2, טען את מרכז קואורדינטות מסה (COM) x ו- y ואת נתוני הציר הראשי. אם הנתונים נשמרים כקובץ ערכים המופרד באמצעות פסיקים, רשימות אלה תואמות לעמודות "XM", "YM" ו-"Major", בהתאמה.
- חשב את העקירה (d) של מרכז המסה הפלנרי בפיקסלים עבור כל מסגרת ביחס למסגרת הבאה באמצעות עמודות הנתונים "XM" ו- "YM". עקירה (ד) ניתנת על-ידי:
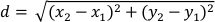
כאשר x1 ו- y1 מתייחסים לנקודות הציון של COM (XM, YM) של מסגרת אחת ו- x2 ו-y 2 מתייחסים לנקודות הציון של COM (XM, YM) של המסגרת הבאה. - הגדר את אורך הגוף המישמיש כאוניוןה-95 של עמודת "מייג'ור". מאחר שהפלנריים מציגיםהתנהגות העדפת קיר 32, הדבר מבטיח שאורך הגוף המחושב של הגוף המחושב יהיה מייצג את הזמן שבו התכנון מוארךב-24.
- לנרמל את העקירה על ידי אורך הגוף הפלנרי על ידי חלוקת עקירות הפיקסלים לכל מסגרת על ידי אורך הגוף הפלנרי (l). עקירה מנורמלת (dn)ניתנת על-ידי:
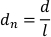
- צור רשימה של מהירויות מנורמלות על-ידי חלוקת העקירה המנורמלת עד שחלף לכל מסגרת (ההופכי של FPS שהוקלט). מהירות גלישה מנורמלת (sn) ניתנת על-ידי:
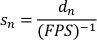
- חשב את מהירות הגלישה המנורמלת של התכנון על-ידי לקיחת הממוצע של רשימת המהירויות המנורמלות (sn). סטיית התקן עשויה לשמש כמדידה של אי ודאות עבור התכנון.
- חזור על שלבים 1.3.1-1.3.6 עבור כל planarian להיות מנותח. ממוצע ולקחת את סטיית התקן של מהירויות הגלישה עבור כל התכנון כדי לקבל את מהירות הגלישה וחוסר הוודאות הקשורים, בהתאמה, עבור אוכלוסייה פלנרית.
- הבחנה של כיווץ ו- peristalsis gaits באמצעות סט הפרמטרים המלא
- טען את רשימת נתוני הציר הראשי מקובץ הנתונים שנשמר מסעיף 1.2. אם הנתונים נשמרים כקובץ ערכים המופרד באמצעות פסיקים, הדבר תואם לעמודה ראשי.
- צור רשימה הממספרת כל נקודת נתונים בעמודה ראשי, החל מ- 0. המר רשימה זו לזמן שחלף לכל מסגרת על-ידי חלוקה לפי FPS שהוקלט.
- התווה את נתוני העמודה העיקריים ביחס לזמן שחלף כדי ליצור עלילת תנודות מכווץ/פריסלזיס(איור 3א). באמצעות עלילת התנודות, לקצץ את הנתונים לפחות שלוש תנודות רצופות, קו ישר (איור 3Bi). לקצץ את הנתונים כדי להתחיל ולהסתיים בפסגות מקומיות (ההאריך המרבי של תנודות) או שוקת (מינימום התנודות).
הערה: אם הגפיים המקומיות אינן שוות בערך (פסגות/שוקת שונות באופן דרמטי בגבהים), הדבר מצביע על כך שהתנודות אינן קו ישר(איור 3Bii). לחלץ רצף נוסף של לפחות שלוש תנודות רצופות, קו ישר. עיין בסעיף 1.2. - ודא כי רצף התנודות של עניין חולץ וגזוז כראוי על ידי שיפוץ הנתונים העיקריים גזוז ביחס לזמן. השתמש ברשימת נתונים חתוכה זו עבור כל החישובים הבאים.
- כדי לחשב את תדירות התנודות (nm),חלק את מספר התנודות (On) במספר הכולל של נקודות נתונים ברשימת נתוני הציר הראשי החתוך (N). הכפיל את FPS בערך זה כדי לקבל תדירות בתנודות לשניה.
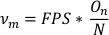
- לחישוב ההאריך המרבי (|Εε| מקסימום), לחסר את אורך הגוף המינימלי המוחלט (lmin) מאורך הגוף המרבי המוחלט (lmax). לנרמל את אורך הגוף מוארך על ידי חלוקה על ידי אורך הגוף המרבי המוחלט.
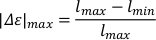
- כדי לחשב מהירות לכל אורך גוף (v*m), הכפל את ההאריך המרבי המחושב בתדר התנודות.
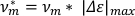
הערה: ניתן להשתמש במהירות בלבד כדי להבחין בין כיווץ לבין ההליכות פריסלזיס7. - כדי לחשב את השבר של זמן שהושקע בהאריך (felong),קח את הנגזרת של רשימת נתוני הציר הראשי החתוך ביחס לזמן. חלק את מספר נקודות הנתונים החיוביות (כלומר, כאשר הנגזרת היא >0 (np), לפי המספר הכולל של נקודות נתונים ברשימת נתוני הציר הראשי (nt).
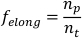
הערה: תכנון מכווץ להפגין שבר אסימטרי של זמן בילה הארכה ואילו planarians ביצוע פריסלזיס לבלות כמויות שוות של זמן הארכה והתכווצות7. - חזור על שלבים 1.4.1-1.4.8 עבור כל planarian להיות מנותח. חשב פרמטר אוכלוסיה תכנון מוגדר על-ידי לקיחת סטיית הממוצע והתקן של כל פרמטר.
הערה: ניתן להשתמש בהסטמת הפרמטרים כדי לקבוע אם אופן הפעולה של התנודות הוא כיווץ, פריסלזיס או צורה אחרת של תנועה עם שינויי צורת גוף תקופתיים. הן לצורך התכווץ והן בפריסלזיס יש פרמטרים קבועיםלמין נתון 7, כאשר פרמטרי ההתכווצות בדרך כלל גדולים יותר מפרמטרים פריסלזיס7. אמנם ייתכן שאחד הפרמטרים עלול ליפול מחוץ לטווח הספציפי למינים, כפי שראינו בעבר עם אינדוקציהכימית 28, ההתנהגות שנצפתה חייבת להסכים עם לפחות 3 מתוך 4 פרמטרים שפורסמו כדי להיות מסווגים כperistalsis או כיווץ.
2. אינדוקציה מכווצת
- גירויים פיזיים (טמפרטורה מזיקה, אור UV, קטיעה)
- לכל ניסויי הגירויים הפיזיים, עיין בסעיף 1.1 להגדרה ניסיונית.
הערה: עדיף להשתמש בזירה גדולה, כגון צלחת פטרי 100 מ"מ, לניסויים בגירויים פיזיים כדי לאפשר שטח פתוח יותר לתמרון פיפטה ו/או סכין גילוח. - כדי לגרום לכווץ באמצעות טמפרטורה מזיקה, מחממים מים פלנריים ב זכוכית (לפחות 100 μL לכל פלנרי להיבדק) עד 65 °C על פלטה חמה.
- שים פלנרי במרכז הזירה. חכה עד שהתכנון יכוון את עצמו זקוף ויתחיל לגלוש. התחל להקליט.
- באמצעות פיפטה P-200, לאט פיפטה 100 μL של 65 ° C מים פלנריים לאחר לוע על קצה הזנב של planarian כדי לגרום כיווץ.
הערה: ודא שהמים התכנון המחוממים נשארים ב-65°C. במידת הצורך, לחמם מחדש את המים ל 65 מעלות צלזיוס לפני תחילת ניסוי נוסף. מאז לחץ יכול גם לגרום כיווץ, pipetting איטי הוא הכרחי. מים בטמפרטורת החדר pipetting באותו אופן כמו בניסוי יכול לשמש כאפשרות שליטה ותרגול. - הפסק את ההקלטה לאחר שהתעוות תיפסק. מניחים את הפלנרי במיכל התאוששות ומחליפים את התקשורת בצלחת פטרי במים טריים בטמפרטורת החדר אם הם עורכים ניסויים נוספים.
- כדי לגרום לעיכוך באמצעות קטיעה, להעביר planarian למרכז הזירה ולחכות עד planarian אוריינטים עצמו זקוף ומתחיל לגלוש. התחל להקליט.
- קטוע את התכנון באמצעות סכין גילוח נקי. קטיעות עשויות להיעשות בכל מקום לאורך התכנון כל עוד המיקום החתוך עקבי על פני ניסויים.
הערה: פרמטרים מכווץ מופקים מהיצירה הקדמית. לכן, הימנע חסימת התצוגה של המצלמה של חלק זה של planarian בעת החלת החתך על ידי התקרבות מהקצה האחורי. כיסוי פלסטיק מחליק גם לעבוד היטב עבור חיתוך והם אופציה בטוחה יותר, במיוחד בסביבה הוראה. - עצור את ההקלטה ברגע שהיצירה הקדמית תפסיק לכרסם. הסר את שתי החלקים, מקם אותם במיכל נפרד ואפשר להם להתחדש למשך 7 ימים. ניתן לשלב מחדש את התכנון הקטוע במיכל הבית לאחר ההתחדשות.
- קטוע את התכנון באמצעות סכין גילוח נקי. קטיעות עשויות להיעשות בכל מקום לאורך התכנון כל עוד המיקום החתוך עקבי על פני ניסויים.
- כדי לגרום לכיסה באמצעות אור UV כמעט, לצרף מסננים מתאימים (למשל, מסנני Roscolux) לעדשת המצלמה כדי להפחית את כמות אור כמעט UV משתקף שנאסף על ידי המצלמה עלול להפריע הדמיה התגובה של planarian. במקום להשתמש בלוח ה-LED כדי להאיר את הזירה מלמטה, השתמשו בתאורה אדומה סביבה שבה33 תוכננים אינם רגישים.
- מלאו זירת צלחת פטרי 100 מ"מ במים פלנריים והניגו תכנון יחיד (5-9 מ"מ) במרכז הזירה. התחל להקליט ב-10 FPS.
- החזק מצביע לייזר UV Class II (405 ± 10 דפים לשעה, הספק פלט <5 mW) כ- 30 ס"מ מהזירה. מקם את מצביע הלייזר בזווית של 45° מהתכנון הגלישה ולאחר מכן האיר את מצביע הלייזר למשך 5-10 שניות באמצע הדרך בין הקצה האחורי של הלוע לקצה הזנב כדי לגרום ללכלך.
הערה: ניתן למדוד את העוצמה של מצביע הלייזר באמצעות מד כוח רגיש ל-UV. - המתן שהפלנרי יתחיל לגלוש שוב לפני שינסה עוד שני גירויים על אותו אדם כדי לבדוק את האפשרות לשחזור של התגובה. אם התכנון ממשיך להראות את אותה התנהגות, הפסק להקליט והחזיר את התכנון למכולה שלו. אם ההתנהגות משתנה בין גירויים, בדיקות נוספות יתראות איזו תגובה היא הבולטת ביותר.
הערה: Planarians יכול להיות חסר נסיון לאור UV כמעט יפסיק להגיב. גירויים רצופים דורשים תקופת מנוחה של 8-10 שניות.
- לכל ניסויי הגירויים הפיזיים, עיין בסעיף 1.1 להגדרה ניסיונית.
- גירוי כימי (AITC)
- כדי לגרום ללכלך באמצעות כימיקל, למשל, אגוניסט TRPA1 AITC28, פלנריים שקועים באופן אידיאלי באמבט של הכימיקל. במידת הצורך, ניתן להחיל pipetting כמתואר בסעיף 2.1.2.3.
התראה: AITC הוא דליק, רעיל מאוד, יכול לגרום לגירוי בעור ובעין, רגישות נשימה ועור, והוא מסוכן לחיים ימיים. שמן AITC צריך להיות מטופל בשכונה אדים. לפני ביצוע פתרונות מלאי של AITC, לשים על PPE המתאים (כפפות nitrile וציפוי מעבדה) ולהגדיר מכולות מתאימות מוצק ונוזלי סילוק פסולת מסוכנת. - במכסה מנוע אדים, לעשות פתרון מניות 10 mM של AITC במים פלנריים בצינור צנטריפוגה 50 מ"ל. פתרון מניות זה ניתן לשימוש עד חודש אחד כאשר הוא מאוחסן ב- 4°C.
- מתוך מלאי זה, להכין פתרון עבודה 25 מ"ל של 100 μM AITC במים פלנריים בצינור צנטריפוגה 50 מ"ל. פתרון AITC זה 100 μM ישמש כדי לגרום כיווץ ב planarians.
הערה: 100 μM AITC גורם כיווץ עקבי ב D. japonica ו S. תכנון מדיטציה28. עבור תכנון ימי אחרים, 100 μM יכול לשמש כריכוז התחלתי, ניתן להתאים בהתאם. - הגדר את ההתקנה הניסיונית (עיין בסעיף 1.1). מלא את הזירה בפתרון העבודה של AITC והניח אותה במיכל משני. המכולה המשנית צריכה להחזיק לפחות פי שניים מנפח הזירה.
הערה: ניתן לבצע ניסויים בתוך מכסה מנוע אדים לבטיחות נוספת. - להעביר עד 10 planarians למרכז הזירה ולהתחיל להקליט.
- ברגע שהפלנריים הופכים לבלתי נמענים ומפסיקים להתעוות, תפסיקו להקליט. הסר את התכנון מפתרון AITC ושטיפה (עיין בסעיף 1.1). להיפטר מפסולת AITC מוצקה ונוזלית במכולות פסולת מתאימות.
- אמת את ספציפיות התגובה ל- AITC באמצעות RNAi ל- TRPA128 תוך שימוש בפרוטוקולים סטנדרטיים.
- מתוך מלאי זה, להכין פתרון עבודה 25 מ"ל של 100 μM AITC במים פלנריים בצינור צנטריפוגה 50 מ"ל. פתרון AITC זה 100 μM ישמש כדי לגרום כיווץ ב planarians.
- כדי לגרום ללכלך באמצעות כימיקל, למשל, אגוניסט TRPA1 AITC28, פלנריים שקועים באופן אידיאלי באמבט של הכימיקל. במידת הצורך, ניתן להחיל pipetting כמתואר בסעיף 2.1.2.3.
תוצאות
תפיסה חוץ עינית כמעט UV ב S. תכנון הים הים הוא TRPA1 תלוי, הוצע להיות מקושר H2O2 שחרור 17. מכיווןשחשיפהH2 O 2 גורם TRPA1 תלויים מכווץ S. מדיטרנה ו D. japonica planarians28, השלבים בסעיף 2.1.4 יכול לשמש כדי לבדוק אם חשיפה לאור UV קרוב גורם התכתשות בשני המינ...
Discussion
באמצעות פרוטוקול זה, ניתן ללמוד באופן כמותי את ההשפעות שלגירוייםפיזיים וכימיים 7,28,29 או מניפולציה גנטית (RNAi)28,29 על תנועה פלנרית. כדי למקסם את הרזולוציה המרחבית, עדיף להזיז את המצלמה קרוב ככל האפשר לזירה תוך ?...
Disclosures
לסופרים אין מה לחשוף.
Acknowledgements
המחברים מודים למר טאפן גול על הערותיו על כתב היד. עבודה זו מומנה על ידי NSF CAREER Grant 1555109.
Materials
| Name | Company | Catalog Number | Comments |
| Allyl isothiocyanate, 95% (AITC) | Sigma-Aldrich | 377430-5G | CAUTION: Flammable and acutely toxic; handle in a fume hood with appropriate PPE. |
| Camera lens, 2/3 25mm F/1.4 | Tamron | 23FM25SP | |
| Cell culture plates, 6 well, tissue culture treated | Genesee Scientific | 25-105 | |
| Centrifuge tubes, 50 mL polypropylene, sterile | MedSupply Partners | 62-1019-2 | |
| Cinnamaldehyde, >95% | Sigma-Aldrich | W228613-100G-K | |
| Dimmable A4 LED Tracer Light Box | Amazon | B07HD631RP | |
| Flea3 USB3 camera | FLIR | FL3-U3-13E4M | |
| Heat resistant gloves | Fisher Scientific | 11-394-298 | |
| Hot plate | Fisher Scientific | HP88854200 | |
| Instant Ocean Sea Salt, prepared in deionized water | Instant Ocean | SS15-10 | Prepare in deionized water at 0.5 g/L. |
| Montjüic salts, prepared in Milli-Q water | Sigma-Aldrich | various | Prepare in milli-Q water at 1.6 mM NaCl, 1.0 mM CaCl2, 1.0 mM MgSO4, 0.1 mM MgCl2, 0.1 mM KCl, 1.2 mM NaHCO3; adjust pH to 7.0 with HCl. |
| Petri dishes, 100 mm x 20 mm, sterile polystyrene | Simport | D210-7 | |
| Pipette, 20-200 μL range | Rainin | 17008652 | |
| PYREX 150 mL beaker | Sigma-Aldrich | CLS1000150 | |
| Razor blade, 0.22 mm | VWR | 55411-050 | |
| Roscolux color filter: Golden Amber | Rosco | R21 | Alternatively purchase the Roscolux Designer Color Selector (Musson Theatrical product #SBLUX0306) which includes all 3 color filters together. |
| Roscolux color filter: Medium Red | Rosco | R27 | |
| Roscolux color filter: Storaro Red | Rosco | R2001 | |
| Samco transfer pipette, 62 µL large aperture | Thermo Fisher | 691TS | |
| Support stand | Fisher Scientific | 12-947-976 | |
| Thermometer | VWR | 89095-600 | |
| UV laser pointer | Amazon | B082DGS86R | This is a Class II laser (405nm ±10nm) with output power <5 mW. |
References
- Rink, J. C. Stem cell systems and regeneration in planaria. Development Genes and Evolution. 223, 67-84 (2013).
- Reddien, P. W., Alvarado, A. S. Fundamentals of Planarian Regeneration. Annual Review of Cell and Developmental Biology. 20, 725-757 (2004).
- Cebrià, F. Regenerating the central nervous system: how easy for planarians. Development Genes and Evolution. 217, 733-748 (2007).
- Pearl, R. Memoirs: The Movements and Reactions of Fresh-Water Planarians: A Study in Animal Behaviour. Journal of Cell Science. , 2-46 (1903).
- Mc Connell, J. . A Manual of Psychological Experimentation on Planarians. , (1967).
- Talbot, J., Schötz, E. M. Quantitative characterization of planarian wild-type behavior as a platform for screening locomotion phenotypes. Journal of Experimental Biology. 214, 1063-1067 (2011).
- Cochet-Escartin, O., Mickolajczk, K. J., Collins, E. M. S. Scrunching: a novel escape gait in planarians. Physical Biology. 12, 055001 (2015).
- Inoue, T., et al. Planarian shows decision-making behavior in response to multiple stimuli by integrative brain function. Zoological Letters. 1, 1-15 (2015).
- Arenas, O. M., et al. Activation of planarian TRPA1 by reactive oxygen species reveals a conserved mechanism for animal nociception. Nature Neuroscience. 20, 1686-1693 (2017).
- Shomrat, T., Levin, M. An automated training paradigm reveals long-term memory in planarians and its persistence through head regeneration. Journal of Experimental Biology. 216, 3799-3810 (2013).
- Blackiston, D., Shomrat, T., Nicolas, C. L., Granata, C., Levin, M. A Second-Generation device for automated training and quantitative behavior analyses of Molecularly-Tractable model organisms. PLoS One. 5, 1-20 (2010).
- Ross, K. G., Currie, K. W., Pearson, B. J., Zayas, R. M. Nervous system development and regeneration in freshwater planarians. Wiley Interdisciplinary Reviews-Developmental Biology. 6, 266 (2017).
- Cebrià, F., et al. The expression of neural-specific genes reveals the structural and molecular complexity of the planarian central nervous system. Mechanisms of Development. , 116-204 (2002).
- Mineta, K., et al. Origin and evolutionary process of the CNS elucidated by comparative genomics analysis of planarian ESTs. Proceedings of the National Academy of Sciences of the United States of America. 100, 7666-7671 (2003).
- Ross, K. G., et al. SoxB1 Activity Regulates Sensory Neuron Regeneration, Maintenance, and Function in Planarians. Developmental Cell. 47, 331-347 (2018).
- Nishimura, K., et al. Reconstruction of Dopaminergic Neural Network and Locomotion Function in Planarian Regenerates. Developmental Neurobiology. 67, 1059-1078 (2007).
- Birkholz, T. R., Beane, W. S. The planarian TRPA1 homolog mediates extraocular behavioral responses to near-ultraviolet light. Journal of Experimental Biology. 220, 2616-2625 (2017).
- Currie, K. W., Molinaro, A. M., Pearson, B. J. Neuronal sources of hedgehog modulate neurogenesis in the adult planarian brain. Elife. 5, (2016).
- Talbot, J. A., Currie, K. W., Pearson, B. J., Collins, E. M. S. Smed-dynA-1 is a planarian nervous system specific dynamin 1 homolog required for normal locomotion. Biology Open. , 1-8 (2014).
- Currie, K. W., Pearson, B. J. Transcription factors lhx1/5-1 and pitx are required for the maintenance and regeneration of serotonergic neurons in planarians. Development. 140, 3577-3588 (2013).
- Hagstrom, D., et al. Planarian cholinesterase: molecular and functional characterization of an evolutionarily ancient enzyme to study organophosphorus pesticide toxicity. Archives of Toxicology. 92, 1161-1176 (2018).
- Hagstrom, D., Cochet-Escartin, O., Collins, E. M. S. Planarian brain regeneration as a model system for developmental neurotoxicology. Regeneration. 3, 65-77 (2016).
- Hagstrom, D., Cochet-Escartin, O., Zhang, S., Khuu, C., Collins, E. M. S. Freshwater planarians as an alternative animal model for neurotoxicology. Toxicological Sciences. 147, 270-285 (2015).
- Zhang, S., Hagstrom, D., Hayes, P., Graham, A., Collins, E. M. S. Multi-behavioral endpoint testing of an 87-chemical compound library in freshwater planarians. Toxicological Sciences. , 26-44 (2019).
- Zhang, S., Hagstrom, D., Siper, N., Behl, M., Collins, E. M. S. Screening for neurotoxic potential of 15 flame retardants using freshwater planarians. Neurotoxicology and Teratology. 73, 54-66 (2019).
- Wu, J. P., Li, M. H. The use of freshwater planarians in environmental toxicology studies: Advantages and potential. Ecotoxicology and Environmental Safety. 161, 45-56 (2018).
- Rompolas, P., Azimzadeh, J., Marshall, W. F., King, S. M. Analysis of ciliary assembly and function in planaria. Methods in Enzymology. 525, 245-264 (2013).
- Sabry, Z., et al. Pharmacological or genetic targeting of Transient Receptor Potential (TRP) channels can disrupt the planarian escape response. PLoS One. , 753244 (2019).
- Cochet-Escartin, O., Carter, J. A., Chakraverti-Wuerthwein, M., Sinha, J., Collins, E. M. S. Slo1 regulates ethanol-induced scrunching in freshwater planarians. Physical Biology. 13, 1-12 (2016).
- Hagstrom, D., Truong, L., Zhang, S., Tanguay, R. L., Collins, E. M. S., et al. Comparative analysis of zebrafish and planarian model systems for developmental neurotoxicity screens using an 87-compound library. Toxicological Sciences. , (2019).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Akiyama, Y., Agata, K., Inoue, T. Spontaneous Behaviors and Wall-Curvature Lead to Apparent Wall Preference in Planarian. PLoS One. 10, 0142214 (2015).
- Paskin, T. R., Jellies, J., Bacher, J., Beane, W. S. Planarian Phototactic Assay Reveals Differential Behavioral Responses Based on Wavelength. PLoS One. 9, 114708 (2014).
- Petrus, M., et al. A role of TRPA1 in mechanical hyperalgesia is revealed by pharmacological inhibition. Molecular Pain. 3, 40 (2007).
- Takano, T., et al. Regeneration-dependent conditional gene knockdown (Readyknock) in planarian: Demonstration of requirement for Djsnap-25 expression in the brain for negative phototactic behavior. Development, Growth & Differentiation. 49, 383-394 (2007).
- Nishimura, K., et al. Identification of glutamic acid decarboxylase gene and distribution of GABAergic nervous system in the planarian Dugesia japonica. Neuroscience. 153, 1103-1114 (2008).
- Inoue, T., Yamashita, T., Agata, K. Thermosensory signaling by TRPM is processed by brain serotonergic neurons to produce planarian thermotaxis. Journal of Neuroscience. 34, 15701-15714 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved