Method Article
المراقبة في الوقت الحقيقي لتنشيط Aurora kinase A باستخدام أجهزة الاستشعار الحيوية FRET التوافقية في الخلايا الحية
In This Article
Summary
يتميز تنشيط Ser/Thr kinase AURKA متعدد الوظائف بفسفرته الذاتية على Thr288. يمكن لمجسات الفلورسنت التي تعتمد على FRET التمييز بين حالاتها غير النشطة والمنشطة. هنا ، نوضح بعض الاستراتيجيات لهندسة المسبار ، جنبا إلى جنب مع بروتوكول FRET السريع لمتابعة تنشيط كيناز في جميع أنحاء الانقسام.
Abstract
غالبا ما تتميز السرطانات الظهارية بالتعبير المفرط عن Ser/Thr kinase Aurora A/AURKA. AURKA هو بروتين متعدد الوظائف ينشط عند الفسفرة الذاتية على Thr288. تبلغ وفرة AURKA ذروتها في الانقسام ، حيث تتحكم في استقرار ودقة المغزل الانقسامي ، والكفاءة الكلية للانقسام. على الرغم من تميزه بشكل جيد على المستوى الهيكلي ، إلا أنه لا يوجد رصد متسق لتنشيط AURKA طوال دورة الخلية. يتمثل الحل المحتمل في استخدام أجهزة الاستشعار الحيوية لنقل الطاقة بالرنين (FRET) المشفرة وراثيا من Förster للحصول على نظرة ثاقبة على الفسفرة الذاتية ل AURKA بدقة مكانية زمانية كافية. هنا ، نصف بروتوكولا لهندسة أجهزة الاستشعار الحيوية FRET للكشف عن الفسفرة الذاتية Thr288 ، وكيفية اتباع هذا التعديل أثناء الانقسام. أولا ، نقدم نظرة عامة على أزواج FRET المحتملة من المانحين / المتقبلين ، ونعرض طرق الاستنساخ والإدراج الممكنة لأجهزة الاستشعار الحيوية AURKA FRET في خلايا الثدييات. بعد ذلك ، نقدم تحليلا خطوة بخطوة لقياسات FRET السريعة بواسطة الفحص المجهري للتصوير مدى الحياة (FLIM) على إعداد مصمم خصيصا. ومع ذلك، ينطبق هذا البروتوكول أيضا على الحلول التجارية البديلة المتاحة. نختتم بالنظر في أنسب ضوابط FRET لجهاز استشعار حيوي قائم على AURKA ، وبتسليط الضوء على التحسينات المستقبلية المحتملة لزيادة حساسية هذه الأداة.
Introduction
Aurora kinase A/AURKA هو كيناز سيرين/ثريونين متعدد الوظائف، ينشط طوال دورة الخلية وفي مقصورات تحت خلوية مختلفة1. إن فهم تنشيطه المكاني الصدغي الواسع مهم بشكل خاص في السرطان ، حيث غالبا ما يتم التعبير عن AURKA بشكل مفرط في الأورام الخبيثة الظهارية والدموية ، حيث يظهر المرضى استجابة ضعيفة للعلاجات المتاحة حاليا2.
كشفت الدراسات الهيكلية أن AURKA يخضع لخطوتين للتحول من كيناز غير نشط إلى كيناز نشط. أولا ، يغير الفوسفور الذاتي ل Thr288 تكوين الجيب الحركي للكيناز وينشطه3،4،5،6. تزيد هذه الخطوة من النشاط الحفاز ل AURKA في الخلايا البشرية وفي Xenopus laevis3,6,7 ، مما يؤدي إلى تهيئة الكيناز للنشاط الكامل. بمجرد تنشيطه ، يؤدي تفاعل AURKA مع البروتين المستهدف ل Xklp2 (TPX2) إلى تغيير تشكيلي ثان5. يسمح هذا التعديل الإضافي ل AURKA بالوصول إلى النشاط الأنزيمي الكامل نحو ركائزه في الخلية5,8,9,10.
على مدى ما يقرب من عقدين من الزمان ، تم الحصول على رؤى حول تنشيط ونشاط AURKA بشكل رئيسي من خلال مزيج من النهج الكيميائية الحيوية. وتشمل هذه الكشف عن Thr288 المفسفرة في الخلايا أو في الجسم الحي كسمة مميزة لتنشيط AURKA ، والتحليلات البلورية ، وفي المختبر أو في مقايسات كيناز السليلو للتحقيق في نشاط AURKA1. ومع ذلك، فإن الحل المكاني الزماني لهذه النهج ضعيف أو غائب، وكانت هناك حاجة إلى حلول جديدة لتوسيع المعرفة بديناميات هذين الحدثين.
سهل تطوير مجسات الفلورسنت في السنوات القليلة الماضية مراقبة AURKA في الخلايا الحية ، مما سمح بمتابعة تنشيطه بدقة مكانية زمانية أكبر. تعتمد أجهزة الاستشعار الأكثر تحديدا ل AURKA التي تم تطويرها حتى الآن على مبدأ FRET (نقل الطاقة بالرنين من Förster)11 للتمييز بين AURKA غير النشطة والنشطة. كان أول مستشعر تم تطويره هو مستشعر حيوي قائم على الركيزة لنشاط كيناز AURKA. تتكون أجهزة الاستشعار الحيوية القائمة على الركيزة من تسلسل حموضة أمينية قصير يستهدفه كيناز معين للفسفرة ، ويتم إدخاله داخل زوج FRET المانح / المتقبل ومجال ربط يتعرف على بقايا المفسفرة ، مما يساعد على طي المستشعر الحيوي لعملية FRET فعالة12. وفي حالة AURKA، تم إدراج جزء من 14 حمضا أمينيا من KIF2C مستهدفا بالفسفرة بين زوج من المتبرعين/المتقبلين CFP-YFP13. ومع ذلك ، فإن هذا المستشعر له بعض العيوب الرئيسية. أولا ، يمكن استهداف تسلسل KIF2C المستخدم في هذا المسبار بواسطة AURKA و kinase AURKB المرتبط ارتباطا وثيقا ، مما يقلل من خصوصية هذا المستشعر الحيوي. ثانيا ، يعتمد المستشعر على الكيناز الداخلي للفسفرة. لذلك ، يمكن أن تكون كفاءة FRET غير قابلة للكشف أو غير كبيرة إذا كانت كميات الكيناز محدودة (على سبيل المثال ، في المقصورات دون الخلوية أو مراحل دورة الخلية). للتغلب على هذه القيود ، تم إنشاء فئة جديدة من أجهزة استشعار AURKA تعرف باسم "أجهزة الاستشعار التوافقية". في هذه المجسات ، تم إدخال التسلسل الكامل الطول ل AURKA داخل الفلوروفور المانح في المحطة N ، والفلوروفور المتقبل في المحطة C. يقدم AURKA غير النشط تشكيلا "مفتوحا" ، والذي يجلب N- و C-termini من كيناز بعيدا عن بعضهما البعض. مع هذه المسافة بين تيرميني (> 10 نانومتر) ، يكون زوج المتبرع / المستقبل في تكوين غير متساهل ل FRET. على العكس من ذلك ، تعتمد AURKA ذاتية الفوسفوريل تشكيلا "مغلقا" ، مع وجود اثنين من البروتين termini واثنين من الفلوروفورات على مقربة. وقد تبين أن هذا يسمح ب FRET بين المتبرع والمتقبل ، والذي يمكن قياسه باستخدام الاختلافات في عمر المتبرع14,15. هذه التحقيقات تقدم العديد من المزايا. أولا ، يتم ترميزها وراثيا ، ويمكن استخدامها لتحل محل الكيناز الداخلي في الخلية. ثانيا ، ينقذون الأنماط الظاهرية الناجمة عن ضربة قاضية من AURKA ، مما يشير إلى أنها وظيفية في الخلية. ثالثا ، تسمح بمتابعة تنشيط الكيناز في مقصورات تحت خلوية مختلفة وطوال دورة الخلية. اكتشفت المجسات تنشيط AURKA في المواقع التي يعرف فيها تنشيط الكيناز (أي السنتروسومات والمغزل الانقسامي) ، وشاركت أيضا في اكتشاف تنشيط AURKA في الميتوكوندريا16. وأخيرا، سمحت هذه المستشعرات بإجراء فحوصات عالية المحتوى استنادا إلى FRET/FLIM، حيث تم استخدام التغييرات التوافقية ل AURKA لتحديد المثبطات الدوائية الجديدة17.
في هذا العمل ، نصف إجراء لتصور تنشيط AURKA في الخلايا المستزرعة. أولا ، سنقدم نظرة ثاقبة على أزواج الفلوروفور المحتملة ل FRET. سيتم اختيار زوج المانح / المتقبل الأنسب وفقا لإعداد المجهر المتاح ، أو تطبيق معين في اتجاه المصب مثل FRET18,19 متعدد الإرسال. بعد ذلك ، نقترح خط أنابيب لاستكشاف سلوك المستشعر الحيوي (المستشعرات الحيوية) المختار في إعداد مجهر FRET / FLIM السريع. سيمتد خط الأنابيب هذا من زراعة الخلايا وإجراءات المزامنة إلى اكتساب FLIM وتحليل البيانات. أخيرا ، سنناقش المزايا المحتملة لهذا البروتوكول ، حيث يمكن تطبيق استراتيجية مماثلة لتصميم أجهزة الاستشعار الحيوية على كينازات أخرى ، ويمكن أيضا استخدامها مع أنظمة التصوير الأخرى القائمة على FRET.
Protocol
ملاحظة: تم شراء خلايا U2OS المستخدمة في هذا البروتوكول من مجموعة American Type Culture Collection (ATCC ، HTB-96) ، وتم اختبارها خالية من الميكوبلازما. يجب تنفيذ الخطوة 2.1 إلى 2.7 تحت غطاء التدفق الصفحي للحفاظ على الخلايا والكواشف معقمة.
1. اختيار زوج FRET المانح / المتقبل
- ارجع إلى الأدبيات لاختيار أزواج FRET المانحة / المتقبلة الأكثر ملاءمة. يمكن العثور على أمثلة مفيدة في20،21،22،23،24 ، على الرغم من أن الاختيار النهائي يجب أن يتم وفقا لخصائص إعداد FRET / FLIM (خطوط الليزر المتاحة ، والمرشحات ، وما إلى ذلك). فيما يلي بعض الاعتبارات حول كيفية اختيار زوج من المتبرعين / المتقبلين.
- اختيار المتبرع: ارجع إلى قاعدة FP (https://www.fpbase.org/) للحصول على مجموعة كاملة من المعلومات حول البروتينات الفلورية المتاحة. يتم تحديث قاعدة البيانات هذه باستمرار مع جميع الفلوروفورات المطورة حديثا.
- ارجع إلى قاعدة بيانات المستشعر الحيوي الفلوري (https://biosensordb.ucsd.edu/index.php) للحصول على مزيد من المعلومات حول أجهزة الاستشعار الحيوية المتوفرة بالفعل في الأدبيات ، إلى جانب البروتينات الفلورية المستخدمة.
- كنقطة انطلاق عامة ، اختر فلوروفور مانح مشرق. المرشحون الجيدون هم بروتينات الفلورسنت السماوية مثل mTFP1 أو ECFP ، أو متغيرات GFP مثل EGFP أو mEGFP.
- يمكن أن تؤثر الأوليغومرات على توطين البروتين و/أو وظيفته25. فكر في استخدام الطفرات الأحادية من CFP مثل mTurquoise226 ، أو Aquamarine27,28. هذه المتغيرات لديها أيضا عائد كمومي جيد ومعاملات الانقراض ، مما يجعلها مرشحة جيدة كمانحين FRET.
- أعط الأفضلية للبروتينات الفلورية (سواء كمتبرع أو متقبلات) غير الحساسة للتغيرات البيئية مثل الرقم الهيدروجيني داخل الخلايا 23 ، أو للتبييض الضوئي25 ، حيث يمكن أن تتأثر كفاءة FRET بشدة بهذه المعلمات29. في الوقت الحاضر ، يتم استخدام الفلوروفورات مثل mTurquoise2 أو mTFP1 على نطاق واسع كمانحين ، وذلك بفضل استقرارها الضوئي الجيد22،25،26.
- اختيار المتقبل: غالبا ما يتم إقران المتبرعين السماويين بمتغيرات بروتين الفلورسنت الأصفر (YFP) ، مثل mVenus و Citrine و YPet20,21,22,30. ومع ذلك ، تجدر الإشارة إلى أن هذه البروتينات لديها حساسية أكبر بكثير لدرجة الحموضة ، وتظهر على مستوى العالم استقرارا ضوئيا ضعيفا.
- فكر في استخدام المتغيرات الصفراء المطورة حديثا وغير الحساسة للأس الهيدروجيني من YFP ك pH-Lemon31 ، أو الفلوروفورات الخضراء مثل mNeonGreen23 أو الفلوروفورات الحمراء مثل mScarlet-I23,32 كمستقبلات الفلورسنت التي تم التحقق منها مسبقا ل mTurquoise2.
- بدلا من ذلك ، فكر في استخدام المشتقات غير الفلورية / الداكنة من YFP مثل ShadowG33 أو ShadowY34 ، والتي ثبت أنها تتصرف كمتقبلات جيدة للمتبرعين بالفلورسنت السماوي في تجارب FRET / FLIM.
- إذا كنت تستخدم mEGFP كمتبرع ، ففكر في استخدام مستقبلات حمراء أحادية اللون مثل mCherry.
- تحقق من الخصائص الطيفية للزوج المختار من المتبرعين/المتقبلين باستخدام الأدوات المتاحة على موقع قاعدة FP على الويب. انظر الشكل 1 للحصول على مثال على زوج mEGFP/mCherry.
- على موقع ويب FP الأساسي، حدد القائمة المنسدلة أدوات وحدد عارض Spectra.
- في القوائم المنسدلة، أدخل اسم زوج الفلوروفور لتصوره (على سبيل المثال، mEGFP و mCherry).
- محاكاة خصائص زوج المتبرع / المستقبل مع مصدر ضوء معين عن طريق تحديد ليزر معين في القائمة المنسدلة. بدلا من ذلك، أدخل طولا موجيا محددا لليزر عن طريق تحديد إضافة ليزر. انقر فوق تطبيع الانبعاثات لهذا الخيار لضبط أطياف الفلوروفور على الطول الموجي المطلوب. هنا ، الطول الموجي المستخدم لإثارة GFP هو 480 ± 10 نانومتر.
- استنساخ زوج المتبرع / المتقبلين المحدد عن طريق إضافة فلوروفور واحد في المحطة N من التسلسل الكامل الطول ل AURKA ، وواحد في المحطة C. اتبع المبادئ التوجيهية لطريقة الاستنساخ المفضلة لإدراج هذه البنية في ناقل تعبير الثدييات المفضل.
2. زراعة الخلايا ، نقل وتزامن
- اليوم 1. تحضير وسط الاستزراع لخلايا U2OS: استخدم وسط النسر المعدل من دولبيكو (DMEM) المكمل بمصل البقر الجنيني (FBS) بنسبة 1٪ والبنسلين-الستربتومايسين و 1٪ L-Glutamine (من هنا فصاعدا ، وسائط النمو الكاملة). بدلا من ذلك ، يمكن أيضا استخدام DMEM مع L-Glutamine المكمل مسبقا.
- إذا تم تجميد الخلايا، قم بإذابة قارورة قبل 8 أيام على الأقل من التجارب (أي من النقطة 2.5 فصاعدا).
- زراعة الخلايا في حاضنة مخصصة لمزارع خلايا الثدييات عند 37 درجة مئوية وبنسبة 5٪ من CO2. تنظيف وتعقيم الحاضنة بانتظام لتجنب التلوث.
- عندما تصل الخلايا إلى التقاء ~ 80٪:
- اغسلها لفترة وجيزة بمحلول ملحي عازل 1x فوسفات (PBS) بدون Ca2+ و Mg2+.
- Trypsinize الخلايا مع معقمة 0.05٪ Trypsin-EDTA وفقا لبروتوكول الشركة المصنعة وعن طريق وضع الخلايا في الحاضنة لمدة 1-3 دقائق.
- تعطيل التربسين عن طريق إضافة ضعف حجم وسائط النمو الكاملة ؛ تخلط جيدا.
- جهاز الطرد المركزي تعليق الخلية في 800 × غرام لمدة 3-5 دقائق.
- عد الخلايا باستخدام مقياس انقياد الدم واحسب التخفيف المناسب لها لتكون عند التقاء ~ 70-80٪ في شرائح الحجرة في اليوم التالي. بدلا من ذلك ، يمكن أيضا استخدام دعامات مماثلة لتصوير الخلايا الحية.
- قم بتحريك الحجم المقابل للخلايا في دعم تصوير الخلايا الحية المختار ، ووضع الخلايا مرة أخرى في الحاضنة حتى اليوم التالي.
- اليوم 2. المضي قدما في نقل. اتبع إرشادات طريقة (طرق) النقل العابر المفضلة للحصول على كفاءة نقل مثالية (~ 50/80٪). لا توجد طريقة نقل محددة مطلوبة. لاحظ أن كفاءة النقل قد تختلف وفقا لخط الخلية المستخدم. احتضان لمدة 48 ساعة.
ملاحظة: إنتاج نسخ مستنسخة مستقرة تحتوي على كل من المتجهات الثلاثة لتجاوز الحاجة إلى عمليات نقل عابرة. في هذه المرحلة ، ينبغي التخطيط لنوعين من الضوابط. أولا، يلزم وجود عنصر تحكم "للمتبرعين فقط" للتحقق من أن وجود AURKA كامل الطول لا يزعج عمر mTurquoise2 في حد ذاته. ثانيا ، يجب استخدام جهاز استشعار حيوي يحمل طفرة ميتة كيناز كعنصر تحكم سلبي حيث يتم إلغاء FRET أو خفضه بشكل كبير. بدلا من المتحور الميت كيناز ، يمكن استخدام مثبط كيميائي لتنشيط AURKA مثل ATP التناظري MLN8237 كعنصر تحكم سلبي.- خطط مسبقا لثلاث حالات نقل ، كل منها في بئر مستقل:
الناقل "للمتبرعين فقط" (على سبيل المثال، AURKA-mTurquoise2)
"المستشعر الحيوي" (على سبيل المثال، superYFP-AURKA-mTurquoise2)
مستشعر حيوي كيناز ميت / "K162M" (على سبيل المثال ، superYFP-AURKA K162M-mTurquoise2) أو بدلا من ذلك ، مثبط لتنشيط AURKA (على سبيل المثال ، MLN8237) - نفذ ثلاثة شروط لكل زوج مستقل من المتبرعين / المتقبلين للمقارنة.
- ضع في اعتبارك مضاعفة عدد الآبار المنقولة عند مقارنة الخلايا غير المتزامنة والخلايا المتزامنة G2/M (انظر الخطوة 2.6).
- خطط مسبقا لثلاث حالات نقل ، كل منها في بئر مستقل:
- اليوم 3. مزامنة الخلايا في G2 / M. أضف 100 نانوغرام / مل نوكودازول مذاب في DMSO إلى كل نقل جيد لتجنب التعرض للضوء والاحتضان لمدة 16 ساعة (يفضل بين عشية وضحاها). عند مقارنة الخلايا غير المتزامنة والخلايا المتزامنة G2/M، عالج كل حالة نقل باستخدام نوكودازول أو بحجم متساو من DMSO. للحصول على كفاءة مزامنة أفضل ، قم بإعداد أليكوتات من نوكودازول ذات الاستخدام الواحد في DMSO ، وقم بتخزينها عند -20 درجة مئوية وتخلص منها بعد الاستخدام.
ملاحظة: يمكن أن تختلف كفاءة مزامنة الخلايا بين خطوط الخلايا. يجب تحديد التركيز الأمثل للنوكودازول ووقت حضانته تجريبيا من خلال نهج قياس التدفق الخلوي قبل تجارب FRET / FLIM. بالنسبة لتحليلات FRET / FLIM ذات الصلة إحصائيا ، نوصي بكفاءة التزامن في G2 / M بنسبة 50٪ على الأقل من إجمالي عدد الخلايا. - اليوم 4. غسل نوكودازول وتصوير FRET / FLIM على الخلايا الانقسامية
- قم بإزالة وسط الثقافة باستخدام ماصة واستبدله ب PBS المعقم الدافئ مسبقا. تجنب التعرض للضوء إن أمكن. هز اللوحة بلطف.
- كرر إجراء الغسيل ، وتجنب دائما التعرض للضوء.
- قم بإزالة غسيل PBS الثاني واستبدله بوسط Leibovitz L-15 المعقم والمعقم مسبقا ، المكمل بمصل البقر الجنيني 20٪ (FBS) و 1٪ البنسلين-الستربتومايسين (من هنا فصاعدا ، وسائط التصوير).
ملاحظة: يجب شراء وسائط التصوير بدون مؤشرات الأس الهيدروجيني (على سبيل المثال، الفينول الأحمر) والمكونات المتوسطة مثل الريبوفلافين. هذه المواد هي مصدر للتألق الذاتي الذي يمكن أن يزعج قيم العمر. - تابع تصوير FRET / FLIM. قلل من التغيرات السريعة في درجة الحرارة وانتقل إلى خطوة التصوير (الخطوة 3) في أسرع وقت ممكن. فكر في حماية العينة من الضوء أثناء نقلها إلى إعداد المجهر (أي عن طريق لفها في رقائق الألومنيوم أو وضعها في صندوق).
3. عمليات الاستحواذ على FRET / FLIM
ملاحظة: تم تنفيذ عمليات الاستحواذ على FRET/FLIM في هذا البروتوكول على إعداد مصمم خصيصا، موصوف في in35 ومجهز بحل تحكم كما في 15,17 (الشكل 2). يتم الآن تسويق الإعداد بواسطة Inscoper وهو مصنوع من مجهر قرص دوار مع ليزر أبيض للإثارة النبضية ، ومكثف ذو بوابات زمنية عالية المعدل أمام الكاميرا. تستخدم البوابات الزمنية من 2 ns في نافذة زمنية من 10 ns بالتتابع للحصول على كومة من خمس صور ذات بوابات زمنية. ثم تستخدم هذه الصور لحساب متوسط عمر التألق بكسل ببكسل وفقا للمعادلة التالية: τ = ΣΔti • Ιi/ΣΙi، حيث يتوافق Δti مع وقت تأخير بوابة ith بينما يشير I إلى صورة الكثافة ذات البوابة الزمنية لكل بكسل35,36 . تضمن هذه الطريقة قياسات FLIM السريعة: لا يلزم اتخاذ خطوات تركيب أو ربط ، ويمكن حساب العمر الافتراضي في وضع عبر الإنترنت ، مع الحد الأدنى من ميزانية الفوتون. ويقدم النظام أيضا واجهة برمجية سهلة الاستعمال. ومع ذلك ، يمكن إجراء نفس التجربة تحت أي إعداد مجهر تجاري آخر مجهز لقياسات FLIM.
- لضمان الإطلاق الأمثل للخلايا من كتلة G2 / M إلى الانقسام الخيطي ، قم بإجراء التجارب عند 37 درجة مئوية. إذا كان ذلك ممكنا ، قم بإجراء تجارب FRET / FLIM باستخدام إعدادات المجهر المجهزة بغرفة ترموستاتية.
- قم بتشغيل غرفة الترموستات في المجهر لمدة 30 دقيقة إلى 1 ساعة على الأقل قبل التجربة.
- قم بتشغيل الليزر والكاميرا وإعداد المجهر وبرنامج التصوير (الشكل 2).
- حدد الأطوال الموجية المناسبة للإثارة والانبعاثات للفلوروفور المانح. خيارات الأطوال الموجية المريحة هي: λex 440/10 nm و λem 483/35 nm ل mTurquoise2 (الشكل 3A) ؛ λex 488/10 نانومتر و λem 525/50 نانومتر ل GFP) (الشكل 3B).
- اضبط وقت التعرض، عادة بين 30 و100 مللي ثانية (الشكل 3). احذر من أن طاقة الليزر المفرطة قد تؤدي إلى تأثيرات سامة للضوء مستحثة مثل التبييض الضوئي ، والتي بدورها يمكن أن تعدل عمر التألق37. عند الإعداد، تحقق من عدم وجود أحداث تبييض ضوئي من خلال مراقبة شدة التألق للبوابة الأولى أثناء عمليات الاستحواذ بفاصل زمني. إذا كانت الاختلافات في شدة التألق ملحوظة ، فتخلص من الاكتساب واضبط طاقة الليزر.
ملاحظة: في الإعداد هنا ، حدد وقت التعرض الذي يسمح بما لا يقل عن 3000 مستوى رمادي في البوابة الأولى ؛ وإلا فإن البرنامج لن يحسب عمر المتبرع. تتوافق قيمة المستوى الرمادي هذه مع الحد الأدنى من ميزانية الفوتون اللازمة للحصول على قيم العمر ذات الصلة. - قبل إطلاق عمليات الاستحواذ على FRET / FLIM ، تأكد من أن الخلايا قد دخلت الانقسام عن طريق الانتظار حتى ظهور المغزل ثنائي القطب (~ 20/30 دقيقة في خلايا U2OS). نظرا لأن AURKA الانقسامي يتمركز بشكل رئيسي في هذا الهيكل ، تحقق من التقدم الانقسامي عن طريق فحص تكوين المغزل في الخلايا الموجودة تحت المجهر مباشرة ، مع مصدر ضوء خارجي (الشكل 1). لاحظ أن الوقت اللازم للتقدم الانقسامي قد يختلف وفقا لخط الخلية المستخدم.
- إذا تم التخطيط للعلاج باستخدام MLN8237 ، فضع الخلايا تحت المجهر واسمح لها بالوصول إلى الطور الفوقي (حوالي 20 دقيقة بعد غسل نوكودازول). أضف 250 نانومتر MLN8237 مذابة في DMSO إلى كل من الخلايا التي تعبر عن البنية المانحة فقط والخلايا التي تعبر عن المستشعر الحيوي.
- السيطرة على هذه الحالة على الخلايا المنقولة على النحو الوارد أعلاه واحتضان مع حجم متساو من DMSO. للحصول على تثبيط AURKA أفضل ، قم بإعداد أليكوتات أحادية الاستخدام من MLN8237 في DMSO ، وقم بتخزينها عند -80 درجة مئوية. قم بإذابتها عن طريق وضع العليات على الجليد ، وتخلص منها بعد الاستخدام.
- الحضانة لمدة 10 دقائق. بعد هذه الفترة ، سوف يتقلص المغزل الانقسامي ولا يتبقى سوى نقطة واحدة مكثفة. لوحظ نمط ظاهري مماثل عند استخدام طفرات K162M.
- للحصول على دقة أفضل للمغزل الانقسامي ، استخدم هدفا 63x على الأقل (الشكل 3).
- بمجرد العثور على خلية في الطور الفوقي (انظر الشكل 4 كمثال على خلية في الطور الفوقي)، اضبط إحداثيات xyz لوضعها في مركز مجال الرؤية.
- للحصول على صور أسرع، حدد مستوى z واحد. اختر المستوى الذي يكون فيه المغزل الانقسامي أكثر وضوحا أو كثافة.
- ابدأ التسجيل. قد يختلف وقت الحصول وفقا لإعداد FLIM المستخدم (من بضع ثوان إلى دقيقة). ستقوم غالبية الإعدادات التجارية المتاحة في السوق بتطوير كل من المجهر الفلوري وخريطة العمر الافتراضي لكل بكسل. احفظ كلتا الصورتين.
- احصل على ما لا يقل عن 10 صور مستقلة من كل حالة نقل و / أو علاج.
4. حساب ΔLifetime ومقارنة قيم FLIM بين أزواج المانحين / المتقبلين
- استخراج قيم العمر الافتراضي من خريطة العمر لكل بكسل على حدة (أي المغزل الانقسامي بأكمله)، أو حدد مناطق الاهتمام (ROIs) المقابلة لمناطق فرعية محددة.
ملاحظة: وفقا لإعداد FRET/FLIM المستخدم، يمكن إجراء حسابات مدى الحياة مباشرة على برنامج الاقتناء، أو استخراجها باستخدام حلول معالجة الصور العامة (على سبيل المثال، Fiji/ImageJ: https://fiji.sc/). يوفر البرنامج الذي يحسب قيم العمر الافتراضي مباشرة (المعروف أيضا باسم الوضع عبر الإنترنت) حلا أكثر سهولة في الاستخدام ، وهو مناسب للمبتدئين ولمستخدمي الفحص المجهري غير المطلعين تماما على FRET / FLIM. على العكس من ذلك ، فإن استخراج قيم العمر الافتراضي بعد الاقتناء غالبا ما يتطلب إجراء مناسبا. هذا الخيار أقل سهولة للمبتدئين ، حيث أن بعض المعرفة السابقة حول النماذج الرياضية للتركيب ضرورية. - بمجرد تصورها أو استخراجها ، احسب متوسط عمر الخلايا التي تعبر عن الناقل "المانح فقط" (على سبيل المثال ، AURKA-mTurquoise2) ، ويعني هذا عمر المتبرع.
- اطرح كل قيمة عمر مستقلة محسوبة في الخطوة 4.1 من متوسط عمر المتبرع. تكرار هذه الخطوة لجميع الخلايا في جميع الظروف التي تم تحليلها سيعطي ΔLifetime لكل حالة.
- قارن قيم ΔLifetime ل "المتبرع فقط" و "المستشعر الحيوي" و "K162M" أو DMSO و MLN8237.
ملاحظة: بالنسبة للشرط "للمتبرع فقط"، يجب أن ينتج عن ΔLifetime قيم قريبة من الصفر ومقابلة للتقلبات التجريبية لقيم العمر. بالنسبة لشرط "المستشعر الحيوي" ، يجب أن تسفر قيم ΔLifetime عن الفرق الصافي بين البنيتين (انظر الشكل 4 للحصول على مثال مصور). - قارن قيم ΔLifetime بين أزواج مختلفة من المتبرعين / المتقبلين.
- قارن بين شروط "المستشعر الحيوي": هل تظهر ΔLifetime مماثلة؟
- هل تظهر ظروف "K162M" أو MLN8237 ΔLifetime مماثلة فيما بينها؟ هل ΔLifetime مشابه لحالة "المتبرع فقط"؟
النتائج
اتبعنا الإجراء الموصوف أعلاه لتسجيل الفسفرة الذاتية ل AURKA على Thr288 باستخدام مستشعرين حيويين لهما خصائص طيفية مختلفة. قارنا مسبار GFP-AURKa-mCherry الأولي14 مع اثنين من أجهزة الاستشعار الحيوية ذات الخصائص الطيفية المختلفة. يعتمد هذان المسباران على مانح الفلورسنت mTurquoise2 وعلى مستقبل غير فلوريسنت (ShadowG) في حالة واحدة ، أو متقبل أصفر (superYFP) في حالة ثانية. ثم أدخلنا التسلسل الكامل ل AURKA داخل كل زوج من المتبرعين / المتقبلين. للحصول على سيطرة سلبية على تنشيط AURKA ، يمكن اتباع استراتيجيتين. أولا ، يتداخل استخدام ATP-analog صغير (MLN8237) مع ربط ATP في الجيب الحركي للكيناز ويمنع تنشيطه38. ثانيا ، طفرة Lys162 إلى Met (K162M) ، تخلق نسخة ميتة من الكيناز من كل مستشعر حيوي غير قادر على تنشيط 14،15،39. تحفز هذه الطفرة اضطراب جسر الملح الذي ينشأ عادة بين Lys162 و Glu181 ، مما يؤدي إلى فتح مستقر للجيب الحركي للكيناز ويؤدي إلى تعطيله بشكل عام40. كعنصر تحكم سلبي ل FRET ، استخدمنا بنية خالية من المتقبلات (GFP-AURKA أو AURKA-mTurquoise2).
بعد مزامنة الخلايا في G2 / M وإطلاقها في الانقسام الخيطي ، قمنا بقياس عمر جميع البنى المنقولة في المغزل الانقسامي (الشكل 4). تجدر الإشارة إلى أن هذا الهيكل تم اعتباره ككل ، ولم يتم تحليل أي عائد استثمار داخل المغزل. ثم قمنا بحساب ΔLifetime لجميع الظروف. وكما كان متوقعا، كان عمر GFP-AURKA أو AURKA-mTurquoise2 (الشروط "للمتبرعين فقط") قريبا من 0، مما يشير إلى أن القيم المقاسة لهذه التركيبات تذبذبت حول القيمة المتوسطة (الشكل 4A،4B). وعلى العكس من ذلك، كانت قيم ΔLifetime ل GFP-AURKA-mCherry مختلفة إحصائيا عن حالة المتبرع فقط، مع زيادة ΔLifetime بمقدار ~ 130 ps (الشكل 4A). وأجريت ملاحظات مماثلة ل shadowG-AURKA-mTurquoise2 و superYFP-AURKA-mTurquoise2، مع زيادة ΔLifetime بمقدار ~ 150 و ~ 220 ps من حالة المانحة فقط، على التوالي (الشكل 4B، 4C). يمكن تصور هذه البيانات بسهولة في خلايا مفردة باستخدام جدول بحث زائف اللون (LUT). في هذه الحالة ، تكون قيم ΔLifetime حول 0 صفراء زائفة اللون ، في حين أن الاختلافات الأكثر أهمية هي الأحمر / الأرجواني الزائف. في الواقع ، كان LUT بكسل تلو الآخر أقرب إلى اللون الأصفر في الخلايا التي تعبر عن البنى المانحة فقط ، في حين كان أكثر في الطيف الأحمر / الأرجواني في الخلايا التي تعبر عن أي من المستشعر الحيوي (الشكل 4A ، 4B). وقد لوحظ هذا أيضا عندما عولج المستشعر الحيوي GFP-AURKA-mCherry باستخدام المثبط الدوائي MLN8237.
ثم قمنا بتحليل ΔLifetime للمستشعرات الحيوية الميتة كيناز. أظهرت هذه التركيبات قيم ΔLifetime الوسيطة: كان ΔLifetime أعلى بكثير عند مقارنته بحالة المتبرع فقط (الشكل 4B ، 4C) ، ولكنه كان أيضا أقل بكثير من نظرائهم العاديين (الشكل 4B ، 4D). المقارنات مع الخلايا المعالجة ب MLN8237 أو التي تعبر عن أجهزة الاستشعار الحيوية الميتة كيناز ضرورية لتقدير ما إذا كانت اختلافات ΔLifetime لكل زوج من المتبرعين / المتقبلين مرتبطة فقط بتنشيط AURKA. في حالة GFP-AURKA-mCherry ، يتم إلغاء اختلافات ΔLifetime عند استخدام مثبط خاص ب AURKA. على العكس من ذلك ، ترتبط اختلافات ΔLifetime في الغالب ، ولكن ليس حصريا بتنشيط AURKA في حالة shadowG-AURKA-mTurquoise2 و superYFP-AURKA-mTurquoise2.
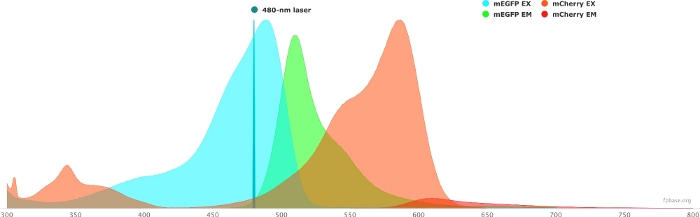
الشكل 1: GFP (المانح) و mCherry (المتقبل) الإثارة وأطياف الانبعاثات.
تم الحصول على الأطياف وتكييفها من موقع قاعدة FP (https://www.fpbase.org/) ، وتعديلها إلى إثارة ليزر 480 نانومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 2: صورة لمساحة العمل التجريبية.
(1) حل التحكم؛ (2) مصدر الليزر الأبيض. (3) كاميرا CCD ؛ (4) إعداد المجهر ؛ (5) مصدر الضوء الخارجي / مصباح لفحص العين من العينة. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
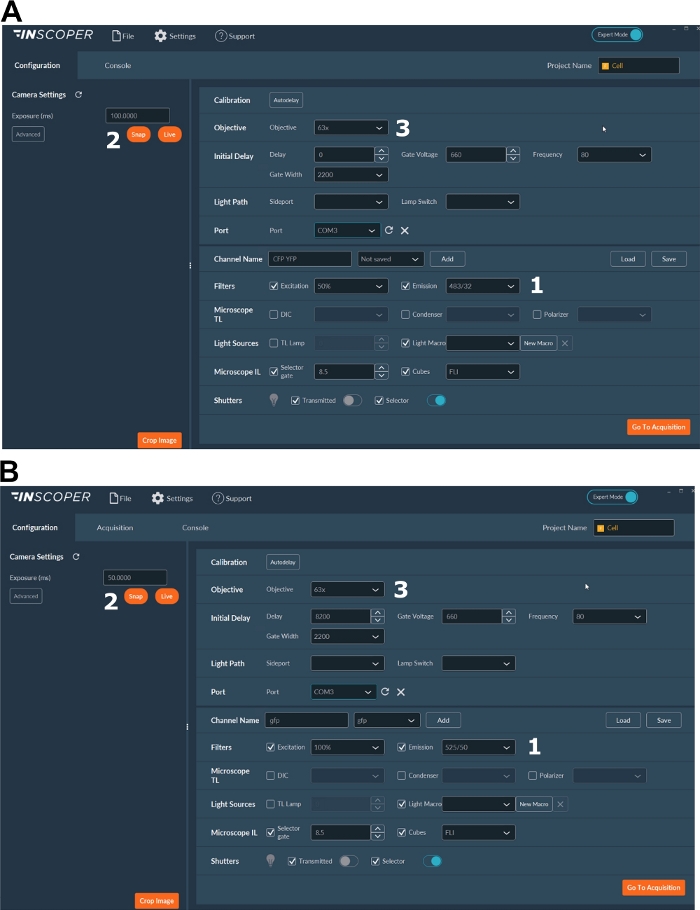
الشكل 3: صور تمثيلية للبرنامج الخاص بالحصول على FLIM.
(أ، ب) (1) بارامترات الإثارة والانبعاثات للمانح (CFP في A ، أو GFP في B) ؛ (2) وقت التعرض؛ (3) اختيار الهدف. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
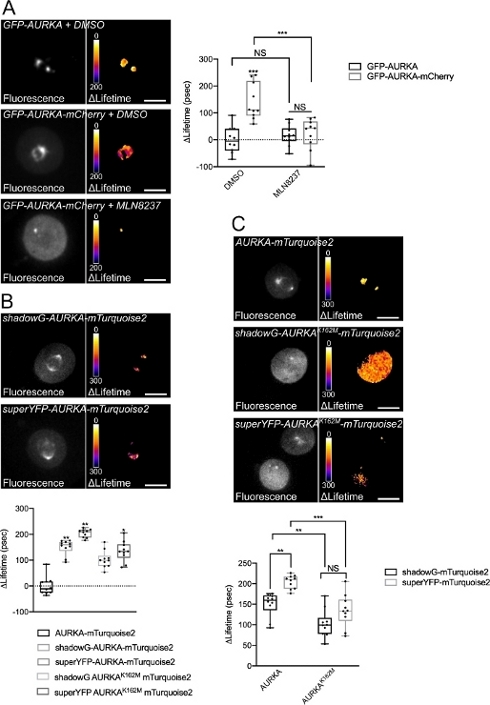
الشكل 4: صور تمثيلية لأجهزة الاستشعار الحيوية AURKA FRET وضوابطها السلبية.
(أ) (Micrographs) Fluorescence (القناة الخضراء) وما يقابلها من بكسل ΔLifetime (المتبرع فقط - المستشعر الحيوي) لخلايا U2OS التي تعبر عن GFP-AURKA أو GFP-AURKA-mCherry ، متزامنة في G2 / M ، يتم إطلاقها حتى يصبح المغزل ثنائي القطب مرئيا ثم يعالج باستخدام DMSO أو مع MLN8237. يتم توضيح ΔLifetime بمقياس زائف اللون (جدول بحث "النار"). (رسم بياني) القياس الكمي المقابل وتحليل ANOVA ثنائي الاتجاه للظروف المشار إليها. (B) (Micrographs) Fluorescence (قناة سماوية) وما يقابلها من بكسل ΔLifetime (مانح فقط - مستشعر حيوي) لخلايا U2OS التي تعبر عن الظل G-AURKA-mTurquoise2 (اللوحة العلوية) أو superYFP-AURKA-mTurquoise2 (اللوحة السفلية) ، متزامنة في G2 / M ويتم إطلاقها حتى يكون المغزل ثنائي القطب مرئيا. يتم توضيح ΔLifetime بمقياس زائف اللون (جدول بحث "النار"). (رسم بياني) القياس الكمي المقابل وتحليل ANOVA أحادي الاتجاه للظروف الممثلة في الصور المجهرية المذكورة أعلاه. (ج) (الصور المجهرية) صور AURKA-mTurquoise2 (اللوحة العلوية) والظل G-AURKA K162M-mTurquoise2 (اللوحة الوسطى) و superYFP-AURKA K162M-mTurquoise2 التي تم الحصول عليها وتمثيلها كما هو الحال في الصور المجهرية. (رسم بياني) تحليل ANOVA ثنائي الاتجاه لظروف النقل المشار إليها. يمثل الشريط الموجود في المربعات الوسيط. تمتد الشعيرات من الحد الأدنى إلى الحد الأقصى n = 10 خلايا لكل حالة من تجربة تمثيلية واحدة (من ثلاثة). يتم تمثيل القيم الفردية كنقاط. شريط المقياس: 10 ميكرومتر* P < 0.05، **P < 0.01، ***P < 0.001 مقابل كل شرط مبين في (A) الشرط "AURKA-mTurquoise2" في (B)، وضد كل شرط مبين في (C). ن.س: ليست مهمة. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
أجهزة الاستشعار الحيوية FRET المشفرة وراثيا هي أدوات موثوقة لقياس تنشيط البروتينات المفردة أو مسارات الإشارات بأكملها41. على وجه الخصوص ، يشكل المستشعر الحيوي AURKA FRET طريقة تفضيلية لاستكشاف تنشيط الكيناز في الزمان والمكان. ومع ذلك ، تستحق بعض العناصر اهتماما خاصا عند تصميم أو تحسين جهاز استشعار حيوي FRET ، ليس فقط بشكل عام ولكن بشكل أكثر تحديدا ل AURKA.
أولا ، يمكن تكييف طبيعة والوضع النسبي لزوج FRET المانح / المتقبل لوظائف محددة لهذا الكيناز. يتم إثراء AURKA بشكل كبير في المغزل الانقسامي أثناء الانقسام ، ولكنه موجود طوال دورة الخلية وفي مواقع مختلفة دون الخلية (على سبيل المثال ، السنتروسومات ، النواة ، والميتوكوندريا)1,2. إذا كان من المقرر استخدام المستشعر الحيوي في مقصورات محددة مثل الميتوكوندريا ، والتي يمكن أن تصل إلى درجة الحموضة الحمضية ، فيجب اختيار زوج FRET غير الحساس للأس الهيدروجيني للمتبرع والمستقبل مثل mTurquoise2 / shadowG. علاوة على ذلك ، فإن وضع المتبرع FRET في المحطة C يمكن أن يسمح بتصور أفضل للمستشعر الحيوي في هذه المقصورة تحت الخلوية ، وربما حتى تحسين اكتشاف FRET بالنظر إلى أن AURKA N-terminus قد تبين أنه يشق جزئيا في الميتوكوندريا 16,42.
ثانيا ، تتطلب طريقة غير مستكشفة بعد لتحسين المستشعر الحيوي AURKA FRET تصميما أكثر دقة للروابط بين AURKA كاملة الطول وزوج المتبرع / المستقبل. ليس فقط المسافة بين زوج الفلورسنت ، ولكن أيضا خصائص الرابط نفسه تبين أنها عوامل رئيسية لتحسين كفاءة FRET43,44,45,46. في ضوء ذلك ، يمكن أن تكون زيادة صلابة أو مرونة الرابط إما ضارة بكفاءة FRET ، أو تزيد من تحسينها.
ثالثا ، من المعروف أن الإفراط في التعبير عن AURKA يؤدي إلى تشوهات المغزل الانقسامي في نسبة كبيرة من الخلايا2. سيكون من المثير للاهتمام مقارنة ΔLifetime التي تم الحصول عليها من خلال التعبير عن نفس بنية FRET تحت مروج قوي مثل الفيروس المضخم للخلايا (CMV) - أحد أكثر المروجين شيوعا الموجودين في ناقلات التعبير الثدييات - أو تحت تسلسل AURKA الأدنى للمروج (CTTCCGG) 14,47. وقد تبين سابقا أن هذا المروج ينقذ المغازل أحادية القطب أو متعددة الأقطاب التي تنشأ بعد ضربة قاضية للكيناز ، ولم يؤد استخدامه إلى اضطرابات دورة الخلية في حد ذاتها 14,47. على الرغم من أن FLIM غير حساس لمستويات التعبير عن البروتين والتركيزات النسبية في الخلية11 ، فإن الاستفادة من مقارنة شاملة بين المروجين على نفس إعداد المستشعر الحيوي من شأنه أن يوسع فهم مجموعة AURKA المنشطة في أي موقع معين. بالإضافة إلى ذلك ، سيوفر رؤى جديدة حول كيفية تغير تنشيط AURKA عند الإفراط في التعبير ، وهو أمر ذي صلة بنماذج السرطان الظهارية والدموية.
أخيرا ، يجب أيضا أخذ تطبيق FRET النهائي في الاعتبار. سيكون المنظور المستقبلي في مجال AURKA هو تجميع المستشعر الحيوي التوافقي كيناز مع مستشعر حيوي قائم على الركيزة. يتطلب تحليل سلوك FRET لاثنين من أجهزة الاستشعار الحيوية في وقت واحد - وهي عملية تعرف باسم FRET متعدد الإرسال - متقبلا مظلما على المستشعر الحيوي الأول لتجنب النزيف الطيفي في القناة المانحة الثانية. في سياق AURKA ، من شأن هذا أن يفتح منظورا جديدا مثيرا للكشف عن تنشيط الكيناز باستخدام المستشعر الحيوي الأول ، ونشاطه الأنزيمي نحو ركيزة معينة مع الركيزة الثانية. تسمح التطورات الأخيرة في تعدد الإرسال الآن بتجميع ما يصل إلى ثلاثة أجهزة استشعار حيوي في وقت واحد48. يمكن أن يمثل تطبيق طريقة مماثلة في سياق AURKA استراتيجية واعدة للغاية ليس فقط لاختبار تفاعل التنشيط والنشاط للكيناز ، ولكن أيضا لاستكشاف سلاسل إشارات AURKA بدقة مكانية زمانية غير مسبوقة.
في الختام ، FRET / FLIM هي طريقة مريحة لتعميق المعرفة حول نشاط البروتين. من ناحية ، فإنه يسمح بتصور توطين بروتين معين في الخلايا الحية ، وذلك بفضل مويتي فلوري واحد على الأقل. من ناحية أخرى ، يمكن أن يكشف عن التغيرات التوافقية للبروتين ، والتي يمكن أن تكون مفيدة في تنشيط البروتين و / أو النشاط. لذلك ، فإن أجهزة الاستشعار الحيوية FRET / FLIM و FRET التوافقية لديها القدرة على أن تصبح طرقا واسعة الانتشار لمتابعة مسارات الإشارات في الخلايا الحية ، ودقة مكانية زمانية رائعة.
Disclosures
أجرى ج.B. التجارب، وكتب المخطوطة وراجعها، وقدم التمويل، وراجع م. ت. المخطوطة وقدم الدعم. M.T. هو مستشار علمي ومساهم في شركة Inscoper (فرنسا) ، التي تنتج حلول قياسات FLIM السريعة الموضحة في هذه المخطوطة. دعم Inscoper جزئيا نشر الوصول المفتوح للمخطوطة. لم يشارك Inscoper في التصميم التجريبي أو معالجة البيانات أو كتابة المخطوطة.
Acknowledgements
نشكر مهندسي مركز التصوير المجهري رين (MRic ، BIOSIT ، رين ، فرنسا) على المشورة والمساعدة ، وخاصة X. Pinson على القراءة النقدية للمخطوطة. MRic عضو في البنية التحتية الوطنية France-BioImaging التي تدعمها الوكالة الوطنية الفرنسية للبحوث (ANR-10-INBS-04). وحظي هذا العمل بدعم المركز الوطني للبحوث العلمية، ورابطة مكافحة السرطان لجان التعليم والفيلين، وكوت الدروع والفينيستير، ورابطة البحوث المناهضة للسرطان التابعة لمجموعة .B.
Materials
| Name | Company | Catalog Number | Comments |
| Alisertib (MLN8237) | SelleckChem | S1133 | Use at a 250 nM final dilution |
| Dulbecco's Modified Eagle Medium (DMEM) | ThermoFischer Scientific Brand: Gibco | 41966052 | High glucose + L-glutamine + Sodium pyruvate |
| Fetal Bovine Serum (FBS) | ThermoFischer Scientific Brand: Gibco | 10270106 | |
| L15 | ThermoFischer Scientific Brand: Gibco | 21083027 | Leibovitz's L15 medium + L-glutamine, no Phenol red |
| LabTek | Nunc | 2515380 | |
| Nocodazole | Merck Brand: Sigma-Aldrich | M1404 | Use at a 100 ng/mL final dilution |
| Penicillin/Streptomycin | ThermoFischer Scientific Brand: Gibco | 15140122 | Penicillin-Streptomycin 10,000 U/mL (100x) |
| Phosphate Buffer Saline (PBS) | ThermoFischer Scientific Brand: Gibco | 14190169 | DPBS, no calcium, no magnesium |
| Trypsin/EDTA | ThermoFischer Scientific Brand: Gibco | 25300096 | Trypsin-EDTA 0.05%, Phenol Red (1x) |
References
- Bertolin, G., Tramier, M. Insights into the non-mitotic functions of Aurora kinase A: more than just cell division. Cellular and Molecular Life Sciences. , (2019).
- Nikonova, A. S., Astsaturov, I., Serebriiskii, I. G., Dunbrack, R. L., Golemis, E. A. Aurora A kinase (AURKA) in normal and pathological cell division. Cellular and Molecular Life Sciences. 70 (4), 661-687 (2013).
- Walter, A. O., Seghezzi, W., Korver, W., Sheung, J., Lees, E. The mitotic serine/threonine kinase Aurora2/AIK is regulated by phosphorylation and degradation. Oncogene. 19 (42), 4906-4916 (2000).
- Cheetham, G. M. T. Crystal Structure of Aurora-2, an Oncogenic Serine/Threonine Kinase. Journal of Biological Chemistry. 277 (45), 42419-42422 (2002).
- Bayliss, R., Sardon, T., Vernos, I., Conti, E. Structural basis of Aurora-A activation by TPX2 at the mitotic spindle. Molecular Cell. 12 (4), 851-862 (2003).
- Zhang, Y., et al. Identification of the auto-inhibitory domains of Aurora-A kinase. Biochemical and Biophysical Research Communications. 357 (2), 347-352 (2007).
- Littlepage, L. E., Wu, H., Andresson, T., Deanehan, J. K., Amundadottir, L. T., Ruderman, J. V. Identification of phosphorylated residues that affect the activity of the mitotic kinase Aurora-A. Proceedings of the National Academy of Sciences of the United States of America. 99 (24), 15440-15445 (2002).
- Kufer, T. A., et al. Human TPX2 is required for targeting Aurora-A kinase to the spindle. The Journal of Cell Biology. 158 (4), 617-623 (2002).
- Eyers, P. A., Erikson, E., Chen, L. G., Maller, J. L. A novel mechanism for activation of the protein kinase Aurora A. Current Biology. 13 (8), 691-697 (2003).
- Brunet, S., et al. Characterization of the TPX2 Domains Involved in Microtubule Nucleation and Spindle Assembly in Xenopus Egg Extracts. Molecular Biology of the Cell. 15 (12), 5318-5328 (2004).
- Padilla-Parra, S., Tramier, M. FRET microscopy in the living cell: Different approaches, strengths and weaknesses. BioEssays. 34 (5), 369-376 (2012).
- Aoki, K., Kamioka, Y., Matsuda, M. Fluorescence resonance energy transfer imaging of cell signaling from in vitro to in vivo: Basis of biosensor construction, live imaging, and image processing. Development, Growth & Differentiation. 55 (4), 515-522 (2013).
- Fuller, B. G., et al. Midzone activation of aurora B in anaphase produces an intracellular phosphorylation gradient. Nature. 453 (7198), 1132-1136 (2008).
- Bertolin, G., et al. A FRET biosensor reveals spatiotemporal activation and functions of aurora kinase A in living cells. Nature Communications. 7, 12674 (2016).
- Bertolin, G., et al. Optimized FRET Pairs and Quantification Approaches To Detect the Activation of Aurora Kinase A at Mitosis. ACS Sensors. 4 (8), 2018-2027 (2019).
- Bertolin, G., et al. Aurora kinase A localises to mitochondria to control organelle dynamics and energy production. eLife. 7, (2018).
- Sizaire, F., Le Marchand, G., Pécréaux, J., Bouchareb, O., Tramier, M. Automated screening of AURKA activity based on a genetically encoded FRET biosensor using fluorescence lifetime imaging microscopy. Methods and Applications in Fluorescence. 8 (2), 024006 (2020).
- Demeautis, C., et al. Multiplexing PKA and ERK1&2 kinases FRET biosensors in living cells using single excitation wavelength dual colour FLIM. Scientific Reports. 7, 41026 (2017).
- Ringer, P., et al. Multiplexing molecular tension sensors reveals piconewton force gradient across talin-1. Nature Methods. 14 (11), 1090-1096 (2017).
- Nagai, T., Yamada, S., Tominaga, T., Ichikawa, M., Miyawaki, A. Expanded dynamic range of fluorescent indicators for Ca(2+) by circularly permuted yellow fluorescent proteins. Proceedings of the National Academy of Sciences of the United States of America. 101 (29), 10554-10559 (2004).
- Klarenbeek, J., Goedhart, J., van Batenburg, A., Groenewald, D., Jalink, K. Fourth-Generation Epac-Based FRET Sensors for cAMP Feature Exceptional Brightness, Photostability and Dynamic Range: Characterization of Dedicated Sensors for FLIM, for Ratiometry and with High Affinity. PLOS ONE. 10 (4), 0122513 (2015).
- Fritz, R. D., et al. A Versatile Toolkit to Produce Sensitive FRET Biosensors to Visualize Signaling in Time and Space. Science Signaling. 6 (285), (2013).
- Mastop, M., et al. Characterization of a spectrally diverse set of fluorescent proteins as FRET acceptors for mTurquoise2. Scientific Reports. 7 (1), 11999 (2017).
- vander Krogt, G. N. M., Ogink, J., Ponsioen, B., Jalink, K. A Comparison of Donor-Acceptor Pairs for Genetically Encoded FRET Sensors: Application to the Epac cAMP Sensor as an Example. PLoS ONE. 3 (4), 1916 (2008).
- Cranfill, P. J., et al. Quantitative assessment of fluorescent proteins. Nature Methods. 13 (7), 557-562 (2016).
- Goedhart, J., et al. Structure-guided evolution of cyan fluorescent proteins towards a quantum yield of 93. Nature Communications. 3 (1), (2012).
- Mérola, F., et al. Newly engineered cyan fluorescent proteins with enhanced performances for live cell FRET imaging. Biotechnology Journal. 9 (2), 180-191 (2014).
- Erard, M., et al. Minimum set of mutations needed to optimize cyan fluorescent proteins for live cell imaging. Molecular BioSystems. 9 (2), 258-267 (2013).
- Tramier, M., Zahid, M., Mevel, J. C., Masse, M. J., Coppey-Moisan, M. Sensitivity of CFP/YFP and GFP/mCherry pairs to donor photobleaching on FRET determination by fluorescence lifetime imaging microscopy in living cells. Microscopy Research and Technique. 69 (11), 933-939 (2006).
- Padilla-Parra, S., et al. Quantitative Comparison of Different Fluorescent Protein Couples for Fast FRET-FLIM Acquisition. Biophysical Journal. 97 (8), 2368-2376 (2009).
- Burgstaller, S., et al. pH-Lemon, a Fluorescent Protein-Based pH Reporter for Acidic Compartments. ACS Sensors. , (2019).
- Bindels, D. S., et al. mScarlet: a bright monomeric red fluorescent protein for cellular imaging. Nature Methods. 14 (1), 53-56 (2016).
- Murakoshi, H., Shibata, A. C. E., Nakahata, Y., Nabekura, J. A dark green fluorescent protein as an acceptor for measurement of Förster resonance energy transfer. Scientific Reports. 5, 15334 (2015).
- Murakoshi, H., Shibata, A. C. E. ShadowY: a dark yellow fluorescent protein for FLIM-based FRET measurement. Scientific Reports. 7 (1), 6791 (2017).
- Leray, A., Padilla-Parra, S., Roul, J., Héliot, L., Tramier, M. Spatio-Temporal Quantification of FRET in living cells by fast time-domain FLIM: a comparative study of non-fitting methods [corrected]. PloS One. 8 (7), 69335 (2013).
- Padilla-Parra, S., Audugé, N., Coppey-Moisan, M., Tramier, M. Quantitative FRET analysis by fast acquisition time domain FLIM at high spatial resolution in living cells. Biophysical Journal. 95 (6), 2976-2988 (2008).
- Song, L., Hennink, E. J., Young, I. T., Tanke, H. J. Photobleaching kinetics of fluorescein in quantitative fluorescence microscopy. Biophysical Journal. 68 (6), 2588-2600 (1995).
- Manfredi, M. G., et al. Characterization of Alisertib (MLN8237), an investigational small-molecule inhibitor of aurora A kinase using novel in vivo pharmacodynamic assays. Clinical Cancer Research: An Official Journal of the American Association for Cancer Research. 17 (24), 7614-7624 (2011).
- Katayama, H., et al. Phosphorylation by aurora kinase A induces Mdm2-mediated destabilization and inhibition of p53. Nature Genetics. 36 (1), 55-62 (2004).
- Nowakowski, J., et al. Structures of the Cancer-Related Aurora-A, FAK, and EphA2 Protein Kinases from Nanovolume Crystallography. Structure. 10 (12), 1659-1667 (2002).
- Palmer, A. E., Qin, Y., Park, J. G., McCombs, J. E. Design and application of genetically encoded biosensors. Trends in Biotechnology. 29 (3), 144-152 (2011).
- Grant, R., et al. Constitutive regulation of mitochondrial morphology by Aurora A kinase depends on a predicted cryptic targeting sequence at the N-terminus. Open Biology. 8 (6), 170272 (2018).
- Shimozono, S., Miyawaki, A. Engineering FRET Constructs Using CFP and YFP. Methods in Cell Biology. 85, 381-393 (2008).
- Komatsu, N., et al. Development of an optimized backbone of FRET biosensors for kinases and GTPases. Molecular Biology of the Cell. 22 (23), 4647-4656 (2011).
- Schifferer, M., Griesbeck, O. A Dynamic FRET Reporter of Gene Expression Improved by Functional Screening. Journal of the American Chemical Society. 134 (37), 15185-15188 (2012).
- Peroza, E. A., Boumezbeur, A. H., Zamboni, N. Rapid, randomized development of genetically encoded FRET sensors for small molecules. Analyst. 140 (13), 4540-4548 (2015).
- Reboutier, D., et al. Aurora A is involved in central spindle assembly through phosphorylation of Ser 19 in P150Glued. The Journal of Cell Biology. 201 (1), 65-79 (2013).
- Mo, G. C. H., Posner, C., Rodriguez, E. A., Sun, T., Zhang, J. A rationally enhanced red fluorescent protein expands the utility of FRET biosensors. Nature Communications. 11 (1), 1848 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved