Method Article
使用活细胞中的构象FRET生物传感器实时监测极光激酶A活化
摘要
多功能Ser/Thr激酶AURKA的激活以其在Thr288上的自磷酸化为特征。依赖于FRET的荧光探针可以区分其非活性和激活状态。在这里,我们说明了探针工程的一些策略,以及快速的FRET方案,以跟踪整个有丝分裂中的激酶激活。
摘要
上皮癌通常以Ser/ Thr激酶Aurora A / AURKA的过表达为特征。AURKA是一种多功能蛋白质,在Thr288上自磷酸化时激活。AURKA丰度在有丝分裂中达到峰值,在那里它控制有丝分裂纺锤体的稳定性和保真度,以及有丝分裂的整体效率。虽然在结构水平上表征良好,但缺乏对整个细胞周期中AURKA激活的一致监测。一种可能的解决方案包括使用遗传编码的Förster共振能量转移(FRET)生物传感器,以足够的时空分辨率深入了解AURKA的自磷酸化。在这里,我们描述了一种方案,用于设计检测Thr288自身磷酸化的FRET生物传感器,以及如何在有丝分裂期间遵循这种修饰。首先,我们概述了可能的供体/受体FRET对,并展示了AURKA FRET生物传感器在哺乳动物细胞中可能的克隆和插入方法。然后,我们在定制设置上通过荧光寿命成像显微镜(FLIM)为快速FRET测量提供分步分析。但是,该协议也适用于可用的替代商业解决方案。最后,我们考虑了基于AURKA的生物传感器最合适的FRET控制,并强调了未来潜在的改进,以进一步提高该工具的灵敏度。
引言
极光激酶 A/AURKA 是一种多功能丝氨酸/苏氨酸激酶,在整个细胞周期和不同的亚细胞区室中具有活性1。了解其广泛的时空激活在癌症中尤为重要,因为AURKA在上皮和血液系统恶性肿瘤中经常过度表达,患者对当前可用的疗法反应不佳2。
结构研究表明,AURKA经历了两个步骤才能从无活性激酶转化为活性激酶。首先,Thr288的自磷酸化改变了激酶动力学口袋的构象并激活了它3,4,5,6。该步骤增加了AURKA在人细胞和非洲爪蟾中的催化活性3,6,7,启动激酶以获得完全活性。一旦被激活,AURKA与Xklp2(TPX2)靶向蛋白的相互作用就会诱导第二次构象变化5。这种进一步的修饰使AURKA能够达到对细胞中底物的完全酶活性5,8,9,10。
近二十年来,对AURKA的激活和活性的见解主要是通过生化方法的组合获得的。这些包括在细胞或 体内 检测磷酸化的Thr288作为AURKA活化的标志,晶体学分析,以及在 体外 或纤维素激酶测定 中以 探测AURKA1的活性。然而,这些方法的时空分辨率很差或不存在,需要新的解决方案来拓宽对这两个事件动态的了解。
在过去几年中,荧光探针的发展促进了对活细胞中AURKA的监测,从而允许以更高的时空分辨率进行后续激活。迄今为止开发的AURKA最具体的传感器依赖于FRET原理(Förster共振能量转移)11 来区分非活动和有源AURKA。开发的第一个传感器是基于底物的AURKA激酶活性生物传感器。基于底物的生物传感器由给定激酶靶向磷酸化的短氨基酸序列构成,并插入供体/受体FRET对和识别磷酸化残基的结合结构域中,这有助于生物传感器的折叠以实现有效的FRET过程12。在AURKA的情况下,在CFP-YFP供体/受体对之间插入磷酸化靶向的KIF2C的14-氨基酸片段13。但是,此传感器具有一些主要缺点。首先,该探针中使用的KIF2C序列可以通过AURKA和密切相关的激酶AURKB靶向,从而降低该生物传感器的特异性。其次,传感器依靠内源性激酶进行磷酸化。因此,如果激酶的量受到限制(例如,在亚细胞区室或细胞周期阶段),则FRET效率可能无法检测到或不显着。为了克服这些限制,我们创建了一类新的AURKA传感器,称为"构象传感器"。在这些探针中,将AURKA的全长序列插入N端的供体荧光团中,并在C端插入受体荧光团中。非活性AURKA呈现"开放"构象,使激酶的N端和C端彼此远离。由于两个末端之间的距离(>10 nm),供体/受体对处于FRET的不允许配置中。相反,自磷酸化AURKA采用"闭合"构象,两个蛋白质末端和两个荧光团靠近。这被证明允许供体和受体之间的FRET,这可以使用供体寿命的变化来测量14,15。这种探头具有几个优点。首先,它们是遗传编码的,它们可以用来替代细胞中的内源性激酶。其次,它们拯救了由AURKA敲低诱导的表型,表明它们在细胞中具有功能性。第三,它们允许在不同的亚细胞区室和整个细胞周期中跟踪激酶的激活。探针在已知激酶被激活的位置(即中心体和有丝分裂纺锤体)检测到AURKA的激活,并且还参与发现线粒体16处AURKA的激活。最后,这些传感器允许基于FRET / FLIM的高内涵筛选,其中AURKA的构象变化用于鉴定新的药理学抑制剂17。
在目前的工作中,我们描述了一种可视化培养细胞中AURKA激活的过程。首先,我们将深入了解FRET的潜在荧光团对。最合适的供体/受体对的选择将根据可用的显微镜设置或特定的下游应用(如多路复用FRET18,19)进行。然后,我们提出了一个管道来探索在快速FRET / FLIM显微镜设置中选择的生物传感器的行为。该管道将从细胞培养和同步程序扩展到FLIM采集和数据分析。最后,我们将讨论该协议的潜在优势,因为生物传感器设计的类似策略可以应用于其他激酶,也可以与其他基于FRET的成像系统一起使用。
研究方案
注意:该方案中使用的U2OS细胞是从American Type Culture Collection(ATCC,HTB-96)购买的,并且它们被测试为不含支原体。步骤2.1至2.7应在层流罩下进行,以保持细胞和试剂无菌。
1. 选择供体/受体 FRET 对
- 有关选择最合适的供体/受体FRET对,请参阅文献。有用的例子可以在20,21,22,23,24中找到,尽管最终的选择必须根据FRET/ FLIM设置的特性(可用的激光线,滤光片等)进行。以下是有关如何选择供体/受体对的一些注意事项。
- 选择供体:参考FP碱基(https://www.fpbase.org/)以获取有关可用荧光蛋白的完整信息。该数据库不断更新所有新开发的荧光团。
- 请参阅荧光生物传感器数据库(https://biosensordb.ucsd.edu/index.php),以获取有关文献中已有的生物传感器以及所使用的相应荧光蛋白的更多信息。
- 作为一般起点,选择明亮的供体荧光团。好的候选者是青色荧光蛋白如mTFP1或ECFP,或GFP变体如EGFP或mEGFP。
- 低聚物可影响蛋白质定位和/或功能25。考虑使用CFP的单体突变体作为mTurquoise226或Aquamarine27,28。这些变体还具有良好的量子产率和消光系数,这使它们成为FRET供体的良好候选者。
- 优先考虑对环境变化(如细胞内pH23)或光漂白25不敏感的荧光蛋白(作为供体或受体),因为FRET效率可能受到这些参数的严重影响29。如今,像mTurquoise2或mTFP1这样的荧光团被广泛用作供体,这要归功于它们良好的光稳定性22,25,26。
- 选择受体:青色供体通常与黄色荧光蛋白(YFP)变体配对,如mVenus,黄水晶和YPet20,21,22,30。然而,应该注意的是,这些蛋白质对pH值具有更高的敏感性,并且在全球范围内显示出较差的光稳定性。
- 考虑使用新开发的、对 pH 不敏感的 YFP 黄色变体作为 pH-Lemon31,使用绿色荧光团作为 mNeonGreen23,或使用红色荧光团作为 mScarlet-I23,32 作为先前验证的 mTurquoise2 荧光受体。
- 或者,考虑使用YFP的非荧光/暗衍生物作为ShadowG33或ShadowY34,它们在FRET / FLIM实验中被证明是青色荧光供体的良好受体。
- 如果使用mEGFP作为供体,请考虑使用单体红色受体作为mCherry。
- 使用FP基础网站上提供的工具验证所选供体/受体对的光谱特性。有关 mEGFP/m 樱桃对的示例,请参见 图 1 。
- 在FP基础网站上,选择 工具 下拉菜单,然后选择 光谱查看器。
- 在下拉菜单中,输入要可视化的荧光团对的名称(例如,mEGFP 和 mCherry)。
- 通过在下拉菜单中选择给定的激光器,模拟具有特定光源的供体/受体对的属性。或者,通过选择 "添加激光器"输入特定的激光波长。单击"归一 化发射到此选项 ",将荧光团光谱调整为所需的波长。在这里,用于激发GFP的波长为480±10nm。
- 通过在AURKA全长序列的N末端添加一个荧光团,在C末端添加一个荧光团来克隆选定的供体/受体对。遵循首选克隆方法的指南,将该结构插入所选的哺乳动物表达载体中。
2. 细胞培养、转染和同步
- 第一天。准备U2OS细胞的培养基:使用Dulbecco的改良鹰培养基(DMEM),并补充10%胎牛血清(FBS),1%青霉素 - 链霉素和1%L-谷氨酰胺(从这里开始, 完整的生长培养基)。或者,也可以使用预先补充的L-谷氨酰胺的DMEM。
- 如果细胞被冷冻,请在实验前至少8天解冻小瓶(即从2.5点开始)。
- 在专用于哺乳动物细胞培养物的培养箱中,在37°C和5%CO 2下培养细胞。定期清洁和消毒培养箱,以避免污染。
- 当细胞达到约80%汇合时:
- 用不含Ca2 +和Mg2 +的无菌1x磷酸盐缓冲盐水(PBS)短暂洗涤它们。
- 根据制造商的方案,用无菌的0.05%胰蛋白酶-EDTA对细胞进行胰蛋白酶消化,并将细胞置于培养箱中1-3分钟。
- 通过添加两倍于完整生长培养基体积来灭活胰蛋白酶;混合均匀。
- 将细胞悬浮液以800× g 离心3-5分钟。
- 使用血细胞计数器计数细胞,并计算适当的稀释度,使它们在第二天的腔室载玻片中汇合度约为70-80%。或者,也可以使用类似的活细胞成像支持。
- 在所选的活细胞成像支持中移取相应体积的细胞,并将细胞放回培养箱中直到第二天。
- 第2天。继续进行转染。遵循首选瞬时转染方法的指南,以获得最佳转染效率(~50/80%)。无需特定的转染方法。请注意,转染效率可能因所使用的细胞系而异。孵育48小时。
注意:生产包含三种载体中每种载体的稳定克隆,以绕过瞬时转染的需要。在此阶段,应规划两种类型的控制措施。首先,需要"仅供体"控制来验证全长AURKA的存在不会干扰mTurquoise2本身的寿命。其次,携带激酶死亡突变的生物传感器应用作阴性对照,其中FRET被废除或显着降低。作为激酶死亡突变体的替代物,作为ATP模拟MLN8237的AURKA激活的化学抑制剂可用作阴性对照。- 提前计划三种转染条件,每种情况都在一个独立的孔中:
"仅限供体"的载体(例如,AURKA-mTurquoise2)
"生物传感器"(例如,superYFP-AURKA-mTurquoise2)
激酶死/"K162M"生物传感器(例如,superYFP-AURKA K162M-mTurquoise2)或替代性 AURKA 激活抑制剂(例如 MLN8237) - 对每个独立的供体/受体对执行三个条件进行比较。
- 如果比较不同步和G2 / M同步的细胞,请考虑将转染孔的数量增加一倍(见步骤2.6)。
- 提前计划三种转染条件,每种情况都在一个独立的孔中:
- 第3天。将溶解在DMSO中的100ng / mL诺考达唑加入到每个转染孔中,避免光照并孵育16小时(最好过夜)。如果比较不同步和G2 / M同步细胞,请用诺考达唑或等体积的DMSO治疗每种转染情况。为了获得更好的同步效率,在DMSO中制备一次性使用酚达唑等分试样,将其储存在-20°C并在使用后丢弃。
注意:细胞同步效率可能因细胞系而异。在进行FRET/FLIM实验之前,应通过流式细胞术方法通过实验确定诺考达唑的最佳浓度及其孵育时间。对于与统计相关的FRET/FLIM分析,我们建议G2/M的同步效率至少为整个细胞群的50%。 - 第四天。有丝分裂细胞的诺考达唑冲洗和FRET/FLIM成像
- 用移液管取出培养基,并用预热的无菌PBS代替。如果可能,避免光照。轻轻摇动盘子。
- 重复洗涤过程,始终避免光照。
- 取出第二次PBS洗涤剂,并用预热的无菌Leibovitz L-15培养基代替,补充20%胎牛血清(FBS)和1%青霉素 - 链霉素(从这里开始, 成像培养基)。
注:应购买不含 pH 指示剂(例如酚红)和核黄素等培养基成分的成像培养基。这些物质是自发荧光的来源,可能会扰乱寿命值。 - 继续进行FRET / FLIM成像。尽量减少温度的快速变化,并尽快进行成像步骤(步骤3)。在将样品运送到显微镜设置时,请考虑保护样品免受光线照射(即,将其包裹在铝箔中或将其放入盒子中)。
3. FRET/FLIM收购
注:该协议中的FRET/FLIM采集是在定制设置上执行的,如35中所述,并配备了与15,17中所示的控制解决方案(图2)。该装置现在由Inscoper商业化,它由带有用于脉冲激发的白色激光的旋转盘显微镜和相机前的高速率时间门控增强器制成。在 10 ns 的时间窗口中,2 ns 的时间门依次用于获得包含 5 个时间门控图像的堆栈。然后,这些图像用于根据以下等式逐个像素计算平均荧光寿命:τ = ΣΔti • Ιi/ΣΙi,其中Δti对应于第i个门的延迟时间,而I表示逐个像素的时间门控强度图像35,36.这种方法确保了快速的FLIM测量:不需要拟合或分档步骤,并且可以在在线模式下以最小的光子预算计算寿命。该系统还提供了一个用户友好的软件界面。但是,可以在配备FLIM测量的任何其他商业显微镜设置下进行相同的实验。
- 为了确保细胞从G2 / M块最佳释放到有丝分裂中,请在37°C下进行实验。 如果可能,使用配备恒温室的显微镜装置进行FRET / FLIM实验。
- 在实验前至少30分钟至1小时打开显微镜的恒温室。
- 打开激光器、相机、显微镜设置和成像软件(图2)。
- 为供体荧光团选择适当的激发和发射波长。方便的波长选项是:mTurquoise2的λex 440/10 nm和λem 483/35 nm(图3A);GFP的λex 488/10 nm和λem 525/50 nm)(图3B)。
- 设置曝光时间,通常在30到100毫秒之间(图3)。请注意,过多的激光功率可能会导致光漂白等诱导的光毒性效应,从而改变荧光寿命37。在设置中,通过在延时采集期间监测第一栅极的荧光强度来验证不存在光漂白事件。如果可以观察到荧光强度的变化,请放弃采集并调整激光功率。
注意:在此处的设置中,选择允许在第一个门中至少3000个灰度级别的曝光时间;否则,软件将不会计算捐赠者的寿命。此灰度级别值对应于获得相关寿命值所需的最小光子预算。 - 在启动FRET / FLIM采集之前,通过等待双极纺锤体出现(在U2OS细胞中约为20/30分钟)来确保细胞已进入有丝分裂。由于有丝分裂AURKA主要定位于该结构上,因此通过直接在显微镜下用外部光源筛选细胞中纺锤体的形成来验证有丝分裂进展(图1)。请注意,有丝分裂进展所需的时间可能因所使用的细胞系而异。
- 如果计划用MLN8237处理,将细胞置于显微镜下并使其达到中期(诺考达唑冲洗后约20分钟)。将溶解在DMSO中的250 nM MLN8237加入到表达仅供体构建体的细胞和表达生物传感器的细胞中。
- 在如上所述转染的细胞上控制这种情况,并用等体积的DMSO孵育。为了获得更好的AURKA抑制,在DMSO中制备一次性使用MLN8237等分试样,将其储存在-80°C。 通过将等分试样放在冰上解冻它们,并在使用后丢弃它们。
- 孵育10分钟。在此之后,有丝分裂纺锤体将收缩,只剩下一个强烈的点。当使用K162M突变体时观察到类似的表型。
- 为了获得更好的有丝分裂纺锤体分辨率,请使用至少63x物镜(图3)。
- 一旦发现中期细胞(参见 图4 作为中期细胞的示例),调整 xyz 坐标以将其放置在视野的中心。
- 要获得更快的图像,请选择一个 z 平面。选择有丝分裂纺锤体更明显或更强烈的平面。
- 开始录制。采集时间可能因所使用的FLIM设置而异(从几秒到几分钟)。市场上的大多数商业设置都将详细阐述荧光显微照片和逐像素寿命图。保存两个图像。
- 从每个转染和/或治疗条件中获取至少10张独立图像。
4. Δ寿命的计算和供体/受体对之间FLIM值的比较
- 从整个逐个像素的生命周期图(即整个有丝分裂纺锤体)中提取生命周期值,或选择与特定子分区相对应的感兴趣区域 (ROI)。
注:根据所使用的FRET/FLIM设置,寿命计算可以直接在采集软件上进行,也可以使用通用图像处理解决方案(例如,Fiji/ImageJ:https://fiji.sc/)提取。直接计算寿命值的软件(也称为 在线模式)提供了一种更加用户友好的解决方案,适用于初学者和不完全熟悉FRET / FLIM的显微镜用户。相反,在获得后提取寿命值通常需要一个合适的程序。对于初学者来说,此选项不太容易获得,因为需要一些先前关于拟合数学模型的知识。 - 一旦可视化或提取,计算表达"仅供体"载体(例如,AURKA-mTurquoise2)的细胞的平均寿命,从而计算供体寿命。
- 从平均供体寿命中减去在步骤 4.1 中计算的每个独立生存期值。在分析的所有条件下对所有细胞重复此步骤将给出每个条件的Δ寿命。
- 比较"仅供体"、"生物传感器"和"K162M"或DMSO和MLN8237条件的Δ寿命值。
注意:对于"仅供体"条件,ΔLifetime应导致值接近于零,并且对应于寿命值的实验波动。对于"生物传感器"条件,Δ寿命值应产生两个构造之间的净差(参见 图4 的图示示例)。 - 比较不同供体/受体对之间的Δ寿命值。
- 比较"生物传感器"条件:它们是否显示相似的ΔLifetime?
- "K162M"或MLN8237条件是否显示相似的ΔLifetime?他们的ΔLifetime是否类似于"仅限捐赠者"的条件?
结果
我们按照上述程序使用两个具有不同光谱性质的生物传感器记录Thr288上AURKA的自磷酸化。我们将最初的GFP-AURKa-mCherry探针14 与两个具有不同光谱特性的生物传感器进行了比较。这两种探针在一种情况下依赖于荧光供体mTurquoise2和非荧光受体(ShadowG),或者在第二种情况下依赖于黄色受体(superYFP)。然后,我们在每个供体/受体对中插入AURKA的完整长度序列。为了对AURKA激活进行阴性控制,可以采用两种策略。首先,使用小的ATP类似物(MLN8237)会干扰ATP在激酶动力学口袋中的结合并阻止其激活38。其次,Lys162突变为Met(K162M),产生每个生物传感器的激酶死亡版本,无法激活14,15,39。这种突变诱导通常在Lys162和Glu181之间建立的盐桥的破坏,这导致激酶动力学口袋的稳定打开并触发其整体失活40。作为FRET的阴性对照,我们使用无受体结构(GFP-AURKA或AURKA-mTurquoise2)。
在同步G2 / M中的细胞并将其释放到有丝分裂中后,我们测量了有丝分裂纺锤体上所有转染构建体的寿命(图4)。值得注意的是,这种结构被视为一个整体,并且没有分析主轴内的投资回报率。然后,我们计算了所有条件的Δ寿命。正如预期的那样,GFP-AURKA或AURKA-mTurquoise2("仅供体"条件)的寿命接近于0,表明这些结构的测量值围绕平均值波动(图4A,4B)。相反,GFP-AURKA-mCherry的ΔLifetime值与仅供体条件的ΔLifetime值在统计学上不同,ΔLifetime增加约130 ps(图4A)。对hadowG-AURKA-mTurquoise2和superYFP-AURKA-mTurquoise2进行了类似的观察,ΔLifetime分别比仅供体条件增加约150和~220 ps(图4B,4C)。这些数据可以通过伪彩色查找表(LUT)在单个单元格中轻松可视化。在这种情况下,ΔLifetime 的值在 0 附近是伪彩色黄色,而更显著的差异是伪彩色的红色/紫色。事实上,在表达仅供体构建体的细胞中,逐像素的LUT更接近黄色,而在表达任何一种生物传感器的细胞中,它更倾向于红色/紫色光谱(图4A,4B)。当用药理抑制剂MLN8237处理GFP-AURKA-mCherry生物传感器时,也观察到了这一点。
然后,我们分析了激酶死亡生物传感器的Δ寿命。这些结构显示出中间Δ寿命值:与仅供体条件相比,Δ寿命显着更高(图4B,4C),但也明显低于正常对应物(图4B,4D)。与用MLN8237或表达激酶死亡的生物传感器处理的细胞进行比较是必要的,以估计每个供体/受体对的ΔLifetime变异是否仅与AURKA的激活有关。在GFP-AURKA-mCherry的情况下,当使用AURKA特异性抑制剂时,ΔLifetime变异被废除。相反,ΔLifetime变化主要(但不完全)与shadowG-AURKA-mTurquoise2和superYFP-AURKA-mTurquoise2情况下的AURKA激活有关。
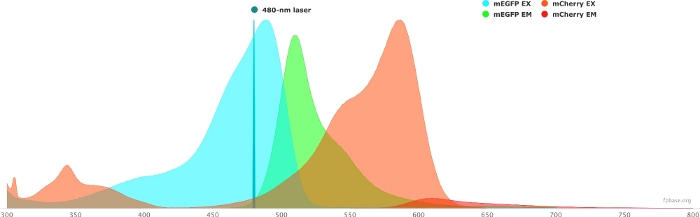
图1:GFP(供体)和mCherry(受体)激发和发射光谱。
光谱是从FP基础网站(https://www.fpbase.org/)获得和改编的,并调整为480nm激光激发。 请点击此处查看此图的放大版本。

图 2:实验工作区的图像。
(1)控制解决方案;(2)白光激光源;(3)CCD摄像机;(4)显微镜设置;(5)外部光源/灯,用于样品的眼部筛查。 请点击此处查看此图的放大版本。
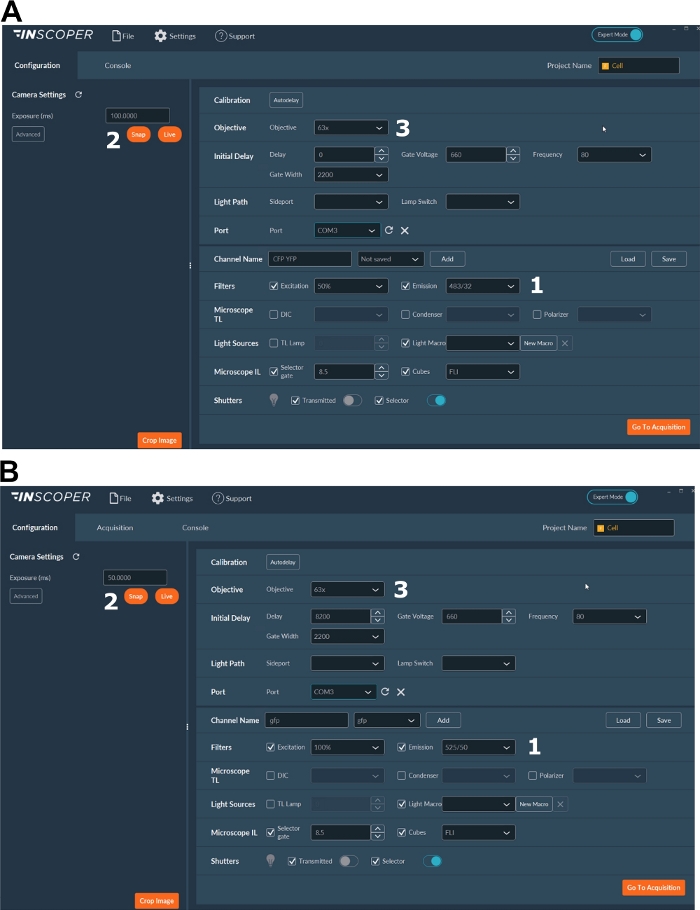
图 3:用于 FLIM 采集的软件的代表性图像。
(A、 B)(1)供体的激励和发射参数( A中的CFP,或 B中的GFP);(2)曝光时间;(3)物镜的选择。 请点击此处查看此图的放大版本。
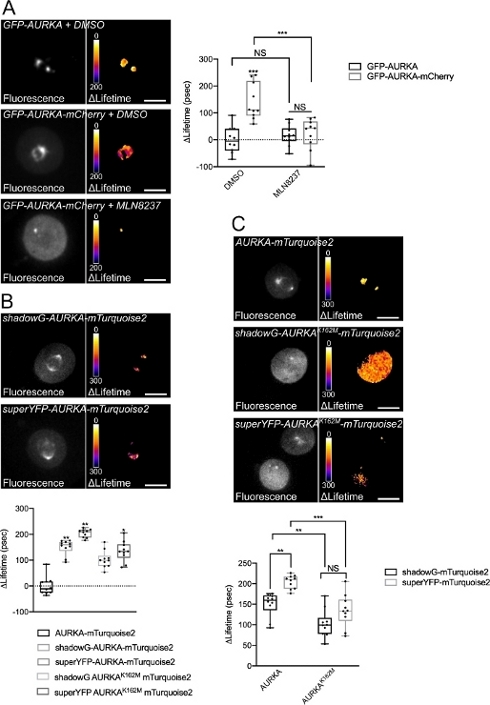
图4:AURKA FRET生物传感器及其阴性对照的代表性图像。
(A)(显微照片)表达GFP-AURKA或GFP-AURKA-mCherry的U2OS细胞的荧光(绿色通道)和相应的逐像素ΔLifetime(仅限供体 - 生物传感器),在G2 / M处同步,释放直到双极纺锤体可见,然后用DMSO或MLN8237处理。ΔLifetime 用伪彩色刻度("Fire"查找表)进行说明。(图表)对指示的条件进行相应的定量和双向方差分析。(B)(显微照片)表达hadowG-AURKA-mTurquoise2(上图)或superYFP-AURKA-mTurquoise2(下图)的U2OS细胞的荧光(青色通道)和相应的逐像素Δ寿命(仅限供体 - 生物传感器),在G2 / M处同步并释放直到双极纺锤体可见。ΔLifetime 用伪彩色刻度("Fire"查找表)进行说明。(图表)对上述显微照片中表示的条件进行相应的定量和单因素方差分析。(C) (显微照片) AURKA-mTurquoise2(上图)、shadowG-AURKA K162M-mTurquoise2(中图)和superYFP-AURKA K162M-mTurquoise2的图像,并像在显微照片中一样表示。(图表)指示转染条件的双向方差分析。箱线图中的条形表示中位数;晶须从最小延伸到最大值, n = 10个细胞,每个条件为一个代表性实验(3个)。单个值表示为点。比例尺:10 μm. *P < 0.05,**P < 0.01,***P < 0.001,针对 (A) 中"AURKA-mTurquoise2"条件中的每个指示条件,以及 (C) 中的每个指示条件。NS:不重要。 请点击此处查看此图的放大版本。
讨论
基因编码的FRET生物传感器是测量单个蛋白质或整个信号通路活化的可靠工具41。特别是,AURKA FRET生物传感器构成了探索激酶在时间和空间上的激活的优先方式。然而,在设计或优化FRET生物传感器时,某些元素值得特别注意,不仅在一般方面,而且更具体地说是AURKA。
首先,供体/受体FRET对的性质和相对位置可以适应该激酶的特定功能。在有丝分裂期间,AURKA在有丝分裂纺锤体上富集,但它存在于整个细胞周期和不同的亚细胞位置(例如,中心体,细胞核和线粒体)1,2。如果生物传感器要用于特定的隔室,如线粒体,其可以达到酸性pH值,则应选择pH不敏感的供体 - 受体FRET对作为mTurquoise2 / shadowG。此外,将FRET供体放置在C端可以更好地可视化该亚细胞室的生物传感器,并且鉴于AURKA N-末端被证明在线粒体处部分分裂,甚至可能优化FRET检测16,42。
其次,优化AURKA FRET生物传感器的一种尚未探索的方法将需要更仔细地设计全长AURKA和供体/受体对之间的连接子。不仅荧光对之间的距离,而且接头本身的性质也被证明是提高FRET效率的关键因素43,44,45,46。有鉴于此,增加连接器的刚性或柔韧性可能会损害FRET效率,或进一步提高其效率。
第三,已知AURKA的过表达会在相当大比例的细胞中诱导有丝分裂纺锤体异常2。比较通过在巨细胞病毒(CMV)等强启动子(哺乳动物表达载体中最常见的启动子之一)或AURKA最小启动子序列(CTTCCGG)下表达相同的FRET构建体获得的ΔLifetime会很有趣。该启动子先前被证明可以挽救激酶敲低后产生的单极或多极纺锤体,并且其使用本身不会诱导细胞周期扰动14,47。虽然FLIM对细胞中的蛋白质表达水平和相对浓度11不敏感,但在同一生物传感器设置上对两个启动子进行彻底比较将扩大对任何给定位置的活化AURKA池的理解。此外,它还将提供关于AURKA激活如何在过度表达时发生变化的新见解,这与上皮癌和血液学癌症范式有关。
最后,还应考虑下游的FRET应用。AURKA领域的未来前景是将激酶构象生物传感器与基于底物的生物传感器累积起来。同时分析两个生物传感器的FRET行为 - 这一过程称为多重FRET - 需要第一个生物传感器上的暗受体,以避免光谱在第二个供体通道中渗出。在AURKA的背景下,这将开辟令人兴奋的新视角,即用第一个生物传感器检测激酶的活化,以及第二个生物传感器对给定底物的酶活性。多路复用的最新发展现在允许一次累积多达三个生物传感器48。在AURKA的背景下应用类似的方法可能代表了一种非常有前途的策略,不仅可以测试激酶的激活 - 活性相互作用,还可以探索具有前所未有的时空分辨率的AURKA信号级联。
总之,FRET/FLIM是加深蛋白质活性知识的便捷方法。一方面,由于至少一个荧光部分,它允许可视化活细胞中给定蛋白质的定位。另一方面,它可以解开蛋白质构象变化,这可能为蛋白质活化和/或活性提供信息。因此,FRET / FLIM和构象FRET生物传感器有可能成为追踪活细胞信号通路的广泛方法,并具有精确的时空分辨率。
披露声明
G.B.进行了实验,撰写和审查了手稿,并提供了资金,M.T.审查了手稿并提供了支持。M.T. 是 Inscoper 公司(法国)的科学顾问和股东,该公司为本手稿中所示的快速 FLIM 测量提供解决方案。Inscoper部分支持手稿的开放获取出版。Inscoper没有参与实验设计,数据处理,也没有参与手稿的撰写。
致谢
我们感谢显微镜-雷恩成像中心(法国雷恩市BIOSIT的MRic,BIOSIT)的工程师们的建议和帮助,特别是X. Pinson对手稿的批判性阅读。MRic是法国国家研究机构(ANR-10-INBS-04)支持的国家基础设施法国生物成像的成员。这项工作得到了 国家科学研究中心 (CNRS)、国际癌症委员会、 盔甲和金融科学研究所以及癌症研究 协会(ARC) 对G.B的支持。
材料
| Name | Company | Catalog Number | Comments |
| Alisertib (MLN8237) | SelleckChem | S1133 | Use at a 250 nM final dilution |
| Dulbecco's Modified Eagle Medium (DMEM) | ThermoFischer Scientific Brand: Gibco | 41966052 | High glucose + L-glutamine + Sodium pyruvate |
| Fetal Bovine Serum (FBS) | ThermoFischer Scientific Brand: Gibco | 10270106 | |
| L15 | ThermoFischer Scientific Brand: Gibco | 21083027 | Leibovitz's L15 medium + L-glutamine, no Phenol red |
| LabTek | Nunc | 2515380 | |
| Nocodazole | Merck Brand: Sigma-Aldrich | M1404 | Use at a 100 ng/mL final dilution |
| Penicillin/Streptomycin | ThermoFischer Scientific Brand: Gibco | 15140122 | Penicillin-Streptomycin 10,000 U/mL (100x) |
| Phosphate Buffer Saline (PBS) | ThermoFischer Scientific Brand: Gibco | 14190169 | DPBS, no calcium, no magnesium |
| Trypsin/EDTA | ThermoFischer Scientific Brand: Gibco | 25300096 | Trypsin-EDTA 0.05%, Phenol Red (1x) |
参考文献
- Bertolin, G., Tramier, M. Insights into the non-mitotic functions of Aurora kinase A: more than just cell division. Cellular and Molecular Life Sciences. , (2019).
- Nikonova, A. S., Astsaturov, I., Serebriiskii, I. G., Dunbrack, R. L., Golemis, E. A. Aurora A kinase (AURKA) in normal and pathological cell division. Cellular and Molecular Life Sciences. 70 (4), 661-687 (2013).
- Walter, A. O., Seghezzi, W., Korver, W., Sheung, J., Lees, E. The mitotic serine/threonine kinase Aurora2/AIK is regulated by phosphorylation and degradation. Oncogene. 19 (42), 4906-4916 (2000).
- Cheetham, G. M. T. Crystal Structure of Aurora-2, an Oncogenic Serine/Threonine Kinase. Journal of Biological Chemistry. 277 (45), 42419-42422 (2002).
- Bayliss, R., Sardon, T., Vernos, I., Conti, E. Structural basis of Aurora-A activation by TPX2 at the mitotic spindle. Molecular Cell. 12 (4), 851-862 (2003).
- Zhang, Y., et al. Identification of the auto-inhibitory domains of Aurora-A kinase. Biochemical and Biophysical Research Communications. 357 (2), 347-352 (2007).
- Littlepage, L. E., Wu, H., Andresson, T., Deanehan, J. K., Amundadottir, L. T., Ruderman, J. V. Identification of phosphorylated residues that affect the activity of the mitotic kinase Aurora-A. Proceedings of the National Academy of Sciences of the United States of America. 99 (24), 15440-15445 (2002).
- Kufer, T. A., et al. Human TPX2 is required for targeting Aurora-A kinase to the spindle. The Journal of Cell Biology. 158 (4), 617-623 (2002).
- Eyers, P. A., Erikson, E., Chen, L. G., Maller, J. L. A novel mechanism for activation of the protein kinase Aurora A. Current Biology. 13 (8), 691-697 (2003).
- Brunet, S., et al. Characterization of the TPX2 Domains Involved in Microtubule Nucleation and Spindle Assembly in Xenopus Egg Extracts. Molecular Biology of the Cell. 15 (12), 5318-5328 (2004).
- Padilla-Parra, S., Tramier, M. FRET microscopy in the living cell: Different approaches, strengths and weaknesses. BioEssays. 34 (5), 369-376 (2012).
- Aoki, K., Kamioka, Y., Matsuda, M. Fluorescence resonance energy transfer imaging of cell signaling from in vitro to in vivo: Basis of biosensor construction, live imaging, and image processing. Development, Growth & Differentiation. 55 (4), 515-522 (2013).
- Fuller, B. G., et al. Midzone activation of aurora B in anaphase produces an intracellular phosphorylation gradient. Nature. 453 (7198), 1132-1136 (2008).
- Bertolin, G., et al. A FRET biosensor reveals spatiotemporal activation and functions of aurora kinase A in living cells. Nature Communications. 7, 12674 (2016).
- Bertolin, G., et al. Optimized FRET Pairs and Quantification Approaches To Detect the Activation of Aurora Kinase A at Mitosis. ACS Sensors. 4 (8), 2018-2027 (2019).
- Bertolin, G., et al. Aurora kinase A localises to mitochondria to control organelle dynamics and energy production. eLife. 7, (2018).
- Sizaire, F., Le Marchand, G., Pécréaux, J., Bouchareb, O., Tramier, M. Automated screening of AURKA activity based on a genetically encoded FRET biosensor using fluorescence lifetime imaging microscopy. Methods and Applications in Fluorescence. 8 (2), 024006 (2020).
- Demeautis, C., et al. Multiplexing PKA and ERK1&2 kinases FRET biosensors in living cells using single excitation wavelength dual colour FLIM. Scientific Reports. 7, 41026 (2017).
- Ringer, P., et al. Multiplexing molecular tension sensors reveals piconewton force gradient across talin-1. Nature Methods. 14 (11), 1090-1096 (2017).
- Nagai, T., Yamada, S., Tominaga, T., Ichikawa, M., Miyawaki, A. Expanded dynamic range of fluorescent indicators for Ca(2+) by circularly permuted yellow fluorescent proteins. Proceedings of the National Academy of Sciences of the United States of America. 101 (29), 10554-10559 (2004).
- Klarenbeek, J., Goedhart, J., van Batenburg, A., Groenewald, D., Jalink, K. Fourth-Generation Epac-Based FRET Sensors for cAMP Feature Exceptional Brightness, Photostability and Dynamic Range: Characterization of Dedicated Sensors for FLIM, for Ratiometry and with High Affinity. PLOS ONE. 10 (4), 0122513 (2015).
- Fritz, R. D., et al. A Versatile Toolkit to Produce Sensitive FRET Biosensors to Visualize Signaling in Time and Space. Science Signaling. 6 (285), (2013).
- Mastop, M., et al. Characterization of a spectrally diverse set of fluorescent proteins as FRET acceptors for mTurquoise2. Scientific Reports. 7 (1), 11999 (2017).
- vander Krogt, G. N. M., Ogink, J., Ponsioen, B., Jalink, K. A Comparison of Donor-Acceptor Pairs for Genetically Encoded FRET Sensors: Application to the Epac cAMP Sensor as an Example. PLoS ONE. 3 (4), 1916 (2008).
- Cranfill, P. J., et al. Quantitative assessment of fluorescent proteins. Nature Methods. 13 (7), 557-562 (2016).
- Goedhart, J., et al. Structure-guided evolution of cyan fluorescent proteins towards a quantum yield of 93. Nature Communications. 3 (1), (2012).
- Mérola, F., et al. Newly engineered cyan fluorescent proteins with enhanced performances for live cell FRET imaging. Biotechnology Journal. 9 (2), 180-191 (2014).
- Erard, M., et al. Minimum set of mutations needed to optimize cyan fluorescent proteins for live cell imaging. Molecular BioSystems. 9 (2), 258-267 (2013).
- Tramier, M., Zahid, M., Mevel, J. C., Masse, M. J., Coppey-Moisan, M. Sensitivity of CFP/YFP and GFP/mCherry pairs to donor photobleaching on FRET determination by fluorescence lifetime imaging microscopy in living cells. Microscopy Research and Technique. 69 (11), 933-939 (2006).
- Padilla-Parra, S., et al. Quantitative Comparison of Different Fluorescent Protein Couples for Fast FRET-FLIM Acquisition. Biophysical Journal. 97 (8), 2368-2376 (2009).
- Burgstaller, S., et al. pH-Lemon, a Fluorescent Protein-Based pH Reporter for Acidic Compartments. ACS Sensors. , (2019).
- Bindels, D. S., et al. mScarlet: a bright monomeric red fluorescent protein for cellular imaging. Nature Methods. 14 (1), 53-56 (2016).
- Murakoshi, H., Shibata, A. C. E., Nakahata, Y., Nabekura, J. A dark green fluorescent protein as an acceptor for measurement of Förster resonance energy transfer. Scientific Reports. 5, 15334 (2015).
- Murakoshi, H., Shibata, A. C. E. ShadowY: a dark yellow fluorescent protein for FLIM-based FRET measurement. Scientific Reports. 7 (1), 6791 (2017).
- Leray, A., Padilla-Parra, S., Roul, J., Héliot, L., Tramier, M. Spatio-Temporal Quantification of FRET in living cells by fast time-domain FLIM: a comparative study of non-fitting methods [corrected]. PloS One. 8 (7), 69335 (2013).
- Padilla-Parra, S., Audugé, N., Coppey-Moisan, M., Tramier, M. Quantitative FRET analysis by fast acquisition time domain FLIM at high spatial resolution in living cells. Biophysical Journal. 95 (6), 2976-2988 (2008).
- Song, L., Hennink, E. J., Young, I. T., Tanke, H. J. Photobleaching kinetics of fluorescein in quantitative fluorescence microscopy. Biophysical Journal. 68 (6), 2588-2600 (1995).
- Manfredi, M. G., et al. Characterization of Alisertib (MLN8237), an investigational small-molecule inhibitor of aurora A kinase using novel in vivo pharmacodynamic assays. Clinical Cancer Research: An Official Journal of the American Association for Cancer Research. 17 (24), 7614-7624 (2011).
- Katayama, H., et al. Phosphorylation by aurora kinase A induces Mdm2-mediated destabilization and inhibition of p53. Nature Genetics. 36 (1), 55-62 (2004).
- Nowakowski, J., et al. Structures of the Cancer-Related Aurora-A, FAK, and EphA2 Protein Kinases from Nanovolume Crystallography. Structure. 10 (12), 1659-1667 (2002).
- Palmer, A. E., Qin, Y., Park, J. G., McCombs, J. E. Design and application of genetically encoded biosensors. Trends in Biotechnology. 29 (3), 144-152 (2011).
- Grant, R., et al. Constitutive regulation of mitochondrial morphology by Aurora A kinase depends on a predicted cryptic targeting sequence at the N-terminus. Open Biology. 8 (6), 170272 (2018).
- Shimozono, S., Miyawaki, A. Engineering FRET Constructs Using CFP and YFP. Methods in Cell Biology. 85, 381-393 (2008).
- Komatsu, N., et al. Development of an optimized backbone of FRET biosensors for kinases and GTPases. Molecular Biology of the Cell. 22 (23), 4647-4656 (2011).
- Schifferer, M., Griesbeck, O. A Dynamic FRET Reporter of Gene Expression Improved by Functional Screening. Journal of the American Chemical Society. 134 (37), 15185-15188 (2012).
- Peroza, E. A., Boumezbeur, A. H., Zamboni, N. Rapid, randomized development of genetically encoded FRET sensors for small molecules. Analyst. 140 (13), 4540-4548 (2015).
- Reboutier, D., et al. Aurora A is involved in central spindle assembly through phosphorylation of Ser 19 in P150Glued. The Journal of Cell Biology. 201 (1), 65-79 (2013).
- Mo, G. C. H., Posner, C., Rodriguez, E. A., Sun, T., Zhang, J. A rationally enhanced red fluorescent protein expands the utility of FRET biosensors. Nature Communications. 11 (1), 1848 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。