Method Article
Мониторинг активации А аврора-киназы в режиме реального времени с использованием конформационных биосенсоров FRET в живых клетках
В этой статье
Резюме
Активация многофункциональной Ser/Thr киназы AURKA характеризуется ее автофосфорилированием на Thr288. Флуоресцентные зонды, полагающиеся на FRET, могут различать его неактивные и активированные состояния. Здесь мы иллюстрируем некоторые стратегии для разработки зондов вместе с быстрым протоколом FRET для отслеживания активации киназы на протяжении всего митоза.
Аннотация
Эпителиальный рак часто характеризуется гиперэкспрессией Ser/Thr киназы Aurora A/AURKA. AURKA - это многофункциональный белок, который активируется при его аутофосфорилировании на Thr288. Обилие AURKA достигает пика в митозе, где оно контролирует стабильность и точность митотического веретена, а также общую эффективность митоза. Несмотря на то, что он хорошо характеризуется на структурном уровне, последовательный мониторинг активации АУРКА на протяжении всего клеточного цикла отсутствует. Возможное решение заключается в использовании генетически закодированных биосенсоров резонансного переноса энергии (FRET) Фёрстера для получения представления об автофосфорилировании AURKA с достаточным пространственно-временным разрешением. Здесь мы описываем протокол разработки биосенсоров FRET, обнаруживающих автофосфорилирование Thr288, и как следить за этой модификацией во время митоза. Во-первых, мы предоставляем обзор возможных пар донор/акцептор FRET, а также показываем возможные методы клонирования и введения биосенсоров AURKA FRET в клетки млекопитающих. Затем мы предоставляем пошаговый анализ для быстрых измерений FRET с помощью флуоресцентной пожизненной визуализационной микроскопии (FLIM) на специально разработанной установке. Однако этот протокол также применим к альтернативным коммерческим решениям. В заключение мы рассмотрим наиболее подходящие элементы управления FRET для биосенсора на основе AURKA и выделим потенциальные будущие улучшения для дальнейшего повышения чувствительности этого инструмента.
Введение
Aurora kinase A/AURKA представляет собой многофункциональную серин/треонинкиназу, активную на протяжении всего клеточного цикла и в различных субклеточных компартментах1. Понимание его широкой пространственно-временной активации особенно важно при раке, поскольку AURKA часто чрезмерно экспрессируется при эпителиальных и гематологических злокачественных новообразованиях, при этом пациенты демонстрируют плохую реакцию на доступные в настоящее время методы лечения2.
Структурные исследования показали, что AURKA проходит два этапа для преобразования из неактивной киназы в активную. Во-первых, аутофосфорилирование Thr288 изменяет конформацию кинетического кармана киназы и активирует его3,4,5,6. Этот этап повышает каталитическую активность AURKA в клетках человека и в Xenopus laevis3,6,7, подготавливая киназу к полной активности. После активации взаимодействие AURKA с целевым белком для Xklp2 (TPX2) вызывает второе конформационное изменение5. Эта дальнейшая модификация позволяет AURKA достичь полной ферментативной активности по отношению к своим субстратам в клетке5,8,9,10.
В течение почти двух десятилетий понимание активации и активности AURKA было получено в основном с помощью комбинации биохимических подходов. К ним относятся обнаружение фосфорилированного Thr288 в клетках или in vivo в качестве отличительного признака активации AURKA, кристаллографический анализ и анализы in vitro или в целлюлокиназе для исследования активности AURKA1. Однако пространственно-временное разрешение этих подходов является плохим или отсутствует, и для расширения знаний о динамике этих двух событий необходимы новые решения.
Разработка флуоресцентных зондов в последние несколько лет облегчила мониторинг AURKA в живых клетках, что позволило следить за ее активацией с большим пространственно-временным разрешением. Наиболее специфические датчики для AURKA, разработанные до сих пор, основаны на принципе FRET (Резонансная передача энергии Фёрстера)11 для различения неактивных и активных AURKA. Первым разработанным датчиком был биосенсор на основе субстрата активности киназы AURKA. Биосенсоры на основе субстрата состоят из короткой аминокислотной последовательности, на которую нацелена данная киназа для фосфорилирования, и вставлены в пару донор/акцептор FRET и связующий домен, распознающий фосфорилированный остаток, что помогает сворачиванию биосенсора для эффективного процесса FRET12. В случае AURKA 14-аминокислотный фрагмент KIF2C, нацеленный фосфорилированием, был вставлен между парой донор/акцептор CFP-YFP13. Однако этот датчик имеет некоторые существенные недостатки. Во-первых, последовательность KIF2C, используемая в этом зонде, может быть нацелена как на AURKA, так и на тесно связанную киназу AURKB, тем самым уменьшая специфичность этого биосенсора. Во-вторых, датчик полагается на эндогенную киназу для фосфорилирования. Таким образом, эффективность FRET может быть неопределяемой или незначительной, если количества киназы являются ограничивающими (например, в субклеточных компартментах или фазах клеточного цикла). Чтобы преодолеть эти ограничения, был создан новый класс датчиков AURKA, известный как «конформационные датчики». В этих зондах полноразмерная последовательность AURKA была вставлена в донорский флуорофор на N-конце и акцепторный флуорофор на C-конце. Неактивная АУРКА представляет собой «открытую» конформацию, которая уводит N- и С-термины киназы друг от друга. При таком расстоянии между двумя конечными точками (> 10 нм) пара донор/акцептор находятся в неразрешительной конфигурации для FRET. Напротив, аутофосфорилированная AURKA принимает «закрытую» конформацию, с двумя белковыми терминами и двумя флуорофорами в непосредственной близости. Было показано, что это позволяет осуществлять FRET между донором и акцептором, который может быть измерен с использованием вариаций в жизни донора14,15. Такие зонды имеют ряд преимуществ. Во-первых, они генетически закодированы, и их можно использовать для замены эндогенной киназы в клетке. Во-вторых, они спасают фенотипы, индуцированные нокдауном AURKA, указывая на то, что они функциональны в клетке. В-третьих, они позволяют следить за активацией киназы в разных субклеточных компартментах и на протяжении всего клеточного цикла. Зонды обнаружили активацию AURKA в местах, где, как известно, активируется киназа (т.е. центросомы и митотическое веретено), а также участвовали в обнаружении активации AURKA в митохондриях16. Наконец, эти датчики позволили проводить скрининг с высоким содержанием на основе FRET/FLIM, где конформационные изменения AURKA использовались для идентификации новых фармакологических ингибиторов17.
В настоящей работе описана процедура визуализации активации AURKA в культивируемых клетках. Во-первых, мы сделаем представление о потенциальных парах флуорофоров для FRET. Выбор наиболее подходящей пары донор/акцептор будет сделан в соответствии с имеющейся установкой микроскопа или конкретным последующим применением в виде мультиплекса FRET18,19. Затем мы предлагаем конвейер для изучения поведения биосенсора (биосенсоров), выбранных в быстрой настройке микроскопа FRET / FLIM. Этот конвейер будет простираться от процедур клеточной культуры и синхронизации до сбора и анализа данных FLIM. Наконец, мы обсудим потенциальные преимущества этого протокола, поскольку аналогичная стратегия для проектирования биосенсоров может быть применена к другим киназам, а также может использоваться с другими системами визуализации на основе FRET.
протокол
ПРИМЕЧАНИЕ: Клетки U2OS, используемые в этом протоколе, были приобретены у American Type Culture Collection (ATCC, HTB-96), и они были протестированы без микоплазмы. Этапы 2.1-2.7 следует выполнять под ламинарной проточной вытяжкой, чтобы сохранить клетки и реагенты стерильными.
1. Выбор пары донор/акцептор FRET
- Обратитесь к литературе для выбора наиболее подходящих пар донор/акцептор FRET. Полезные примеры можно найти в 20,21,22,23,24, хотя окончательный выбор должен быть сделан в соответствии с характеристиками установки FRET/FLIM (доступные лазерные линии, фильтры и т.д.). Ниже приведены некоторые соображения о том, как выбрать пару донор/акцептор.
- Выбор донора: обратитесь к основанию FP (https://www.fpbase.org/) для получения полного набора информации о доступных флуоресцентных белках. Эта база данных постоянно пополняется всеми вновь разработанными флуорофорами.
- Обратитесь к базе данных флуоресцентных биосенсоров (https://biosensordb.ucsd.edu/index.php) для получения дополнительной информации о биосенсорах, уже доступных в литературе, вместе с соответствующими используемыми флуоресцентными белками.
- В качестве общей отправной точки выбирайте яркий донорский флуорофор. Хорошими кандидатами являются голубые флуоресцентные белки в виде mTFP1 или ECFP, или варианты GFP как EGFP или mEGFP.
- Олигомеры могут влиять на локализацию белка и/или функцию25. Рассмотрите возможность использования мономерных мутантов CFP как mTurquoise226 или Aquamarine27,28. Эти варианты также имеют хорошие квантовые коэффициенты выхода и вымирания, что делает их хорошими кандидатами в качестве доноров FRET.
- Отдавайте предпочтение флуоресцентным белкам (как донорским, так и акцепторам), нечувствительным к изменениям окружающей среды, таким как внутриклеточный рН23, или фотоотбеливанию25, так как эффективность FRET может сильно зависеть от этих параметров29. В настоящее время флуорофоры, такие как mTurquoise2 или mTFP1, широко используются в качестве доноров, благодаря их хорошей фотостабильности22,25,26.
- Выбор акцептора: голубые доноры часто сочетаются с вариантами желтого флуоресцентного белка (YFP), такими как mVenus, Citrine и YPet20,21,22,30. Однако следует отметить, что эти белки обладают гораздо большей чувствительностью к рН, и глобально демонстрируют плохую фотостабильность.
- Рассмотрите возможность использования недавно разработанных, нечувствительных к pH желтых вариантов YFP в качестве pH-Lemon31, зеленых флуорофоров в качестве mNeonGreen23 или красных флуорофоров в качестве mScarlet-I23,32 в качестве ранее проверенных флуоресцентных акцепторов для mTurquoise2.
- В качестве альтернативы, рассмотрите возможность использования нефлуоресцентных /темных производных YFP в качестве ShadowG33 или ShadowY34, которые, как было показано, ведут себя как хорошие акцепторы для голубо-флуоресцентных доноров в экспериментах FRET / FLIM.
- При использовании mEGFP в качестве донора рассмотрите возможность использования мономерных красных акцепторов в качестве mCherry.
- Проверьте спектральные свойства выбранной пары донор/акцептор с помощью инструментов, доступных на веб-сайте базы FP. Пример пары mEGFP/mCherry приведен на рисунке 1 .
- На базовом веб-сайте FP выберите раскрывающееся меню Инструменты и выберите Spectra viewer.
- В раскрывающихся меню введите название пары флуорофоров для визуализации (например, mEGFP и mCherry).
- Имитируйте свойства пары донор/акцептор с конкретным источником света, выбрав данный лазер в раскрывающемся меню. Кроме того, можно ввести определенную длину волны лазера, выбрав Добавить лазер. Нажмите на опцию Нормализовать излучение для этой опции, чтобы настроить спектры флуорофора на нужную длину волны. Здесь длина волны, используемая для возбуждения GFP, составляет 480 ± 10 нм.
- Клонируйте выбранную пару донор/акцептор, добавляя один флуорофор на N-конце полноразмерной последовательности AURKA и один на C-конце. Следуйте рекомендациям предпочтительного метода клонирования, чтобы вставить эту конструкцию в вектор выражения млекопитающих.
2. Клеточная культура, трансфекция и синхронизация
- ДЕНЬ 1. Подготовьте культуральную среду для клеток U2OS: используйте модифицированную орлиную среду Dulbecco (DMEM), дополненную 10% фетальной бычьей сывороткой (FBS), 1% пенициллин-стрептомицином и 1% L-глутамином (с этого момента , полная среда роста). В качестве альтернативы можно также использовать DMEM с предварительно добавленным L-глютамином.
- Если клетки заморожены, разморозьте флакон не менее чем за 8 дней до начала экспериментов (т.е. с точки 2,5).
- Выращивайте клетки в инкубаторе, предназначенном для клеточных культур млекопитающих при 37 °C и с 5% CO2. Регулярно очищайте и стерилизуйте инкубатор, чтобы избежать загрязнений.
- Когда клетки достигают ~80% слияния:
- Вымойте их ненадолго стерильным 1x фосфатным буферным физиологическим раствором (PBS) без Ca2+ и Mg2+.
- Трипсинизировать клетки стерильным 0,05% трипсина-ЭДТА по протоколу производителя и путем помещения клеток в инкубатор на 1-3 мин.
- Инактивировать трипсин, добавляя вдвое больший объем полной питательной среды; хорошо перемешать.
- Центрифугируют клеточную суспензию при 800 х г в течение 3-5 мин.
- Подсчитайте клетки с помощью гемоцитометра и рассчитайте соответствующее разбавление, чтобы они были на уровне ~ 70-80% слияния в камерных слайдах на следующий день. В качестве альтернативы могут также использоваться аналогичные опоры для визуализации живых клеток.
- Пипетируйте соответствующий объем клеток в выбранной поддержке визуализации живых клеток и поместите клетки обратно в инкубатор до следующего дня.
- ДЕНЬ 2. Приступайте к трансфекции. Следуйте рекомендациям предпочтительного метода (методов) транзиторной трансфекции для получения оптимальной эффективности трансфекции (~50/80%). Никакого конкретного метода трансфекции не требуется. Обратите внимание, что эффективность трансфекции может варьироваться в зависимости от используемой клеточной линии. Инкубировать в течение 48 ч.
ПРИМЕЧАНИЕ: Создание стабильных клонов, содержащих каждый из трех векторов, чтобы обойти необходимость переходных трансфекций. На этом этапе следует спланировать два типа контроля. Во-первых, требуется контроль «только для доноров», чтобы убедиться, что наличие полноразмерной AURKA не нарушает срок службы mTurquoise2 как таковой. Во-вторых, биосенсор, несущий мутацию, мертвую от киназы, должен использоваться в качестве отрицательного контроля, где FRET отменяется или значительно снижается. Альтернативно киназно-мертвому мутанту, химический ингибитор активации AURKA в качестве аналога АТФ MLN8237 может быть использован в качестве отрицательного контроля.- Заранее спланируйте три условия трансфекции, каждое из которых находится в независимом колодце:
Вектор «только донор» (например, AURKA-mTurquoise2)
"Биосенсор" (например, суперYFP-AURKA-mTurquoise2)
Биосенсор "K162M" (например, суперYFP-AURKA K162M-mTurquoise2) или, альтернативно, ингибитор активации AURKA (например, MLN8237) - Выполните три условия для сравнения каждой независимой пары донор/акцептор.
- Рассмотрите возможность удвоения числа трансфектированных скважин при сравнении несинхронизированных и G2/M-синхронизированных ячеек (см. шаг 2.6).
- Заранее спланируйте три условия трансфекции, каждое из которых находится в независимом колодце:
- ДЕНЬ 3. Синхронизируйте клетки в G2/M. Добавляйте 100 нг/мл нокодазола, растворенного в ДМСО, к каждому трансфектированному хорошо, избегая воздействия света, и инкубируйте в течение 16 ч (предпочтительно на ночь). При сравнении несинхронизированных и G2/M-синхронизированных клеток обрабатывайте каждое трансфекционное состояние нокодазолом или равным объемом ДМСО. Для лучшей эффективности синхронизации подготовьте одноразовые аликвоты нокодазола в ДМСО, храните их при -20 °C и выбрасывайте после использования.
ПРИМЕЧАНИЕ: Эффективность синхронизации ячеек может варьироваться в зависимости от клеточных линий. Оптимальная концентрация нокодазола и время его инкубации должны быть экспериментально определены методами проточной цитометрии до проведения экспериментов FRET/FLIM. Для статистически значимого анализа FRET/FLIM мы рекомендуем эффективность синхронизации в G2/M не менее 50% от общей популяции клеток. - ДЕНЬ 4. Вымывание нокодазола и визуализация FRET/FLIM на митотических клетках
- Удалите питательную среду пипеткой и замените ее предварительно подогретым, стерильным PBS. Избегайте воздействия света, если это возможно. Аккуратно покачивайте плиту.
- Повторяйте процедуру стирки, всегда избегая воздействия света.
- Удалите вторую промывку PBS и замените ее предварительно подогретой, стерильной средой Leibovitz L-15, дополненной 20% фетальной бычьей сывороткой (FBS) и 1% пенициллин-стрептомицином (с этого момента, среды визуализации).
ПРИМЕЧАНИЕ: Средства визуализации следует приобретать без показателей рН (например, фенол красный) и средних компонентов, таких как рибофлавин. Эти вещества являются источником автофлуоресценции, которая может нарушить значения времени жизни. - Приступайте к визуализации FRET/FLIM. Сведите к минимуму быстрые изменения температуры и приступайте к этапу визуализации (шаг 3) как можно быстрее. Рассмотрите возможность защиты образца от света при транспортировке его в микроскоп (т. Е. Обернув его в алюминиевую фольгу или поместив в коробку).
3. Приобретение FRET/FLIM
ПРИМЕЧАНИЕ: Приобретения FRET/FLIM в этом протоколе выполнялись на индивидуальной установке, описанной в 35 и оснащенной управляющим решением, как в 15,17 (рисунок 2). Установка в настоящее время коммерциализирована Inscoper и сделана из вращающегося дискового микроскопа с белым лазером для импульсного возбуждения и высокоскоростного усилителя времени перед камерой. Временные затворы 2 нс во временном окне 10 нс последовательно используются для получения стека из пяти временных изображений. Эти изображения затем используются для расчета среднепиксельного времени жизни флуоресценции в соответствии со следующим уравнением: τ = ΣΔti • Ιi/ΣΙi, где Δti соответствует времени задержки i-го затвора, в то время как i указывает попиксельное изображение интенсивности с ограничением по времени35,36 . Этот метод обеспечивает быстрые измерения FLIM: не требуется никаких этапов подгонки или биннинга, а срок службы может быть рассчитан в онлайн-режиме с минимальным бюджетом фотонов. Система также представляет собой удобный программный интерфейс. Тем не менее, тот же эксперимент может быть выполнен под любой другой коммерческой установкой микроскопа, оборудованной для измерений FLIM.
- Чтобы обеспечить оптимальное высвобождение клеток из блока G2/M в митоз, проводят эксперименты при 37 °C. Если возможно, проводите эксперименты FRET/FLIM с помощью микроскопов, оснащенных термостатической камерой.
- Включите термостатическую камеру микроскопа не менее чем за 30 мин до 1 ч до начала эксперимента.
- Включите лазер, камеру, настройку микроскопа и программное обеспечение для обработки изображений (рисунок 2).
- Выберите соответствующие длины волн возбуждения и излучения для донорского флуорофора. Удобные варианты длин волн: λex 440/10 нм и λem 483/35 нм для mTurquoise2 (рисунок 3A); λex 488/10 нм и λem 525/50 нм для GFP) (рисунок 3B).
- Установите время экспозиции, обычно от 30 до 100 мс (рисунок 3). Имейте в виду, что чрезмерная мощность лазера может привести к индуцированным фототоксическим эффектам, таким как фотоотбеливание, что, в свою очередь, может изменить время жизни флуоресценции37. На установке проверьте отсутствие событий фотоотбеливания, отслеживая интенсивность флуоресценции первого затвора во время покадровых захватов. Если наблюдаются изменения интенсивности флуоресценции, откажитесь от сбора и отрегулируйте мощность лазера.
ПРИМЕЧАНИЕ: В этой настройке выберите время экспозиции, допускающее не менее 3000 уровней серого в первых воротах; в противном случае программное обеспечение не будет рассчитывать срок службы донора. Это значение уровня серого соответствует минимальному бюджету фотона, необходимому для получения соответствующих значений срока службы. - Прежде чем запускать приобретения FRET / FLIM, убедитесь, что клетки вошли в митоз, дождавшись появления биполярного веретена (~ 20/30 мин в клетках U2OS). Поскольку митотическая АУРКА локализуется преимущественно по этой структуре, проверяют митотическую прогрессию путем скрининга образования веретена в клетках непосредственно под микроскопом, с внешним источником света (рисунок 1). Обратите внимание, что время, необходимое для митотической прогрессии, может варьироваться в зависимости от используемой клеточной линии.
- Если планируется лечение MLN8237, поместите клетки под микроскоп и дайте им достичь метафазы (около 20 мин после вымывания нокодазола). Добавьте 250 нМ MLN8237, растворенных в ДМСО, как к клеткам, экспрессирующим только донорскую конструкцию, так и к клеткам, экспрессирующим биосенсор.
- Контролируйте это состояние на трансфектированных клетках, как указано выше, и инкубируйте с равным объемом ДМСО. Для лучшего ингибирования АУРКИ приготовьте одноразовые аликвоты MLN8237 в ДМСО, храните их при -80 °C. Разморозьте их, поместив аликвоты на лед, и выбросьте их после использования.
- Инкубировать в течение 10 мин. После этого периода митотическое веретено будет сжиматься, и останется только одна интенсивная точка. Подобный фенотип наблюдается при использовании мутантов K162M.
- Для лучшего разрешения митотического шпинделя используйте, по крайней мере, объектив 63x (рисунок 3).
- После того, как ячейка найдена в метафазе (см. Рисунок 4 в качестве примера ячейки в метафазе), отрегулируйте координаты xyz , чтобы поместить ее в центр поля зрения.
- Для получения более быстрых изображений выберите одну единственную плоскость z . Выберите плоскость, где митотический шпиндель более заметен или интенсивен.
- Начните запись. Время получения может варьироваться в зависимости от используемой настройки FLIM (от нескольких секунд до мин). Большинство коммерческих установок, доступных на рынке, будут разрабатывать как флуоресцентную микрофотографию, так и попиксельную карту срока службы. Сохраните оба изображения.
- Получите не менее 10 независимых изображений от каждого состояния трансфекции и/или лечения.
4. Расчет ΔLifetime и сравнение значений FLIM среди пар донор/акцептор
- Извлеките значения времени жизни из всей попиксельной карты времени жизни (т. е. всего митотического шпинделя) или выберите интересующие области (ROI), соответствующие конкретным субрегионам.
ПРИМЕЧАНИЕ: В соответствии с используемой установкой FRET/FLIM расчеты срока службы могут выполняться непосредственно на программном обеспечении для сбора или извлекаться с помощью общих решений для обработки изображений (например, Fiji/ImageJ: https://fiji.sc/). Программное обеспечение для непосредственного расчета значений срока службы (также известное как онлайн-режим) предлагает более удобное решение, которое подходит для начинающих и для пользователей микроскопии, не полностью знакомых с FRET / FLIM. Напротив, извлечение жизненных ценностей после приобретения часто требует процедуры подгонки. Этот вариант менее доступен новичкам, так как необходимы некоторые предварительные знания по математическим моделям примерки. - После визуализации или извлечения рассчитайте среднее время жизни клеток, экспрессирующих вектор «только донор» (например, AURKA-mTurquoise2), то есть время жизни донора.
- Вычтите каждое независимое значение срока службы, рассчитанное на шаге 4.1, из среднего срока службы донора. Повторение этого шага для всех анализируемых клеток во всех проанализированных условиях даст ΔLifetime для каждого состояния.
- Сравните значения ΔLifetime для условий «только донор», «биосенсор» и «K162M» или условия DMSO и MLN8237.
ПРИМЕЧАНИЕ: Для условия "только донор" ΔLifetime должен приводить к значениям, близким к нулю и соответствующим экспериментальным флуктуациям значений времени жизни. Для условия "биосенсора" значения ΔLifetime должны давать чистую разницу между двумя конструкциями (см. рисунок 4 для проиллюстрированного примера). - Сравните значения ΔLifetime между различными парами донор/акцептор.
- Сравните условия «биосенсора»: показывают ли они сходство ΔLifetime?
- Показывают ли условия "K162M" или MLN8237 сходные условия ΔLifetime среди них? Похож ли их ΔLifetime на состояние «только донора»?
Результаты
Мы следовали описанной выше процедуре, чтобы записать автофосфорилирование AURKA на Thr288 с использованием двух биосенсоров с различными спектральными свойствами. Мы сравнили исходный зонд GFP-AURKa-mCherry14 с двумя биосенсорами с различными спектральными свойствами. Эти два зонда полагаются на флуоресцентный донор mTurquoise2 и на нефлуоресцентный акцептор (ShadowG) в одном случае или желтый акцептор (superYFP) во втором случае. Затем мы вставили полноразмерную последовательность AURKA в каждую пару донор/акцептор. Чтобы иметь отрицательный контроль над активацией AURKA, можно использовать две стратегии. Во-первых, использование небольшого АТФ-аналога (MLN8237) препятствует связыванию АТФ в кинетическом кармане киназы и препятствует ее активации38. Во-вторых, мутация Lys162 в Met (K162M) создает киназно-мертвую версию каждого биосенсора, неспособного активировать14,15,39. Эта мутация вызывает нарушение соляного моста, обычно устанавливаемого между Lys162 и Glu181, что приводит к стабильному открытию кинетического кармана киназы и вызывает ее общую инактивацию40. В качестве отрицательного контроля для FRET мы использовали конструкцию акцептора-лишенного (GFP-AURKA или AURKA-mTurquoise2).
После синхронизации клеток в G2/M и высвобождения их в митоз мы измерили время жизни всех трансфектных конструкций в митотическом веретне (рисунок 4). Следует отметить, что эта структура рассматривалась как единое целое, и никакие ROI внутри шпинделя не были проанализированы. Затем мы рассчитали ΔLifetime для всех условий. Как и ожидалось, срок службы GFP-AURKA или AURKA-mTurquoise2 (условия «только донор») был близок к 0, что указывает на то, что значения, измеренные для этих конструкций, колебались вокруг среднего значения (рисунок 4A,4B). И наоборот, значения ΔLifetime для GFP-AURKA-mCherry статистически отличались от состояния только донора, при этом ΔLifetime увеличивался на ~ 130 л.с. (рисунок 4A). Аналогичные наблюдения были сделаны для shadowG-AURKA-mTurquoise2 и для superYFP-AURKA-mTurquoise2, при этом ΔLifetime увеличивается на ~150 и ~220 ps от состояния только донора, соответственно (рисунок 4B,4C). Эти данные можно легко визуализировать в отдельных ячейках с помощью псевдоцветной таблицы подстановки (LUT). В этом случае значения ΔLifetime около 0 являются псевдоцветными желтыми, в то время как более существенными различиями являются псевдоцветные красный / фиолетовый. Действительно, попиксельный LUT был ближе к желтому в клетках, экспрессирующих только донорские конструкции, в то время как он был больше в красно-фиолетовом спектре в клетках, экспрессирующих любой биосенсор (рисунок 4A, 4B). Это также наблюдалось при лечении биосенсора GFP-AURKA-mCherry фармакологическим ингибитором MLN8237.
Затем мы проанализировали ΔLifetime киназно-мертвых биосенсоров. Эти конструкции показали промежуточные значения ΔLifetime: ΔLifetime был значительно выше по сравнению с условием донора (рисунок 4B,4C), но он также был значительно ниже, чем у их нормальных аналогов (рисунок 4B,4D). Сравнение с клетками, обработанными MLN8237 или экспрессирующими киназно-мертвыми биосенсорами, необходимо для оценки того, связаны ли вариации ΔLifetime для каждой пары донор/акцептор исключительно с активацией AURKA. В случае GFP-AURKA-mCherry вариации ΔLifetime отменяются при использовании ингибитора, специфичного для AURKA. И наоборот, вариации ΔLifetime в основном, но не исключительно, связаны с активацией AURKA в случае shadowG-AURKA-mTurquoise2 и superYFP-AURKA-mTurquoise2.
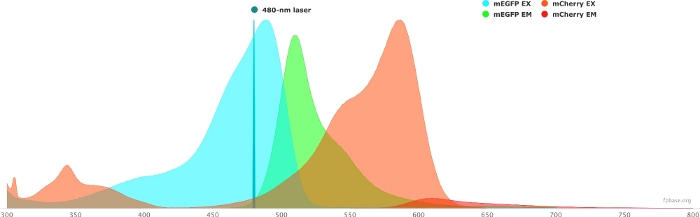
Рисунок 1: Спектры возбуждения и излучения GFP (донор) и mCherry (акцептор).
Спектры были получены и адаптированы с базового веб-сайта FP (https://www.fpbase.org/) и настроены на 480-нм лазерное возбуждение. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Изображение экспериментального рабочего пространства.
(1) Решение для контроля; (2) белый лазерный источник; (3) ПЗС-камера; (4) установка микроскопа; (5) внешний источник света/лампа для глазного скрининга образца. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
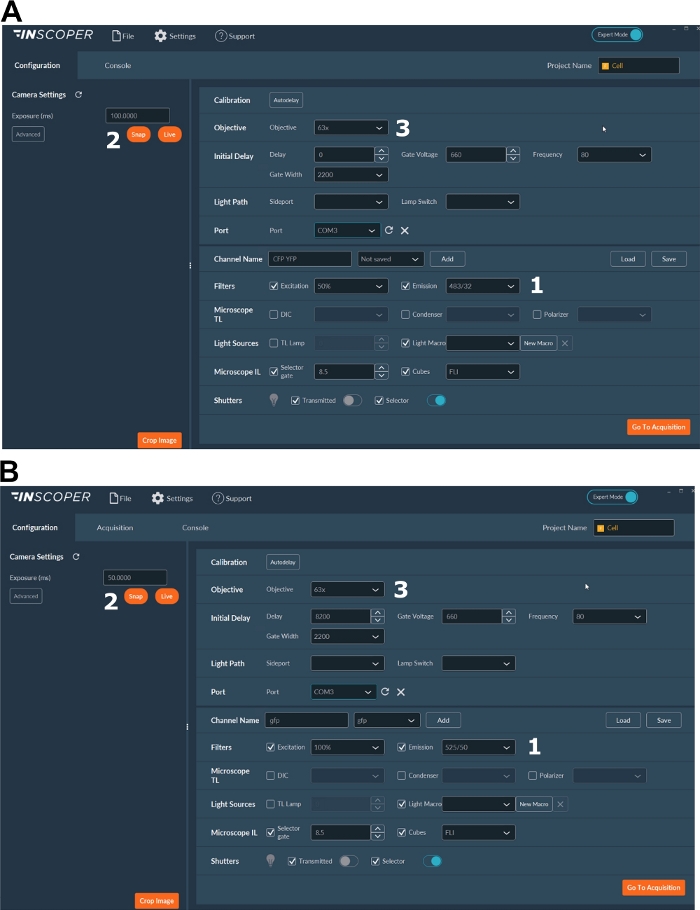
Рисунок 3: Репрезентативные изображения программного обеспечения для получения FLIM.
(А, Б) 1) параметры возбуждения и выбросов для донора (CFP в A или GFP в B); 2) время экспозиции; 3) выбор цели. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
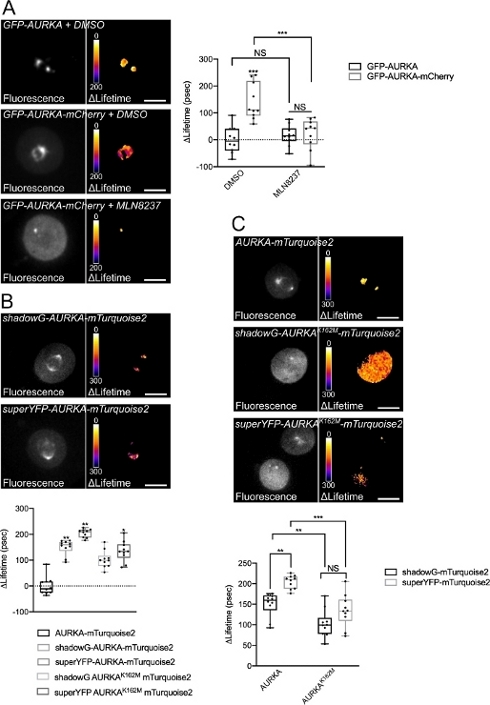
Рисунок 4: Репрезентативные изображения биосенсоров AURKA FRET и их отрицательных элементов управления.
(A) (Микроснимки) Флуоресценция (зеленый канал) и соответствующий попиксельный ΔLifetime (только донор – биосенсор) клеток U2OS, экспрессирующих GFP-AURKA или GFP-AURKA-mCherry, синхронизированных при G2/M, высвобождаемых до тех пор, пока биполярное веретено не будет видно, а затем обработанных DMSO или MLN8237. ΔLifetime иллюстрируется псевдоцветной шкалой (таблица подстановки "Огонь"). (График) Соответствующая количественная оценка и двусторонний анализ ANOVA для указанных условий. (B) (Микроснимки) Флуоресценция (голубой канал) и соответствующий попиксельный ΔLifetime (только донор – биосенсор) клеток U2OS, экспрессирующих теньG-AURKA-mTurquoise2 (верхняя панель) или superYFP-AURKA-mTurquoise2 (нижняя панель), синхронизируются при G2/M и высвобождаются до тех пор, пока не будет виден биполярный шпиндель. ΔLifetime иллюстрируется псевдоцветной шкалой (таблица подстановки "Огонь"). (График) Соответствующая количественная оценка и односторонний анализ ANOVA условий, представленных на вышеуказанных микроснимках. (C) (Микроснимки) Изображения AURKA-mTurquoise2 (верхняя панель), shadowG-AURKA K162M-mTurquoise2 (средняя панель) и superYFP-AURKA K162M-mTurquoise2 получены и представлены как на микроснимках. (График) Двусторонний анализ ANOVA для указанных условий трансфекции. Полоса в квадратах представляет медиану; усы простираются от min до max. n = 10 клеток на условие одного репрезентативного эксперимента (из трех). Отдельные значения представлены в виде точек. Шкала шкалы: 10 мкм. *P < 0,05, **P < 0,01, ***P < 0,001 против каждого указанного условия в (A) условии «AURKA-mTurquoise2» в (B) и против каждого указанного условия в (C). Н.С.: незначимый. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Генетически закодированные биосенсоры FRET являются надежными инструментами для измерения активации отдельных белков или целых сигнальных путей41. В частности, биосенсор AURKA FRET представляет собой предпочтительный способ исследования активации киназы во времени и пространстве. Однако некоторые элементы заслуживают особого внимания при проектировании или оптимизации биосенсора FRET не только в общих чертах, но и более конкретно для AURKA.
Во-первых, характер и относительное положение пары донор/акцептор FRET могут быть адаптированы под конкретные функции этой киназы. AURKA значительно обогащается в митотическом веретене во время митоза, но она присутствует на протяжении всего клеточного цикла и в разных субклеточных местах (например, центросомах, ядре и митохондриях)1,2. Если биосенсор должен использоваться в определенных отсеках, таких как митохондрии, которые могут достигать кислого рН, следует выбрать pH-нечувствительную к донору-акцептору freT пару mTurquoise2/shadowG. Более того, размещение донора FRET на C-конце может позволить лучше визуализировать биосенсор в этом субклеточном компартменте и потенциально даже оптимизировать обнаружение FRET, учитывая, что AURKA N-конец, как было показано, частично расщепляется в митохондриях16,42.
Во-вторых, еще не изученный способ оптимизации биосенсора AURKA FRET потребует более тщательного проектирования линкеров между полноразмерной AURKA и парой донор/акцептор. Было показано, что не только расстояние между флуоресцентной парой, но и свойства самого линкера являются ключевыми факторами повышения эффективности FRET43,44,45,46. В этом свете повышение жесткости или гибкости линкера может либо нанести ущерб эффективности FRET, либо еще больше улучшить ее.
В-третьих, известно, что сверхэкспрессия АУРКА вызывает митотические веретенообразные аномалии у значительной части клеток2. Было бы интересно сравнить ΔLifetime, полученный путем экспрессии той же конструкции FRET под сильным промотором, таким как цитомегаловирус (ЦМВ) - один из наиболее распространенных промоторов, обнаруженных в векторах экспрессии млекопитающих - или под последовательностью минимальных промоторов AURKA (CTTCCGG) 14,47. Ранее было показано, что этот промотор спасает монополярные или многополярные веретена, возникающие после сбития киназы, и его использование не вызывало возмущений клеточного цикла как такового14,47. Хотя FLIM нечувствителен к уровням экспрессии белка и относительным концентрациям в клетке11, получение выгоды от тщательного сравнения двух промоторов на одной и той же установке биосенсора расширит понимание пула активированной AURKA в любом заданном месте. Кроме того, это даст новое представление о том, как активация AURKA может измениться при гиперэкспрессии, что имеет отношение к парадигмам эпителиального и гематологического рака.
Наконец, следует также учитывать последующее применение FRET. Будущая перспектива в области AURKA будет заключаться в кумуляции конформационного биосенсора киназы с биосенсором на основе субстрата. Анализ поведения FRET двух биосенсоров одновременно - процесс, известный как мультиплексный FRET - требует темного акцептора на первом биосенсоре, чтобы избежать спектрального кровотечения во втором донорском канале. В контексте AURKA это открыло бы захватывающую новую перспективу обнаружения активации киназы с первым биосенсором и ее ферментативной активности по отношению к данному субстрату со вторым. Последние разработки в области мультиплексирования теперь позволяют накапливать до трех биосенсоров одновременно48. Применение аналогичного метода в контексте AURKA может представлять собой очень перспективную стратегию не только для тестирования взаимодействия активации-активности киназы, но и для изучения сигнальных каскадов AURKA с беспрецедентным пространственно-временным разрешением.
В заключение, FRET/FLIM является удобным способом углубления знаний об активности белка. С одной стороны, он позволяет визуализировать локализацию данного белка в живых клетках, благодаря хотя бы одному флуоресцентному фрагменту. С другой стороны, он может распутать конформационные изменения белка, которые могут быть информативными для активации и / или активности белка. Таким образом, биосенсоры FRET/FLIM и конформационные ФРЕТ могут стать широко распространенными методами следования сигнальным путям в живых клетках и с изысканным пространственно-временным разрешением.
Раскрытие информации
Г.B. проводил эксперименты, писал и рецензировал рукопись, а также предоставлял финансирование, М.Т. рецензировал рукопись и оказывал поддержку. М.Т. является научным консультантом и акционером компании Inscoper (Франция), которая производит решения для быстрых измерений FLIM, показанные в этой рукописи. Inscoper частично поддержал публикацию рукописи в открытом доступе. Inscoper не участвовал ни в экспериментальном проектировании, обработке данных, ни в написании рукописи.
Благодарности
Мы благодарим инженеров Центра визуализации Микроскопии-Ренна (MRic, BIOSIT, Ренн, Франция) за советы и помощь, и особенно X. Pinson за критическое прочтение рукописи. MRic является членом национальной инфраструктуры France-BioImaging при поддержке Французского национального исследовательского агентства (ANR-10-INBS-04). Эта работа была поддержана Национальным центром научных исследований (CNRS), Лигой по борьбе с раком, Комитетами по борьбе с раком, Бронетанковыми и финансовыми институтами и Ассоциацией по борьбе с раком (ARC) при G.B.
Материалы
| Name | Company | Catalog Number | Comments |
| Alisertib (MLN8237) | SelleckChem | S1133 | Use at a 250 nM final dilution |
| Dulbecco's Modified Eagle Medium (DMEM) | ThermoFischer Scientific Brand: Gibco | 41966052 | High glucose + L-glutamine + Sodium pyruvate |
| Fetal Bovine Serum (FBS) | ThermoFischer Scientific Brand: Gibco | 10270106 | |
| L15 | ThermoFischer Scientific Brand: Gibco | 21083027 | Leibovitz's L15 medium + L-glutamine, no Phenol red |
| LabTek | Nunc | 2515380 | |
| Nocodazole | Merck Brand: Sigma-Aldrich | M1404 | Use at a 100 ng/mL final dilution |
| Penicillin/Streptomycin | ThermoFischer Scientific Brand: Gibco | 15140122 | Penicillin-Streptomycin 10,000 U/mL (100x) |
| Phosphate Buffer Saline (PBS) | ThermoFischer Scientific Brand: Gibco | 14190169 | DPBS, no calcium, no magnesium |
| Trypsin/EDTA | ThermoFischer Scientific Brand: Gibco | 25300096 | Trypsin-EDTA 0.05%, Phenol Red (1x) |
Ссылки
- Bertolin, G., Tramier, M. Insights into the non-mitotic functions of Aurora kinase A: more than just cell division. Cellular and Molecular Life Sciences. , (2019).
- Nikonova, A. S., Astsaturov, I., Serebriiskii, I. G., Dunbrack, R. L., Golemis, E. A. Aurora A kinase (AURKA) in normal and pathological cell division. Cellular and Molecular Life Sciences. 70 (4), 661-687 (2013).
- Walter, A. O., Seghezzi, W., Korver, W., Sheung, J., Lees, E. The mitotic serine/threonine kinase Aurora2/AIK is regulated by phosphorylation and degradation. Oncogene. 19 (42), 4906-4916 (2000).
- Cheetham, G. M. T. Crystal Structure of Aurora-2, an Oncogenic Serine/Threonine Kinase. Journal of Biological Chemistry. 277 (45), 42419-42422 (2002).
- Bayliss, R., Sardon, T., Vernos, I., Conti, E. Structural basis of Aurora-A activation by TPX2 at the mitotic spindle. Molecular Cell. 12 (4), 851-862 (2003).
- Zhang, Y., et al. Identification of the auto-inhibitory domains of Aurora-A kinase. Biochemical and Biophysical Research Communications. 357 (2), 347-352 (2007).
- Littlepage, L. E., Wu, H., Andresson, T., Deanehan, J. K., Amundadottir, L. T., Ruderman, J. V. Identification of phosphorylated residues that affect the activity of the mitotic kinase Aurora-A. Proceedings of the National Academy of Sciences of the United States of America. 99 (24), 15440-15445 (2002).
- Kufer, T. A., et al. Human TPX2 is required for targeting Aurora-A kinase to the spindle. The Journal of Cell Biology. 158 (4), 617-623 (2002).
- Eyers, P. A., Erikson, E., Chen, L. G., Maller, J. L. A novel mechanism for activation of the protein kinase Aurora A. Current Biology. 13 (8), 691-697 (2003).
- Brunet, S., et al. Characterization of the TPX2 Domains Involved in Microtubule Nucleation and Spindle Assembly in Xenopus Egg Extracts. Molecular Biology of the Cell. 15 (12), 5318-5328 (2004).
- Padilla-Parra, S., Tramier, M. FRET microscopy in the living cell: Different approaches, strengths and weaknesses. BioEssays. 34 (5), 369-376 (2012).
- Aoki, K., Kamioka, Y., Matsuda, M. Fluorescence resonance energy transfer imaging of cell signaling from in vitro to in vivo: Basis of biosensor construction, live imaging, and image processing. Development, Growth & Differentiation. 55 (4), 515-522 (2013).
- Fuller, B. G., et al. Midzone activation of aurora B in anaphase produces an intracellular phosphorylation gradient. Nature. 453 (7198), 1132-1136 (2008).
- Bertolin, G., et al. A FRET biosensor reveals spatiotemporal activation and functions of aurora kinase A in living cells. Nature Communications. 7, 12674 (2016).
- Bertolin, G., et al. Optimized FRET Pairs and Quantification Approaches To Detect the Activation of Aurora Kinase A at Mitosis. ACS Sensors. 4 (8), 2018-2027 (2019).
- Bertolin, G., et al. Aurora kinase A localises to mitochondria to control organelle dynamics and energy production. eLife. 7, (2018).
- Sizaire, F., Le Marchand, G., Pécréaux, J., Bouchareb, O., Tramier, M. Automated screening of AURKA activity based on a genetically encoded FRET biosensor using fluorescence lifetime imaging microscopy. Methods and Applications in Fluorescence. 8 (2), 024006 (2020).
- Demeautis, C., et al. Multiplexing PKA and ERK1&2 kinases FRET biosensors in living cells using single excitation wavelength dual colour FLIM. Scientific Reports. 7, 41026 (2017).
- Ringer, P., et al. Multiplexing molecular tension sensors reveals piconewton force gradient across talin-1. Nature Methods. 14 (11), 1090-1096 (2017).
- Nagai, T., Yamada, S., Tominaga, T., Ichikawa, M., Miyawaki, A. Expanded dynamic range of fluorescent indicators for Ca(2+) by circularly permuted yellow fluorescent proteins. Proceedings of the National Academy of Sciences of the United States of America. 101 (29), 10554-10559 (2004).
- Klarenbeek, J., Goedhart, J., van Batenburg, A., Groenewald, D., Jalink, K. Fourth-Generation Epac-Based FRET Sensors for cAMP Feature Exceptional Brightness, Photostability and Dynamic Range: Characterization of Dedicated Sensors for FLIM, for Ratiometry and with High Affinity. PLOS ONE. 10 (4), 0122513 (2015).
- Fritz, R. D., et al. A Versatile Toolkit to Produce Sensitive FRET Biosensors to Visualize Signaling in Time and Space. Science Signaling. 6 (285), (2013).
- Mastop, M., et al. Characterization of a spectrally diverse set of fluorescent proteins as FRET acceptors for mTurquoise2. Scientific Reports. 7 (1), 11999 (2017).
- vander Krogt, G. N. M., Ogink, J., Ponsioen, B., Jalink, K. A Comparison of Donor-Acceptor Pairs for Genetically Encoded FRET Sensors: Application to the Epac cAMP Sensor as an Example. PLoS ONE. 3 (4), 1916 (2008).
- Cranfill, P. J., et al. Quantitative assessment of fluorescent proteins. Nature Methods. 13 (7), 557-562 (2016).
- Goedhart, J., et al. Structure-guided evolution of cyan fluorescent proteins towards a quantum yield of 93. Nature Communications. 3 (1), (2012).
- Mérola, F., et al. Newly engineered cyan fluorescent proteins with enhanced performances for live cell FRET imaging. Biotechnology Journal. 9 (2), 180-191 (2014).
- Erard, M., et al. Minimum set of mutations needed to optimize cyan fluorescent proteins for live cell imaging. Molecular BioSystems. 9 (2), 258-267 (2013).
- Tramier, M., Zahid, M., Mevel, J. C., Masse, M. J., Coppey-Moisan, M. Sensitivity of CFP/YFP and GFP/mCherry pairs to donor photobleaching on FRET determination by fluorescence lifetime imaging microscopy in living cells. Microscopy Research and Technique. 69 (11), 933-939 (2006).
- Padilla-Parra, S., et al. Quantitative Comparison of Different Fluorescent Protein Couples for Fast FRET-FLIM Acquisition. Biophysical Journal. 97 (8), 2368-2376 (2009).
- Burgstaller, S., et al. pH-Lemon, a Fluorescent Protein-Based pH Reporter for Acidic Compartments. ACS Sensors. , (2019).
- Bindels, D. S., et al. mScarlet: a bright monomeric red fluorescent protein for cellular imaging. Nature Methods. 14 (1), 53-56 (2016).
- Murakoshi, H., Shibata, A. C. E., Nakahata, Y., Nabekura, J. A dark green fluorescent protein as an acceptor for measurement of Förster resonance energy transfer. Scientific Reports. 5, 15334 (2015).
- Murakoshi, H., Shibata, A. C. E. ShadowY: a dark yellow fluorescent protein for FLIM-based FRET measurement. Scientific Reports. 7 (1), 6791 (2017).
- Leray, A., Padilla-Parra, S., Roul, J., Héliot, L., Tramier, M. Spatio-Temporal Quantification of FRET in living cells by fast time-domain FLIM: a comparative study of non-fitting methods [corrected]. PloS One. 8 (7), 69335 (2013).
- Padilla-Parra, S., Audugé, N., Coppey-Moisan, M., Tramier, M. Quantitative FRET analysis by fast acquisition time domain FLIM at high spatial resolution in living cells. Biophysical Journal. 95 (6), 2976-2988 (2008).
- Song, L., Hennink, E. J., Young, I. T., Tanke, H. J. Photobleaching kinetics of fluorescein in quantitative fluorescence microscopy. Biophysical Journal. 68 (6), 2588-2600 (1995).
- Manfredi, M. G., et al. Characterization of Alisertib (MLN8237), an investigational small-molecule inhibitor of aurora A kinase using novel in vivo pharmacodynamic assays. Clinical Cancer Research: An Official Journal of the American Association for Cancer Research. 17 (24), 7614-7624 (2011).
- Katayama, H., et al. Phosphorylation by aurora kinase A induces Mdm2-mediated destabilization and inhibition of p53. Nature Genetics. 36 (1), 55-62 (2004).
- Nowakowski, J., et al. Structures of the Cancer-Related Aurora-A, FAK, and EphA2 Protein Kinases from Nanovolume Crystallography. Structure. 10 (12), 1659-1667 (2002).
- Palmer, A. E., Qin, Y., Park, J. G., McCombs, J. E. Design and application of genetically encoded biosensors. Trends in Biotechnology. 29 (3), 144-152 (2011).
- Grant, R., et al. Constitutive regulation of mitochondrial morphology by Aurora A kinase depends on a predicted cryptic targeting sequence at the N-terminus. Open Biology. 8 (6), 170272 (2018).
- Shimozono, S., Miyawaki, A. Engineering FRET Constructs Using CFP and YFP. Methods in Cell Biology. 85, 381-393 (2008).
- Komatsu, N., et al. Development of an optimized backbone of FRET biosensors for kinases and GTPases. Molecular Biology of the Cell. 22 (23), 4647-4656 (2011).
- Schifferer, M., Griesbeck, O. A Dynamic FRET Reporter of Gene Expression Improved by Functional Screening. Journal of the American Chemical Society. 134 (37), 15185-15188 (2012).
- Peroza, E. A., Boumezbeur, A. H., Zamboni, N. Rapid, randomized development of genetically encoded FRET sensors for small molecules. Analyst. 140 (13), 4540-4548 (2015).
- Reboutier, D., et al. Aurora A is involved in central spindle assembly through phosphorylation of Ser 19 in P150Glued. The Journal of Cell Biology. 201 (1), 65-79 (2013).
- Mo, G. C. H., Posner, C., Rodriguez, E. A., Sun, T., Zhang, J. A rationally enhanced red fluorescent protein expands the utility of FRET biosensors. Nature Communications. 11 (1), 1848 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены