Method Article
라이브 셀의 형성 FRET 바이오 센서를 사용하여 오로라 키나아제 활성화의 실시간 모니터링
요약
다기능 Ser/Th 키나아제 AURKA의 활성화는 Thr288에 대한 자가포스포틸화로 특징지입니다. 여기에서는 프로브 엔지니어링을 위한 몇 가지 전략과 미토시스 전반에 걸쳐 키나아제 활성화를 따르는 빠른 FRET 프로토콜을 설명합니다.
초록
상피 암은 종종 Ser / Thr 키나아제 오로라 A / AURKA의 과발현에 의해 특징입니다. AURKA는 Thr288에 그것의 자기 포인질에 활성화하는 다기능 단백질입니다. AURKA는 미토시스에 있는 풍부한 봉우리, 미토틱 스핀들의 안정성 과 충실도 및 미토시스의 전반적인 효율성을 통제합니다. 구조적 수준에서 잘 특성화되었지만 세포 주기 전반에 걸쳐 AURKA의 활성화에 대한 일관된 모니터링이 부족합니다. 가능한 해결책은 유전적으로 인코딩된 Förster의 공진 에너지 전송(FRET) 바이오 센서를 사용하여 충분한 현면 해상도를 갖춘 AURKA의 자가포식에 대한 통찰력을 얻는 것으로 구성됩니다. 여기에서는 Thr288 자가 포인시립을 감지하는 FRET 바이오 센서를 설계하는 프로토콜과 미토시스 중에 이 수정을 따르는 방법에 대해 설명합니다. 첫째, 우리는 가능한 기증자 / 수용자 FRET 쌍의 개요를 제공하고, 우리는 포유류 세포에 AURKA FRET 바이오 센서의 가능한 복제 및 삽입 방법을 보여줍니다. 그런 다음 맞춤형 설정에서 형광 수명 이미징 현미경 검사법(FLIM)에 의한 신속한 FRET 측정을 위한 단계별 분석을 제공합니다. 그러나 이 프로토콜은 사용 가능한 대체 상용 솔루션에도 적용할 수 있습니다. 우리는 AURKA 기반 바이오 센서에 대한 가장 적합한 FRET 제어를 고려하고 이 도구의 감도를 더욱 높이기 위해 잠재적인 향후 개선을 강조함으로써 결론을 내립니다.
서문
오로라 키나아제 A/AURKA는 다기능 세린/스레오닌 키나아제로 세포 주기 전반에 걸쳐 다양한 세포체 구획1에서 활동합니다. AURKA는 종종 현재 이용 가능한 치료에 가난한 반응을 보이는 환자와 함께, 상피 및 혈액학적 악성종양에서 과발현되기 때문에 그것의 광범위한 현면 활성화를 이해하는 것은 암에서 특히 중요합니다2.
구조 연구에 따르면 AURKA는 비활성 에서 활성 키나아제로 전환하는 두 단계를 거치고 있습니다. 먼저, Thr288의 자가포식은 키나아제의 운동용 포켓의 형성을 변화시키고 활성화시켜 3,4,5,6을 활성화한다. 이 단계는 인간 세포와 제노푸스 laevis3,6,7에서 AURKA의 촉매 활성을 증가시키고, 전체 활성을 위해 키나아제를 프라이밍합니다. 일단 활성화되면, Xklp2 (TPX2)에 대한 표적 단백질과 AURKA의 상호 작용은 제 2 의 형성 변화를 유도5. 이 추가 수정은 AURKA가 셀5,8,9,10의 기판을 향한 완전한 효소 활성에 도달 할 수 있게합니다.
거의 2 년 동안, AURKA의 활성화 및 활동에 대한 통찰력은 생화학적 접근의 조합을 통해 주로 얻어졌다. 이들은 AURKA1의 활동을 조사하기 위하여 AURKA 활성화, 결정분석, 및 체외 또는 셀룰로 키나제 분석의 특징으로 세포 또는 생체 내에서 인지질Thr288의 검출을 포함합니다. 그러나 이러한 접근 방식의 현수체 적 해결은 가난하거나 결석하며 이 두 사건의 역학에 대한 지식을 넓히기 위해 새로운 해결책이 필요했습니다.
지난 몇 년 동안 형광 프로브의 개발은 살아있는 세포에서 AURKA의 모니터링을 용이하게, 더 큰 현시성 해상도와 활성화의 다음을 허용. 지금까지 개발된 AURKA의 가장 구체적인 센서는 FRET 원칙(Förster의 공명 에너지 전송)11에 의존하여 비활성 및 활성 AURKA를 구분합니다. 개발된 첫 번째 센서는 AURKA 키나아제 활성의 기질 계 바이오센서였습니다. 기판 계 바이오 센서는 인산화를 위한 주어진 키나아제에 의해 표적화되고, 기증자/수용자 FRET 쌍 및 인산 잔류물을 인식하는 결합 도메인 내에 삽입되는 짧은 아미노산 서열에 의해 구성되며, 이는 효율적인 FRET 공정을 위한 생체 센서의 접기를 돕는다12. AURKA의 경우, 인산화를 표적으로 한 KIF2C의 14아미노산 단편이 CFP-YFP 기증자/수용자 쌍13 사이에 삽입되었다. 그러나 이 센서에는 몇 가지 주요 단점이 있습니다. 먼저, 이 프로브에 사용되는 KIF2C 서열은 AURKA와 밀접한 관련 키나아제 AURKB에 의해 표적으로 삼아 이 생체센서의 특이성을 감소시킬 수 있다. 둘째, 센서는 인산화를 위한 내인성 키나아제에 의존한다. 따라서, FRET 효율은 키나아제의 양이 제한되는 경우 검출할 수 없거나 중요하지 않을 수 있다(예를 들어, 세포외 구획 또는 세포 주기 상에서). 이러한 한계를 극복하기 위해 AURKA 센서의 새로운 클래스를 "변형 센서"로 만들었습니다. 이러한 프로브에서, AURKA의 전체 길이 서열은 N-종기에서 기증자 불소호레 내에 삽입되었고, C-종부에서 수용자 불소호레를 삽입했다. 비활성 AURKA는 키나아제의 N-및 C-테르미니를 서로 멀리 가져오는 "열린" 변형을 제공합니다. 두 종착기 (> 10 nm) 사이의 이러한 거리와 함께, 기증자 / 수용자 쌍은 FRET에 대한 비 허용 구성에 있습니다. 반대로, 자가포증 AURKA는 두 가지 단백질 테르미니와 두 개의 형광을 근접한 "폐쇄" 변형을 채택한다. 이것은 기증자 일생에 있는 변이를 사용하여 측정될 수 있는 기증자와 수용자 사이 FRET를 허용하는 것을 보여주었습니다14,15. 이러한 프로브는 몇 가지 장점을 제시한다. 첫째, 그들은 유전적으로 인코딩되고, 세포에 있는 내인성 키나아제를 대체하기 위하여 이용될 수 있습니다. 둘째, 그들은 AURKA의 녹다운에 의해 유도된 표현형을 구출하여 세포에서 기능하고 있음을 나타냅니다. 셋째, 상이한 세포전 구획과 세포 주기 전반에 걸쳐 키나아제의 활성화를 따를 수 있다. 프로브는 키나아제가 활성화되는 것으로 알려진 위치(즉, 센트로솜 및 미토틱 스핀들)에서 AURKA의 활성화를 검출하고 미토콘드리아16에서 AURKA의 활성화를 발견하는 데도 참여했다. 마지막으로, 이러한 센서는 FRET/FLIM을 기반으로 한 고함량 스크리닝을 허용했으며, AURKA의 형태 변화는 새로운 약리학적 억제제17을 식별하는 데 사용되었습니다.
본 작업에서, 우리는 배양 된 세포에서 AURKA 활성화를 시각화하는 절차를 설명합니다. 첫째, 우리는 FRET에 대한 잠재적 인 불소 쌍에 대한 통찰력을 만들 것입니다. 가장 적합한 기증자/수용자 쌍의 선택은 사용 가능한 현미경 설정또는 멀티플렉스 FRET18,19와 같은 특정 다운스트림 응용 프로그램에 따라 이루어집니다. 그런 다음 신속한 FRET/FLIM 현미경 설정에서 선택한 바이오 센서의 동작을 탐색하는 파이프라인을 제안합니다. 이 파이프라인은 세포 배양 및 동기화 절차에서 FLIM 수집 및 데이터 분석으로 확장됩니다. 마지막으로, 바이오센서 설계를 위한 유사 전략이 다른 키나아제에 적용될 수 있고 다른 FRET 기반 이미징 시스템과도 사용될 수 있기 때문에 이 프로토콜의 잠재적 이점에 대해 논의할 것입니다.
프로토콜
참고: 이 프로토콜에 사용된 U2OS 세포는 미국식 배양 컬렉션(ATCC, HTB-96)에서 구입되었으며, 마이코플라즈마에서 무료로 테스트되었습니다. 단계 2.1 받는 것 2.7 세포와 시약을 멸균 하기 위해 라미나르 흐름 후드에서 수행 되어야 합니다.
1. 기부자/수락자 FRET 쌍 선택
- 가장 적합한 기증자/수락자 FRET 쌍을 선택하려면 문헌을 참조하십시오. 유용한 예는 FRET/FLIM 설정(사용 가능한 레이저 라인, 필터 등)의 특성에 따라 최종 선택이 이루어져야 하지만 20,21,22,23,24에서 찾을 수 있습니다. 다음은 기증자/수락자 쌍을 선택하는 방법에 대한 몇 가지 고려 사항입니다.
- 기증자 선택: FP 베이스(https://www.fpbase.org/)를 참조하여 사용 가능한 형광 단백질에 대한 완전한 정보를 제공합니다. 이 데이터베이스는 새로 개발된 모든 형광으로 지속적으로 업데이트됩니다.
- 사용 된 각 형광 단백질과 함께 문헌에서 이미 사용 가능한 바이오 센서에 대한 자세한 내용은 형광 바이오 센서 데이터베이스 (https://biosensordb.ucsd.edu/index.php)를 참조하십시오.
- 일반적인 출발점으로, 밝은 기증자 불소 를 선택합니다. 좋은 후보는 mTFP1 또는 ECFP, 또는 EGFP 또는 mEGFP로 GFP 이체로 시안 형광 단백질입니다.
- 올리고머는 단백질 국소화 및/또는 기능에 영향을 미칠 수 있습니다25. CFP의 단황 돌연변이를 mTurquoise226 또는 아쿠아마린27,28로 사용하는 것이 좋습니다. 이러한 변종은 또한 좋은 양자 수율과 멸종 계수를 가지고, 이는 그들에게 FRET 기증자로 좋은 후보를 만들.
- FRET 효율이 이러한 매개 변수29에 의해 크게 영향을 받을 수 있으므로 세포 내 pH23과 같은 환경 변화에 민감하지 않은 형광 단백질(기증자 또는 수용자 모두)에 우선순위를 부여합니다25. 요즘, mTurquoise2 또는 mTFP1 같은 형광은 그들의 좋은 광안정성 덕분에 기증자로 광범위하게 이용됩니다22,25,26.
- 수락자 선택: 시안 기증자는 종종 mVenus, Citrine 및 YPet20,21,22,30으로 황색 형광 단백질 (YFP) 변이체와 짝을 이룹니다. 그러나, 이러한 단백질pH에 훨씬 더 큰 감도, 그리고 전 세계적으로 가난한 광 안정성을 표시 주의 해야 한다.
- mNeonGreen23 또는 mScarlet-I23,32로 mScarlet-I23,32로 YFP의 새로 개발된 pH 무감각 한 노란색 변종을 mTurquoise2에 대한 이전에 검증 된 형광 수용체로 사용하는 것이 좋습니다.
- 또는, FRET/FLIM 실험에서 시안 형광 기증자를 위한 좋은 수용자로 행동하기 위하여 보였던 ShadowG33 또는 ShadowY34로 YFP의 비 형광/어두운 유도체를 사용하는 것을 고려해 보십시오.
- mEGFP를 기증자로 사용하는 경우 단황 빨간색 수락기를 mCherry로 사용하는 것이 좋습니다.
- FP 기본 웹 사이트에서 사용할 수 있는 도구를 사용하여 선택한 기증자/수락자 쌍의 스펙트럼 속성을 확인합니다. mEGFP/mCherry 쌍의 예를 보려면 그림 1 을 참조하십시오.
- FP 기본 웹 사이트에서 도구 드롭다운 메뉴를 선택하고 스펙트럼 뷰어를 선택합니다.
- 드롭다운 메뉴에서 플루오로포레 쌍의 이름을 입력하여 시각화합니다(예: mEGFP 및 mCherry).
- 드롭다운 메뉴에서 지정된 레이저를 선택하여 특정 광원으로 기증자/수락자 쌍의 특성을 시뮬레이션합니다. 또는 레이저 추가를 선택하여 특정 레이저 파장을 입력합니다. 원하는 파장에 불소 포스펙트럼을 조정 하려면 이 옵션에 대한 재정규 방출 을 클릭합니다. 여기서, GFP를 자극하는 데 사용되는 파장은 480 ± 10nm이다.
- 선택된 기증자/수용자 쌍을 AURKA의 전체 길이 서열의 N-terminus에 1개의 불소호를 추가하고, C-종부에서 하나를 복제한다. 선호하는 복제 방법의 지침을 따라 이 구조를 포유동물 발현 벡터에 삽입한다.
2. 세포 배양, 형질 전환 및 동기화
- 1일차. U2OS 세포에 대한 배양 배지 준비: 덜벡코의 수정된 독수리 매체(DMEM)를 10% 태아 소 세럼(FBS), 1% 페니실린-스트렙토마이신 및 1% L-글루타민(여기에서 완전한 성장 미디어)으로 보충한다. 또는, 사전 보충 L-글루타민DMEM또한 사용할 수 있습니다.
- 세포가 동결되는 경우, 실험 8일 전에 병병을 해동한다(즉, 2.5점부터).
- 37°C에서 5%의 CO2로 포유류 세포 배양에 전념하는 인큐베이터에서 세포를 성장시면 됩니다. 오염을 피하기 위해 인큐베이터를 정기적으로 청소하고 살균하십시오.
- 세포가 ~80% 합류에 도달하면:
- Ca2+와 Mg2+없이 멸균 1x 인산염 완충식식염(PBS)으로 간략하게 세척합니다.
- 제조업체의 프로토콜에 따라 멸균 0.05% 트립신-EDTA를 사용하여 세포를 1-3분 동안 인큐베이터에 배치하여 트립시니즈.
- 완전한 성장 미디어의 두 배를 추가하여 트립신을 비활성화; 잘 섞으세요.
- 3-5 분 동안 800 x g 에서 세포 현탁액을 원심 분리합니다.
- 혈류계를 사용하여 세포를 계산하고 챔버 슬라이드에서 ~70-80 %의 합류에 적합한 희석을 계산합니다. 대안적으로, 살아있는 세포 화상 진찰을 위한 유사한 지원은 또한 이용될 수 있습니다.
- 선택한 라이브 셀 이미징 지원에 있는 세포의 해당 부피를 파이프하고, 다음 날까지 인큐베이터에 세포를 다시 배치합니다.
- 2일차. 트랜스페션을 진행합니다. 최적의 전환 효율(~50/80%)을 얻기 위해 선호하는 과도 전환 방법의 지침을 따릅니다. 특정 전환 방법이 필요하지 않습니다. 사용되는 세포주에 따라 경질 효율이 달라질 수 있습니다. 48h에 대한 인큐베이션.
참고: 과도 과도 의 필요성을 우회하기 위해 세 벡터각각을 포함하는 안정적인 클론을 생성합니다. 이 단계에서는 두 가지 유형의 컨트롤을 계획해야 합니다. 첫째, 전체 길이 AURKA의 존재가 se 당 mTurquoise2의 수명을 왜곡하지 않는지 확인하기 위해 "기증자 전용"제어가 필요합니다. 둘째, 키나아제 죽은 돌연변이를 운반하는 바이오센서는 FRET가 폐지되거나 현저히 낮아지는 네거티브 컨트롤로 사용되어야 한다. 대안적으로 키나아제-죽은 돌연변이에, ATP 아날로그 MLN8237로서 AURKA 활성화의 화학억제제는 음의 대조군으로 사용될 수 있다.- 세 가지 전환 조건을 미리 계획하며, 각 조건은 독립적인 우물에서 계획합니다.
"기증자 전용" 벡터(예: AURKA-mTurquoise2)
"바이오 센서"(예: superYFP-AURKA-mTurquoise2)
키나아제 데드/"K162M" 바이오센서(예: superYFP-AURKA K162M-mTurquoise2) 또는 대안적으로 AURKA 활성화 억제제(예를 들어, MLN8237) - 비교할 각 독립적인 기증자/수락자 쌍에 대해 세 가지 조건을 수행합니다.
- 비동기화 된 및 G2 / M 동기화 된 세포를 비교하는 경우 전관 된 우물의 수를 두 배로 고려하십시오 (단계 2.6 참조).
- 세 가지 전환 조건을 미리 계획하며, 각 조건은 독립적인 우물에서 계획합니다.
- 3일차. G2/M. DMSO에 용해된 100 ng/mL 노코다졸을 첨가하여 광 노출을 피하고 16h(바람직하게는 하룻밤)를 위해 배양합니다. 비동기화 된 및 G2 / M 동기화 셀을 비교하는 경우 각 경질 상태를 nocodazole또는 동일한 양의 DMSO로 처리하십시오. 더 나은 동기화 효율을 위해 DMSO에서 노코다졸의 일회용 알리쿼트를 준비하고 -20 °C에 보관하고 사용 후 폐기하십시오.
참고: 세포 동기화 효율은 세포주마다 다를 수 있습니다. 노코다졸과 그 잠복기의 최적 농도는 FRET/FLIM 실험 전에 유동 세포측정 접근법에 의해 실험적으로 결정되어야 합니다. 통계적으로 관련된 FRET/FLIM 분석을 위해 전체 세포 인구의 50% 이상의 G2/M의 동기화 효율을 권장합니다. - 4일차. 미토세포에 대한 노코다졸 워시아웃 및 FRET/FLIM 이미징
- 배양 매체를 파이펫으로 제거하고 미리 데워진 멸균 PBS로 교체하십시오. 가능하면 광 노출을 피하십시오. 부드럽게 접시를 흔들어.
- 항상 빛 노출을 피하면서 세척 절차를 반복하십시오.
- 두 번째 PBS 세척을 제거하고 20% 태아 보빈 혈청(FBS)과 1% 페니실린-스트렙토마이신(여기에서 이미징 미디어)으로 보충된 사전 따뜻하게 멸균 된 Leibovitz L-15 배지로 교체하십시오.
참고: 이미징 미디어는 pH 표시기(예: 페놀 레드) 및 중간 성분없이 리보플라빈으로 구입해야 합니다. 이 물질은 평생 값을 왜곡할 수 있는 자동 형광의 근원입니다. - FRET/FLIM 이미징을 진행합니다. 온도의 급격한 변화를 최소화하고 가능한 한 빨리 이미징 단계(3단계)로 진행합니다. 현미경 설정으로 운반하는 동안 빛으로부터 샘플을 보호하는 것이 좋습니다 (즉, 알루미늄 호일에 포장하거나 상자에 배치하여).
3. FRET/FLIM 인수
참고: 이 프로토콜의 FRET/FLIM 인수는 사용자 지정 빌드 설정에서 수행되었으며, 35년에 설명되어 있으며 in15,17(그림 2)와 같은 제어 솔루션을 장착했습니다. 이 설정은 현재 Inscoper에 의해 상용화되었으며 펄스 흥분을 위한 흰색 레이저가 있는 회전 디스크 현미경으로 만들어졌으며 카메라 앞에서 고율의 시간 게이트 강화장치가 있습니다. 10ns의 시간 창에서 2ns의 시간 게이트는 순차적으로 5 개의 시간 게이트 이미지의 스택을 얻는 데 사용됩니다. 이러한 이미지는 다음 방정식에 따라 픽셀별 픽셀 평균 형광 수명을 계산하는 데 사용됩니다: θ = ΣΔti • θi/ΘÎîi, 여기서 Δti는 ith 게이트의 지연 시간에 대응하는 동안 픽셀별 시간 게이트 강도 이미지35,36 . 이 방법은 빠른 FLIM 측정을 보장합니다: 피팅 또는 비닝 단계가 필요하지 않으며, 수명은 최소한의 광자 예산으로 온라인 모드에서 계산할 수 있습니다. 이 시스템은 또한 사용자 친화적 인 소프트웨어 인터페이스를 제공합니다. 그러나, 동일한 실험은 FLIM 측정을 위해 장착된 다른 상업적 현미경 설정하에서 수행될 수 있다.
- G2/M 블록에서 미토시스로의 세포가 최적의 방출을 보장하려면 37°C에서 실험을 수행합니다. 가능하면 온도 성 챔버가 장착 된 현미경 설정으로 FRET / FLIM 실험을 수행하십시오.
- 실험 전에 현미경의 온도 성 챔버를 적어도 30 분내지 1 시간 켜십시오.
- 레이저, 카메라, 현미경 설정 및 이미징 소프트웨어(그림 2)를 켭니다.
- 기증자 불소에 대한 적절한 여기 및 방출 파장을 선택합니다. 편리한 파장 옵션은 다음과 같습니다: λex 440/10 nm 및 λem 483/35 nm 용 mTurquoise2 (그림 3A); λex 488/10 nm 및 λem 525/50 nm GFP용 nm(그림 3B).
- 노출 시간을 일반적으로 30~100ms(그림 3)로 설정합니다. 과도한 레이저 전원이 광표백으로 유도된 광독성 효과를 초래할 수 있으며, 이는 형광 수명을 수정할 수 있습니다37. 설정시 시간 경과 획득 시 첫 번째 게이트의 형광 강도를 모니터링하여 광표백 이벤트의 부재를 검증합니다. 형광 강도의 변형을 관찰 할 수있는 경우, 인수를 폐기하고 레이저 전력을 조정합니다.
참고: 여기 설정에서 첫 번째 게이트에서 최소 3000개의 회색 레벨을 허용하는 노출 시간을 선택합니다. 그렇지 않으면 소프트웨어는 기증자 수명을 계산하지 않습니다. 이 회색 수준 값은 관련 수명 값을 얻는 데 필요한 최소한의 광자 예산에 해당합니다. - FRET/FLIM 인수를 시작하기 전에 양극성 스핀들(U2OS 셀에서~20/30분)이 출현할 때까지 대기하여 세포가 미토시스에 들어갔는지 확인합니다. 미토틱 AURKA는 이러한 구조를 중심으로 국소화되기 때문에, 현미경으로 직접 세포에서 스핀들의 형성을 선별하여 미토성 진행을 검증하며, 외부 광원(도 1)을 갖는다. 미토성 진행에 필요한 시간은 사용되는 세포주에 따라 달라질 수 있습니다.
- MLN8237로 치료하는 경우, 현미경 의 밑에 세포를 놓고 그(것)들이 메타상에 도달할 수 있도록 합니다 (nocodazole 세척 후에 대략 20 분). 기증자 전용 구조를 발현하는 세포와 바이오 센서를 발현하는 세포에 DMSO에 용해된 250nM MLN8237을 추가합니다.
- 위와 같이 전이된 세포에 이 조건을 통제하고 DMSO의 동등한 부피로 배양한다. 더 나은 AURKA 억제를 위해, DMSO에서 MLN8237의 일회용 알리쿼트를 준비하여 -80°C에 보관하십시오. 알리코를 얼음 위에 놓고 해동하고 사용 후 폐기합니다.
- 10 분 동안 인큐베이션하십시오. 이 기간 이후에는 미토틱 스핀들이 줄어들고 단 하나의 강렬한 점만 남게 됩니다. K162M 돌연변이를 사용할 때 유사한 표현형이 관찰됩니다.
- 미토틱 스핀들의 더 나은 해상도를 위해 적어도 63배 의 목표를 사용하십시오(그림 3).
- 메타Phase에서 셀을 발견한 후( 도 4 를 메타Phase의 셀의 예로 참조), xyz 좌표를 조정하여 시야의 중심에 놓습니다.
- 더 빠른 이미지를 보려면 하나의 z 평면을 선택합니다. 미토틱 스핀들이 더 눈에 띄거나 강렬한 평면을 선택합니다.
- 레코딩을 시작합니다. 취득 시간은 사용된 FLIM 설정(몇 초에서 최소)에 따라 달라질 수 있습니다. 시장에서 사용할 수있는 상용 설정의 대부분은 형광 현미경 과 픽셀별 수명지도를 모두 정교하게합니다. 두 이미지를 모두 저장합니다.
- 각 형질 및 / 또는 치료 조건에서 적어도 10 개의 독립적 인 이미지를 습득하십시오.
4. ΔLifetime 계산 및 기증자/수락자 쌍 간의 FLIM 값 비교
- 전체 픽셀별 수명 맵(즉, 전체 미토틱 스핀들)에서 수명 값을 추출하거나 특정 하위 영역에 해당하는 관심 영역(ROI)을 선택합니다.
참고: 사용된 FRET/FLIM 설정에 따르면, 수명 계산은 획득 소프트웨어에서 직접 수행되거나 일반 이미지 처리 솔루션(예: 피지/ImageJ: https://fiji.sc/)으로 추출될 수 있습니다. 수명 값( 온라인 모드라고도 함)을 직접 계산하는 소프트웨어는 초보자와 FRET/FLIM에 완전히 익숙하지 않은 현미경 사용자에게 적합한 사용자 친화적인 솔루션을 제공합니다. 반대로, 획득 후 평생 값을 추출하려면 피팅 절차가 필요한 경우가 많습니다. 피팅의 수학적 모델에 대한 몇 가지 이전 지식이 필요하기 때문에이 옵션은 초보자가 접근 할 수 없습니다. - 일단 시각화되거나 추출되면, "기증자 전용" 벡터(예를 들어, AURKA-mTurquoise2)를 표현하는 세포의 평균 수명을 계산하여 기증자 수명을 의미한다.
- 평균 기증자 수명에서 4.1 단계에서 계산된 각 독립적인 평생 값을 뺍니다. 분석된 모든 조건에서 모든 셀에 대해 이 단계를 반복하면 모든 조건에 대해 ΔLifetime이 부여됩니다.
- "기증자 전용", "바이오 센서"및 "K162M", 또는 DMSO 및 MLN8237 조건에 대한 Δ Lifetime 값을 비교합니다.
참고: "기증자 전용" 조건의 경우 ΔLifetime은 값값이 0에 가깝고 수명 값의 실험적 변동에 대응해야 합니다. "바이오센서" 조건의 경우 ΔLifetime 값은 두 구문 간의 순 차이를 산출해야 합니다(그림 4 참조). - 다른 기증자/수락자 쌍 간에 Δ Lifetime 값을 비교합니다.
- "바이오 센서"조건을 비교 : 그들은 유사한 Δ Lifetime을 보여 합니까?
- "K162M" 또는 MLN8237 조건이 비슷한 Δ Lifetime을 보여 주는가? 그들의 ΔLifetime은 "기증자 전용" 조건과 유사합니까?
결과
우리는 Thr288에 AURKA의 자가 변압을 다른 스펙트럼 특성을 가진 두 개의 바이오 센서를 사용하여 위에서 설명한 절차를 따랐습니다. 우리는 초기 GFP-AURKa-mCherry 프로브14와 다른 스펙트럼 특성을 가진 두 개의 바이오 센서를 비교했습니다. 이 두 프로브는 형광 기증자 mTurquoise2 및 비형광 수용자 (ShadowG)에 의존하거나 두 번째 경우 노란색 수용자 (superYFP)에 의존한다. 그런 다음 각 기증자/수락자 쌍 내에 AURKA의 전체 길이 시퀀스를 삽입했습니다. AURKA 활성화에 대한 부정적인 제어를 위해 두 가지 전략을 추구할 수 있습니다. 먼저, 작은 ATP-analog(MLN8237)를 사용하여 키나아제의 운동 용 주머니에 ATP의 결합을 방해하고 활성화를 방지한다38. 둘째, Lys162를 Met(K162M)으로 돌연변이하여 14,15,39를 활성화할 수 없는 각 바이오센서의 키나아제 데드 버전을 생성합니다. 이 돌연변이는 일반적으로 Lys162와 Glu181 사이에 설치된 염교의 붕괴를 유도하여 키나아제의 운동 주머니가 안정적으로 열리고 전반적인 비활성화를 유발합니다40. FRET에 대한 부정적인 제어로, 우리는 수용자 - 무효 구조 (GFP-AURKA 또는 AURKA-mTurquoise2)를 사용했다.
G2/M에서 세포를 동기화하고 미토시스로 방출한 후, 우리는 미토틱 스핀들에서 모든 전염된 구문의 수명을 측정했습니다(도 4). 참고로, 이러한 구조는 전체적으로 고려되었고, 스핀들 내의 ROI는 분석되지 않았다. 그런 다음 모든 조건에 대해 ΔLifetime을 계산했습니다. 예상대로, GFP-AURKA 또는 AURKA-mTurquoise2("기증자 전용" 조건)의 수명은 0에 가까웠으며, 이는 이러한 구조에 대해 측정된 값이 평균 값(그림 4A,4B)을 중심으로 변동했음을 나타냅니다. 반대로, GFP-AURKA-mCherry에 대한 ΔLifetime 값은 기증자 전용 조건과 통계적으로 달랐으며, ΔLifetime은 ~130 ps(그림 4A)가 증가했습니다. 유사한 관측은 섀도우-AURKA-mTurquoise2 및 초YFP-AURKA-mTurquoise2에 대해 이루어졌으며, ΔLifetime은 기증자 전용 조건에서 각각 ~150 및 ~220 ps의 증가(도 4B,4C)를 위해 만들어졌다. 이러한 데이터는 의사 색상 조회 테이블(LUT)을 사용하여 단일 셀에서 쉽게 시각화할 수 있습니다. 이 경우 ΔLifetime 의 값은 0 주위의 의사 변색 노란색이며, 더 중요한 차이점은 의사 변색 빨간색 / 보라색입니다. 실제로, 픽셀별 LUT는 기증자 전용 구조를 표현하는 세포에서 노란색에 가까웠으며, 바이오 센서를 표현하는 세포의 빨간색/보라색 스펙트럼에서 더 가까웠습니다(그림 4A,4B). 이는 또한 GFP-AURKA-mCherry 바이오센서가 약리학적 억제제 MLN8237로 치료되었을 때도 관찰되었다.
그런 다음 키나아제 죽은 바이오 센서의 Δ Lifetime을 분석했습니다. 이러한 구조는 중간 ΔLifetime 값을 보여 주었다: ΔLifetime 기증자 전용 조건 (그림 4B,4C)에 비해 상당히 높았지만, 또한 정상 대응 (그림 4B,4D)보다 상당히 낮았다. MLN8237로 처리된 세포와 비교하거나 키나아제 죽은 바이오 센서를 표현하는 것은 각 기증자/수용자 쌍에 대한 ΔLifetime 변이가 AURKA의 활성화에만 전적으로 연관되어 있는지 여부를 추정하는 데 필요합니다. GFP-AURKA-mCherry의 경우, AURKA 특이적 억제제가 사용될 때 ΔLifetime 변형이 폐지됩니다. 반대로, ΔLifetime 변화는 대부분, 하지만 독점적으로 그림자G-AURKA-mTurquoise2및 superYFP-AURKA-mTurquoise2의 경우 AURKA 활성화에 연결 되지 않습니다.
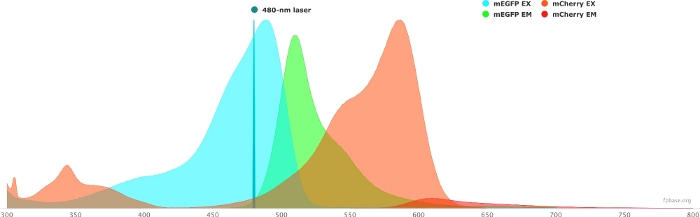
그림 1: GFP(기증자) 및 mCherry(수락자) 여기 및 배출 스펙트럼.
스펙트럼은 FP 베이스 웹 사이트 (https://www.fpbase.org/)에서 획득및 적응하고 480 nm 레이저 여기로 조정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 실험 작업 영역의 이미지입니다.
(1) 제어 용액; (2) 백색 레이저 소스; (3) CCD 카메라; (4) 현미경 설정; (5) 시료의 안구 스크리닝을 위한 외부 광원/램프. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
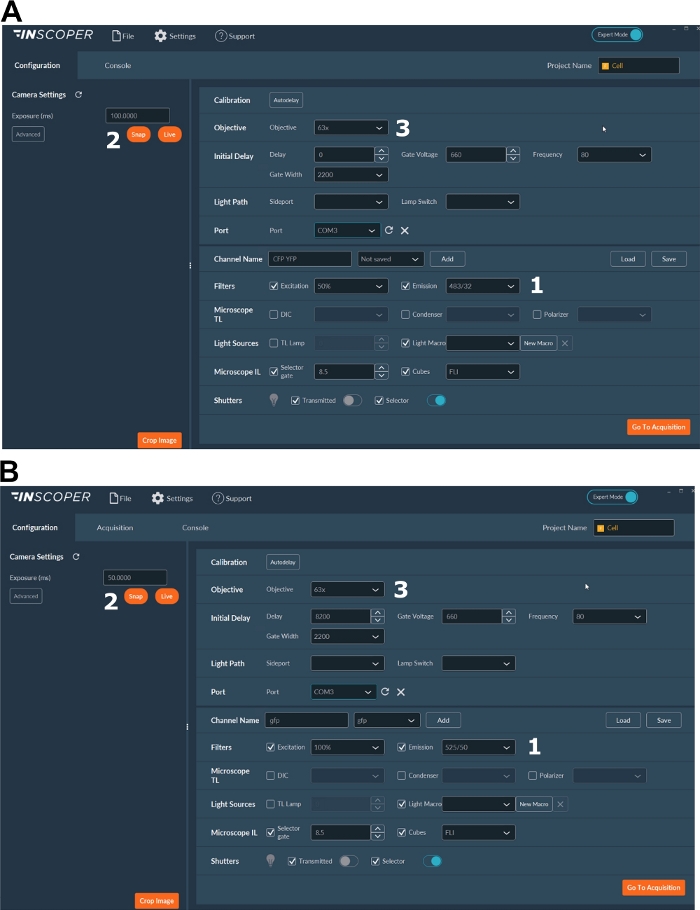
그림 3: FLIM 획득을 위한 소프트웨어의 대표적인 이미지입니다.
(A, B) (1) 기증자에 대한 여기 및 방출 매개 변수 ( A의 CFP, 또는 B의 GFP); (2) 노출 시간; (3) 목표의 선택. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
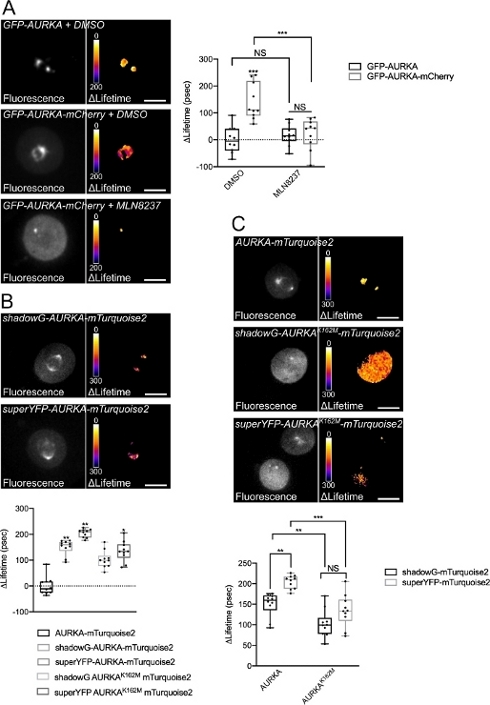
그림 4: AURKA FRET 바이오 센서및 음의 제어의 대표적인 이미지.
(A) (Micrographs) 형광(green channel) 및 해당 픽셀별 ΔLifetime(기증자 전용 – 바이오센서)은 GFP-AURKA 또는 GFP-AURKA-mCherry를 발현하며, G2/M에서 동기화된 양극성 스핀들이 눈에 띄게 될 때까지 방출된 후 DMSO 또는 MLN8237로 처리된다. Δ Lifetime은 의사 색상 스케일("Fire" 조회 테이블)으로 설명되어 있습니다. (그래프) 표시된 조건에 대한 상응하는 정량화 및 양방향 ANOVA 분석. (B) (마이크로그래프) 형광(시안 채널) 및 해당 픽셀별 ΔLifetime(기증자 전용 – 바이오센서)은 그림자-AURKA-mTurquoise2(상부 패널) 또는 초YFP-AURKA-mTurquoise2(하부 패널) 또는 초유FP-AURKA-mTurquoise2(하부 패널)를 발현하고, G2/M에서 동기화되고, 양극성 스핀까지 방출된다. Δ Lifetime은 의사 색상 스케일("Fire" 조회 테이블)으로 설명되어 있습니다. (그래프) 상기 현미경으로 표현되는 조건의 상응하는 정량화 및 단방향 ANOVA 분석. (C) (마이크로그래프) AURKA-mTurquoise2(상부 패널), 섀도우-AURKA K162M-mTurquoise2(중간 패널) 및 초YFP-AURKA K162M-mTurquoise2의 이미지가 마이크로그래프에서와 같이 획득및 표현된다. (그래프) 표시된 형질 전환 조건에 대한 양방향 ANOVA 분석. 상자플롯의 막대는 중앙값을 나타냅니다. 수염은 최소에서 최대 n = 10 개의 대표적인 실험 (3)의 조건당 10 세포로 확장됩니다. 개별 값은 점으로 표시됩니다. 규모 막대: 10 μm. *P < 0.05, **P < 0.01, ***P < 0.001 (A) (AURKA-mTurquoise2" 조건(B)에서 각 표시된 조건에 대해, 그리고 각 표시된 조건(C)에 대해. NS: 중요하지 않습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
유전자 로코딩된 FRET 바이오 센서는 단일 단백질 또는 전체 신호 경로41의 활성화를 측정하는 신뢰할 수 있는 도구입니다. 특히, AURKA FRET 바이오 센서는 시간과 공간에서 키나아제의 활성화를 탐구하는 우대적인 방법을 구성한다. 그러나 일부 요소는 FRET 바이오 센서를 설계하거나 최적화할 때 특별한 주의를 기울여야 합니다.
첫째, 기증자/수용자 FRET 쌍의 특성 및 상대적 위치는 이 키나아제의 특정 기능에 맞게 조정할 수 있다. AURKA는 미토시스 도중 미토틱 스핀들에서 크게 농축되지만, 세포 주기 전체와 다른 세포 외 위치(예를 들어, 센트루좀, 핵 및 미토콘드리아)1,2에서 존재한다. 바이오 센서가 산성 pH에 도달 할 수있는 미토콘드리아와 같은 특정 구획에서 사용되는 경우, pH 무감각 기증자 수용자 FRET 쌍의 선택은 mTurquoise2 / shadowG로 이루어져야합니다. 더욱이, C-terminus에 FRET 기증자를 배치하면 이 세포전 구획에서 바이오 센서의 더 나은 시각화를 허용할 수 있고, 잠재적으로 AURKA N-terminus가 미토콘드리아16,42에서 부분적으로 갈라지는 것으로 나타났다는 점을 감안할 때 FRET 검출을 최적화할 수 있습니다.
둘째, AURKA FRET 바이오 센서를 최적화하는 아직 미개척 된 방법은 전체 길이 AURKA와 기증자 / 수용자 쌍 사이의 링커보다 신중한 설계가 필요합니다. 형광 쌍 사이의 거리뿐만 아니라 링커 자체의 특성은 FRET 효율을 향상시키는 핵심 요소인 것으로 나타났다43,44,45,46. 이 관점에서, 링커의 강성 또는 유연성을 증가하는 것은 FRET 효율성에 해롭거나 더 향상시킬 수 있습니다.
셋째, AURKA의 과발현이 세포의 상당 비율로 미토틱 스핀들 이상을 유도하는 것으로 알려져 있다2. 포유류 발현 벡터에서 발견되는 가장 일반적인 프로모터 중 하나인 사이토메갈로바이러스(CMV)와 같은 강력한 프로모터하에서 동일한 FRET 구조를 표현하거나 AURKA 최소 프로모터 시퀀스(CTTCCGG)14,47에서 얻은 ΔLifetime을 비교하는 것은 흥미로웠습니다. 이러한 프로모터는 이전에 키나아제의 낙마 후 발생하는 단극성 또는 다극성 스핀들을 구출하는 것으로 나타났으며, 그 사용은 세포 주기 의 혼란을 유도하지 않았다. FLIM은 cell11의 단백질 발현 수준 및 상대 적 농도에 민감하지 않지만 동일한 바이오 센서 설정에서 두 프로모터를 철저히 비교하면 지정된 위치에서 활성화 된 AURKA 풀의 이해를 넓힐 수 있습니다. 또한, 상피 및 혈액성 암 패러다임과 관련된 과잉 발현시 AURKA 활성화가 어떻게 변할 수 있는지에 대한 새로운 통찰력을 제공합니다.
마지막으로 다운스트림 FRET 응용 프로그램도 고려해야 합니다. AURKA 분야의 미래 관점은 기질 계 바이오 센서로 키나아제 형성 바이오 센서를 구성하는 것입니다. 멀티플렉스 FRET로 알려진 프로세스인 두 개의 바이오 센서의 FRET 거동을 동시에 분석하려면 제2 차 기증자 채널에서 스펙트럼출혈을 피하기 위해 제1 바이오 센서의 어두운 수용자가 필요합니다. AURKA의 맥락에서, 이것은 첫번째 biosensor를 가진 키나아제의 활성화를 검출하는 흥미진진한 새로운 관점을 열고, 두 번째와 주어진 기판을 향한 효소 활동. 멀티플렉스의 최근 개발은 이제 한 번에 최대 3개의 바이오 센서를 누적할 수 있게 해 주었습니다48. AURKA의 맥락에서 유사한 방법을 적용하면 키나아제의 활성화 활동 상호 작용을 테스트할 뿐만 아니라 전례 없는 현면 해상도를 가진 AURKA 신호 캐스케이드를 탐색하는 매우 유망한 전략을 나타낼 수 있습니다.
결론적으로, FRET/FLIM은 단백질 활성에 대한 지식을 심화하는 편리한 방법입니다. 한편으로는 적어도 하나의 형광 폭정 덕분에 살아있는 세포에서 주어진 단백질의 국소화를 시각화 할 수 있습니다. 다른 한편으로는, 그것은 단백질 형성 변화를 해명 할 수 있습니다., 단백질 활성화 및/또는 활동에 유익한 수 있는. 따라서 FRET/FLIM 및 형태 FRET 바이오 센서는 살아있는 세포에서 시그널링 경로를 따르고 절묘한 현수막 분해능을 따르는 광범위한 방법이 될 가능성이 있습니다.
공개
G.B. 실험을 수행하고 원고를 작성하고 검토하고 자금을 제공, M.T.는 원고를 검토하고 지원을 제공했다. M.T.는 이 원고에 표시된 신속한 FLIM 측정을 위한 솔루션을 생산하는 Inscoper 회사(프랑스)의 과학 고문이자 주주입니다. Inscoper는 원고의 오픈 액세스 게시를 부분적으로 지원했습니다. Inscoper는 실험 설계, 데이터 처리 또는 원고 작성에 관여하지 않았습니다.
감사의 말
우리는 현미경 - 렌 이미징 센터 (MRic, BIOSIT, 렌, 프랑스)의 엔지니어에게 조언과 도움을 주며, 특히 X. Pinson에게 원고의 비판적 판독에 감사드립니다. MRic은 프랑스 국립 연구 기관 (ANR-10-INBS-04)이 지원하는 국가 인프라 프랑스 - 바이오 이미징의 회원입니다. 이 작품은 센터 내셔널 드 라 레체쉬 시엔티피크 (CNRS), 리그 콘트론 르 암 코미테스 d'Ille et Vilaine, des Côtes d'Armor et du Finistère, 그리고 협회는 G에 라 레체쉬 콘트레 르 암 (ARC)을 부어 지원했다.B
자료
| Name | Company | Catalog Number | Comments |
| Alisertib (MLN8237) | SelleckChem | S1133 | Use at a 250 nM final dilution |
| Dulbecco's Modified Eagle Medium (DMEM) | ThermoFischer Scientific Brand: Gibco | 41966052 | High glucose + L-glutamine + Sodium pyruvate |
| Fetal Bovine Serum (FBS) | ThermoFischer Scientific Brand: Gibco | 10270106 | |
| L15 | ThermoFischer Scientific Brand: Gibco | 21083027 | Leibovitz's L15 medium + L-glutamine, no Phenol red |
| LabTek | Nunc | 2515380 | |
| Nocodazole | Merck Brand: Sigma-Aldrich | M1404 | Use at a 100 ng/mL final dilution |
| Penicillin/Streptomycin | ThermoFischer Scientific Brand: Gibco | 15140122 | Penicillin-Streptomycin 10,000 U/mL (100x) |
| Phosphate Buffer Saline (PBS) | ThermoFischer Scientific Brand: Gibco | 14190169 | DPBS, no calcium, no magnesium |
| Trypsin/EDTA | ThermoFischer Scientific Brand: Gibco | 25300096 | Trypsin-EDTA 0.05%, Phenol Red (1x) |
참고문헌
- Bertolin, G., Tramier, M. Insights into the non-mitotic functions of Aurora kinase A: more than just cell division. Cellular and Molecular Life Sciences. , (2019).
- Nikonova, A. S., Astsaturov, I., Serebriiskii, I. G., Dunbrack, R. L., Golemis, E. A. Aurora A kinase (AURKA) in normal and pathological cell division. Cellular and Molecular Life Sciences. 70 (4), 661-687 (2013).
- Walter, A. O., Seghezzi, W., Korver, W., Sheung, J., Lees, E. The mitotic serine/threonine kinase Aurora2/AIK is regulated by phosphorylation and degradation. Oncogene. 19 (42), 4906-4916 (2000).
- Cheetham, G. M. T. Crystal Structure of Aurora-2, an Oncogenic Serine/Threonine Kinase. Journal of Biological Chemistry. 277 (45), 42419-42422 (2002).
- Bayliss, R., Sardon, T., Vernos, I., Conti, E. Structural basis of Aurora-A activation by TPX2 at the mitotic spindle. Molecular Cell. 12 (4), 851-862 (2003).
- Zhang, Y., et al. Identification of the auto-inhibitory domains of Aurora-A kinase. Biochemical and Biophysical Research Communications. 357 (2), 347-352 (2007).
- Littlepage, L. E., Wu, H., Andresson, T., Deanehan, J. K., Amundadottir, L. T., Ruderman, J. V. Identification of phosphorylated residues that affect the activity of the mitotic kinase Aurora-A. Proceedings of the National Academy of Sciences of the United States of America. 99 (24), 15440-15445 (2002).
- Kufer, T. A., et al. Human TPX2 is required for targeting Aurora-A kinase to the spindle. The Journal of Cell Biology. 158 (4), 617-623 (2002).
- Eyers, P. A., Erikson, E., Chen, L. G., Maller, J. L. A novel mechanism for activation of the protein kinase Aurora A. Current Biology. 13 (8), 691-697 (2003).
- Brunet, S., et al. Characterization of the TPX2 Domains Involved in Microtubule Nucleation and Spindle Assembly in Xenopus Egg Extracts. Molecular Biology of the Cell. 15 (12), 5318-5328 (2004).
- Padilla-Parra, S., Tramier, M. FRET microscopy in the living cell: Different approaches, strengths and weaknesses. BioEssays. 34 (5), 369-376 (2012).
- Aoki, K., Kamioka, Y., Matsuda, M. Fluorescence resonance energy transfer imaging of cell signaling from in vitro to in vivo: Basis of biosensor construction, live imaging, and image processing. Development, Growth & Differentiation. 55 (4), 515-522 (2013).
- Fuller, B. G., et al. Midzone activation of aurora B in anaphase produces an intracellular phosphorylation gradient. Nature. 453 (7198), 1132-1136 (2008).
- Bertolin, G., et al. A FRET biosensor reveals spatiotemporal activation and functions of aurora kinase A in living cells. Nature Communications. 7, 12674 (2016).
- Bertolin, G., et al. Optimized FRET Pairs and Quantification Approaches To Detect the Activation of Aurora Kinase A at Mitosis. ACS Sensors. 4 (8), 2018-2027 (2019).
- Bertolin, G., et al. Aurora kinase A localises to mitochondria to control organelle dynamics and energy production. eLife. 7, (2018).
- Sizaire, F., Le Marchand, G., Pécréaux, J., Bouchareb, O., Tramier, M. Automated screening of AURKA activity based on a genetically encoded FRET biosensor using fluorescence lifetime imaging microscopy. Methods and Applications in Fluorescence. 8 (2), 024006 (2020).
- Demeautis, C., et al. Multiplexing PKA and ERK1&2 kinases FRET biosensors in living cells using single excitation wavelength dual colour FLIM. Scientific Reports. 7, 41026 (2017).
- Ringer, P., et al. Multiplexing molecular tension sensors reveals piconewton force gradient across talin-1. Nature Methods. 14 (11), 1090-1096 (2017).
- Nagai, T., Yamada, S., Tominaga, T., Ichikawa, M., Miyawaki, A. Expanded dynamic range of fluorescent indicators for Ca(2+) by circularly permuted yellow fluorescent proteins. Proceedings of the National Academy of Sciences of the United States of America. 101 (29), 10554-10559 (2004).
- Klarenbeek, J., Goedhart, J., van Batenburg, A., Groenewald, D., Jalink, K. Fourth-Generation Epac-Based FRET Sensors for cAMP Feature Exceptional Brightness, Photostability and Dynamic Range: Characterization of Dedicated Sensors for FLIM, for Ratiometry and with High Affinity. PLOS ONE. 10 (4), 0122513 (2015).
- Fritz, R. D., et al. A Versatile Toolkit to Produce Sensitive FRET Biosensors to Visualize Signaling in Time and Space. Science Signaling. 6 (285), (2013).
- Mastop, M., et al. Characterization of a spectrally diverse set of fluorescent proteins as FRET acceptors for mTurquoise2. Scientific Reports. 7 (1), 11999 (2017).
- vander Krogt, G. N. M., Ogink, J., Ponsioen, B., Jalink, K. A Comparison of Donor-Acceptor Pairs for Genetically Encoded FRET Sensors: Application to the Epac cAMP Sensor as an Example. PLoS ONE. 3 (4), 1916 (2008).
- Cranfill, P. J., et al. Quantitative assessment of fluorescent proteins. Nature Methods. 13 (7), 557-562 (2016).
- Goedhart, J., et al. Structure-guided evolution of cyan fluorescent proteins towards a quantum yield of 93. Nature Communications. 3 (1), (2012).
- Mérola, F., et al. Newly engineered cyan fluorescent proteins with enhanced performances for live cell FRET imaging. Biotechnology Journal. 9 (2), 180-191 (2014).
- Erard, M., et al. Minimum set of mutations needed to optimize cyan fluorescent proteins for live cell imaging. Molecular BioSystems. 9 (2), 258-267 (2013).
- Tramier, M., Zahid, M., Mevel, J. C., Masse, M. J., Coppey-Moisan, M. Sensitivity of CFP/YFP and GFP/mCherry pairs to donor photobleaching on FRET determination by fluorescence lifetime imaging microscopy in living cells. Microscopy Research and Technique. 69 (11), 933-939 (2006).
- Padilla-Parra, S., et al. Quantitative Comparison of Different Fluorescent Protein Couples for Fast FRET-FLIM Acquisition. Biophysical Journal. 97 (8), 2368-2376 (2009).
- Burgstaller, S., et al. pH-Lemon, a Fluorescent Protein-Based pH Reporter for Acidic Compartments. ACS Sensors. , (2019).
- Bindels, D. S., et al. mScarlet: a bright monomeric red fluorescent protein for cellular imaging. Nature Methods. 14 (1), 53-56 (2016).
- Murakoshi, H., Shibata, A. C. E., Nakahata, Y., Nabekura, J. A dark green fluorescent protein as an acceptor for measurement of Förster resonance energy transfer. Scientific Reports. 5, 15334 (2015).
- Murakoshi, H., Shibata, A. C. E. ShadowY: a dark yellow fluorescent protein for FLIM-based FRET measurement. Scientific Reports. 7 (1), 6791 (2017).
- Leray, A., Padilla-Parra, S., Roul, J., Héliot, L., Tramier, M. Spatio-Temporal Quantification of FRET in living cells by fast time-domain FLIM: a comparative study of non-fitting methods [corrected]. PloS One. 8 (7), 69335 (2013).
- Padilla-Parra, S., Audugé, N., Coppey-Moisan, M., Tramier, M. Quantitative FRET analysis by fast acquisition time domain FLIM at high spatial resolution in living cells. Biophysical Journal. 95 (6), 2976-2988 (2008).
- Song, L., Hennink, E. J., Young, I. T., Tanke, H. J. Photobleaching kinetics of fluorescein in quantitative fluorescence microscopy. Biophysical Journal. 68 (6), 2588-2600 (1995).
- Manfredi, M. G., et al. Characterization of Alisertib (MLN8237), an investigational small-molecule inhibitor of aurora A kinase using novel in vivo pharmacodynamic assays. Clinical Cancer Research: An Official Journal of the American Association for Cancer Research. 17 (24), 7614-7624 (2011).
- Katayama, H., et al. Phosphorylation by aurora kinase A induces Mdm2-mediated destabilization and inhibition of p53. Nature Genetics. 36 (1), 55-62 (2004).
- Nowakowski, J., et al. Structures of the Cancer-Related Aurora-A, FAK, and EphA2 Protein Kinases from Nanovolume Crystallography. Structure. 10 (12), 1659-1667 (2002).
- Palmer, A. E., Qin, Y., Park, J. G., McCombs, J. E. Design and application of genetically encoded biosensors. Trends in Biotechnology. 29 (3), 144-152 (2011).
- Grant, R., et al. Constitutive regulation of mitochondrial morphology by Aurora A kinase depends on a predicted cryptic targeting sequence at the N-terminus. Open Biology. 8 (6), 170272 (2018).
- Shimozono, S., Miyawaki, A. Engineering FRET Constructs Using CFP and YFP. Methods in Cell Biology. 85, 381-393 (2008).
- Komatsu, N., et al. Development of an optimized backbone of FRET biosensors for kinases and GTPases. Molecular Biology of the Cell. 22 (23), 4647-4656 (2011).
- Schifferer, M., Griesbeck, O. A Dynamic FRET Reporter of Gene Expression Improved by Functional Screening. Journal of the American Chemical Society. 134 (37), 15185-15188 (2012).
- Peroza, E. A., Boumezbeur, A. H., Zamboni, N. Rapid, randomized development of genetically encoded FRET sensors for small molecules. Analyst. 140 (13), 4540-4548 (2015).
- Reboutier, D., et al. Aurora A is involved in central spindle assembly through phosphorylation of Ser 19 in P150Glued. The Journal of Cell Biology. 201 (1), 65-79 (2013).
- Mo, G. C. H., Posner, C., Rodriguez, E. A., Sun, T., Zhang, J. A rationally enhanced red fluorescent protein expands the utility of FRET biosensors. Nature Communications. 11 (1), 1848 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유