Method Article
Aurora kinazının Gerçek Zamanlı İzlenmesi Canlı Hücrelerde Konformasyonsal FRET Biyosensörleri Kullanılarak Aktivasyon
Bu Makalede
Özet
Çok fonksiyonlu Ser/Thr kinaz AURKA'nın aktivasyonu, Thr288'deki otofosforilasyonu ile ayırt edilir. Burada, mitoz boyunca kinaz aktivasyonunu takip etmek için hızlı bir FRET protokolü ile birlikte prob mühendisliği için bazı stratejileri göstermektedir.
Özet
Epitel kanserleri genellikle Ser/Thr kinaz Aurora A/AURKA'nın aşırı ifadesi ile belirgindir. AURKA, Thr288'deki otofosforilasyonu üzerine aktive olan çok fonksiyonlu bir proteindir. Yapısal düzeyde iyi karakterize olmasına rağmen, hücre döngüsü boyunca AURKA'nın aktivasyonunun tutarlı bir şekilde izlenmesi eksiktir. Olası bir çözüm, AURKA'nın otofosforilasyonu hakkında yeterli mekansal çözünürlükle fikir edinmek için genetik olarak kodlanmış Förster'in Rezonans Enerji Transferi (FRET) biyosensörlerinin kullanılmasından oluşur. Burada, Thr288 otofosforilasyonünü tespit eden FRET biyosensörlerini ve mitoz sırasında bu modifikasyonun nasıl takip edeceğine dair bir protokol açıklıyoruz. İlk olarak, olası donör/kabul eden FRET çiftlerine genel bir bakış sunuyoruz ve memeli hücrelerinde AURKA FRET biyosensörlerinin olası klonlama ve yerleştirme yöntemlerini gösteriyoruz. Daha sonra, özel yapım bir kurulumda floresan ömür boyu görüntüleme mikroskopisi (FLIM) ile hızlı FRET ölçümleri için adım adım analiz sağlıyoruz. Ancak, bu protokol mevcut alternatif ticari çözümler için de geçerlidir. AURKA tabanlı bir biyosensör için en uygun FRET kontrollerini göz önünde bulundurarak ve bu aracın hassasiyetini daha da artırmak için gelecekteki potansiyel iyileştirmeleri vurgulayarak sonuca varıyoruz.
Giriş
Aurora kinaz A/AURKA, hücre döngüsü boyunca ve farklı hücre altı bölmelerde aktif olan çok fonksiyonlu bir serine/threonine kinazdır1. Geniş mekansal arteral aktivasyonunu anlamak kanserde özellikle önemlidir, çünkü AURKA genellikle epitel ve hematolojik malignitelerde aşırı ifade edilir ve hastalar şu anda mevcut tedavilere zayıf yanıt verir2.
Yapısal çalışmalar, AURKA'nın aktif olmayan bir kinazdan aktif bir kinaza dönüştürmek için iki adımdan geçtiğini ortaya koydu. İlk olarak, Thr288'in otofosforilasyonu kinazın kinetik cebinin konformasyonunu değiştirir ve 3,4,5,6'yı aktive eder. Bu adım, AURKA'nın insan hücrelerinde ve Xenopus laevis3,6,7'de katalitik aktivitesini artırarak kinazın tam aktiviteye neden olduğunu sağlar. Etkinleştirildikten sonra, AURKA'nın Xklp2 (TPX2) için hedefleme proteini ile etkileşimi ikinci bir konformasyon değişikliğine neden olur5. Bu daha fazla değişiklik, AURKA'nın hücredeki alt tabakalarına doğru tam enzymatic aktiviteye ulaşmasını sağlar5,8,9,10.
Yaklaşık yirmi yıl boyunca, AURKA'nın aktivasyonu ve aktivitesi hakkında içgörüler esas olarak biyokimyasal yaklaşımların bir kombinasyonu ile elde edildi. Bunlar arasında AURKA aktivasyonunun ayırt edici özelliği olarak hücrelerde veya in vivoda fosforilasyonlu Thr288'in tespiti, kristalografik analizler ve in vitro veya AURKA1'in aktivitesini araştırmak için selüloz kinaz tahlilleri sayıldı. Ancak, bu yaklaşımların mekansal çözümü zayıf veya yoktur ve bu iki olayın dinamiklerinin bilgisini genişletmek için yeni çözümlere ihtiyaç vardı.
Son birkaç yılda floresan probların gelişimi, AURKA'nın canlı hücrelerde izlenmesini kolaylaştırdı ve daha fazla mekansal çözünürlükle aktivasyonunun takip etmesine izin verdi. Şimdiye kadar geliştirilen AURKA için en spesifik sensörler, etkin olmayan ve aktif AURKA arasında ayrım yapmak için FRET prensibine (Förster'ın Rezonans Enerji Transferi)11'e güveniyor. Geliştirilen ilk sensör, AURKA kinaz aktivitesinin substrat bazlı bir biyosensörüydü. Substrat bazlı biyosensörler, fosforilasyon için belirli bir kinaz tarafından hedeflenen kısa bir aminoasik dizi ile oluşturulur ve bir donör / alıcı FRET çiftine ve verimli bir FRET işlemi için biyosensörün katlanmasına yardımcı olan fosforillenmiş kalıntıyı tanıyan bağlayıcı bir etki alanına yerleştirilir12. AURKA durumunda, fosforilasyon tarafından hedeflenen 14 aminoasidlik bir KIF2C parçası CFP-YFP donör/alıcı çifti arasına sokuldu13. Ancak, bu sensörün bazı büyük dezavantajları vardır. İlk olarak, bu probda kullanılan KIF2C dizisi hem AURKA hem de yakından ilişkili kinaz AURKB tarafından hedeflenebilir, böylece bu biyosensörün özgüllüğü azaltılabilir. İkincisi, sensör fosforilasyon için endojen kinazlara dayanır. Bu nedenle, kinaz miktarları sınırlanıyorsa (örneğin, hücre altı bölmelerde veya hücre döngüsü aşamalarında) FRET verimliliği tespit edilemez veya önemli olmayabilir. Bu sınırlamaların üstesinden gelmek için "konformasyon sensörleri" olarak bilinen yeni bir AURKA sensörü sınıfı oluşturuldu. Bu problarda, AURKA'nın tam uzunluktaki dizisi N-terminustaki bir donör floroforu ve C-terminustaki bir kabul edici florofor içine yerleştirildi. Inaktif AURKA, kinazın N ve C-termini birbirinden uzaklaştıran "açık" bir uyum sunar. İki termini (> 10 nm) arasındaki bu mesafede, donör/alıcı çifti FRET için izin vermeyen bir yapılandırmadadır. Aksine, otofosforil aURKA, iki protein termini ve iki floroforun yakınında olduğu "kapalı" bir uyum benimsemiştir. Bu, donör ve alıcı arasında, donör ömründeki varyasyonlar kullanılarak ölçülebilen FRET'e izin verdiği gösterilmiştir14,15. Bu tür problar çeşitli avantajlar sunar. İlk olarak, genetik olarak kodlanırlar ve hücredeki endojen kinazın yerini almak için kullanılabilirler. İkincisi, AURKA'nın devrilmesiyle indüklenen fenotipleri kurtarırlar, bu da hücrede işlevsel olduklarını gösterir. Üçüncüsü, kinazın farklı hücre altı bölmelerde ve hücre döngüsü boyunca aktivasyonunu takip etmeye izin verirler. Problar, kinazın aktive olduğu bilinen yerlerde (yani centrosomes ve mitotik iğ) AURKA'nın aktivasyonunu tespit etti ve ayrıca mitokondri16'da AURKA'nın aktivasyonunu keşfetmeye katıldı. Son olarak, bu sensörler, yeni farmakolojik inhibitörleri tanımlamak için AURKA'nın konformasyon değişikliklerinin kullanıldığı FRET / FLIM tabanlı yüksek içerikli taramalara izin sağladı17.
Bu çalışmada, kültürlü hücrelerde AURKA aktivasyonunu görselleştirmek için bir prosedür açıklıyoruz. İlk olarak, FRET için potansiyel florofor çiftleri hakkında bir fikir vereceğiz. En uygun donör/alıcı çiftinin seçimi mevcut mikroskop kurulumuna veya multipleks FRET18,19 olarak belirli bir aşağı akış uygulamasına göre yapılacaktır. Ardından, hızlı bir FRET/FLIM mikroskop kurulumunda seçilen biyosensörlerin davranışlarını araştırmak için bir boru hattı öneriyoruz. Bu işlem hattı, hücre kültürü ve eşitleme yordamlarından FLIM edinme ve veri analizine kadar uzanacaktır. Son olarak, biyosensör tasarımı için benzer bir stratejinin diğer kinazlara uygulanabileceği ve diğer FRET tabanlı görüntüleme sistemleriyle de kullanılabileceği için bu protokolün potansiyel avantajlarını tartışacağız.
Protokol
NOT: Bu protokolde kullanılan U2OS hücreleri Amerikan Tip Kültür Koleksiyonu'ndan (ATCC, HTB-96) satın alınmış ve mikoplazmadan arındırılmış olarak test edilmiştir. 2.1 ile 2.7 arası adım, hücreleri ve reaktifleri steril tutmak için laminer akış başlığı altında yapılmalıdır.
1. Donör/alıcı FRET çiftinin seçilmesi
- En uygun donör/alıcı FRET çiftlerinin seçimi için literatüre bakın. FRET/FLIM kurulumunun özelliklerine (mevcut lazer hatları, filtreler vb.) göre son seçimin yapılması gerekmesine rağmen, yararlı örnekler 20.21.22.23,24'te bulunabilir. Aşağıda, bir donör/alıcı çiftinin nasıl seçilene ilişkin bazı hususlar yer alır.
- Donörün seçilmesi: mevcut floresan proteinler hakkında tam bir bilgi kümesi için FP tabanına (https://www.fpbase.org/) bakın. Bu veritabanı sürekli olarak tüm yeni geliştirilen floroforlarla güncellenir.
- Literatürde mevcut olan biyosensörler ve kullanılan ilgili floresan proteinler hakkında daha fazla bilgi için Floresan Biyosensör Veritabanı'na (https://biosensordb.ucsd.edu/index.php) bakın.
- Genel bir başlangıç noktası olarak, parlak bir donör florofor seçin. İyi adaylar mTFP1 veya ECFP olarak siyan floresan proteinler veya EGFP veya mEGFP olarak GFP varyantlarıdır.
- Oligomerler protein lokalizasyonunu ve/veya işlevini etkileyebilir25. CFP monomerik mutantlarını mTurquoise226 veya Aquamarine27,28 olarak kullanmayı düşünün. Bu varyantlar ayrıca iyi kuantum verimi ve yok olma katsayılarına sahiptir, bu da onları FRET bağışçıları olarak iyi adaylar haline getirir.
- FRET verimliliği bu parametrelerden yoğun olarak etkilenebileceği için hücre içi pH23 gibi çevresel değişikliklere karşı duyarsız floresan proteinleri (hem donör hem de kabul eden olarak) veya fotobleaching25'i tercih edin29. Günümüzde, mTurquoise2 veya mTFP1 gibi floroforlar, iyi fotoğraflanabilirlikleri sayesinde donör olarak yaygın olarak kullanılmaktadır22,25,26.
- Kabul edenin seçilmesi: siyan donörleri genellikle mVenus, Citrine ve YPet20,21,22,30 olarak Sarı Floresan Protein (YFP) varyantları ile eşleştirilir. Bununla birlikte, bu proteinlerin pH'a karşı çok daha fazla hassasiyete sahip olduğu ve küresel olarak zayıf bir fotoğraflanabilirlik gösterdiği belirtilmelidir.
- YFP'nin yeni geliştirilen, pH'a duyarsız sarı varyantlarını pH-Lemon31, yeşil floroforları mNeonGreen23 veya kırmızı floroforları mScarlet-I23,32 olarak mTurquoise2 için daha önce onaylanmış floresan kabul edenler olarak kullanmayı düşünün.
- Alternatif olarak, FRET/FLIM deneylerinde siyan-floresan donörler için iyi bir kabul edici olarak gösterilen ShadowG33 veya ShadowY34 olarak YFP'nin floresan olmayan /karanlık türevlerini kullanmayı düşünün.
- Donör olarak mEGFP kullanıyorsanız, mCherry olarak monomerik kırmızı alıcıları kullanmayı düşünün.
- FP temel web sitesinde bulunan araçları kullanarak seçilen donör/alıcı çiftin spektral özelliklerini doğrulayın. mEGFP/mCherry çiftinin bir örneği için Şekil 1'e bakın.
- FP temel web sitesinde Araçlar açılır menüsünü ve Spectra görüntüleyici'yi seçin.
- Açılır menülerde, görselleştirmek için florofor çiftinin adını girin (örneğin, mEGFP ve mCherry).
- Açılır menüde belirli bir lazer seçerek donör/alıcı çiftinin özelliklerini belirli bir ışık kaynağıyla simüle edin. Alternatif olarak, Lazer ekle'yi seçerek belirli bir lazer dalga boylarını girin. Florofor spektrumunu istediğiniz dalga boyunu ayarlamak için emisyonu normalleştir seçeneğine tıklayın. Burada, GFP'yi heyecanlandırmak için kullanılan dalga boyu 480 ± 10 nm'dir.
- Seçilen donör/alıcı çifti, AURKA'nın tam uzunluk dizisinin N-terminus'una bir florofor ekleyerek ve bir tane de C-terminus'ta klonlayın. Bu yapıyı tercih edilen bir memeli ifade vektörüne eklemek için tercih edilen klonlama yönteminin yönergelerini izleyin.
2. Hücre kültürü, transfection ve senkronizasyon
- 1. GÜN. U2OS hücreleri için kültür ortamı hazırlayın: Dulbecco'nun %10 Fetal Sığır Serumu (FBS), %1 Penisilin-Streptomisin ve %1 L-Glutamin (bundan böyle tam büyüme ortamı) ile desteklenmiş Modifiye Kartal Orta (DMEM) kullanın. Alternatif olarak, önceden takviye edilmiş L-Glutaminli DMEM de kullanılabilir.
- Hücreler donmuşsa, bir şişeyi deneylerden en az 8 gün önce (yani 2,5 noktadan itibaren) çözün.
- Hücreleri 37 °C'de memeli hücre kültürlerine adanmış ve %5 CO2'ye sahip bir inkübatörde büyütün. Kirlenmeleri önlemek için inkübatörleri düzenli olarak temizleyin ve sterilize edin.
- Hücreler ~% 80 izdihama ulaştığında:
- Ca2+ ve Mg2+ olmadan steril 1x fosfat tampon salin (PBS) ile kısaca yıkayın.
- Üretici protokolüne göre steril %0,05 Trypsin-EDTA ile hücreleri 1-3 dk inkübatöre yerleştirerek trypsinize hücreleri.
- Tam büyüme medyasının iki katı hacim ekleyerek trypsin inaktive; iyice karıştırın.
- Hücre süspansiyonu 3-5 dakika boyunca 800 x g'da santrifüj.
- Hemositometre kullanarak hücreleri sayın ve ertesi gün oda slaytlarında ~ % 70-80 izdiahta olmaları için uygun seyreltmeyi hesaplayın. Alternatif olarak, canlı hücre görüntüleme için benzer destekler de kullanılabilir.
- Seçilen canlı hücre görüntüleme desteğindeki ilgili hücre hacmini pipetle ve hücreleri ertesi güne kadar inkübatöre geri yerleştirin.
- 2. GÜN. Transfection ile devam edin. Optimum transfeksiyon verimliliği (~%50/80) elde etmek için tercih edilen geçici transeksiyon yöntemleri yönergelerini izleyin. Spesifik bir transfeksiyon yöntemine gerek yoktur. Transeksiyon verimliliğinin kullanılan hücre hattına göre değişebileceğini unutmayın. 48 saat kuluçkaya yaslanın.
NOT: Geçici transeksiyon ihtiyacını atlamak için üç vektörün her birini içeren kararlı klonlar üretin. Bu aşamada iki tür denetim planlanmalıdır. İlk olarak, tam uzunlukta AURKA varlığının mTurquoise2'nin ömrünü etkilemediğini doğrulamak için "yalnızca donör" kontrolü gereklidir. İkinci olarak, kinaz-ölü mutasyonu taşıyan bir biyosensör, FRET'in kaldırıldığı veya önemli ölçüde düşürüldüğü negatif bir kontrol olarak kullanılmalıdır. Kinaz ölü bir mutant alternatif olarak, ATP analog MLN8237 olarak AURKA aktivasyonunun kimyasal inhibitörü negatif kontrol olarak kullanılabilir.- Her biri bağımsız bir kuyuda olmak üzere üç transfeksiyon koşulu önceden planlayın:
"Sadece donör" vektörü (örneğin, AURKA-mTurquoise2)
"Biyosensör" (örneğin, superYFP-AURKA-mTurquoise2)
Bir kinaz-ölü/"K162M" biyosensör (örneğin, superYFP-AURKA K162M-mTurquoise2) veya alternatif olarak, AURKA aktivasyonunun inhibitörü (örneğin, MLN8237) - Her bağımsız donör/alıcı çiftin karşılaştırması için üç koşul gerçekleştirin.
- Eşitlenmemiş ve G2/M senkronize edilmiş hücreleri karşılaştırıyorsanız transfected kuyuların sayısını iki katına çıkarmayı düşünün (bkz. adım 2.6).
- Her biri bağımsız bir kuyuda olmak üzere üç transfeksiyon koşulu önceden planlayın:
- 3. GÜN. G2/M'deki hücreleri senkronize edin. DMSO'da çözünmüş 100 ng/mL nokodazol ekleyin ve her transfected kuyuya ışık maruziyetini önleyin ve 16 saat boyunca kuluçkaya yatın (tercihen bir gecede). Eşitlenmemiş ve G2/M senkronize edilmiş hücreleri karşılaştırıyorsanız, her transfeksiyon durumunu nokodazol veya eşit miktarda DMSO ile tedavi edin. Daha iyi bir senkronizasyon verimliliği için, DMSO'da tek kullanımlık nokodazol aliquots hazırlayın, -20 ° C'de saklayın ve kullandıktan sonra atın.
NOT: Hücre eşitleme verimliliği hücre çizgileri arasında değişebilir. Nokodazolün optimal konsantrasyonu ve kuluçka süresi, FRET/FLIM deneylerinden önce akış sitometrisi yaklaşımları ile deneysel olarak belirlenmelidir. İstatistiksel olarak ilgili FRET/FLIM analizleri için G2/M'de genel hücre popülasyonunun en az %50'si kadar bir senkronizasyon verimliliği öneriyoruz. - 4. GÜN. Mitotik hücrelerde nokodazol yıkama ve FRET/FLIM görüntüleme
- Kültür ortamını bir pipetle çıkarın ve önceden ısıtılmış, steril PBS ile değiştirin. Mümkünse ışığa maruz kalmaktan kaçının. Tabağı hafifçe sallayın.
- Yıkama prosedürünü tekrarlayın, her zaman ışığa maruz kalmaktan kaçının.
- İkinci PBS yıkamayı çıkarın ve %20 Fetal Sığır Serumu (FBS) ve %1 Penisilin-Streptomisin (bundan böyle görüntüleme ortamı) ile desteklenmiş önceden ısıtılmış, steril Leibovitz L-15 ortamı ile değiştirin.
NOT: Görüntüleme ortamı pH göstergesi (örneğin fenol kırmızısı) ve orta bileşenler riboflavin olmadan satın alınmalıdır. Bu maddeler, ömür boyu değerleri bozabilecek bir otofluoresans kaynağıdır. - FRET/FLIM görüntülemeye devam edin. Sıcaklıktaki hızlı değişiklikleri en aza indirin ve mümkün olduğunca hızlı görüntüleme adımına (adım 3) geçin. Numuneyi mikroskop kurulumuna taşırken ışıktan korumayı düşünün (yani alüminyum bir folyoya sararak veya bir kutuya yerleştirerek).
3. FRET/FLIM alımları
NOT: Bu protokoldeki FRET/FLIM alımları, in35 olarak tanımlanan ve 15,17'de olduğu gibi bir kontrol çözümü ile donatılmış özel yapım bir kurulum üzerinde gerçek yapılmıştır (Şekil 2). Kurulum artık Inscoper tarafından ticarileştirildi ve darbeli heyecan için beyaz lazerli bir dönen disk mikroskobundan ve kameranın önünde yüksek hızlı bir zaman kapılı yoğunlaştırıcıdan yapılmıştır. 10 ns'lik bir zaman diliminde 2 ns'lik zamansal kapılar, beş zaman kapılı görüntü yığını elde etmek için ardışık olarak kullanılır. Bu görüntüler daha sonra aşağıdaki denkleme göre piksel piksel ortalama floresan ömrünü hesaplamak için kullanılır: δti = ΔΔti • Δti ith kapısının gecikme süresine karşılık gelirken ben piksel piksel zaman geçişli yoğunluk görüntüsünü gösterir35,36 . Bu yöntem hızlı FLIM ölçümleri sağlar: montaj veya binning adımları gerekmez ve ömür, minimum foton bütçesi ile çevrimiçi modda hesaplanabilir. Sistem ayrıca kullanıcı dostu bir yazılım arayüzü sunar. Bununla birlikte, aynı deney FLIM ölçümleri için donatılmış diğer herhangi bir ticari mikroskop kurulumu altında gerçekleştirilebilir.
- G2/M bloğundaki hücrelerin mitoza en uygun şekilde salınmasını sağlamak için 37 °C'de deneyler yapın. Mümkünse termostatik oda ile donatılmış mikroskop kurulumları ile FRET/FLIM deneyleri gerçekleştirin.
- Deneyden en az 30 dakika ila 1 saat önce mikroskobun termostatik odasını açın.
- Lazeri, kamerayı, mikroskop kurulumunu ve görüntüleme yazılımını çalıştırın (Şekil 2).
- Donör florofor için uygun ekscitasyon ve emisyon dalga boylarını seçin. Uygun dalga boyları seçenekleri şunlardır: mTurquoise2 için φex 440/10 nm ve φem 483/35 nm (Şekil 3A); GFP için φex 488/10 nm ve φem 525/50 nm(Şekil 3B).
- Pozlama süresini genellikle 30 ila 100 ms arasında ayarlayın (Şekil 3). Aşırı lazer gücünün fotobleaching olarak indüklenmiş fototoksik etkilere neden olabileceğine dikkat edin, bu da floresan ömrünü değiştirebilir37. Kurulumda, zaman atlamalı alımlar sırasında ilk kapının floresan yoğunluğunu izleyerek fotobleaching olaylarının yokluğunu doğrulayın. Floresan yoğunluğundaki değişimler gözlenebilirse, alımı atın ve lazer gücünü ayarlayın.
NOT: Buradaki kurulumda, ilk kapıda en az 3000 gri düzeye izin verilen bir pozlama süresi seçin; aksi takdirde yazılım donör ömrünü hesaplamaz. Bu gri düzey değeri, ilgili yaşam değerleri elde etmek için gereken minimum foton bütçesine karşılık gelir. - FRET/FLIM kazanımlarını başlatmadan önce, bipolar iğlerin ortaya çıkmasını bekleyerek hücrelerin mitoza girdiğinden emin olun (U2OS hücrelerinde ~ 20/30 dk). Mitotik AURKA esas olarak bu yapıda lokalize olduğundan, iğlerin doğrudan mikroskop altındaki hücrelerde oluşumunu harici bir ışık kaynağı ile tarayarak mitotik ilerlemeyi doğrulayın (Şekil 1). Mitotik ilerleme için gereken sürenin kullanılan hücre satırına göre değişebileceğini unutmayın.
- MLN8237 ile tedavi planlanıyorsa, hücreleri mikroskop altına yerleştirin ve metafaza ulaşmalarına izin verin (nokodazol yıkamadan yaklaşık 20 dakika sonra). DMSO'da çözünmüş 250 nM MLN8237'yi hem donör yapıyı ifade eden hücrelere hem de biyosensörü ifade eden hücrelere ekleyin.
- Yukarıdaki gibi transfected hücreler üzerinde bu durumu kontrol edin ve eşit miktarda DMSO ile kuluçkaya yaslanın. Daha iyi bir AURKA inhibisyonu için, DMSO'da MLN8237'nin tek kullanımlık aliquotlarını hazırlayın, -80 ° C'de saklayın. Aliquotları buza yerleştirerek çözün ve kullandıktan sonra atın.
- 10 dakika kuluçkaya yaslanın. Bu süreden sonra, mitotik iğ küçülür ve sadece tek, yoğun bir nokta kalır. K162M mutantları kullanıldığında da benzer bir fenotip gözlenir.
- Mitotik iğdenin daha iyi çözülmesi için en az 63x hedef kullanın (Şekil 3).
- Metafazda bir hücre bulunduktan sonra (bkz. Şekil 4 metafazdaki bir hücre örneği olarak), xyz koordinatlarını görüş alanının ortasına yerleştirmek için ayarlayın.
- Daha hızlı görüntüler için tek bir z düzlemi seçin. Mitotik milin daha görünür veya yoğun olduğu düzlemi seçin.
- Kaydı başlatın. Alım süresi kullanılan FLIM kurulumuna göre değişebilir (birkaç saniyeden en aza kadar). Piyasada bulunan ticari kurulumların çoğu, hem floresan mikrografisini hem de piksel piksel yaşam haritasını detaylandıracaktır. Her iki görüntü de kaydedin.
- Her transfection ve/veya tedavi durumundan en az 10 bağımsız görüntü elde edin.
4. ΔLifetime'ın hesaplanması ve donör/alıcı çiftler arasında FLIM değerlerinin karşılaştırılması
- Piksel piksel yaşam boyu haritanın tamamından (yani, tüm mitotik mil) ömür boyu değerleri ayıklayın veya belirli alt bölgelere karşılık gelen ilgi alanlarını (ROI) seçin.
NOT: Kullanılan FRET/FLIM kurulumuna göre, ömür boyu hesaplamalar doğrudan satın alma yazılımı üzerinde yapılabilir veya genel görüntü işleme çözümleriyle (örneğin, Fiji/ImageJ: https://fiji.sc/) çıkarılabilir. Yaşam boyu değerleri doğrudan hesaplayan yazılım ( çevrimiçi mod olarak da bilinir), yeni başlayanlar ve FRET / FLIM'e tam olarak aşina olmayan mikroskopi kullanıcıları için uygun olan daha kullanıcı dostu bir çözüm sunar. Aksine, edinimden sonra ömür boyu değerlerin çıkarılması genellikle uygun bir prosedür gerektirir. Bu seçenek yeni başlayanlar için daha az erişilebilirdir, çünkü matematiksel montaj modelleri hakkında daha önceki bazı bilgiler gereklidir. - Görselleştirildikten veya çıkarıldıktan sonra, "yalnızca donör" vektörünü (örneğin, AURKA-mTurquoise2) ifade eden hücrelerin ortalama ömrünü hesaplayın, bu da donör ömrü anlamına gelir.
- 4.1 adımında hesaplanan her bağımsız yaşam süresi değerini ortalama donör ömründen çıkarın. Analiz edilen tüm koşullarda tüm hücreler için bu adımın tekrarlanması, her durum için ΔLifetime verecektir.
- "Yalnızca donör", "biyosensör" ve "K162M" veya DMSO ve MLN8237 koşulları için ΔLifetime değerlerini karşılaştırın.
NOT: "Yalnızca donör" durumu için, ΔLifetime sıfıra yakın ve ömür boyu değerlerin deneysel dalgalanmalarına karşılık gelen değerlerle sonuçlanmalıdır. "Biyosensör" koşulu için, ΔLifetime değerleri iki yapı arasındaki net farkı vermelidir (resimli bir örnek için Şekil 4'e bakın). - ΔLifetime değerlerini farklı donör/alıcı çiftler arasında karşılaştırın.
- "Biyosensör" koşullarını karşılaştırın: benzer ΔLifetime gösteriyorlar mı?
- "K162M" veya MLN8237 koşulları aralarında benzer ΔLifetime gösteriyor mu? ΔLifetime'ları "yalnızca donör" durumuna benzer mi?
Sonuçlar
Farklı spektral özelliklere sahip iki biyosensör kullanarak Thr288'de AURKA'nın otofosforilasyonunu kaydetmek için yukarıda açıklanan prosedürü izledik. İlk GFP-AURKa-mCherry probu14'i farklı spektral özelliklere sahip iki biyosensörle karşılaştırdık. Bu iki prob, floresan donör mTurquoise2'ye ve bir durumda floresan olmayan bir alıcıya (ShadowG) veya ikinci bir durumda sarı bir alıcıya (superYFP) dayanır. Daha sonra her donör/alıcı çiftine tam uzunlukta AURKA dizisini ekledik. AURKA aktivasyonu için negatif kontrole sahip olmak için iki strateji izlenebilir. İlk olarak, küçük bir ATP-analog (MLN8237) kullanımı, kinazın kinetik cebine ATP'nin bağlanmasını engeller ve aktivasyonunu önler38. İkincisi, Lys162'nin Met'e (K162M) mutasyonu, her biyosensörün 14,15,39'u aktive edemeyen kinaz ölü bir versiyonunu oluşturur. Bu mutasyon, normalde Lys162 ve Glu181 arasında kurulan bir tuz köprüsünün bozulmasına neden olur, bu da kinazın kinetik cebinin istikrarlı bir şekilde açılmasına neden olur ve genel inaktivasyonunu tetikler40. FRET için negatif bir kontrol olarak, kabul edici-devoid bir yapı (GFP-AURKA veya AURKA-mTurquoise2) kullandık.
G2/M'deki hücreleri senkronize ettikten ve mitoza salduktan sonra, mitotik mildeki tüm transfected yapıların ömrünü ölçtük (Şekil 4). Not olarak, bu yapı bir bütün olarak kabul edildi ve mil içindeki hiçbir ROI analiz edildi. Daha sonra tüm koşullar için ΔLifetime'ı hesapladık. Beklendiği gibi, GFP-AURKA veya AURKA-mTurquoise2'nin ömrü ("yalnızca donör" koşulları) 0'a yakındı, bu da bu yapılar için ölçülen değerlerin ortalama değer etrafında dalgalandığını gösteriyordu (Şekil 4A,4B). Buna karşılık, GFP-AURKA-mCherry için ΔLifetime değerleri istatistiksel olarak yalnızca donör durumundan farklıydı ve ΔLifetime ~130 ps arttı (Şekil 4A). Benzer gözlemler shadowG-AURKA-mTurquoise2 ve superYFP-AURKA-mTurquoise2 için de yapılmıştır ve ΔLifetime'ın sadece donör durumundan sırasıyla ~150 ve ~220 ps arttığı (Şekil 4B,4C). Bu veriler, sahte renk arama tablosu (LUT) ile tek hücrelerde kolayca görselleştirilebilir. Bu durumda, ΔLifetime'ın 0 civarındaki değerleri sahte renkte sarı iken, daha önemli farklılıklar sahte renkte kırmızı/mordur. Gerçekten de, piksel piksel LUT, yalnızca donör yapılarını ifade eden hücrelerde sarıya daha yakınken, biyosensörü ifade eden hücrelerde kırmızı / mor spektrumda daha fazlaydı (Şekil 4A,4B). Bu durum, GFP-AURKA-mCherry biyosensörü mln8237 farmakolojik inhibitörü ile tedavi edildiğinde de gözlenmiştir.
Daha sonra kinaz ölü biyosensörlerinin ΔLifetime'ını analiz ettik. Bu yapılar ara ΔLifetime değerlerini gösterdi: ΔLifetime, yalnızca donör durumuna kıyasla önemli ölçüde daha yüksekti (Şekil 4B,4C), ancak normal benzerlerinden de önemli ölçüde daha düşüktü (Şekil 4B,4D). MLN8237 ile tedavi edilen veya kinaz ölü biyosensörlerini ifade eden hücrelerle yapılan karşılaştırmalar, her donör/alıcı çift için ΔLifetime varyasyonlarının yalnızca AURKA'nın aktivasyonuyla bağlantılı olup olmadığını tahmin etmek için gereklidir. GFP-AURKA-mCherry durumunda, AURKA'ya özgü bir inhibitör kullanıldığında ΔLifetime varyasyonları ortadan kalkmaktadır. Tersine, ΔLifetime varyasyonları çoğunlukla, ancak shadowG-AURKA-mTurquoise2 ve superYFP-AURKA-mTurquoise2 durumunda sadece AURKA aktivasyonu ile bağlantılı değildir.
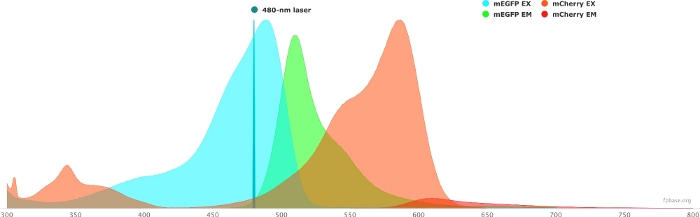
Şekil 1: GFP (donör) ve mCherry (alıcı) ekscitasyon ve emisyon spektrumu.
Spectra, FP temel web sitesinden (https://www.fpbase.org/) elde edildi ve uyarlandı ve 480 nm lazer uyarlamaya göre ayarlandı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Deneysel çalışma alanının görüntüsü.
(1) Kontrol çözümü; (2) beyaz lazer kaynağı; (3) CCD kamera; (4) mikroskop kurulumu; (5) numunenin oküler taraması için harici ışık kaynağı / lamba. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
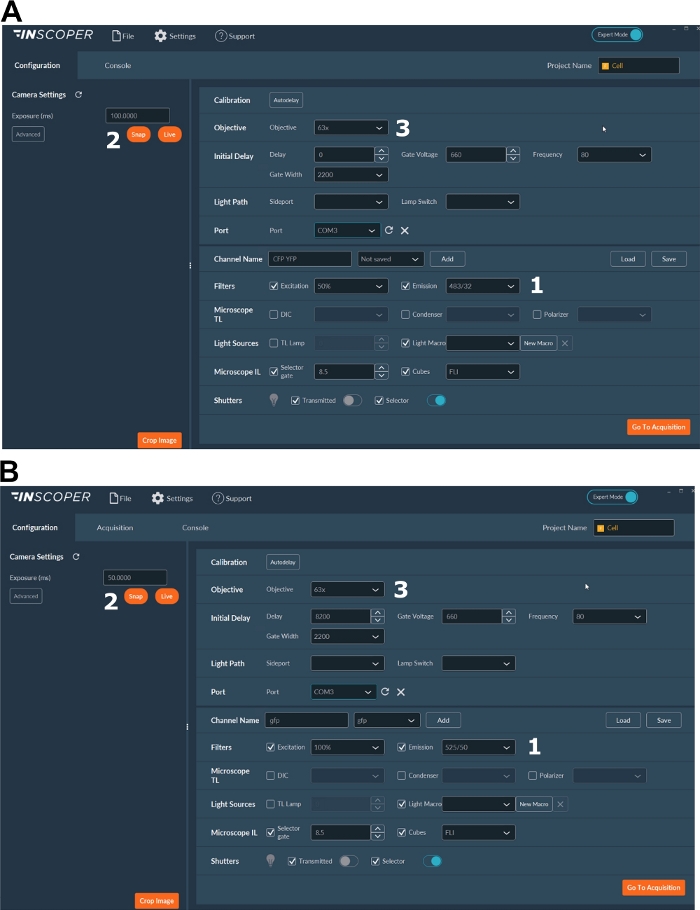
Şekil 3: FLIM alımı için yazılımın temsili görüntüleri.
(A, B) (1) donör için heyecan ve emisyon parametreleri ( A'da CFP veya B'de GFP); (2) pozlama süresi; (3) hedefin seçimi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
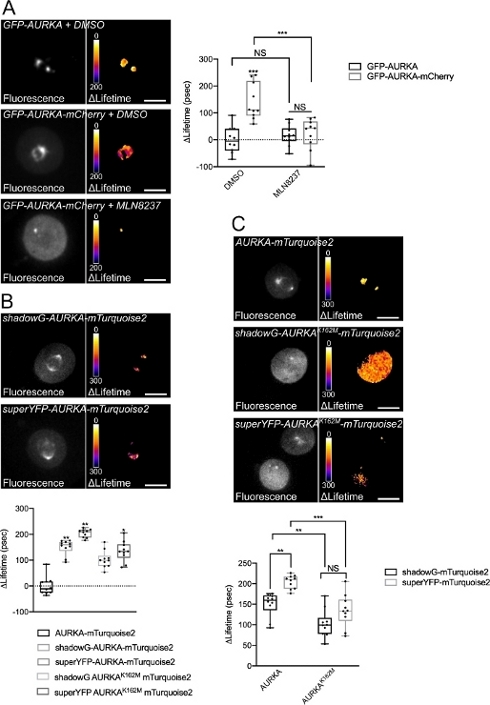
Şekil 4: AURKA FRET biyosensörlerinin temsili görüntüleri ve negatif kontrolleri.
(A) (Mikrograflar) Floresan (yeşil kanal) ve GFP-AURKA veya GFP-AURKA-mCherry'yi ifade eden U2OS hücrelerinin ilgili piksel piksel ΔLifetime'ı (yalnızca donör – biyosensör), G2/M'de senkronize edilir, bipolar mil görünene kadar serbest bırakılır ve daha sonra DMSO veya MLN8237 ile tedavi edilir. ΔLifetime sahte renk ölçeği ("Ateş" arama tablosu) ile gösterilmiştir. (Grafik) Belirtilen koşullar için karşılık gelen niceleme ve iki yönlü ANOVA analizi. (B) (Mikrografiler) Floresan (camgöbeği kanalı) ve gölgeyi ifade eden U2OS hücrelerinin ilgili piksel piksel ΔLifetime 'ı (yalnızca donör – biyosensör) shadowG-AURKA-mTurquoise2 (üst panel) veya superYFP-AURKA-mTurquoise2 (alt panel), G2/M'de senkronize edilir ve iki kutuplu mil görünene kadar serbest bırakılır. ΔLifetime sahte renk ölçeği ("Ateş" arama tablosu) ile gösterilmiştir. (Grafik) Yukarıdaki mikrograflarda temsil edilen koşulların ilgili nicelleştirilmesi ve tek yönlü ANOVA analizi. (C) (Mikrograflar) AURKA-mTurquoise2 (üst panel), shadowG-AURKA K162M-mTurquoise2 (orta panel) ve superYFP-AURKA K162M-mTurquoise2'nin görüntüleri mikrograflarda olduğu gibi elde edildi ve temsil edildi. (Grafik) Belirtilen transeksiyon koşulları için iki yönlü ANOVA analizi. Boxplots çubuk ortanca temsil eder; bıyıklar min'den maks. n = bir temsili deneyin (üç) durumu başına 10 hücreye kadar uzanır. Tek tek değerler nokta olarak temsil edilir. Ölçek çubuğu: 10 μm. *P < 0,05, **P < 0,01, ***P < 0,001 (A) içinde belirtilen her koşula karşı (B) ve (C) içinde belirtilen her duruma karşı. NS: önemli değil. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Genetik olarak kodlanmış FRET biyosensörleri, tek proteinlerin veya tüm sinyal yollarının aktivasyonunu ölçmek için güvenilir araçlardır41. Özellikle, AURKA FRET biyosensörü, kinazın zaman ve mekanda aktivasyonunu keşfetmenin tercihli bir yolunu oluşturur. Bununla birlikte, bazı unsurlar bir FRET biyosensör tasarlarken veya optimize ederken, sadece genel anlamda değil, daha spesifik olarak AURKA için özel ilgiyi hak eder.
İlk olarak, donör/alıcı FRET çiftinin niteliği ve göreceli konumu bu kinazın belirli işlevlerine uyarlanabilir. AURKA, mitoz sırasında mitotik iğdede büyük ölçüde zenginleştirilmiştir, ancak hücre döngüsü boyunca ve farklı hücre altı yerlerde (örneğin, centrosomes, çekirdek ve mitokondri)1,2 bulunur. Biyosensör, asidik pH'a ulaşabilen mitokondri gibi belirli bölmelerde kullanılacaksa, mTurquoise2/shadowG olarak pH duyarsız donör-alıcı FRET çifti seçimi yapılmalıdır. Ayrıca, FRET donörün C-terminusuna yerleştirilmesi, biyosensörün bu hücre altı bölmesinde daha iyi bir şekilde görselleştirilmesine izin verebilir ve hatta AURKA N-terminus'un mitokondri16,42'de kısmen parçalandığının gösterildiği göz önüne alındığında FRET tespitini optimize edebilir.
İkincisi, AURKA FRET biyosensörünü optimize etmenin henüz keşfedilmemiş bir yolu, tam uzunlukta AURKA ve donör / alıcı çifti arasındaki bağlayıcıların daha dikkatli bir şekilde tasarlanmasını gerektirecektir. Sadece floresan çifti arasındaki mesafe değil, aynı zamanda bağlayıcının kendisinin özellikleri de FRET verimliliğini artırmak için temel faktörler olarak gösterildi43,44,45,46. Bu ışıkta, bağlayıcının sertliğini veya esnekliğini artırmak FRET verimliliğine zarar verebilir veya daha da iyileştirebilir.
Üçüncü olarak, AURKA'nın aşırı ifadesinin hücrelerin önemli bir kısmında mitotik iğ anormalliklerine neden olduğu bilinmektedir2. Memeli ekspresyon vektörlerinde bulunan en yaygın promotörlerden biri olan sitomegalovirüs (CMV) gibi güçlü bir promotör altında veya AURKA minimal promotör dizisi (CTTCCGG)14,47 altında aynı FRET yapıyı ifade ederek elde edilen ΔLifetime'ı karşılaştırmak ilginç olacaktır. Bu organizatörün daha önce kinazın devrilmesinden sonra ortaya çıkan tekelci veya çok kutuplu iğleri kurtardığı gösterildi ve kullanımı se14,47 başına hücre döngüsü pertürbasyonlarına neden olmadı. FLIM protein ekspresyon seviyelerine ve hücredeki göreceli konsantrasyonlara karşı duyarsız olsa da11, aynı biyosensör kurulumundaki iki promotörün kapsamlı bir karşılaştırmasından yararlanmak, herhangi bir yerdeki aktif AURKA havuzunun anlaşılmasını genişletecektir. Buna ek olarak, epitel ve hematolojik kanser paradigmaları için geçerli olan aşırı ifade üzerine AURKA aktivasyonunun nasıl değişebileceği hakkında yeni içgörüler sağlayacaktır.
Son olarak, aşağı akış FRET uygulaması da dikkate alınmalıdır. AURKA alanında gelecekteki bir bakış açısı, kinaz konformasyonal biyosensörü substrat bazlı bir biyosensörle bir araya getirmek olacaktır. İki biyosensörün FRET davranışını aynı anda analiz etmek - multipleks FRET olarak bilinen bir süreç - ikinci donör kanalında spektral kanamayı önlemek için ilk biyosensörde koyu renkli bir alıcı gerektirir. AURKA bağlamında, bu, kinazın ilk biyosensörle aktivasyonunu ve ikincisiyle belirli bir substrata doğru enzymatic aktivitesini tespit etmenin heyecan verici yeni perspektifini açacaktır. Çoklamadaki son gelişmeler artık aynı anda en fazla üç biyosensöre izin veriyor48. Benzer bir yöntemin AURKA bağlamında uygulanması, sadece kinazın aktivasyon etkinliği etkileşimini test etmek için değil, aynı zamanda AURKA sinyal basamaklarını benzeri görülmemiş mekansal çözünürlükle keşfetmek için de çok umut verici bir stratejiyi temsil edebilir.
Sonuç olarak, FRET/FLIM protein aktivitesi hakkındaki bilgileri derinleştirmek için uygun bir yoldur. Bir yandan, en az bir floresan moiety sayesinde, canlı hücrelerde belirli bir proteinin lokalizasyonunu görselleştirmeye izin verir. Öte yandan, protein aktivasyonu ve/veya aktivitesi hakkında bilgilendirici olabilecek protein konformasyon değişikliklerini çözebilir. Bu nedenle, FRET/FLIM ve konformasyonsal FRET biyosensörleri, canlı hücrelerde sinyal yollarını takip etmek için yaygın yöntemler haline gelme potansiyeline sahiptir ve enfes mekansal çözünürlüktedir.
Açıklamalar
G.B. deneyleri gerçekleştirdi, makaleyi yazıp inceledi ve fon sağladı, M.T. makaleyi inceledi ve destek sağladı. Bu yazıda gösterilen hızlı FLIM ölçümleri için çözümler üreten Inscoper şirketinin (Fransa) bilimsel danışmanı ve hissedarı olan M.T. Inscoper makalenin Açık Erişim yayınını kısmen destekledi. Inscoper deneysel tasarım, veri işleme veya makalenin yazımında yer almadı.
Teşekkürler
Mikroskopi-Rennes Görüntüleme Merkezi (MRic, BIOSIT, Rennes, Fransa) mühendislerine tavsiye ve yardım için ve özellikle X. Pinson'a makalenin eleştirel okuması için teşekkür ederiz. MRic, Fransız Ulusal Araştırma Ajansı (ANR-10-INBS-04) tarafından desteklenen Ulusal Altyapı France-BioImaging'in üyesidir. Bu çalışma Centre National de la Recherche Scientifique (CNRS), Ligue Contre le Cancer Comités d'Ille et Vilaine, des Côtes d'Armor et du Finistère ve Association pour la Recherche Contre le Cancer (ARC) tarafından G.B.'ye desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Alisertib (MLN8237) | SelleckChem | S1133 | Use at a 250 nM final dilution |
| Dulbecco's Modified Eagle Medium (DMEM) | ThermoFischer Scientific Brand: Gibco | 41966052 | High glucose + L-glutamine + Sodium pyruvate |
| Fetal Bovine Serum (FBS) | ThermoFischer Scientific Brand: Gibco | 10270106 | |
| L15 | ThermoFischer Scientific Brand: Gibco | 21083027 | Leibovitz's L15 medium + L-glutamine, no Phenol red |
| LabTek | Nunc | 2515380 | |
| Nocodazole | Merck Brand: Sigma-Aldrich | M1404 | Use at a 100 ng/mL final dilution |
| Penicillin/Streptomycin | ThermoFischer Scientific Brand: Gibco | 15140122 | Penicillin-Streptomycin 10,000 U/mL (100x) |
| Phosphate Buffer Saline (PBS) | ThermoFischer Scientific Brand: Gibco | 14190169 | DPBS, no calcium, no magnesium |
| Trypsin/EDTA | ThermoFischer Scientific Brand: Gibco | 25300096 | Trypsin-EDTA 0.05%, Phenol Red (1x) |
Referanslar
- Bertolin, G., Tramier, M. Insights into the non-mitotic functions of Aurora kinase A: more than just cell division. Cellular and Molecular Life Sciences. , (2019).
- Nikonova, A. S., Astsaturov, I., Serebriiskii, I. G., Dunbrack, R. L., Golemis, E. A. Aurora A kinase (AURKA) in normal and pathological cell division. Cellular and Molecular Life Sciences. 70 (4), 661-687 (2013).
- Walter, A. O., Seghezzi, W., Korver, W., Sheung, J., Lees, E. The mitotic serine/threonine kinase Aurora2/AIK is regulated by phosphorylation and degradation. Oncogene. 19 (42), 4906-4916 (2000).
- Cheetham, G. M. T. Crystal Structure of Aurora-2, an Oncogenic Serine/Threonine Kinase. Journal of Biological Chemistry. 277 (45), 42419-42422 (2002).
- Bayliss, R., Sardon, T., Vernos, I., Conti, E. Structural basis of Aurora-A activation by TPX2 at the mitotic spindle. Molecular Cell. 12 (4), 851-862 (2003).
- Zhang, Y., et al. Identification of the auto-inhibitory domains of Aurora-A kinase. Biochemical and Biophysical Research Communications. 357 (2), 347-352 (2007).
- Littlepage, L. E., Wu, H., Andresson, T., Deanehan, J. K., Amundadottir, L. T., Ruderman, J. V. Identification of phosphorylated residues that affect the activity of the mitotic kinase Aurora-A. Proceedings of the National Academy of Sciences of the United States of America. 99 (24), 15440-15445 (2002).
- Kufer, T. A., et al. Human TPX2 is required for targeting Aurora-A kinase to the spindle. The Journal of Cell Biology. 158 (4), 617-623 (2002).
- Eyers, P. A., Erikson, E., Chen, L. G., Maller, J. L. A novel mechanism for activation of the protein kinase Aurora A. Current Biology. 13 (8), 691-697 (2003).
- Brunet, S., et al. Characterization of the TPX2 Domains Involved in Microtubule Nucleation and Spindle Assembly in Xenopus Egg Extracts. Molecular Biology of the Cell. 15 (12), 5318-5328 (2004).
- Padilla-Parra, S., Tramier, M. FRET microscopy in the living cell: Different approaches, strengths and weaknesses. BioEssays. 34 (5), 369-376 (2012).
- Aoki, K., Kamioka, Y., Matsuda, M. Fluorescence resonance energy transfer imaging of cell signaling from in vitro to in vivo: Basis of biosensor construction, live imaging, and image processing. Development, Growth & Differentiation. 55 (4), 515-522 (2013).
- Fuller, B. G., et al. Midzone activation of aurora B in anaphase produces an intracellular phosphorylation gradient. Nature. 453 (7198), 1132-1136 (2008).
- Bertolin, G., et al. A FRET biosensor reveals spatiotemporal activation and functions of aurora kinase A in living cells. Nature Communications. 7, 12674 (2016).
- Bertolin, G., et al. Optimized FRET Pairs and Quantification Approaches To Detect the Activation of Aurora Kinase A at Mitosis. ACS Sensors. 4 (8), 2018-2027 (2019).
- Bertolin, G., et al. Aurora kinase A localises to mitochondria to control organelle dynamics and energy production. eLife. 7, (2018).
- Sizaire, F., Le Marchand, G., Pécréaux, J., Bouchareb, O., Tramier, M. Automated screening of AURKA activity based on a genetically encoded FRET biosensor using fluorescence lifetime imaging microscopy. Methods and Applications in Fluorescence. 8 (2), 024006 (2020).
- Demeautis, C., et al. Multiplexing PKA and ERK1&2 kinases FRET biosensors in living cells using single excitation wavelength dual colour FLIM. Scientific Reports. 7, 41026 (2017).
- Ringer, P., et al. Multiplexing molecular tension sensors reveals piconewton force gradient across talin-1. Nature Methods. 14 (11), 1090-1096 (2017).
- Nagai, T., Yamada, S., Tominaga, T., Ichikawa, M., Miyawaki, A. Expanded dynamic range of fluorescent indicators for Ca(2+) by circularly permuted yellow fluorescent proteins. Proceedings of the National Academy of Sciences of the United States of America. 101 (29), 10554-10559 (2004).
- Klarenbeek, J., Goedhart, J., van Batenburg, A., Groenewald, D., Jalink, K. Fourth-Generation Epac-Based FRET Sensors for cAMP Feature Exceptional Brightness, Photostability and Dynamic Range: Characterization of Dedicated Sensors for FLIM, for Ratiometry and with High Affinity. PLOS ONE. 10 (4), 0122513 (2015).
- Fritz, R. D., et al. A Versatile Toolkit to Produce Sensitive FRET Biosensors to Visualize Signaling in Time and Space. Science Signaling. 6 (285), (2013).
- Mastop, M., et al. Characterization of a spectrally diverse set of fluorescent proteins as FRET acceptors for mTurquoise2. Scientific Reports. 7 (1), 11999 (2017).
- vander Krogt, G. N. M., Ogink, J., Ponsioen, B., Jalink, K. A Comparison of Donor-Acceptor Pairs for Genetically Encoded FRET Sensors: Application to the Epac cAMP Sensor as an Example. PLoS ONE. 3 (4), 1916 (2008).
- Cranfill, P. J., et al. Quantitative assessment of fluorescent proteins. Nature Methods. 13 (7), 557-562 (2016).
- Goedhart, J., et al. Structure-guided evolution of cyan fluorescent proteins towards a quantum yield of 93. Nature Communications. 3 (1), (2012).
- Mérola, F., et al. Newly engineered cyan fluorescent proteins with enhanced performances for live cell FRET imaging. Biotechnology Journal. 9 (2), 180-191 (2014).
- Erard, M., et al. Minimum set of mutations needed to optimize cyan fluorescent proteins for live cell imaging. Molecular BioSystems. 9 (2), 258-267 (2013).
- Tramier, M., Zahid, M., Mevel, J. C., Masse, M. J., Coppey-Moisan, M. Sensitivity of CFP/YFP and GFP/mCherry pairs to donor photobleaching on FRET determination by fluorescence lifetime imaging microscopy in living cells. Microscopy Research and Technique. 69 (11), 933-939 (2006).
- Padilla-Parra, S., et al. Quantitative Comparison of Different Fluorescent Protein Couples for Fast FRET-FLIM Acquisition. Biophysical Journal. 97 (8), 2368-2376 (2009).
- Burgstaller, S., et al. pH-Lemon, a Fluorescent Protein-Based pH Reporter for Acidic Compartments. ACS Sensors. , (2019).
- Bindels, D. S., et al. mScarlet: a bright monomeric red fluorescent protein for cellular imaging. Nature Methods. 14 (1), 53-56 (2016).
- Murakoshi, H., Shibata, A. C. E., Nakahata, Y., Nabekura, J. A dark green fluorescent protein as an acceptor for measurement of Förster resonance energy transfer. Scientific Reports. 5, 15334 (2015).
- Murakoshi, H., Shibata, A. C. E. ShadowY: a dark yellow fluorescent protein for FLIM-based FRET measurement. Scientific Reports. 7 (1), 6791 (2017).
- Leray, A., Padilla-Parra, S., Roul, J., Héliot, L., Tramier, M. Spatio-Temporal Quantification of FRET in living cells by fast time-domain FLIM: a comparative study of non-fitting methods [corrected]. PloS One. 8 (7), 69335 (2013).
- Padilla-Parra, S., Audugé, N., Coppey-Moisan, M., Tramier, M. Quantitative FRET analysis by fast acquisition time domain FLIM at high spatial resolution in living cells. Biophysical Journal. 95 (6), 2976-2988 (2008).
- Song, L., Hennink, E. J., Young, I. T., Tanke, H. J. Photobleaching kinetics of fluorescein in quantitative fluorescence microscopy. Biophysical Journal. 68 (6), 2588-2600 (1995).
- Manfredi, M. G., et al. Characterization of Alisertib (MLN8237), an investigational small-molecule inhibitor of aurora A kinase using novel in vivo pharmacodynamic assays. Clinical Cancer Research: An Official Journal of the American Association for Cancer Research. 17 (24), 7614-7624 (2011).
- Katayama, H., et al. Phosphorylation by aurora kinase A induces Mdm2-mediated destabilization and inhibition of p53. Nature Genetics. 36 (1), 55-62 (2004).
- Nowakowski, J., et al. Structures of the Cancer-Related Aurora-A, FAK, and EphA2 Protein Kinases from Nanovolume Crystallography. Structure. 10 (12), 1659-1667 (2002).
- Palmer, A. E., Qin, Y., Park, J. G., McCombs, J. E. Design and application of genetically encoded biosensors. Trends in Biotechnology. 29 (3), 144-152 (2011).
- Grant, R., et al. Constitutive regulation of mitochondrial morphology by Aurora A kinase depends on a predicted cryptic targeting sequence at the N-terminus. Open Biology. 8 (6), 170272 (2018).
- Shimozono, S., Miyawaki, A. Engineering FRET Constructs Using CFP and YFP. Methods in Cell Biology. 85, 381-393 (2008).
- Komatsu, N., et al. Development of an optimized backbone of FRET biosensors for kinases and GTPases. Molecular Biology of the Cell. 22 (23), 4647-4656 (2011).
- Schifferer, M., Griesbeck, O. A Dynamic FRET Reporter of Gene Expression Improved by Functional Screening. Journal of the American Chemical Society. 134 (37), 15185-15188 (2012).
- Peroza, E. A., Boumezbeur, A. H., Zamboni, N. Rapid, randomized development of genetically encoded FRET sensors for small molecules. Analyst. 140 (13), 4540-4548 (2015).
- Reboutier, D., et al. Aurora A is involved in central spindle assembly through phosphorylation of Ser 19 in P150Glued. The Journal of Cell Biology. 201 (1), 65-79 (2013).
- Mo, G. C. H., Posner, C., Rodriguez, E. A., Sun, T., Zhang, J. A rationally enhanced red fluorescent protein expands the utility of FRET biosensors. Nature Communications. 11 (1), 1848 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır