A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
إعداد جسيمات نانوية سبائك الفضة-البلاديوم للحفز بلازمونيك تحت الإضاءة الضوئية المرئية
In This Article
Summary
هنا هو بروتوكول لتركيب الفضة البلاديوم (Ag-Pd) سبائك الجسيمات النانوية (NPs) معتمدة على ZrO2 (Ag-Pd/ZrO2). يسمح هذا النظام بحصاد الطاقة من التشعيع الضوئي المرئي لتسريع التحولات الجزيئية والتحكم فيها. ويتجلى ذلك في تخفيض النيتروبزين في إطار التشعيع الخفيف الذي حفزه Ag-Pd/ZrO2 NPs.
Abstract
يمكن لـ 20000000000000000000000000000000000000000000000000 (LSPR) في جسيمات نانوية (NPs) تسريع والسيطرة على الانتقائية في مجموعة متنوعة من التحولات الجزيئية. وهذا يفتح إمكانيات لاستخدام الضوء المرئي أو القريب من الأشعة تحت الحمراء كمدخلات مستدامة لدفع والسيطرة على ردود الفعل عندما تستخدم الجسيمات النانوية plasmonic التي تدعم إثارة LSPR في هذه النطاقات كمحفزات. للأسف، ليس هذا هو الحال بالنسبة للعديد من المعادن الحفازة مثل البلاديوم (Pd). وتتمثل إحدى الاستراتيجيات للتغلب على هذا القيد في استخدام مصادر وطنية ثنائية الفلزات تحتوي على معادن بلاسامونية وحفازة. في هذه الحالة، يمكن لإثارة LSPR في المعدن plasmonic المساهمة في تسريع والسيطرة على التحولات التي يقودها المكون الحفاز. تركز الطريقة المذكورة هنا على تركيب ثنائي الفلزات الفضة البلاديوم (Ag-Pd) NPs المعتمدة على ZrO2 (Ag-Pd/ZrO2) التي تعمل كنظام تحفيزي plasmonic. وقد أُعدت هذه البرامج عن طريق المشاركة في تعبئة السلائف المعدنية المقابلة على دعم ZrO2، ثم أعقب ذلك خفض متزامن يؤدي إلى تشكيل مصادر معدنية ثنائية الفلزات مباشرة على دعم ZrO2. ثم استخدمت الـ Ag-Pd/ZrO2 NPs كمحفّزات بلازمونية للحد من النيتروبزين تحت 425 نانومتر من خلال مصابيح LED. باستخدام الكروماتوغرافيا الغاز (GC)، يمكن رصد تحويل وانتقائية تفاعل الحد في ظل ظروف التشعيع المظلمة والضوء، مما يدل على الأداء الحفاز المعزز والسيطرة على الانتقائية تحت الإثارة LSPR بعد السبائك غير plasmonic Pd مع Plasmonic المعادن Ag. ويمكن تكييف هذه التقنية مع مجموعة واسعة من التحولات الجزيئية وتكوينات مصادر القدرة الوطنية، مما يجعلها مفيدة لتوصيف النشاط الحفاز البلازموني لأنواع مختلفة من الحفز من حيث التحويل والانتقائية.
Introduction
من بين العديد من التطبيقات للجسيمات النانوية المعدنية (NPs) ، الحفز يستحق اهتماما خاصا. الحفز يلعب دورا محوريا في مستقبل مستدام، والمساهمة في استهلاك أقل للطاقة، واستخدام أفضل للمواد الخام، وتمكين ظروف رد فعل أنظف1،2،3،4. وبالتالي، يمكن أن يوفر التقدم في التحفيز أدوات لتعزيز الكفاءة الذرية للعمليات الكيميائية، وجعلها أنظف وأكثر قابلية للحياة من الناحية الاقتصادية وأكثر ملاءمة للبيئة. NPs المعدنية التي تشمل الفضة (Ag) ، والذهب (الاتحاد الافريقي) أو النحاس (Cu) يمكن عرض خصائص بصرية مثيرة للاهتمام في نطاق مرئي التي تنشأ من الطريقة الفريدة هذه النظم تتفاعل مع الضوء في النانو عبر سطح محلي الرنين plasmon (LSPR) الإثارة5،6،7،8. في هذه NPs ، ويشار إلى NPs plasmonic ، وLSPR يضم التفاعل الرنانة بين الفوتونات الحادث (من موجة الكهرومغناطيسية واردة) مع الحركة الجماعية للإلكترونات5،6،7،8. هذه الظاهرة تجري على تردد مميز يعتمد على حجم وشكل وتكوين وثابت عازل للبيئة9،10،11. على سبيل المثال ، لAg ، Au ، و Cu ، يمكن أن تتراوح هذه الترددات من المرئية إلى الأشعة تحت الحمراء القريبة ، مما يفتح إمكانيات لاستخدام الطاقة الشمسية لإثارة LSPR5،6،7،8،12،13.
في الآونة الأخيرة ، وقد ثبت أن الإثارة LSPR في NPs plasmonic يمكن أن تسهم في تسريع معدلات والسيطرة على الانتقائية من التحولات الجزيئية5،14،15،16،17،18،19. هذا أعطى ولادة حقل يسمى الحفز البلازمونية، والتي تركز على استخدام الطاقة من الضوء لتسريع، محرك و / أو التحكم في التحولات الكيميائية5،14،15،16،17،18،19. في هذا السياق، وقد ثبت أن الإثارة LSPR في NPs plasmonic يمكن أن يؤدي إلى تشكيل الإلكترونات الساخنة النشطة والثقوب، ويشار إلى ناقلات ساخنة متحمس LSPR. هذه الناقلات يمكن أن تتفاعل مع الأنواع الممتزة من خلال تنشيط الالكترونية أو الاهتزازية15،16. بالإضافة إلى زيادة معدلات التفاعل، يمكن أن توفر هذه العملية أيضا مسارات رد فعل بديلة لا يمكن الوصول إليها عبر العمليات التقليدية التي تحركها الحرارية، وفتح سبل جديدة للسيطرة على الانتقائية رد الفعل20،21،22،23،24،25. الأهم من ذلك، تجدر الإشارة إلى أن الاضمحلال البلازمون يمكن أن يؤدي أيضا إلى تبديد الحراري، مما يؤدي إلى زيادة درجة الحرارة في محيط NPs التي يمكن أن تسهم أيضا في تسريع معدلات التفاعل15،16.
بسبب هذه الميزات المثيرة للاهتمام، وقد تم استخدام الحفز plasmonic بنجاح نحو مجموعة متنوعة من التحولات الجزيئية18. ومع ذلك، لا يزال هناك تحدٍّ هام. في حين أن NPs plasmonic مثل Ag و Au تعرض خصائص بصرية ممتازة في نطاقات الأشعة تحت الحمراء المرئية وشبه ، فإن خصائصها الحفازة محدودة من حيث نطاق التحولات. وبعبارة أخرى، فإنها لا تعرض خصائص الحفاز جيدة لعدة من التحولات. بالإضافة إلى ذلك، المعادن التي تعتبر مهمة في الحفز، مثل البلاديوم (Pd) والبلاتين (Pt)، لا تدعم الإثارة LSPR في نطاقات مرئية أو القريبة IR. لسد هذه الفجوة ، وNps ثنائي الفلزات التي تحتوي على plasmonic والمعادن الحفاز يمثل استراتيجية فعالة20،26،27،28،29. في هذه الأنظمة، يمكن استخدام المعدن البلازمونية كهوائي لحصد الطاقة من الإثارة الضوئية من خلال LSPR، والذي يستخدم بعد ذلك لدفع، وتسريع، والسيطرة على التحولات الجزيئية في المعدن الحفاز. ولذلك، هذه الاستراتيجية تمكننا من تمديد الحفز البلازمونية وراء التقليدية NPs المعادن البلازمونية20،26،27،28،29.
يصف هذا البروتوكول التركيب السهل للفضة الثنائية الفلزات -البلاديوم (Ag-Pd) سبائك NPs المدعومة على ZrO2 (Ag-Pd/ZrO2)التي يمكن أن تعمل كنظام تحفيزي بلاسمونيكي للحفز. وقد أعدت المصابيح الوطنية Ag-Pd/ZrO2 عن طريق التشريب المشترك للسلائف المعدنية المناظرة على دعم ZrO2، يليه التخفيضالمتزامن 30. أدى هذا النهج إلى تشكيل مصادر ثنائية الفلزات حول 10 نانومتر في الحجم (قطر) مباشرة على سطح دعم ZrO2. كانت NPs تتكون من 1 مول٪ من PD لتقليل استخدام المعدن الحفاز مع تعظيم الخصائص البصرية الناتجة من أجهزة NPs Ag-Pd. وقد ثبت وجود بروتوكول لتطبيق الـ Ag-Pd/ZrO2 NPs في الحفز البلازمونيكي للحد من النيتروبزين. نحن تستخدم 425 نانومتر LED الإضاءة لإثارة LSPR. وقد أجريت كروماتوغرافيا الغاز لرصد تحويل وانتقائية تفاعل الخفض في ظل ظروف التشعيع المظلمة والخفيفة. أدت الإثارة LSPR إلى تعزيز الأداء الحفاز والسيطرة على الانتقائية في Ag-Pd/ZrO2 NPs نسبة إلى الظروف التي تحركها حراريا بحتة. وتستند الطريقة الموصوفة في هذا البروتوكول على إعداد رد فعل ضوئي بسيط مقرونة ب اللوني الغازي ويمكن تكييفها مع مجموعة واسعة من التحولات الجزيئية وتكوينات NPs. وهكذا، فإن هذه الطريقة تجعل من الممكن توصيف النشاط الضوئي، من حيث التحويل والانتقائية رد الفعل، من مصادر القدرة الوطنية المختلفة، وعدد لا يحصى من التحولات المرحلة السائلة. نعتقد أن هذه المقالة سوف توفر مبادئ توجيهية هامة ورؤى لكل من القادمين الجدد والعلماء الأكثر خبرة في هذا المجال.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. توليفة من Ag - PD / ZrO2 NPs
ملاحظة: في هذا الإجراء، يتوافق mol Pd في Ag-Pd إلى 1٪، وتطابق التحميل Ag-Pd على ZrO2 إلى 3 wt.٪
- مكان 1 غرام من مسحوقZrO 2 في 250 مل من الكأس.
- إضافة 50 مل من حلول AgNO3 (aq) (0.0059 مول / لتر) و 9.71 مل من K2PdCl4 (aq) (0.00031 مول / لتر) إلى كوب تحت تحريك مغناطيسي قوي (500 دورة في الدقيقة) في درجة حرارة الغرفة.
- إضافة 10 مل من ليسين (0.53 M) محلول مائي.
- الحفاظ على الخليط تحت تحريك قوية (500 دورة في الدقيقة) لمدة 20 دقيقة.
- بعد 20 دقيقة، واستخدام ماصة لإضافة إلى تعليق 10 مل منNaBH الطازجة (aq) (0.035 M) حل قطرة، بمعدل 1 مل / دقيقة. الحفاظ على تعليق تحت اثارة (500 دورة في الدقيقة) طوال العملية.
- دعي الخليط يحرك لمدة 30 دقيقة في درجة حرارة الغرفة.
2- فصل وتنقية العامل الحفاز
- نقل التعليق إلى أنابيب الطرد المركزي وفصل المواد الصلبة من الخليط عن طريق الطرد المركزي في 3260 × ز لمدة 10 دقائق.
- إزالة بعناية المرحلة السائلة مع ماصة وإضافة 15 مل المياه deionized إلى الأنابيب.
- يهز بقوة حتى يتم الحصول على تشتت الصلبة. إذا لم يتحقق تشتت جيد، ضع الأنابيب في حمام بالموجات فوق الصوتية لمدة 5 دقائق.
- الطرد المركزي التشتت في 3260 س ز لمدة 10 دقيقة.
- كرر خطوات الغسيل (2.2. إلى 2.2.2.) مرتين اإلستخدام الماء الأيوني، ثم مرة واحدة باستخدام الإيثانول بدلاً من الماء.
- يُرفع الإيثانول ويجفف الصلب في فرن عند درجة حرارة 60 درجة مئوية لمدة 12 ساعة.
- وصف إعداد Ag-Pd/ZrO2 NPs بواسطة مجموعة متنوعة من التقنيات المجهرية، والمجهرية، والمجهرية.
3. توليفة من Ag / ZrO2 NPs
ملاحظة: في هذا الإجراء، يتوافق تحميل Ag على ZrO2 إلى 3 wt.٪
- مكان 1 غرام من مسحوقZrO 2 في 250 مل من الكأس.
- أضف 50 مل من حل AgNO3 (aq) (0.0059 mol/L) إلى الكوكر تحت التحريك المغناطيسي القوي (500 دورة في الدقيقة) في درجة حرارة الغرفة.
- إضافة 10 مل من ليسين (0.53 M) محلول مائي.
- الحفاظ على الخليط تحت تحريك قوية (500 دورة في الدقيقة) لمدة 20 دقيقة.
- بعد 20 دقيقة، واستخدام ماصة لإضافة إلى تعليق 10 مل منNaBH الطازجة (aq) (0.035 M) حل قطرة، بمعدل 1 مل / دقيقة. الحفاظ على تعليق تحت اثارة (500 دورة في الدقيقة) طوال العملية.
- دعي الخليط يحرك لمدة 30 دقيقة تحت درجة حرارة الغرفة.
4- فصل وتنقية العامل الحفاز
- نقل التعليق إلى أنابيب الطرد المركزي وفصل المواد الصلبة من الخليط عن طريق الطرد المركزي في 3260 × ز لمدة 10 دقائق.
- إزالة بعناية المرحلة السائلة مع ماصة وإضافة 15 مل المياه deionized إلى الأنابيب.
- يهز بقوة حتى يتم ملاحظة تشتت الصلبة. إذا لم يتحقق تشتت جيد، ضع الأنابيب في حمام بالموجات فوق الصوتية لمدة 5 دقائق.
- الطرد المركزي التشتت في 3260 س ز لمدة 10 دقيقة.
- كرر خطوات الغسيل (4.2. إلى 4.2.2.) مرتين اإلستخدام الماء الأيوني، ثم مرة واحدة باستخدام الإيثانول بدلا من الماء.
- يُرفع الإيثانول ويجفف الصلب في فرن عند درجة حرارة 60 درجة مئوية لمدة 12 ساعة.
- ويمكن بعد ذلك أن تتميز أجهزة التقييم الوطنية Ag/ZrO2 المعدة بمجموعة متنوعة من التقنيات المجهرية، والمجهرية، والمجهرية.
5. التحقيق في الأداء الحفاز plasmonic نحو الحد من النيتروبزين في إطار الإثارة LSPR (الإضاءة الخفيفة)
- مكان 30 ملغ من محفز في 25 مل جولة أسفل قارورة جنبا إلى جنب مع شريط التحريك المغناطيسي.
- إضافة 5 مل من محلول نيتروبنزين (0.03 مول / لتر) في الكحول ايزوبروبيل (IPA) إلى المفاعل.
- ثم، إضافة 11.22 ملغ من مسحوق كوه (0.0002 مول).
- تطهير المفاعل عن طريق محتدما تعليق مع تدفق الأرجون لمدة 1 دقيقة. مباشرة بعد تطهير، ختم القارورة.
- ضع المفاعل في حمام نفط يسخن عند درجة حرارة 70 درجة مئوية فوق المحرك المغناطيسي الذي يتم التحكم فيه بدرجة الحرارة (500 دورة في الدقيقة).
- تشعّع الأنبوب باستخدام 4 مصابيح LED مع طول موجي 425 نانومتر كمصدر للضوء، وشدة الضوء 0.5 واط/سم2. يجب أن تكون المسافة من المصابيح إلى قارورة التفاعل 7 سم.
- اسمحوا رد فعل المضي قدما ل 2.5 ساعة في 70 درجة مئوية تحت التحريك المغناطيسي قوية (500 دورة في الدقيقة).
- ثم، قم بإيقاف تشغيل الضوء، وفتح المفاعل واستخدام حقنة وإبرة لجمع عينة 1 مل. تصفية من خلال مرشح 0.45 μm، لإزالة الجسيمات المحفزة، في قارورة الكروموغرافيا الغاز.
6. رد فعل في غياب LSPR الإثارة (الظروف المظلمة)
- اتبع نفس الخطوات كما هو موضح في 5، ولكن دون تشعيع خفيف. لف أنبوب التفاعل مع رقائق الألومنيوم لمنع أي التعرض للضوء.
7- إعداد تحليل الكروماتوغرافيا اللونية للغاز
- إعداد حل IPA يحتوي على حوالي 30 مليمول / لتر نيتروبنزين (NB)، 30 مليمول / لتر من النيالين (AN)، و 30 مليمول / لتر من أزوبنزين (AB).
- تشغيل تحليل GC للحل باستخدام أسلوب مناسب. يمكن اختبار طرق مختلفة من خلال تغيير درجة حرارة العمود وبرامج تدفق الغاز. يجب أن يكون الأسلوب المختار قادراً على فصل القمم المطابقة لـ IPA و NB و AN و AB في الحد الأدنى من فترة الاحتفاظ.
- وبمجرد اختيار هذه الطريقة، قم بإعداد مجموعة من الحلول من 50 mM، 25 mM، 10 mM، 5 mM و 2.5 mM NB في IPA، ومجموعة أخرى من الحلول من AN وAB في IPA مع نفس التركيزات.
- تشغيل تحليل GC من الحلول المعدة. وينبغي أن يقدم كل كروماتوغرام 2 قمم: أعلى واحد يتوافق مع IPA وأقل واحد يتوافق مع NB، AN، أو AB. لكل كروماتوجرام، لاحظ أسفل وقت الاحتفاظ ومساحة الذروة من جميع القمم.
- تتبع منحنيات المعايرة من NB، AN، وAB عن طريق رسم التركيز مقابل منطقة الذروة لكل عينة.
8- تحليل GC
- تشغيل تحليل GC على العينات التي تم تجميعها في الخطوات 5. و6. مع نفس الأسلوب المستخدم للخطوات 7.2. و7.4.
- لكل كروماتوجرام، لاحظ أسفل وقت الاحتفاظ ومساحة الذروة واستخدام منحنيات المعايرة رسمها سابقا لتحديد تركيز NB، AN، وAB في العينات.
- حساب تحويل نيتروبنزين وكذلك العانيلين و azobenzene الانتقائية باستخدام المعادلات:
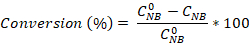
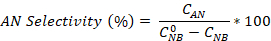
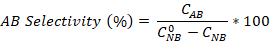
حيث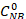 هو تركيز NB الأولي (0.03 مول / لتر)، و C NB، CAN، CAB تتوافق مع تركيزات NB و AN و AB، على التوالي، بعد 2.5 ساعة من التفاعل بواسطة تحليل GC.
هو تركيز NB الأولي (0.03 مول / لتر)، و C NB، CAN، CAB تتوافق مع تركيزات NB و AN و AB، على التوالي، بعد 2.5 ساعة من التفاعل بواسطة تحليل GC.
Access restricted. Please log in or start a trial to view this content.
النتائج
ويبين الشكل 1 ألف صورا رقمية للعينات الصلبة التي تحتوي على أكسيد زرو2 النقي (يسار) و Ag-Pd/ZrO2 NPs (يمين). هذا التغيير في اللون من الأبيض (في ZrO2)إلى البني (Ag-Pd/ZrO2)يوفر الدليل النوعي الأولي على ترسب أجهزة NPs Ag-Pd في سطح ZrO2. ويبين الشكل 1ب أطيا...
Access restricted. Please log in or start a trial to view this content.
Discussion
وتبين النتائج الموصوفة في هذه الطريقة أن النشاط الحفاز الجوهري لـ Pd (أو غيره من المعادن الحفازة ولكن ليس plasmonic) يمكن تعزيزه بشكل كبير عن طريق استثارة LSPR عن طريق التشعيع الضوئي المرئي في سبائك ثنائية الفلزات35. وفي هذه الحالة، فإن Ag (أو معدن بلازمونيك آخر) قادر على حصاد الطاقة من ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
وقد دعم هذا العمل جامعة هلسنكي ومؤسسة جين وأتوس إركو. S.H. شكرا ايراسموس + الاتحاد الأوروبي الأموال للزمالة.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 2-Propanol (anhydrous, 99.5%) | Sigma-Aldrich | 278475 | CAS Number 67-63-0 |
| Aniline (for synthesis) | Sigma-Aldrich | 8.22256 | CAS Number 62-53-3 |
| Azobenzene (98%) | Sigma-Aldrich | 424633 | CAS Number 103-33-3 |
| Ethanol | Honeywell | 32221 | CAS Number 64-17-5 |
| Hydrochloric acid (37%) | VWR | PRLSMC310066 | CAS Number 7647-01-0 |
| L-Lysine (crystallized, ≥98.0% (NT)) | Sigma-Aldrich | 62840 | CAS Number 56-87-1 |
| Nitric acid (65%) | Merck | 100456 | CAS Number 7697-37-2 |
| Nitrobenzene | Sigma-Aldrich | 8.06770 | CAS Number 98-95-3 |
| Potassium hydroxide | Fisher | 10448990 | CAS Number 1310-58-3 |
| Potassium tetrachloropalladate (II) (98%) | Sigma-Aldrich | 205796 | CAS Number 10025-98-6 |
| Silver nitrate (ACS reagent, ≥99.0%) | Sigma-Aldrich | 209139 | CAS Number 7761-88-8 |
| Sodium borohydride (fine granular for synthesis) | Sigma-Aldrich | 8.06373 | CAS Number 16940-66-2 |
| Zirconium (IV) oxide (nanopowder, <100 nm particle size (TEM)) | Sigma-Aldrich | 544760 | CAS Number 1314-23-4 |
References
- Dunn, P. J., Hii, K. K., Krische, M. J., Williams, M. T. Sustainable Catalysis: Challenges and Pratices for the Pharmaceutical and Fine Chemical Industries. , Wiley-Blackwell. (2013).
- Tzouras, N. V., Stamatopoulos, I. K., Papastavrou, A. T., Liori, A. A., Vougioukalakis, G. C. Sustainable metal catalysis in C-H activation. Coordination Chemistry Reviews. 343, 25(2017).
- Polshettiwar, V., Varma, R. S. Green chemistry by nano-catalysis. Green Chemistry. 12 (5), 743(2010).
- Rodrigues, T. S., da Silva, A. G. M., Camargo, P. H. C. Nanocatalysis by noble metal nanoparticles: controlled synthesis for the optimization and understanding of activities. Journal of Materials Chemistry A. 7 (11), 5857-5874 (2019).
- Linic, S., Christopher, P., Ingram, D. B. Plasmonic-metal nanostructures for efficient conversion of solar to chemical energy. Nature Materials. 10 (12), 911-921 (2011).
- Nam, J. M., Liz-Marzán, L., Halas, N. Chemical Nanoplasmonics: Emerging Interdisciplinary Research Field at Crossroads between Nanoscale Chemistry and Plasmonics. Accounts of Chemical Research. 52 (11), 2995-2996 (2019).
- Brongersma, M. L., Halas, N. J., Nordlander, P. Plasmon-induced hot carrier science and technology. Nature Nanotechnology. 10 (1), 25-34 (2015).
- Smith, J. G., Faucheaux, J. A., Jain, P. K. Plasmon resonances for solar energy harvesting: A mechanistic outlook. Nano Today. 10 (1), 67-80 (2015).
- Hartland, G. V. Optical studies of dynamics in noble metal nanostructures. Chemical Reviews. 111 (6), 3858-3887 (2011).
- Kelly, K. L., Coronado, E., Zhao, L. L., Schatz, G. C. The optical properties of metal nanoparticles: The influence of size, shape, and dielectric environment. Journal of Physical Chemistry B. 107 (3), 668-677 (2003).
- Hermoso, W., et al. Triangular metal nanoprisms of Ag, Au, and Cu: Modeling the influence of size, composition, and excitation wavelength on the optical properties. Chemical Physics. 423, 142-150 (2013).
- Kumar, A., et al. Rational Design and Development of Lanthanide-Doped NaYF4@CdS-Au-RGO as Quaternary Plasmonic Photocatalysts for Harnessing Visible-Near-Infrared Broadband Spectrum. ACS Applied Materials and Interfaces. 10 (18), 15565-15581 (2018).
- Reddy, K. L., Kumar, S., Kumar, A., Krishnan, V. Wide spectrum photocatalytic activity in lanthanide-doped upconversion nanophosphors coated with porous TiO2 and Ag-Cu bimetallic nanoparticles. Journal of Hazardous Materials. 367, 694-705 (2019).
- Ingram, D. B., Linic, S. Water splitting on composite plasmonic-metal/semiconductor photoelectrodes: Evidence for selective plasmon-induced formation of charge carriers near the semiconductor surface. Journal of the American Chemical Society. 133 (14), 5202-5205 (2011).
- Linic, S., Aslam, U., Boerigter, C., Morabito, M. Photochemical transformations on plasmonic metal nanoparticles. Nature Materials. 14 (6), 567-576 (2015).
- Aslam, U., Rao, V. G., Chavez, S., Linic, S. Catalytic conversion of solar to chemical energy on plasmonic metal nanostructures. Nature Catalyst. 1, 656-665 (2018).
- Araujo, T. P., Quiroz, J., Barbosa, E. C. M., Camargo, P. H. C. Understanding plasmonic catalysis with controlled nanomaterials based on catalytic and plasmonic metals. Current Opinion in Colloid and Interface Science. 39, 110-122 (2019).
- Gellé, A., et al. Applications of plasmon-enhanced nanocatalysis to organic transformations. Chemical Reviews. , 986-1041 (2020).
- Shaik, F., Peer, I., Jain, P. K., Amirav, L. Plasmon-Enhanced Multicarrier Photocatalysis. Nano Letters. 18 (7), 4370-4376 (2018).
- Quiroz, J., et al. Controlling Reaction Selectivity over Hybrid Plasmonic Nanocatalysts. Nano Letters. 18, 7289-7297 (2018).
- Peiris, E., et al. Plasmonic Switching of the Reaction Pathway: Visible-Light Irradiation Varies the Reactant Concentration at the Solid-Solution Interface of a Gold-Cobalt Catalyst. Angewandte Chemie - International Edition. 58 (35), 12032-12036 (2019).
- Yu, S., Wilson, A. J., Heo, J., Jain, P. K. Plasmonic Control of Multi-Electron Transfer and C-C Coupling in Visible-Light-Driven CO2 Reduction on Au Nanoparticles. Nano Letters. 18 (4), 2189-2194 (2018).
- Yu, S., Jain, P. K. Plasmonic photosynthesis of C 1 -C 3 hydrocarbons from carbon dioxide assisted by an ionic liquid. Nature Communications. 10, 2022(2019).
- Zhang, X., et al. Product selectivity in plasmonic photocatalysis for carbon dioxide hydrogenation. Nature Communications. 8, 1-9 (2017).
- Cortés, E. Efficiency and Bond Selectivity in Plasmon-Induced Photochemistry. Advanced Optical Materials. 5 (15), 1700191(2017).
- de Freitas, I. C., et al. Design-controlled synthesis of IrO 2 sub-monolayers on Au nanoflowers: marrying plasmonic and electrocatalytic properties. Nanoscale. , 23-27 (2020).
- Zhang, C., et al. Al-Pd Nanodisk Heterodimers as Antenna-Reactor Photocatalysts. Nano Letters. 16 (10), 6677-6682 (2016).
- Zhou, L., et al. Light-driven methane dry reforming with single atomic site antenna-reactor plasmonic photocatalysts. Nature Energy. 5, 61-70 (2020).
- Swearer, D. F., et al. Heterometallic antenna-reactor complexes for photocatalysis. Proceedings of the National Academy of Sciences. 113 (32), 8916-8920 (2016).
- Peiris, S., Sarina, S., Han, C., Xiao, Q., Zhu, H. -Y. Silver and palladium alloy nanoparticle catalysts: reductive coupling of nitrobenzene through light irradiation. Dalton Transactions. 46 (32), 10665-10672 (2017).
- Rahm, J. M., et al. A Library of Late Transition Metal Alloy Dielectric Functions for Nanophotonic Applications. Advanced Functional Materials. 2002122, 02122(2020).
- Zhang, C., Chen, B. Q., Li, Z. Y., Xia, Y., Chen, Y. G. Surface Plasmon Resonance in Bimetallic Core-Shell Nanoparticles. Journal of Physical Chemistry C. 119 (29), 16836-16845 (2015).
- Liu, Z., Huang, Y., Xiao, Q., Zhu, H. Selective reduction of nitroaromatics to azoxy compounds on supported Ag-Cu alloy nanoparticles through visible light irradiation. Green Chemistry. 18 (3), 817-825 (2016).
- Chaiseeda, K., Nishimura, S., Ebitani, K. Gold nanoparticles supported on alumina as a catalyst for surface plasmon-enhanced selective reductions of nitrobenzene. ACS Omega. 2 (10), 7066-7070 (2017).
- Peiris, S., et al. Metal nanoparticle photocatalysts: emerging processes for green organic synthesis. Catalysis Science and Technology. 6 (2), 320-338 (2016).
- García-García, I., et al. Silver-Based Plasmonic Catalysts for Carbon Dioxide Reduction. ACS Sustainable Chemistry and Engineering. 8 (4), 1879-1887 (2020).
- Agrawal, A., Johns, R. W., Milliron, D. J. Control of Localized Surface Plasmon Resonances in Metal Oxide Nanocrystals. Annual Review of Materials Research. 47 (1), 1-31 (2017).
- Lounis, S. D., Runnerstrom, E. L., Llordés, A., Milliron, D. J. Defect chemistry and Plasmon physics of colloidal metal oxide Nanocrystals. Journal of Physical Chemistry Letters. 5 (9), 1564-1574 (2014).
- Rej, S., et al. Determining Plasmonic Hot Electrons and Photothermal Effects during H2 Evolution with TiN-Pt Nanohybrids. ACS Catalysis. 10 (9), 5261-5271 (2020).
- Barragan, A. A., et al. Photochemistry of Plasmonic Titanium Nitride Nanocrystals. The Journal of Physical Chemistry C. 123 (35), 21796-21804 (2019).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved