Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Préparation de nanoparticules alliées d’argent-palladium pour la catalyse plasmonique sous illumination visible
Dans cet article
Résumé
Présenté ici est un protocole pour la synthèse des nanoparticules d’alliage argent-palladium (Ag-Pd) (NPs) prises en charge sur ZrO2 (Ag-Pd/ZrO2). Ce système permet de récolter l’énergie de l’irradiation de la lumière visible pour accélérer et contrôler les transformations moléculaires. Ceci est illustré par la réduction de nitrobenzene sous l’irradiation légère catalysée par Ag-Pd/ZrO2 NPs.
Résumé
La résonance plasmonie de surface localisée (LSPR) dans les nanoparticules plasmoniques (PN) peut accélérer et contrôler la sélectivité d’une variété de transformations moléculaires. Cela ouvre des possibilités pour l’utilisation de la lumière visible ou proche de l’IR comme un apport durable pour conduire et contrôler les réactions lorsque les nanoparticules plasmoniques soutenant l’excitation LSPR dans ces gammes sont utilisées comme catalyseurs. Malheureusement, ce n’est pas le cas pour plusieurs métaux catalytiques tels que le palladium (Pd). Une stratégie pour surmonter cette limitation est d’employer des PN bimétalliques contenant des métaux plasmoniques et catalytiques. Dans ce cas, l’excitation LSPR dans le métal plasmonique peut contribuer à accélérer et contrôler les transformations entraînées par la composante catalytique. La méthode rapportée ci-dessous se concentre sur la synthèse des PS bimétalliques argent-palladium (Ag-Pd) pris en charge sur ZrO2 (Ag-Pd/ZrO2)qui agit comme un système plasmonique-catalytique. Les PN ont été préparés par co-imprégnation des précurseurs métalliques correspondants sur le support ZrO2, suivie d’une réduction simultanée conduisant à la formation de PN bimétalliques directement sur le support ZrO2. Les PN Ag-Pd/ZrO2 ont ensuite été utilisés comme catalyseurs plasmoniques pour la réduction du nitrobenzene sous l’éclairage de 425 nm par les lampes LED. À l’aide de la chromatographie gazeuse (GC), la conversion et la sélectivité de la réaction de réduction dans les conditions d’irradiation foncée et lumineuse peuvent être surveillées, démontrant les performances catalytiques améliorées et le contrôle de la sélectivité dans le cadre de l’excitation LSPR après alliage de non plasmonique avec du métal plasmonique Ag. Cette technique peut être adaptée à un large éventail de transformations moléculaires et de compositions de PN, ce qui la rend utile pour la caractérisation de l’activité catalytique plasmonique de différents types de catalyse en termes de conversion et de sélectivité.
Introduction
Parmi les nombreuses applications de nanoparticules métalliques (PN), la catalyse mérite une attention particulière. La catalyse joue un rôle central dans un avenir durable, contribuant à réduire la consommation d’énergie, une meilleure utilisation des matières premières et permettant des conditions de réaction pluspropres 1,2,3,4. Ainsi, les progrès de la catalyse peuvent fournir des outils pour améliorer l’efficacité atomique des procédés chimiques, les rendant plus propres, plus économiquement viables et plus respectueux de l’environnement. Les PN métalliques englobant l’argent (Ag), l’or (Au) ou le cuivre (Cu) peuvent afficher des propriétés optiques intéressantes dans la gamme visible qui découlent de la façon unique dont ces systèmes interagissent avec la lumière à l’échelle nanométrique par l’intermédiaire de la résonance plasmon de surface localisée (LSPR) excitation5,6,7,8. Dans ces PN, appelés PN plasmoniques, le LSPR comprend l’interaction résonnante entre les photons incidents (à partir d’une onde électromagnétique entrante) avec le mouvement collectif desélectrons 5,6,7,8. Ce phénomène se déroule à une fréquence caractéristique qui dépend de la taille, de la forme, de la composition et de la constante diélectrique del’environnement 9,10,11. Par exemple, pour Ag, Au, et Cu, ces fréquences peuvent aller du visible au proche-IR, ouvrant des possibilités pour l’utilisation de l’énergie solaire pour exciter leur LSPR5,6,7,8,12,13.
Récemment, il a été démontré que l’excitation LSPR dans les SNP plasmoniques peut contribuer à accélérer les taux et contrôler la sélectivité des transformationsmoléculaires 5,14,15,16,17,18,19. Cela a donné naissance à un champ appelé catalyse plasmonique, qui se concentrent sur l’utilisation de l’énergie de la lumière pour accélérer, conduire et / ou contrôler les transformationschimiques 5,14,15,16,17,18,19. Dans ce contexte, il a été établi que l’excitation LSPR dans les PN plasmoniques peut conduire à la formation d’électrons chauds énergétiques et de trous, appelés porteurs chauds excités par le LSPR. Ces porteurs peuvent interagir avec les espèces adsorbées par l’activation électronique ou vibratoire15,16. En plus de l’augmentation des taux de réaction, ce processus peut également fournir des voies de réaction alternatives non accessibles par le biais de processus thermochimiques traditionnels, ouvrant de nouvelles voies pour le contrôle de la sélectivitéde réaction 20,21,22,23,24,25. Fait important, il convient de noter que la décomposition du plasmon peut également conduire à la dissipation thermique, conduisant à une augmentation de la température à proximité des IP qui peut également contribuer à accélérer les taux deréaction 15,16.
En raison de ces dispositifs intéressants, la catalyse plasmonique a été employée avec succès vers une série de transformations moléculaires18. Néanmoins, un défi important demeure. Alors que les PN plasmoniques tels que Ag et Au affichent d’excellentes propriétés optiques dans les gammes visibles et proches de l’IR, leurs propriétés catalytiques sont limitées en termes de portée des transformations. En d’autres termes, ils n’affichent pas de bonnes propriétés catalytiques pour plusieurs transformations. En outre, les métaux qui sont importants dans la catalyse, tels que le palladium (Pd) et le platine (Pt), ne supportent pas l’excitation LSPR dans les gammes visibles ou proches de l’IR. Pour combler cet écart, les PN bimétalliques contenant un métal plasmonique et catalytique représentent une stratégieefficace 20,26,27,28,29. Dans ces systèmes, le métal plasmonique peut être utilisé comme antenne pour récolter l’énergie de l’excitation lumineuse à travers le LSPR, qui est ensuite utilisé pour conduire, accélérer et contrôler les transformations moléculaires du métal catalytique. Par conséquent, cette stratégie nous permet d’étendre la catalyse plasmonique au-delà des SNP plasmoniquestraditionnels 20,26,27,28,29.
Ce protocole décrit la synthèse facile des PN en alliage argent-palladium bimétallique (Ag-Pd) pris en charge sur ZrO2 (Ag-Pd/ZrO2)qui peuvent agir comme un système plasmonique-catalytique pour la catalyse plasmonique. Les PN Ag-Pd/ZrO2 ont été préparés par co-imprégnation des précurseurs métalliques correspondants sur le support ZrO2 suivie d’une réductionsimultanée de 30. Cette approche a conduit à la formation de PN bimétalliques d’environ 10 nm de taille (diamètre) directement à la surface du support ZrO2. Les PN étaient composés de 1 mol% de pour minimiser l’utilisation du métal catalytique tout en maximisant les propriétés optiques des PN Ag-Pd qui en résultaient. Un protocole pour l’application de l’Ag-Pd/ZrO2 NPs dans la catalyse plasmonique a été démontré pour la réduction de nitrobenzene. Nous avons employé l’éclairage led de 425 nm pour l’excitation de LSPR. La chromatographie gazeuse a été effectuée pour surveiller la conversion et la sélectivité de la réaction de réduction dans les conditions d’irradiation foncée et lumineuse. L’excitation de LSPR a mené à la performance catalytique améliorée et au contrôle sur la sélectivité dans Ag-Pd/ZrO2 NPs par rapport aux conditions purement thermiquement conduites. La méthode décrite dans ce protocole est basée sur une configuration simple de réaction photocatalytique couplée à la chromatographie gazeuse et peut être adaptée à un large éventail de transformations moléculaires et de compositions de PN. Ainsi, cette méthode permet la caractérisation de l’activité photocatalytique, en termes de conversion et de sélectivité des réactions, de différents PN et d’une myriade de transformations en phase liquide. Nous croyons que cet article fournira des lignes directrices et des idées importantes aux nouveaux arrivants et aux scientifiques plus expérimentés dans le domaine.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Synthèse d’Ag-Pd/ZrO2 PN
NOTE: Dans cette procédure, le mol% dans Ag-Pd correspondait à 1%, et le chargement d’Ag-Pd sur ZrO2 correspondait à 3 wt.%.
- Placer 1 g de poudre ZrO2 dans un bécher de 250 mL.
- Ajouter 50 mL d’agNO3 (aq) (0,0059 mol/L) et 9,71 mL d’un K2PdCl4 (aq) (0,00031 mol/L) au bécher sous agitation magnétique vigoureuse (500 rpm) à température ambiante.
- Ajouter 10 mL de solution aqueuse de lysine (0,53 M).
- Garder le mélange sous agitation vigoureuse (500 rpm) pendant 20 min.
- Après 20 min, utiliser une pipette pour ajouter à la suspension 10 mL d’une solution NaBH4 (aq) (0,035 M) fraîchement préparée, à raison de 1 mL/min. Gardez la suspension en remuant (500 rpm) tout au long du processus.
- Laisser remuer le mélange pendant 30 min à température ambiante.
2. Séparation et purification du catalyseur
- Transférer la suspension dans des tubes de centrifugeuse et séparer les solides du mélange par centrifugation à 3 260 x g pendant 10 min.
- Retirer délicatement la phase liquide à l’intérieur d’une pipette et ajouter 15 mL d’eau déionisée aux tubes.
- Agiter vigoureusement jusqu’à ce que la dispersion du solide soit obtenue. Si une bonne dispersion n’est pas atteinte, placez les tubes dans un bain ultrasonique pendant 5 min.
- Centrifugeuse la dispersion à 3.260 x g pendant 10 min.
- Répétez les étapes de lavage (2,2 à 2,2,2.) deux fois de plus à l’aide d’eau déionisée, puis une fois en utilisant de l’éthanol au lieu de l’eau.
- Retirer l’éthanol et sécher le solide au four à 60 °C pendant 12 h.
- Caractérisez les SNP Ag-Pd/ZrO2 préparés par une variété de techniques microscopies, élémentaires et spectroscopiques.
3. Synthèse des PN Ag/ZrO2
REMARQUE: Dans cette procédure, ag chargement sur ZrO2 correspondait à 3 wt.%.
- Placer 1 g de poudre ZrO2 dans un bécher de 250 mL.
- Ajouter 50 mL d’une solution AgNO3 (aq) (0,0059 mol/L) au bécher en remuant magnétique vigoureux (500 rpm) à température ambiante.
- Ajouter 10 mL de solution aqueuse de lysine (0,53 M).
- Garder le mélange sous agitation vigoureuse (500 rpm) pendant 20 min.
- Après 20 min, utiliser une pipette pour ajouter à la suspension 10 mL d’une solution NaBH4 (aq) (0,035 M) fraîchement préparée, à raison de 1 mL/min. Gardez la suspension en remuant (500 rpm) tout au long du processus.
- Laisser remuer le mélange pendant 30 min à température ambiante.
4. Séparation et purification du catalyseur
- Transférer la suspension dans des tubes de centrifugeuse et séparer les solides du mélange par centrifugation à 3 260 x g pendant 10 min.
- Retirer délicatement la phase liquide à l’intérieur d’une pipette et ajouter 15 mL d’eau déionisée aux tubes.
- Agiter vigoureusement jusqu’à ce que la dispersion du solide soit observée. Si une bonne dispersion n’est pas atteinte, placez les tubes dans un bain ultrasonique pendant 5 min.
- Centrifugeuse la dispersion à 3.260 x g pendant 10 min.
- Répétez les étapes de lavage (4,2 à 4,2,2.) deux fois de plus à l’aide d’eau déionisée, puis une fois en utilisant de l’éthanol au lieu de l’eau.
- Retirer l’éthanol et sécher le solide au four à 60 °C pendant 12 h.
- Les PN Ag/ZrO2 préparés peuvent alors être caractérisés par une variété de techniques microscopies, élémentaires et spectroscopiques.
5. Étude de la performance catalytique plasmonique vers la réduction de nitrobenzene sous l’excitation de LSPR (illumination lumineuse)
- Placer 30 mg de catalyseur dans un flacon à fond rond de 25 mL avec une barre magnétique.
- Ajouter 5 mL d’une solution de nitrobenzene (0,03 mol/L) en alcool isopropylique (IPA) au réacteur.
- Ensuite, ajouter 11,22 mg de poudre koh (0,0002 mol).
- Purger le réacteur en bouillonnant la suspension avec un écoulement d’argon pendant 1 min. Immédiatement après la purge, sceller le flacon.
- Placer le réacteur dans un bain d’huile chauffé à 70 °C au-dessus d’un agitateur magnétique à température contrôlée (500 rpm).
- Irradier le tube à l’aide de 4 lampes LED avec une longueur d’onde de 425 nm comme source de lumière, et une intensité lumineuse de 0,5 W/cm2. La distance entre les lampes et le flacon de réaction doit être de 7 cm.
- Laisser la réaction se poursuivre pendant 2,5 h à 70 °C sous un remuement magnétique vigoureux (500 rpm).
- Ensuite, éteignez la lumière, ouvrez le réacteur et utilisez une seringue et une aiguille pour recueillir un échantillon de 1 mL. Filtrez-le à travers un filtre de 0,45 μm, pour enlever les particules catalyseur, dans un flacon de chromatographie gazeuse.
6. Réaction en l’absence d’excitation LSPR (conditions sombres)
- Suivez les mêmes étapes que décrites dans 5, mais sans irradiation légère. Envelopper le tube de réaction de papier d’aluminium pour éviter toute exposition à la lumière.
7. Préparation d’analyse de la chromatographie gazeuse (GC)
- Préparer une solution IPA contenant environ 30 mmol/L nitrobenzene (NB), 30 mmol/L d’aniline (AN) et 30 mmol/L d’azobenzene (AB).
- Exécutez une analyse GC de la solution à l’aide d’une méthode appropriée. Différentes méthodes peuvent être testées en variant la température de la colonne et les programmes d’écoulement du gaz. La méthode choisie devrait être en mesure de séparer les pics correspondant à l’API, au Nouveau-Brunswick, à l’AN et à l’AB pendant la période minimale de rétention.
- Une fois la méthode sélectionnée, préparez un ensemble de solutions de 50 mM, 25 mM, 10 mM, 5 mM et 2,5 mM NB en IPA, et un autre ensemble de solutions d’AN et d’AB en IPA avec les mêmes concentrations.
- Exécutez une analyse gc des solutions préparées. Chaque chromatogramme doit présenter 2 pics : le plus élevé correspond à l’IPA et le plus bas correspond au NB, à l’AN ou à l’AB. Pour chaque chromatogramme, notez l’heure de rétention et la zone de pointe de tous les pics.
- Tracez les courbes d’étalonnage du Nouveau-Brunswick, de l’AN et de l’AB en traçant la concentration par rapport à la zone de pointe de chaque échantillon.
8. Analyse gc
- Exécuter une analyse gc sur les échantillons recueillis dans les étapes 5. et 6. avec la même méthode utilisée pour les étapes 7.2. et 7,4.
- Pour chaque chromatogramme, notez le temps de rétention et la zone de pointe et utilisez les courbes d’étalonnage tracées précédemment pour déterminer la concentration de NB, AN et AB dans les échantillons.
- Calculez la conversion nitrobenzene ainsi que la sélectivité de l’aniline et de l’azobenzene à l’aide des équations :
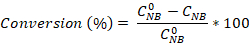
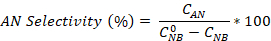
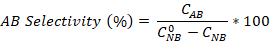
Où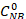 est la concentration initiale du Nouveau-Brunswick (0,03 mol/L) et des concentrations de C NB, CAN, CAB correspondant aux concentrations de NB, AN et AB, respectivement, après 2,5 heures de réaction par l’analyse gc.
est la concentration initiale du Nouveau-Brunswick (0,03 mol/L) et des concentrations de C NB, CAN, CAB correspondant aux concentrations de NB, AN et AB, respectivement, après 2,5 heures de réaction par l’analyse gc.
Access restricted. Please log in or start a trial to view this content.
Résultats
La figure 1A montre des photographies numériques des échantillons solides contenant l’oxyde ZrO2 pur (à gauche) et les PN Ag-Pd/ZrO2 (à droite). Ce changement de couleur du blanc (en ZrO2)au brun (Ag-Pd/ZrO2)fournit les premières preuves qualitatives sur le dépôt des SNP Ag-Pd à la surface ZrO2. La figure 1B montre les spectres d’absorption visibles par LES UV des PN Ag-Pd/ZrO2 (trace ...
Access restricted. Please log in or start a trial to view this content.
Discussion
Les résultats décrits dans cette méthode démontrent que l’activité catalytique intrinsèque de (ou autre métal catalytique mais pas plasmonique) peut être sensiblement augmentée par l’excitation de LSPR par irradiation de lumière visible dans les NPs alliage bimétalliques35. Dans ce cas, Ag (ou un autre métal plasmonique) est capable de récolter l’énergie de l’irradiation de lumière visible par l’excitation de LSPR. L’excitation LSPR conduit à la formation de porteurs de...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par l’Université d’Helsinki et la Fondation Jane et Aatos Erkko. S.H. remercie Erasmus+ fonds de l’UE pour la bourse.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 2-Propanol (anhydrous, 99.5%) | Sigma-Aldrich | 278475 | CAS Number 67-63-0 |
| Aniline (for synthesis) | Sigma-Aldrich | 8.22256 | CAS Number 62-53-3 |
| Azobenzene (98%) | Sigma-Aldrich | 424633 | CAS Number 103-33-3 |
| Ethanol | Honeywell | 32221 | CAS Number 64-17-5 |
| Hydrochloric acid (37%) | VWR | PRLSMC310066 | CAS Number 7647-01-0 |
| L-Lysine (crystallized, ≥98.0% (NT)) | Sigma-Aldrich | 62840 | CAS Number 56-87-1 |
| Nitric acid (65%) | Merck | 100456 | CAS Number 7697-37-2 |
| Nitrobenzene | Sigma-Aldrich | 8.06770 | CAS Number 98-95-3 |
| Potassium hydroxide | Fisher | 10448990 | CAS Number 1310-58-3 |
| Potassium tetrachloropalladate (II) (98%) | Sigma-Aldrich | 205796 | CAS Number 10025-98-6 |
| Silver nitrate (ACS reagent, ≥99.0%) | Sigma-Aldrich | 209139 | CAS Number 7761-88-8 |
| Sodium borohydride (fine granular for synthesis) | Sigma-Aldrich | 8.06373 | CAS Number 16940-66-2 |
| Zirconium (IV) oxide (nanopowder, <100 nm particle size (TEM)) | Sigma-Aldrich | 544760 | CAS Number 1314-23-4 |
Références
- Dunn, P. J., Hii, K. K., Krische, M. J., Williams, M. T. Sustainable Catalysis: Challenges and Pratices for the Pharmaceutical and Fine Chemical Industries. , Wiley-Blackwell. (2013).
- Tzouras, N. V., Stamatopoulos, I. K., Papastavrou, A. T., Liori, A. A., Vougioukalakis, G. C. Sustainable metal catalysis in C-H activation. Coordination Chemistry Reviews. 343, 25(2017).
- Polshettiwar, V., Varma, R. S. Green chemistry by nano-catalysis. Green Chemistry. 12 (5), 743(2010).
- Rodrigues, T. S., da Silva, A. G. M., Camargo, P. H. C. Nanocatalysis by noble metal nanoparticles: controlled synthesis for the optimization and understanding of activities. Journal of Materials Chemistry A. 7 (11), 5857-5874 (2019).
- Linic, S., Christopher, P., Ingram, D. B. Plasmonic-metal nanostructures for efficient conversion of solar to chemical energy. Nature Materials. 10 (12), 911-921 (2011).
- Nam, J. M., Liz-Marzán, L., Halas, N. Chemical Nanoplasmonics: Emerging Interdisciplinary Research Field at Crossroads between Nanoscale Chemistry and Plasmonics. Accounts of Chemical Research. 52 (11), 2995-2996 (2019).
- Brongersma, M. L., Halas, N. J., Nordlander, P. Plasmon-induced hot carrier science and technology. Nature Nanotechnology. 10 (1), 25-34 (2015).
- Smith, J. G., Faucheaux, J. A., Jain, P. K. Plasmon resonances for solar energy harvesting: A mechanistic outlook. Nano Today. 10 (1), 67-80 (2015).
- Hartland, G. V. Optical studies of dynamics in noble metal nanostructures. Chemical Reviews. 111 (6), 3858-3887 (2011).
- Kelly, K. L., Coronado, E., Zhao, L. L., Schatz, G. C. The optical properties of metal nanoparticles: The influence of size, shape, and dielectric environment. Journal of Physical Chemistry B. 107 (3), 668-677 (2003).
- Hermoso, W., et al. Triangular metal nanoprisms of Ag, Au, and Cu: Modeling the influence of size, composition, and excitation wavelength on the optical properties. Chemical Physics. 423, 142-150 (2013).
- Kumar, A., et al. Rational Design and Development of Lanthanide-Doped NaYF4@CdS-Au-RGO as Quaternary Plasmonic Photocatalysts for Harnessing Visible-Near-Infrared Broadband Spectrum. ACS Applied Materials and Interfaces. 10 (18), 15565-15581 (2018).
- Reddy, K. L., Kumar, S., Kumar, A., Krishnan, V. Wide spectrum photocatalytic activity in lanthanide-doped upconversion nanophosphors coated with porous TiO2 and Ag-Cu bimetallic nanoparticles. Journal of Hazardous Materials. 367, 694-705 (2019).
- Ingram, D. B., Linic, S. Water splitting on composite plasmonic-metal/semiconductor photoelectrodes: Evidence for selective plasmon-induced formation of charge carriers near the semiconductor surface. Journal of the American Chemical Society. 133 (14), 5202-5205 (2011).
- Linic, S., Aslam, U., Boerigter, C., Morabito, M. Photochemical transformations on plasmonic metal nanoparticles. Nature Materials. 14 (6), 567-576 (2015).
- Aslam, U., Rao, V. G., Chavez, S., Linic, S. Catalytic conversion of solar to chemical energy on plasmonic metal nanostructures. Nature Catalyst. 1, 656-665 (2018).
- Araujo, T. P., Quiroz, J., Barbosa, E. C. M., Camargo, P. H. C. Understanding plasmonic catalysis with controlled nanomaterials based on catalytic and plasmonic metals. Current Opinion in Colloid and Interface Science. 39, 110-122 (2019).
- Gellé, A., et al. Applications of plasmon-enhanced nanocatalysis to organic transformations. Chemical Reviews. , 986-1041 (2020).
- Shaik, F., Peer, I., Jain, P. K., Amirav, L. Plasmon-Enhanced Multicarrier Photocatalysis. Nano Letters. 18 (7), 4370-4376 (2018).
- Quiroz, J., et al. Controlling Reaction Selectivity over Hybrid Plasmonic Nanocatalysts. Nano Letters. 18, 7289-7297 (2018).
- Peiris, E., et al. Plasmonic Switching of the Reaction Pathway: Visible-Light Irradiation Varies the Reactant Concentration at the Solid-Solution Interface of a Gold-Cobalt Catalyst. Angewandte Chemie - International Edition. 58 (35), 12032-12036 (2019).
- Yu, S., Wilson, A. J., Heo, J., Jain, P. K. Plasmonic Control of Multi-Electron Transfer and C-C Coupling in Visible-Light-Driven CO2 Reduction on Au Nanoparticles. Nano Letters. 18 (4), 2189-2194 (2018).
- Yu, S., Jain, P. K. Plasmonic photosynthesis of C 1 -C 3 hydrocarbons from carbon dioxide assisted by an ionic liquid. Nature Communications. 10, 2022(2019).
- Zhang, X., et al. Product selectivity in plasmonic photocatalysis for carbon dioxide hydrogenation. Nature Communications. 8, 1-9 (2017).
- Cortés, E. Efficiency and Bond Selectivity in Plasmon-Induced Photochemistry. Advanced Optical Materials. 5 (15), 1700191(2017).
- de Freitas, I. C., et al. Design-controlled synthesis of IrO 2 sub-monolayers on Au nanoflowers: marrying plasmonic and electrocatalytic properties. Nanoscale. , 23-27 (2020).
- Zhang, C., et al. Al-Pd Nanodisk Heterodimers as Antenna-Reactor Photocatalysts. Nano Letters. 16 (10), 6677-6682 (2016).
- Zhou, L., et al. Light-driven methane dry reforming with single atomic site antenna-reactor plasmonic photocatalysts. Nature Energy. 5, 61-70 (2020).
- Swearer, D. F., et al. Heterometallic antenna-reactor complexes for photocatalysis. Proceedings of the National Academy of Sciences. 113 (32), 8916-8920 (2016).
- Peiris, S., Sarina, S., Han, C., Xiao, Q., Zhu, H. -Y. Silver and palladium alloy nanoparticle catalysts: reductive coupling of nitrobenzene through light irradiation. Dalton Transactions. 46 (32), 10665-10672 (2017).
- Rahm, J. M., et al. A Library of Late Transition Metal Alloy Dielectric Functions for Nanophotonic Applications. Advanced Functional Materials. 2002122, 02122(2020).
- Zhang, C., Chen, B. Q., Li, Z. Y., Xia, Y., Chen, Y. G. Surface Plasmon Resonance in Bimetallic Core-Shell Nanoparticles. Journal of Physical Chemistry C. 119 (29), 16836-16845 (2015).
- Liu, Z., Huang, Y., Xiao, Q., Zhu, H. Selective reduction of nitroaromatics to azoxy compounds on supported Ag-Cu alloy nanoparticles through visible light irradiation. Green Chemistry. 18 (3), 817-825 (2016).
- Chaiseeda, K., Nishimura, S., Ebitani, K. Gold nanoparticles supported on alumina as a catalyst for surface plasmon-enhanced selective reductions of nitrobenzene. ACS Omega. 2 (10), 7066-7070 (2017).
- Peiris, S., et al. Metal nanoparticle photocatalysts: emerging processes for green organic synthesis. Catalysis Science and Technology. 6 (2), 320-338 (2016).
- García-García, I., et al. Silver-Based Plasmonic Catalysts for Carbon Dioxide Reduction. ACS Sustainable Chemistry and Engineering. 8 (4), 1879-1887 (2020).
- Agrawal, A., Johns, R. W., Milliron, D. J. Control of Localized Surface Plasmon Resonances in Metal Oxide Nanocrystals. Annual Review of Materials Research. 47 (1), 1-31 (2017).
- Lounis, S. D., Runnerstrom, E. L., Llordés, A., Milliron, D. J. Defect chemistry and Plasmon physics of colloidal metal oxide Nanocrystals. Journal of Physical Chemistry Letters. 5 (9), 1564-1574 (2014).
- Rej, S., et al. Determining Plasmonic Hot Electrons and Photothermal Effects during H2 Evolution with TiN-Pt Nanohybrids. ACS Catalysis. 10 (9), 5261-5271 (2020).
- Barragan, A. A., et al. Photochemistry of Plasmonic Titanium Nitride Nanocrystals. The Journal of Physical Chemistry C. 123 (35), 21796-21804 (2019).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon