Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Herstellung von silber-palladiumlegierten Nanopartikeln zur Plasmonischen Katalyse unter sichtbarer Lichtbeleuchtung
In diesem Artikel
Zusammenfassung
Hier wird ein Protokoll zur Synthese von Silber-Palladium (Ag-Pd) Legierung Nanopartikel (NPs) auf ZrO2 unterstützt (Ag-Pd/ZrO2). Dieses System ermöglicht die Gewinnung von Energie aus sichtbarer Lichtbestrahlung, um molekulare Transformationen zu beschleunigen und zu steuern. Dies wird durch die Nitrobenzolreduktion unter Lichtbestrahlung veranschaulicht, die von Ag-Pd/ZrO2 NPs katalysiert wird.
Zusammenfassung
Lokalisierte Oberflächen-Plasmonresonanz (LSPR) in plasmonischen Nanopartikeln (NPs) kann die Selektivität einer Vielzahl molekularer Transformationen beschleunigen und steuern. Dies eröffnet Möglichkeiten für die Verwendung von sichtbarem oder IR-nahen Licht als nachhaltiger Input für Antriebs- und Kontrollreaktionen, wenn Plasmonische Nanopartikel, die die LSPR-Erregung in diesen Bereichen unterstützen, als Katalysatoren eingesetzt werden. Leider ist dies bei mehreren katalytischen Metallen wie Palladium (Pd) nicht der Fall. Eine Strategie, um diese Einschränkung zu überwinden, ist die Verwendung bimetallischer NPs, die plasmonische und katalytische Metalle enthalten. In diesem Fall kann die LSPR-Erregung im Plasmonischen Metall dazu beitragen, Transformationen, die von der katalytischen Komponente angetrieben werden, zu beschleunigen und zu steuern. Die hier in diesem Verfahren berichtete Methode konzentriert sich auf die Synthese von bimetallischen Silber-Palladium (Ag-Pd) NPs, die auf ZrO2 (Ag-Pd/ZrO2) unterstützt werden und als plasmonisch-katalytisches System wirken. Die NPs wurden durch Co-Imprägnierung entsprechender Metallvorläufer auf der ZrO2-Unterstützung vorbereitet, gefolgt von gleichzeitiger Reduktion, die zur Bildung von bimetallischen NPs direkt auf der ZrO2-Unterstützung führte. Die Ag-Pd/ZrO2 NPs wurden dann als Plasmonische Katalysatoren zur Reduktion von Nitrobenzol unter 425 nm Beleuchtung durch LED-Lampen eingesetzt. Mit Hilfe der Gaschromatographie (GC) kann die Umwandlung und Selektivität der Reduktionsreaktion unter den dunklen und hellen Bestrahlungsbedingungen überwacht werden, was die verbesserte katalytische Leistungsfähigkeit und Kontrolle der Selektivität unter LSPR-Erregung nach der Legierung nicht-plasmonischer Pd mit Plasmonischem Metall Ag demonstriert. Diese Technik kann an eine Breite von molekularen Transformationen und NPs-Zusammensetzungen angepasst werden, was sie für die Charakterisierung der plasmonischen katalytischen Aktivität verschiedener Arten von Katalyse in Bezug auf Umwandlung und Selektivität nützlich macht.
Einleitung
Unter den verschiedenen Anwendungen von Metall-Nanopartikeln (NPs) verdient die Katalyse besondere Aufmerksamkeit. Die Katalyse spielt eine zentrale Rolle in einer nachhaltigen Zukunft, trägt zu weniger Energieverbrauch, besserer Nutzung von Rohstoffen bei und ermöglicht sauberere Reaktionsbedingungen1,2,3,4. So können Fortschritte in der Katalyse Instrumente zur Verbesserung der atomaren Effizienz chemischer Prozesse bereitstellen, die sie sauberer, wirtschaftlicher und umweltfreundlicher machen. Metall-NPs, die Silber (Ag), Gold (Au) oder Kupfer (Cu) umfassen, können interessante optische Eigenschaften im sichtbaren Bereich aufweisen, die sich aus der einzigartigen Art und Weise ergeben, wie diese Systeme über die lokalisierte Oberflächen-Plasmonresonanz (LSPR) Anregung5,6,7,8. In diesen NPs, die als Plasmonische NPs bezeichnet werden, umfasst die LSPR die Resonanzinteraktion zwischen den einfallenden Photonen (von einer eingehenden elektromagnetischen Welle) mit der kollektiven Bewegung der Elektronen5,6,7,8. Dieses Phänomen tritt in einer charakteristischen Frequenz auf, die von der Größe, Form, Zusammensetzung und Dielektrizitätskonstante der Umgebung9,10,11abhängt. Für Ag, Au und Cu können diese Frequenzen beispielsweise von der sichtbaren bis zur Nah-IR reichen und Möglichkeiten für die Nutzung von Sonnenenergie eröffnen, um ihre LSPR5,6,7,8,12,13zu erregen.
Kürzlich wurde gezeigt, dass die LSPR-Erregung in plasmonischen NPs dazu beitragen kann, die Raten zu beschleunigen und die Selektivität molekularer Transformationen5,14,15,16,17,18,19zu kontrollieren. Dies führte zu einem Feld namens Plasmonische Katalyse, die sich auf die Verwendung von Energie aus Licht konzentrieren, um chemische Transformationen zu beschleunigen, anzutreiben und/oder zu kontrollieren5,14,15,16,17,18,19. In diesem Zusammenhang wurde festgestellt, dass die LSPR-Erregung in plasmonischen NPs zur Bildung energetischer heißer Elektronen und Löcher führen kann, die als LSPR-erregte Heißträger bezeichnet werden. Diese Träger können mit adsorbten Arten durch elektronische oder Schwingungsaktivierung interagieren15,16. Neben erhöhten Reaktionsraten kann dieses Verfahren auch alternative Reaktionswege bieten, die nicht über herkömmliche thermochemisch gesteuerte Prozesse zugänglich sind, und neue Wege für die Steuerung der Reaktionsselektivität20,21,22,23,24,25eröffnen. Wichtig ist, dass es erwähnenswert ist, dass der Plasmonzerfall auch zu einer thermischen Ableitung führen kann, was zu einem Temperaturanstieg in der Nähe der NPs führen kann, was auch zur Beschleunigung der Reaktionsraten15,16beitragen kann.
Aufgrund dieser interessanten Eigenschaften wurde die Plasmonische Katalyse erfolgreich für eine Vielzahl molekularer Transformationen eingesetzt18. Dennoch bleibt eine wichtige Herausforderung bestehen. Während Plasmonische NPs wie Ag und Au hervorragende optische Eigenschaften im sichtbaren und nahen IR-Bereich aufweisen, sind ihre katalytischen Eigenschaften in Bezug auf den Umfang von Transformationen begrenzt. Mit anderen Worten, sie zeigen keine guten katalytischen Eigenschaften für mehrere Transformationen. Darüber hinaus unterstützen Metalle, die bei der Katalyse wichtig sind, wie Palladium (Pd) und Platin (Pt), keine LSPR-Erregung im sichtbaren oder nahen IR-Bereich. Um diese Lücke zu überbrücken, stellen bimetallische NPs, die ein plasmonisches und katalytisches Metall enthalten, eine effektive Strategie20,26,27,28,29dar. In diesen Systemen kann das Plasmonische Metall als Antenne eingesetzt werden, um Energie aus der Lichterregung durch das LSPR zu ernten, das dann verwendet wird, um molekulare Transformationen am katalytischen Metall anzutreiben, zu beschleunigen und zu steuern. Daher ermöglicht uns diese Strategie, die Plasmonische Katalyse über traditionelle Plasmonische Metall-NPs hinaus zu erweitern20,26,27,28,29.
Dieses Protokoll beschreibt die einfache Synthese von bimetallischen Silber-Palladium (Ag-Pd) legierten NPs, die auf ZrO2 (Ag-Pd/ZrO2) unterstützt werden und als plasmonisch-katalytisches System für die Plasmonische Katalyse fungieren können. Die Ag-Pd/ZrO2 NPs wurden durch Co-Imprägnierung der entsprechenden Metallvorläufer auf der ZrO 2-Stütze mit anschließender gleichzeitiger Reduktion30vorbereitet. Dieser Ansatz führte zur Bildung von bimetallischen NPs mit einer Größe von etwa 10 nm (Durchmesser) direkt an der Oberfläche des ZrO 2-Trägers. Die NPs setzten sich aus 1 mol% Pd zusammen, um die Nutzung des katalytischen Metalls zu minimieren und gleichzeitig die optischen Eigenschaften der resultierenden Ag-Pd NPs zu maximieren. Zur Reduktion von Nitrobenzol wurde ein Protokoll zur Anwendung der Ag-Pd/ZrO2 NPs in der Plasmonischen Katalyse nachgewiesen. Wir haben 425 nm LED-Beleuchtung für die LSPR-Erregung eingesetzt. Die Gaschromatographie wurde durchgeführt, um die Umwandlung und Selektivität der Reduktionsreaktion unter den dunklen und hellen Bestrahlungsbedingungen zu überwachen. DIE LSPR-Erregung führte zu einer verbesserten katalytischen Leistung und Kontrolle der Selektivität in Ag-Pd/ZrO2 NPs im Verhältnis zu rein thermisch angetriebenen Bedingungen. Die in diesem Protokoll beschriebene Methode basiert auf einem einfachen photokatalytischen Reaktionsaufbau in Verbindung mit gaschromatographie und kann an eine Vielzahl molekularer Transformationen und NPs-Zusammensetzungen angepasst werden. Somit ermöglicht diese Methode die Charakterisierung der photokatalytischen Aktivität in Bezug auf Umwandlung und Reaktionsselektivität, verschiedenen NPs und für eine Vielzahl von Flüssigkeitsphasentransformationen. Wir glauben, dass dieser Artikel wichtige Leitlinien und Einblicke sowohl für Neulinge als auch für erfahrenere Wissenschaftler auf diesem Gebiet bieten wird.
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Synthese von Ag-Pd/ZrO2 NPs
HINWEIS: Bei diesem Verfahren entsprach die Pd mol% in Ag-Pd 1%, und die Ag-Pd-Beladung auf ZrO2 entsprach 3 Gew.%.
- 1 g ZrO2 Pulver in ein 250 ml Becherglas geben.
- 50 ml einer AgNO3 (aq) (0,0059 mol/L) und 9,71 ml einer K2PdCl4 (aq) (0.00031 mol/L) Lösungen zum Becher unter kräftigem magnetischem Rühren (500 U/min) bei Raumtemperatur hinzufügen.
- 10 ml Lysin (0,53 M) wässrige Lösung hinzufügen.
- Halten Sie die Mischung unter kräftigem Rühren (500 U/min) für 20 min.
- Nach 20 min verwenden Sie eine Pipette, um die Suspension 10 ml einer frisch zubereiteten NaBH4 (aq) (0,035 M) Lösung tropfenweise mit einer Rate von 1 ml/min hinzuzufügen. Halten Sie die Suspension während des gesamten Prozesses unter Rühren (500 U/min).
- Lassen Sie die Mischung 30 min bei Raumtemperatur umrühren.
2. Trennung und Reinigung des Katalysators
- Die Suspension auf Zentrifugenrohre übertragen und die Feststoffe durch Zentrifugation bei 3.260 x g 10 min von der Mischung trennen.
- Entfernen Sie vorsichtig die flüssige Phase mit einer Pipette und fügen Sie 15 ml deionisiertes Wasser in die Rohre.
- Kräftig schütteln, bis eine Dispersion des Festkörpers erreicht ist. Wenn keine gute Dispersion erreicht wird, legen Sie die Rohre für 5 min in ein Ultraschallbad.
- Zentrifugieren Sie die Dispersion bei 3.260 x g für 10 min.
- Wiederholen Sie die Waschschritte (2.2. bis 2.2.2.) zwei weitere Male mit entionisiertem Wasser, dann einmal mit Ethanol anstelle von Wasser.
- Das Ethanol entfernen und im Ofen bei 60 °C 12 h trocknen.
- Charakterisieren Sie die vorbereiteten Ag-Pd/ZrO2 NPs durch eine Vielzahl von Mikroskopie-, Elementar- und Spektroskoptechniken.
3. Synthese von Ag/ZrO2 NPs
HINWEIS: Bei diesem Verfahren entsprach die Ag-Belastung auf ZrO2 3 Gew.%.
- 1 g ZrO2 Pulver in ein 250 ml Becherglas geben.
- 50 ml einer AgNO3 (aq) (0,0059 mol/l) Lösung unter kräftigem magnetischem Rühren (500 U/min) bei Raumtemperatur in den Becher geben.
- 10 ml Lysin (0,53 M) wässrige Lösung hinzufügen.
- Halten Sie die Mischung unter kräftigem Rühren (500 U/min) für 20 min.
- Nach 20 min verwenden Sie eine Pipette, um die Suspension 10 ml einer frisch zubereiteten NaBH4 (aq) (0,035 M) Lösung tropfenweise mit einer Rate von 1 ml/min hinzuzufügen. Halten Sie die Suspension während des gesamten Prozesses unter Rühren (500 U/min).
- Lassen Sie die Mischung 30 min unter Raumtemperatur umrühren.
4. Trennung und Reinigung des Katalysators
- Die Suspension auf Zentrifugenrohre übertragen und die Feststoffe durch Zentrifugation bei 3.260 x g 10 min von der Mischung trennen.
- Entfernen Sie vorsichtig die flüssige Phase mit einer Pipette und fügen Sie 15 ml deionisiertes Wasser in die Rohre.
- Kräftig schütteln, bis die Dispersion des Festkörpers beobachtet wird. Wenn keine gute Dispersion erreicht wird, legen Sie die Rohre für 5 min in ein Ultraschallbad.
- Zentrifugieren Sie die Dispersion bei 3.260 x g für 10 min.
- Wiederholen Sie die Waschschritte (4.2. bis 4.2.2.) zwei weitere Male mit entionisiertem Wasser, dann einmal mit Ethanol anstelle von Wasser.
- Das Ethanol entfernen und im Ofen bei 60 °C 12 h trocknen.
- Die vorbereiteten Ag/ZrO2 NPs können dann durch eine Vielzahl von Mikroskopie-, Elementar- und Spektroskoptechniken charakterisiert werden.
5. Untersuchung der plasmonischen katalytischen Leistung zur Nitrobenzolreduktion unter LSPR-Erregung (Lichtbeleuchtung)
- Legen Sie 30 mg Katalysator in einen 25 ml Rundbodenkolben zusammen mit einem magnetischen Rührstab.
- 5 ml einer Lösung von Nitrobenzol (0,03 mol/L) in Isopropylalkohol (IPA) in den Reaktor geben.
- Dann 11,22 mg KOH-Pulver (0,0002 Mol) hinzufügen.
- Reinigen Sie den Reaktor, indem Sie die Suspension mit einem Argonstrom für 1 min sprudeln. Unmittelbar nach dem Spülen den Kolben versiegeln.
- Stellen Sie den Reaktor in ein Ölbad, das bei 70 °C erhitzt wird, über einem temperaturgeregelten Magnetrührer (500 Umdrehungen pro Minute).
- Bestrahlen Sie das Rohr mit 4 LED-Lampen mit einer Wellenlänge von 425 nm als Lichtquelle und einer Lichtintensität von 0,5 W/cm2. Der Abstand von den Lampen zum Reaktionskolben sollte 7 cm betragen.
- Lassen Sie die Reaktion 2,5 h bei 70 °C unter kräftigem magnetischem Rühren (500 U/min) ablaufen.
- Schalten Sie dann das Licht aus, öffnen Sie den Reaktor und verwenden Sie eine Spritze und eine Nadel, um eine 1 ml Probe zu sammeln. Filtern Sie es durch einen 0,45 m-Filter, um die Katalysatorpartikel zu entfernen, in eine Gaschromatographie-Durchstechflasche.
6. Reaktion in Abwesenheit von LSPR-Erregung (dunkle Bedingungen)
- Führen Sie die gleichen Schritte wie in 5 beschrieben, aber ohne Lichtbestrahlung. Wickeln Sie das Reaktionsrohr mit Aluminiumfolie, um eine Lichteinwirkung zu verhindern.
7. Analysevorbereitung der Gaschromatographie (GC)
- Bereiten Sie eine IPA-Lösung vor, die ca. 30 mmol/L Nitrobenzol (NB), 30 mmol/L Aniin (AN) und 30 mmol/L Azobenzol (AB) enthält.
- Führen Sie eine GC-Analyse der Lösung mit einer geeigneten Methode aus. Verschiedene Methoden können getestet werden, indem die Säulentemperatur- und Gasdurchflussprogramme variiert werden. Die ausgewählte Methode sollte in der Lage sein, die Spitzen, die IPA, NB, AN und AB entsprechen, während der Mindesthaltedauer der Aufbewahrung zu trennen.
- Nach der Auswahl der Methode bereiten Sie eine Reihe von Lösungen von 50 mM, 25 mM, 10 mM, 5 mM und 2,5 mM NB in IPA und eine weitere Reihe von Lösungen von AN und AB in IPA mit den gleichen Konzentrationen vor.
- Führen Sie eine GC-Analyse der vorbereiteten Lösungen durch. Jedes Chromatogramm sollte 2 Spitzen enthalten: der höhere entspricht IPA und das untere entspricht NB, AN oder AB. Beachten Sie für jedes Chromatogramm die Retentionszeit und den Spitzenbereich aller Spitzen.
- Verfolgen Sie die Kalibrierkurven von NB, AN und AB, indem Sie die Konzentration im Vergleich zur Spitzenfläche jeder Probe nachzeichnen.
8. GC-Analyse
- Führen Sie eine GC-Analyse für die in den Schritten 5 gesammelten Stichproben durch. und 6. mit der gleichen Methode, die für die Schritte 7.2 verwendet wird. und 7.4.
- Notieren Sie sich für jedes Chromatogramm die Retentionszeit und den Spitzenbereich, und verwenden Sie die zuvor dargestellten Kalibrierkurven, um die Konzentration von NB, AN und AB in den Proben zu bestimmen.
- Berechnen Sie die Nitrobenzolumwandlung sowie die Aniline- und Azobenzenselektivität mit den Gleichungen:
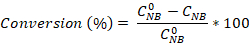
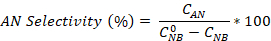
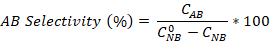
Wobei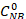 die anfängliche NB-Konzentration (0,03 mol/L) und CNB, CAN, CAB den NB-, AN- und AB-Konzentrationen nach 2,5 Stunden Reaktion durch die GC-Analyse entsprechen.
die anfängliche NB-Konzentration (0,03 mol/L) und CNB, CAN, CAB den NB-, AN- und AB-Konzentrationen nach 2,5 Stunden Reaktion durch die GC-Analyse entsprechen.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Abbildung 1A zeigt digitale Fotos der festen Proben mit dem reinen ZrO2-Oxid (links) und den Ag-Pd/ZrO2 NPs (rechts). Diese Farbänderung von Weiß (in ZrO2) zu Braun (Ag-Pd/ZrO2) liefert den ersten qualitativen Beweis für die Abscheidung von Ag-Pd NPs an der ZrO2-Oberfläche. Abbildung 1B zeigt die UV-sichtbaren Absorptionsspektren der Ag-Pd/ZrO2 NPs (blaue Spur) sowie ZrO2 (schwarze ...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Die in diesem Verfahren beschriebenen Ergebnisse zeigen, dass die intrinsische katalytische Aktivität von Pd (oder anderem katalytischen, aber nicht plasmonischen Metall) durch LSPR-Erregung durch sichtbare Lichtbestrahlung in bimetallisch legierten NPs35signifikant verstärkt werden kann. In diesem Fall ist Ag (oder ein anderes Plasmonisches Metall) in der Lage, Energie aus der bestrahlung von sichtbarem Licht über LSPR-Erregung zu ernten. Die LSPR-Erregung führt zur Bildung von Heißladungstr...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde von der Universität Helsinki und der Jane and Aatos Erkko Foundation unterstützt. S.H. dankt Erasmus+ EU-Mitteln für das Stipendium.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| 2-Propanol (anhydrous, 99.5%) | Sigma-Aldrich | 278475 | CAS Number 67-63-0 |
| Aniline (for synthesis) | Sigma-Aldrich | 8.22256 | CAS Number 62-53-3 |
| Azobenzene (98%) | Sigma-Aldrich | 424633 | CAS Number 103-33-3 |
| Ethanol | Honeywell | 32221 | CAS Number 64-17-5 |
| Hydrochloric acid (37%) | VWR | PRLSMC310066 | CAS Number 7647-01-0 |
| L-Lysine (crystallized, ≥98.0% (NT)) | Sigma-Aldrich | 62840 | CAS Number 56-87-1 |
| Nitric acid (65%) | Merck | 100456 | CAS Number 7697-37-2 |
| Nitrobenzene | Sigma-Aldrich | 8.06770 | CAS Number 98-95-3 |
| Potassium hydroxide | Fisher | 10448990 | CAS Number 1310-58-3 |
| Potassium tetrachloropalladate (II) (98%) | Sigma-Aldrich | 205796 | CAS Number 10025-98-6 |
| Silver nitrate (ACS reagent, ≥99.0%) | Sigma-Aldrich | 209139 | CAS Number 7761-88-8 |
| Sodium borohydride (fine granular for synthesis) | Sigma-Aldrich | 8.06373 | CAS Number 16940-66-2 |
| Zirconium (IV) oxide (nanopowder, <100 nm particle size (TEM)) | Sigma-Aldrich | 544760 | CAS Number 1314-23-4 |
Referenzen
- Dunn, P. J., Hii, K. K., Krische, M. J., Williams, M. T. Sustainable Catalysis: Challenges and Pratices for the Pharmaceutical and Fine Chemical Industries. , Wiley-Blackwell. (2013).
- Tzouras, N. V., Stamatopoulos, I. K., Papastavrou, A. T., Liori, A. A., Vougioukalakis, G. C. Sustainable metal catalysis in C-H activation. Coordination Chemistry Reviews. 343, 25(2017).
- Polshettiwar, V., Varma, R. S. Green chemistry by nano-catalysis. Green Chemistry. 12 (5), 743(2010).
- Rodrigues, T. S., da Silva, A. G. M., Camargo, P. H. C. Nanocatalysis by noble metal nanoparticles: controlled synthesis for the optimization and understanding of activities. Journal of Materials Chemistry A. 7 (11), 5857-5874 (2019).
- Linic, S., Christopher, P., Ingram, D. B. Plasmonic-metal nanostructures for efficient conversion of solar to chemical energy. Nature Materials. 10 (12), 911-921 (2011).
- Nam, J. M., Liz-Marzán, L., Halas, N. Chemical Nanoplasmonics: Emerging Interdisciplinary Research Field at Crossroads between Nanoscale Chemistry and Plasmonics. Accounts of Chemical Research. 52 (11), 2995-2996 (2019).
- Brongersma, M. L., Halas, N. J., Nordlander, P. Plasmon-induced hot carrier science and technology. Nature Nanotechnology. 10 (1), 25-34 (2015).
- Smith, J. G., Faucheaux, J. A., Jain, P. K. Plasmon resonances for solar energy harvesting: A mechanistic outlook. Nano Today. 10 (1), 67-80 (2015).
- Hartland, G. V. Optical studies of dynamics in noble metal nanostructures. Chemical Reviews. 111 (6), 3858-3887 (2011).
- Kelly, K. L., Coronado, E., Zhao, L. L., Schatz, G. C. The optical properties of metal nanoparticles: The influence of size, shape, and dielectric environment. Journal of Physical Chemistry B. 107 (3), 668-677 (2003).
- Hermoso, W., et al. Triangular metal nanoprisms of Ag, Au, and Cu: Modeling the influence of size, composition, and excitation wavelength on the optical properties. Chemical Physics. 423, 142-150 (2013).
- Kumar, A., et al. Rational Design and Development of Lanthanide-Doped NaYF4@CdS-Au-RGO as Quaternary Plasmonic Photocatalysts for Harnessing Visible-Near-Infrared Broadband Spectrum. ACS Applied Materials and Interfaces. 10 (18), 15565-15581 (2018).
- Reddy, K. L., Kumar, S., Kumar, A., Krishnan, V. Wide spectrum photocatalytic activity in lanthanide-doped upconversion nanophosphors coated with porous TiO2 and Ag-Cu bimetallic nanoparticles. Journal of Hazardous Materials. 367, 694-705 (2019).
- Ingram, D. B., Linic, S. Water splitting on composite plasmonic-metal/semiconductor photoelectrodes: Evidence for selective plasmon-induced formation of charge carriers near the semiconductor surface. Journal of the American Chemical Society. 133 (14), 5202-5205 (2011).
- Linic, S., Aslam, U., Boerigter, C., Morabito, M. Photochemical transformations on plasmonic metal nanoparticles. Nature Materials. 14 (6), 567-576 (2015).
- Aslam, U., Rao, V. G., Chavez, S., Linic, S. Catalytic conversion of solar to chemical energy on plasmonic metal nanostructures. Nature Catalyst. 1, 656-665 (2018).
- Araujo, T. P., Quiroz, J., Barbosa, E. C. M., Camargo, P. H. C. Understanding plasmonic catalysis with controlled nanomaterials based on catalytic and plasmonic metals. Current Opinion in Colloid and Interface Science. 39, 110-122 (2019).
- Gellé, A., et al. Applications of plasmon-enhanced nanocatalysis to organic transformations. Chemical Reviews. , 986-1041 (2020).
- Shaik, F., Peer, I., Jain, P. K., Amirav, L. Plasmon-Enhanced Multicarrier Photocatalysis. Nano Letters. 18 (7), 4370-4376 (2018).
- Quiroz, J., et al. Controlling Reaction Selectivity over Hybrid Plasmonic Nanocatalysts. Nano Letters. 18, 7289-7297 (2018).
- Peiris, E., et al. Plasmonic Switching of the Reaction Pathway: Visible-Light Irradiation Varies the Reactant Concentration at the Solid-Solution Interface of a Gold-Cobalt Catalyst. Angewandte Chemie - International Edition. 58 (35), 12032-12036 (2019).
- Yu, S., Wilson, A. J., Heo, J., Jain, P. K. Plasmonic Control of Multi-Electron Transfer and C-C Coupling in Visible-Light-Driven CO2 Reduction on Au Nanoparticles. Nano Letters. 18 (4), 2189-2194 (2018).
- Yu, S., Jain, P. K. Plasmonic photosynthesis of C 1 -C 3 hydrocarbons from carbon dioxide assisted by an ionic liquid. Nature Communications. 10, 2022(2019).
- Zhang, X., et al. Product selectivity in plasmonic photocatalysis for carbon dioxide hydrogenation. Nature Communications. 8, 1-9 (2017).
- Cortés, E. Efficiency and Bond Selectivity in Plasmon-Induced Photochemistry. Advanced Optical Materials. 5 (15), 1700191(2017).
- de Freitas, I. C., et al. Design-controlled synthesis of IrO 2 sub-monolayers on Au nanoflowers: marrying plasmonic and electrocatalytic properties. Nanoscale. , 23-27 (2020).
- Zhang, C., et al. Al-Pd Nanodisk Heterodimers as Antenna-Reactor Photocatalysts. Nano Letters. 16 (10), 6677-6682 (2016).
- Zhou, L., et al. Light-driven methane dry reforming with single atomic site antenna-reactor plasmonic photocatalysts. Nature Energy. 5, 61-70 (2020).
- Swearer, D. F., et al. Heterometallic antenna-reactor complexes for photocatalysis. Proceedings of the National Academy of Sciences. 113 (32), 8916-8920 (2016).
- Peiris, S., Sarina, S., Han, C., Xiao, Q., Zhu, H. -Y. Silver and palladium alloy nanoparticle catalysts: reductive coupling of nitrobenzene through light irradiation. Dalton Transactions. 46 (32), 10665-10672 (2017).
- Rahm, J. M., et al. A Library of Late Transition Metal Alloy Dielectric Functions for Nanophotonic Applications. Advanced Functional Materials. 2002122, 02122(2020).
- Zhang, C., Chen, B. Q., Li, Z. Y., Xia, Y., Chen, Y. G. Surface Plasmon Resonance in Bimetallic Core-Shell Nanoparticles. Journal of Physical Chemistry C. 119 (29), 16836-16845 (2015).
- Liu, Z., Huang, Y., Xiao, Q., Zhu, H. Selective reduction of nitroaromatics to azoxy compounds on supported Ag-Cu alloy nanoparticles through visible light irradiation. Green Chemistry. 18 (3), 817-825 (2016).
- Chaiseeda, K., Nishimura, S., Ebitani, K. Gold nanoparticles supported on alumina as a catalyst for surface plasmon-enhanced selective reductions of nitrobenzene. ACS Omega. 2 (10), 7066-7070 (2017).
- Peiris, S., et al. Metal nanoparticle photocatalysts: emerging processes for green organic synthesis. Catalysis Science and Technology. 6 (2), 320-338 (2016).
- García-García, I., et al. Silver-Based Plasmonic Catalysts for Carbon Dioxide Reduction. ACS Sustainable Chemistry and Engineering. 8 (4), 1879-1887 (2020).
- Agrawal, A., Johns, R. W., Milliron, D. J. Control of Localized Surface Plasmon Resonances in Metal Oxide Nanocrystals. Annual Review of Materials Research. 47 (1), 1-31 (2017).
- Lounis, S. D., Runnerstrom, E. L., Llordés, A., Milliron, D. J. Defect chemistry and Plasmon physics of colloidal metal oxide Nanocrystals. Journal of Physical Chemistry Letters. 5 (9), 1564-1574 (2014).
- Rej, S., et al. Determining Plasmonic Hot Electrons and Photothermal Effects during H2 Evolution with TiN-Pt Nanohybrids. ACS Catalysis. 10 (9), 5261-5271 (2020).
- Barragan, A. A., et al. Photochemistry of Plasmonic Titanium Nitride Nanocrystals. The Journal of Physical Chemistry C. 123 (35), 21796-21804 (2019).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten