Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Preparación de nanopartículas de aleación silver-palladium para catálisis plásmiónica bajo iluminación de luz visible
En este artículo
Resumen
Aquí se presenta un protocolo para la síntesis de nanopartículas de aleación de paladio de plata (Ag-Pd) soportadas en ZrO2 (Ag-Pd/ZrO2). Este sistema permite cosechar energía a partir de irradiación de luz visible para acelerar y controlar transformaciones moleculares. Esto se ilustra mediante la reducción de nitrobenzene bajo irradiación ligera catalizada por Ag-Pd/ZrO2 NPs.
Resumen
La resonancia localizada del plásmido superficial (LSPR) en nanopartículas plásmidas (NPs) puede acelerar y controlar la selectividad de una variedad de transformaciones moleculares. Esto abre posibilidades para el uso de luz visible o cercana al IR como una entrada sostenible para impulsar y controlar las reacciones cuando las nanopartículas plásicas que soportan la excitación LSPR en estos rangos se emplean como catalizadores. Desafortunadamente, este no es el caso de varios metales catalíticos como el paladio (Pd). Una estrategia para superar esta limitación es emplear NPs bimetálicos que contengan metales plásmidos y catalíticos. En este caso, la excitación LSPR en el metal plásmido puede contribuir a acelerar y controlar las transformaciones impulsadas por el componente catalítico. El método aquí reportado se centra en la síntesis de NPs bimetálicos plata-paladio (Ag-Pd) apoyados en ZrO2 (Ag-Pd/ZrO2)que actúa como un sistema plásmido-catalítico. Los NPs se prepararon mediante la co-impregnación de los precursores metálicos correspondientes en el soporte ZrO2, seguidos de una reducción simultánea que condujo a la formación de NPs bimetálicos directamente en el soporte ZrO2. Los NPs Ag-Pd/ZrO2 se utilizaron entonces como catalizadores plásmidos para la reducción de nitrobenzene bajo iluminación de 425 nm por lámparas LED. Utilizando cromatografía de gases (GC), se puede controlar la conversión y selectividad de la reacción de reducción bajo las condiciones de irradiación oscura y ligera, demostrando el mayor rendimiento catalítico y el control sobre la selectividad bajo excitación LSPR después de aleación pd no plásmido con metal plásmido Ag. Esta técnica se puede adaptar a una amplia gama de transformaciones moleculares y composiciones NPs, por lo que resulta útil para la caracterización de la actividad catalítica plásmida de diferentes tipos de catálisis en términos de conversión y selectividad.
Introducción
Entre las diversas aplicaciones de las nanopartículas metálicas (NPs), la catálisis merece una atención especial. La catálisis juega un papel central en un futuro sostenible, contribuyendo a un menor consumo de energía, una mejor utilización de las materias primas y permitiendo condiciones de reacción más limpias1,2,3,4. Por lo tanto, el progreso en la catálisis puede proporcionar herramientas para mejorar la eficiencia atómica de los procesos químicos, haciéndolos más limpios, más viables económicamente y más respetuosos con el medio ambiente. Los NPs metálicos que abarcan plata (Ag), oro (Au) o cobre (Cu) pueden mostrar interesantes propiedades ópticas en el rango visible que surgen de la forma única en que estos sistemas interactúan con la luz a nanoescala a través de la excitación de resonancia de plásmido superficial localizada (LSPR)5,6,7,8. En estos NPs, conocidos como NPs plasmónicos, el LSPR comprende la interacción resonante entre los fotones incidente (de una onda electromagnética entrante) con el movimiento colectivo de electrones5,6,7,8. Este fenómeno tiene lugar a una frecuencia característica que depende del tamaño, la forma, la composición y la constante dieléctrica del entorno9,10,11. Por ejemplo, para Ag, Au y Cu, estas frecuencias pueden ir desde lo visible hasta lo cercano al IR, abriendo posibilidades para la utilización de energía solar para excitar sus LSPR5,6,7,8,12,13.
Recientemente, se ha demostrado que la excitación LSPR en los NPs plásmidos puede contribuir a acelerar las tasas y controlar la selectividad de las transformaciones moleculares5,14,15,16,17,18,19. Esto dio origen a un campo llamado catálisis plásmil, que se centran en el uso de energía de la luz para acelerar, conducir y/o controlar transformaciones químicas5,14,15,16,17,18,19. En este contexto, se ha establecido que la excitación LSPR en los NPs plásmidos puede conducir a la formación de electrones y agujeros calientes energéticos, conocidos como portadores calientes excitados por LSPR. Estos operadores pueden interactuar con especies adsorbidas a través de la activación electrónica o vibratoria15,16. Además del aumento de las tasas de reacción, este proceso también puede proporcionar vías de reacción alternativas no accesibles a través de procesos tradicionales impulsados por termoquímica, abriendo nuevas vías para el control sobre la selectividad de reacción20,21,22,23,24,25. Es importante destacar que vale la pena señalar que la descomposición del plásmido también puede conducir a la disipación térmica, lo que conduce a un aumento de la temperatura en las proximidades de los NPs que también puede contribuir a acelerar las tasas de reacción15,16.
Debido a estas características interesantes, catálisis plásmil se ha empleado con éxito hacia una variedad de transformaciones moleculares18. No obstante, sigue existiendo un reto importante. Mientras que los NPs plásmidos como Ag y Au muestran excelentes propiedades ópticas en los rangos visibles y cercanos al IR, sus propiedades catalíticas son limitadas en términos del alcance de las transformaciones. En otras palabras, no muestran buenas propiedades catalíticas para varias de transformaciones. Además, los metales que son importantes en la catálisis, como el paladio (Pd) y el platino (Pt), no admiten la excitación LSPR en los rangos visibles o cercanos al IR. Para cerrar esta brecha, los NPs bimetálicos que contienen un metal plásmido y catalítico representan una estrategia efectiva20,26,27,28,29. En estos sistemas, el metal plásmido se puede emplear como una antena para cosechar energía de la excitación de la luz a través del LSPR, que luego se utiliza para impulsar, acelerar y controlar transformaciones moleculares en el metal catalítico. Por lo tanto, esta estrategia nos permite extender la catálisis plasmónica más allá del metal plasmónico tradicional NPs20,26,27,28,29.
Este protocolo describe la síntesis fácil de NPs aleados de plata-paladio bimetálico (Ag-Pd) apoyados en ZrO2 (Ag-Pd/ZrO2)que pueden actuar como un sistema plásmido-catalítico para la catálisis plásmiónica. Los NPs Ag-Pd/ZrO2 se prepararon mediante la co-impregnación de los precursores metálicos correspondientes en el soporte ZrO2 seguidos de la reducción simultánea30. Este enfoque condujo a la formación de NPs bimetálicos de alrededor de 10 nm de tamaño (diámetro) directamente en la superficie del soporte ZrO2. Los NPs se componían de 1 mol% de Pd para minimizar la utilización del metal catalítico mientras maximizaban las propiedades ópticas de los NPs Ag-Pd resultantes. Se demostró un protocolo para la aplicación de los NPs Ag-Pd/ZrO2 en catálisis plásmiónica para la reducción del nitrobenzene. Empleamos iluminación LED de 425 nm para la excitación LSPR. Se realizó cromatografía de gases para monitorear la conversión y selectividad de la reacción de reducción bajo las condiciones de irradiación oscura y ligera. La excitación LSPR condujo a un mayor rendimiento catalítico y control sobre la selectividad en ag-pd/ZrO2 NPs en relación con condiciones puramente impulsadas térmicamente. El método descrito en este protocolo se basa en una simple configuración de reacción fotocatalítica junto con cromatografía de gases y se puede adaptar a una amplia gama de transformaciones moleculares y composiciones NPs. Por lo tanto, este método hace posible la caracterización de la actividad fotocatalítica, en términos de selectividad de conversión y reacción, de diferentes NPs y para una miríada de transformaciones en fase líquida. Creemos que este artículo proporcionará importantes directrices e ideas tanto a los recién llegados como a los científicos más experimentados en el campo.
Protocolo
1. Síntesis de Ag-Pd/ZrO2 NPs
NOTA: En este procedimiento, el Pd mol% en Ag-Pd correspondió al 1%, y la carga Ag-Pd en ZrO2 correspondió al 3%.
- Coloque 1 g de polvo ZrO2 en un vaso de precipitados de 250 ml.
- Añada 50 ml de una solución AgNO3 (aq) (0,0059 mol/L) y 9,71 ml de una solución K2PdCl4 (aq) (0,00031 mol/L) al vaso de precipitados bajo agitación magnética vigorosa (500 rpm) a temperatura ambiente.
- Añadir 10 ml de solución acuosa de lisina (0,53 M).
- Mantenga la mezcla bajo agitación vigorosa (500 rpm) durante 20 min.
- Después de 20 min, utilice una pipeta para añadir a la suspensión 10 ml de una solución NaBH4 (aq) (0.035 M) recién preparada, a una velocidad de 1 mL/min. Mantenga la suspensión bajo agitación (500 rpm) durante todo el proceso.
- Deje que la mezcla se revuelva durante 30 minutos a temperatura ambiente.
2. Separación y purificación del catalizador
- Transfiera la suspensión a tubos centrífugas y separe los sólidos de la mezcla por centrifugación a 3.260 x g durante 10 minutos.
- Retire cuidadosamente la fase líquida con una pipeta y agregue 15 ml de agua desionizada a los tubos.
- Agitar vigorosamente hasta que se obtenga la dispersión del sólido. Si no se logra una buena dispersión, coloque los tubos en un baño ultrasónico durante 5 minutos.
- Centrífuga la dispersión a 3.260 x g durante 10 min.
- Repita los pasos de lavado (2.2. a 2.2.2.) dos veces más usando agua desionizada, luego una vez usando etanol en lugar de agua.
- Retire el etanol y seque el sólido en un horno a 60 °C durante 12 h.
- Caracterizar los NPs Ag-Pd/ZrO2 preparados mediante una variedad de técnicas microscopía, elementales y espectroscópicas.
3. Síntesis de Ag/ZrO2 NPs
NOTA: En este procedimiento, ag carga en ZrO2 correspondió a 3 wt.%.
- Coloque 1 g de polvo ZrO2 en un vaso de precipitados de 250 ml.
- Añadir 50 ml de una solución AgNO3 (aq) (0.0059 mol/L) al vaso de precipitados bajo agitación magnética vigorosa (500 rpm) a temperatura ambiente.
- Añadir 10 ml de solución acuosa de lisina (0,53 M).
- Mantenga la mezcla bajo agitación vigorosa (500 rpm) durante 20 min.
- Después de 20 min, utilice una pipeta para añadir a la suspensión 10 ml de una solución NaBH4 (aq) (0.035 M) recién preparada, a una velocidad de 1 mL/min. Mantenga la suspensión bajo agitación (500 rpm) durante todo el proceso.
- Deje que la mezcla se revuelva durante 30 minutos a temperatura ambiente.
4. Separación y purificación del catalizador
- Transfiera la suspensión a tubos centrífugas y separe los sólidos de la mezcla por centrifugación a 3.260 x g durante 10 minutos.
- Retire cuidadosamente la fase líquida con una pipeta y agregue 15 ml de agua desionizada a los tubos.
- Agitar vigorosamente hasta que se observe la dispersión del sólido. Si no se logra una buena dispersión, coloque los tubos en un baño ultrasónico durante 5 minutos.
- Centrífuga la dispersión a 3.260 x g durante 10 min.
- Repita los pasos de lavado (4.2. a 4.2.2.) dos veces más usando agua desionizada, luego una vez usando etanol en lugar de agua.
- Retire el etanol y seque el sólido en un horno a 60 °C durante 12 h.
- Los NPs Ag/ZrO2 preparados se pueden caracterizar por una variedad de técnicas microscopía, elementales y espectroscópicas.
5. Investigación del rendimiento catalítico plásmido hacia la reducción del nitrobenzene bajo excitación LSPR (iluminación de luz)
- Coloque 30 mg de catalizador en un matraz de fondo redondo de 25 ml junto con una barra de agitación magnética.
- Añadir 5 ml de una solución de nitrobenzene (0,03 mol/L) en alcohol isopropílico (IPA) al reactor.
- A continuación, añadir 11,22 mg de polvo koh (0,0002 mol).
- Purgue el reactor burbujeando la suspensión con un flujo de argón durante 1 minuto. Inmediatamente después de purgar, selle el matraz.
- Coloque el reactor en un baño de aceite calentado a 70 °C por encima de un agitador magnético controlado por temperatura (500 rpm).
- Irradia el tubo usando 4 lámparas LED con una longitud de onda de 425 nm como fuente de luz, y una intensidad de luz de 0,5 W/cm2. La distancia desde las lámparas hasta el matraz de reacción debe ser de 7 cm.
- Deje que la reacción continúe durante 2,5 h a 70 °C bajo agitación magnética vigorosa (500 rpm).
- A continuación, apague la luz, abra el reactor y use una jeringa y una aguja para recoger una muestra de 1 ml. Filtrarlo a través de un filtro de 0,45 μm, para eliminar las partículas del catalizador, en un vial de cromatografía de gases.
6. Reacción en ausencia de excitación LSPR (condiciones oscuras)
- Siga los mismos pasos descritos en 5, pero sin irradiación de luz. Envuelva el tubo de reacción con papel de aluminio para evitar cualquier exposición a la luz.
7. Preparación del análisis de cromatografía de gases (GC)
- Preparar una solución de IPA que contenga aproximadamente 30 mmol/L de nitrobenzene (NB), 30 mmol/L de anilina (AN) y 30 mmol/L de azobenzene (AB).
- Ejecute un análisis de GC de la solución mediante un método adecuado. Diferentes métodos se pueden probar variando los programas de temperatura de columna y flujo de gas. El método seleccionado debe ser capaz de separar los picos correspondientes a IPA, NB, AN y AB en el período mínimo de tiempo de retención.
- Una vez seleccionado el método, preparar un conjunto de soluciones de 50 mM, 25 mM, 10 mM, 5 mM y 2,5 mM NB en IPA, y otro conjunto de soluciones de AN y AB en IPA con las mismas concentraciones.
- Ejecute un análisis de GC de las soluciones preparadas. Cada cromatograma debe presentar 2 picos: el más alto corresponde a IPA y el inferior corresponde a NB, AN o AB. Para cada cromatograma, tenga en cuenta el tiempo de retención y el área pico de todos los picos.
- Trace las curvas de calibración de NB, AN y AB trazando la concentración frente al área de pico de cada muestra.
8. Análisis de GC
- Ejecute un análisis de GC en las muestras recogidas en los pasos 5. y 6. con el mismo método utilizado para los pasos 7.2. y 7.4.
- Para cada cromatograma, anote el tiempo de retención y el área de pico y utilice las curvas de calibración trazadas previamente para determinar la concentración de NB, AN y AB en las muestras.
- Calcule la conversión de nitrobenzene, así como la selectividad de la anilina y el azobenzene utilizando las ecuaciones:
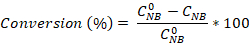
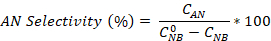
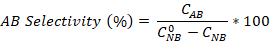
¿Dónde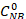 está la concentración inicial de NB (0,03 mol/L), y las concentraciones C NB, CAN, CAB corresponden a las concentraciones NB, AN y AB, respectivamente, después de 2,5 horas de reacción por el análisis de GC.
está la concentración inicial de NB (0,03 mol/L), y las concentraciones C NB, CAN, CAB corresponden a las concentraciones NB, AN y AB, respectivamente, después de 2,5 horas de reacción por el análisis de GC.
Resultados
La Figura 1A muestra fotografías digitales de las muestras sólidas que contienen el óxido ZrO2 puro (izquierda) y los NPs Ag-Pd/ZrO2 (derecha). Este cambio de color del blanco (en ZrO2)al marrón (Ag-Pd/ZrO2)proporciona la evidencia cualitativa inicial sobre la deposición de los NPs Ag-Pd en la superficie ZrO2. La Figura 1B muestra los espectros de absorción visibles para UV de los NPs Ag-Pd/ZrO2 <...
Discusión
Los hallazgos descritos en este método demuestran que la actividad catalítica intrínsica de Pd (u otro metal catalítico pero no plásico) puede mejorarse significativamente mediante excitación LSPR a través de la irradiación de luz visible en NPs35de aleación bimetálica. En este caso, Ag (u otro metal plásmido) es capaz de cosechar energía de la irradiación de luz visible a través de excitación LSPR. La excitación LSPR conduce a la formación de portadores de carga caliente (electro...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por la Universidad de Helsinki y la Fundación Jane y Aatos Erkko. S.H. agradece los fondos Erasmus+ de la UE para la beca.
Materiales
| Name | Company | Catalog Number | Comments |
| 2-Propanol (anhydrous, 99.5%) | Sigma-Aldrich | 278475 | CAS Number 67-63-0 |
| Aniline (for synthesis) | Sigma-Aldrich | 8.22256 | CAS Number 62-53-3 |
| Azobenzene (98%) | Sigma-Aldrich | 424633 | CAS Number 103-33-3 |
| Ethanol | Honeywell | 32221 | CAS Number 64-17-5 |
| Hydrochloric acid (37%) | VWR | PRLSMC310066 | CAS Number 7647-01-0 |
| L-Lysine (crystallized, ≥98.0% (NT)) | Sigma-Aldrich | 62840 | CAS Number 56-87-1 |
| Nitric acid (65%) | Merck | 100456 | CAS Number 7697-37-2 |
| Nitrobenzene | Sigma-Aldrich | 8.06770 | CAS Number 98-95-3 |
| Potassium hydroxide | Fisher | 10448990 | CAS Number 1310-58-3 |
| Potassium tetrachloropalladate (II) (98%) | Sigma-Aldrich | 205796 | CAS Number 10025-98-6 |
| Silver nitrate (ACS reagent, ≥99.0%) | Sigma-Aldrich | 209139 | CAS Number 7761-88-8 |
| Sodium borohydride (fine granular for synthesis) | Sigma-Aldrich | 8.06373 | CAS Number 16940-66-2 |
| Zirconium (IV) oxide (nanopowder, <100 nm particle size (TEM)) | Sigma-Aldrich | 544760 | CAS Number 1314-23-4 |
Referencias
- Dunn, P. J., Hii, K. K., Krische, M. J., Williams, M. T. . Sustainable Catalysis: Challenges and Pratices for the Pharmaceutical and Fine Chemical Industries. , (2013).
- Tzouras, N. V., Stamatopoulos, I. K., Papastavrou, A. T., Liori, A. A., Vougioukalakis, G. C. Sustainable metal catalysis in C-H activation. Coordination Chemistry Reviews. 343, 25 (2017).
- Polshettiwar, V., Varma, R. S. Green chemistry by nano-catalysis. Green Chemistry. 12 (5), 743 (2010).
- Rodrigues, T. S., da Silva, A. G. M., Camargo, P. H. C. Nanocatalysis by noble metal nanoparticles: controlled synthesis for the optimization and understanding of activities. Journal of Materials Chemistry A. 7 (11), 5857-5874 (2019).
- Linic, S., Christopher, P., Ingram, D. B. Plasmonic-metal nanostructures for efficient conversion of solar to chemical energy. Nature Materials. 10 (12), 911-921 (2011).
- Nam, J. M., Liz-Marzán, L., Halas, N. Chemical Nanoplasmonics: Emerging Interdisciplinary Research Field at Crossroads between Nanoscale Chemistry and Plasmonics. Accounts of Chemical Research. 52 (11), 2995-2996 (2019).
- Brongersma, M. L., Halas, N. J., Nordlander, P. Plasmon-induced hot carrier science and technology. Nature Nanotechnology. 10 (1), 25-34 (2015).
- Smith, J. G., Faucheaux, J. A., Jain, P. K. Plasmon resonances for solar energy harvesting: A mechanistic outlook. Nano Today. 10 (1), 67-80 (2015).
- Hartland, G. V. Optical studies of dynamics in noble metal nanostructures. Chemical Reviews. 111 (6), 3858-3887 (2011).
- Kelly, K. L., Coronado, E., Zhao, L. L., Schatz, G. C. The optical properties of metal nanoparticles: The influence of size, shape, and dielectric environment. Journal of Physical Chemistry B. 107 (3), 668-677 (2003).
- Hermoso, W., et al. Triangular metal nanoprisms of Ag, Au, and Cu: Modeling the influence of size, composition, and excitation wavelength on the optical properties. Chemical Physics. 423, 142-150 (2013).
- Kumar, A., et al. Rational Design and Development of Lanthanide-Doped NaYF4@CdS-Au-RGO as Quaternary Plasmonic Photocatalysts for Harnessing Visible-Near-Infrared Broadband Spectrum. ACS Applied Materials and Interfaces. 10 (18), 15565-15581 (2018).
- Reddy, K. L., Kumar, S., Kumar, A., Krishnan, V. Wide spectrum photocatalytic activity in lanthanide-doped upconversion nanophosphors coated with porous TiO2 and Ag-Cu bimetallic nanoparticles. Journal of Hazardous Materials. 367, 694-705 (2019).
- Ingram, D. B., Linic, S. Water splitting on composite plasmonic-metal/semiconductor photoelectrodes: Evidence for selective plasmon-induced formation of charge carriers near the semiconductor surface. Journal of the American Chemical Society. 133 (14), 5202-5205 (2011).
- Linic, S., Aslam, U., Boerigter, C., Morabito, M. Photochemical transformations on plasmonic metal nanoparticles. Nature Materials. 14 (6), 567-576 (2015).
- Aslam, U., Rao, V. G., Chavez, S., Linic, S. Catalytic conversion of solar to chemical energy on plasmonic metal nanostructures. Nature Catalyst. 1, 656-665 (2018).
- Araujo, T. P., Quiroz, J., Barbosa, E. C. M., Camargo, P. H. C. Understanding plasmonic catalysis with controlled nanomaterials based on catalytic and plasmonic metals. Current Opinion in Colloid and Interface Science. 39, 110-122 (2019).
- Gellé, A., et al. Applications of plasmon-enhanced nanocatalysis to organic transformations. Chemical Reviews. , 986-1041 (2020).
- Shaik, F., Peer, I., Jain, P. K., Amirav, L. Plasmon-Enhanced Multicarrier Photocatalysis. Nano Letters. 18 (7), 4370-4376 (2018).
- Quiroz, J., et al. Controlling Reaction Selectivity over Hybrid Plasmonic Nanocatalysts. Nano Letters. 18, 7289-7297 (2018).
- Peiris, E., et al. Plasmonic Switching of the Reaction Pathway: Visible-Light Irradiation Varies the Reactant Concentration at the Solid-Solution Interface of a Gold-Cobalt Catalyst. Angewandte Chemie - International Edition. 58 (35), 12032-12036 (2019).
- Yu, S., Wilson, A. J., Heo, J., Jain, P. K. Plasmonic Control of Multi-Electron Transfer and C-C Coupling in Visible-Light-Driven CO2 Reduction on Au Nanoparticles. Nano Letters. 18 (4), 2189-2194 (2018).
- Yu, S., Jain, P. K. Plasmonic photosynthesis of C 1 -C 3 hydrocarbons from carbon dioxide assisted by an ionic liquid. Nature Communications. 10, 2022 (2019).
- Zhang, X., et al. Product selectivity in plasmonic photocatalysis for carbon dioxide hydrogenation. Nature Communications. 8, 1-9 (2017).
- Cortés, E. Efficiency and Bond Selectivity in Plasmon-Induced Photochemistry. Advanced Optical Materials. 5 (15), 1700191 (2017).
- de Freitas, I. C., et al. Design-controlled synthesis of IrO 2 sub-monolayers on Au nanoflowers: marrying plasmonic and electrocatalytic properties. Nanoscale. , 23-27 (2020).
- Zhang, C., et al. Al-Pd Nanodisk Heterodimers as Antenna-Reactor Photocatalysts. Nano Letters. 16 (10), 6677-6682 (2016).
- Zhou, L., et al. Light-driven methane dry reforming with single atomic site antenna-reactor plasmonic photocatalysts. Nature Energy. 5, 61-70 (2020).
- Swearer, D. F., et al. Heterometallic antenna-reactor complexes for photocatalysis. Proceedings of the National Academy of Sciences. 113 (32), 8916-8920 (2016).
- Peiris, S., Sarina, S., Han, C., Xiao, Q., Zhu, H. -. Y. Silver and palladium alloy nanoparticle catalysts: reductive coupling of nitrobenzene through light irradiation. Dalton Transactions. 46 (32), 10665-10672 (2017).
- Rahm, J. M., et al. A Library of Late Transition Metal Alloy Dielectric Functions for Nanophotonic Applications. Advanced Functional Materials. 2002122, 02122 (2020).
- Zhang, C., Chen, B. Q., Li, Z. Y., Xia, Y., Chen, Y. G. Surface Plasmon Resonance in Bimetallic Core-Shell Nanoparticles. Journal of Physical Chemistry C. 119 (29), 16836-16845 (2015).
- Liu, Z., Huang, Y., Xiao, Q., Zhu, H. Selective reduction of nitroaromatics to azoxy compounds on supported Ag-Cu alloy nanoparticles through visible light irradiation. Green Chemistry. 18 (3), 817-825 (2016).
- Chaiseeda, K., Nishimura, S., Ebitani, K. Gold nanoparticles supported on alumina as a catalyst for surface plasmon-enhanced selective reductions of nitrobenzene. ACS Omega. 2 (10), 7066-7070 (2017).
- Peiris, S., et al. Metal nanoparticle photocatalysts: emerging processes for green organic synthesis. Catalysis Science and Technology. 6 (2), 320-338 (2016).
- García-García, I., et al. Silver-Based Plasmonic Catalysts for Carbon Dioxide Reduction. ACS Sustainable Chemistry and Engineering. 8 (4), 1879-1887 (2020).
- Agrawal, A., Johns, R. W., Milliron, D. J. Control of Localized Surface Plasmon Resonances in Metal Oxide Nanocrystals. Annual Review of Materials Research. 47 (1), 1-31 (2017).
- Lounis, S. D., Runnerstrom, E. L., Llordés, A., Milliron, D. J. Defect chemistry and Plasmon physics of colloidal metal oxide Nanocrystals. Journal of Physical Chemistry Letters. 5 (9), 1564-1574 (2014).
- Rej, S., et al. Determining Plasmonic Hot Electrons and Photothermal Effects during H2 Evolution with TiN-Pt Nanohybrids. ACS Catalysis. 10 (9), 5261-5271 (2020).
- Barragan, A. A., et al. Photochemistry of Plasmonic Titanium Nitride Nanocrystals. The Journal of Physical Chemistry C. 123 (35), 21796-21804 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados