Method Article
4D المجهري: كشف Caenorhabditis elegans التطور الجنيني باستخدام المجهر نومارسكي
In This Article
Summary
هنا ، نقدم بروتوكولا لإعداد وتركيب أجنة Caenorhabditis elegans ، وتسجيل التطور تحت مجهر 4D وتتبع سلالة الخلايا.
Abstract
المجهر 4D هو أداة لا تقدر بثمن لكشف عملية النمو الجنيني في الحيوانات المختلفة. على مدى العقود الماضية ، برزت Caenorhabditis elegans كواحدة من أفضل النماذج لدراسة التنمية. من وجهة نظر بصرية ، فإن حجمها وجسمها الشفاف يجعلان هذه الديدان الخيطية عينة مثالية للفحص المجهري DIC (تباين التداخل التفاضلي أو Nomarski). توضح هذه المقالة بروتوكولا لزراعة الديدان الخيطية C. elegans ، وإعداد وتركيب أجنة ، وإجراء الفحص المجهري 4D وتتبع نسب الخلايا. تعتمد هذه الطريقة على سجلات الفاصل الزمني متعدد البؤر لصور Nomarski وتحليلها باستخدام برامج محددة. تكشف هذه التقنية عن ديناميكيات النمو الجنيني على المستوى الخلوي. يمكن اكتشاف أي عيب جنيني في الطفرات ، مثل مشاكل في اتجاه المغزل أو هجرة الخلايا أو موت الخلايا المبرمج أو مواصفات مصير الخلية ، وتسجيلها بكفاءة. تقريبا كل خلية واحدة من الجنين يمكن متابعتها حتى اللحظة التي يبدأ فيها الجنين في التحرك. إن تتبع السلالة الخلوية الكاملة لجنين C. elegans بواسطة المجهر 4D DIC أمر شاق ، لكن استخدام برامج محددة يسهل هذه المهمة إلى حد كبير. بالإضافة إلى ذلك ، هذه التقنية سهلة التنفيذ في المختبر. المجهر 4D هو أداة متعددة الاستخدامات ويفتح إمكانية إجراء تحليل لا مثيل له للتطور الجنيني.
Introduction
الفحص المجهري 4D هو نظام تسجيل متعدد البؤر بفاصل زمني يسمح للباحثين بتسجيل وقياس ديناميكيات الخلية للعينة البيولوجية مكانيا وبمرور الوقت. يمكن أن تخضع مزارع الخلايا أو الخمائر أو الأنسجة الحية لتحليل 4D ولكن هذه التقنية مناسبة بشكل خاص لتحليل تطور الأجنة الحية. تصل دقة هذا التحليل إلى مستوى كل خلية من خلايا الجنين. يمكن الكشف عن كل انقسام خلوي ، ويمكن تتبع حركات الخلايا بمرور الوقت. يتم تقييم مصائر الخلايا وفقا للموضع والشكل الذي تكتسبه الخلايا. يعزز استخدام بصريات نومارسكي تباين العينات الشفافة غير الملطخة باستخدام حزم ضوئية مستقطبة بشكل متعامد تتداخل في المستوى البؤري. تظهر الصور الناتجة ثلاثية الأبعاد ، مضاءة على جانب واحد.
تم تطوير طرق أخرى تعتمد على استخدام المجهر البؤري والحيوانات المعدلة وراثيا GFP للكشف التلقائي عن النوى وتوليد سلالات الخلايا 1,2. ميزة هذه الأنظمة واضحة: البرنامج يتجاوز إلى حد كبير الحاجة إلى وضع علامة يدويا على كل نواة على مدى فترة من الزمن (على الرغم من أن بعض الإشراف اليدوي مطلوب خلال المراحل المتأخرة). ومع ذلك ، فإن العمليات الخلوية التي تنطوي على تغييرات في شكل الخلية أو ديناميكيات الغشاء ، مثل تلك التي تحدث أثناء تمايز الخلايا أو الهجرة أو موت الخلايا المبرمج أو ابتلاع الجثة ، تظل مخفية كخلفية سوداء في صور النوى الموسومة بالفلورسنت.
في المقابل ، يظهر مجهر نومارسكي 4D (ويسمى أيضا مجهر DIC ، مجهر تباين التداخل التفاضلي) كلا من النوى وتغيرات شكل الخلية التي تحدث أثناء تطور النوع البري أو الحيوانات المتحولة. وهذا يسمح بتتبع نسب الخلايا باستخدام المجاهر القياسية، باستخدام الضوء المنقول فقط. ليست هناك حاجة عامة لاستخدام الحيوانات المعدلة وراثيا إلا لإظهار أنماط تعبير محددة ، وفي هذه الحالة يمكن أن تكون عمليات المسح الفلورية متداخلة. لذلك ، يمكن أن يكون هذا هو النهج الأمثل للعديد من المختبرات التي تعمل على عمليات الخلايا الديناميكية مثل تكوين الأجنة أو موت الخلايا المبرمج الذي يمكن تسليط الضوء عليه تحت المجهر DIC3،4،5،6،7.
تتوفر العديد من البرامج المرنة وسهلة الاستخدام لالتقاط الصور المجهرية وإعادة بناء سلالات الخلايا ونماذج 3D ومسارات هجرة الخلايا وما إلى ذلك في العينة المسجلة. في تجربة قياسية ، يتم الحصول على الصور في سلسلة من المستويات البؤرية ، على مسافة ثابتة ، يعتمد عددها على سمك العينة. يمكن تحسين الدقة الزمنية للتحليل عن طريق زيادة تردد المسح. لا يوجد أي حد تقريبا لمدة التسجيل بخلاف سعة تخزين الكمبيوتر. على سبيل المثال، بالنسبة لتحليل تطور جنين C. elegans ، نحصل بشكل روتيني على صور على 30 مستوى بؤري (1 ميكرون خطوة لكل منها)، كل 30 ثانية لمدة 12 ساعة.
تم تطبيق هذه الأنظمة على تحليل العديد من الأجنة الحيوانية مثل Caenorhabditis elegans 8,9,10 و Drosophila melanogaster11 و nematode embryosالأخرى 12,13 و tardigrades14,15 وحتى أجنة الفئران المبكرة 16. الشرط الوحيد هو وجود جنين شفاف قادر على التطور على إعداد الشريحة تحت المجهر.
باختصار ، يعد الفحص المجهري 4D القائم على DIC مفيدا بشكل خاص ل 1) تحليل التطور الجنيني للحيوانات الصغيرة والشفافة: تتبع سلالة الخلايا ، ومسارات هجرة الخلايا ، وتوليد نماذج 3D ، وما إلى ذلك ؛ 2) تحديد أنماط التعبير الجيني ؛ 3) دراسة ديناميكيات زراعة الخلايا ، من الخميرة إلى الخلايا البشرية ؛ 4) تحليل ديناميات الأنسجة أو شظايا الجنين ؛ 5) تحديد كمي لحركية موت الخلايا وابتلاع الجثث ؛ و 6) إجراء تحليل السلالات المقارن على أساس الخصائص التنموية الجنينية. إذا كان هناك اهتمام بأي من هذه الموضوعات (أو مواضيع مماثلة) ، يمكن استخدام المجهر 4D.
Protocol
1. تنمو C. elegans على أطباق بتري
- تحضير أطباق NGM وزرعها باستخدام E. coli OP50 كمصدر للغذاء (الشكل 1). تنمو وتحافظ على C. elegans كما هو موضح17. قم بتخزين الألواح المصنفة على درجة حرارة 4 درجات مئوية لمدة تصل إلى شهر واحد.
- اضبط الألواح على درجة الحرارة المطلوبة قبل إضافة الديدان.
- لنقل الديدان ، قم بإزالة قطعة من الآجار من طبق قديم وضعها على طبق طازج.
- بدلا من ذلك ، التقط مفردة باستخدام منتقي دودة معقمة (قطعة مقاس 1 بوصة من سلك بلاتيني بقياس 32 مع طرف مسطح ، مثبت على طرف ماصة باستور) وضعها على اللوحة الجديدة.
- تنمو الديدان في درجة الحرارة المطلوبة.
- تنمو ديدان C. elegans عند 20 درجة مئوية ، درجة الحرارة القياسية. ومع ذلك ، لتحليل تطور الطفرات الحساسة للحرارة ، قم بإجراء حضانة بين عشية وضحاها ، عادة عند 25 درجة مئوية. اضبط مدة ودرجة حرارة هذه الحضانة حسب الحاجة ، اعتمادا على المتحور المحدد.
2. إعداد تسجيل المجهر 4D قبل تركيب الأجنة (الشكل 2)
- قم بإعداد المجهر وضوابط درجة الحرارة قبل تحضير الجنين. C. تنقسم أجنة elegans بسرعة كبيرة. كن مستعدا لبدء التسجيل مباشرة بعد تركيب الأجنة.
- اضبط درجة حرارة التسجيل إما على 15 درجة مئوية أو 20 درجة مئوية أو 25 درجة مئوية.
- تسجيل الأجنة بشكل روتيني عند 25 درجة مئوية. سجل الطفرات الحساسة للحرارة عند درجة الحرارة المقيدة لإظهار أنماطها الظاهرية. سجل عنصر تحكم WT (إذا تم إجراؤه في إعداد مختلف) في نفس درجة حرارة الطفرات.
ملاحظة: تتطور أجنة WT بشكل أسرع عند 25 درجة مئوية وأبطأ عند 15 درجة مئوية دون اختلافات إضافية في نسب الخلايا. ضع المجاهر في غرفة يتم التحكم في درجة حرارتها. التحكم الإضافي عن طريق تبريد أو تسخين الشريحة أمر مرغوب فيه للغاية. يمكن تحقيق ذلك عن طريق تدوير الماء عند درجة حرارة محددة من خلال حلقة معدنية حول هدف المجهر والمكثف. الهدف والتحضير على اتصال مباشر من خلال زيت الغمر ونقل درجة الحرارة فعال. يسمح هذا النظام بالتحكم الدقيق في درجة حرارة التسجيل وإجراء تحولات درجة الحرارة أثناء تطور الجنين.
- تسجيل الأجنة بشكل روتيني عند 25 درجة مئوية. سجل الطفرات الحساسة للحرارة عند درجة الحرارة المقيدة لإظهار أنماطها الظاهرية. سجل عنصر تحكم WT (إذا تم إجراؤه في إعداد مختلف) في نفس درجة حرارة الطفرات.
- تحديد معلمات السجل في برنامج الفحص المجهري.
- للحصول على تسجيل C. elegans قياسي (بدون عمليات مسح الفلورسنت)، حدد:
مكدسات z من 30 مستوى بؤري ، على مسافة 1 ميكرون لكل منها.
30 ثانية فترات بين بداية كل مكدس z.
1500 z-stacks (12.5 ساعة من السجل).
ملاحظة: يمكن استخدام كل من برامج التحكم في المجهر التجارية والمفتوحة المصدر لتحديد سير العمل هذا لالتقاط الصور. الآن المجهر جاهز للتسجيل.
- للحصول على تسجيل C. elegans قياسي (بدون عمليات مسح الفلورسنت)، حدد:
3. إعداد وتركيب الأجنة
- قم بإعداد وسادة أجار رقيقة ومتجانسة كخطوة أولى في الحصول على صورة جميلة (الشكل 3).
- تحضير 50 مل من محلول أجار 4.5 ٪ في الماء منزوع الأيونات. يسخن حتى يغلي في الميكروويف ويصب 0.5 - 1 مل في أنابيب زجاجية سعة 3 مل.
- أغلق الأنابيب بعناية بفيلم شمعي لتجنب الجفاف. يمكن تخزين أنابيب أجار المختومة في درجة حرارة الغرفة لمدة تصل إلى شهرين.
- على مقعد المختبر ، احصل على كتلة حرارة عند 80 درجة مئوية مع:
أنبوب اختبار من هلام البترول النقي (مذاب) ، مع فرشاة طلاء دقيقة في الداخل.
أنبوب اختبار مع الماء المقطر الذي يحتوي على ماصة باستور.
ملاحظة: هذا يضمن أن جميع المواد المطلوبة ستكون ساخنة ، ولن تتصلب الأجار في عملية صنع اللوحة. - قم بإزالة فيلم الشمع من أعلى أحد أنابيب الأجار ، وقم بتسخينه بعناية فوق موقد كحول لإذابة الأجار. توخ الحذر لأن الأجار الساخن الذي يتم طرده من الأنبوب الزجاجي يمكن أن يسبب حروقا.
- بمجرد ذوبان الآجار ، ضع الأنبوب في كتلة الحرارة للحفاظ على الآجار في شكل سائل.
- بدلا من ذلك ، ضع أنابيب الأجار في كتلة الحرارة 1h قبل التجربة لإذابتها دون استخدام الموقد. يجب التخلص من الآجار المذاب بعد يوم واحد.
- ضع شريحة مجهرية (شريحة A) بين اثنين آخرين على قطعة من البلاستيك.
- خذ شريحة أخرى (الشريحة B) وأمسكها بأصابعك بيد واحدة.
- من ناحية أخرى ، ضع قطرة صغيرة من الآجار المذاب في وسط الشريحة A باستخدام ماصة باستور الدافئة.
- اضغط على الشريحة B على الفور على قطرة الأجار لإنشاء لوحة رقيقة جدا بين الشريحتين A وB. احتفظ بهذه الشرائح محصورة معا حتى الخطوة 3.2.3.
- جبل الأجنة.
- اجمع 5-10 خنثى محبب مع المنتقي وضعها في كوب صانع ساعات مملوء بالماء.
- استخدم مشرطا لقطع الديدان الخيطية الخنثى واستخراج البيض المبكر (1-4 خلايا) من الرحم ، تحت المجهر المجسم.
- خذ الشريحة من الخطوة 3.1.10 وقم بتحريك الشريحة B برفق لكشف لوحة الأجار على الشريحة A.
- ضع بيضة مبكرة في وسط وسادة الآجار عن طريق السحب باستخدام أنبوب شعري.
- بدلا من ذلك ، ماصة قطرة تحتوي على مجموعة من الأجنة على وسادة أجار ثم ابحث عن أجنة في مرحلة مبكرة. قم بهذه الخطوة تحت المجهر المجسم.
- إذا لزم الأمر ، حرك البيضة عن طريق دفعها برموش لاصق في نهاية المسواك.
- إزالة الماء الزائد مع ماصة الشعيرات الدموية.
ملاحظة: يمكن بسهولة تحضير ماصة شعرية عن طريق تسخين ماصة باستور فوق موقد كحول وسحبها من كلا الطرفين. - قم بتغطية التحضير بعناية باستخدام غطاء لاصق. لتجنب فقاعات الهواء، ضع حافة واحدة من الغطاء على الشريحة وحرك مشرطا برفق على طول الحافة المجاورة للف الغطاء ببطء وبشكل غير مباشر على المستحضر.
- استخدم ماصة لملء 3/4 من المساحة المحيطة بوسادة الأجار بالماء. اترك 1/4 من المساحة مع الهواء.
- أغلق الغطاء بالفازلين لتجنب الجفاف أثناء فترات التسجيل الطويلة.
- استخدم الفرشاة الدقيقة لتمديد طبقة رقيقة من الفازلين المذاب حول حافة الغطاء.
ملاحظة: الآن الإعداد جاهز للتسجيل.
4. ضبط DIC وبدء تسجيل المجهر 4D
- ضع الشريحة على مرحلة المجهر. ركز الجنين باستخدام هدف التكبير المنخفض (5x أو 10x).
- التغيير إلى هدف الغمر 100x.
- اضبط المكونات البصرية للمجهر للحصول على صورة نومارسكي.
- ركز المكثف.
- افتح فتحة المكثف بالكامل وأغلق الحجاب الحاجز الميداني (سيوفر ذلك فتحة رقمية أعلى وبالتالي دقة أكبر).
- تحقق من أن كلا المستقطبين على المجهر موجهان للتسبب في أقصى قدر من انقراض الضوء.
- أدر منشور ولاستون للحصول على صورة ثلاثية الأبعاد لطيفة للجنين ، مضاءة على جانب واحد. أدر المنشور في الاتجاه الآخر للحصول على تأثير إضاءة الجنين على الجانب الآخر.
ملاحظة: يمكن تنفيذ هذه الخطوات على عينة اختبار قبل التسجيل بحيث لا يلزم سوى الضبط الدقيق على العينة التي يتم تحليلها.
- قم بتشغيل التقاط الصورة في المجهر.
5. تحليل الفيلم 4D (الشكل 4).
ملاحظة: بمجرد اكتمال التسجيل، استخدم برنامج تتبع نسب الخلايا لإعادة بناء وتحليل نسب الخلية.
يعد برنامج تتبع نسب الخلايا أداة قوية لإجراء تحليلات مفصلة للتطور الجنيني أو الديناميكيات في مزارع الخلايا أو شظايا الأنسجة. يقوم البرنامج باستخراج وقياس العديد من مجموعات البيانات حول الديناميكيات الخلوية للعينة والتي تشمل توليد السلالة الخلوية الكاملة لكل خلية مسجلة، بما في ذلك انقسامات الخلايا وطول دورة الخلية والهجرة أو موت الخلايا المبرمج بالإضافة إلى حركياتها. بالإضافة إلى ذلك ، يمكن تسجيل تمايز الخلايا من خلال التغيرات المورفولوجية للخلية أو عن طريق التعبير عن علامات محددة. في الأساس ، تعرض شاشة البرنامج نافذتين: في النافذة اليسرى ، يمكن تشغيل فيلم 4D إلى الأمام والخلف أو لأعلى ولأسفل إلى المستويات العليا أو السفلية بحيث يمكن متابعة كل خلية في الوقت والمكان طوال التسجيل. على الأرملة اليمنى ، يتم إنشاء سلالة الخلية. يؤدي النقر فوق نواة خلية في فيلم 4D إلى إنشاء نقطة في نافذة النسب التي تخزن معلومات اسم الخلية ومصيرها وإحداثياتها المكانية. يتم إنشاء سلالة الخلية لخلية معينة عن طريق تشغيل فيلم 4D إلى الأمام والنقر بشكل دوري على النواة لوضع علامة على الانقسام الخيطي لتلك الخلية المحددة بمرور الوقت. تكرار هذه العملية لكل خلية من الخلايا المسجلة يولد السلالة الخلوية الكاملة للجنين أو العينة. يتم استخدام المعلومات المخزنة للإحداثيات المكانية لكل خلية في وقت لاحق لإعادة بناء نماذج الأجنة 3D ومسارات هجرة الخلايا.
- افتح برنامج تتبع النسب وأنشئ مشروعا جديدا بالانتقال إلى قائمة الشريط العلوي وتحديد:
| الملفات مشروع جديد. - حدد قالب نسب الخلية اعتمادا على درجة حرارة التسجيل: DB08 للتسجيل عند 25 درجة مئوية، DB10 للتسجيل عند 20 درجة مئوية، وDB12 للتسجيل عند 15 درجة مئوية.
- اضبط معلمات التسجيل في النافذة الناشئة: عدد المسح الضوئي (عادة 1500) ، والوقت بين عمليات المسح الضوئي (30 ثانية) ، وعدد المستويات (30) والمسافة بين المستويات (1 ميكرون).
- حدد ملف الصورة وتنسيقها.
- حدد دليل الصور حيث تم حفظ الصور.
- اختر ما إذا كان يجب حفظ الصور كصور مفردة (صورة واحدة لكل مستوى ووقت) أو كمكدسات z متعددة الصور.
- تحديد تسمية الملف وتنسيق الصورة. بشكل روتيني ، يتم حفظ الصور الفردية تحت الأسماء التالية:
X0000L00C1 (للمسح الضوئي 0، المستوى 0، القناة 1)
X0000L01C1 (للمسح الضوئي 0، المستوى 1، القناة 1)
X0000L02C1 (للمسح الضوئي 0، المستوى 2، القناة 1)
...
X0001L00C1 (للمسح الضوئي 1، المستوى 0، القناة 1)
X0001L01C1 (للمسح الضوئي 1، المستوى 1، القناة 1)
...
X0300L04C1 (للمسح الضوئي 300، المستوى 4، القناة 1)
...
ملاحظة: يؤدي حفظ الصور بتنسيق مضغوط إلى توفير مساحة على القرص الثابت.
- حدد قنوات الضوء: 1 لبصريات DIC ، 2 ل GFP ، 3 ل RFP ، إلخ. أضف تلك التي تم استخدامها في تسجيل 4D. انقر فوق "تمكين معالجة القناة" لاكتشافها.
- ابدأ في تتبع سلالة خلية الجنين. تحتوي الشاشة الآن على نافذتين رئيسيتين: نافذة الفيديو ونافذة نسب الخلية.
- في نافذة النسب، حدد فرع النسب واستخدم الماوس للنقر فوق نواة الخلية المقابلة لهذه الخلية في نافذة الفيديو.
- اتبع الخلية مكانيا ومع مرور الوقت عن طريق تشغيل فيلم 4D إلى الأمام أو الخلف أو لأعلى أو لأسفل مستوى ، باستخدام مفاتيح المؤشر.
- انقر بشكل دوري على نواة الخلية. هذا يولد نقطة في فرع النسب ويسجل الإحداثيات المكانية للخلية في هذا الوقت. نتيجة لذلك ، يتقدم نسب الخلية ، ومن الممكن إعادة بناء الجنين 3D.
- ضع علامة على الانقسام بالنقر فوق مفتاح الرجوع. ثم حدد إحدى الخلايا الابنة واتبعها كما كان من قبل.
- كرر العملية (الخطوات من 5.6.1 إلى 5.6.4) لبقية الخلايا الجنينية لتتبع سلالة الخلايا الكاملة ، أو لمتابعة خلايا محددة ذات أهمية مثل تلك التي تمر بموت الخلايا المبرمج.
- قارن السلالة المتحولة مع سلالة خلية WT C. elegans النمطية.
النتائج
لتوصيف التطور الجنيني لمتحور C. elegans للجين gsr-1 ، الذي يشفر إنزيم الجلوتاثيون المختزل ، المطلوب لتجديد الجلوتاثيون المنخفض (GSH) ويشارك في الحفاظ على توازن الأكسدة والاختزال في الديدان الخيطية ، أجرينا فحصا مجهريا رباعي الأبعاد لمتحور حذف gsr-1 (tm3574) وهو فقدان وظيفة أليل يسبب النمط الظاهري المبكر للاعتقال الجنيني18. تم زراعة كل من WT و gsr-1 (tm3574) المتحولة C. elegans الديدان الخيطية على ألواح NGM المزروعة ب E. coli OP50 كمصدر غذائي17. نمت ديدان gsr-1 (tm3574) على شكل متغاير الزيجوت عند 20 درجة مئوية لمدة جيلين ثم تم تحويل الديدان المتجانسة الزيجوت (القادرة على النمو حتى مرحلة البلوغ بفضل الحمل الأمومي) إلى 25 درجة مئوية للحضانة بين عشية وضحاها قبل تحليل الجنين. تم تحضين ألواح الدودة داخل صناديق من الورق المقوى لتجنب التكثيف (الشكل 1). تم قطع الديدان الخيطية الجرافية لاستخراج الأجنة الصغيرة.
لمقارنة التطور الجنيني للمتحور مقابل WT النمطي في ظل ظروف متطابقة ، تم وضع WT (كعنصر تحكم) وجنين gsr-1 (tm3574) على نفس المستحضر بجانب بعضهما البعض. تم تشغيل سير عمل المجهر 4D على مجهر مستقيم قياسي مزود بمحرك مجهز ببصريات DIC. كانت معلمات التسجيل المختارة في برنامج التحكم في المجهر هي: مكدسات z من 30 مستوى بؤري على مسافة ميكرون واحد لكل منها ، وفترات 30 ثانية بين بداية كل مكدس z و 1500 z-stacks (12.5 ساعة من التسجيل). تم ضبط درجة حرارة التسجيل إلى 25 درجة مئوية (سواء في الغرفة أو على مسرح المجهر) (الشكل 2).
بمجرد الانتهاء من التسجيل ، تم فتح ملف الصور ، وتم إعادة بناء سلالة الخلية باستخدام برنامج تتبع النسب بالنقر فوق نوى الخلية الموضحة في نافذة الفيديو (الشكل 4). تمت مقارنة سلالة الخلايا الجنينية الطافرة gsr-1 (tm3574) التي تم تتبعها مع سلالة C. elegans WT الموضحة في الخلفية. وكانت النتيجة الرئيسية هي الكشف عن تأخير تدريجي في دورة الخلية أثناء التطور الجنيني. ونتيجة لذلك ، تم القبض على الأجنة المتحولة في المراحل المتوسطة بينما تقدمت أجنة WT وأخيرا فقست كيرقات.
يمكن أن يكشف التحضير والمراقبة المباشرة للأجنة تحت المجهر أو التلطيخ المناعي بالأجسام المضادة ضد العلامات الجنينية المتأخرة عن وجود نسبة عالية من الأجنة الصغيرة في المتحور مقارنة ب WT. يمكن بعد ذلك استنتاج اعتقال الجنين باعتباره التفسير الأكثر معقولية. ومع ذلك ، لا يمكن إظهار الدليل المباشر والقياس الكمي الدقيق لتأخير دورة الخلية إلا بأناقة وسهولة وقياسه كميا من خلال تجربة الفحص المجهري 4D. يمكن أيضا تصور السمات المهمة الأخرى للتطور الجنيني مثل تمايز الخلايا أو موت الخلايا المبرمج (الشكل 5) بطريقة ديناميكية باستخدام الفحص المجهري 4D الذي يقدم تحليلا مفصلا لجوانب متعددة من التطور في تجربة واحدة.

الشكل 1: الديدان الخيطية C. elegans تنمو تحت ظروف المختبر. تزرع الديدان الخيطية على ألواح NGM المزينة ببذور الإشريكية القولونية ، وتخزن في صناديق من الورق المقوى وتحضن إما عند 15 درجة مئوية أو 20 درجة مئوية أو 25 درجة مئوية .
الشكل 2: لقطة شاشة لبرنامج تسجيل 4D المجهري. مثال على برنامجين مختلفين للتحكم في المجهر (A و B). تقوم هذه البرامج بإنشاء مهام سير عمل للتحكم في المجهر والتقاط الصور أثناء تسجيل المجهر 4D. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: صور متسلسلة لإعداد وسادة أجار وتركيب جنين C. elegans الذي يظهر. أ . أنابيب أجار المعدة. ب-ج. إعداد وسادة أجار. د. شريحة مملوءة جزئيا بالماء. ه. ختم الشريحة مع هلام البترول. و. الإعداد النهائي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
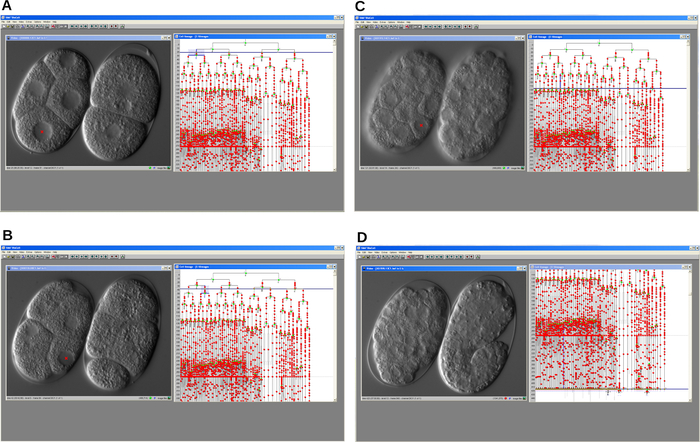
الشكل 4: لقطات شاشة تسلسلية لبرنامج تتبع سلالات الخلايا. يسمح البرنامج بإعادة بناء سلالة الخلية الجنينية لدورة الخلية تأخير المتحور (يسار) و WT (يمين) C. elegans. A. خطوة مبكرة من التطور. ب-ج. يتطور كلا الجنينين بمرور الوقت. D. يتطور جنين WT بشكل صحيح ويبدأ في الاستطالة بينما يقبض المتحور. في جميع الحالات ، يعرض البرنامج نافذة الفيديو ونافذة النسب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
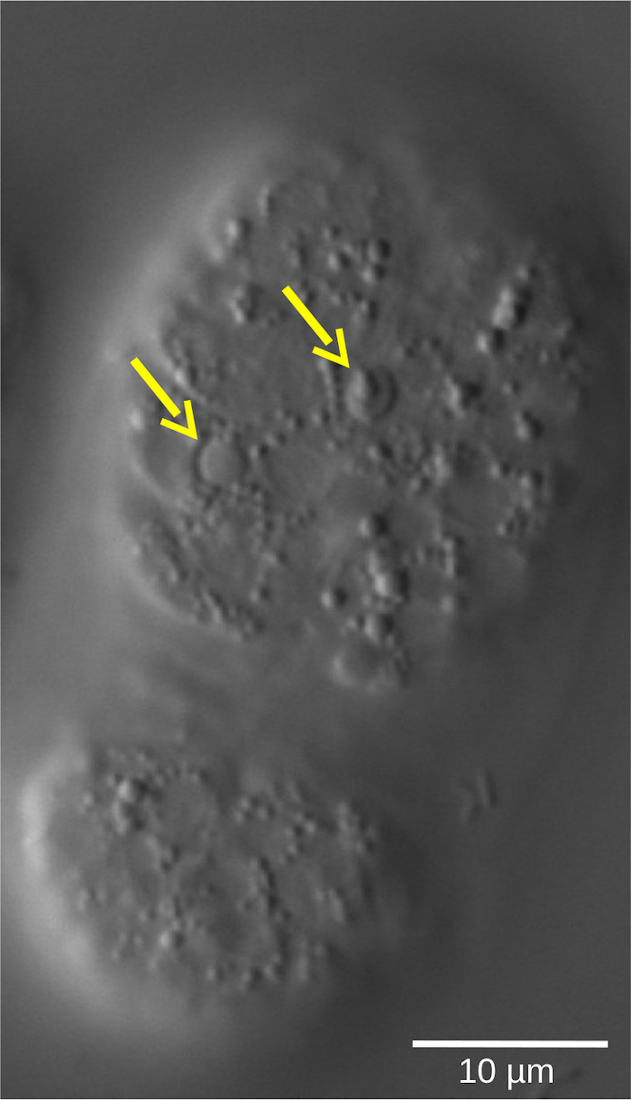
الشكل 5: شكل العدس المنكسر للخلايا الماصة في جنين C. elegans WT. يمكن تقييم مصير الخلية ، الذي تحدده الخصائص المورفولوجية ، بواسطة الفحص المجهري 4D. تظهر الصورة جنين C. elegans في مرحلة الفول. تظهر الخلايا الحية نوى ناعمة الشكل محاطة بسيتوبلازم حبيبي. في المقابل ، تتكثف الخلايا الماصة (الأسهم الصفراء) وتعتمد شكلا يشبه العدس والانكساري. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
أحد التحديات الرئيسية في علم الأحياء الحديث هو فهم تطور الكائنات الحية متعددة الخلايا. برزت C. elegans كواحدة من أفضل النماذج المناسبة لدراسة التنسيق الدقيق بين تكاثر الخلايا وتمايز الخلايا في الجنين النامي. من وجهة نظر بصرية ، فإن جسمها الشفاف وحجمها الصغير يجعلان هذه الديدان الخيطية عينة مثالية للفحص المجهري DIC. كما خضعت كائنات حية أخرى ذات خصائص مماثلة لتحليل المجهر 4D11،12،13،14،15،16.
بالنسبة لتلك الدراسات التنموية، فإن تعطيل الجينات إما عن طريق علم الوراثة الأمامي أو العكسي يوفر دليلا على مشاركته في تكوين الأجنة. بمجرد أن يثبت أن الجين يلعب دورا في التنمية ، فإن الخطوة التالية هي تحديد دوره الدقيق في إنشاء خطة الجسم الصحيحة. التلطيخ المناعي هو النهج المختار لمعظم النماذج. توضح هذه التقنية المشاكل في تمايز الخلايا أو التعبير عن علامات محددة. ومع ذلك، فإن أحد القيود الرئيسية لهذا النهج هو أنه لا يوفر سوى رؤية ثابتة للتعبير عن علامة واحدة أو أكثر عند نقطة ثابتة في التطوير. لا يمكن الحصول على رؤية ديناميكية لهذه العلامات طوال فترة التطور إلا عن طريق تلطيخ الأجنة المختلفة في نقاط زمنية مختلفة. بالإضافة إلى ذلك ، لا يمكن إعادة بناء سلالة الخلايا في مثل هذه العينات الثابتة.
الفحص المجهري 4D هو نهج تكميلي لدراسة التطور الجنيني. تكشف هذه التقنية عن ديناميكيات التطوير بدقة على مستوى الخلية. أي عيب في الجنين مثل مشاكل في اتجاه المغزل ، وهجرة الخلايا ، موت الخلايا المبرمج ، ومواصفات مصير الخلية ، وما إلى ذلك ، سيظهر في فيلم 4D يمكن تصوره إلى الأمام والخلف ، وتحديده كميا وتسجيله من قبل الباحث. باستخدام هذه التقنية ، يمكن متابعة كل خلية في الجنين تقريبا حتى اللحظة التي يبدأ فيها الجنين في التحرك. الأجنة المعرضة للمجهر 4D مع الضوء المرئي فقط والبصريات نومارسكي لا تتكبد أضرارا ضوئية. يمكن أيضا إجراء عمليات المسح الفلوري داخل التسجيل للكشف عن متى وأين يتم التعبير عن الجين. يتم تحديد الأجنة التي تعاني من تلف ضوئي كبير من خلال تمديد دورة الخلية التي تسبب تشعيع قوي للأشعة فوق البنفسجية مقارنة بجنين سلالة WT القياسي. في هذه الحالة ، يمكن تقليل الضرر الضوئي عن طريق خفض شدة مصباح الأشعة فوق البنفسجية وزيادة حساسية الكاميرا أو وقت التعرض. يمكن أن تساعد الخصائص المورفولوجية والواسمات الجزيئية في توضيح التطور الجنيني لأي متحور.
من السهل تنفيذ نظام الفحص المجهري 4D في المختبر ، وبعد بعض الممارسة ، يتيح تحليلا لا مثيل له لديناميكيات الخلية وتتبع سلالات مزارع الخلايا والعينات الحية الشفافة على مستوى دقة كل خلية في مجال المجهر. لا يزال تتبع نسب الخلايا على صور DIC تتم معالجته يدويا. يستغرق الأمر وقتا طويلا ، وعلى الرغم من أن البرنامج يكتشف أخطاء النسب مثل فروع النسب المختلفة التي تميز نفس الخلية ، إلا أن الأخطاء ممكنة. في حين أن الكشف التلقائي عن الخلايا التي تحمل علامة GFP متطور بشكل جيد2 ، فإن برنامج تتبع السلالات التكميلي القائم على الخلايا غير المميزة وصور الضوء المرئي لا يزال في المرحلة المبكرة وغير مفيد حقا لتحليل الجنين الكامل. مما لا شك فيه أن تطبيق أنظمة التعرف على الصور في مجال الفحص المجهري للضوء المرئي سيحقق تقدما كبيرا في هذا المجال.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
يود المؤلفون أن ينوه بالدعم المقدم من مؤسسة ريوخا سالود (Fondos FEDER) ووزارة العلوم الإسبانية ، Innovación y Universidades (MCIU) (Grant PGC2018-094276-B-I00). يتم تمويل كريستينا روميرو أراندا من خلال زمالة من AECC (الرابطة الإسبانية كونترا إل كانسر).
Materials
| Name | Company | Catalog Number | Comments |
| Caenorhabditis elegans (N2) | GCG (Caenorhabditis Genetics Center) | N2 | WT C. elegans strain. Can be requested at GCG (Caenorhabditis Genetics Center): https://cgc.umn.edu/ |
| Caenorhabditis elegans (VZ454) | GCG (Caenorhabditis Genetics Center) | VZ454 | gsr-1(tm3574) C. elegans mutant strain. Can be requested at GCG (Caenorhabditis Genetics Center): https://cgc.umn.edu/ |
| Cell Lineage Tracing software | SIMI | Simi BioCell | This is the software to reconstruct the embryo cell lineage. For a detailed explanation check at: http://www.simi.com/en/products/cell-research/simi-biocell.html |
| Microscope camera | Hamamatsu | Orca-R2 | Miscroscope camera for both transmitted and UV light |
| Microscope control software | Caenotec | Time to Live | This software controls the microscope to perform the 4D image capture. Can be requested at: Caenotec Prof. Ralf Schnabel Kleine Dorfstr. 9 38312 Börßum, Germany, Ph: ++49 151 11653356 r.schnabel(at)tu-bs.de |
| Microscope control software | Micro-manager | Micro-manager | This software controls the microscope to perform the 4D image capture. Can be downloaded at: https://micro-manager.org/ |
| Motorized microscope | Leica | Leica DM6000 | Motorized upright microscope to perform 4D microscopy |
| Standard equipment in a Molecular Biology lab. | |||
| Stereomicroscope | Leica | MZ16FA | Steromicroscope to manipulate nematodes and prepare embryos. |
References
- Hardin, J. Imaging embryonic morphogenesis in C. elegans. Methods in Cell Biology. 106, 377-412 (2011).
- Mace, D. L., Weisdepp, P., Gevirtzman, L., Boyle, T., Waterston, R. H. A high-fidelity cell lineage tracing method for obtaining systematic spatiotemporal gene expression patterns in Caenorhabditis elegans. G3: Genes, Genomes, Genetics (Bethesda). 3 (5), 851-863 (2013).
- Nieto, C., et al. ccz-1 mediates the digestion of apoptotic corpses in C. elegans. Journal of Cell Science. 123 (12), 2001-2007 (2010).
- Cabello, J., et al. PDR-1/hParkin negatively regulates the phagocytosis of apoptotic cell corpses in Caenorhabditis elegans. Cell Death & Disease. 5, 1120 (2014).
- Pinto, S. M., Almendinger, J., Cabello, J., Hengartner, M. O. Loss of Acetylcholine Signaling Reduces Cell Clearance Deficiencies in Caenorhabditis elegans. PLOS One. 11 (2), 0149274 (2016).
- Sáenz-Narciso, B., Gómez-Orte, E., Zheleva, A., Gastaca, I., Cabello, J. Control of developmental networks by Rac/Rho small GTPases: How cytoskeletal changes during embryogenesis are orchestrated. Bioessays. 38 (12), 1246-1254 (2016).
- Zheleva, A. Reduction of mRNA export unmasks different tissue sensitivities to low mRNA levels during Caenorhabditis elegans development. PLOS Genetics. 15 (9), 1008338 (2019).
- Schnabel, R., Hutter, H., Moerman, D., Schnabel, H. Assessing normal embryogenesis in Caenorhabditis elegans using a 4D microscope: variability of development and regional specification. Developmental Biology. 184 (2), 234-265 (1997).
- Verbrugghe, K. J. C., Chan, R. C. Imaging C. elegans Embryos using an Epifluorescent Microscope and Open Source Software. Journal of Visualized Experiments. (49), e2625 (2011).
- Boyd, L., Hajjar, C., O'Connell, K. Time-lapse Microscopy of Early Embryogenesis in Caenorhabditis elegans. Journal of Visualized Experiments. (54), e2852 (2011).
- Urbach, R., Schnabel, R., Technau, G. M. The pattern of neuroblast formation, mitotic domains and proneural gene expression during early brain development in Drosophila. Development. 130 (16), 3589-3606 (2003).
- Dolinski, C., Borgonie, G., Schnabel, R., Baldwin, J. G. Buccal capsule development as a consideration for phylogenetic analysis of Rhabditida (Nemata). Development Genes and Evolution. 208 (9), 495-503 (1998).
- Houthoofd, W., Jacobsen, K., Mertens, C., Vangestel, S., Coomans, A., Borgonie, G. Embryonic cell lineage of the marine nematode Pellioditis marina. Developmental Biology. 258 (1), 57-69 (2003).
- Hejnol, A., Schnabel, R. The eutardigrade Thulinia stephaniae has an indeterminate development and the potential to regulate early blastomere ablations. Development. 132 (6), 1349-1361 (2005).
- Hejnol, A., Schnabel, R. What a couple of dimensions can do for you: Comparative developmental studies using 4D microscopy-examples from tardigrade development. Integrative and Comparative Biology. 46 (2), 151-161 (2006).
- Bischoff, M., Parfitt, D. E., Zernicka-Goetz, M. Formation of the embryonic-abembryonic axis of the mouse blastocyst: relationships between orientation of early cleavage divisions and pattern of symmetric/asymmetric divisions. Development. 135 (5), 953-962 (2008).
- Mora-Lorca, J. A. Glutathione reductase gsr-1 is an essential gene required for Caenorhabditis elegans early embryonic development. Free Radical Biology and Medicine. 96, 446-461 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved